Method Article
Triagem de campos de lentilha para presença de murcha de Fusarium e podridão radicular na Turquia sob clima terrestre
Neste Artigo
Resumo
Um estudo na província de Yozgat descobriu que fatores bióticos, como doenças fúngicas como murcha e podridão radicular, limitam a produção de lentilhas. Isolados de Fusarium foram encontrados em 95,4% das amostras, sugerindo levantamentos locais periódicos e monitoramento regular para desenvolvimento de tecnologia sustentável e estratégias de controle eficazes.
Resumo
A lentilha é uma importante leguminosa autopolinizada. Sua produção é limitada por vários fatores bióticos, especialmente agentes fúngicos causadores do complexo murcha e podridão radicular. O estudo teve como objetivo compreender a epidemiologia regional e a etiologia dos agentes fúngicos fitopatogênicos para desenvolver estratégias de controle contra Fusarium spp. Este estudo investigou 83 localidades de semeadura de lentilhas na província de Yozgat para doenças de murcha, podridão radicular e da coroa causadas por espécies comuns de Fusarium durante 2022 e 2023. Plantas de lentilha sintomáticas foram coletadas para isolamento e identificação de fungos. Os isolados de Fusarium foram agrupados de acordo com a morfologia da colônia e cultivados em meio BDA. Além disso, os DNAs genômicos obtidos de isolados de Fusarium foram analisados por PCR e comparados com outros isolados de Fusarium registrados no NCBI GenBank. As relações genéticas entre os isolados de Fusarium foram determinadas usando o método de Parcimônia Máxima (MP) no programa Mega 11. Os resultados, a incidência média e a taxa de severidade das doenças da murcha e da podridão radicular na província de Yozgat foram determinados em 16,9% e 38,6%, respectivamente. Isolados de Fusarium foram encontrados em 95,4% das amostras. Houve homogeneidade de 99,5% a 100% da sequência de nucleotídeos entre os isolados de F. oxysporum, F. culmorum, F. graminearum, F. acuminatum e F. solani , sendo que a espécie mais isolada foi F. oxysporum. O dendrograma MP dos isolados de Fusarium foi dividido em dois ramos principais, o primeiro ramo incluiu todos os isolados de F. solani . O segundo ramo principal incluiu outras espécies de Fusarium isoladas no presente estudo e no NCBI GenBank. O estudo sugere pesquisas locais periódicas para determinar a frequência da murcha de Fusarium para supressão em lentilhas. A supressão oportuna dos danos à base de Fusarium é fortemente sugerida para controlar a doença e conservar o sistema de produção de lentilhas.
Introdução
A lentilha (Lens culinaris Medik.), Uma pequena leguminosa de grão comestível pertencente à família Fabaceae, é uma cultura autopolinizadora de estação fria com folhas em forma de agulha e flores brancas a roxas pálidas ou roxas escuras1. Foi domesticado por humanos há cerca de 10.000 anos na parte mesopotâmica do Crescente Fértil e rapidamente se espalhou para o Novo Mundo, incluindo a Bacia do Mediterrâneo e a Ásia Central, e mais tarde foi naturalizado para as Américas2. A área mundial de cultivo de lentilha é de cerca de 5,5 milhões de hectares, com produção de 6,6 milhões de toneladas3. A Turquia ocupa o4º lugar na produção de lentilhas, depois do Canadá, Índia e Austrália. O cultivo de lentilha na Turquia é muito importante e representa 6,7% da produção mundial. A produção total de lentilhas da Turquia é de 474.000 toneladas e é produzida em pelo menos 40 províncias4. Cerca de 89,5% da produção de lentilhas da Turquia são lentilhas vermelhas e verdes, que constituem 10,5% da safra de inverno na região sudeste da Anatólia. O resto da safra é cultivado como safras de verão. As províncias de Yozgat (39,5%), Konya (23,7%), Kırşehir (16,3%), Çorum (7,6%) e Ancara (2,9%) contribuem amplamente para a produção de lentilhas verdes4. A produção de lentilhas pode ser limitada por fatores de estresse bióticos e abióticos. Geada e seca são os fatores de estresse abiótico mais comuns na produção de lentilha verde no verão5. Doenças fúngicas como murcha, raiz e complexo de podridão da coroa causadas por Ascochyta lentis, Rhizoctonia solani, R. bataticola, Aphanomyces euteiche, Pythium e espécies de Fusarium são as doenças fúngicas mais importantes, que causam uma combinação de doenças, incluindo tombamento, ferrugem das plântulas, murcha e podridão radicular, dependendo do momento da infecção, suscetibilidade do hospedeiro e condições meteorológicas 6,7, 8.
Fusarium é um fungo filamentoso imperfeito encontrado no solo, plantas e substratos orgânicos e é um gênero cosmopolita entre esses patógenos9. Causa várias doenças, como murcha de Fusarium, podridão da raiz e do colo da raiz, bem como ferrugem da cabeça de Fusarium no trigo, murcha de Fusarium em cucurbitáceas e podridão radicular na maioria das leguminosas, incluindo lentilhas 10,11,12. A murcha vascular, a podridão da raiz e do colo radicular causada por Fusarium spp. é a doença mais importante das lentilhas em muitas áreas de cultivo de lentilhas em todo o mundo10. Fusarium oxysporum é a espécie mais comum de Fusarium associada à murcha, raiz e podridão do colo da raiz em lentilhas. Globalmente, as doenças da murcha, da raiz e da podridão da coroa são causadas por F. graminearum, F. sporotrichioides, F. equity, F. acuminatum, F. redolent, F. avenaceum, F. culmorum, F. solani e F. verticillioides em áreas de plantio de lentilhas7. As doenças da murcha, podridão radicular e da coroa causadas por Fusarium spp. ocorrem nos estágios de plântula e adulto e causam murcha súbita, ressecamento e eventual morte das folhas. Os sintomas da doença incluem podridão das sementes, podridão da raiz, murcha dos folíolos superiores, nanismo, encolhimento e enrolamento das folhas. Nos estágios intermediário e tardio de enchimento das vagens, as sementes geralmente são encolhidas e os sintomas das raízes incluem crescimento atrofiado, descoloração marrom, pontas das raízes principais danificadas e proliferação de raízes secundárias. A descoloração do tecido vascular pode não ser observada em todos os casos13.
Na região da Anatólia Central, estudos sobre o status das doenças da murcha e da podridão radicular nas lentilhas foram realizados em número limitado. Yozgat tem um clima ameno e moderado com chuvas abundantes no inverno quando comparado ao verão e é classificado como Dsb (clima terrestre quente e úmido) pela Köppen e Geiger14. A temperatura média é de 9,6 °C, com uma precipitação média de 512 mm. Yozgat está localizada no hemisfério norte. O verão ocorre em junho, julho, agosto e setembro. É muito importante ter informações sobre a epidemiologia regional e a etiologia dos agentes fúngicos fitopatogênicos causadores da doença para o desenvolvimento de diferentes estratégias de controle contra Fusarium spp. transmitidas pelo solo, para controlar a doença15. Nesse contexto, os objetivos do presente estudo são determinar e identificar os parâmetros da doença (prevalência, incidência e severidade da doença) das doenças da murcha, da raiz e da podridão da coroa em lentilhas, realizando um levantamento na província de Yozgat, onde aproximadamente 40% da produção total de lentilha verde é feita isoladamente, o patogênico Fusarium espécies que causam murcha e podridão radicular em lentilhas por meio de análises morfológicas e moleculares, e para determinar os níveis de virulência individuais das espécies de Fusarium por meio da realização de testes de patogenicidade.
Protocolo
NOTA: Os detalhes dos reagentes e do equipamento usado no estudo estão listados na Tabela de Materiais.
1. Pesquisa de campo, amostragem e isolamento de fungos
NOTA: O trabalho de levantamento foi realizado em 2022 e 2023, de acordo com o Endes16. Um total de 83 áreas de plantio de lentilha cobrindo nove distritos na província de Yozgat foram observadas para murcha, raiz e podridão do colo radicular (Figura 1).
- Selecione campos de lentilha com mais de 1000 m2 de área como área de amostragem. Colete cada amostra caminhando aleatoriamente da borda para o centro ou meio do campo em ziguezagues caminhando ao longo das diagonais usando um quadro de 1 m2 , colocando-o aleatoriamente em um mínimo de três pontos diferentes selecionados aleatoriamente. Colete plantas de lentilha que apresentem sintomas de doenças em cada ponto, coloque-as em sacos de papel e transfira-as para o laboratório para uso em estudos de isolamento e identificação de fungos.
NOTA: As raízes e colos radiculares de plantas de lentilha doentes transferidas para o laboratório foram primeiro lavadas com água da torneira para se livrar dos resíduos grosseiros; posteriormente, foram submetidos à desinfecção de superfície para o isolamento dos patógenos fúngicos, conforme descrito por Endes16. - Mergulhe os tecidos vegetais doentes em etanol a 70% por 10-15 s e depois enxágue 3x por 3 minutos cada em água estéril. Segure todos eles em hipoclorito de sódio a 1% (NaOCl) por 5 min e enxágue 3x por 5 min cada novamente com água estéril.
- Seque os tecidos vegetais úmidos em papéis de filtro em um gabinete estéril para finalizar o processo de desinfecção da superfície. Em seguida, corte os tecidos vegetais desinfetados em pedaços de 5-10 mm de comprimento e coloque 4-5 pedaços em um meio de BDA contendo 0,01% de estreptomicina em placas de Petri (90 mm de diâmetro). Coloque as placas de Petri em uma incubadora no escuro a 25 ± 1 °C por 4-7 dias e observe o crescimento do fungo.
NOTA: Os isolados de fungos em desenvolvimento foram purificados através do método de isolamento de esporos únicos. Para tanto, o estudo realizado por Choi et al.17 sobre a obtenção de culturas de esporos únicos de fungos pertencentes a Ascomicetes, Basidiomicetos, Celomicetos e Hyphomycetes foi modificado e utilizado conforme descrito a seguir. - Para purificar os isolados de fungos, manter os isolados de fungos obtidos no final dos estudos de isolamento numa incubadora a 25 ± 1 °C durante 12 h de luz fluorescente / 12 h de escuridão durante 15 dias para favorecer a formação de estruturas anamórficas de reprodução no PCA.
- Pese cerca de 100 mg de micélio de fungo de culturas de 15 dias com uma espátula, transfira-o para um tubo de microcentrífuga estéril de 1,5 mL e, em seguida, triture-o completamente com pilões de plástico estéreis para homogeneização.
- Adicione 1 mL de água estéril e vórtice por 1 min para garantir a transferência de esporos para a água. Para ajustar o número de esporos transferidos para a água, extraia 20 μL dessa mistura com uma pipeta e verifique o número de esporos com ampliação de 10x do microscópio óptico.
- Quando a quantidade de esporos for maior do que a quantidade desejada, dilua a mistura de esporos e água em proporções como 1/10, 1/100 e 1/1000. Forneça uma mistura contendo 4-6 esporos no campo de visão do microscópio.
- Pegue 100 μL da suspensão de esporos preparada e transfira-a para placas de Petri de 90 mm de diâmetro contendo meio BDA suplementado com estreptomicina a 0,1%. Em seguida, espalhe a suspensão transferida no PDA com uma espátula Drigalski.
- Incubar as placas de Petri preparadas no escuro a 25 ± 1 °C durante 12-24 h. No final deste período, transferir pequenos pedaços de hifas desenvolvidos de um único conídio com uma alça de inoculação para uma nova placa de Petri contendo meio BDA. Cada cultura obtida de cada esporo é uma única cultura de esporos. Armazene-os para serem usados em testes de patogenicidade e identificação morfológica e molecular.
NOTA: O objetivo principal é manter os isolados de fungos vivos por muito tempo sem alterar sua morfologia, genética e virulência. O processo de armazenamento foi realizado por meio de dois métodos diferentes18,19. Todos os métodos de armazenamento usados neste estudo são explicados em detalhes abaixo.- O primeiro método para armazenar amostras é o seguinte. Cultivar isolados de fungos em meio BDA a 25 ± 1 °C com uma luz escura de 12:12 h durante 15 dias para obter discos de micélio de 4 mm de diâmetro que possam ser armazenados em água estéril.
- Corte discos de micélio (4 mm de diâmetro, 10 discos) com uma broca de cortiça de culturas fúngicas que cresceram nas condições acima mencionadas. Transfira os discos de micélio para tubos de microcentrífuga contendo 1 mL de água estéril. Manter as amostras em tubos de microcentrífuga no frigorífico a -20 °C durante 6 meses.
- O segundo método para armazenar amostras é o seguinte. Em primeiro lugar, pegue uma pitada do disco fúngico puro das culturas de esporos únicos obtidos com uma alça de inoculação e transfira-o para placas de Petri contendo BDA suplementado com cloranfenicol, ácido lático, ampicilina, rifampicina, tetraciclina, estreptomicina, etc.
- Crescer durante 5-10 dias antes do processo de armazenamento a 25 ± 1 °C com uma condição de 12 h: 12 h escura: clara. Corte e esterilize papéis de filtro de uso geral de 1 cm x 1 cm em uma autoclave a 121 °C, 15 psi por 60 min.
- Colocar os papéis de filtro em placas de Petri novas com o mesmo meio ou com meio selectivo. Corte colônias / esporos de cultura fúngica pura e coloque-os no topo de cada peça.
- Sele as placas de Petri e coloque-as em uma incubadora em condições de crescimento apropriadas (como mencionado acima). Os isolados de fungos crescem lentamente em papel de filtro. Incubar por aproximadamente 15 dias para garantir a colonização completa.
- Após a esporulação ou formação completa de colônias em papéis de filtro, transfira os pedaços individuais de papel para uma nova placa de Petri sem meio de cultura. Posteriormente, coloque as placas de Petri na incubadora até que o papel de filtro e o fungo estejam completamente secos (aproximadamente 20-30 dias).
- Após a secagem, coloque 10 pedaços de papel de filtro em cada envelope de papel estéril, etiquete cada envelope, coloque esses envelopes em sacos plásticos e guarde os sacos plásticos contendo os envelopes em um recipiente plástico e transparente a -20 °C.
- Calcule a taxa de prevalência da murcha da lentilha, raiz e podridão da coroa em Yozgat de acordo com a fórmula abaixo, considerando a prevalência da doença em cada campo de lentilha, seguido do nome do distrito da província.
Taxa de prevalência da doença (%) = (a / b) x 100
onde a indica o número de campos doentes; b indica o número total de campos pesquisados em um distrito. - Calcular a incidência da doença de acordo com o método da média ponderada relatada por Bora e Karaca20. Conte as plantas em cada quadrado do campo. Separe-os em plantas doentes e não doentes em cada quadrado e calcule a prevalência da doença de acordo com a fórmula abaixo.
Taxa de prevalência da doença (%) = (x / y) x 100
onde x indica o número de plantas doentes; y indica o número total de plantas pesquisadas. - Calcule a severidade da doença de acordo com a escala de 0 a 4 de Öğüt21, onde 0 = não apresentou sintomas, 1 = sintomas de nível leve em 25% das folhas; 2 = sintomas de nível moderado em 26%-50% das folhas; 3= clorose severa e murcha em 51%-75% das folhas; e 4 = clorose muito severa e sintomas de murcha ou secagem, queda, retardo de crescimento ou folhas mortas em mais de 75% das plantas na mesma ordem (Figura 2).
- Calcule a gravidade da doença usando a seguinte fórmula com os valores de escala obtidos16.
Gravidade da doença (%) = [∑ [i (ni x vi) / (V) x N)] x 100
em que ni número de plantas no valor da escala; valor da escala vi; V maior valor de escala; N número total de plantas observadas; i indica o número de classes.
2. Dados meteorológicos
- Realize estudos de pesquisa. Para este protocolo, foram realizados inquéritos durante os períodos de maio e junho de 2022 e 2023. Obtenha os valores de temperatura, umidade relativa e precipitação total para o período de março a julho de 2022, 2023 e longos anos da Diretoria de Meteorologia Provincial de Yozgat (Tabela 1).
3. Identificação morfológica
- Compare as características culturais (cor da colônia, micélio aéreo, taxa de crescimento do micélio) e conídios (dimensões dos conídios, forma, cor e número de septos) dos isolados de Fusarium com as de estudos anteriores e identifique provisoriamente as espécies de fungos.
- Selecionar amostras representativas dos grupos a serem utilizados na identificação morfológica. Purifique essas amostras de acordo com o método de isolamento de esporos únicos, conforme mencionado acima. Durante este período, observar as características de pigmentação da colônia de isolados de Fusarium , bem como as estruturas de micro/macroconídios e clamidósporos.
- Para promover a formação de estruturas micromorfológicas como micro/macroconídios e clamidósporos nas culturas fúngicas puras obtidas, incubar em BDA a 25 ± 1 °C e 12 h: 12 h escuro: claro por 25-30 dias em uma incubadora. Medir o comprimento e a largura dos conídios de cada isolado de Fusarium por microscopia de luz. Além disso, documente a estrutura, forma, cor e septos ou sem septos dos conídios usando um microscópio de luz fornecido com uma câmera digital.
- Com base nas observações acima, agrupe os isolados de Fusarium de acordo com o nível da espécie, conforme descrito em Leslie e Suerell22.
4. Identificação molecular
NOTA: O DNA genômico total dos isolados de Fusarium foi extraído usando o seguinte método, que foi ligeiramente modificado do protocolo do Cenis23. As análises de PCR e eletroforese dos isolados de Fusarium foram realizadas usando o protocolo descrito por Aras e Endes24.
- Extração de DNA genômico fúngico
- A partir de uma cultura fresca (10 dias de idade) de isolados de Fusarium cultivados em BDA, raspe 100 mg de micélio com um bisturi estéril e transfira-o para um tubo de microcentrífuga de 2 mL. Incubar os tubos a -20 °C durante a noite.
- Após a incubação durante a noite, adicione 500 μL de tampão de extração de DNA (200 mM Tris-HCl pH: 8,5, 250 mM NaCl, 25 mM EDTA, 0,5% de dodecil sulfato de sódio) nos tubos e esmague com um pilão de plástico estéril.
- Em seguida, adicione 150 μL de acetato de sódio 3M (NaOAc) pH 5,2 aos tubos e incube a -20 °C por 30 min. Após esta etapa, centrifugue os tubos a 4.000 x g por 10 min.
- Após a centrifugação, transfira 400 μL do sobrenadante na parte superior do tubo para novos tubos (1,5 mL) e adicione um volume igual de isopropanol (2-propanol). Incubar os novos tubos a -20 °C durante 30 min. Durante este tempo, misture delicadamente os tubos 5x ou 6x.
- Centrifugue a 4.000 x g por 10 min para precipitar o DNA genômico e descartar todo o líquido restante nos tubos.
- Adicione 1 mL de etanol a 70% ao pellet de DNA genômico como um sedimento branco ou creme no fundo do tubo. Misture suavemente o tubo para cima e para baixo 4x-5x por aproximadamente 1 min, descartando todo o etanol nos tubos. Em seguida, abra os tubos em fluxo de ar laminar por 30 min para evaporar completamente o etanol no pellet de DNA.
- Para dissolver o DNA genômico e armazená-lo por um longo tempo, adicione 50 μL de solução tampão TE (1M Tris-HCl pH: 8,0; 0,5M EDTA pH 8,0) aos tubos e incube os tubos em banho-maria a 65 ° C por 1 h. Durante este tempo, misture suavemente o tubo para cima e para baixo 8x-10x. Conservar o ADN genómico dissolvido numa solução tampão TE num congelador a -20 °C para utilização em estudos moleculares.
- Para estudos de PCR, use os primers oligonucleotídeos ITS5 F (5'GGAAGTAAAGTCGTAACAAGG3') / ITS4 R (5'TCCTCCGCTTATTGATATGC3') para amplificar a região ITS do rDNA25. Realize cada reação de PCR com 2,5 μL de tampão PCR 10x, 2,5 μL de MgCl2 (25 mM), 2,5 μL de dNTP (2 mM), 0,5 μL de cada primer (10 μM), 2 μL de DNA molde, 0,5 μL de Taq DNA polimerase (1 U/μL, Fermantas) e 14 μL de sQH2O em um volume total de 25 μL.
- Para a reação de PCR de 25 μL, execute o seguinte programa de PCR a 95 °C por 2 min (desnaturação inicial), seguido de 40 ciclos; 95 °C por 30 s (desnaturação), 55 °C por 45 s (recozimento), 72 °C por 90 s (extensão) e 72 °C por 5 min (extensão final). Produtos de PCR eletroforese por 1,5 h a 90 V em gel de agarose a 1,5% preparado em solução tampão 1x TAE (Tris Base - Ácido Acético Glacial - EDTA).
- Para preparar o tampão TAE para eletroforese em gel, dissolva 242 g de base Tris em 700 mL de água estéril; adicione os 57,1 mL de ácido acético glacial; adicione os 100 mL de solução de EDTA 0,5 M e ajuste o volume para 1 L adicionando água estéril. Ajuste o pH final do tampão TAE 1 L 50x para 8,5. Para fazer o tampão de trabalho 1x TAE, adicione 49 partes de água estéril a 1 parte do tampão 50x TAE.
- Pinte os géis com brometo de etídio de 0,5 μg/mL e inspecione-os visualmente, tornando-os visíveis em um transiluminador UV.
- A fim de examinar a relação filogenética entre isolados de agentes de podridão radicular e da coroa, obtenha-se as sequências de bases do gene ITS por PCR, que foram sintetizadas bidirecionalmente (5'-3' e 3'- 5') por meio de um fornecedor. Compare as sequências de bases com os dados genéticos do site do NCBI (National Center of Biotechnology Information) e as sequências de bases do gene ITS de outros isolados de Fusarium no mundo usando o programa Blast. Use-o para identificar os isolados no nível da espécie, conforme descrito abaixo.
- Acesse https://www.ncbi.nlm.nih.gov site. Clique na guia BLAST na seção Recursos Populares.
- Clique na guia Nucleotide BLAST na nova janela. Na seção Inserir Sequência de Consulta na nova janela, insira as sequências base no formato Fasta e escreva o nome do estudo na seção Cargo.
- Em seguida, marque Bancos de dados padrão (nr etc.) na guia Banco de dados na seção Escolher conjunto de pesquisa na parte inferior.
- Marque Sequências altamente semelhantes (megablast) na guia Otimizar para na seção Seleção de programa e clique na guia BLAST na parte inferior da página.
- Use o programa de análise filogenética MEGA 11 para determinar a relação filogenética entre os isolados de Fusarium . Alinhe as sequências de bases usando o programa ClustalW e crie as árvores genealógicas genéticas dos isolados de acordo com a parcimônia máxima para o gene ITS26.
- Para baixar o software Mega, acesse o site https://www.megasoftware.net e instale o software Mega. O software MEGA é fornecido GRATUITAMENTE para uso em pesquisa e educação.
- Primeiro, salve as sequências na área de trabalho como um arquivo do Bloco de Notas (.txt) no formato FASTA. Execute o programa de software Mega e clique na guia ALIGN. Clique em Editar/Construir Alinhamento na janela. Em seguida, marque Criar um novo alinhamento na nova janela e clique em OK para confirmar.
- Clique na guia DNA . Exclua o 1. Sequência que aparece automaticamente na janela, vá para o arquivo Editar e clique na guia Inserir sequência do arquivo . Abra o arquivo do Bloco de Notas (.txt) que contém as sequências e está localizado na área de trabalho.
- Nesta fase, todas as sequências aparecem na tela. Primeiro, clique em Qualquer sequência que apareça na tela e, em seguida, marque todas as sequências com CTRL + A. Abra o arquivo Alinhamento e clique em Alinhar por Clustal W a partir daí e clique em OK para executar o programa nas configurações padrão.
- Depois de examinar as diferenças no alinhamento das sequências, vá para o arquivo de dados, clique em Análise filogenética e, em seguida, clique em Não na caixa de seleção da janela para saber se as sequências sintetizam proteínas ou não. Nossas sequências não sintetizam proteínas porque pertencem à região ITS.
- Retorne à janela principal do software Mega. Clique em Filogenia e selecione Construir/Testar Árvore(s) de Parcimônia Máxima. Na nova janela, selecione Método de Bootstrap para o teste de Filogenia e insira os valores de bootstrap 1.000 para testar a força da ramificação. Na guia Lacunas/Tratamento de Dados Ausentes, selecione Exclusão Parcial, selecione SPR (Poda de Subárvore-Reenxertia) como o método de pesquisa MP e clique em OK para confirmar as operações.
- Aguarde o resultado da análise para mostrar a árvore filogenética.
5. Teste de patogenicidade
- Utilizar quatro isolados para estudos de patogenicidade para cada espécie representativa das espécies de Fusarium que foram identificadas por métodos moleculares. Realizar estudos de patogenicidade a 24 °C, 16 h de luz fluorescente/8 h de fotoperíodo escuro, com 65% de umidade em uma sala com ar condicionado.
- Semeie sementes de lentilha em frascos de plástico preto com 45 orifícios de 5 cm de diâmetro. Mantenha cada frasco em hipoclorito de sódio a 1% por 3 min e depois enxágue com água destilada estéril 3x. Seque as sementes em um armário estéril por 24 h e semeie com uma semente em cada cova.
NOTA: As sementes de lentilha da variedade Kayı 91, sensíveis à doença, foram utilizadas em todos os testes de patogenicidade6. A técnica de imersão em plântulas foi utilizada como método de inoculação27. - Incubar culturas puras de cada isolado em BDA a 24 °C durante 7-10 dias. Raspar as colónias cultivadas a partir da cultura de reserva da superfície do meio com uma espátula e preparar a suspensão de esporos/micélio com água destilada estéril.
- Remova os resíduos grandes da suspensão por filtração através de uma gaze de 4 camadas e ajuste a concentração de esporos/micélio para 1 x 106 esporos/mL com a ajuda de um hemocitômetro.
- Após esta fase, arranque as raízes das mudas previamente cultivadas nos frascos quando tiverem 2-3 folhas verdadeiras. Lave em água da torneira e machuque levemente as raízes com uma agulha estéril. Mergulhe essas mudas na suspensão preparada de esporos / micélio por 3 min e, em seguida, transplante-as em frascos de plástico contendo a mistura estéril de solo / turfa (2: 1; v / v).
- Para as mudas usadas como controle, arranque suas raízes, machuque-as e plante-as mergulhando-as apenas em água estéril. Faça avaliações de teste de patogenicidade 3 semanas após o processo de inoculação de acordo com a escala de 0-4.
- Após os valores calculados de severidade da doença foram submetidos à transformação angular, submeter os valores obtidos à análise de variância e avaliar as diferenças entre as médias de acordo com o teste HSD de Tukey (p = 0,05). Severidade da doença: Isolados com 0%-15% foram avaliados como tendo virulência muito baixa (LV), isolados com 16%-35% foram avaliados como baixa virulência (LV), isolados com 36%-50% foram avaliados como virulência moderada (O), isolados com 51%-70% foram avaliados como alta virulência (VV), isolados com 71%-100% foram avaliados como muito alta virulência (VV) e isolados sem sintomas da doença foram avaliados como isolados saprófitos ou epífitos.
Resultados
Determinação dos parâmetros da doença
Um total de 83 áreas de semeadura de lentilha cobrindo nove regiões diferentes de Yozgat foram avaliadas em termos de murcha, raízes e sintomas de podridão da coroa foram pesquisados, estendendo-se por uma área de 1,1984 x 106 m2 (Tabela 2). Sintomas de murcha ou podridão radicular foram encontrados em todos os campos. No entanto, a incidência de murcha e podridão radicular em Yozgat foi determinada em 16,9%, com severidade da doença de 38,6% nos distritos de Sorgun e Sarıkaya. A incidência considerável da doença também foi determinada nos distritos de Şefaatli (26,4%), Boğazlayan (23,0%) e Sorgun (20,1%). Paradoxalmente, a maior porcentagem de gravidade da doença foi determinada no distrito de Sorgun com 45,2%, seguido por Boğazlayan com 36,0% e Sarıkaya com 35,4%. Além disso, 679 plantas apresentaram sintomas da doença em amostras coletadas nos campos de lentilha das áreas demarcadas examinadas (Tabela 3). Seguiu-se a identificação morfológica dos agentes fúngicos isolados distribuídos em dois grupos. Os isolados de Fusarium classificados no primeiro grupo incluíram patógenos ou saprófitas como Alternaria sp, Ascochyta sp. e Rhizoctonia sp. A porcentagem da taxa de isolamento dos isolados de Fusarium foi de 95,4%. F. oxysporum foi determinada como a espécie de fungo mais isolada de plantas de lentilha apresentando sintomas da doença em Yozgat, com uma porcentagem de taxa de isolamento de 59,5%. Esta espécie patogênica de Fusarium foi seguida por F. graminearum (15,8%) e F. culmorum (10,2%). Paradoxalmente, F. solani (4,4%) e F. acuminatum (5,5%) foram isolados em níveis mais baixos de plantas com sintomas da doença. F. oxysporum foi obtido em todos os distritos onde o estudo de pesquisa foi realizado, e o percentual de taxa de isolamento de acordo com os bairros foi distribuído entre 45,3% e 72,2%. F. oxysporum foi mais isolado nos distritos Central (72,2%), Şefaatli (71,9%), Akdağmadeni (68,3%) e Sorgun (62,2%) de Yozgat. Em contraste, F. solani e F. acuminatum foram as espécies de Fusarium menos isoladas em Yozgat. F. solani não foi isolado dos distritos de Çekerek e Central; F. acuminatum também não foi isolado dos distritos de Akdağmadeni, Central e Şefaatli (Tabela 3).
Identificação morfológica
Culturas puras de isolados de Fusarium foram identificadas morfologicamente de acordo com os caracteres de suas colônias, bem como estruturas de microconídios, macroconídios e clamidósporos. Estudos de identificação foram realizados em nível de espécie, de acordo com Leslie e Summerell22. Todos os isolados fúngicos obtidos de plantas com sintomas de murcha, raiz e podridão do colo radicular nas lentilhas foram coletados em seis grupos de acordo com sua colônia e micromorfologia (Tabela 3). Enquanto os cinco primeiros grupos incluíam isolados pertencentes a espécies de Fusarium , o outro grupo incluía isolados de fungos patogênicos diferentes do gênero Fusarium , como Alternaria, Rhizoctonia e Ascochyta.
Os isolados de F. oxysporum com maior taxa de isolamento apresentam colônias brancas a amarelas e pigmentação lilás-púrpura. As macrocônias são de comprimento curto a médio, ligeiramente curvadas e geralmente têm de 3 a 5 septos. A estrutura de esporos de alguns isolados é ligeiramente enganchada com dimensões de macroconídios determinadas como 33,8 a 71,5 μm x 3,1 a 4,5 μm. Os microconídios são geralmente não septados, ovais, elípticos ou em forma de rim. A formação de clamidósporos ocorreu lentamente (4-6 semanas). Foi observado em clusters duplos e uma estrutura de cadeia curta16.
A segunda espécie com maior taxa de isolamento, os isolados de F. graminearum , apresentam micélio aéreo branco-rosa e pigmentação vermelha escura. Os macroconídios são finos, retos ou ligeiramente curvos, com cinco a sete septos. Os septos são bastante distintos. Tem uma célula apical pontiaguda e uma célula basal distintamente em forma de pé. As dimensões são 25,7 a 97,3 μm x 3,5 a 5,5 μm. Não foram observados microconídios e formação de clamidósporos28.
As colônias de isolados de F. culmorum no terceiro grupo eram inicialmente brancas, mas com a idade, observou-se uma estrutura micelial rosa claro a rosa escuro. Os macroconídios são curtos, 4-6 septados e ligeiramente curvos. Dimensões dos macrósporos; 15,8 - 60,0 μm x 3,2 - 5,1 μm. Eles são numerosos. Microsporos não foram observados. A formação de clamidósporos é rápida em comparação com outras espécies (3-5 semanas). Eles são encontrados individualmente ou em grupos de dois29.
As colônias da quarta espécie, isolados de F. acuminatum , são laranja pálido, laranja e bordô claro. É uma espécie de crescimento relativamente lento. Seus macroconídios são finos, têm uma curvatura distinta e têm uma estrutura septada de 3-5. As dimensões dos macroconídios foram determinadas como 31,0-65,5 × 4,3-6,6 μm. Os microconídios têm 0 e 1 septado. Foi observado raramente em imagens microscópicas. A formação de clamidósporos é muito lenta (mais de 6 semanas). Forma-se em cadeias e aglomerados22.
A cor da colônia da última espécie patogênica identificada, isolado de F. solani , é branca e de cor creme. Sua macroconia é larga, plana e ligeiramente curva. As hifas são 3-7 septadas e abundantes. As dimensões dos macrósporos são determinadas como 20,2 a 50,6 μm x 3,1 a 6,2 μm. Os microconídios são indivisíveis ou 1-divididos. Eles são ovais e elipsóides em estrutura. Os clamidósporos são encontrados terminalmente em cadeias curtas em meio CLA dentro de 2-4 semanas30.
Identificação molecular
A PCR foi realizada usando primers ITS4/ITS5 com DNA genômico total obtido de isolados de Fusarium . As sequências de bases bidirecionais (5'-3' e 3'-5') foram registradas e comparadas com outros NCBI GenBank usando o programa Blast (Tabela 4 e Tabela 5). Os isolados de F. oxysporum apresentaram homogeneidade de 99,5% a 100% na sequência de nucleotídeos com isolados da Índia (MT740398), Lituânia (KF646094) e Alemanha (MT453296). Os isolados de F. culmorum apresentaram 100% de homogeneidade na sequência de nucleotídeos com isolados do Canadá (AY147290), França (OW983123) e República Tcheca (MT453296). Os isolados de F. graminearum apresentaram homogeneidade de 99,5% a 100% na sequência de nucleotídeos com isolados da Colômbia (MT598163) e da China (ON527490). Os isolados de F. acuminatum apresentaram homogeneidade de 99,5% a 100% na sequência de nucleotídeos com isolados do Uzbequistão (OR975902) e da China (MZ424810, PP336554). Os isolados de F. solani apresentaram 100% de homogeneidade na sequência de nucleotídeos com isolados do Egito (OR713084), China (PQ482231) e Índia (OP848138). Em seguida, a relação genética entre os isolados de Fusarium foi determinada pela árvore filogenética obtida de acordo com o método de Máxima Parcimônia (MP) usando o programa Mega 11 (Figura 3). Na árvore filogenética MP, 638 caracteres de nucleotídeos foram usados, incluindo lacunas, e 145 desses nucleotídeos foram determinados como regiões informativas que fornecem parcimônia. As análises de MP produziram uma das árvores mais parcimoniosas (Figura 3; Comprimento da Árvore: 172; Índice de Consistência (ConI): 0,974; Índice de Retenção (IR): 0,961; Índice Composto (ComI): 0,7600). Quando este dendrograma MP de isolados de Fusarium foi examinado, a árvore genealógica foi primeiro dividida em dois ramos principais. O primeiro deles correspondeu a todos os isolados de F. solani suportados por 100% de valor de bootstrap. O outro ramo principal foi reunido dentro de si com um valor de bootstrap de 78% e quatro subgrupos F. acuminatum, F. redolens, F. proliferatum e F. acutatum. O outro ramo principal foi dividido em cinco subgrupos F. oxysporum, F. culmorum, F. graminarum, F. pseudograminearum e F. equiseti, com um valor de bootstrap de 97%.
Determinação dos níveis de virulência de isolados de Fusarium
Os resultados dos estudos de patogenicidade de Fusarium spp. isolados de lentilhas mostrando murcha e podridão radicular, para os quais foram concluídos estudos de caracterização morfológica e molecular, estão resumidos na Tabela 6 e na Figura 4. Em geral, todos os isolados de Fusarium apresentaram diferenças nos níveis de severidade das doenças que causaram na lentilha Kayı 91 variedade F (19-60; 0,05) = 43,06; p< 0,0001). Os isolados mais virulentos foram F. oxysporum (YBUFol4), F. culmorum (YBUFc1, YBUFc2) e F. graminearum (YBUFg1, YBUFg3). Descobriu-se que esses cinco isolados tinham um nível de virulência muito alto. Por outro lado, um isolado de F. oxysporum (YBUFol2), F. solani (YBUFs1) e F. graminearum (YBUFg2) apresentou virulência moderada. Além disso, os isolados de F. acuminatum (YBUFa1, YBUFa2, YBUFa3 e YBUFa4) apresentaram virulência fraca ou baixa. Todos os isolados utilizados nos estudos de patogenicidade variaram de 42,5% a 97,5% e foram obtidos após a inoculação de mudas de lentilha.

Figura 1: Plantas de lentilha afetadas por espécies de Fusarium. (A) Visão geral de áreas doentes localizadas em um campo de lentilha com alta gravidade da doença. (B) Vista de plantas com severidade da doença 4. (C) Vista de plantas com severidade da doença 3. Clique aqui para ver uma versão maior desta figura.

Figura 2: Vista das plantas de lentilha nos níveis de severidade da doença de 0 a 4. Nível 0 = não apresentou sintomas, 1 = sintomas das folhas em 25%; 2 = 26%-50%; 3 = 51%-75% das folhas; 4 = mais de 75% na mesma ordem. Clique aqui para ver uma versão maior desta figura.
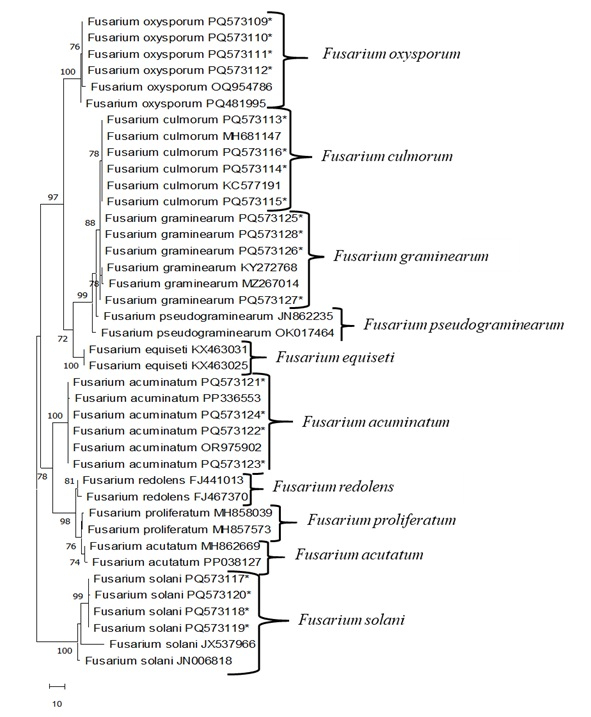
Figura 3: Árvore não enraizada mais parcimoniosa com base na região ITS de Fusarium sp. usando MEGA 11. Os isolados são indicados por asteriscos. O resto é retirado do GenBank. Clique aqui para ver uma versão maior desta figura.
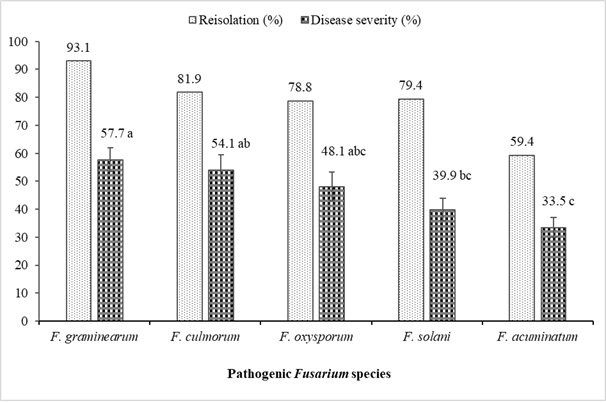
Figura 4: Taxas de reisolamento (%) e severidade da doença (%) de Fusarium spp. isolado de plantas de lentilha. As linhas verticais representam o erro padrão na barra (n = 16). Clique aqui para ver uma versão maior desta figura.
| Temperatura (°C) | Umidade relativa (%) | Precipitação (mm) | |||||||
| Mês | 2022 | 2023 | Duradouro | 2022 | 2023 | Duradouro | 2022 | 2023 | Duradouro |
| Akdağmadeni | |||||||||
| Março | 11.1 | 7.4 | 3.8 | 45.1 | 68.8 | 71.1 | 21.4 | 78.7 | 60.6 |
| Abril | 11.1 | 11.4 | 8.8 | 59.2 | 67 | 61.5 | 56.5 | 109.8 | 42.6 |
| Maio | 16.3 | 15.1 | 12.9 | 64.3 | 73.9 | 64.8 | 48.5 | 83.6 | 74.1 |
| Junho | 16.5 | 18.4 | 16.2 | 63.4 | 53.2 | 69.1 | 0.3 | 20.1 | 57.2 |
| Julho | 22 | 22.2 | 18.7 | 48 | 40.5 | 60.5 | 1.4 | 0 | 7 |
| Boğazlıyan | |||||||||
| Março | 12.3 | 9.9 | 5.2 | 47.8 | 65.5 | 66 | 13 | 64 | 40.1 |
| Abril | 12.8 | 13.5 | 10.2 | 62.6 | 66.6 | 59.3 | 20.2 | 24.2 | 24.4 |
| Maio | 18.7 | 17.7 | 14.6 | 62.5 | 67.4 | 61.2 | 65.4 | 20 | 35.1 |
| Junho | 19.7 | 20.6 | 18.6 | 52.9 | 49.9 | 59.9 | 0 | 2.4 | 35.5 |
| Julho | 24.3 | 24 | 21.7 | 42.5 | 39.5 | 50 | 0 | 0 | 3.9 |
| Çekerek | |||||||||
| Março | 13.5 | 10.8 | 6.6 | 52.8 | 70.4 | 69 | 24.3 | 111.3 | 48.7 |
| Abril | 14.1 | 13.9 | 11.5 | 63.9 | 72.3 | 61 | 48.1 | 73.4 | 32 |
| Maio | 19.3 | 18.6 | 15.8 | 69.1 | 72.7 | 65.4 | 80.3 | 69 | 59.3 |
| Junho | 20.1 | 21.8 | 19.4 | 61.5 | 57.5 | 67.8 | 0 | 16.4 | 62.8 |
| Julho | 24.6 | 24.7 | 22 | 57.8 | 52.4 | 57.5 | 33.2 | 0 | 10.9 |
| Yozgat | |||||||||
| Março | 11.5 | 8.4 | 4 | 47.3 | 68.7 | 67.5 | 14.6 | 84.8 | 87.3 |
| Abril | 12.4 | 12.7 | 9.3 | 60.1 | 65.2 | 58.7 | 47.4 | 54.4 | 41.9 |
| Maio | 17.5 | 16.8 | 13.7 | 64.2 | 68 | 60.2 | 92.6 | 61.6 | 72.2 |
| Junho | 18.3 | 20.3 | 17.4 | 57.9 | 50.7 | 61.2 | 1 | 4.8 | 63.6 |
| Julho | 22.9 | 23.6 | 20.5 | 50.9 | 44.3 | 52.7 | 7 | 0.2 | 8.8 |
| Saraykent | |||||||||
| Março | 14.8 | 9 | 6.2 | 50.9 | 71.1 | 71 | 11.1 | 77.3 | 55.3 |
| Abril | 12.5 | 12.3 | 10.5 | 64.6 | 73.2 | 60.7 | 35.3 | 36.1 | 29 |
| Maio | 17.6 | 16.4 | 14.2 | 69.1 | 76.7 | 65.9 | 47.8 | 72.4 | 57 |
| Junho | 18.2 | 19.2 | 18.2 | 63.8 | 61 | 69.6 | 0 | 28.6 | 56.1 |
| Julho | 23.2 | 23.1 | 21.6 | 54.2 | 51.7 | 57.9 | 0 | 0 | 7.4 |
| Sarıkaya | |||||||||
| Março | 12.9 | 9.6 | 5.6 | 47 | 68.2 | 66.5 | 18.4 | 75.5 | 53.6 |
| Abril | 13.2 | 13.1 | 10.7 | 59 | 68.8 | 56.5 | 24.8 | 60.6 | 27.2 |
| Maio | 18.5 | 17.3 | 14.7 | 63.2 | 71.6 | 60.6 | 57.6 | 64.5 | 47.2 |
| Junho | 18.9 | 20.5 | 18.4 | 59 | 53.9 | 62 | 0 | 16.1 | 50.6 |
| Julho | 24 | 24 | 21.3 | 48.6 | 45.4 | 51.5 | 0 | 0 | 6.4 |
| Şefaatli | |||||||||
| Março | 13.1 | 10.6 | 6.2 | 48.2 | 61.1 | 67 | 12.6 | 71.5 | 50.2 |
| Abril | 11.2 | 14.3 | 11.1 | 61.6 | 60.9 | 58.6 | 48.4 | 50.5 | 26 |
| Maio | 19.9 | 18.6 | 15.4 | 66.7 | 61.9 | 62.3 | 65.2 | 95.4 | 53.7 |
| Junho | 20.4 | 22.2 | 19.7 | 55.8 | 45.5 | 61.2 | 1.2 | 2.5 | 46.8 |
| Julho | 25 | 25.3 | 23.2 | 47.9 | 39.5 | 47.1 | 0 | 0 | 4.1 |
| Sorgun | |||||||||
| Março | 12.2 | 9.4 | 4.8 | 48.4 | 68.2 | 67 | 21.6 | 104.2 | 49.8 |
| Abril | 13 | 13.3 | 10.1 | 59.7 | 66.1 | 58.9 | 53.2 | 33.8 | 31.7 |
| Maio | 18.3 | 17.4 | 14.5 | 63.7 | 69.1 | 60.9 | 56.6 | 89.6 | 44.2 |
| Junho | 18.9 | 20.3 | 18.3 | 56.8 | 53.4 | 61.5 | 0 | 16.6 | 55.2 |
| Julho | 23.7 | 23.7 | 21.2 | 50 | 44.9 | 52.9 | 4 | 0 | 7.5 |
| Yerköy | |||||||||
| Março | 15 | 12.1 | 6 | 41.2 | 60.5 | 61.3 | 4.4 | 46.1 | 60.1 |
| Abril | 16.2 | 16.2 | 13.5 | 54.8 | 60.4 | 50.9 | 40.9 | 46.8 | 23 |
| Maio | 21.5 | 20.6 | 17.4 | 55.4 | 59.6 | 52.2 | 57 | 23.6 | 35.1 |
| Junho | 23 | 24.5 | 20.9 | 45.2 | 41.4 | 56.4 | 0.2 | 0 | 39.1 |
| Julho | 27.5 | 27.7 | 24.4 | 38.2 | 35.5 | 42.2 | 0.2 | 0 | 3.5 |
Tabela 1: Dados meteorológicos do local pesquisado durante a temporada de produção de lentilhas por ano.
| Condado | Número de campo | Área de Semeadura Pesquisada (Decare) | Prevalência da doença (%) | Incidência da doença (%) | Gravidade da doença (%) |
| Akdağmadeni | 4 | 43.2 | 100 | 7 | 21.8 |
| Boğazlıyan | 4 | 86.4 | 100 | 23 | 36 |
| Çekerek | 1 | 2.7 | 100 | 1.6 | 14.4 |
| Merkez | 3 | 24.3 | 100 | 5.8 | 23 |
| Saraykent | 6 | 53.3 | 100 | 8.1 | 28.2 |
| Sarıkaya | 12 | 189.3 | 100 | 17 | 35.4 |
| Sorgun | 48 | 683.2 | 100 | 20.1 | 45.2 |
| Şefaatli | 2 | 73.7 | 100 | 26.4 | 23.4 |
| Yerköy | 3 | 42.3 | 100 | 9.1 | 32.9 |
| Geral | 83 | 1198.4 | 100 | 16.9 | 38.6 |
Tabela 2: Parâmetros da doença, prevalência, incidência e severidade da murcha, podridão da raiz e do colo da raiz em campos de lentilha.
| Condado | Número de plantas usadas para isolamento | Frequência de isolamento (%) | |||||
| F. oxysporum | F. culmorum | F. solani | F. acuminatum | F. graminearum | Outro | ||
| Akdağmadeni | 41 | 68.3 | 9.8 | 2.4 | 0 | 14.6 | 4.9 |
| Boğazlıyan | 57 | 54.4 | 1.8 | 12.3 | 7 | 15.8 | 8.8 |
| Çekerek | 21 | 52.4 | 4.8 | 0 | 23.8 | 9.5 | 9.5 |
| Merkez | 36 | 72.2 | 11.1 | 0 | 0 | 13.9 | 2.8 |
| Saraykent | 64 | 45.3 | 12.5 | 7.8 | 4.7 | 21.9 | 7.8 |
| Sarıkaya | 148 | 56.8 | 11.5 | 7.4 | 5.4 | 15.5 | 3.4 |
| Sorgun | 233 | 62.2 | 9.4 | 1.3 | 7.3 | 16.3 | 3.4 |
| Şefaatli | 32 | 71.9 | 15.6 | 3.1 | 0 | 9.4 | 0 |
| Yerköy | 47 | 57.4 | 14.9 | 4.3 | 2.1 | 14.9 | 6.4 |
| Geral | 679 | 59.5 | 10.2 | 4.4 | 5.5 | 15.8 | 4.6 |
Tabela 3: Informações sobre lentilhas amostradas para frequência de isolamento fúngico na província de Yozgat, na Turquia.
| Espécies de Fusarium | Isolar | Condado | Fonte de isolamento | Número de acesso do GeneBank |
| F. oxysporum | YBUFol1 | Sorgun | Raiz | PQ573109 |
| YBUFol2 | Bogazlayan | Colar de raiz | PQ573110 | |
| YBUFol3 | Sarıkaya | Raiz | PQ573111 | |
| YBUFol4 | Akdagmadeni | Raiz | PQ573112 | |
| F. culmorum | YBUFc1 | Sorgun | Raiz | PQ573113 |
| YBUFc2 | Yerkoy | Raiz | PQ573114 | |
| YBUFc3 | Sarıkaya | Raiz | PQ573115 | |
| YBUFc4 | Saraykent | Colar de raiz | PQ573116 | |
| F. solani | YBUFs1 | Yozgat | Raiz | PQ573117 |
| YBUFs2 | Sorgun | Raiz | PQ573118 | |
| YBUFs3 | Sefaatli | Raiz | PQ573119 | |
| YBUFs4 | Sarıkaya | Raiz | PQ573120 | |
| F. acuminatum | YBUFa1 | Cekerek | Raiz | PQ573121 |
| YBUFa2 | Bogazlayan | Colar de raiz | PQ573122 | |
| YBUFa3 | Sarıkaya | Colar de raiz | PQ573123 | |
| YBUFa4 | Sorgun | Raiz | PQ573124 | |
| F. graminearum | YBUFg1 | Yozgat | Raiz | PQ573125 |
| YBUFg2 | Sorgun | Raiz | PQ573126 | |
| YBUFg3 | Saraykent | Raiz | PQ573127 | |
| YBUFg4 | Sarıkaya | Colar de raiz | PQ573128 |
Tabela 4: Fusarium spp. isolados de lentilha (Lens culinaris) da província de Yozgat, região central da Turquia, usados no estudo filogenético.
| Espécies de Fusarium | Isolar | País | Fonte de isolamento | Número de acesso do GenBank |
| F. acuminatum | AAG4 | n/a | Prunus persica | OR975902 |
| WHWNSHJ1 | China | Malus domestica | PP336553 | |
| F. acutatum | CBS 739,97 | Índia | n/a | MH862669 |
| NSF1 | Egito | Tetraena alba | PP038127 | |
| F. culmorum | 2090 | Índia | n/a | KC577191 |
| G49 | Polônia | Pisum sativum | MH681147 | |
| F. equiseti | Fusarium equiseti Resposta 577 | China | Patchuli | KX463031 |
| Fusarium equiseti Resposta 571 | China | Patchuli | KX463025 | |
| F. graminearum | Wm-233 | China | n/a | MZ267014 |
| 16uma | n/a | n/a | KY272768 | |
| F. oxysporum | YBUFoc4 | Türkiye | Cicer arietinum | OQ954786 |
| LuC-8 | China | Crisântemo x morifolium | PQ481995 | |
| F. proliferatum | CBS 246,61 | Alemanha | n/a | MH858039 |
| CBS 186,56 | n/a | n/a | MH857573 | |
| F. pseudograminearum | WZ-8A | China | Trigo | JN862235 |
| GAAET080 | China | Milho | OK017464 | |
| F. redolens | M11 | n/a | Cogumelo | FJ441013 |
| 2008 | n/a | Cogumelo | FJ467370 | |
| F. solani | S2-27 | França | n/a | JX537966 |
| UENFCF279 | Brasil | Goiaba | JN006818 |
Tabela 5: Sequências de espécies de Fusarium usadas do GenBank em estudo filogenético.
| Espécies de Fusarium | Isolar | Gravidade da doença (%) a | Nível de virulência do isolado | Isolamento (%) |
| (Erro padrão médio ±) | ||||
| F. oxysporum | YBUFol1 | 20. 0 ± 1,1 i | Fraco | 62.5 |
| YBUFol2 | 56,9 ± 1,2 CDE | Moderadamente | 85 | |
| YBUFol3 | 42,5 ± 1,0 efg | Menos | 77.5 | |
| YBUFol4 | 73.1 ± 3.9 ab | Altamente | 90 | |
| F. culmorum | YBUFc1 | 72.5 ± 1.0 ab | Altamente | 95 |
| YBUFc2 | 72.5 ± 2.7 ab | Altamente | 95 | |
| YBUFc3 | 23,6 ± 1,6 oi | Fraco | 60 | |
| YBUFc4 | 48.1 ± 2.6 def | Menos | 77.5 | |
| F. solani | YBUFs1 | 58,8 ± 1,6 bcd | Moderadamente | 97.5 |
| YBUFs2 | 46.9 ± 2.1 def | Menos | 75 | |
| YBUFs3 | 17,5 ± 2,3 i | Fraco | 65 | |
| YBUFs4 | 36,3 ± 1,6 FGH | Menos | 80 | |
| F. acuminatum | YBUFa1 | 42,5 ± 2,3 efg | Menos | 65 |
| YBUFa2 | 16,9 ± 2,8 i | Fraco | 42.5 | |
| YBUFa3 | 30.6 ± 6.1 oi | Menos | 62.5 | |
| YBUFa4 | 44.1 ± 7.1 defg | Menos | 67.5 | |
| F. graminearum | YBUFg1 | 76,3 ± 2,2 a | Altamente | 97.5 |
| YBUFg2 | 50.6 ± 3.3 def | Moderadamente | 92.5 | |
| YBUFg3 | 68,1 ± 2,1 abc | Moderadamente | 95 | |
| YBUFg4 | 35,6 ± 1,9 FGH | Menos | 87.5 |
Tabela 6: Testes de patogenicidade de espécies de Fusarium em plantas de lentilha. Isolados classificação média <10% = não agressivo; 11%-25% = fraco agressivo; 26%-50% = menos agressivo; 51%-70% = moderadamente agressivo; >70% = altamente agressivo. um Diferença estatística entre os isolados de acordo com o teste Tukey HSD (p < 0,05).
Discussão
A murcha de Fusarium é conhecida por causar sérias perdas de rendimento econômico em algumas partes do mundo31. A doença foi relatada pela primeira vez na Hungria32 e posteriormente relatada em muitos países, como Egito, Índia, Mianmar, Nepal, Paquistão, Turquia, Síria e EUA33. Kumar et al.34 relataram uma ampla distribuição de murcha de lentilha, raiz e podridão do colo radicular com relatos de ocorrência em pelo menos 26 países em todo o mundo. Em um estudo recente, 12 espécies de fungos foram isoladas de plantas de lentilha doentes coletadas em diferentes estados da Índia, e F. oxysporum f. sp. lentis foi identificado como o patógeno mais importante (30%), seguido por Rhizoctonia bataticola (17,5%) e Sclerotium rolfsii (15,7%)31. Da mesma forma, no presente estudo, o gênero fúngico mais frequentemente isolado foi o Fusarium (95,4%). De acordo com Zitnick-Anderson et al.7, Fusarium (50%) foi o gênero fúngico dominante causando murcha, podridão radicular e do colo radicular nas plantações de lentilha de Dakota do Norte. Eles também relataram que F. oxysporum, F. solani, F. culmorum, F. equiseti, F. acuminatum, F. graminearum, F. redolens e F. avenaceum são patógenos dentro deste gênero.
As características morfológicas das cinco espécies de Fusarium identificadas neste estudo foram semelhantes às de estudos recentes35. De acordo com Rathod et al.36, os isolados de F. oxysporum relataram que apresentavam desenvolvimento de colônias septadas, ramificadas, inicialmente brancas e depois elevadas ou afundadas na PCA, que se tornaram coloridas em diferentes pigmentações. Da mesma forma, no estudo atual, os isolados de F. oxysporum formaram inicialmente colônias brancas, posteriormente amarelas, violetas ou rosa. Por outro lado, clamidósporos na forma de duas ou três cadeias, que foram utilizados como critério morfológico de identificação de isolados de F. oxysporum , foram observados em colônias com aproximadamente 30 dias de idade. De fato, Endes15 relatou que os clamidósporos de isolados de F. oxysporum mantidos por >30 dias obtidos de tiveram maior tendência a infectar plantas em áreas de cultivo de grão-de-bico da província de Yozgat foram geralmente observados em ambientes antigos.
A podridão radicular de Fusarium em grão-de-bico e lentilha é causada por muitas espécies de Fusarium, como F. solani, F. oxysporum e F. graminearum37. Conforme relatado por Dean et al.38, F. graminearum e F. oxysporum estão entre os patógenos fúngicos de plantas mais comumente isolados por micologistas de plantas em todo o mundo. No entanto, Aydın et al.6 relataram que F. graminearum está entre os agentes causadores da murcha, raiz e podridão da coroa em áreas de cultivo de lentilha na região sudeste da Anatólia da Turquia. Além disso, F. graminearum é conhecido por causar podridão radicular e da coroa em lentilhas no estado de Dakota do Norte, EUA7.
Fletcher et al.39 relataram que F. culmorum raramente pode ser isolado como patógeno em áreas de cultivo de lentilhas. Além disso, em um estudo recente de Zitnick-Anderson et al.7, foi relatado que F. culmorum está associado à murcha, raiz e podridão do colo radicular em plantas de lentilha. No entanto, Aydın et al.6 identificaram muitas espécies de Fusarium que causam murcha e podridão radicular em áreas de cultivo de lentilhas, mas não relataram F. culmorum como patógeno. Essa situação, que difere do presente estudo, pode ser devido ao número diferente de áreas pesquisadas ou ao apoio de estudos morfológicos com métodos moleculares no presente estudo.
Zitnick-Anderson et al.7 relataram que F. acuminatum está entre as espécies de Fusarium que causam murcha e podridão radicular e do colo radicular em campos de lentilha de Dakota do Norte. Por outro lado, Aydın et al.6 documentaram que F. solani está entre os agentes causadores da murcha e podridão radicular em áreas de cultivo de lentilha. Sabe-se também que F. solani é isolado de áreas de cultivo de lentilha como um patógeno fraco7.
As espécies de Fusarium são parasitas facultativos. Infecções devido ao gênero Fusarium em lentilhas podem causar destruição completa das plantas, especialmente em temperaturas extremas no final da primavera ou início do verão. Al Ahmad e Mouselli40 relataram que F. oxysporum e F. solani causaram sintomas de amarelecimento, desfolha e dessecação em plantações de lentilha no sul da Síria. F. solani causa podridão radicular e doenças murchas na Anatólia Central, incluindo Yozgat16. Além disso, algumas outras espécies de Fusarium também foram consideradas patogênicas em certas taxas. Zitnick-Anderson et al.7 relataram que a murcha de Fusarium é causada por Fusarium oxysporum f. sp lentis, mas as espécies de F. culmorum, F. solani, F. graminearum também podem causar murcha de acordo com características morfológicas, fisiológicas e patológicas. Além disso, Fletcher et al.39 relataram que F. acuminatum, que causa murcha e podridão radicular em lentilhas, tem virulência fraca ou baixa.
O estudo revelou que 95,4% dos isolados de Fusarium obtidos dos campos de lentilha examinados eram espécies de Fusarium e tiveram uma incidência de 1,6% - 26,4% e severidade da doença de 14,4% - 45,2% em plantas de lentilha. Condições climáticas adversas, como primavera quente e seca e calor do início do verão, enfraquecem o crescimento das plantas e tornam as plantas suscetíveis às espécies de Fusarium . A maioria das espécies de Fusarium são patógenos fracos e, quando as condições ambientais enfraquecem a planta hospedeira, causam um aumento na murcha de Fusarium , especialmente em condições de seca.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este estudo foi apoiado pelo Centro de Pesquisa e Aplicação de Coordenação de Projetos da Universidade Bozok, unidade BAP com número de projeto FÇD-2022-1096. Este estudo faz parte do estudo de doutorado de Sevim Atmaca.
Materiais
| Name | Company | Catalog Number | Comments |
| (S)-lactic acid | Merck | 100366 | Was used as an antibiotic in studies. |
| 2-propanol | Merck | 109634 | Used in molecular studies. |
| Adjustable micro automatic pipette (0.1-2.5 µL) | Eppendorf Research | LB.EP.3123000012 | Used to measure small volumes of liquids. |
| Adjustable micro automatic pipette set (2 – 20 µl, 20 – 200 µl, 100 – 1.000 µl) | Eppendorf Research | LB.EP.4924000916 | Used to measure small volumes of liquids. |
| Agar | Merck | 110453 | For use in making fungal media. |
| Agarose | Sigma-Aldrich | 18300012 | For use in gel preparation in electrophoresis. |
| Air conditioning room | ?klimlab | Was used to grow plants under controlled conditions. | |
| Ampisilin | Sigma-Aldrich | A9393 | Was used as an antibiotic in studies. |
| Analytical precision balance | Shimadzu ATX224 | Was used to weigh the solid materials used in the study. | |
| Autoclave sterilizer | Zealway | GF-120DR | It was used to sterilize solid and liquid materials at every stage of the study. |
| Binocular microscope | Leica DM750 | For use in morphological diagnosis. | |
| Biological safety cabinet | HFsafe Class II A2 | To ensure the safety of the work area, the user, the environment and the operation. | |
| Centrifugal | DLAB DM1424 | LB.DL.903001124 | Used to separate particles in a sample based on their shape, size and density |
| Chloramphenicol | Sigma-Aldrich | 220551 | Was used as an antibiotic in studies. |
| Cork-borer set | Sigma-Aldrich | Z165220 | It was used to take samples from fungus culture in petri dishes. |
| Cover glass and slide | ISOLAB | 075.01.006 / 075.02.005 | Was used in the preparation process for microscope studies. |
| D(+)-glucose monohydrate | Merck | 108342 | For use in making fungal media. |
| DFC450 with digital camera | Leica | Digital microscope camera with c-mount interface and with a 5 megapixel ccd sensor. | |
| Dm750 binocular microscope | Leica | MIC5246 | Was used for morphological identification of fungi. |
| DNA gel electrophoresis | thermo fisher scientific | B2-UVT | |
| Dna gel loading dye (6x) | Thermo Scientific | R0611 | For use in molecular diagnostics. |
| dNTP mix | Thermo Scientific | R0192 | Used in molecular studies. |
| Dreamtaq pcr master mixes (2x) | Thermo Scientific | K1082 | For use in molecular diagnostics. |
| Drigalski spatule | ISOLAB | 082.03.001 | It was used to scrape and spread fungal cultures grown in petri dishes. |
| Edta | Thermo Scientific | 17892 | For use in molecular diagnostics. |
| Ethanol | Merck | 100983 | Used in molecular studies and surface disinfection studies. |
| Ethidium bromide | Sigma-Aldrich | E7637 | Used to stain dna in gels during gel electrophoresis. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6758 | Used in molecular studies. |
| Filter paper | ISOLAB | 107.58.158 | Used in stock culture studies. |
| Forced air drying cabinet | ZHICHENG ZXDS-A-1090 | For use in incubation processes. | |
| Fume hood | Elektromag EM1201 | LB.EM.EM1201 | It was used to control harmful chemical vapors, gases and dust. |
| Gel imaging system | Syngene G:BOX Chemi XX6 | For use in molecular diagnostics. | |
| Generuler 50 bp dna ladder | Thermo Scientific | SM0372 | For use in molecular diagnostics. |
| Glacial acetic acid | Merck | 1005706 | Used in molecular studies. |
| Glycerol | Merck | 104094 | For use in stock culture of fungi. |
| Lancet | ISOLAB | 048.50.002 | Used to remove diseased tissue from plant samples. |
| Magnesium chloride | Sigma-Aldrich | 814733 | Used in molecular studies. |
| Measuring tape | ISOLAB | 016.07.500 | Used to measure liquid volumes. |
| Microcentrifuge tubes | ISOLAB | 0778.03.001 / 0778.03.002 / 0778.03.003 | Used to store different volumes of liquids. |
| PCR tube | ISOLAB | 123.01.002 | It was used to put dna mix in pcr studies. |
| Petri dishes | ISOLAB | 120.13.090 | For use in growing fungus culture. |
| Pipette tips | ISOLAB | 005.01.001 / 005.01.002 / 005.01.003 / 005.01.004 | To transfer liquid volumes used in analyses. |
| Plastic bag | ISOLAB | 039.30.005 | Was used to transport samples to the laboratory. |
| Plastic pot | ToXA | Was used for growing plants. | |
| Pliers, clamps | ISOLAB | 048.08.130 | It was used to put filter papers into envelopes after the fungus grew in the petri dish. |
| Porcelain mortar | ISOLAB | 038.02.150 | Was used to crush fungal mycelia. |
| Potato dextrose agar | Condalab | 1022 | For the identification and cultivation and of fungi. |
| Pure water system | human CORPORATION | LT.HC.NHP009 | Was used in solution preparation and analysis throughout the studies. |
| Refrigerator (+4 °C / -20 °C) | Vestel | For use in the storage of stock materials. | |
| Rifampicin | Sigma-Aldrich | 557303 | Was used as an antibiotic in studies. |
| Sodium acetate | Merck | 106268 | Used in molecular studies. |
| Sodium chloride | Merck | 1064041000 | Used in molecular studies. |
| Sodium dodecyl sulfate | Sigma-Aldrich | 436143 | Used in molecular studies. |
| Sodium hypochlorite solution | Merck | 105614 | Used for surface disinfection. |
| Spatula | ISOLAB | 047.33.210 | It was used to scrape the fungus culture growing in petri dishes. |
| Streptomyc?n sulfate | BioShop Canada | STP101 | To prevent contamination in fungal culture cultivation. |
| Teksoll extra pure | Tekkim | TK.200650 | For use as a disinfectant in all stages of work. |
| Tetrasiklin | Sigma-Aldrich | T3258 | Was used as an antibiotic in studies. |
| Thermal cycler PCR | Bio?Rad T100 | For use in genomic analyses. | |
| Thoma lam | ISOLAB | 075.03.002 | For use in spore counting. |
| Tris HCL | Roche | 10812846001 | Used in molecular studies. |
| Trizma | Sigma-Aldrich | T1503 | Used in molecular studies. |
| Tween 80 | Merck | 822187 | For use in spore solution in pathogenicity testing. |
| Vortex mixer vorteks | Velp WIZARD | LB.VLP.F202A0175 | Used to mix substances in liquid volumes. |
| Water baths | Memmert WNB 22 | 1018-5702 | It was used during incubation in dna extraction studies. |
Referências
- Skrzypkowski, W., Kiełkowska, A. Current status of haploidization in cool-season grain legume crop species. Agriculture. 14 (7), 1031 (2024).
- Liber, M., Duarte, I., Maia, A. T., Oliveira, H. R. The history of lentil (Lens culinaris subsp. culinaris) domestication and spread as revealed by genotyping-by-sequencing of wild and landrace accessions. Front Plant Sci. 12, 628439 (2021).
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data (2022)
- TÜİK. . Agricultural statistics report. , (2023).
- Baxevanos, D., et al. Lentil cultivar evaluation in diverse organic mediterranean environments. Agronomy. 14 (4), 790 (2024).
- Aydın, M., Koç, M., Sağır, A. Investigations on determination of soilborne fungal pathogens causing root rot, crown rot and wilt on lentil in Southeast Anatolia Region. Plant Protect Bulletin. 44 (1), 93-103 (2004).
- Zitnick-Anderson, K., et al. Fusarium species associated with root rot of lentil (Lens culinaris) in North Dakota. Plant Health Prog. 22 (4), 524-528 (2021).
- Kushwaha, D. A. . A research book of seed mycoflora of chickpea (Cicer arietinum). , (2020).
- Ekwomadu, T. I., Mwanza, M. Fusarium fungi pathogens, identification, adverse effects, disease management, and global food security: A review of the latest research. Agriculture. 13 (9), 1810 (2023).
- Jiskani, A. M., et al. A destructive disease of lentil: Fusarium wilt of lentil. Plant Arch. 21 (1), 2117-2127 (2021).
- Alisaac, E., Mahlein, A. K. Fusarium head blight on wheat: biology, modern detection and diagnosis and integrated disease management. Toxins. 15 (3), 192 (2023).
- Yang, F., et al. Effects of rhizosphere microbial communities on cucumber Fusarium wilt disease suppression. Microorganisms. 11 (6), 1576 (2023).
- Kumari, N., Katoch, S. Wilt and root rot complex of important pulse crops: their detection and integrated management. Management of Fungal Pathogens in Pulses. Fungal Biology. , (2020).
- Köppen, W., Geiger, R. . Handbuch der klimatologie. , (1936).
- Agrios, G. N. . Plant Pathology. , (2005).
- Endes, A. Occurrence and distribution of Chickpea root rot and wilt disease in Yozgat Kırşehir and Kırıkkale Provinces. Çukurova J Agri Food Sci. 38 (2), 284-298 (2023).
- Choi, Y. W., Hyde, K. D., Ho, W. H. Single spore isolation of fungi. Fungal Diversity. 3, 29-38 (1999).
- Baskarathevan, J., Jaspers, M. V., Jones, E. E., Ridgway, H. J. Evaluation of different storage methods for rapid and cost effective preservation of Botryosphaeria species. New Zealand Plant Protect. 62, 234-237 (2009).
- Dikilitaş, M., Katırcıoğlu, Z., Altınok, H. Latest developments and methods on long-term storage, protection, and recycle of fungi and fungal material. JAgric Fac HR U. 15 (1), 55-69 (2011).
- Bora, T., Karaca, &. #. 3. 0. 4. ;. . Measurement of disease and damage in cultivated plants. , (1970).
- Öğüt, E. . Pathogenic and molecular characterization of some Fusarium spp. causing root rot and wilt on lentil with determination of variety reactions in south eastern Anatolia. , (2015).
- Leslie, J. F., Summerell, B. A. . The Fusarium Laboratory manual. , (2006).
- Cenis, J. L. Rapid extraction of fungal DNA for PCR amplification. Nuc Acids Res. 20 (9), 2380 (1992).
- Aras, S., Endes, A. Effect of Fusarium oxysporum infection on strawberry under calcium, iron, and zinc deficiency conditions. Zemdirbyste-Agri. 110 (1), 71-78 (2023).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protoc A Guide Metho Appl. , 315-322 (1990).
- Endes, A. Characterization and pathogenicity of Botryosphaeriaceae species associated with Gummosis, Dieback, Trunk and Branch Cankers of almond trees in Türkiye. J Agri Sci. 30 (4), 698-711 (2024).
- Gordon, T. R., Okamoto, D., Jacobson, D. J. Colonization of muskmelon and non-susceptible crops by Fusarium oxysporum f. sp. melonis and other species of Fusarium. Phytopathology. 79 (10), 1095-1100 (1989).
- Xu, X., et al. Fusarium species associated with maize leaf blight in Heilongjiang Province, China. J Fungi. 8 (11), 1170 (2022).
- Fonseca-Guerra, I. R., Chiquillo-Pompeyo, J. C., Benavides Rozo, M. E., Díaz Ovalle, J. F. Fusarium spp. associated with Chenopodium quinoa crops in Colombia. Sci Rep. 12 (1), 20841 (2022).
- Khan, M. F., et al. First report of damping-off and seedling rot of Hemp (Cannabis sativa) caused by Fusarium solani in North Dakota, U.S.A. Plant Dis. 107 (1), 232 (2023).
- Chaudhary, R. G., Saxena, D. R., Dhar, V., Singh, R. K., Namdev, J. K. Prevalence of wilt-root rot and their associated pathogens at reproductive phase in lentil. Arch Phytopathol Plant Protect. 43 (10), 996-1000 (2010).
- Fleischmann, R. Some observations on Maize smut in Hungary. Pflanzenbau. 14 (5), 199-206 (1937).
- Bedasa, T. . Distribution and management of Fusarium wilt (Fusarium oxysporum f. sp. lentis) of lentil (Lens culinaris Medikus) in Central Highlands of Ethiopia. , (2018).
- Kumar, S., et al. Vascular wilt disease of lentil: A review. J Lentil Res. 4, 1-14 (2010).
- Chenari, S., Abbasi, S., Chehri, K. Phylogeny and host specificity of Fusarium solani species complex isolated from chickpea, lentil and common bean. Arch Phytopathol Plant Protect. , 1-15 (2024).
- Rathod, A., et al. Isolation of causal organism of wilt and collar rot of lentil and its pathogenicity tests. Int J Curr Microbiol Appl Sci. 10 (12), 276-282 (2021).
- Hayit, T., Endes, A., Hayit, F. The severity level classification of Fusarium wilt of chickpea by pre-trained deep learning models. J Plant Pathol. 106 (1), 93-105 (2024).
- Dean, R., et al. The Top 10 fungal pathogens in molecular plant pathology. Mol Plant Pathol. 13 (4), 414-430 (2012).
- Fletcher, J. D., Broadhurst, P. G., Bansal, R. K. F. avenaceum: A pathogen of lentil in New Zealand. New Zealand J Crop Horticultural Sci. 19 (2), 207-210 (1991).
- Al Ahmad, M., Mouselli, N. Wilt and root rot of lentis. Lens. 14 (1/2), 27-31 (1987).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados