Method Article
육상 기후에서 튀르키예에서 푸사리움 시들음병과 뿌리썩음병의 존재에 대한 렌즈콩 밭 스크리닝
요약
요즈갓(Yozgat) 지방에서 실시된 한 연구에서는 시들음병과 뿌리썩음병과 같은 곰팡이 질병과 같은 생물학적 요인이 렌틸콩 생산을 제한하는 것으로 나타났습니다. 푸사리움 분리물은 샘플의 95.4%에서 발견되었으며, 이는 지속 가능한 기술 개발 및 효과적인 제어 전략을 위한 주기적인 현지 조사와 정기적인 모니터링을 시사합니다.
초록
렌틸콩은 중요한 자가수분 콩과 식물 작물입니다. 그것의 생산은 다양한 생물 요인, 특히 시들음병과 뿌리 썩음 복합체를 일으키는 곰팡이 제제에 의해 제한됩니다. 이 연구는 토양 매개 Fusarium spp.에 대한 통제 전략을 개발하기 위해 식물 병원성 곰팡이 병원체의 지역 역학 및 병인을 이해하는 것을 목표로 했습니다. 이 연구는 2022년과 2023년 동안 일반적인 푸사리움 종에 의해 유발된 시들음병, 뿌리 및 크라운 썩음병에 대해 Yozgat 지방의 83개 렌틸콩 파종 지역을 조사했습니다. 증상이 있는 렌틸콩 식물은 진균 분리 및 식별을 위해 수집되었습니다. Fusarium isolates는 콜로니 형태에 따라 그룹화되고 PDA 배지에서 배양되었습니다. 또한, Fusarium isolates에서 얻은 게놈 DNA는 PCR을 사용하여 분석하고 NCBI GenBank에 등록된 다른 Fusarium isolates와 비교했습니다. Fusarium 분리물 간의 유전적 관계는 Mega 11 프로그램에서 MP(Maximum Parsimony) 방법을 사용하여 결정되었습니다. 그 결과, 요즈갓 주에서 시들음병과 뿌리썩음병의 평균 발병률과 질병 중증도율은 각각 16.9%와 38.6%로 확인되었다. 푸사리움 분리물은 샘플의 95.4%에서 발견되었습니다. F. oxysporum, F. culmorum, F. graminearum, F. acuminatum 및 F. solani isolates 사이에는 99.5%에서 100%의 뉴클레오티드 서열 균질성이 있었으며, 가장 고립된 종은 F. oxysporum이었다. Fusarium isolates의 MP dendrogram은 두 가지 주요 분기로 나뉘었으며 첫 번째 분기에는 모든 F. solani isolates가 포함되었습니다. 두 번째 주요 분기에는 본 연구와 NCBI GenBank에서 분리된 다른 Fusarium 종이 포함되었습니다. 이 연구는 렌틸콩의 억제를 위한 푸사리움 시들음병의 빈도를 결정하기 위해 주기적인 지역 조사를 제안한다. 푸사리움 기반 피해를 적시에 억제하는 것이 질병을 통제하고 렌틸콩 생산 시스템을 보존하기 위해 강력히 제안됩니다.
서문
렌틸콩(Lens culinaris Medik.)은 Fabaceae과에 속하는 작은 식용 곡물 콩과 식물로, 잎이 바늘 모양이고 흰색에서 옅은 자주색 또는 짙은 자주색 꽃을 피우는 서늘한 계절에 자가수분을 하는 작물입니다1. 약 10,000년 전 비옥한 초승달 지대의 메소포타미아 지역에서 인간에 의해 길들여졌으며 지중해 분지와 중앙 아시아를 포함한 신세계로 빠르게 퍼졌으며 나중에 아메리카 대륙에 귀화했습니다2. 세계 렌즈 콩 재배 면적은 약 550 만 헥타르이며 생산량은 660 만 톤입니다3. 튀르키예는 렌틸콩 생산에서 캐나다, 인도, 호주에 이어 4위를 차지했습니다. 튀르키예에서 렌틸콩 재배는 매우 중요하며 전 세계 생산량의 6.7%를 차지합니다. 튀르키예의 총 렌틸콩 생산량은 474,000톤이며 최소 40개 주에서 생산됩니다4. 튀르키예 렌틸콩 생산량의 약 89.5%는 적색 및 녹색 렌틸콩을 구성하며, 이는 아나톨리아 남동부 지역의 겨울 작물의 10.5%를 차지합니다. 나머지 작물은 여름 작물로 재배합니다. 요즈가트(Yozgat, 39.5%), 콘야(Konya, 23.7%), 크르셰히르(Kırşehir, 16.3%), 초룸(Çorum, 7.6%), 앙카라(Ankara, 2.9%) 주가 녹색 렌틸콩 생산에 크게 기여하고 있다4. 렌틸콩 생산은 생물적 및 비생물적 스트레스 요인에 의해 제한될 수 있습니다. 서리와 가뭄은 여름 녹색 렌틸콩 생산에서 가장 흔한 비생물적 스트레스 요인입니다5. Ascochyta lentis, Rhizoctonia solani, R. bataticola, Aphanomyces euteiche, Pythium 및 Fusarium 종에 의해 발생하는 시들음병, 뿌리썩음병 복합체와 같은 곰팡이 질병은 가장 중요한 곰팡이 질병으로, 감염 시기, 숙주 감수성 및 기상 조건에 따라 댐핑 오프, 묘목 마름병, 시들음병 및 뿌리 썩음병을 포함한 질병의 조합을 유발합니다 6,7, 8.
푸사리움(Fusarium)은 토양, 식물 및 유기 기질에서 발견되는 필라멘트 불완전한 곰팡이이며 이러한 병원체 중 세계적인 속입니다9. 그것은 Fusarium 시들음병, 뿌리 고리 썩음병과 같은 다양한 질병을 일으키며, 밀의 Fusarium 머리 마름병, 박과박과의 Fusarium 시들음병, 렌즈 콩 10,11,12를 포함한 대부분의 콩과 식물에서 뿌리 썩음병을 유발합니다. Fusarium spp.에 의해 유발되는 혈관 시들음병, 뿌리 및 뿌리 쇄골 부패병은 전 세계적으로 많은 렌틸콩 재배 지역에서 렌틸콩의 가장 중요한 질병이다10. Fusarium oxysporum은 렌틸콩의 시들음병, 뿌리 및 뿌리 칼라 썩음병과 관련된 가장 흔한 Fusarium 종입니다. 전 세계적으로 렌틸콩 재배 지역에서 F. graminearum, F. sporotrichioides, F. equity, F. acuminatum, F. redolent, F. avenaceum, F. culmorum, F. solani, F. verticillioides에 의해 시들음병, 뿌리병, 크라운썩음병이 발생한다7. Fusarium spp.에 의해 발생하는 시들음병, 뿌리썩음병, 크라운썩음병은 묘목과 성충 단계 모두에서 발생하며 잎의 갑작스러운 시들음, 건조 및 결국 죽음을 유발합니다. 이 질병의 증상으로는 종자 썩음병, 뿌리 썩음병, 위쪽 잎 시들음, 발육 부진, 수축 및 잎 말리기가 있습니다. 꼬투리를 채우는 중기 및 후기 단계에서는 일반적으로 씨앗이 줄어들고 뿌리 증상으로는 성장 저해, 갈색 변색, 원뿌리 끝 손상, 2차 뿌리 증식 등이 있습니다. 모든 사례에서 혈관 조직의 변색이 나타나는 것은 아니다13.
중부 아나톨리아 지역에서는 렌틸콩의 시들음병과 뿌리썩음병 상태에 대한 연구가 제한된 수로 수행되었습니다. Yozgat은 여름에 비해 겨울에 강우량이 풍부한 온화하고 온화한 기후를 가지고 있으며 Köppen과 Geiger14에 의해 Dsb (따뜻하고 습한 육상 기후)로 분류됩니다. 평균 기온은 9.6 °C이며 평균 강수량은 512 mm입니다. Yozgat는 북반구에 위치하고 있습니다. 여름은 6월, 7월, 8월, 9월입니다. 질병을 통제하기 위해 토양 매개 Fusarium spp.에 대한 다양한 방제 전략을 개발하기 위해 질병을 유발하는 식물 병원성 곰팡이 병원체의 지역 역학 및 병인에 대한 정보를 얻는 것이 매우 중요합니다15. 이러한 맥락에서 본 연구의 목적은 전체 녹색 렌틸콩 생산의 약 40%가 병원성 푸사리움(Fusarium )인 요즈갓(Yozgat) 지방에서 조사를 수행하여 렌틸콩의 시들음병, 뿌리병, 크라운썩음병의 질병 매개변수(질병 유병률, 발병률 및 중증도)를 결정하고 식별하는 것입니다 렌틸콩에서 시들음병과 뿌리썩음병을 유발하는 종은 형태학적 및 분자 분석을 통해 발생하며, 병원성 테스트를 수행하여 Fusarium 종의 개별 독성 수준을 결정합니다.
프로토콜
참고: 연구에 사용된 시약 및 장비의 세부 정보는 재료 표에 나열되어 있습니다.
1. 현장 조사, 샘플링 및 곰팡이 격리
참고: Endes16에 따르면 조사 작업은 2022년과 2023년에 수행되었습니다. 요즈갓(Yozgat) 주의 9개 지역을 포괄하는 총 83개의 렌틸콩 재배 지역에서 시들음병, 뿌리썩음병(root collar rot disease)이 관찰되었다(그림 1).
- 1000m2 이상의 면적을 샘플링 영역으로 선택한 렌틸콩 밭을 선택합니다. 1m2 프레임을 사용하여 대각선을 따라 지그재그로 걸어 경계에서 필드의 중앙 또는 중앙까지 무작위로 걸어 각 샘플을 수집하고 무작위로 선택된 최소 3 개의 다른 지점에 무작위로 배치합니다. 각 지점에서 질병 증상을 보이는 렌틸콩 식물을 수집하여 종이 봉지에 넣고 곰팡이 분리 및 식별 연구에 사용하기 위해 실험실로 옮깁니다.
참고: 실험실로 옮겨진 병든 렌즈콩 식물의 뿌리와 뿌리 고리는 먼저 거친 잔류물을 제거하기 위해 수돗물로 씻었습니다. 나중에, 그들은 Endes16에 의해 설명 된대로 곰팡이 병원체의 격리를 위해 표면 소독을 받았다. - 병든 식물 조직을 70% 에탄올에 10-15초 동안 담근 다음 멸균수에서 각각 3분 동안 3번 헹굽니다. 1% 차아염소산나트륨(NaOCl)에 모두 5분 동안 담갔다가 멸균수로 다시 3분씩 5분씩 헹굽니다.
- 멸균 캐비닛의 여과지에 젖은 식물 조직을 건조시켜 표면 소독 과정을 마칩니다. 그런 다음 소독된 식물 조직을 5-10mm 길이의 조각으로 자르고 페트리 접시(직경 90mm) 내에 0.01% 스트렙토마이신이 포함된 PDA 배지에 4-5개를 놓습니다. 페트리 접시를 25 ± 1 °C의 어두운 곳에서 4-7 일 동안 인큐베이터에 넣고 곰팡이 성장을 관찰하십시오.
참고: 발달 중인 곰팡이 분리물은 단일 포자 분리 방법을 통해 정제되었습니다. 이를 위해, Ascomycetes, Basidiomycetes, Coelomycetes, Hyphomycetes에 속하는 진균의 단일 포자 배양액을 수득하는 것에 대해 Choi et al.17 에 의해 수행된 연구를 아래와 같이 수정하여 사용하였다. - 진균 분리물을 정제하려면 분리 연구가 끝날 때 얻은 진균 분리물을 인큐베이터에서 25 ± 1°C에서 12시간 동안 형광등/12시간 암흑에서 15일 동안 보관하여 PDA에서 아나모픽 생식 구조의 형성을 촉진합니다.
- 주걱으로 15일 된 배양액에서 약 100mg의 곰팡이 균사체의 무게를 측정하고 1.5mL 멸균 마이크로 원심분리기 튜브에 옮긴 다음 균질화를 위해 멸균 플라스틱 절굿공이로 철저히 분쇄합니다.
- 멸균수 1mL를 넣고 포자가 물로 이동하도록 1분 동안 와류를 넣습니다. 물로 이동하는 포자의 수를 조정하려면 이 혼합물을 피펫으로 20μL를 추출하고 광학 현미경의 10배 배율에서 포자 수를 확인합니다.
- 포자의 양이 원하는 양보다 많을 때 포자-물 혼합물을 1/10, 1/100, 1/1000과 같은 비율로 희석합니다. 현미경 시야에 4-6개의 포자를 포함하는 혼합물을 제공합니다.
- 준비된 포자 현탁액 100μL를 0.1% 스트렙토마이신이 보충된 PDA 배지가 포함된 90mm 직경의 페트리 접시로 옮깁니다. 그런 다음 Drigalski 주걱으로 PDA에 전달된 현탁액을 펴 바릅니다.
- 준비된 페트리 접시를 25 ± 1 ° C의 어둠 속에서 12-24 시간 동안 배양합니다. 이 기간이 끝나면 접종 루프가 있는 단일 분생포자에서 발달한 작은 균사 조각을 PDA 배지를 포함하는 새로운 페트리 접시로 옮깁니다. 각 포자에서 얻은 각 배양물은 단일 포자 배양물입니다. 병원성 테스트와 형태학 및 분자 식별에 사용하기 위해 보관하십시오.
참고: 주요 목적은 곰팡이 분리체의 형태, 유전학 및 독성을 변경하지 않고 오랫동안 살아 있게 유지하는 것입니다. 저장 과정은 두 가지 다른 방법을 사용하여 수행되었습니다18,19. 이 연구에서 사용된 모든 저장 방법은 아래에 자세히 설명되어 있습니다.- 샘플을 저장하는 첫 번째 방법은 다음과 같습니다. 12:12 시간 어둠과 함께 25 ± 1 ° C에서 PDA 배지에서 곰팡이 분리 물을 성장시킵니다 : 15 일 동안 밝게 하여 멸균 수에 저장할 수있는 4mm 직경의 균사체 디스크를 얻습니다.
- 앞서 언급한 조건에서 자란 곰팡이 배양에서 코르크 천공으로 균사체 디스크(직경 4mm, 디스크 10개)를 자릅니다. 균사체 디스크를 1mL의 멸균수가 들어 있는 미세 원심분리 튜브로 옮깁니다. 샘플을 마이크로 원심분리기 튜브에 담아 -20°C의 냉장고에 6개월 동안 보관합니다.
- 샘플을 저장하는 두 번째 방법은 다음과 같습니다. 먼저 접종 루프로 얻은 단일 포자 배양액에서 순수한 곰팡이 디스크를 한 꼬집어 클로람페니콜, 젖산, 암피실린, 리팜피신, 테트라사이클린, 스트렙토마이신 등이 보충된 PDA가 함유된 페트리 접시에 옮깁니다.
- 보관 과정 전에 5-10일 동안 25 ± 1 °C에서 12 h: 12 h 어둡습니다: 밝은 조건으로 성장합니다. 121°C, 15psi의 오토클레이브에서 60분 동안 1cm x 1cm 범용 여과지를 자르고 살균합니다.
- 여과지를 동일하거나 선택적인 매체를 가진 새 페트리 접시에 놓습니다. 순수한 곰팡이 배양에서 군체/포자를 잘라내어 각 조각의 맨 위에 놓습니다.
- 페트리 접시를 밀봉하고 적절한 성장 조건(위에서 언급한 대로)의 인큐베이터에 넣습니다. 곰팡이 분리물은 여과지에서 천천히 자랍니다. 완전한 집락화를 보장하기 위해 약 15일 동안 배양하십시오.
- 여과지에 포자 형성 또는 완전한 집락 형성 후, 개별 종이 조각을 배양 배지가 없는 새 페트리 접시로 옮깁니다. 나중에 여과지와 곰팡이가 완전히 건조 될 때까지 (약 20-30 일) 페트리 접시를 인큐베이터에 넣으십시오.
- 건조 후 각 멸균 종이 봉투에 여과지 10장을 넣고 각 봉투에 라벨을 붙이고 이 봉투를 비닐 봉지에 넣고 봉투가 들어 있는 비닐 봉지를 -20°C의 플라스틱 투명 용기에 보관하십시오.
- 아래 주어진 공식에 따라 Yozgat에서 렌즈 콩 시들음병, 뿌리 및 크라운 썩음 병의 유병률을 계산하고 각 렌즈 콩 밭의 질병 유병률을 고려한 다음 지방의 지역 이름을 계산합니다.
질병 유병률 (%) = (a / b) x 100
여기서 a는 병에 걸린 필드의 수를 나타냅니다. B는 한 구역에서 조사된 필드의 총 수를 나타냅니다. - Bora 및 Karaca20에서 보고한 가중 평균 방법에 따라 질병의 발병률을 계산합니다. 밭의 각 칸에 있는 식물을 세십시오. 각 사각형에서 병에 걸린 식물과 병에 걸리지 않은 식물로 분리하고 아래 주어진 공식에 따라 질병 유병률을 계산합니다.
질병 유병률 (%) = (x / y) x 100
여기서 x는 병에 걸린 식물의 수를 나타냅니다. y는 조사된 총 식물 수를 나타냅니다. - Öğüt21의 척도 0-4에 따라 질병 중증도를 계산하며, 여기서 0 = 증상이 없음, 1 = 잎의 25%에서 경미한 수준의 증상이 나타납니다. 2 = 잎의 26%-50%에서 중간 수준의 증상; 3 = 잎의 51 % -75 %에서 심한 백화증 및 시들음; 4 = 매우 심한 백화증 및 시들음 증상 또는 동일한 순서로 75% 이상의 식물에서 건조, 탈락, 성장 지연 또는 죽은 잎(그림 2).
- 얻어진 척도 값16과 함께 다음 공식을 사용하여 질병 중증도를 계산합니다.
질병 중증도(%) = [∑ [ i (ni x vi) / (V) x N)] x 100
여기서 ni 스케일 값에서의 식물 수; vi 스케일 값; V 가장 높은 스케일 값; N개의 관찰된 총 식물 수; i는 클래스 수를 나타냅니다.
2. 기상 데이터
- 설문 조사를 수행합니다. 이 프로토콜의 경우 2022년 5월과 6월, 2023년 기간 동안 설문조사가 수행되었습니다. 2022년, 2023년 및 장기 연도의 3월-7월 기간의 온도, 상대 습도 및 총 강우량 값을 Yozgat의 지방 기상청에서 가져옵니다(표 1).
3. 형태학적 식별
- Fusarium isolates의 문화적(군체 색상, 공중 균사체, 균사체 성장률) 및 원추형(원뿔 치수, 모양, 색상 및 중격 수) 특성을 이전 연구의 특성과 비교하고 곰팡이 종을 잠정적으로 식별합니다.
- 그룹에서 형태학적 식별에 사용할 대표 샘플을 선택합니다. 위에서 언급한 단일 포자 분리 방법에 따라 이러한 샘플을 정제합니다. 이 기간 동안 Fusarium isolates의 집락 색소 특성과 미시/거대 분생포자 및 클라미도포자 구조를 관찰합니다.
- 얻어진 순수한 진균 배양물에서 미시/대분생포자 및 클라미도스포어와 같은 미세형태학적 구조의 형성을 촉진하기 위해 인큐베이터에서 25-30일 동안 25± 1°C 및 12시간: 12시간 어둡음에서 PDA를 배양합니다. 광학 현미경으로 각 Fusarium isolate에 대한 분생포자의 길이와 너비를 측정합니다. 또한 디지털 카메라와 함께 제공된 광학 현미경을 사용하여 분생포자(conidia)의 구조, 모양, 색상 및 격막 또는 격막 없이 문서화합니다.
- 위의 관찰을 바탕으로, Leslie and Suerell22에 기술된 바와 같이 Fusarium isolates를 종 수준에 따라 그룹화합니다.
4. 분자 식별
참고: Fusarium isolates의 총 게놈 DNA는 Cenis23의 프로토콜에서 약간 수정된 다음 방법을 사용하여 추출되었습니다. Fusarium 분리물의 PCR 분석 및 전기영동은 Aras 및 Endes24에 의해 기술된 프로토콜을 사용하여 수행되었습니다.
- 곰팡이 게놈 DNA 추출
- PDA에서 배양한 Fusarium isolates의 신선한 배양액(10일)에서 멸균 메스로 100mg의 균사체를 긁어낸 다음 2mL 마이크로 원심분리 튜브로 옮깁니다. 튜브를 -20°C에서 밤새 배양합니다.
- 하룻밤 배양 후 500μL의 DNA 추출 완충액(200mM Tris-HCl pH: 8.5, 250mM NaCl, 25mM EDTA, 0.5% 도데실황산나트륨)을 튜브에 넣고 멸균 플라스틱 절굿공이로 분쇄합니다.
- 그 후, 150μL의 3M 아세트산나트륨(NaOAc) pH 5.2를 튜브에 첨가하고 -20°C에서 30분 동안 배양합니다. 이 단계가 끝나면 4,000 x g 에서 10분 동안 튜브를 원심분리합니다.
- 원심분리 후 튜브 상단에 있는 상등액 400μL를 새 튜브(1.5mL)로 옮기고 동일한 부피의 이소프로판올(2-프로판올)을 추가합니다. 새 튜브를 -20°C에서 30분 동안 배양합니다. 이 시간 동안 튜브를 5x 또는 6x 부드럽게 섞습니다.
- 4,000 x g 에서 10분 동안 원심분리기를 사용하여 게놈 DNA를 침전시키고 튜브에 남아 있는 모든 액체를 버립니다.
- 70% 에탄올 1mL를 튜브 바닥에 흰색 또는 크림색 침전물로 게놈 DNA 펠릿에 추가합니다. 튜브를 약 4분 동안 5x-1x 위아래로 부드럽게 혼합하여 튜브의 모든 에탄올을 버립니다. 그런 다음 층류 공기 흐름에서 튜브를 30분 동안 열어 DNA 펠릿의 에탄올을 완전히 증발시킵니다.
- 게놈 DNA를 용해하여 장기간 보관하려면 튜브에 50μL의 TE(1M Tris-HCl pH: 8.0, 0.5M EDTA pH 8.0) 완충 용액을 추가하고 65°C의 수조에서 1시간 동안 튜브를 배양합니다. 이 시간 동안 튜브를 8x-10x 위아래로 부드럽게 섞습니다. TE 완충 용액에 용해된 게놈 DNA를 분자 연구에 사용하기 위해 -20°C 급속 냉동고에 보관합니다.
- PCR 연구의 경우 올리고뉴클레오티드 프라이머 ITS5 F(5'GGAAGTAAAGTCGTAACAAGG3') / ITS4 R(5'TCCTCCGCTTATTGATATGC3')을 사용하여 rDNA25의 ITS 영역을 증폭합니다. 2.5 μL의 10x PCR 완충액, 2.5 μL의 MgCl2 (25 mM), 2.5 μL의 dNTP (2 mM), 0.5 μL의 각 프라이머(10 μM), 2 μL의 템플릿 DNA, 0.5 μL의 Taq DNA 중합효소(1 U/μL, Fermantas) 및 14 μL의 sQH2O를 총 25 μL의 부피로 각 PCR 반응을 수행합니다.
- 25μL PCR 반응의 경우 다음 PCR 프로그램을 95°C에서 2분(초기 변성) 동안 실행한 다음 40사이클을 실행합니다. 30초(변성) 동안 95°C, 45초(어닐링) 동안 55°C, 90초(연장) 동안 72°C, 5분(최종 연장) 동안 72°C. 1x TAE (Tris Base - Glacial Acetic Acid - EDTA) 완충 용액에서 준비된 1.5% 아가로스 겔에서 90V에서 1.5시간 동안 전기영동 PCR 제품.
- 겔 전기영동을 위한 TAE 완충액을 준비하려면 242g의 Tris 염기를 700mL의 멸균수에 용해시킵니다. 57.1 mL의 빙초산을 첨가하십시오. 100mL의 0.5M EDTA 용액을 넣고 멸균수를 첨가하여 부피를 1L로 조정합니다. 1L 50x TAE 완충액의 최종 pH를 8.5로 조정합니다. 1x TAE 완충액이 작동하도록 하려면 50x TAE 완충액 1부에 멸균수 49부를 추가합니다.
- 0.5 μg/mL 에티듐 브로마이드로 겔을 염색하고 UV transilluminator에서 볼 수 있도록 하여 육안으로 검사합니다.
- 뿌리와 크라운 썩음병 제제 분리물 사이의 계통발생학적 관계를 조사하기 위해, 공급업체를 통해 양방향(5'-3' 및 3'-5')으로 합성된 PCR에 의한 ITS 유전자 염기서열을 얻습니다. Blast 프로그램을 사용하여 NCBI(National Center of Biotechnology Information) 웹사이트의 유전자 데이터 및 전 세계 다른 Fusarium isolates의 ITS 유전자 염기서열과 염기서열을 비교합니다. 이를 사용하여 아래에 설명된 대로 종 수준에서 분리물을 식별합니다.
- https://www.ncbi.nlm.nih.gov 웹사이트로 이동합니다. 인기 리소스 섹션에서 BLAST 탭을 클릭합니다.
- 새 창에서 Nucleotide BLAST 탭을 클릭합니다. 새 창의 Enter Query Sequence(쿼리 시퀀스 입력) 섹션에서 기본 시퀀스를 Fasta 형식으로 입력하고 Job Title(작업 제목) 섹션에 스터디 이름을 씁니다.
- 그런 다음 하단의 Choose Search Set(검색 세트 선택) 섹션의 Database 탭에서 Standard databases (nr etc.) 를 선택합니다.
- 프로그램 선택 섹션의 최적화 탭에서 매우 유사한 시퀀스(메가블라스트) 를 선택하고 페이지 하단의 BLAST 탭을 클릭합니다.
- MEGA 11 계통발생학적 분석 프로그램을 사용하여 분리푸사리움 사이의 계통발생학적 관계를 결정하십시오. ClustalW 프로그램을 사용하여 염기서열을 정렬하고 ITS 유전자26에 대한 최대 간결성에 따라 분리체의 유전적 가계도를 생성합니다.
- Mega 소프트웨어를 다운로드하려면 https://www.megasoftware.net 웹 사이트로 이동하여 Mega 소프트웨어를 설치하십시오. MEGA 소프트웨어는 연구 및 교육에 사용할 수 있도록 무료로 제공됩니다.
- 먼저 시퀀스를 바탕 화면에 FASTA 형식의 메모장 파일(.txt)로 저장합니다. Mega 소프트웨어 프로그램을 실행하고 ALIGN 탭을 클릭합니다. 창에서 Edit/Build Alignment 를 클릭합니다. 그런 다음 새 창에서 새 정렬 만들기를 선택하고 확인을 클릭하여 확인합니다.
- DNA 탭을 클릭합니다. 삭제 1. 창에 자동으로 나타나는 시퀀스를 선택하고 파일 편집으로 이동한 다음 파일에서 시퀀스 삽입 탭을 클릭합니다. 시퀀스가 포함되어 있고 바탕 화면에 있는 메모장(.txt) 파일을 엽니다.
- 이 단계에서 모든 시퀀스가 화면에 나타납니다. 먼저 화면에 나타나는 시퀀스 를 클릭 한 다음 CTRL + A로 모든 시퀀스를 표시합니다. 정렬 파일을 열고 거기에서 Clustal W로 정렬 을 클릭하고 확인을 클릭하여 기본 설정으로 프로그램을 실행합니다.
- 염기서열 정렬의 차이를 검토한 후 데이터 파일로 이동하여 계통발생 분석을 클릭한 다음 염기서열이 단백질을 합성하는지 여부에 대한 창의 확인란에서 아니오 를 클릭합니다. 우리의 염기서열은 단백질이 ITS 영역에 속하기 때문에 단백질을 합성하지 않습니다.
- Mega 소프트웨어의 기본 창으로 돌아갑니다. 계통발생(Phylogeny )을 클릭하고 최대 간결성 트리(Construct/Test Maximum Parsimony Tree(s))를 선택합니다. 새 창에서 계통 발생 테스트에 대해 Bootstrap Method 를 선택하고 Branch 강도를 테스트하기 위해 bootstrap 값 1,000을 입력합니다. Gaps/missing Data Treatment 탭에서 Partial Deletion을 선택하고 MP 검색 방법으로 SPR(Subtree-pruning-Regrafting) 을 선택한 다음 OK 를 클릭하여 작업을 확인합니다.
- 분석 결과에 계통 발생 나무가 표시될 때까지 기다립니다.
5. 병원성 시험
- 분자 방법으로 확인된 Fusarium 종의 각 대표 종에 대한 병원성 연구를 위해 4개의 분리물을 사용합니다. 에어컨이 설치된 실내에서 24°C, 형광등 16시간/어두운 광주기 8시간, 습도 65%에서 병원성 연구를 수행합니다.
- 렌즈 콩 씨앗을 직경 5cm의 45 개의 구멍이있는 검은 색 플라스틱 유리병에 파종합니다. 각 바이알을 1% 차아염소산나트륨에 3분 동안 보관한 다음 멸균 증류수 3회로 헹굽니다. 멸균 캐비닛에서 씨앗을 24 시간 동안 말리고 각 구멍에 하나의 씨앗을 파종합니다.
참고: 이 질병에 민감한 Kayı 91 품종의 렌즈콩 씨앗은 모든 병원성 검사에 사용되었다6. 접종 방법으로는 묘목 침지 기법이 사용되었다27. - PDA에서 각 분리물의 순수 배양물을 24 ° C에서 7-10 일 동안 배양합니다. 원료 배양에서 배양된 군체를 배지 표면에서 주걱으로 긁어내고 멸균 증류수를 사용하여 포자/균사체 현탁액을 준비합니다.
- 4층 무명천을 통한 여과로 현탁액에서 큰 잔류물을 제거하고 혈구계를 사용하여 포자/균사체 농도를 1 x 106 spores/mL로 조정합니다.
- 이 단계가 끝나면 바이알에서 이전에 자란 묘목의 뿌리가 2-3개의 진정한 잎이 있을 때 뿌리를 뽑습니다. 수돗물로 씻고 멸균 바늘로 뿌리를 약간 다치게하십시오. 이 묘목을 준비된 포자/균사체 현탁액에 3분 동안 담근 다음 멸균 토양/이탄(2:1, v/v) 혼합물이 들어 있는 플라스틱 바이알에 이식합니다.
- 방제로 사용되는 묘목의 경우 뿌리를 뽑고 상처를 입힌 다음 멸균 물에만 담가 심습니다. 접종 3주 후 0-4 척도에 따라 병원성 검사 평가를 실시합니다.
- 계산된 질병 중증도 값을 각도 변환을 거친 후 얻은 값을 분산 분석을 수행하고 Tukey의 HSD(p = 0.05) 검정에 따라 평균 간의 차이를 평가합니다. 질병 중증도: 0%-15%의 분리물은 매우 낮은 병독성(LV)으로 평가되었고, 16%-35%의 분리물은 낮은 독성(LV)으로 평가되었으며, 36%-50%의 분리물은 중등도의 독성(O)으로 평가되었으며, 51%-70%의 분리물은 높은 독성(VV)으로 평가되었으며, 71%-100%의 분리물은 매우 높은 독성(VV)으로 평가되었으며, 질병 증상이 없는 분리물은 부생식물 또는 착생식물 분리물로 평가되었습니다.
결과
질병 매개변수의 결정
Yozgat의 9개 지역을 포함하는 총 83개의 렌즈콩 파종 지역을 1.1984 x 106m2의 면적에 걸쳐 시들음병, 뿌리 및 크라운 썩음병 증상 측면에서 평가했습니다(표 2). 시들음병 또는 뿌리썩음병 증상은 모든 밭에서 나타났습니다. 그러나 요즈갓의 시들음병과 뿌리썩음병 발병률은 16.9%로 나타났으며, 소르군과 사르카야 지역에서는 38.6%의 중증도를 보였다. 이 질병의 상당한 발병률은 Şefaatli(26.4%), Boğazlayan(23.0%), Sorgun(20.1%) 지역에서도 확인되었다. 역설적이게도, 질병 중증도가 가장 높은 지역은 소르군 지역이 45.2%였고, 보다즐라얀이 36.0%, 사르카야가 35.4%로 그 뒤를 이었다. 또한, 679개의 식물이 조사된 표시된 지역의 렌틸콩 밭에서 채취한 샘플에서 질병 증상을 보였다(표 3). 그 다음에는 두 그룹에 분포된 분리된 곰팡이 제제의 형태학적 식별이 이어졌습니다. 첫 번째 그룹으로 분류된 Fusarium 분리물에는 Alternaria sp, Ascochyta sp. 및 Rhizoctonia sp.와 같은 병원체 또는 부생식물이 포함되었습니다. Fusarium isolates의 분리율 비율은 95.4%였습니다. F. oxysporum은 요즈가트에서 질병 증상을 보이는 렌즈콩 식물에서 가장 격리된 곰팡이 종으로 결정되었으며, 격리율은 59.5%였습니다. 이 병원성 Fusarium 종은 F. graminearum (15.8 %)과 F. culmorum (10.2 %)이 뒤를 이었습니다. 역설적이게도, F. solani(4.4%)와 F. acuminatum(5.5%)은 질병 증상을 보이는 식물로부터 더 낮은 수준으로 분리되었습니다. F. oxysporum은 조사 연구가 수행된 모든 지역에서 얻었으며, 지역에 따른 격리율 비율은 45.3%에서 72.2% 사이로 분포되었습니다. F. oxysporum은 Yozgat의 Central (72.2%), Şefaatli (71.9%), Akdağmadeni (68.3%), Sorgun (62.2%) 지역에서 가장 많이 격리되었습니다. 대조적으로, F. solani와 F. acuminatum은 Yozgat에서 가장 덜 고립된 Fusarium 종이었습니다. F. solani는 Çekerek 및 Central 지역에서 격리되지 않았습니다. F. acuminatum은 또한 Akdağmadeni, Central 및 Şefaatli 지역에서도 분리되지 않았습니다(표 3).
형태학적 식별
Fusarium isolates의 순수 배양은 군체 특성과 micro-conidia, macro-conidia 및 chlamydospore 구조에 따라 형태학적으로 확인되었습니다. 동정 연구는 종 수준에서 수행되었다고 Leslie와 Summerell22에 따르면. 렌틸콩에서 시들음병, 뿌리 및 뿌리 칼라 썩음 증상을 보이는 식물에서 얻은 모든 곰팡이 분리물은 군집 및 미세 형태에 따라 6개 그룹으로 수집되었습니다(표 3). 처음 5개 그룹에는 Fusarium 종에 속하는 분리물이 포함되었지만 다른 그룹에는 Alternaria, Rhizoctonia 및 Ascochyta와 같은 Fusarium 속 이외의 병원성 곰팡이 분리물이 포함되었습니다.
분리율이 가장 높은 F. oxysporum 분리물은 흰색에서 노란색 군체와 라일락-보라색 색소를 가지고 있습니다. 대원뿔은 길이가 짧거나 중간 길이이며 약간 구부러져 있으며 일반적으로 3-5개의 격막이 있습니다. 일부 분리물의 포자 구조는 33.8-71.5 μm x 3.1-4.5 μm로 결정된 거대 분생포 치수와 약간 연결되어 있습니다. Microconidia는 일반적으로 비격형, 타원형, 타원형 또는 신장 모양입니다. 클라미도스포어(Chlamydospore) 형성은 서서히(4-6주) 일어났습니다. 이는 이중 군집과 짧은 사슬 구조16에서 관찰되었다.
분리율이 가장 높은 두 번째 종인 F. graminearum isolates는 흰색-분홍색 공중 균사체와 짙은 빨간색 색소 침착을 가지고 있습니다. Macroconidia는 얇거나 직선 또는 약간 구부러져 있으며 5-7 개의 격막이 있습니다. 격막은 매우 뚜렷합니다. 그것은 뾰족한 정점 세포와 뚜렷한 발 모양의 기저 세포를 가지고 있습니다. 치수는 25.7 - 97.3 μm x 3.5 - 5.5 μm입니다. 미세분생자(Microconidia)와 클라미도스포어(chlamydospore) 형성은 관찰되지 않았다28.
세 번째 그룹에서 분리된 F. culmorum 군체는 처음에는 흰색이었지만 나이가 들면서 밝은 분홍색에서 짙은 분홍색 균사체 구조가 관찰되었습니다. Macroconidia는 짧고 4-6 격막이며 약간 구부러져 있습니다. 매크로스포자 치수; 15.8 - 60.0 μm x 3.2 - 5.1 μm. 그들은 많습니다. 미세 포자는 관찰되지 않았습니다. 클라미도스포어의 형성은 다른 종에 비해 빠릅니다(3-5주). 그들은 단독으로 또는 두 개의 클러스터로 발견됩니다29.
네 번째 종인 F. acuminatum isolates의 군체는 옅은 주황색, 주황색 및 밝은 부르고뉴입니다. 비교적 느리게 자라는 종입니다. 그것의 macroconidia는 얇고 뚜렷한 곡률을 가지며 3-5 개의 격막 구조를 가지고 있습니다. 거대 분생자 치수는 31.0-65.5 × 4.3-6.6 μm로 결정되었습니다. Microconidia에는 0과 1 격막이 있습니다. 현미경 이미지에서는 거의 관찰되지 않았습니다. 클라미도스포어의 형성은 매우 느립니다(6주 이상). 그것은 사슬과 군집을 형성한다22.
마지막으로 확인된 병원성 종인 F. solani isolate의 군집 색상은 흰색과 크림색입니다. 그것의 대원뿔은 넓고 평평하며 약간 구부러져 있습니다. 균사는 3-7 개의 중격이며 풍부합니다. 매크로스포자 치수는 20.2 - 50.6 μm x 3.1 - 6.2 μm로 결정됩니다. 마이크로코니디아는 분할되지 않거나 1로 분할됩니다. 그들은 구조가 타원형과 타원형입니다. 클라미도스포자는 2-4주 이내에 CLA 배지의 짧은 사슬에서 말단으로 발견됩니다30.
분자 식별
PCR은 Fusarium isolates에서 얻은 총 게놈 DNA와 함께 ITS4/ITS5 프라이머를 사용하여 수행되었습니다. 양방향(5'-3' 및 3'-5') 염기서열을 등록하고 Blast 프로그램을 사용하여 다른 NCBI GenBank와 비교했습니다(표 4 및 표 5). F. oxysporum isolates는 인도(MT740398), 리투아니아(KF646094) 및 독일(MT453296)에서 분리된 물과 99.5%에서 100%의 뉴클레오티드 서열 균질성을 보여주었습니다. F. culmorum isolates는 캐나다(AY147290), 프랑스(OW983123) 및 체코(MT453296)에서 분리된 물과 100% 뉴클레오티드 서열 균질성을 보여주었습니다. F. graminearum isolates는 Columbia(MT598163) 및 중국(ON527490)에서 분리된 물과 99.5%에서 100%의 뉴클레오티드 서열 균질성을 보여주었습니다. F. acuminatum isolates는 우즈베키스탄(OR975902) 및 중국(MZ424810, PP336554)에서 분리된 물과 99.5%에서 100%의 뉴클레오티드 서열 균질성을 보여주었습니다. F. solani isolates는 이집트(OR713084), 중국(PQ482231) 및 인도(OP848138)에서 분리된 물과 100% 뉴클레오티드 서열 균질성을 보여주었습니다. 그런 다음, Fusarium isolates 사이의 유전적 관계는 Mega 11 프로그램을 사용하여 MP(Maximum Parsimony) 방법에 따라 얻은 계통발생 나무에 의해 결정되었습니다(그림 3). MP 계통발생 트리에서는 갭을 포함하여 638개의 뉴클레오티드 문자가 사용되었으며, 이러한 뉴클레오티드 중 145개는 간결성 제공 정보 영역으로 결정되었습니다. MP 분석은 가장 간결한 트리 중 하나를 산출했습니다(그림 3; 나무 길이 : 172; 일관성 지수 (ConI) : 0.974; 리텐션 인덱스(RI): 0.961; 종합 지수(ComI): 0.7600). Fusarium isolates의 이 MP 덴드로그램을 조사했을 때, 가계도는 먼저 두 개의 주요 가지로 나뉘었습니다. 이 중 첫 번째는 100% 부트스트랩 값으로 지원되는 모든 F. solani 분리물에 해당했습니다. 다른 주요 분기는 78%의 부트스트랩 값과 4개의 하위 그룹인 F. acuminatum, F. redolens, F. proliferatum 및 F. acutatum으로 자체 내에 수집되었습니다. 다른 주요 분기는 F. oxysporum, F. culmorum, F. graminarum, F. pseudograminearum 및 F. equiseti 의 5개 하위 그룹으로 나뉘었으며 부트스트랩 값은 97%였습니다.
Fusarium isolates의 독성 수준 측정
형태학적 및 분자적 특성화 연구가 완료된 시들음병과 뿌리썩음병을 나타내는 렌즈콩에서 분리된 Fusarium spp.의 병원성 연구 결과를 표 6 및 그림 4에 요약하여 정리했습니다. 일반적으로 모든 Fusarium isolates는 Kayı 91 렌틸콩 품종 F(19-60; 0.05) = 43.06에서 유발된 질병의 중증도 수준에서 차이를 보였다. p< 0.0001). 가장 독성이 강한 분리물은 F. oxysporum (YBUFol4), F. culmorum (YBUFc1, YBUFc2) 및 F. graminearum (YBUFg1, YBUFg3)이었습니다. 이 5개의 분리물은 매우 높은 독성 수준을 갖는 것으로 밝혀졌습니다. 반면, F. oxysporum (YBUFol2), F. solani (YBUFs1) 및 F. graminearum (YBUFg2)은 각각 1개씩 중등도의 독성을 갖는 것으로 밝혀졌습니다. 또한 F. acuminatum (YBUFa1, YBUFa2, YBUFa3 및 YBUFa4) 분리물은 독성이 약하거나 낮은 것으로 밝혀졌습니다. 병원성 연구에 사용된 모든 분리물은 42.5%에서 97.5% 범위였으며 렌즈콩 묘목을 접종한 후 얻었습니다.

그림 1: Fusarium 종의 영향을 받은 렌틸콩 식물. (A) 질병 중증도가 높은 렌틸콩 밭의 국소적 질병 지역에 대한 일반적인 견해. (B) 질병의 중증도를 가진 식물의 전망 4. (C) 질병 중증도를 가진 식물의 전망 3. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 질병 중증도 수준 0 - 4에서 렌틸콩 식물의 모습. 레벨 0 = 증상이 나타나지 않음, 1 = 25 %의 잎 증상; 2 = 26%-50%; 3 = 잎의 51%-75%; 4 = 동일한 순서로 75% 이상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
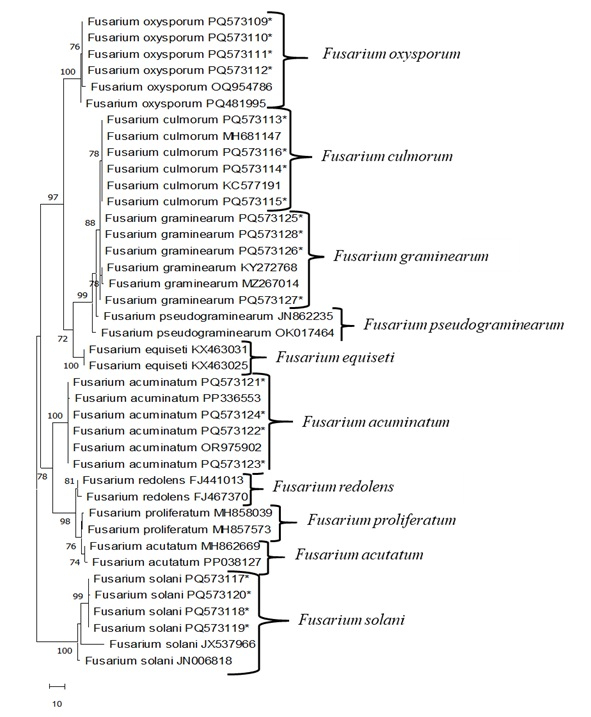
그림 3: MEGA 11을 사용하는 Fusarium sp.의 ITS 영역을 기반으로 한 가장 간결한 뿌리가 없는 나무.분리는 별표로 표시됩니다. 나머지는 GenBank에서 가져옵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
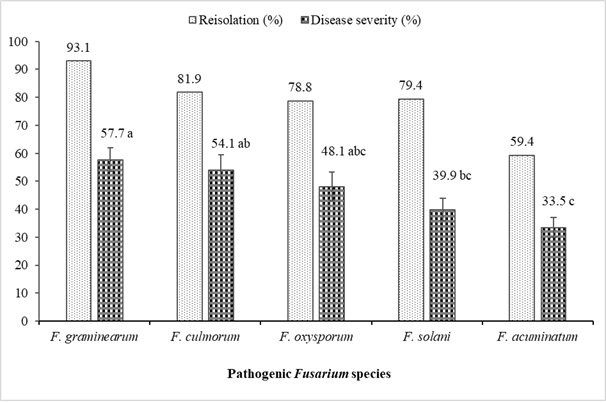
그림 4: 렌틸콩 식물에서 분리된 Fusarium spp.의 재분리(%) 및 질병 중증도(%). 세로선은 막대의 표준 오차를 나타냅니다(n = 16). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 온도(°C) | 상대 습도(%) | 강수량 (mm) | |||||||
| 달 | 2022 | 2023 | 장기 | 2022 | 2023 | 장기 | 2022 | 2023 | 장기 |
| Akdağmadeni | |||||||||
| 3월 | 11.1 | 7.4 | 3.8 | 45.1 | 68.8 | 71.1 | 21.4 | 78.7 | 60.6 |
| 4월 | 11.1 | 11.4 | 8.8 | 59.2 | 67 | 61.5 | 56.5 | 109.8 | 42.6 |
| 5월 | 16.3 | 15.1 | 12.9 | 64.3 | 73.9 | 64.8 | 48.5 | 83.6 | 74.1 |
| 6월 | 16.5 | 18.4 | 16.2 | 63.4 | 53.2 | 69.1 | 0.3 | 20.1 | 57.2 |
| 7월 | 22 | 22.2 | 18.7 | 48 | 40.5 | 60.5 | 1.4 | 0 | 7 |
| Boğazlıyan | |||||||||
| 3월 | 12.3 | 9.9 | 5.2 | 47.8 | 65.5 | 66 | 13 | 64 | 40.1 |
| 4월 | 12.8 | 13.5 | 10.2 | 62.6 | 66.6 | 59.3 | 20.2 | 24.2 | 24.4 |
| 5월 | 18.7 | 17.7 | 14.6 | 62.5 | 67.4 | 61.2 | 65.4 | 20 | 35.1 |
| 6월 | 19.7 | 20.6 | 18.6 | 52.9 | 49.9 | 59.9 | 0 | 2.4 | 35.5 |
| 7월 | 24.3 | 24 | 21.7 | 42.5 | 39.5 | 50 | 0 | 0 | 3.9 |
| 체케렉 | |||||||||
| 3월 | 13.5 | 10.8 | 6.6 | 52.8 | 70.4 | 69 | 24.3 | 111.3 | 48.7 |
| 4월 | 14.1 | 13.9 | 11.5 | 63.9 | 72.3 | 61 | 48.1 | 73.4 | 32 |
| 5월 | 19.3 | 18.6 | 15.8 | 69.1 | 72.7 | 65.4 | 80.3 | 69 | 59.3 |
| 6월 | 20.1 | 21.8 | 19.4 | 61.5 | 57.5 | 67.8 | 0 | 16.4 | 62.8 |
| 7월 | 24.6 | 24.7 | 22 | 57.8 | 52.4 | 57.5 | 33.2 | 0 | 10.9 |
| 요즈갓 | |||||||||
| 3월 | 11.5 | 8.4 | 4 | 47.3 | 68.7 | 67.5 | 14.6 | 84.8 | 87.3 |
| 4월 | 12.4 | 12.7 | 9.3 | 60.1 | 65.2 | 58.7 | 47.4 | 54.4 | 41.9 |
| 5월 | 17.5 | 16.8 | 13.7 | 64.2 | 68 | 60.2 | 92.6 | 61.6 | 72.2 |
| 6월 | 18.3 | 20.3 | 17.4 | 57.9 | 50.7 | 61.2 | 1 | 4.8 | 63.6 |
| 7월 | 22.9 | 23.6 | 20.5 | 50.9 | 44.3 | 52.7 | 7 | 0.2 | 8.8 |
| 사라켄트 | |||||||||
| 3월 | 14.8 | 9 | 6.2 | 50.9 | 71.1 | 71 | 11.1 | 77.3 | 55.3 |
| 4월 | 12.5 | 12.3 | 10.5 | 64.6 | 73.2 | 60.7 | 35.3 | 36.1 | 29 |
| 5월 | 17.6 | 16.4 | 14.2 | 69.1 | 76.7 | 65.9 | 47.8 | 72.4 | 57 |
| 6월 | 18.2 | 19.2 | 18.2 | 63.8 | 61 | 69.6 | 0 | 28.6 | 56.1 |
| 7월 | 23.2 | 23.1 | 21.6 | 54.2 | 51.7 | 57.9 | 0 | 0 | 7.4 |
| 사르카야 | |||||||||
| 3월 | 12.9 | 9.6 | 5.6 | 47 | 68.2 | 66.5 | 18.4 | 75.5 | 53.6 |
| 4월 | 13.2 | 13.1 | 10.7 | 59 | 68.8 | 56.5 | 24.8 | 60.6 | 27.2 |
| 5월 | 18.5 | 17.3 | 14.7 | 63.2 | 71.6 | 60.6 | 57.6 | 64.5 | 47.2 |
| 6월 | 18.9 | 20.5 | 18.4 | 59 | 53.9 | 62 | 0 | 16.1 | 50.6 |
| 7월 | 24 | 24 | 21.3 | 48.6 | 45.4 | 51.5 | 0 | 0 | 6.4 |
| Şefaatli | |||||||||
| 3월 | 13.1 | 10.6 | 6.2 | 48.2 | 61.1 | 67 | 12.6 | 71.5 | 50.2 |
| 4월 | 11.2 | 14.3 | 11.1 | 61.6 | 60.9 | 58.6 | 48.4 | 50.5 | 26 |
| 5월 | 19.9 | 18.6 | 15.4 | 66.7 | 61.9 | 62.3 | 65.2 | 95.4 | 53.7 |
| 6월 | 20.4 | 22.2 | 19.7 | 55.8 | 45.5 | 61.2 | 1.2 | 2.5 | 46.8 |
| 7월 | 25 | 25.3 | 23.2 | 47.9 | 39.5 | 47.1 | 0 | 0 | 4.1 |
| 소르군 | |||||||||
| 3월 | 12.2 | 9.4 | 4.8 | 48.4 | 68.2 | 67 | 21.6 | 104.2 | 49.8 |
| 4월 | 13 | 13.3 | 10.1 | 59.7 | 66.1 | 58.9 | 53.2 | 33.8 | 31.7 |
| 5월 | 18.3 | 17.4 | 14.5 | 63.7 | 69.1 | 60.9 | 56.6 | 89.6 | 44.2 |
| 6월 | 18.9 | 20.3 | 18.3 | 56.8 | 53.4 | 61.5 | 0 | 16.6 | 55.2 |
| 7월 | 23.7 | 23.7 | 21.2 | 50 | 44.9 | 52.9 | 4 | 0 | 7.5 |
| 예르쾨이 | |||||||||
| 3월 | 15 | 12.1 | 6 | 41.2 | 60.5 | 61.3 | 4.4 | 46.1 | 60.1 |
| 4월 | 16.2 | 16.2 | 13.5 | 54.8 | 60.4 | 50.9 | 40.9 | 46.8 | 23 |
| 5월 | 21.5 | 20.6 | 17.4 | 55.4 | 59.6 | 52.2 | 57 | 23.6 | 35.1 |
| 6월 | 23 | 24.5 | 20.9 | 45.2 | 41.4 | 56.4 | 0.2 | 0 | 39.1 |
| 7월 | 27.5 | 27.7 | 24.4 | 38.2 | 35.5 | 42.2 | 0.2 | 0 | 3.5 |
표 1: 렌틸콩 생산 시즌 동안 연도별로 조사한 지역의 기상 데이터.
| 군 | 필드 수 | 조사된 파종 지역(Decare) | 질병 유병률(%) | 질병 발생률(%) | 질병 중증도(%) |
| Akdağmadeni | 4 | 43.2 | 100 | 7 | 21.8 |
| Boğazlıyan | 4 | 86.4 | 100 | 23 | 36 |
| 체케렉 | 1 | 2.7 | 100 | 1.6 | 14.4 |
| 메르케즈 | 3 | 24.3 | 100 | 5.8 | 23 |
| 사라켄트 | 6 | 53.3 | 100 | 8.1 | 28.2 |
| 사르카야 | 12 | 189.3 | 100 | 17 | 35.4 |
| 소르군 | 48 | 683.2 | 100 | 20.1 | 45.2 |
| Şefaatli | 2 | 73.7 | 100 | 26.4 | 23.4 |
| 예르쾨이 | 3 | 42.3 | 100 | 9.1 | 32.9 |
| 전반적 | 83 | 1198.4 | 100 | 16.9 | 38.6 |
표 2: 렌틸콩 밭에서 시들음병, 뿌리 및 뿌리 칼라 부패의 질병 매개변수, 유병률, 발병률 및 중증도.
| 군 | 격리에 사용되는 플랜트의 수 | 절연 주파수(%) | |||||
| F. 옥시스포럼 | F. 쿨모룸 | F. 솔라니 | F. 아쿠미나툼 | F. 그라미네아룸 | 다른 | ||
| Akdağmadeni | 41 | 68.3 | 9.8 | 2.4 | 0 | 14.6 | 4.9 |
| Boğazlıyan | 57 | 54.4 | 1.8 | 12.3 | 7 | 15.8 | 8.8 |
| 체케렉 | 21 | 52.4 | 4.8 | 0 | 23.8 | 9.5 | 9.5 |
| 메르케즈 | 36 | 72.2 | 11.1 | 0 | 0 | 13.9 | 2.8 |
| 사라켄트 | 64 | 45.3 | 12.5 | 7.8 | 4.7 | 21.9 | 7.8 |
| 사르카야 | 148 | 56.8 | 11.5 | 7.4 | 5.4 | 15.5 | 3.4 |
| 소르군 | 233 | 62.2 | 9.4 | 1.3 | 7.3 | 16.3 | 3.4 |
| Şefaatli | 32 | 71.9 | 15.6 | 3.1 | 0 | 9.4 | 0 |
| 예르쾨이 | 47 | 57.4 | 14.9 | 4.3 | 2.1 | 14.9 | 6.4 |
| 전반적 | 679 | 59.5 | 10.2 | 4.4 | 5.5 | 15.8 | 4.6 |
표 3: 튀르키예의 요즈가트(Yozgat) 지방에서 진균 분리 빈도로 샘플링된 렌틸콩에 관한 정보.
| 푸사리움 종 | 격리 | 군 | 격리 소스 | GeneBank 식별 번호 |
| F. 옥시스포럼 | YBUFol1 | 소르군 | 뿌리 | PQ573109 |
| YBUFol2 | 보가즐라얀 | 루트 칼라 | PQ573110 | |
| YBUFol3 | 사르카야 | 뿌리 | PQ573111 | |
| YBUFol4 | 악다그마데니 | 뿌리 | PQ573112 | |
| F. 쿨모룸 | YBUFc1 | 소르군 | 뿌리 | PQ573113 |
| YBUFc2 | 예르코이 | 뿌리 | PQ573114 | |
| YBUFc3 | 사르카야 | 뿌리 | PQ573115 | |
| YBUFc4 | 사라켄트 | 루트 칼라 | PQ573116 | |
| F. 솔라니 | YBUFs1 | 요즈갓 | 뿌리 | PQ573117 |
| YBUF2 | 소르군 | 뿌리 | PQ573118 | |
| YBUF3 | 세파틀리 | 뿌리 | PQ573119 | |
| YBUF4 | 사르카야 | 뿌리 | PQ573120 | |
| F. 아쿠미나툼 | YBUFa1 | 체케렉 | 뿌리 | PQ573121 |
| YBUFa2 | 보가즐라얀 | 루트 칼라 | PQ573122 | |
| YBUFa3 | 사르카야 | 루트 칼라 | PQ573123 | |
| YBUFa4 | 소르군 | 뿌리 | PQ573124 | |
| F. 그라미네아룸 | YBUFg1 | 요즈갓 | 뿌리 | PQ573125 |
| YBUFg2 | 소르군 | 뿌리 | PQ573126 | |
| YBUFg3 | 사라켄트 | 뿌리 | PQ573127 | |
| YBUFg4 | 사르카야 | 루트 칼라 | PQ573128 |
표 4: 계통발생학 연구에 사용된 튀르키예 중부 요즈가트(Yozgat) 지방의 렌틸콩(Lens culinaris)에서 분리한 Fusarium spp.
| 푸사리움 종 | 격리 | 나라 | 격리 소스 | GenBank 가입 번호 |
| F. 아쿠미나툼 | AAG4 | 해당 없음 | 벚나무 페르시카 | OR975902 |
| WHWNSHJ1 | 중국 | 말루스 도메스티카 | PP336553 | |
| F. 아쿠타툼 | CBS 739.97 | 인도 | 해당 없음 | MH862669 |
| NSF1 | 이집트 | 테트라에나 알바 | PP038127 | |
| F. 쿨모룸 | 2090 | 인도 | 해당 없음 | KC577191 |
| G49 (영어) | 폴란드 | Pisum sativum | MH681147 | |
| F. equiseti | 푸사리움 에퀴세티 A577 | 중국 | 패 출 리 | KX463031 |
| 푸사리움 에퀴세티 A571 | 중국 | 패 출 리 | KX463025 | |
| F. 그라미네아룸 | 음-233 | 중국 | 해당 없음 | MZ267014 |
| 16ᄀ | 해당 없음 | 해당 없음 | KY272768 | |
| F. 옥시스포럼 | YBUFoc4 | 튀르키예 | Cicer arietinum | OQ954786 |
| 뤽크-8 | 중국 | 국화 x morifolium | PQ481995 | |
| F. 증식 | CBS 246.61 | 독일 | 해당 없음 | MH858039 |
| CBS 186.56 | 해당 없음 | 해당 없음 | MH857573 | |
| F. 슈도그라미네아룸 | WZ-8A | 중국 | 밀 | JN862235 |
| GAAET080 | 중국 | 옥수수 | OK017464 | |
| F. 레돌렌스 | 엠11 | 해당 없음 | 버섯 | FJ441013 |
| 2008 | 해당 없음 | 버섯 | FJ467370 | |
| F. 솔라니 | 시즌 2-27 | 프랑스 | 해당 없음 | JX537966 |
| UENFCF279 | 브라질 | 구아바 | JN006818 |
표 5: 계통발생학 연구에서 GenBank에서 사용한 Fusarium 종의 염기서열.
| 푸사리움 종 | 격리 | 질병 중증도(%) a | 분리물의 독성 수준 | 재격리(%) |
| (평균 ± 표준 오차) | ||||
| F. 옥시스포럼 | YBUFol1 | 20. 0 ± 1.1 나 | 약한 | 62.5 |
| YBUFol2 | 56.9 ± 1.2 CDE | 적당히 | 85 | |
| YBUFol3 | 42.5 ± 1.0 efg | 덜 | 77.5 | |
| YBUFol4 | 73.1 ± 3.9 ab | 매우 | 90 | |
| F. 쿨모룸 | YBUFc1 | 72.5 ± 1.0 ab | 매우 | 95 |
| YBUFc2 | 72.5 ± 2.7 ab | 매우 | 95 | |
| YBUFc3 | 23.6 ± 1.6 안녕 | 약한 | 60 | |
| YBUFc4 | 48.1 ± 2.6 방어력 | 덜 | 77.5 | |
| F. 솔라니 | YBUFs1 | 58.8 ± 1.6 BCD | 적당히 | 97.5 |
| YBUF2 | 46.9 ± 2.1 방어력 | 덜 | 75 | |
| YBUF3 | 17.5 ± 2.3 i | 약한 | 65 | |
| YBUF4 | 36.3 ± 1.6 FGH | 덜 | 80 | |
| F. 아쿠미나툼 | YBUFa1 | 42.5 ± 2.3 efg | 덜 | 65 |
| YBUFa2 | 16.9 ± 2.8 나 | 약한 | 42.5 | |
| YBUFa3 | 30.6 ± 6.1 안녕 | 덜 | 62.5 | |
| YBUFa4 | 44.1 ± 7.1 데프그 | 덜 | 67.5 | |
| F. 그라미네아룸 | YBUFg1 | 76.3 ± 2.2 ᅡ | 매우 | 97.5 |
| YBUFg2 | 50.6 ± 3.3 방어력 | 적당히 | 92.5 | |
| YBUFg3 | 68.1 ± 2.1 abc | 적당히 | 95 | |
| YBUFg4 | 35.6 ± 1.9 FGH | 덜 | 87.5 |
표 6: 렌틸콩 식물에 대한 Fusarium 종의 병원성 테스트. 분리 평균 순위 <10% = 비공격적; 11%-25% = 약함 공격적; 26%-50% = 덜 공격적입니다. 51%-70% = 적당히 공격적; >70% = 매우 공격적입니다. ᅡ Tukey HSD 테스트에 따른 분리물 간의 통계적 차이(p < 0.05).
토론
푸사리움 시들음병은 세계 일부 지역에서 심각한 경제적 수확량 손실을 초래하는 것으로 알려져 있다31. 이 질병은 헝가리에서 처음 보고되었고32 이후 이집트, 인도, 미얀마, 네팔, 파키스탄, 튀르키예, 시리아, 미국과 같은 많은 국가에서 보고되었다33. Kumar 등[34 ]은 렌틸콩 시들음병, 뿌리 고리 썩음병이 광범위하게 분포되어 있으며 전 세계적으로 최소 26개국에서 발생하고 있다고 보고했습니다. 최근 연구에서는 인도의 여러 주에서 채취한 병든 렌틸콩 식물에서 12종의 곰팡이를 분리한 결과, F. oxysporum f. sp. lentis 가 가장 중요한 병원체로 확인되었으며(30%), Rhizoctonia bataticola (17.5%)와 Sclerotium rolfsii (15.7%)가 그 뒤를 이었습니다31. 마찬가지로, 본 연구에서 가장 빈번하게 분리된 곰팡이 속은 Fusarium (95.4%)이었습니다. Zitnick-Anderson et al.7에 따르면, 푸사리움(50 %)은 노스다코타 렌틸콩 농장에서 시들음병, 뿌리 및 뿌리 칼라 썩음병을 유발하는 지배적인 곰팡이 속이었습니다. 그들은 또한 F. oxysporum, F. solani, F. culmorum, F. equiseti, F. acuminatum, F. graminearum, F. redolens 및 F. avenaceum 이 이 속의 병원체라고 보고했습니다.
이 연구에서 확인된 5종의 푸사리움(Fusarium ) 종의 형태학적 특성은 최근 연구의 특성과 유사했다35. Rathod et al.36에 따르면, F. oxysporum isolates는 PDA에서 격막, 분지, 처음에는 흰색, 그 다음에는 융기되거나 가라앉은 군체 발달을 보였으며, 이는 다른 색소 침착으로 착색되었다고 보고했습니다. 마찬가지로, 현재 연구에서 F. oxysporum isolates는 처음에는 흰색 군체를 형성하고 나중에는 노란색, 보라색 또는 분홍색을 형성했습니다. 반면에, F. oxysporum isolates 식별의 형태학적 기준으로 사용된 2개 또는 3개의 사슬 형태의 클라미도스포어는 약 30일 된 군체에서 관찰되었습니다. 실제로, Endes15 는 >30일 동안 유지된 F. oxysporum isolates의 chlamydospores가 Yozgat 지방의 병아리콩 재배 지역에서 식물을 감염시키는 경향이 더 높았다고 보고했습니다.
병아리콩과 렌틸콩의 푸사리움 뿌리썩음병은 F. solani, F. oxysporum, F. graminearum37과 같은 많은 푸사리움 종에 의해 발생합니다. Dean et al.38에 의해 보고된 바와 같이, F. graminearum 및 F. oxysporum은 전 세계 식물 균류학자들에 의해 가장 일반적으로 분리되는 식물 곰팡이 병원체 중 하나입니다. 그러나 Aydın 등6은 F. graminearum이 튀르키예 남동부 아나톨리아 지역의 렌틸콩 재배 지역에서 시들음병, 뿌리 및 크라운 썩음병의 원인 물질 중 하나라고 보고했습니다. 또한, F. graminearum은 미국 노스다코타주에서 렌틸콩의 뿌리와 크라운썩음병을 유발하는 것으로 알려져 있다7.
Fletcher 등[39 ]은 F. culmorum 이 렌틸콩 재배 지역에서 병원체로 거의 분리될 수 없다고 보고했습니다. 또한, Zitnick-Anderson et al.7의 최근 연구에서 F. culmorum 은 렌틸콩 식물의 시들음병, 뿌리 및 뿌리 칼라 썩음병과 관련이 있다고 보고되었습니다. 그러나 Aydın 등6 은 렌틸콩 재배 지역에서 시들음병과 뿌리썩음병을 유발하는 많은 Fusarium 종을 확인했지만 F. culmorum 을 병원체로 보고하지는 않았습니다. 현재 연구와 다른 이러한 상황은 조사 된 영역의 수가 다르거나 현재 연구에서 분자 방법을 사용한 형태 학적 연구의 지원 때문일 수 있습니다.
Zitnick-Anderson 등[7 ]은 F. acuminatum 이 노스 다코타 렌틸콩 밭에서 시들음병과 뿌리 고리 부패를 일으키는 Fusarium 종 중 하나라고 보고했다. 반면에, Aydın et al.6 은 F. solani 가 렌틸콩 재배 지역에서 시들음병과 뿌리썩음병의 원인 물질 중 하나라고 기록했다. 또한 F. solani 는 렌틸콩 재배 지역에서 약한 병원체로 분리되어 있는 것으로 알려져 있습니다7.
Fusarium 종은 통성 기생충입니다. 렌틸콩의 Fusarium 속으로 인한 감염은 특히 늦봄이나 초여름의 극한의 온도에서 식물을 완전히 파괴할 수 있습니다. 알 아흐마드(Al Ahmad)와 무셀리(Mouselli)40는 F. 옥시스포룸(F. oxysporum)과 F. 솔라니(F. solani)가 시리아 남부의 렌틸콩 농장에서 황변, 낙엽 및 건조 증상을 일으켰다고 보고했다. F. solani는 Yozgat16을 포함하여 중부 아나톨리아에서 뿌리 썩음병과 시들음병을 일으킵니다. 또한 일부 다른 Fusarium 종도 특정 비율로 병원성이 있는 것으로 밝혀졌습니다. Zitnick-Anderson 등[7]은 Fusarium wilt disease가 Fusarium oxysporum f. sp lentis에 의해 발생한다고 보고하였으나, F. culmorum, F. solani, F. graminearum 종 역시 형태학적, 생리학적, 병리학적 특성에 따라 시들음병을 유발할 수 있다. 또한, Fletcher 등[39]은 렌틸콩에서 시들음병과 뿌리썩음병을 유발하는 F. acuminatum이 약하거나 낮은 독성을 가지고 있다고 보고했다.
이 연구는 조사된 렌틸콩 밭에서 얻은 푸사리움 분리물의 95.4%가 푸사리움 종이며 렌틸콩 식물에서 1.6% - 26.4%의 발병률과 14.4% - 45.2%의 질병 중증도를 가졌다는 것을 밝혔습니다. 덥고 건조한 봄과 초여름의 더위와 같은 불리한 기후 조건은 식물 성장을 약화시키고 식물을 Fusarium 종에 취약하게 만듭니다. 대부분의 Fusarium 종은 약한 병원체이며 환경 조건이 숙주 식물을 약화시키면 특히 가뭄 조건에서 Fusarium 시들음병이 증가합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 프로젝트 번호가 FÇD-2022-1096인 Bozok University Project Coordination Application and Research Center, BAP 단위의 지원을 받았습니다. 이 연구는 Sevim Atmaca의 박사 학위 연구의 일부입니다.
자료
| Name | Company | Catalog Number | Comments |
| (S)-lactic acid | Merck | 100366 | Was used as an antibiotic in studies. |
| 2-propanol | Merck | 109634 | Used in molecular studies. |
| Adjustable micro automatic pipette (0.1-2.5 µL) | Eppendorf Research | LB.EP.3123000012 | Used to measure small volumes of liquids. |
| Adjustable micro automatic pipette set (2 – 20 µl, 20 – 200 µl, 100 – 1.000 µl) | Eppendorf Research | LB.EP.4924000916 | Used to measure small volumes of liquids. |
| Agar | Merck | 110453 | For use in making fungal media. |
| Agarose | Sigma-Aldrich | 18300012 | For use in gel preparation in electrophoresis. |
| Air conditioning room | ?klimlab | Was used to grow plants under controlled conditions. | |
| Ampisilin | Sigma-Aldrich | A9393 | Was used as an antibiotic in studies. |
| Analytical precision balance | Shimadzu ATX224 | Was used to weigh the solid materials used in the study. | |
| Autoclave sterilizer | Zealway | GF-120DR | It was used to sterilize solid and liquid materials at every stage of the study. |
| Binocular microscope | Leica DM750 | For use in morphological diagnosis. | |
| Biological safety cabinet | HFsafe Class II A2 | To ensure the safety of the work area, the user, the environment and the operation. | |
| Centrifugal | DLAB DM1424 | LB.DL.903001124 | Used to separate particles in a sample based on their shape, size and density |
| Chloramphenicol | Sigma-Aldrich | 220551 | Was used as an antibiotic in studies. |
| Cork-borer set | Sigma-Aldrich | Z165220 | It was used to take samples from fungus culture in petri dishes. |
| Cover glass and slide | ISOLAB | 075.01.006 / 075.02.005 | Was used in the preparation process for microscope studies. |
| D(+)-glucose monohydrate | Merck | 108342 | For use in making fungal media. |
| DFC450 with digital camera | Leica | Digital microscope camera with c-mount interface and with a 5 megapixel ccd sensor. | |
| Dm750 binocular microscope | Leica | MIC5246 | Was used for morphological identification of fungi. |
| DNA gel electrophoresis | thermo fisher scientific | B2-UVT | |
| Dna gel loading dye (6x) | Thermo Scientific | R0611 | For use in molecular diagnostics. |
| dNTP mix | Thermo Scientific | R0192 | Used in molecular studies. |
| Dreamtaq pcr master mixes (2x) | Thermo Scientific | K1082 | For use in molecular diagnostics. |
| Drigalski spatule | ISOLAB | 082.03.001 | It was used to scrape and spread fungal cultures grown in petri dishes. |
| Edta | Thermo Scientific | 17892 | For use in molecular diagnostics. |
| Ethanol | Merck | 100983 | Used in molecular studies and surface disinfection studies. |
| Ethidium bromide | Sigma-Aldrich | E7637 | Used to stain dna in gels during gel electrophoresis. |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6758 | Used in molecular studies. |
| Filter paper | ISOLAB | 107.58.158 | Used in stock culture studies. |
| Forced air drying cabinet | ZHICHENG ZXDS-A-1090 | For use in incubation processes. | |
| Fume hood | Elektromag EM1201 | LB.EM.EM1201 | It was used to control harmful chemical vapors, gases and dust. |
| Gel imaging system | Syngene G:BOX Chemi XX6 | For use in molecular diagnostics. | |
| Generuler 50 bp dna ladder | Thermo Scientific | SM0372 | For use in molecular diagnostics. |
| Glacial acetic acid | Merck | 1005706 | Used in molecular studies. |
| Glycerol | Merck | 104094 | For use in stock culture of fungi. |
| Lancet | ISOLAB | 048.50.002 | Used to remove diseased tissue from plant samples. |
| Magnesium chloride | Sigma-Aldrich | 814733 | Used in molecular studies. |
| Measuring tape | ISOLAB | 016.07.500 | Used to measure liquid volumes. |
| Microcentrifuge tubes | ISOLAB | 0778.03.001 / 0778.03.002 / 0778.03.003 | Used to store different volumes of liquids. |
| PCR tube | ISOLAB | 123.01.002 | It was used to put dna mix in pcr studies. |
| Petri dishes | ISOLAB | 120.13.090 | For use in growing fungus culture. |
| Pipette tips | ISOLAB | 005.01.001 / 005.01.002 / 005.01.003 / 005.01.004 | To transfer liquid volumes used in analyses. |
| Plastic bag | ISOLAB | 039.30.005 | Was used to transport samples to the laboratory. |
| Plastic pot | ToXA | Was used for growing plants. | |
| Pliers, clamps | ISOLAB | 048.08.130 | It was used to put filter papers into envelopes after the fungus grew in the petri dish. |
| Porcelain mortar | ISOLAB | 038.02.150 | Was used to crush fungal mycelia. |
| Potato dextrose agar | Condalab | 1022 | For the identification and cultivation and of fungi. |
| Pure water system | human CORPORATION | LT.HC.NHP009 | Was used in solution preparation and analysis throughout the studies. |
| Refrigerator (+4 °C / -20 °C) | Vestel | For use in the storage of stock materials. | |
| Rifampicin | Sigma-Aldrich | 557303 | Was used as an antibiotic in studies. |
| Sodium acetate | Merck | 106268 | Used in molecular studies. |
| Sodium chloride | Merck | 1064041000 | Used in molecular studies. |
| Sodium dodecyl sulfate | Sigma-Aldrich | 436143 | Used in molecular studies. |
| Sodium hypochlorite solution | Merck | 105614 | Used for surface disinfection. |
| Spatula | ISOLAB | 047.33.210 | It was used to scrape the fungus culture growing in petri dishes. |
| Streptomyc?n sulfate | BioShop Canada | STP101 | To prevent contamination in fungal culture cultivation. |
| Teksoll extra pure | Tekkim | TK.200650 | For use as a disinfectant in all stages of work. |
| Tetrasiklin | Sigma-Aldrich | T3258 | Was used as an antibiotic in studies. |
| Thermal cycler PCR | Bio?Rad T100 | For use in genomic analyses. | |
| Thoma lam | ISOLAB | 075.03.002 | For use in spore counting. |
| Tris HCL | Roche | 10812846001 | Used in molecular studies. |
| Trizma | Sigma-Aldrich | T1503 | Used in molecular studies. |
| Tween 80 | Merck | 822187 | For use in spore solution in pathogenicity testing. |
| Vortex mixer vorteks | Velp WIZARD | LB.VLP.F202A0175 | Used to mix substances in liquid volumes. |
| Water baths | Memmert WNB 22 | 1018-5702 | It was used during incubation in dna extraction studies. |
참고문헌
- Skrzypkowski, W., Kiełkowska, A. Current status of haploidization in cool-season grain legume crop species. Agriculture. 14 (7), 1031 (2024).
- Liber, M., Duarte, I., Maia, A. T., Oliveira, H. R. The history of lentil (Lens culinaris subsp. culinaris) domestication and spread as revealed by genotyping-by-sequencing of wild and landrace accessions. Front Plant Sci. 12, 628439 (2021).
- . FAOSTAT Available from: https://www.fao.org/faostat/en/#data (2022)
- TÜİK. . Agricultural statistics report. , (2023).
- Baxevanos, D., et al. Lentil cultivar evaluation in diverse organic mediterranean environments. Agronomy. 14 (4), 790 (2024).
- Aydın, M., Koç, M., Sağır, A. Investigations on determination of soilborne fungal pathogens causing root rot, crown rot and wilt on lentil in Southeast Anatolia Region. Plant Protect Bulletin. 44 (1), 93-103 (2004).
- Zitnick-Anderson, K., et al. Fusarium species associated with root rot of lentil (Lens culinaris) in North Dakota. Plant Health Prog. 22 (4), 524-528 (2021).
- Kushwaha, D. A. . A research book of seed mycoflora of chickpea (Cicer arietinum). , (2020).
- Ekwomadu, T. I., Mwanza, M. Fusarium fungi pathogens, identification, adverse effects, disease management, and global food security: A review of the latest research. Agriculture. 13 (9), 1810 (2023).
- Jiskani, A. M., et al. A destructive disease of lentil: Fusarium wilt of lentil. Plant Arch. 21 (1), 2117-2127 (2021).
- Alisaac, E., Mahlein, A. K. Fusarium head blight on wheat: biology, modern detection and diagnosis and integrated disease management. Toxins. 15 (3), 192 (2023).
- Yang, F., et al. Effects of rhizosphere microbial communities on cucumber Fusarium wilt disease suppression. Microorganisms. 11 (6), 1576 (2023).
- Kumari, N., Katoch, S. Wilt and root rot complex of important pulse crops: their detection and integrated management. Management of Fungal Pathogens in Pulses. Fungal Biology. , (2020).
- Köppen, W., Geiger, R. . Handbuch der klimatologie. , (1936).
- Agrios, G. N. . Plant Pathology. , (2005).
- Endes, A. Occurrence and distribution of Chickpea root rot and wilt disease in Yozgat Kırşehir and Kırıkkale Provinces. Çukurova J Agri Food Sci. 38 (2), 284-298 (2023).
- Choi, Y. W., Hyde, K. D., Ho, W. H. Single spore isolation of fungi. Fungal Diversity. 3, 29-38 (1999).
- Baskarathevan, J., Jaspers, M. V., Jones, E. E., Ridgway, H. J. Evaluation of different storage methods for rapid and cost effective preservation of Botryosphaeria species. New Zealand Plant Protect. 62, 234-237 (2009).
- Dikilitaş, M., Katırcıoğlu, Z., Altınok, H. Latest developments and methods on long-term storage, protection, and recycle of fungi and fungal material. JAgric Fac HR U. 15 (1), 55-69 (2011).
- Bora, T., Karaca, &. #. 3. 0. 4. ;. . Measurement of disease and damage in cultivated plants. , (1970).
- Öğüt, E. . Pathogenic and molecular characterization of some Fusarium spp. causing root rot and wilt on lentil with determination of variety reactions in south eastern Anatolia. , (2015).
- Leslie, J. F., Summerell, B. A. . The Fusarium Laboratory manual. , (2006).
- Cenis, J. L. Rapid extraction of fungal DNA for PCR amplification. Nuc Acids Res. 20 (9), 2380 (1992).
- Aras, S., Endes, A. Effect of Fusarium oxysporum infection on strawberry under calcium, iron, and zinc deficiency conditions. Zemdirbyste-Agri. 110 (1), 71-78 (2023).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protoc A Guide Metho Appl. , 315-322 (1990).
- Endes, A. Characterization and pathogenicity of Botryosphaeriaceae species associated with Gummosis, Dieback, Trunk and Branch Cankers of almond trees in Türkiye. J Agri Sci. 30 (4), 698-711 (2024).
- Gordon, T. R., Okamoto, D., Jacobson, D. J. Colonization of muskmelon and non-susceptible crops by Fusarium oxysporum f. sp. melonis and other species of Fusarium. Phytopathology. 79 (10), 1095-1100 (1989).
- Xu, X., et al. Fusarium species associated with maize leaf blight in Heilongjiang Province, China. J Fungi. 8 (11), 1170 (2022).
- Fonseca-Guerra, I. R., Chiquillo-Pompeyo, J. C., Benavides Rozo, M. E., Díaz Ovalle, J. F. Fusarium spp. associated with Chenopodium quinoa crops in Colombia. Sci Rep. 12 (1), 20841 (2022).
- Khan, M. F., et al. First report of damping-off and seedling rot of Hemp (Cannabis sativa) caused by Fusarium solani in North Dakota, U.S.A. Plant Dis. 107 (1), 232 (2023).
- Chaudhary, R. G., Saxena, D. R., Dhar, V., Singh, R. K., Namdev, J. K. Prevalence of wilt-root rot and their associated pathogens at reproductive phase in lentil. Arch Phytopathol Plant Protect. 43 (10), 996-1000 (2010).
- Fleischmann, R. Some observations on Maize smut in Hungary. Pflanzenbau. 14 (5), 199-206 (1937).
- Bedasa, T. . Distribution and management of Fusarium wilt (Fusarium oxysporum f. sp. lentis) of lentil (Lens culinaris Medikus) in Central Highlands of Ethiopia. , (2018).
- Kumar, S., et al. Vascular wilt disease of lentil: A review. J Lentil Res. 4, 1-14 (2010).
- Chenari, S., Abbasi, S., Chehri, K. Phylogeny and host specificity of Fusarium solani species complex isolated from chickpea, lentil and common bean. Arch Phytopathol Plant Protect. , 1-15 (2024).
- Rathod, A., et al. Isolation of causal organism of wilt and collar rot of lentil and its pathogenicity tests. Int J Curr Microbiol Appl Sci. 10 (12), 276-282 (2021).
- Hayit, T., Endes, A., Hayit, F. The severity level classification of Fusarium wilt of chickpea by pre-trained deep learning models. J Plant Pathol. 106 (1), 93-105 (2024).
- Dean, R., et al. The Top 10 fungal pathogens in molecular plant pathology. Mol Plant Pathol. 13 (4), 414-430 (2012).
- Fletcher, J. D., Broadhurst, P. G., Bansal, R. K. F. avenaceum: A pathogen of lentil in New Zealand. New Zealand J Crop Horticultural Sci. 19 (2), 207-210 (1991).
- Al Ahmad, M., Mouselli, N. Wilt and root rot of lentis. Lens. 14 (1/2), 27-31 (1987).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유