Method Article
Um modelo suíno de alta fidelidade de transplante cardíaco ortotópico após doação após morte circulatória
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O protocolo aqui descrito descreve um modelo de transplante cardíaco suíno de alta fidelidade após doação após morte circulatória utilizando perfusão ex vivo do aloenxerto.
Resumo
O número de pacientes com insuficiência cardíaca avançada que podem receber um transplante de coração é limitado pela escassez de doadores de órgãos adequados. Nos esforços para expandir o pool de doadores, métodos alternativos de doação e aquisição foram desenvolvidos, incluindo transplante cardíaco após doação após morte circulatória (DCD HT). Embora a sobrevida em curto prazo após DCD HT não seja inferior ao transplante cardíaco com doadores com morte encefálica, pode haver um aumento da taxa de disfunção primária do enxerto (PGD) associada aos aloenxertos DCD HT. A etiologia subjacente do PGD é multifatorial e incompletamente compreendida. Para aloenxertos DCD HT, o período de lesão isquêmica quente durante a aquisição de DCD é um fator de risco potencial para PGD ao qual os aloenxertos de morte encefálica não estão expostos. O tempo isquêmico quente funcional, portanto, pode ser um importante impulsionador do PGD no TDC HT. No entanto, os mecanismos subjacentes ao PGD neste cenário clínico são pouco compreendidos em nível molecular. O trabalho aqui apresentado tem como objetivo descrever o desenvolvimento e a validação de um modelo suíno de alta fidelidade e não sobrevida de transplante cardíaco ortotópico com DCD. Nossa hipótese é que o uso desse modelo translacional de animais de grande porte é fundamental para elucidar os mecanismos moleculares que contribuem para o PGD, bem como para investigar intervenções destinadas a otimizar a preservação do aloenxerto e o desempenho inicial. Este modelo replica clinicamente a abordagem perioperatória e cirúrgica usada no DCD HT, com modificações para levar em conta a anatomia e fisiologia suína. O desenvolvimento deste modelo cirúrgico de animais de grande porte não apenas fornecerá insights mecanicistas sobre o desenvolvimento do PGD, mas também pode ser modificado para aprimorar os esforços de pesquisa translacional destinados a melhorar a recuperação de órgãos após o DCD HT.
Introdução
Para pacientes com insuficiência cardíaca em estágio terminal refratária ao tratamento clínico, o transplante cardíaco continua sendo a terapia associada à melhor sobrevida e qualidade de vida em longo prazo. Historicamente, o transplante cardíaco exigia o uso de um aloenxerto cardíaco obtido de um doador com morte encefálica (DBD HT) e transportado enquanto preservado com armazenamento estático hipotérmico. No entanto, o número de pacientes que necessitam de transplante cardíaco excede o número de doadores disponíveis. Enquanto mais de 5.000 transplantes cardíacos são realizados anualmente em todo o mundo, estima-se que 50.000 candidatos aguardem um transplante cardíaco1. Além disso, a utilização de órgãos de doadores identificados permanece tão baixa quanto 30%2. A fim de melhorar a utilização de órgãos de doadores, métodos alternativos de doação e aquisição foram desenvolvidos nos últimos anos, incluindo o transplante cardíaco após doação após morte circulatória (DCD HT)3,4,5,6.
Os doadores de DCD HT não atendem aos critérios formais de morte cerebral, mas têm uma lesão neurológica não recuperável para a qual os cuidados médicos contínuos são considerados inúteis. Durante uma aquisição de TCD com TDC, as medidas de suporte à vida são retiradas e o paciente é monitorado quanto à progressão para apneia e parada circulatória. A morte nessas situações é declarada por um médico que não participa do processo de transplante ou aquisição de órgãos. Uma vez declarada a morte, há um período adicional de impasse (geralmente 5 min) em que o potencial doador é observado para garantir que não haja recuperação ou sinais de vida, após o qual a declaração de óbito é reconfirmada antes de prosseguir com a aquisição de órgãos 7,8. Os aloenxertos de DCD são, portanto, expostos a um período variável de isquemia quente (pelo menos 10 min) ao qual os aloenxertos de doadores de DBD não são expostos. Este período de isquemia quente anteriormente dissuadiu o uso de transplante cardíaco com doadores DCD. No entanto, nos últimos cinco anos, dois métodos de reperfusão de aquisição foram desenvolvidos para a recuperação do aloenxerto após o tempo isquêmico quente associado ao DCD. Primeiro, a aquisição direta e perfusão (DPP) envolve a cardioectomia do doador após a confirmação da morte circulatória, seguida de ressuscitação do aloenxerto e preservação por perfusão ex vivo. Alternativamente, a perfusão regional normotérmica (NRP) usa circulação extracorpórea com a exclusão da circulação cerebral para reperfundir e reanimar o coração do doador in situ antes da cardiectomia 9,10,11,12.
Até agora, a sobrevida em curto prazo associada ao TDC HT tem sido semelhante à observada com DBD HT. No entanto, estudos iniciais também sugerem que há um risco maior de disfunção primária grave do enxerto (PGD) com DCD HT em comparação com DBD HT3. PGD é um termo usado para descrever a circunstância clínica em que, após o transplante cardíaco, a função precoce do aloenxerto é insuficiente para atender às necessidades circulatórias do receptor. Um sistema para classificar a gravidade do PGD foi descrito pela Sociedade Internacional de Transplante de Coração e Pulmão. No DPE grave, o suporte circulatório mecânico é necessário para apoiar a circulação adequada no período pós-transplante13. Essa condição é o principal fator de mortalidade pós-operatória precoce após o transplante cardíaco. A etiologia do PGD para DBD HT e DCD HT é pouco compreendida, mas provavelmente é multifatorial, com variáveis de doador, preservação e receptor contribuindo. Para aloenxertos DCD, a lesão isquêmica quente durante a aquisição de DCD, bem como respostas deletérias específicas do doador, incluindo instabilidade hemodinâmica, distúrbios metabólicos e surtos de catecolaminas, citocinas, lactato e potássio, são fatores propostos que podem contribuir para um risco aumentado de PGD em comparação com aloenxertos DBD. 14,15,16. No entanto, os mecanismos subjacentes ao PGD neste cenário clínico são pouco compreendidos em nível molecular. Além disso, talvez devido a essas preocupações, os corações com DCD têm 3,37 vezes mais chances de serem recusados do que os órgãos com DBD17. Como resultado, ainda há uma necessidade não atendida de melhorar a utilização de órgãos e melhorar os resultados do transplante, otimizando o processo de preservação de órgãos.
Neste estudo, descrevemos um DCD HT suíno usando DPP que espelha o DCD HT clínico atual com alta fidelidade. Este modelo inclui elementos em todo o processo de transplante de DCD: 1) aquisição de DCD, 2) preservação de perfusão ex vivo com um Organ Care System (OCS) e 3) implantação do receptor. Este modelo abrangente oferece uma oportunidade para caracterizar melhor os mecanismos subjacentes ao PGD no DCD HT. Isso permite o desenvolvimento de estratégias terapêuticas direcionadas e racionais destinadas a melhorar a preservação e o desempenho do aloenxerto. Além disso, este modelo fornece uma plataforma para a avaliação pré-clínica de tais novas terapêuticas, que serão importantes para ajudar a avançar no campo do transplante cardíaco de maneira segura e rápida.
Protocolo
Todos os manejos e procedimentos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Duke University Medical Center, de acordo com seus regulamentos e diretrizes.
1. Preparo pré-operatório do doador
- Selecione dois porcos Yorkshire compatíveis com o tipo sanguíneo pesando 70-80 kg (tipagem sanguínea realizada pela Looper Farms em Granite Falls, NC, EUA). Jejue ambos os porcos por um mínimo de 6-8 h antes da cirurgia.
- Prepare o módulo de perfusão cardíaca de acordo com as diretrizes do fabricante e os testes de ponto de atendimento necessários (Tabela de Materiais).
- Prepare a solução de manutenção para o módulo de perfusão cardíaca. Esta solução contém nutrientes para o coração metabolicamente ativo, bem como adenosina, para ajudar a manter a pressão arterial alvo.
- Adicione o seguinte: 500 mL de solução de primer transparente, 100 mL de albumina a 25%, 100 mg de ciprofloxacina (200 mg / 100 mL), dois frascos de 5 mL de injeção multivitamínica, bicarbonato de sódio 20mEq, 1 g de cefazolina sódica e 250 mg de metilprednisolona. Espague a solução de escorva e adicione o conteúdo ao módulo de perfusão cardíaca.
- Uma vez preparado, injete 50 UI de insulina recombinante humana no saco.
- Prepare uma solução de epinefrina injetando 0,25 mg de epinefrina e 30 UI de insulina recombinante humana em um saco de 500 mL de dextrose a 5% em água. Esta solução destina-se a substituir as catecolaminas em vez de ter um efeito inotrópico. Infundir a solução a 10 ml/h.
- Prepare a solução T4 injetando 200 μg de levotiroxina reconstituída em uma bolsa salina normal a 0,9% de 100 mL. Infundir a uma taxa de 3 mL / h.
- Prepare a solução de manutenção para o módulo de perfusão cardíaca. Esta solução contém nutrientes para o coração metabolicamente ativo, bem como adenosina, para ajudar a manter a pressão arterial alvo.
- Sedar o porco doador designado com 4,4 mg/kg de telazol e 1,0 mg/kg de propofol, seguidos de isoflurano inalado a 2% a 5% administrado por máscara facial.
- Enquanto o porco estiver em decúbito dorsal, intubar com um tubo endotraqueal de 8-10 mm para manutenção das vias aéreas durante a cirurgia. Prenda o tubo endotraqueal no lugar do focinho. Aplique pomada veterinária nos olhos para manter a lubrificação ocular durante a cirurgia.
- Insira um cateter intravenoso (IV) em uma veia da orelha para administrar fluidos intravenosos (fluidos de manutenção: solução de Ringer com lactato 10 mL / kg / h).
- Inicie a infusão contínua de fentanil para analgesia (25-100 μg/h) e administre 0,2 mg/kg de vecurônio para manter a paralisia.
- Coloque eletrodos de eletrocardiograma e oxímetro de pulso para monitoramento contínuo da atividade elétrica e oxigenação.
- Inicie a ventilação mecânica a um volume corrente de 10 mL / kg / min, uma taxa de 10-15 respirações por minuto e com manutenção de isoflurano (1% -5%) pelo restante do procedimento. Titule anestésicos e medicamentos vasoativos de forma que os reflexos estejam ausentes, a frequência cardíaca permaneça em 61-99 bpm e a pressão arterial sistólica permaneça em 90-130 mmHg.
- Posicione o porco na mesa cirúrgica com as extremidades superiores posicionadas cefalicicamente e presas fora do campo operatório. Fixe as extremidades inferiores fora do campo operatório.
- Defina a área a ser incluída no campo operatório pela papada superiormente, linha axilar anterior bilateralmente e dois dedos abaixo do apêndice xifóide inferiormente. Prepare e cubra o local da cirurgia assepticamente, seguindo as práticas padrão.
- Faça um corte da carótida do lado direito.
- Usando uma lâmina # 10, faça uma incisão lateral direita oblíqua no pescoço, com dois dedos laterais à traqueia, ao longo da borda medial do músculo esternocleidomastóideo.
- Realize esta incisão através do platisma com eletrocautério, garantindo a hemostasia. Uma vez através do platisma, use um afastador auto-retentor para ajudar na exposição.
- Dissecar e isolar cuidadosamente a artéria carótida e a veia jugular interna; Coloque um laço de vaso ao redor de cada vaso.
- Aplicar 10 mL de lidocaína a 2% topicamente para banhar os vasos.
NOTA: A lidocaína é usada por seus efeitos vasodilatadores, pois os vasos suínos têm espasmos facilmente com a manipulação e podem se tornar difíceis de canular. - Usando a técnica de Seldinger, canule diretamente a artéria carótida com uma micropuntura de 5 Fr, seguida por uma bainha introdutora de 6 Fr.
- Conecte a bainha introdutora a uma linha arterial e transdutor para monitoramento contínuo da pressão arterial sistêmica durante o procedimento.
- Colete sangue da linha arterial da artéria carótida para exames laboratoriais pré-operatórios (hemograma completo, perfil metabólico abrangente, troponina, lactato e sangue total para isolamento de células mononucleares do sangue periférico).
- Canular a veia jugular interna utilizando a mesma técnica do ponto 1.11.5. Deixe a bainha de 6 Fr no lugar, pois ela será usada para introduzir um cateter de alça de pressão-volume para avaliações funcionais a jusante.
2. Doação após morte circulatória e cardiectomia do doador
- Realize uma esternotomia.
- Usando uma lâmina # 10, faça uma incisão longitudinal da incisura esternal até o apêndice xifóide. Usando eletrocautério, realize a dissecção através do tecido subcutâneo e da fáscia do músculo peitoral.
- Marque a linha média do esterno com eletrocautério. Disseque as inserções ligamentares no manúbrio e ao redor do processo xifóide.
- Use uma serra esternal oscilante para dividir cuidadosamente a mesa anterior do esterno ao longo da linha média. Use a serra oscilante para dividir completamente a mesa posterior do esterno ao nível do manúbrio. Tome cuidado para evitar lesões na veia inominada nesta etapa. Complete a divisão esternal da mesa posterior abaixo do manúbrio usando uma tesoura pesada.
NOTA: A dissecção manual romba do plano entre a parte inferior do esterno e o pericárdio pode ajudar a evitar lesões no coração durante esta etapa. - Use eletrocautério para obter hemostasia das bordas esternais. Coloque um afastador esternal.
- Remova o tecido do coxim adiposo tímico e pericárdico com eletrocautério para otimizar a exposição do pericárdio.
- Abra cuidadosamente o pericárdio com eletrocautério. Realize a incisão longitudinalmente do ápice do coração até o nível da aorta.
- Crie um poço pericárdico com pontos de seda 2-0.
- Realize análises de aloenxerto de doador de linha de base.
- Enquanto o coração do doador estiver exposto e antes de qualquer manipulação cardíaca direta, realize análises basais. Isso inclui ecocardiografia epicárdica direta, avaliação da alça de pressão-volume e biópsias miocárdicas por agulha grossa.
- Realize a ecocardiografia de forma estéril para obter visualizações padrão de eixos longo e curto diretamente da superfície epicárdica.
- Para realizar registros de loop de pressão-volume, introduza um cateter de pressão-volume de estado sólido (5Fr, 122 cm) sequencialmente na artéria carótida e na veia jugular interna nos ventrículos esquerdo e direito, respectivamente.
- Meça o comprimento do cateter a ser introduzido externamente (do local da canulação até o ápice do coração) antes da inserção na bainha.
- Introduza o cateter na bainha arterial, guiando-o para o ventrículo esquerdo usando ultrassom epicárdico. Certifique-se de que o cateter não esteja tocando diretamente uma parede ventricular, pois isso pode interferir na precisão da medição.
- Em seguida, introduza o cateter na bainha venosa, guiando-o para o ventrículo direito, usando palpação direta ou orientação por ultrassom epicárdico.
- Realize biópsias miocárdicas com agulha grossa para coletar tecido para análises posteriores. Faça isso no ápice do ventrículo esquerdo. Se houver sangramento significativo no local da biópsia, coloque um ponto de reparo.
- Prepare o coração do doador.
- Disseque a janela aortopulmonar para permitir espaço para a colocação do grampo cruzado.
- Dissecar circunferencialmente a veia cava superior (VCS) e a veia cava inferior (VCI) com eletrocautério.
- Para anticoagular, administrar 300 unidades/kg de heparina por via intravenosa (IV) antes da canulação da aorta.
- Use uma sutura de polipropileno 4-0 de braço duplo para colocar um cordão de bolsa aórtica na raiz da aorta para canulação da aorta. Canular com cânula de ventilação radicular aórtica 7 Fr (14G).
- Desaire e prenda no lugar com um torniquete Rumel. Lave o tubo de cardioplegia para desar e prenda a linha à cânula da raiz da aorta.
- Em seguida, para se preparar para uma futura canulação venosa, coloque um ponto em bolsa no apêndice atrial direito e prenda-o com um torniquete Rumel.
- Realize a morte circulatória controlada.
- Forneça 250 μg de fentanil IV em bolus seguido de infusão contínua (IRC) a 100 μg/h para analgesia. Para paralisar, administre 0,2 mg / kg de vecurônio por via intravenosa.
- Interrompa a ventilação mecânica para iniciar o processo de morte circulatória controlada.
- Monitore continuamente a pressão arterial sistólica e média, a pulsatilidade da linha arterial, a atividade elétrica cardíaca e o estado de oxigenação.
NOTA: A fase agonal começa quando a pressão arterial sistólica cai abaixo de 50 mmHg. Neste ponto, o coração pode se distender. A morte é definida pela assistolia mecânica (atividade elétrica sem pulso) e nenhum sinal de vida. Este estudo não define morte por assistolia elétrica neste modelo, pois a atividade elétrica lenta e sem pulso persiste em suínos por um período de tempo mais longo do que o observado em humanos, o que pode resultar em aumento do insulto isquêmico do aloenxerto do que o pretendido para o modelo. - Aguarde 10 minutos após o momento da morte/assistolia antes de prosseguir com as etapas a seguir do protocolo. Esse intervalo simula o período de afastamento mais o tempo necessário para a entrada e preparo do mediastino no TDC clínico HT.
- Realize o escorvamento do dispositivo de perfusão ex vivo .
- Com uma lâmina #11, faça uma incisão no apêndice atrial direito e canule com a cânula venosa 34Fr fornecida pelo fabricante. Prenda a cânula com um torniquete Rumel e conecte a cânula à bolsa de coleta do dispositivo de perfusão ex vivo .
- Colete aproximadamente 1200-1500 mL de sangue do doador na bolsa de coleta fornecida pelo fabricante. Antes da exsanguinação, 30.000 U de heparina e 2 mg de tirofiban HCl terão sido adicionados à bolsa de coleta.
- Filtre o sangue do doador e entregue-o no módulo de perfusão cardíaca.
- Realize a cardiectomia do doador.
- Após a coleta do sangue do doador, aplique o pinçamento cruzado da aorta.
- Observe que a raiz da aorta suína e a aorta ascendente são consideravelmente mais curtas do que nos humanos. Tome cuidado para aplicar o grampo cruzado o mais proximalmente possível para evitar o clampeamento do arco ou a oclusão incompleta da aorta.
- Administre 1 L de cardioplegia Del Nido na raiz da aorta, visando uma pressão radicular de 60-100 mmHg.
- Aplique a veia cava inferior no reflexo pericárdico e o apêndice atrial esquerdo para ventilar os ventrículos direito e esquerdo durante o parto da cardioplegia.
- Coloque lama estéril fria no coração do doador.
- Divida a VCI, a VCS, a aorta imediatamente distal à artéria inominada e a artéria pulmonar (AP) na bifurcação. Transecto do átrio esquerdo do doador (AE), deixando um manguito de tecido suficiente no aloenxerto.
- Remova o coração do campo e coloque-o em uma bacia cheia de lama fria e estéril para a preparação da mesa traseira.
- Coloque quatro suturas de colchão horizontais equidistantes (polipropileno 4-0) dentro da extremidade distal da aorta.
- Após a coleta do sangue do doador, aplique o pinçamento cruzado da aorta.
- Perfusão ex vivo
- Coloque o adaptador aórtico de perfusão ex vivo na aorta distal e prenda firmemente com uma sutura de seda 0-0 ou fita umbilical colocada logo abaixo das suturas prometidas.
- Deixe o PA, SVC, IVC e átrio esquerdo abertos enquanto estiver no dispositivo de perfusão ex vivo .
NOTA: Com esta configuração, não foi encontrada distensão ventricular esquerda. - Transporte o aloenxerto para o dispositivo de perfusão ex vivo e conecte o adaptador aórtico. Certifique-se de que a superfície posterior do coração esteja voltada para a frente. Certifique-se de que a superfície anterior do coração esteja em contato com o dispositivo e duas almofadas de desfibrilação. Manter o aloenxerto a 34 °C. Desfibrilar conforme necessário para restaurar qualquer arritmia ventricular a um ritmo organizado.
- Nesse ponto, uma terapêutica poderia ser introduzida no circuito de perfusão ex-vivo através da porta de cardioplegia. Alternativamente, o perfusato ou circuito físico pode ser modificado para avaliar as condições experimentais destinadas a melhorar a recuperação de um aloenxerto DCD HT. Por exemplo, mostramos anteriormente que o perfusato precisa ser lavado de anticorpos neutralizantes pré-formados por meio de um protetor de células para aumentar a transdução com vetores virais 18,19,20.
- Use laboratórios no local de atendimento para orientar a administração de bicarbonato de sódio, gluconato de cálcio e dextrose, conforme necessário.
- Obtenha amostras de perfusato, exames de sangue e amostras de biópsia por agulha grossa durante este estágio de perfusão ex vivo .
NOTA: Neste modelo, o aloenxerto permanece no dispositivo de perfusão ex vivo por aproximadamente 2-3 h antes do implante no receptor (Tabela 1). O tempo de perfusão do aloenxerto ex vivo foi determinado pelo tempo necessário para preparar o animal receptor para implantação. No entanto, o tempo de perfusão ex vivo é uma variável que pode ser ajustada com base nos objetivos do estudo.
3. Cardiectomia, implante e reperfusão do receptor
- Preparar o suíno receptor conforme descrito nos passos 1.3 a 1.11.8.
- Além disso, coloque um cateter de cateter central de 7 Fr 20 cm de triplo lúmen na veia jugular externa ou interna esquerda usando orientação por ultrassom e a técnica de Seldinger. Coloque uma linha arterial femoral de 5 Fr usando orientação por ultrassom.
- Depois de cobrir o campo estéril, prepare o circuito de circulação extracorpórea (CEC) e traga as linhas para o campo.
- Recircule através das linhas arteriais e venosas da CEC para desairar. Prenda e divida as linhas. Prepare a linha venosa para canulação bicaval.
- Administrar uma dose pré-operatória de 1 g de metilprednisolona para tratar eventuais respostas inflamatórias por rejeição ou isquemia, como é feito no transplante cardíaco clínico na instituição onde este estudo é realizado.
- Realize um corte da carótida direita e esternotomia na linha média conforme descrito anteriormente nas etapas 1.11 e 2.1.
- Realize a cardiomiectomia do receptor.
- Disseque a janela aortopulmonar como antes. Dissecar a VCS e a VCI e colocar fita umbilical circunferencial ao redor dos vasos.
- Antes da canulação, administrar 400 unidades/kg de heparina. Titule para uma meta de tempo de coagulação ativado (ACT) > 480 s.
- Coloque um ponto de cordão de bolsa de canulação aórtica padrão na aorta ascendente distal (usando sutura de poliéster trançado revestido 2-0 com dois braços). Prenda com um torniquete Rumel e hemostático.
- Certifique-se de que a pressão arterial sistólica seja inferior a 120 mmHg. Use uma lâmina # 11 para fazer uma incisão de facada de espessura total dentro do cordão da bolsa. Canule a aorta com uma cânula de 15 Fr através desta incisão. Prenda a cânula no lugar com um torniquete Rumel.
- Clamp a cânula aórtica. Depois de desarejar a linha de circulação de safena, conecte a cânula aórtica ao circuito de CEC. Certifique-se de que não haja bolhas de ar na linha.
- Faça outro cordão de bolsa aórtico e insira a cânula de ventilação da raiz aórtica.
- Realize a canulação venosa usando uma técnica bicaval com cânulas de ponta metálica de ângulo reto 18-20 Fr na VCS e na VCI, presas com torniquetes Rummel. Em seguida, conecte essas cânulas ao membro venoso do circuito de CEC.
- Inicie a CEC para um fluxo alvo de 2,4 L / min / m2 e resfrie a 32 ° C. Titular anestésico e vasopressores para manter uma pressão arterial média > 60 mmHg.
NOTA: Esses procedimentos são realizados com anestesiologistas cardiotorácicos certificados e perfusionistas certificados que monitoram e coordenam o manejo hemodinâmico durante toda a execução da CEC. - Aplique o pinçamento cruzado aórtico proximal à cânula aórtica e prossiga com uma explicação do coração nativo do receptor. Deixe intactos os manguitos atriais direito e esquerdo grandes o suficiente para facilitar uma técnica de implante bi-atrial.
NOTA: A técnica bi-atrial é utilizada neste modelo, pois a vasculatura suína é muito delicada, o que torna as anastomoses vasculares da VCI e da VCS tecnicamente desafiadoras em uma técnica bicaval. - Tranecte a aorta e a AP o mais próximo possível da raiz para manter o comprimento máximo do vaso. Coloque o coração recém-explantado em solução salina tamponada com fosfato (PBS) gelada para ser transportado e processado no laboratório.
- Realize o implante bi-atrial do aloenxerto do receptor.
- Resfrie o aloenxerto no dispositivo de perfusão ex vivo de acordo com as instruções do fabricante. Administre 1 L de cardioplegia Del Nido fria para parada cardioplégica mais uma vez antes da remoção do dispositivo.
- Desconecte o adaptador aórtico e transporte o coração em uma bacia de lama estéril e fria para a mesa de trás.
- Inspecione o coração em busca de qualquer primum fossa ovalis patente (FOP) ou locais de lesão inadvertida.
NOTA: É importante ressaltar que, em suínos, geralmente há uma veia sistêmica que drena ao longo da borda do átrio esquerdo antes de drenar para o átrio direito ou VCI. Essa veia pode ser aberta no processo de aquisição, e deve-se tomar cuidado para garantir que ela seja ligada antes de prosseguir com o implante. - Apare a aorta de volta ao tecido saudável abaixo do local de fixação do adaptador.
- Usando uma tesoura de Metzenbaum, apare a abertura do átrio esquerdo para corresponder ao tamanho do manguito do AE receptor. Faça o mesmo com o átrio direito.
- Inicie a anastomose do átrio esquerdo de forma contínua com sutura de Prolene 4-0 de braço duplo. Continue com as anastomoses de AP, aórtica e átrio direito direito, também todas concluídas com sutura contínua de prolene 4-0.
- Comece a reaquecer até a normotermia (37 °C) antes da remoção do grampo cruzado aórtico.
- Realizar a reperfusão do aloenxerto e desmamar da CEC.
- Depois de completar todas as anastomoses, solte o pinçamento cruzado da aorta para reperfundir o aloenxerto.
- Garanta a hemostasia de todas as anastomoses.
- Aguarde o retorno do ritmo e da contratilidade nativos. Coloque os fios de estimulação epicárdica e estimule a 100 bpm se a frequência cardíaca do aloenxerto for <100 bpm.
- Após 60 min de reperfusão, tentar desmamar da CEC. Os receptores são apoiados com 0,05 μg/kg/min de epinefrina, bem como infusões de vasopressores, conforme necessário, para manter uma pressão arterial média (PAM) >65 mmHg.
- Realize análises como ecocardiografia, exames de sangue, biópsias miocárdicas e avaliação da alça pressão-volume em pontos de tempo de reperfusão precoce e tardia.
4. Término do experimento e eutanásia
NOTA: Neste estudo, o animal receptor do transplante foi apoiado por 1 h após a separação da CEC.
- Após a conclusão do experimento, a eutanásia é realizada por meio de exsanguinação sob anestesia.
- Explante o aloenxerto transplantado seccionando as linhas de sutura ao longo de todas as anastomoses. Tome cuidado para não incluir nenhum tecido receptor nativo com a amostra do aloenxerto.
- Coloque o aloenxerto imediatamente em PBS gelado e transporte-o para o laboratório para processamento e armazenamento.
Resultados
Um total de 6 transplantes de DCD suínos foram realizados para uma análise piloto usando o protocolo aqui descrito. Ao longo desses seis experimentos piloto, os componentes do protocolo foram refinados para melhor atender às necessidades do modelo, melhorar a reprodutibilidade e levar em conta as restrições logísticas. O protocolo final resultante, conforme escrito aqui, está resumido na Figura 1.
Ao contrário do processo de morte circulatória controlado por humanos, os corações suínos submetidos à isquemia mantiveram a atividade elétrica por muito mais tempo do que o esperado, mesmo após a cessação da contratilidade. Após o reconhecimento dessa diferença no primeiro experimento, a assistolia elétrica foi considerada não confiável como medida para declaração de óbito. Para evitar danos isquêmicos quentes ao aloenxerto desproporcionais ao observado no contexto clínico, assistolia mecânica (atividade elétrica sem pulso) foi utilizada para determinar o tempo de óbito para os demais procedimentos de transplante.
Além disso, o período de impasse foi inicialmente de 15 minutos antes de prosseguir com a cardiectomia do doador. Isso foi utilizado para os três primeiros experimentos do conjunto piloto. Parte da justificativa para esse período de isquemia quente de 15 minutos era que pretendíamos ter uma lesão grave o suficiente para ter um grau de disfunção do enxerto pós-transplante que fosse adequado para estudo. Descobrimos que a disfunção do enxerto nesses primeiros experimentos era tão grave que tivemos dificuldade em sustentar o animal receptor por uma hora após a separação da CEC, de modo que o animal receptor necessitou de altas doses de suporte inotrópico e pressor para cumprir o ponto de tempo de 1 h. Dadas essas dificuldades, reduzimos o período de lesão isquêmica por calor para 10 min, o que se aproxima mais do TDC clínico HT com perfusão ex vivo . A Figura 2 mostra imagens representativas do aloenxerto nesta fase, bem como durante a perfusão ex vivo e após o implante. Por fim, foram feitos ajustes na titulação das infusões vasopressoras e inotrópicas na fase de desmame pós-CEC para apoiar o coração recém-transplantado. Nunca é demais enfatizar a necessidade de uma equipe experiente e com experiência específica em anestesiologia cardiovascular para aumentar o sucesso nesta fase pós-CEC.
Os tempos operatórios foram rastreados em 4 dos 6 experimentos e estão resumidos na Tabela 1. Na fase de aquisição de DCD do protocolo, o tempo decorrido desde a cessação das medidas de suporte à vida no porco doador até a declaração de óbito foi de 14,25 (+/- 2,6) min. O tempo de circulação extracorpórea operatória e o tempo de pinçamento cruzado permaneceram consistentes ao longo dos experimentos piloto em cerca de 3 h e 1,5 h, respectivamente. Os experimentos foram encerrados com eutanásia aproximadamente 1 h após a separação da CEC. Houve variabilidade no grau de estabilidade dos animais no momento da eutanásia. Alguns animais demonstraram estabilidade relativamente boa e apenas disfunção leve do enxerto, enquanto outros demonstraram instabilidade hemodinâmica significativa e disfunção grave do enxerto. Exibições representativas de ecocardiografia estática são demonstradas na Figura 3. Esta e outras avaliações funcionais, como loops PV, podem ser utilizadas para determinar diferenças na função do aloenxerto desde a linha de base, bem como antes e depois da introdução de intervenções terapêuticas.
Um resumo das amostras coletadas, processadas e armazenadas durante o experimento é exibido na Figura 4. Os corações explantados foram imediatamente colocados em PBS gelada e armazenados em laboratório para análise tecidual e molecular. O coração nativo do receptor foi utilizado como controle, enquanto o aloenxerto transplantado foi armazenado como tecido experimental. Os corações foram cortados em 4 seções transversais do ápice à base. De cada uma delas, amostras representativas de tecido de cada câmara (ventrículo esquerdo, ventrículo direito, septo e ambos os átrios) foram congeladas rapidamente em nitrogênio líquido e armazenadas a -80 ° C para análise futura. Da mesma forma, amostras de tecido representativas de cada um desses níveis e câmaras foram incubadas em RNAlater e congeladas rapidamente. A amostra restante de tecido foi preservada em formol para análise histopatológica. Amostras de sangue de qualquer ponto de tempo foram obtidas em duplicata e armazenadas em tubos de EDTA ou CPT. O sangue armazenado em tubos de EDTA foi centrifugado para isolar o plasma, que foi congelado rapidamente. O sangue nos tubos CPT foi processado para PBMCs usando um protocolo modificado fornecido pelo fornecedor do tubo CPT.

Figura 1: Esquema do protocolo HT DCD suíno. A linha do tempo dos eventos que ocorrem no procedimento de HT DCD suíno é representada aqui. Neste estudo piloto, foram realizados 6 TDC HTs. As avaliações miocárdicas basais são realizadas no aloenxerto cardíaco do porco doador, após o qual a morte circulatória controlada começa. Após a declaração de morte, há um período de impasse de 10 minutos. O aloenxerto é então explantado e transportado para o dispositivo de perfusão ex vivo , onde é reperfundido por 2-3 h. Após o preparo do animal receptor, o aloenxerto do doador é implantado com técnica biatrial. Após 1 h de reperfusão na CEC, o receptor é desmamado do suporte de bypass. A eutanásia ocorre 1 h após a separação da CEC. O aloenxerto implantado é então processado para análise tecidual. TDC HT = transplante cardíaco após doação após morte circulatória; CEC = circulação extracorpórea. Clique aqui para ver uma versão maior desta figura.
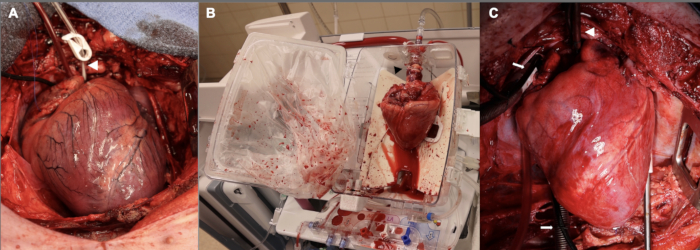
Figura 2: Aloenxerto cardíaco suíno em diferentes estágios ao longo do processo de DCD OHT. (A) Após a morte circulatória controlada, o aloenxerto do doador é distendido, isquêmico e edemaciado. A ponta da seta branca mostra a cânula da raiz da aorta. (B) Uma vez que o aloenxerto é explantado do doador, ele é colocado no dispositivo EVP para perfusão ex vivo . Observe a orientação do coração, com o aspecto posterior voltado para fora. A ponta da seta preta aponta para o adaptador aórtico usado para conectar o aloenxerto ao dispositivo. (C) Após o implante no receptor, o aloenxerto é reperfundido na circulação extracorpórea por uma hora antes do desmame da CEC. A ponta da seta branca mostra a cânula aórtica; setas brancas apontam para as cânulas venosas bicavais. EVP = perfusão ex vivo ; CEC = circulação extracorpórea. Clique aqui para ver uma versão maior desta figura.

Figura 3: Ecocardiografia epicárdica cardíaca. Durante todo o procedimento de DCD OHT, várias imagens ecocardiográficas epicárdicas foram adquiridas para avaliar a função ventricular. (A) Eixo curto padrão, (B) 4 câmaras e (C) 2 câmaras são mostradas aqui. VE = ventrículo esquerdo; AE = átrio esquerdo; VD = ventrículo direito; AR = átrio direito. Clique aqui para ver uma versão maior desta figura.

Figura 4: Fluxo de trabalho de coleta e processamento de amostras. Esquema de coleta e processamento de amostras em cada etapa do procedimento. hemograma completo = hemograma; CMP = perfil metabólico abrangente; PBMCs = células mononucleares do sangue periférico. Figura criada em BioRender. Clique aqui para ver uma versão maior desta figura.
| Período de tempo (min) | |
| (média ± DP; n = 4) | |
| Tempo desde a interrupção da ventilação até a declaração de óbito | 14.25 (2.6) |
| Duração da perfusão ex vivo | 147 (18) |
| Duração da CEC | 174 (4) |
| Tempo de grampo cruzado | 90 (12.5) |
| Tempo do desmame da CEC até o óbito | 50 (37) |
Tabela 1. Informações processuais. A duração média de cada etapa crítica no procedimento DCD HT. CEC = circulação extracorpórea.
Discussão
Apesar da eficácia do transplante cardíaco para o tratamento da insuficiência cardíaca terminal, persistem desafios significativos neste campo. Para combater a disponibilidade limitada de órgãos de doadores, os avanços nos métodos de preservação de aloenxertos cardíacos (por exemplo, perfusão normotérmica por máquina) ganharam destaque nos últimos anos. Esses avanços levaram à adoção do transplante de aloenxertos cardíacos após doação após morte circulatória (DCD HT). Embora a utilização de aloenxertos DCD HT tenha expandido o pool de doadores e tenha resultados de curto prazo que não são inferiores aos aloenxertos DBD HT, permanece um risco de aproximadamente 5% de mortalidade peri-transplante precoce associada a ambos os tipos de doadores3. O risco de mortalidade precoce no transplante cardíaco é impulsionado predominantemente pelo PGD. Embora o PGD seja multifatorial na etiologia com alguma contribuição de variáveis definidas de doador, receptor e preservação, os mecanismos moleculares subjacentes ao PGD permanecem geralmente pouco compreendidos. Além disso, dada a lesão isquêmica quente adicional incorrida pelo processo DCD HT, não é surpreendente que esses corações, em comparação com os aloenxertos DBD, possam estar em maior risco de PGD. Portanto, uma melhor compreensão do PGD é importante para ajudar a reduzir o risco de mortalidade em curto prazo após o transplante cardíaco ortotópico, e isso pode ser particularmente verdadeiro para o TDC HT.
Aqui, descrevemos um modelo cirúrgico suíno de alta fidelidade de DCD HT. Os benefícios da modelagem do DCD HT in vivo em um modelo animal de grande porte incluem não apenas a capacidade de entender melhor as alterações fisiopatológicas que ocorrem em um aloenxerto obtido durante o DCD HT, mas também a capacidade de testar intervenções direcionadas destinadas a garantir a qualidade ideal do aloenxerto. A avaliação da função ventricular esquerda pós-implante e a análise da alça pressão-volume sugerem que este modelo cirúrgico suíno é capaz de recapitular a disfunção precoce do aloenxerto cardíaco após DCD HT. Assim, a técnica detalhada aqui cria um modelo animal grande reprodutível de PGD após DCD HT e é passível de avaliar estratégias terapêuticas em muitos pontos ao longo do processo DCD HT. De fato, o uso da perfusão ex vivo como meio de fornecer novas terapêuticas, como a terapia gênica mediada por vetores virais, é uma área ativa de foco em nosso laboratório e em outros 18,19,20. Demonstramos anteriormente a capacidade de entregar de forma robusta e homogênea um transgene a um aloenxerto cardíaco usando um modelo HT suíno não DCD; as mesmas técnicas podem ser aplicadas a um modelo de TDC HT 19,20. Outras estratégias terapêuticas potenciais incluem modificação química do perfusato, entrega de pequenas moléculas com o objetivo de diminuir o estresse oxidativo, fornecer substratos metabólicos para apoiar o metabolismo durante o período isquêmico, etc 16,21,22. Além disso, o modelo aqui apresentado pode ser facilmente adaptado para avaliar diferentes variáveis associadas ao TDC HT, incluindo as diferentes técnicas de aquisição utilizadas clinicamente. Por exemplo, descrevemos uma estratégia de aquisição direta e perfusão ex vivo; no entanto, o modelo pode ser facilmente adaptado para incorporar métodos alternativos de perfusão por aquisição, incluindo perfusão regional normotérmica.
A técnica cirúrgica empregada neste modelo reflete de perto a usada no ambiente clínico; no entanto, existem algumas diferenças importantes. Primeiro, a esternotomia e a exposição cardíaca ocorrem antes da cessação do suporte cardiopulmonar, fase agonal, determinação de morte e período de afastamento eticamente exigido (modelo de tórax aberto)23. A esternotomia é feita nesta ordem para que a avaliação inicial do coração do doador, incluindo biópsias miocárdicas, possa ocorrer. A avaliação prévia do momento da esternotomia em um modelo suíno DCD HT demonstrou que a progressão da retirada das medidas de suporte à vida até a morte (tempo isquêmico quente) é mais rápida com alterações hemodinâmicas menos pronunciadas no modelo de tórax aberto; Esses aloenxertos podem sofrer condições menos prejudiciais durante a aquisição. No entanto, não houve diferenças significativas nos valores laboratoriais bioquímicos (lactato, glicose, catecolaminas, etc.) ou marcadores de morte celular entre os grupos de tórax fechado e aberto24. Além disso, devido à inclusão do período de afastamento de 10 minutos no modelo, o tempo desde a retirada da ventilação até a isquemia quente funcional neste modelo se assemelha mais ao momento do grupo de tórax fechado do estudo citado. Além disso, dentro desse modelo, o tempo de isquemia quente funcional é uma variável que pode ser modificada para se adequar aos objetivos experimentais de um estudo específico. Outra diferença potencial entre o modelo relatado aqui e o cenário clínico é que a atividade elétrica sem pulso (PEA; assistolia mecânica) é usada para definir a morte neste modelo. No contexto clínico, a declaração de óbito é feita por um médico que não está envolvido no processo de transplante; PEA, juntamente com a ausência de outros sinais de vida ou assistolia elétrica, seriam aceitáveis para atender aos critérios de declaração de óbito. Os corações suínos mantiveram a atividade elétrica por um período prolongado após a cessação da contratilidade. Para evitar danos isquêmicos quentes desproporcionais aos observados no contexto clínico, a assistolia mecânica (AEP) foi utilizada para definir o óbito. Para os investigadores que usam um modelo de tórax fechado de DCD, a atividade elétrica sem pulso (falta de pulsatilidade na linha arterial) ainda pode ser usada como critério definidor de morte. Não encontramos que a saturação periférica de oxigênio fosse um marcador relevante para definir o início do período agonal ou para definir o óbito.
Por fim, o que descrevemos aqui é um modelo que consome muito tempo e recursos. Desde a preparação do porco doador até a morte do animal receptor leva aproximadamente 10 horas e requer um grande esforço colaborativo. A equipe de procedimentos inclui cirurgiões cardíacos experientes, anestesiologistas cardíacos, perfusionistas e pessoal veterinário e de laboratório que ajudam na coleta e processamento de amostras. Uma grande equipe como essa é essencial durante o complexo procedimento de TDC HT. No entanto, com uma equipe experiente, é possível a criação de um modelo suíno de alta fidelidade de TDC HT, conforme descrito neste manuscrito.
Divulgações
CAM recebeu compensação em ações por atuar como consultor da TransMedics Inc.
Agradecimentos
Agradecemos ao suporte técnico veterinário da Duke Laboratory Animal Resources, ao suporte de perfusão da Centrifugal Solutions e às equipes de anestesia cardiovascular da Duke por seu inestimável apoio a esses experimentos cirúrgicos. Também agradecemos sinceramente a Paul Lezberg e à TransMedics, Inc. por seu apoio.
Materiais
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
Referências
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados