Method Article
循环死亡后捐献后原位心脏移植的高保真猪模型
* 这些作者具有相同的贡献
摘要
这里的方案描述了一种高保真猪模型,即循环死亡后利用同种异体移植物 的离体 灌注进行心脏移植。
摘要
由于缺乏合适的器官供体,可以接受心脏移植的晚期心力衰竭患者的数量受到限制。在扩大供体库的努力中,已经开发了替代捐赠和获取方法,包括循环死亡后捐献后的心脏移植 (DCD HT)。虽然 DCD HT 后的短期生存率不劣于使用脑死亡供体进行心脏移植,但与 DCD HT 同种异体移植物相关的原发性移植物功能障碍 (PGD) 的发生率可能会增加。PGD 的潜在病因是多因素的,尚不完全清楚。对于 DCD HT 同种异体移植物,DCD 采购过程中的热缺血损伤期是 PGD 的潜在危险因素,而脑死亡同种异体移植物未暴露于其中。因此,功能性热缺血时间可能是 DCD HT 中 PGD 的重要驱动因素。然而,在分子水平上,对这种临床情况下 PGD 的潜在机制知之甚少。本文介绍的工作旨在描述 DCD 原位心脏移植的高保真非存活猪模型的开发和验证。我们假设这种转化大型动物模型的使用对于阐明导致 PGD 的分子机制以及研究旨在优化同种异体移植物保存和早期性能的干预措施至关重要。该模型在临床上复制了 DCD HT 中使用的围手术期和手术方法,并根据猪的解剖学和生理学进行了修改。这种大型动物手术模型的开发不仅将为 PGD 的发展提供机制见解,而且可以进行修改以加强旨在改善 DCD HT 后器官恢复的转化研究工作。
引言
对于药物治疗难治的终末期心力衰竭患者,心脏移植仍然是与最佳长期生存率和生活质量相关的治疗方法。从历史上看,心脏移植需要使用从脑死亡供体 (DBD HT) 处获得的同种异体心脏移植物,并在低温静态储存下运输。然而,需要心脏移植的患者人数超过了可用的供体数量。虽然全球每年进行 5,000 多例心脏移植手术,但据估计,有 50,000 名候选人正在等待心脏移植1。此外,来自已确定供体的器官的利用率仍然低至 30%2。为了提高供体器官的利用率,近年来开发了替代捐赠和获取方法,包括循环死亡后捐赠后的心脏移植 (DCD HT)3,4,5,6。
DCD HT 供体不符合正式的脑死亡标准,但存在不可恢复的神经损伤,持续的医疗护理被认为是徒劳的。在购买 DCD HT 期间,应撤回维持生命的措施,并监测患者是否进展为呼吸暂停和循环停止。在这些情况下,死亡是由不参与移植或器官获取过程的医生宣布的。一旦宣布死亡,将有一个额外的对峙期(通常为 5 分钟),观察潜在捐献者以确保没有恢复或生命迹象,之后在进行器官获取之前再次确认死亡宣布 7,8。因此,DCD 同种异体移植物暴露于可变的热缺血时间(至少 10 分钟),而 DBD 供体同种异体移植物不会暴露于其中。这段热缺血期以前阻止了 DCD 供体的心脏移植。然而,在过去五年中,开发了两种采购再灌注方法,用于与 DCD 相关的热缺血时间后的同种异体移植物恢复。首先,直接获取和灌注 (DPP) 涉及在确认循环系统死亡后进行供体心脏切除术,然后进行同种异体移植物复苏和离体灌注保存。或者,常温区域灌注 (NRP) 在心脏切除术前使用排除脑循环的体外循环来原位再灌注和恢复供体心脏 9,10,11,12。
到目前为止,与 DCD HT 相关的短期生存率与 DBD HT 观察到的生存期相似。然而,早期研究还表明,与 DBD HT3 相比,DCD HT 发生严重原发性移植物功能障碍 (PGD) 的风险更高。PGD 是一个术语,用于描述心脏移植后早期同种异体移植物功能不足以满足受者的循环需求的临床情况。国际心肺移植学会描述了一种对 PGD 严重程度进行分级的系统。在严重的 PGD 中,需要机械循环支持来支持移植后期间的充足循环13。这种情况是心脏移植术后早期死亡的主要驱动因素。DBD HT 和 DCD HT 的 PGD 病因知之甚少,但可能是多因素的,供体、保存和受体变量都有影响。对于 DCD 同种异体移植物,DCD 采购过程中的温缺血性损伤,以及有害的供体特异性反应,包括血流动力学不稳定、代谢紊乱以及儿茶酚胺、细胞因子、乳酸和钾的激增,是可能导致 PGD 风险增加的因素与 DBD 同种异体移植物相比。 14,15,16。然而,在分子水平上,对这种临床情况下 PGD 的潜在机制知之甚少。此外,也许是由于这些担忧,DCD 心脏下降的可能性是 DBD 器官的 3.37 倍17。因此,通过优化器官保存过程来提高器官利用率和改善移植结果的需求仍未得到满足。
在这项研究中,我们描述了一种使用 DPP 的猪 DCD HT,它以高保真度反映了当前的临床 DPP DCD HT。该模型包括整个 DCD 移植过程的要素:1) DCD 采购,2) 器官护理系统 (OCS) 的 离体 灌注保存,以及 3) 受体植入。这个全面的模型为更好地表征 DCD HT 中 PGD 的潜在机制提供了机会。然后,这允许开发靶向和合理的治疗策略,旨在改善同种异体移植物的保存和性能。此外,该模型为此类新型疗法的临床前评估提供了一个平台,这对于帮助以安全和快速的方式推进心脏移植领域非常重要。
研究方案
所有饲养和程序均由杜克大学医学中心的机构动物护理和使用委员会根据其法规和指南批准。
1. 术前供体准备
- 选择两头血型匹配的约克郡猪,体重为 70-80 公斤(由美国北卡罗来纳州 Granite Falls 的 Looper Farms 进行血型鉴定)。手术前让两头猪禁食至少 6-8 小时。
- 根据制造商的指南和必要的即时检测(材料表)准备心脏灌注模块。
- 准备心脏灌注模块的维护溶液。该解决方案含有代谢活跃的心脏的营养物质以及腺苷,以帮助维持目标血压。
- 添加以下内容:500 mL 透明启动液、100 mL 25% 白蛋白、100 mg 环丙沙星 (200 mg/100 mL)、两瓶 5 mL 多种维生素注射液、20mEq 碳酸氢钠、1 g 头孢唑啉钠和 250 mg 甲泼尼龙。加标启动溶液并将内容物添加到心脏灌注模块中。
- 准备好后,将 50 IU 人重组胰岛素注射到袋子中。
- 通过将 0.25 mg 肾上腺素和 30 IU 人重组胰岛素注射到 500 mL 袋中(含 5% 葡萄糖)的水溶液中来制备肾上腺素溶液。该溶液旨在替代儿茶酚胺,而不是具有正性肌力作用。以 10 mL/h 的速度注入溶液。
- 通过将 200 μg 重构的左旋甲状腺素注入 100 mL 0.9% 生理盐水袋中来制备 T4 溶液。以 3 mL/h 的速度注入。
- 准备心脏灌注模块的维护溶液。该解决方案含有代谢活跃的心脏的营养物质以及腺苷,以帮助维持目标血压。
- 用 4.4 mg/kg 的 Telazol 和 1.0 mg/kg 的异丙酚镇静指定的供体猪,然后用面罩输送 2%-5% 吸入异氟醚。
- 当猪处于仰卧位时,用 8-10 毫米气管插管插管,以在手术期间维持气道。将气管插管固定到鼻子上。在手术过程中将兽药膏涂抹在眼睛上以保持眼部润滑。
- 将静脉内 (IV) 导管插入耳静脉以注入静脉输液(维持液:乳酸林格液 10 mL/kg/h)。
- 开始连续输注芬太尼镇痛 (25-100 μg/h) 并给予 0.2 mg/kg 维库溴铵以维持麻痹。
- 放置心电图导线和脉搏血氧仪,以持续监测电活动和氧合。
- 以 10 mL/kg/min 的潮气量、每分钟 10-15 次呼吸的速率开始机械通气,并在手术的剩余时间内维持异氟醚 (1%-5%)。滴定麻醉剂和血管活性药物,使反射消失,心率保持 61-99 bpm,收缩压保持 90-130 mmHg。
- 将猪放在手术台上,上肢位于头侧并固定在手术区域外。将下肢固定在手术区域外。
- 定义下颌上方、两侧腋前线和下方剑突下方两指宽要包含在手术区域的区域。按照标准做法无菌准备和覆盖手术部位。
- 进行右侧颈动脉切断术。
- 使用 #10 刀片,沿着胸锁乳突肌的内侧缘,在气管外侧做一个右侧颈部斜切口,两指宽。
- 用电烙术将这个切口向下穿过颈阔肌,确保止血。穿过颈阔肌后,使用自固定牵开器来帮助暴露。
- 仔细解剖并隔离颈动脉和颈内静脉;在每个容器周围放置一个容器环。
- 局部涂抹 10 mL 2% 利多卡因以沐浴血管。
注意:利多卡因因其血管舒张作用而被使用,因为猪血管很容易在作时痉挛并且难以插管。 - 使用 Seldinger 技术,先用 5 Fr 显微穿刺直接插管颈动脉,然后用 6 Fr 导引鞘插管。
- 将导引器鞘连接到动脉管路和传感器,以便在手术过程中持续监测全身动脉压。
- 从颈动脉动脉线抽血进行术前实验室血液检查(全血细胞计数、综合代谢组、肌钙蛋白、乳酸和用于外周血单核细胞分离的全血)。
- 使用与 1.11.5 相同的技术插管颈内静脉。将 6 Fr 护套留在原位,因为这将用于引入压力-体积环形导管以进行下游功能评估。
2. 循环死亡和供体心脏切除术后的捐献
- 进行胸骨切开术。
- 使用 #10 刀片,从胸骨切迹到剑突做一个纵向切口。使用电烙术,将夹层向下穿过皮下组织和胸大肌筋膜。
- 用电烙术在胸骨中线划痕。解剖柄处和剑突周围的韧带附着物。
- 使用摆动的胸骨锯沿中线小心地划分胸骨前部。使用摆动锯在柄水平完全分割胸骨后桌。在此步骤中要注意避免损伤无名静脉。使用一把沉重的剪刀完成柄下方后表的胸骨分割。
注意:手动钝性解剖胸骨下侧和心包之间的平面有助于避免在此步骤中对心脏造成伤害。 - 使用电烙术进行胸骨边缘止血。放置胸骨牵开器。
- 用电烙术去除胸腺和心包脂肪垫组织,以优化心包的暴露。
- 用电烙术小心地打开心包。将切口从心尖纵向移植到主动脉水平。
- 用 2-0 丝绸斜纹缝合创建一个心包孔。
- 进行基线供体同种异体移植物分析。
- 当供体心脏暴露时,在进行任何直接心脏作之前,进行基线分析。这些检查包括直接心外膜超声心动图、压力-容积环评估和心肌空心针活检。
- 以无菌方式进行超声心动图检查,直接从心外膜表面获得标准的长轴和短轴视图。
- 为了进行压力-容积回路记录,将固态压力-容积导管(5Fr,122 cm)依次引入颈动脉和颈内静脉,分别进入左心室和右心室。
- 在插入护套之前,测量要从外部(从插管部位到心脏顶点)引入的导管的长度。
- 将导管引入动脉鞘,使用心外膜超声将其引导至左心室。确保导管不直接接触心室壁,因为这可能会干扰测量精度。
- 接下来,使用直接触诊或心外膜超声引导,将导管引入静脉鞘,将其引导至右心室。
- 进行空芯针心肌活检,以收集组织以供日后分析。在左心室的心尖执行此作。如果活检部位有大量出血,请进行修复缝合。
- 准备供体心脏。
- 解剖主动脉肺窗,为交叉夹放置留出空间。
- 用电烙术圆周解剖上腔静脉 (SVC) 和下腔静脉 (IVC)。
- 为了抗凝,在主动脉插管前静脉注射 (IV) 300 单位/kg 的肝素。
- 使用双臂 4-0 聚丙烯缝合线将主动脉荷包线放入主动脉根部进行主动脉插管。用 7 Fr (14G) 主动脉根部通风套管插管插管。
- 使用 Rumel 止血带脱气并固定到位。冲洗心脏停搏管以脱气并将导管固定到主动脉根套管上。
- 接下来,为了为未来的静脉插管做准备,在右心耳中放置一个钱包针,并用 Rumel 止血带固定。
- 进行受控循环死亡。
- 提供 250 μg 芬太尼静脉推注,然后以 100 μg/h 的速度持续速率输注 (CRI) 用于镇痛。为了麻痹,静脉内施用 0.2 mg/kg 维库溴铵。
- 停止机械通气以开始受控循环死亡过程。
- 持续监测收缩压和平均动脉压、动脉线搏动、心脏电活动和氧合状态。
注意:当收缩压低于 50 mmHg 时,激动期开始。此时,心脏可能会膨胀。死亡定义为机械性心脏停搏(无脉性电活动)且无生命迹象。本研究并未定义该模型中因电心脏停搏而死亡,因为猪体内缓慢无脉电活动持续的时间比在人类中观察到的要长,这可能导致同种异体移植物缺血性损伤增加,而不是该模型的预期。 - 在死亡/心搏停止后等待 10 分钟,然后再继续执行协议的以下步骤。该间隔模拟对峙期加上临床 DCD HT 中纵隔进入和准备所需的时间。
- 进行 离体 灌注装置灌注。
- 使用 #11 刀片,在右心耳切开一个切口,并使用制造商提供的 34Fr 静脉插管插管。用 Rumel 止血带固定套管,并将套管连接到 离体 灌注装置的收集袋。
- 将大约 1200-1500 mL 的供体血液收集到制造商提供的收集袋中。在放血之前,将 30,000 U 肝素和 2 mg 盐酸替罗非班添加到收集袋中。
- 过滤供体血液并将其输送到心脏灌注模块中。
- 进行供体心脏切除术。
- 采集供体血液后,应用主动脉夹闭术。
- 请注意,猪主动脉根部和升主动脉比人类短得多。注意尽可能在近端应用十字夹,以避免夹住牙弓或不完全阻塞主动脉。
- 将 1 L Del Nido 心脏麻痹注射到主动脉根部,目标根部压力为 60-100 mmHg。
- 在心脏停搏分娩期间,横切心包反射处的下腔静脉和左心耳,以排出右心室和左心室。
- 将冷的无菌雪泥放在供体心脏上。
- 将 IVC、SVC、无名动脉远端的主动脉和分叉处的肺动脉 (PA) 分开。横切供体左心房 (LA),在同种异体移植物上留下足够的组织袖带。
- 将心从田间取出,放入装满无菌冷雪泥的盆中,以便为后桌做准备。
- 将四根等距的水平床垫缝合线(4-0 聚丙烯)放在主动脉远端内。
- 采集供体血液后,应用主动脉夹闭术。
- 离体灌注
- 将 离体 灌注主动脉适配器放入远端主动脉中,并用 0-0 丝缝线或脐带紧紧固定,该缝合线位于固定缝合线下方。
- 在 离体 灌注装置上时,保持 PA、SVC、IVC 和心房开放。
注意:在这种配置下,没有遇到左心室扩张。 - 将同种异体移植物运输到 离体 灌注装置并连接主动脉适配器。确保心脏的后表面朝前。确保心脏的前表面与设备和两个除颤垫接触。将同种异体移植物保持在 34 °C。 根据需要进行除颤,以使任何室性心律失常恢复到有组织的心律。
- 此时,可以通过心脏停搏端口将治疗药物引入离体灌注回路。或者,可以修改灌注液或物理回路以评估旨在提高 DCD HT 同种异体移植物恢复的实验条件。例如,我们之前已经证明,需要通过细胞保护剂洗涤灌注液中预先形成的中和抗体,以增强病毒载体 18,19,20 的转导。
- 根据需要,使用即时实验室指导碳酸氢钠、葡萄糖酸钙和葡萄糖的给药。
- 在此 离体 灌注阶段获取灌注液样本、血液检查和空芯针活检样本。
注意:在该模型中,同种异体移植物在植入受体之前在 离体 灌注装置上保留约 2-3 小时(表 1)。同种异体移植物离 体 灌注的时间长度取决于准备受体动物植入所需的时间长度。然而, 离体 灌注时间是一个可以根据研究目标进行调整的变量。
3. 受者心脏切除术、植入和再灌注
- 按照步骤 1.3-1.11.8 中的说明准备接收者 pig。
- 此外,使用超声引导和 Seldinger 技术将一根 7 Fr 20 cm 三腔中心线导管放入左颈外静脉或颈内静脉。使用超声引导放置一条 5 Fr 股动脉线。
- 覆盖无菌区域后,准备体外循环 (CPB) 回路并将线路带到区域。
- 通过 CPB 动脉和静脉管路再循环以脱气。夹紧并分割线条。准备用于双腔静脉插管的静脉导管。
- 术前给予 1 克甲泼尼龙,以解决因排斥反应或缺血引起的任何炎症反应,就像在进行本研究的机构进行临床心脏移植时所做的那样。
- 按照前面步骤 1.11 和 2.1 中描述的进行右颈动脉切开术和中线胸骨切开术。
- 进行受者心脏切除术。
- 像以前一样解剖主动脉肺窗。解剖 SVC 和 IVC,并在血管周围放置圆周脐带。
- 插管前,给予 400 单位/kg 的肝素。滴定至活化凝血时间 (ACT) 的目标> 480 秒。
- 在远端升主动脉中放置标准主动脉插管荷包缝合线(使用双臂 2-0 涂层编织聚酯缝合线)。用 Rumel 止血带和止血钳固定。
- 确保收缩压低于 120 mmHg。使用 #11 刀片在钱包绳内做一个全层刺切开。通过这个切口用 15 Fr 套管插管主动脉。用 Rumel 止血带将套管固定到位。
- 夹住主动脉插管。将动脉旁路管路脱气后,将主动脉插管连接到 CPB 回路。确保管路中没有气泡。
- 制作另一根主动脉钱包绳并插入主动脉根部通风套管。
- 使用双腔静脉技术进行静脉插管,在 SVC 和 IVC 中使用 18-20 Fr 直角金属尖端插管,并用 Rummel 止血带固定。然后,将这些插管连接到 CPB 回路的静脉肢。
- 将 CPB 起始至 2.4 L/min/m2 的目标流量并冷却至 32 °C。 调整麻醉剂和血管加压药,以维持平均动脉压> 60 mmHg。
注意:这些程序由董事会认证的心胸麻醉师和认证灌注师执行,他们在整个 CPB 运行过程中监测和协调血流动力学管理。 - 将主动脉夹钳夹应用于主动脉插管的近端,并继续解释受体的自体心脏。保持完整的右心房和左心房袖带足够大,以便于双心房植入技术。
注意:该模型使用双心房技术,因为猪脉管系统非常脆弱,这使得 IVC 和 SVC 血管吻合术在双腔静脉技术中具有技术挑战性。 - 尽可能靠近根部横切主动脉和 PA,以保持最大的血管长度。将新移植的心脏放入冰冷的磷酸盐缓冲盐水 (PBS) 中,以便在实验室中运输和处理。
- 进行受者同种异体移植双心房植入术。
- 按照制造商的说明冷却 离体 灌注装置上的同种异体移植物。在从设备中取出之前,再次施用 1 L 冷 Del Nido 心脏停搏以缓解心脏停搏。
- 断开主动脉适配器的连接,将心脏装在一盆无菌的冷泥中输送到后桌。
- 检查心脏是否有任何卵圆原发窝未闭 (PFO) 或意外损伤部位。
注意:重要的是,在猪中,通常有一条体循环静脉沿着左心房边界引流,然后引流到右心房或 IVC。这条静脉可以在采购过程中打开,应注意确保在进行植入之前将其结扎。 - 将主动脉修剪回衔接器固定部位下方的健康组织。
- 使用 Metzenbaum 剪刀修剪左心房开口以匹配受者 LA 袖带的大小。对右心房执行相同作。
- 以双臂 4-0 Prolene 缝合线以跑步方式开始左心房吻合术。继续进行右 PA、主动脉和右心房吻合,也全部以连续 4-0 prolene 缝合完成。
- 在移除主动脉夹钳之前开始复温至正常体温 (37 °C)。
- 进行同种异体移植物再灌注并脱离 CPB。
- 完成所有吻合后,松开主动脉夹钳以重新灌注同种异体移植物。
- 确保所有吻合口的止血。
- 等待原生节奏和收缩的回归。放置心外膜起搏线,如果同种异体移植心率为 <100 次/分,则以 100 次/分的速度起搏。
- 再灌注 60 分钟后,尝试从 CPB 撤机。接受者需要 0.05 μg/kg/min 的肾上腺素以及血管加压药输注,以维持平均动脉压 (MAP) >65 mmHg。
- 在早期和晚期再灌注时间点进行超声心动图、血液检查、心肌活检和压力-容量环评估等分析。
4. 实验终止和安乐死
注意:在本研究中,移植受体动物在与 CPB 分离后支持 1 小时。
- 实验完成后,通过在麻醉下放血进行安乐死。
- 通过沿所有吻合口横切缝合线来移植移植的同种异体移植物。注意不要在同种异体移植物标本中加入任何天然受体组织。
- 立即将同种异体移植物放入冰冷的 PBS 中,并将其运送到实验室进行加工和储存。
结果
使用此处描述的方案进行了总共 6 例猪 DCD 移植进行初步分析。在这六次试点实验的过程中,对协议的组成部分进行了改进,以更好地满足模型的需求,提高可重复性,并考虑物流限制。 图 1 总结了最终的协议,如此处所述。
与人类控制的循环死亡过程不同,猪心脏缺血后维持电活动的时间比预期的要长得多,即使在收缩停止后也是如此。在第一次实验中认识到这种差异后,电心脏停搏被认为是不可靠的死亡宣告量度。为了避免对同种异体移植物的热缺血损伤与临床环境中看到的不成比例,使用机械心脏停搏 (无脉性电活动) 来确定其余移植手术的死亡时间。
此外,对峙期最初为进行供体心脏切除术前 15 分钟。这被用于试验集的前三个实验。这个 15 分钟的热缺血期的部分基本原理是,我们的目标是造成足够严重的损伤,以达到适合研究的移植后移植物功能障碍程度。我们发现这些早期实验中的移植物功能障碍非常严重,以至于我们在与 CPB 分离后难以维持受体动物一小时,因此受体动物需要高剂量的正性肌力药和升压药支持才能满足 1 小时的时间点。鉴于这些困难,我们将热缺血性损伤的时间减少到 10 分钟,这更接近于离 体 灌注的临床 DCD HT。 图 2 描绘了同种异体移植物在此阶段以及 离体 灌注期间和植入后的代表性图像。最后,在 CPB 脱机后阶段调整血管加压药和正性肌力药输注的滴定,以支持新移植的心脏。需要一支具有心血管麻醉学特定专业知识的经验丰富的团队来提高 CPB 后阶段的成功率怎么强调都不为过。
在 6 个实验中的 4 个实验中跟踪了手术时间,并在 表 1 中进行了总结。在方案的 DCD 采购阶段,从供体猪停止维持生命措施到宣布死亡的经过时间为 14.25 (+/- 2.6) 分钟。手术体外循环时间和夹闭时间在整个试点实验中保持一致,分别约为 3 h 和 1.5 h。实验在与 CPB 分离后约 1 小时以安乐死结束。安乐死时动物的稳定性存在差异。一些动物表现出相对良好的稳定性,只有轻微的移植物功能障碍,而另一些动物表现出明显的血流动力学不稳定和严重的移植物功能障碍。代表性的静止超声心动图显示如图 3 所示。这项和其他功能评估,例如 PV 环,可用于确定同种异体移植物功能与基线以及引入治疗干预前后的差异。
通过实验收集、处理和储存的样品摘要如图 4 所示。立即将移植的心脏放入冰冷的 PBS 中,并储存在实验室中用于组织和分子分析。受者的自体心脏被用作对照,而移植的同种异体移植物作为实验组织储存。心形从顶端到基部切成 4 个横截面。从这些中,每个腔室(左心室、右心室、隔膜和两个心房)的代表性组织样品在液氮中快速冷冻并储存在 -80 °C 以备将来分析。同样,来自每个水平和腔室的代表性组织样本在 RNAlater 中孵育并快速冷冻。剩余的组织样本保存在福尔马林中用于组织病理学分析。从任何时间点采集血样一式两份,并储存在 EDTA 或 CPT 管中。储存在 EDTA 管中的血液被旋转以分离血浆,血浆被快速冷冻。使用 CPT 管供应商提供的修改后的方案处理 CPT 管中的血液以进行 PBMC 检测。

图 1:猪 DCD HT 协议示意图。此处描述了猪 DCD HT 手术中发生的事件时间线。在这项初步研究中,进行了 6 例 DCD HTs。对供体猪心脏同种异体移植物进行基线心肌评估,之后开始受控循环死亡。宣布死亡后,有 10 分钟的对峙期。然后将同种异体移植物移植并运输到离体灌注装置,在那里再灌注 2-3 小时。在受体动物制备后,用双心房技术植入供体同种异体移植物。在 CPB 上再灌注 1 小时后,受体脱离旁路支持。安乐死发生在与 CPB 分离后 1 小时。然后对植入的同种异体移植物进行处理以进行组织分析。DCD HT = 循环死亡后捐献后的心脏移植;CPB = 体外循环。请单击此处查看此图的较大版本。
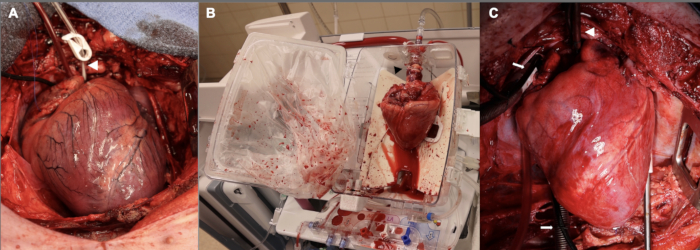
图 2:DCD OHT 过程不同阶段的猪同种异体心脏移植物。(A) 受控循环死亡后,供体同种异体移植物膨胀、缺血和水肿。白色箭头表示主动脉根套管。(二) 从供体中移植出同种异体移植物后,将其放置在 EVP 装置上进行离体灌注。注意心脏的方向,后部朝外。黑色箭头指向用于将同种异体移植物连接到装置的主动脉适配器。(C) 植入受者体内后,同种异体移植物在脱离 CPB 之前通过体外循环再灌注 1 小时。白色箭头表示主动脉套管;白色箭头指向双腔静脉插管。EVP = 离体灌注;CPB = 体外循环。请单击此处查看此图的较大版本。

图 3: 心脏外膜超声心动图。 在整个 DCD OHT 手术过程中,采集了多个心外膜超声心动图图像以评估心室功能。此处显示了标准短轴、(B) 4 腔和 (C) 2 腔视图。LV = 左心室;LA = 左心房;RV = 右心室;RA = 右心房。 请单击此处查看此图的较大版本。

图 4:样本采集和处理工作流程。程序每个步骤的样本采集和处理示意图。CBC = 全血细胞计数;CMP = 综合代谢组;PBMC = 外周血单核细胞。在 BioRender 中创建的图窗。请单击此处查看此图的较大版本。
| 时间长度 (min) | |
| (均值 ± SD;n = 4) | |
| 从停止通气到宣布死亡的时间 | 14.25 (2.6) |
| 离体灌注持续时间 | 147 (18) |
| CPB 持续时间 | 174 (4) |
| 交叉夹持时间 | 90 (12.5) |
| 从 CPB 脱机到死亡的时间 | 50 (37) |
表 1. 程序信息。 DCD HT 程序中每个关键步骤的平均持续时间。CPB = 体外循环。
讨论
尽管心脏移植治疗终末期心力衰竭有效,但该领域仍然存在重大挑战。为了解决供体器官可用性有限的问题,近年来,同种异体心脏移植物保存方法(例如,常温机器灌注)的进步已走在前列。这些进步导致了循环死亡后捐献后心脏同种异体移植物移植 (DCD HT) 的采用。虽然使用 DCD HT 同种异体移植物扩大了供体库并且具有不劣于 DBD HT 同种异体移植物的短期结果,但与两种供体类型相关的早期移植期死亡风险仍约为 5%3。心脏移植的早期死亡风险主要由 PGD 驱动。虽然 PGD 的病因是多因素的,并且有明确的供体、受体和保存变量的一些贡献,但 PGD 的分子机制通常仍然知之甚少。此外,鉴于 DCD HT 过程引起的额外温缺血损伤,与 DBD 同种异体移植物相比,这些心脏可能具有更高的 PGD 风险也就不足为奇了。因此,更好地了解 PGD 对于帮助降低原位心脏移植后的短期死亡风险非常重要,对于 DCD HT 来说可能尤其如此。
在这里,我们描述了 DCD HT 的高保真猪手术模型。在大型动物模型中对体内 DCD HT 进行建模的好处不仅包括能够进一步了解在 DCD HT 期间购买的同种异体移植物中发生的病理生理变化,还包括能够测试旨在确保最佳同种异体移植物质量的靶向干预措施。植入后左心室功能的评估和压力-容积环分析表明,这种猪手术模型能够概括 DCD HT 后的早期心脏同种异体移植物功能障碍。因此,此处详述的技术在 DCD HT 后创建了一个可重复的 PGD 大型动物模型,并且适用于在 DCD HT 过程中的许多点评估治疗策略。事实上,使用离体灌注作为提供新疗法(例如病毒载体介导的基因疗法)的手段是我们实验室和其他实验室的一个活跃关注领域 18,19,20。我们之前证明了使用猪非 DCD HT 模型将转基因稳健、均匀地递送到心脏同种异体移植物的能力;相同的技术可以应用于 DCD HT 型号19,20。其他潜在的治疗策略包括灌注液的化学修饰、旨在减少氧化应激的小分子递送、提供代谢底物以支持缺血期的新陈代谢等 16,21,22。此外,本文提出的模型可以很容易地用于评估与 DCD HT 相关的不同变量,包括临床上使用的不同采购技术。例如,我们描述了一种直接采购和离体灌注策略;然而,该模型可以很容易地适应纳入替代的获取灌注方法,包括常温区域灌注。
该模型采用的手术技术与临床环境中使用的手术技术非常相似;但是,存在一些关键差异。首先,胸骨切开术和心脏暴露发生在停止心肺支持、激动期、确定死亡和道德规定的对峙期(开胸模型)之前23。胸骨切开术按此顺序进行,以便进行基线供体心脏评估,包括心肌活检。在 DCD HT 猪模型中对胸骨切开术时间的先前评估表明,从撤回维持生命措施到死亡(热缺血时间)的进展更快,在开胸模型中伴随着不太明显的血流动力学变化;这些同种异体移植物在采购过程中可能会经历较小的损害条件。然而,闭胸组和开胸组之间的生化(乳酸、葡萄糖、儿茶酚胺等)实验室值或细胞死亡标志物没有显着差异24。此外,由于模型中包含了 10 分钟的对峙期,该模型中从撤出通气到功能性热缺血的时间更接近于引用研究的闭胸组的时间。此外,在这个模型中,功能性热缺血的时间是一个变量,可以修改以适应特定研究的实验目标。此处报告的模型与临床环境之间的另一个潜在差异是,在该模型中,无脉性电活动 (PEA;机械性心脏停搏) 用于定义死亡。在临床情况下,死亡声明是由不参与移植过程的医生做出的;PEA 以及没有其他生命体征或电心脏停搏,都可以接受以满足死亡宣布的标准。猪心脏在收缩停止后长时间保持电活动。为了避免与临床环境中看到的不成比例的热缺血性损伤,使用机械性心脏停搏 (PEA) 来定义死亡。对于使用 DCD 闭胸模型的研究人员,无脉性电活动(动脉线无脉动)仍可用作死亡定义标准。我们没有发现外周血氧饱和度是定义痛苦期开始或定义死亡的相关标志物。
最后,我们在这里描述的是一个时间和资源密集型模型。从准备供体猪到受体动物死亡大约需要 10 小时,并且需要大量的协作努力。手术团队包括经验丰富的心脏外科医生、心脏麻醉师、灌注师以及帮助样本采集和处理的兽医和实验室工作人员。在 DCD HT 的复杂过程中,像这样的大型团队是不可或缺的。然而,如本手稿所述,凭借经验丰富的团队,可以创建 DCD HT 的高保真猪模型。
披露声明
CAM 因担任 TransMedics Inc. 的顾问而获得股票薪酬。
致谢
我们感谢杜克实验动物资源公司的兽医技术支持、离心解决方案的灌注支持以及杜克心血管麻醉团队对这些手术实验的宝贵支持。我们还衷心感谢 Paul Lezberg 和 TransMedics, Inc. 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
参考文献
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。