Method Article
מודל חזירי בנאמנות גבוהה של השתלת לב אורתוטופית לאחר תרומה לאחר מוות במחזור הדם
* These authors contributed equally
In This Article
Summary
הפרוטוקול כאן מתאר מודל חזירי בנאמנות גבוהה של השתלת לב לאחר תרומה לאחר מוות במחזור הדם תוך שימוש בזלוף ex vivo של האלוגרפט.
Abstract
מספר חולי אי ספיקת לב מתקדמת שיכולים לעבור השתלת לב מוגבל בגלל מחסור בתורמי איברים מתאימים. במאמצים להרחיב את מאגר התורמים, פותחו שיטות תרומה ורכש חלופיות, כולל השתלת לב לאחר תרומה לאחר מוות במחזור הדם (DCD HT). בעוד שהישרדות לטווח קצר לאחר DCD HT אינה נחותה מהשתלת לב עם תורמים מוות מוחי, ייתכן שיש שיעור מוגבר של תפקוד לקוי של השתל הראשוני (PGD) הקשור להשתלות DCD HT. האטיולוגיה הבסיסית של PGD היא רב-גורמית ולא מובנת לחלוטין. עבור השתלות DCD HT, תקופת הפגיעה האיסכמית החמה במהלך רכישת DCD היא גורם סיכון פוטנציאלי ל-PGD שאליו לא נחשפים השתלות מוות מוחי. הזמן האיסכמי החם התפקודי עשוי אפוא להיות מניע חשוב של PGD ב-DCD HT. עם זאת, המנגנונים העומדים בבסיס PGD בתרחיש קליני זה אינם מובנים היטב ברמה המולקולרית. העבודה המוצגת כאן נועדה לתאר את הפיתוח והאימות של מודל חזירי לא הישרדותי בנאמנות גבוהה של השתלת לב אורתוטופית DCD. אנו משערים כי השימוש במודל בעל חיים גדולים תרגומי זה הוא קריטי להבהרת מנגנונים מולקולריים התורמים ל-PGD, כמו גם לחקירת התערבויות שנועדו לייעל את שימור האלוגרפט וביצועים מוקדמים. מודל זה משכפל את הגישה הפרי-ניתוחית והכירורגית המשמשת ב-DCD HT מבחינה קלינית, עם שינויים כדי לקחת בחשבון את האנטומיה והפיזיולוגיה של חזירים. הפיתוח של מודל כירורגי זה של בעלי חיים גדולים לא רק יספק תובנות מכניסטיות לגבי התפתחות PGD, אלא גם ניתן לשנות אותו כדי לשפר את מאמצי המחקר התרגומי שמטרתם לשפר את התאוששות האיברים לאחר DCD HT.
Introduction
עבור חולים עם אי ספיקת לב בשלב הסופי העמיד לטיפול רפואי, השתלת לב נותרה הטיפול הקשור להישרדות ולאיכות החיים הטובה ביותר לטווח הארוך. מבחינה היסטורית, השתלת לב דרשה שימוש באלוגרפט לב שנרכש מתורם מת מוחי (DBD HT) והועבר תוך כדי שימור עם אחסון סטטי היפותרמי. עם זאת, מספר החולים הזקוקים להשתלת לב עולה על מספר התורמים הזמינים. בעוד שיותר מ-5,000 השתלות לב מבוצעות מדי שנה ברחבי העולם, ההערכה היא ש-50,000 מועמדים ממתינים להשתלת לב1. בנוסף, ניצול האיברים מתורמים מזוהים נותר נמוך עד 30%2. על מנת לשפר את ניצול האיברים של התורם, פותחו בשנים האחרונות שיטות תרומה ורכש חלופיות, כולל השתלת לב לאחר תרומה לאחר מוות במחזור הדם (DCD HT)3,4,5,6.
תורמי DCD HT אינם עומדים בקריטריונים הרשמיים של מוות מוחי אך יש להם פגיעה נוירולוגית שאינה ניתנת להחלמה שטיפול רפואי מתמשך עבורה נחשב חסר תועלת. במהלך רכישת DCD HT, נסוגים אמצעים מאריכי חיים, והמטופל נמצא במעקב אחר התקדמות לדום נשימה ודום דם. מוות במצבים אלה מוכרז על ידי רופא שאינו משתתף בתהליך ההשתלה או רכישת האיברים. לאחר ההכרזה על המוות, יש תקופת עיכוב נוספת (בדרך כלל 5 דקות) שבה התורם הפוטנציאלי נצפה כדי לוודא שאין החלמה או סימני חיים, ולאחר מכן ההכרזה על הפטירה מאושרת מחדש לפני המשך רכישת האיברים 7,8. השתלות DCD חשופות, אם כן, לתקופה משתנה של איסכמיה חמה (לפחות 10 דקות) שאליה לא נחשפים השתלות תורם DBD. תקופה זו של איסכמיה חמה הרתיעה בעבר את השימוש בהשתלת לב עם תורמי DCD. עם זאת, במהלך חמש השנים האחרונות פותחו שתי שיטות רפרפוזיה לרכש לשחזור אלוגרפט לאחר הזמן האיסכמי החם הקשור ל-DCD. ראשית, רכש ישיר וזלוף (DPP) כרוך בכריתת לב של תורם עם אישור מוות במחזור הדם, ולאחר מכן החייאה ושימור של אלוגרפט על ידי זלוף ex vivo. לחלופין, זלוף אזורי נורמותרמי (NRP) משתמש במחזור חוץ-גופי ללא הוצאת מחזור המוח כדי להחיות מחדש את לב התורם באתרו לפני כריתת הלב 9,10,11,12.
עד כה, ההישרדות לטווח קצר הקשורה ל-DCD HT הייתה דומה לזו שנצפתה עם DBD HT. עם זאת, מחקרים מוקדמים מצביעים גם על כך שיש סיכון גבוה יותר לתפקוד לקוי חמור של השתל הראשוני (PGD) עם DCD HT בהשוואה ל-DBD HT3. PGD הוא מונח המשמש לתיאור הנסיבות הקליניות שבהן, לאחר השתלת לב, תפקוד אלוגרפט מוקדם אינו מספיק כדי לענות על צרכי מחזור הדם של המקבל. מערכת לדירוג חומרת ה-PGD תוארה על ידי האגודה הבינלאומית להשתלות לב וריאות. ב-PGD חמור, נדרשת תמיכה מכנית במחזור הדם כדי לתמוך במחזור דם תקין בתקופה שלאחר ההשתלה13. מצב זה הוא המניע העיקרי לתמותה מוקדמת לאחר הניתוח לאחר השתלת לב. האטיולוגיה של PGD הן עבור DBD HT והן עבור DCD HT אינה מובנת היטב, אך סביר להניח שהיא רב-גורמית, כאשר משתני התורם, השימור והמקבל תורמים כולם. עבור השתלות DCD, הפגיעה האיסכמית החמה במהלך רכישת DCD, כמו גם תגובות מזיקות ספציפיות לתורם, כולל חוסר יציבות המודינמית, הפרעות מטבוליות ועלייה בקטכולאמינים, ציטוקינים, לקטט ואשלגן, הם גורמים מוצעים שעשויים לתרום לסיכון מוגבר ל-PGD בהשוואה להשתלות DBD. 14,15,16. עם זאת, המנגנונים העומדים בבסיס PGD בתרחיש קליני זה אינם מובנים היטב ברמה המולקולרית. בנוסף, אולי בשל חששות אלה, לבבות DCD הם בעלי סיכוי גבוה פי 3.37 להידלדלות מאשר איברי DBD17. כתוצאה מכך, עדיין קיים צורך שלא נענה לשפר את ניצול האיברים ולשפר את תוצאות ההשתלה על ידי אופטימיזציה של תהליך שימור האיברים.
במחקר זה, אנו מתארים DCD HT חזירי באמצעות DPP המשקף את ה-DPP DCD HT הקליני הנוכחי בנאמנות גבוהה. מודל זה כולל אלמנטים לאורך תהליך השתלת DCD: 1) רכישת DCD, 2) שימור זלוף ex vivo עם מערכת טיפול באיברים (OCS), ו-3) השתלת מקבל. מודל מקיף זה מספק הזדמנות לאפיין טוב יותר את המנגנונים העומדים בבסיס PGD ב-DCD HT. לאחר מכן זה מאפשר פיתוח של אסטרטגיות טיפוליות ממוקדות ורציונליות שמטרתן לשפר את שימור האלוגרפט וביצועיו. יתר על כן, מודל זה מספק פלטפורמה להערכה פרה-קלינית של טיפולים חדשניים כאלה, שיהיו חשובים כדי לסייע בקידום תחום השתלות הלב בצורה בטוחה ומהירה.
Protocol
כל הגידול והנהלים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של המרכז הרפואי של אוניברסיטת דיוק בהתאם לתקנות ולהנחיות שלהם.
1. הכנת תורם לפני הניתוח
- בחר שני חזירי יורקשייר תואמים לסוג דם במשקל 70-80 ק"ג (סוג הדם בוצע על ידי חוות לופר בגרניט פולס, צפון קרוליינה, ארה"ב). צמו את שני החזירים לפחות 6-8 שעות לפני הניתוח.
- הכן את מודול זלוף הלב בהתאם להנחיות היצרן ולבדיקות נקודת הטיפול הנדרשות (טבלת חומרים).
- הכן את פתרון התחזוקה למודול זלוף הלב. תמיסה זו מכילה חומרים מזינים ללב הפעיל מטבולית, כמו גם אדנוזין, כדי לסייע בשמירה על לחץ הדם המטרה.
- הוסף את הדברים הבאים: 500 מ"ל של תמיסת תחול שקופה, 100 מ"ל של 25% אלבומין, 100 מ"ג של ציפרופלוקסצין (200 מ"ג/100 מ"ל), שני בקבוקונים של 5 מ"ל של הזרקת מולטי ויטמין, 20mEq נתרן ביקרבונט, 1 גרם של צפזולין סודיום ו-250 מ"ג של מתילפרדניזולון. העלה את תמיסת ההתחלה והוסף את התוכן למודול זלוף הלב.
- לאחר ההכנה, יש להזריק 50 יחב"ל אינסולין רקומביננטי אנושי לשקית.
- הכינו תמיסת אפינפרין על ידי הזרקת 0.25 מ"ג אפינפרין ו-30 יחב"ל אינסולין רקומביננטי אנושי לשקית של 500 מ"ל של 5% דקסטרוז במים. תמיסה זו נועדה להחליף את הקטכולאמינים ולא להיות בעלת השפעה אינוטרופית. יש להחדיר את התמיסה במהירות של 10 מ"ל לשעה.
- הכן את תמיסת T4 על ידי הזרקת 200 מיקרוגרם של לבותירוקסין משוחזר לשקית מלח רגילה של 100 מ"ל 0.9%. יש להחדיר בקצב של 3 מ"ל לשעה.
- הכן את פתרון התחזוקה למודול זלוף הלב. תמיסה זו מכילה חומרים מזינים ללב הפעיל מטבולית, כמו גם אדנוזין, כדי לסייע בשמירה על לחץ הדם המטרה.
- הרדימו את החזיר התורם המיועד עם 4.4 מ"ג/ק"ג טלזול ו-1.0 מ"ג/ק"ג פרופופול ואחריו 2%-5% איזופלורן בשאיפה המועבר על ידי מסכת פנים.
- בזמן שהחזיר במצב שכיבה, יש להחדיר עם צינור אנדוטרכיאלי בקוטר 8-10 מ"מ לתחזוקת דרכי הנשימה במהלך הניתוח. אבטח את הצינור האנדוטרכיאלי במקומו לחוטם. מרחו משחה וטרינרית על העיניים כדי לשמור על שימון העיניים במהלך הניתוח.
- יש להכניס קטטר תוך ורידי (IV) לווריד האוזן כדי לתת נוזלים לווריד (נוזלי תחזוקה: תמיסת רינגר חלב 10 מ"ל/ק"ג/שעה).
- התחל עירוי פנטניל רציף לשיכוך כאבים (25-100 מיקרוגרם לשעה) ומתן 0.2 מ"ג/ק"ג של וקורוניום כדי לשמור על שיתוק.
- הנח מובילי אלקטרוקרדיוגרמה ואוקסימטר דופק לניטור רציף של פעילות חשמלית וחמצון.
- התחל הנשמה מכנית בנפח גאות של 10 מ"ל/ק"ג/דקה, קצב של 10-15 נשימות לדקה, ועם שמירה על איזופלורן (1%-5%) למשך שארית ההליך. חומרי הרדמה טיטראטים ותרופות כלי דם כך שרפלקסים נעדרים, קצב הלב נשאר 61-99 פעימות לדקה ולחץ הדם הסיסטולי נשאר 90-130 מ"מ כספית.
- מקם את החזיר על שולחן הניתוחים כשהגפיים העליונות ממוקמות צפלד ומאובטחות מחוץ לשדה הניתוח. אבטח את הגפיים התחתונות מחוץ לשדה הניתוח.
- הגדר את האזור שייכלל בשדה הניתוח על ידי הלסת בצורה עליונה, קו בית השחי הקדמי דו צדדי, ושתי אצבעות רוחב מתחת לתהליך ה-xiphoid בצורה נחותה. הכן ועטוף את אתר הניתוח באופן אספטי, בהתאם לשיטות המקובלות.
- בצע חיתוך צוואר בצד ימין.
- בעזרת להב #10, בצע חתך אלכסוני לרוחב הצוואר הימני, שתי אצבעות רוחב לרוחב קנה הנשימה, לאורך הגבול המדיאלי של שריר הסטרנוקלידומסטואיד.
- נשא את החתך הזה למטה דרך הפלטיזמה עם צריבה חשמלית, והבטיח המוסטזיס. לאחר שעברתם את הפלטיזמה, השתמשו במחזיר שומר על עצמו כדי לסייע בחשיפה.
- לנתח ולבודד בזהירות את עורק הצוואר ואת וריד הצוואר הפנימי; הנח לולאת כלי סביב כל כלי.
- מרחו 10 מ"ל של 2% לידוקאין באופן מקומי כדי לרחוץ את הכלים.
הערה: לידוקאין משמש להשפעות הרחבת כלי הדם שלו, מכיוון שכלי החזיר מתכווצים בקלות במניפולציה ויכולים להיות קשים לקנולציה. - באמצעות טכניקת סלדינגר, קנול ישיר של עורק הצוואר עם מיקרו-ניקוב של 5 Fr, ואחריו מעטפת מכניס של 6 Fr.
- חבר את מעטפת הכניסה לקו עורקי ומתמר לניטור רציף של לחץ עורקי מערכתי במהלך ההליך.
- שאיבת דם מקו העורקים של עורק הצוואר לבדיקות דם מעבדה לפני הניתוח (ספירת דם מלאה, פאנל מטבולי מקיף, טרופונין, לקטט ודם מלא לבידוד תאים חד-גרעיניים בדם היקפי).
- קנולציה של וריד הצוואר הפנימי באותה טכניקה כמו ב-1.11.5. השאר את מעטפת 6 Fr במקומה, מכיוון שהיא תשמש להכנסת קטטר לולאת לחץ-נפח להערכות תפקודיות במורד הזרם.
2. תרומה לאחר מוות במחזור הדם וכריתת לב מתורם
- בצע סטרנוטומיה.
- בעזרת להב #10, בצע חתך אורכי מהחריץ החזה לתהליך ה-xiphoid. בעזרת צריבה חשמלית, נשא את הדיסקציה כלפי מטה דרך הרקמה התת עורית ופאשיה של שריר החזה.
- קלעו את קו האמצע של עצם החזה בעזרת צריבה חשמלית. נתח את חיבורי הרצועות במנובריום וסביב תהליך ה-xiphoid.
- השתמש במסור חזה מתנודד כדי לחלק בזהירות את השולחן הקדמי של עצם החזה לאורך קו האמצע. השתמש במסור המתנודד כדי לחלק לחלוטין את השולחן האחורי של עצם החזה בגובה המנובריום. הקפד להימנע מפגיעה בווריד הלא נומינלי בשלב זה. השלם את חלוקת החזה של השולחן האחורי מתחת למנובריום בעזרת מספריים כבדים.
הערה: חיתוך קהה ידני של המישור בין הצד התחתון של עצם החזה לקרום הלב יכול לסייע במניעת פגיעה בלב במהלך שלב זה. - השתמש בצריבה חשמלית כדי להשיג המוסטזיס של קצוות החזה. הניחו מפסק עצם החזה.
- הסר את רקמת כרית השומן של בלוטת התימוס וקרום הלב בעזרת צריבה חשמלית כדי לייעל את החשיפה של קרום הלב.
- פתח בזהירות את קרום הלב בעזרת צריבה חשמלית. נשא את החתך לאורך מקודקוד הלב לגובה אבי העורקים.
- צור באר קרום הלב עם 2-0 תפרי משי.
- בצע ניתוחי אלוגרפט של תורם בסיסי.
- בזמן שהלב התורם חשוף ולפני כל מניפולציה ישירה של הלב, בצע ניתוחים בסיסיים. אלה כוללים אקו לב אפיקרדיאלי ישיר, הערכת לולאת לחץ-נפח וביופסיות מחט ליבת שריר הלב.
- בצע אקו לב בצורה סטרילית כדי לקבל תצוגות ציר ארוכות וקצרות סטנדרטיות ישירות מהמשטח האפיקרדיאלי.
- על מנת לבצע הקלטות לולאה של נפח לחץ, הכנס קטטר נפח לחץ במצב מוצק (5Fr, 122 ס"מ) ברצף לעורק הצוואר ווריד הצוואר הפנימי לחדר השמאלי והימני, בהתאמה.
- מדוד את אורך הקטטר שיוכנס חיצונית (מאתר הקנולציה לקודקוד הלב) לפני החדרתו למעטפת.
- הכניסו את הקטטר לתוך המעטפת העורקית, והובילו אותו לחדר השמאלי באמצעות אולטרסאונד אפיקרדיאלי. ודא שהקטטר אינו נוגע ישירות בדופן החדר, מכיוון שהדבר עלול להפריע לדיוק המדידה.
- לאחר מכן, הכנס את הקטטר לתוך המעטפת הוורידית, והנח אותו לחדר הימני, באמצעות מישוש ישיר או הנחיית אולטרסאונד אפיקרדיאלי.
- בצע ביופסיות שריר הלב במחט ליבה כדי לאסוף רקמה לניתוחים מאוחרים יותר. בצע זאת בקודקוד החדר השמאלי. אם יש דימום משמעותי מאתר הביופסיה, הנח תפר תיקון.
- הכן את לב התורם.
- נתח את חלון אבי העורקים כדי לאפשר מקום למיקום מהדק צולב.
- נתח באופן היקפי את הווריד הנבוב העליון (SVC) ואת הווריד הנבוב התחתון (IVC) באמצעות צריבה חשמלית.
- כדי נוגד קרישה, יש לתת 300 יחידות/ק"ג של הפרין תוך ורידי (IV) לפני צינורית אבי העורקים.
- השתמש בתפר פוליפרופילן 4-0 בעל זרוע כפולה כדי למקם חוט ארנק אבי העורקים בשורש אבי העורקים לצורך קנולציה של אבי העורקים. קנולאט עם צינורית אוורור שורש אבי העורקים 7 Fr (14G).
- הורידו את האוויר ואבטחו במקום עם חוסם עורקים של רומל. שטוף את צינור הקרדיופלגיה כדי להוציא אוויר ולאבטח את הקו לצינורית שורש אבי העורקים.
- לאחר מכן, כדי להתכונן לקנולציה ורידית עתידית, הנח תפר חוט ארנק בנספח הפרוזדורים הימני ואבטח אותו עם חוסם עורקים של רומל.
- לבצע מוות מבוקר במחזור הדם.
- ספק בולוס של 250 מיקרוגרם של פנטניל IV ואחריו עירוי בקצב רציף (CRI) ב-100 מיקרוגרם/שעה לשיכוך כאבים. לשיתוק, יש לתת 0.2 מ"ג/ק"ג וקורוניום תוך ורידי.
- הפסק את ההנשמה המכנית כדי להתחיל בתהליך המוות המבוקר במחזור הדם.
- ניטור רציף של לחץ הדם הסיסטולי והעורקי הממוצע, פעימות קו העורקים, פעילות הלב החשמלית ומצב החמצון.
הערה: השלב האגונלי מתחיל כאשר לחץ הדם הסיסטולי יורד מתחת ל-50 מ"מ כספית. בשלב זה, הלב עלול להתרחב. מוות מוגדר על ידי אסיסטולה מכנית (פעילות חשמלית ללא דופק) וללא סימני חיים. מחקר זה אינו מגדיר מוות מאסיסטולה חשמלית במודל זה, מכיוון שפעילות חשמלית איטית ללא דופק נמשכת בחזירים לפרק זמן ארוך יותר ממה שנצפה בבני אדם, מה שעלול לגרום לעלבון איסכמי מוגבר של אלוגרפט מהמתוכנן למודל. - המתן 10 דקות לאחר מועד המוות/אסיסטולה לפני שתמשיך בשלבים הבאים של הפרוטוקול. מרווח זה מדמה את תקופת הניתוק בתוספת הזמן הדרוש לכניסה והכנה מדיאסטינלית ב-DCD HT הקליני.
- בצע תחול מכשיר זלוף ex vivo .
- בעזרת להב #11, בצע חתך דקירה בתוספתן הפרוזדורים הימני והשתמש בצינורית הוורידים 34Fr המסופקת על ידי היצרן. אבטח את הצינורית עם חוסם עורקים של רומל וחבר את הצינורית לתיק האיסוף של מכשיר הזלוף ex vivo .
- אסוף כ-1200-1500 מ"ל של דם תורם לשקית האיסוף שסופקה על ידי היצרן. לפני ההוצאה, 30,000 יחידות של הפרין ו-2 מ"ג של טירופיבן הידרוכלוריד יתווספו לשקית האיסוף.
- סנן את דם התורם והעביר אותו למודול הזלוף הלב.
- לבצע כריתת לב מתורם.
- לאחר איסוף הדם התורם, יש למרוח את מהדק אבי העורקים.
- שימו לב ששורש אבי העורקים של החזיר ואבי העורקים העולה קצרים משמעותית מאשר בבני אדם. הקפד למרוח את המהדק הצולב קרוב ככל האפשר על מנת להימנע מהידוק הקשת או חסימה לא מלאה של אבי העורקים.
- יש לתת 1 ליטר של Del Nido cardioplegia לשורש אבי העורקים, תוך התמקדות בלחץ שורש של 60-100 מ"מ כספית.
- לחצות את הווריד הנבוב התחתון בהשתקפות קרום הלב ואת התוספתן הפרוזדורי השמאלי כדי לאוורר את החדר הימני והשמאלי במהלך לידת קרדיופלגיה.
- הניחו רפש סטרילי קר על לב התורם.
- חלקו את IVC, SVC, אבי העורקים רק דיסטלי לעורק האינומינט, ועורק הריאה (PA) בהתפצלות. לחצות את הפרוזדור השמאלי של התורם (LA), ולהשאיר שרוול מספיק של רקמה על האלוגרפט.
- הוציאו את הלב מהשדה והניחו אותו באגן מלא ברפש סטרילי וקר להכנת שולחן אחורי.
- הנח ארבעה תפרי מזרן אופקיים משועבדים במרחקים שווים (4-0 פוליפרופילן) בתוך הקצה הדיסטלי של אבי העורקים.
- לאחר איסוף הדם התורם, יש למרוח את מהדק אבי העורקים.
- זלוף ex vivo
- הנח את מתאם אבי העורקים ex vivo perfusion לתוך אבי העורקים הדיסטלי ואבטח היטב עם תפר משי 0-0 או סרט טבורי המונח ממש מתחת לתפרים המשועבדים.
- השאר את ה-PA, SVC, IVC והאטריום הנותר פתוח בזמן שאתה משתמש במכשיר הזלוף ex vivo .
הערה: בתצורה זו, לא נתקלה בהתנפחות של החדר השמאלי. - העבר את האלוגרפט למכשיר הזלוף ex vivo וחבר את מתאם אבי העורקים. ודא שהמשטח האחורי של הלב פונה קדימה. ודא שהמשטח הקדמי של הלב נמצא במגע עם המכשיר ושתי רפידות דפיברילציה. שמור על האלוגרפט בטמפרטורה של 34 מעלות צלזיוס. דפיבריל לפי הצורך כדי להחזיר כל הפרעת קצב חדרית לקצב מאורגן.
- בשלב זה, ניתן להכניס תרופה למעגל הזלוף ex-vivo דרך יציאת הלב. לחלופין, ניתן לשנות את הפרפוזה או המעגל הפיזי כדי להעריך תנאי ניסוי שמטרתם לשפר את ההתאוששות של השתלת DCD HT. לדוגמה, הראינו בעבר כי יש לשטוף את הפרפוזה מנוגדנים מנטרלים שנוצרו מראש באמצעות שומר תאים כדי לשפר את ההתמרה עם וקטורים נגיפיים 18,19,20.
- השתמש במעבדות נקודת טיפול כדי להנחות את מתן נתרן ביקרבונט, סידן גלוקונאט ודקסטרוז לפי הצורך.
- השג דגימות פרפוזה, בדיקות דם ודגימות ביופסיית מחט ליבה במהלך שלב הזלוף ex vivo הזה.
הערה: במודל זה, האלוגרפט נשאר במכשיר הזלוף ex vivo למשך כ-2-3 שעות לפני ההשתלה במקבל (טבלה 1). משך הזמן שבו האלוגרפט בוצע ex vivo נקבע על ידי משך הזמן שלקח להכין את בעל החיים המקבל להשתלה. עם זאת, זמן הזלוף ex vivo הוא משתנה שניתן להתאים על סמך יעדי המחקר.
3. כריתת לב, השתלה ורפרפוזיה
- הכן את החזיר הנמען כמתואר בשלבים 1.3-1.11.8.
- בנוסף, הנח קטטר קו מרכזי משולש לומן 7 Fr 20 ס"מ לתוך וריד הצוואר החיצוני או הפנימי השמאלי באמצעות הנחיית אולטרסאונד וטכניקת סלדינגר. הנח קו עורק עצם הירך 5 Fr באמצעות הנחיית אולטרסאונד.
- לאחר עטיפת השדה הסטרילי, הכינו את מעגל מעקף הלב-ריאה (CPB) והביאו את הקווים לשדה.
- מחזור מחדש דרך קווי העורקים והוורידים CPB כדי לנתק את האוויר. מהדקים ומחלקים את הקווים. הכן את הקו הוורידי לקנולציה ביקוואלית.
- יש לתת מינון טרום ניתוחי של 1 גרם מתילפרדניזולון כדי לטפל בתגובות דלקתיות עקב דחייה או איסכמיה, כפי שנעשה בהשתלת לב קלינית במוסד בו מבוצע מחקר זה.
- בצע חיתוך צוואר ימני וסטרנוטומיה של קו האמצע כמתואר קודם לכן בשלבים 1.11 ו-2.1.
- בצע כריתת לב מקבל.
- נתח את חלון אבי העורקים כמו קודם. נתחו את ה-SVC וה-IVC והניחו סרט טבורי היקפי סביב הכלים.
- לפני הקנולציה יש לתת 400 יחידות/ק"ג הפרין. טיטרציה ליעד של זמן קרישה מופעל (ACT) > 480 שניות.
- הנח תפר ארנק ארנק סטנדרטי של אבי העורקים באבי העורקים העולה הדיסטלי (באמצעות תפר פוליאסטר קלוע מצופה 2-0 משועבד כפול). מאובטח עם חוסם עורקים רומל והמוסטט.
- ודא שלחץ הדם הסיסטולי נמוך מ-120 מ"מ כספית. השתמש בלהב #11 כדי לבצע חתך דקירה בעובי מלא בתוך חוט הארנק. קנול את אבי העורקים עם צינורית 15 Fr דרך חתך זה. אבטח את הצינורית במקומה עם חוסם עורקים של רומל.
- מהדק את צינורית אבי העורקים. לאחר ביטול קו המעקף העורקי, חבר את צינורית אבי העורקים למעגל CPB. ודא שאין בועות אוויר בקו.
- צור מחרוזת ארנק נוספת של אבי העורקים והכנס את צינורית האוורור של שורש אבי העורקים.
- בצע קנולציה ורידית בטכניקת ביקוואל עם צינוריות קצה מתכת בזווית ישרה של 18-20 Fr הן ב-SVC והן ב-IVC, מאובטחות עם חוסמי עורקים של רומל. לאחר מכן, חבר את הצינוריות הללו לגפה הוורידית של מעגל ה- CPB.
- התחל CPB לזרימת יעד של 2.4 ליטר/דקה/מ"ר וקירור ל-32 מעלות צלזיוס. טיטראט חומרי הרדמה וכלי דם כדי לשמור על לחץ עורקי ממוצע > 60 מ"מ כספית.
הערה: הליכים אלה מבוצעים עם מרדימי לב חזה מוסמכים ומומחי פרפוזיה מוסמכים המנטרים ומתאמים את הניהול ההמודינמי לאורך כל ריצת ה-CPB. - החל את המהדק הצולב של אבי העורקים על צינורית אבי העורקים והמשך בהסבר על הלב המקורי של המקבל. השאר את אזיקי הפרוזדורים הימניים והשמאליים שלמים גדולים מספיק כדי להקל על טכניקת השתלה דו-פרוזדורית.
הערה: הטכניקה הדו-פרוזדורית משמשת במודל זה מכיוון שכלי הדם החזיריים עדינים מאוד, מה שהופך את האנסטומוזות של כלי הדם IVC ו-SVC למאתגרות מבחינה טכנית בטכניקת ביקוואל. - יש לחצות את אבי העורקים וה-PA קרוב ככל האפשר לשורש כדי לשמור על אורך כלי דם מקסימלי. הנח את הלב החדש שהושתל בתמיסת מלח עם חוצץ פוספט קר כקרח (PBS) להובלה ועיבוד במעבדה.
- בצע השתלת אלוגרפט דו-פרוזדורית של הנמען.
- מצננים את האלוגרפט במכשיר הזלוף ex vivo לפי הוראות היצרן. יש לתת 1 ליטר של קרדיופלגיה של Del Nido קר לדום לב פעם נוספת לפני הוצאתו מהמכשיר.
- נתק את מתאם אבי העורקים והעביר את הלב באגן של רפש סטרילי וקר לשולחן האחורי.
- בדוק את הלב לאיתור כל פטנט של primum fossa ovalis (PFO) או אתרים של פציעה בשוגג.
הערה: חשוב לציין, בחזירים, בדרך כלל יש וריד מערכתי המתנקז לאורך גבול הפרוזדורים השמאלי לפני שהוא מתנקז לאטריום הימני או IVC. וריד זה עשוי להיפתח בתהליך הרכש, ויש להקפיד על קשירתו לפני המשך ההשתלה. - חתוך את אבי העורקים בחזרה לרקמה בריאה מתחת לאתר אבטחת המתאם.
- בעזרת מספריים של מצנבאום, חתוך את פתח הפרוזדורים השמאלי כך שיתאים לגודל שרוול ה-LA של הנמען. עשו את אותו הדבר לאטריום הימני.
- התחל את האנסטומוזה הפרוזדורית השמאלית בצורה של ריצה עם תפר פרולן 4-0 כפול. המשך עם ה-PA הימני, אבי העורקים ואנסטומוזה של פרוזדורים ימניים, גם הם הושלמו עם תפר רציף של 4-0 פרולן.
- התחל להתחמם מחדש לנורמותרמיה (37 מעלות צלזיוס) לפני הסרת מהדק אבי העורקים.
- בצע רפרופוזיה של אלוגרפט וגמילה מ-CPB.
- לאחר השלמת כל האנסטומוזות, שחרר את מהדק אבי העורקים הצולב כדי להחזיר את האלוגרפט.
- ודא המוסטזיס של כל האנסטומוזות.
- חכו לשובו של הקצב וההתכווצות המקומיים. הנח חוטי קצב אפיקרדיאליים וקצב ב-100 פעימות לדקה אם קצב הלב של האלוגרפט הוא <100 פעימות לדקה.
- לאחר 60 דקות של עירוי, נסה להיגמל מ-CPB. המושתלים נתמכים ב-0.05 מיקרוגרם/ק"ג/דקה של אפינפרין וכן עירויי כלי דם לפי הצורך כדי לשמור על לחץ עורקי ממוצע (MAP) >65 מ"מ כספית.
- בצע ניתוחים כגון אקו לב, בדיקות דם, ביופסיות שריר הלב והערכת לולאת לחץ-נפח בנקודות זמן מוקדמות ומאוחרות של רפרפוזיה.
4. הפסקת הניסוי והמתת חסד
הערה: במחקר זה, בעל החיים המושתל נתמך במשך שעה אחת לאחר ההפרדה מ-CPB.
- עם סיום הניסוי, המתת חסד מתבצעת באמצעות אקסנגווינציה בהרדמה.
- הוצא את האלוגרפט המושתל על ידי מעבר קווי התפר לאורך כל האנסטומוזות. הקפד לא לכלול שום רקמת נמען מקורית עם דגימת האלוגרפט.
- הנח את האלוגרפט מיד לתוך PBS קר כקרח והעביר אותו למעבדה לעיבוד ואחסון.
תוצאות
בסך הכל בוצעו 6 השתלות DCD חזיריות לניתוח פיילוט באמצעות הפרוטוקול המתואר כאן. במהלך ששת ניסויי הפיילוט הללו, מרכיבי הפרוטוקול שוכללו כך שיתאימו טוב יותר לצרכי המודל, ישפרו את יכולת השחזור ויביא בחשבון אילוצים לוגיסטיים. הפרוטוקול הסופי שנוצר, כפי שנכתב כאן, מסוכם באיור 1.
בניגוד לתהליך המוות במחזור הדם הנשלט על ידי בני אדם, לבבות חזירים הנתונים לאיסכמיה המשיכו בפעילות חשמלית הרבה יותר זמן מהצפוי, גם לאחר הפסקת ההתכווצות. עם ההכרה בהבדל זה בניסוי הראשון, אסיסטולה חשמלית נחשבה כלא אמינה כמדד להכרזת מוות. על מנת למנוע נזק איסכמי חם לאלוגרפט מעבר לפרופורציה לזה שנראה בהקשר הקליני, נעשה שימוש באסיסטולה מכנית (פעילות חשמלית ללא דופק) כדי לקבוע את זמן המוות עבור הליכי ההשתלה הנותרים.
בנוסף, תקופת העיכוב הייתה בתחילה 15 דקות לפני המשך כריתת הלב של התורם. זה שימש לשלושת הניסויים הראשונים של ערכת הפיילוט. חלק מהרציונל לתקופה זו של איסכמיה חמה של 15 דקות היה שכוונו לפגיעה חמורה מספיק כדי שתהיה לנו מידה מסוימת של תפקוד לקוי של השתל לאחר ההשתלה שתהיה מתאימה למחקר. מצאנו שתפקוד לקוי של השתל בניסויים מוקדמים אלה היה כה חמור עד שהתקשינו להחזיק את בעל החיים המקבל במשך שעה לאחר ההפרדה מ-CPB, כך שהחיה הנמענת נזקקה למינונים גבוהים של תמיכה אינוטרופית ולחץ כדי לעמוד בנקודת הזמן של שעה. בהתחשב בקשיים אלה, הפחתנו את תקופת הפגיעה החמה-איסכמית ל-10 דקות, מה שמתקרב יותר ל-DCD HT הקליני עם זלוף ex vivo . איור 2 מתאר תמונות מייצגות של האלוגרפט בשלב זה, כמו גם במהלך זלוף ex vivo ולאחר ההשתלה. לבסוף, בוצעו התאמות לטיטרציה של עירויי וזופרסור ואינוטרופ בשלב הגמילה שלאחר CPB כדי לתמוך בלב החדש שהושתל. לא ניתן להדגיש מספיק את הצורך בצוות מנוסה עם מומחיות ספציפית בהרדמה קרדיווסקולרית כדי לשפר את ההצלחה בשלב זה שלאחר CPB.
זמני הניתוח נבדקו ב-4 מתוך 6 הניסויים ומסוכמים בטבלה 1. בשלב הרכש של DCD של הפרוטוקול, הזמן שחלף מהפסקת האמצעים המקיימים חיים בחזיר התורם ועד להכרזת המוות היה 14.25 (+/- 2.6) דקות. זמן מעקף לב-ריאה ניתוחי וזמן מהדק צולב נשארו עקביים לאורך כל ניסויי הפיילוט כ-3 שעות ו-1.5 שעות, בהתאמה. הניסויים הסתיימו בהמתת חסד כשעה לאחר ההפרדה מ-CPB. הייתה שונות במידת היציבות של בעלי החיים בזמן המתת החסד. חלק מבעלי החיים הפגינו יציבות טובה יחסית ותפקוד לקוי קל בלבד של השתל, בעוד שאחרים הפגינו חוסר יציבות המודינמית משמעותית ותפקוד לקוי חמור של השתל. תצוגות אקו לב מייצגות עדיין מודגמות באיור 3. ניתן להשתמש בהערכות תפקודיות אלה ואחרות, כגון לולאות PV, כדי לקבוע הבדלים בתפקוד האלוגרפט מנקודת ההתחלה כמו גם לפני ואחרי הכנסת התערבויות טיפוליות.
סיכום של דגימות שנאספו, עובדו ואוחסנו במהלך הניסוי מוצג באיור 4. לבבות שהושתלו הוכנסו מיד ל-PBS קר כקרח ואוחסנו במעבדה לניתוח רקמות ומולקולריות. הלב הטבעי של המקבל שימש כביקורת, בעוד שהאלוגרפט המושתל אוחסן כרקמת הניסוי. הלבבות נחתכו ל-4 חתכים מהקודקוד ועד הבסיס. מכל אחד מאלה, דגימות רקמה מייצגות של כל תא (החדר השמאלי, החדר הימני, המחיצה ושתי הפרוזדורים) הוקפאו בחנקן נוזלי ואוחסנו בטמפרטורה של -80 מעלות צלזיוס לניתוח עתידי. באופן דומה, דגימות רקמה מייצגות מכל אחת מהרמות והתאים הללו הודגרו ב-RNAlater והוקפאו בזק. דגימת הרקמה הנותרת נשמרה בפורמלין לניתוח היסטופתולוגי. דגימות דם מכל נקודת זמן נלקחו בשכפול ואוחסנו בצינורות EDTA או CPT. דם המאוחסן בצינורות EDTA סובב למטה כדי לבודד פלזמה, שהוקפאה בזק. דם בצינורות CPT עובד עבור PBMCs באמצעות פרוטוקול שונה שסופק על ידי ספק שפופרת ה-CPT.

איור 1: סכמטי של פרוטוקול DCD HT חזירי. ציר הזמן של האירועים המתרחשים בהליך DCD HT החזירי מתואר כאן. במחקר פיילוט זה נערכו 6 DCD HTs. הערכות שריר הלב הבסיסיות מבוצעות על השתלת לב החזיר התורם, ולאחר מכן מתחיל מוות מבוקר במחזור הדם. לאחר הכרזת המוות, יש תקופת עיכוב של 10 דקות. לאחר מכן האלוגרפט מושתל ומועבר למכשיר הזלוף ex vivo , שם הוא מוחזר למשך 2-3 שעות. לאחר הכנת החיה המקבלת, האלוגרפט התורם מושתל בטכניקה דו-פרוזדורית. לאחר שעה אחת של רפרפוזיה ב-CPB, המקבל נגמל מתמיכה במעקפים. המתת חסד מתרחשת שעה לאחר ההפרדה מ-CPB. לאחר מכן מעובד האלוגרפט המושתל לניתוח רקמות. DCD HT = השתלת לב לאחר תרומה לאחר מוות במחזור הדם; CPB = מעקף לב-ריאה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
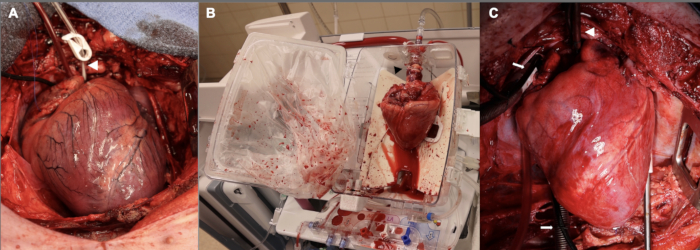
איור 2: השתלת לב חזירית בשלבים שונים לאורך תהליך DCD OHT. (A) לאחר מוות מבוקר במחזור הדם, האלוגרפט של התורם נפוח, איסכמי ובצקתי. ראש החץ הלבן מראה את צינורית השורש של אבי העורקים. (ב) לאחר השתלת האלוגרפט מהתורם, הוא מונח על מכשיר ה-EVP לזלוף ex vivo . שימו לב לכיוון הלב, כאשר ההיבט האחורי פונה כלפי חוץ. ראש החץ השחור מצביע על מתאם אבי העורקים המשמש לחיבור האלוגרפט למכשיר. (C) לאחר ההשתלה במקבל, האלוגרפט מועבר למעקף לב-ריאה למשך שעה אחת לפני הגמילה מ-CPB. ראש החץ הלבן מראה את צינורית אבי העורקים; חיצים לבנים מצביעים על צינוריות הוורידים הדו-צדדיות. EVP = זלוף ex vivo ; CPB = מעקף לב-ריאה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: אקו לב אפיקרדיאלי לבבי. לאורך הליך DCD OHT, נרכשו תמונות אקו לב אפיקרדיאליות מרובות כדי להעריך את תפקוד החדר. (A) ציר קצר סטנדרטי, (B) 4 חדרים ו-(C) 2 חדרים view מוצגים כאן. LV = חדר שמאלי; LA = אטריום שמאלי; RV = חדר ימין; RA = פרוזדור ימני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: זרימת עבודה של איסוף ועיבוד דגימות. סכמטי של איסוף ועיבוד דגימות בכל שלב בהליך. CBC = ספירת דם מלאה; CMP = פאנל מטבולי מקיף; PBMCs = תאים חד-גרעיניים בדם היקפי. דמות שנוצרה ב-BioRender. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| משך זמן (דקות) | |
| (ממוצע ± SD; n = 4) | |
| זמן מהפסקת ההנשמה ועד להכרזת הפטירה | 14.25 (2.6) |
| משך הזלוף ex vivo | 147 (18) |
| משך העלות לאלף הופעות | 174 (4) |
| זמן מהדק צולב | 90 (12.5) |
| זמן מהגמילה מ-CPB ועד המוות | 50 (37) |
טבלה 1. מידע פרוצדורלי. משך הזמן הממוצע של כל שלב קריטי בהליך DCD HT. CPB = מעקף לב-ריאה.
Discussion
למרות היעילות של השתלת לב לטיפול באי ספיקת לב סופנית, קיימים אתגרים משמעותיים בתחום זה. כדי להילחם בזמינות המוגבלת של איברים תורמים, ההתקדמות בשיטות שימור אלוגרפט לב (למשל, זלוף מכונה נורמותרמית) עלתה לקדמת הבמה בשנים האחרונות. התקדמות זו הובילה לאימוץ השתלת השתלות לב לאחר תרומה לאחר מוות במחזור הדם (DCD HT). בעוד שהשימוש בהשתלות DCD HT הרחיב את מאגר התורמים ויש לו תוצאות לטווח קצר שאינן נחותות מהשתלות DBD HT, נותר סיכון של כ-5% לתמותה מוקדמת לפני ההשתלה הקשורה לשני סוגי התורמים3. הסיכון לתמותה מוקדמת בהשתלת לב מונע בעיקר על ידי PGD. בעוד ש-PGD הוא רב-גורמי באטיולוגיה עם תרומה מסוימת של משתנים מוגדרים של תורם, מקבל ושימור, המנגנונים המולקולריים העומדים בבסיס PGD נותרים בדרך כלל לא מובנים היטב. יתר על כן, בהתחשב בפגיעה האיסכמית החמה הנוספת שנגרמה על ידי תהליך DCD HT, אין זה מפתיע שלבבות אלה, בהשוואה להשתלות DBD, עשויים להיות בסיכון גבוה יותר ל-PGD. לכן, הבנה טובה יותר של PGD חשובה כדי לסייע בהפחתת הסיכון לתמותה בטווח הקצר לאחר השתלת לב אורתוטופית, וזה עשוי להיות נכון במיוחד עבור DCD HT.
כאן, אנו מתארים מודל כירורגי חזירי בנאמנות גבוהה של DCD HT. היתרונות של מידול DCD HT in vivo במודל של בעלי חיים גדולים כוללים לא רק את היכולת להבין עוד יותר את השינויים הפתופיזיולוגיים המתרחשים באלוגרפט שנרכש במהלך DCD HT, אלא גם את היכולת לבדוק התערבויות ממוקדות שמטרתן להבטיח איכות אלוגרפט אופטימלית. הערכת תפקוד החדר השמאלי לאחר ההשתלה, וניתוח לולאת לחץ-נפח מצביעים על כך שמודל כירורגי חזירי זה מסוגל לסכם תפקוד לקוי מוקדם של השתלת הלב בעקבות DCD HT. לפיכך, הטכניקה המפורטת כאן יוצרת מודל בעל חיים גדולים הניתן לשחזור של PGD בעקבות DCD HT והיא ניתנת להערכת אסטרטגיות טיפוליות בנקודות רבות לאורך תהליך DCD HT. למעשה, השימוש בזלוף ex vivo כאמצעי למתן טיפולים חדשים, כגון טיפול גנטי בתיווך וקטור ויראלי, הוא תחום פעיל של התמקדות במעבדה שלנו ובאחרים 18,19,20. הדגמנו בעבר את היכולת להעביר טרנסגן בצורה חזקה והומוגנית לאלוגרפט לב באמצעות מודל HT חזירי שאינו DCD; ניתן ליישם את אותן טכניקות על דגם DCD HT19,20. אסטרטגיות טיפוליות פוטנציאליות אחרות כוללות שינוי כימי של הפרפוזאט, אספקת מולקולות קטנות שמטרתן להפחית מתח חמצוני, מתן מצעים מטבוליים לתמיכה בחילוף החומרים במהלך התקופה האיסכמית וכו' 16,21,22. יתר על כן, ניתן להתאים בקלות את המודל המוצג כאן כדי להעריך משתנים שונים הקשורים ל-DCD HT, כולל טכניקות הרכש השונות המשמשות קלינית. לדוגמה, אנו מתארים אסטרטגיית רכש ישיר וזילוף ex vivo; עם זאת, ניתן להתאים את המודל בקלות לשילוב שיטות זלוף רכש חלופיות, כולל זלוף אזורי נורמותרמי.
הטכניקה הכירורגית המשמשת במודל זה משקפת היטב את זו המשמשת בסביבה הקלינית; עם זאת, ישנם כמה הבדלים עיקריים. ראשית, הסטרנוטומיה והחשיפה הלבבית מתרחשות לפני הפסקת התמיכה הלב-ריאתית, השלב האגונלי, קביעת המוות ותקופת הקיפאון המחויבת מבחינה אתית (מודל חזה פתוח)23. הסטרנוטומיה נעשית בסדר זה כך שהערכת לב התורם הבסיסית, כולל ביופסיות שריר הלב, יכולה להתרחש. הערכה מוקדמת של תזמון הסטרנוטומיה במודל חזירי DCD HT הראתה כי ההתקדמות מנסיגה של אמצעים תומכי חיים למוות (זמן איסכמי חם) מהירה יותר עם שינויים המודינמיים פחות בולטים במודל החזה הפתוח; השתלות אלו עשויות לחוות תנאים פחות מזיקים במהלך הרכש. עם זאת, לא היו הבדלים משמעותיים בערכי המעבדה הביוכימיים (לקטט, גלוקוז, קטכולמין וכו') או בסמנים של מוות תאים בין קבוצת החזה הסגור והחזה הפתוח24. יתר על כן, בשל הכללת תקופת ההפסקה של 10 דקות במודל, הזמן מהפסקת האוורור לאיסכמיה חמה תפקודית במודל זה דומה יותר לתזמון של קבוצת החזה הסגור של המחקר המצוטט. בנוסף, בתוך מודל זה, זמן האיסכמיה החמה התפקודית הוא משתנה שניתן לשנות כך שיתאים למטרות ניסוי למחקר מסוים. הבדל פוטנציאלי נוסף בין המודל המדווח כאן לבין ההגדרה הקלינית הוא שפעילות חשמלית ללא דופק (PEA; אסיסטולה מכנית) משמשת להגדרת מוות במודל זה. בהקשר הקליני, הצהרת פטירה נעשית על ידי רופא שאינו מעורב בתהליך ההשתלה; PEA, יחד עם היעדר סימני חיים אחרים או אסיסטולה חשמלית, יהיו מקובלים לעמידה בקריטריונים להצהרת פטירה. הלבבות החזיריים המשיכו בפעילות חשמלית במשך תקופה ממושכת לאחר הפסקת ההתכווצות. על מנת למנוע נזק איסכמי חם שאינו פרופורציונלי לזה שנראה בהקשר הקליני, נעשה שימוש באסיסטולה מכנית (PEA) להגדרת מוות. עבור חוקרים המשתמשים במודל חזה סגור של DCD, פעילות חשמלית ללא דופק (חוסר פעימות בקו העורקים) עדיין יכולה לשמש כקריטריון המגדיר את המוות. לא מצאנו כי ריווי החמצן ההיקפי היה סמן רלוונטי להגדרת תחילת התקופה האגונלית או להגדרת המוות.
לבסוף, מה שתיארנו כאן הוא מודל עתיר זמן ומשאבים. מהכנת החזיר התורם ועד למותו של בעל החיים המקבל לוקח כ-10 שעות ודורש מאמץ משותף גדול. הצוות הפרוצדורלי כולל מנתחי לב מנוסים, מרדימי לב, פרפוזיה וצוות וטרינרי ומעבדה המסייעים באיסוף ועיבוד דגימות. צוות גדול כזה הוא חלק בלתי נפרד מההליך המורכב של DCD HT. עם זאת, עם צוות מנוסה, יצירת מודל חזירי בנאמנות גבוהה של DCD HT אפשרית, כמתואר בכתב יד זה.
Disclosures
CAM קיבלה פיצוי מניות על כך ששימשה כיועצת ל-TransMedics Inc.
Acknowledgements
אנו מודים לתמיכה הטכנית הווטרינרית ממשאבי בעלי החיים של מעבדת דיוק, לתמיכה בזלוף מפתרונות צנטריפוגליים ולצוותי ההרדמה הקרדיווסקולרית של דיוק על תמיכתם שלא תסולא בפז בניסויים כירורגיים אלה. אנו גם מודים בכנות לפול לזברג ולטרנסמדיקס בע"מ על תמיכתם.
Materials
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
References
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved