Method Article
نموذج خنزير عالي الدقة لزراعة القلب تقويم العظام بعد التبرع بعد وفاة الدورة الدموية
* These authors contributed equally
In This Article
Summary
يصف البروتوكول هنا نموذجا عالي الدقة لزراعة القلب بعد التبرع بعد الموت أثناء الدورة الدموية باستخدام التروية خارج الجسم الحي للطعم الخيفي.
Abstract
عدد مرضى قصور القلب المتقدم الذين يمكنهم إجراء عملية زرع قلب محدود بسبب نقص المتبرعين بالأعضاء المناسبين. في الجهود المبذولة لتوسيع مجموعة المتبرعين ، تم تطوير طرق بديلة للتبرع والمشتريات ، بما في ذلك زراعة القلب بعد التبرع بعد الموت أثناء الدورة الدموية (DCD HT). في حين أن البقاء على قيد الحياة على المدى القصير بعد DCD HT ليس أقل شأنا من زراعة القلب مع المتبرعين المتوفين دماغيا ، فقد يكون هناك معدل متزايد من الخلل الوظيفي الأولي للكسب غير المشروع (PGD) المرتبط بالطعوم الخيفية DCD HT. المسببات الأساسية للتشخيص الوراثي قبل الزرع متعددة العوامل وغير مفهومة تماما. بالنسبة للطعوم الخيفية DCD HT ، تعد فترة الإصابة الإقفارية الدافئة أثناء شراء DCD عامل خطر محتمل للإصابة بالتشخيص الوراثي قبل الزرع التي لا تتعرض لها الطعوم الخيفية للموت الدماغي. وبالتالي ، قد يكون الوقت الإقفاري الدافئ الوظيفي محركا مهما للتشخيص الوراثي قبل الزرع في DCD HT. ومع ذلك ، فإن الآليات الكامنة وراء التشخيص الوراثي قبل الزرع في هذا السيناريو السريري غير مفهومة جيدا على المستوى الجزيئي. يهدف العمل المقدم هنا إلى وصف تطوير والتحقق من صحة نموذج الخنازير عالي الدقة غير القابل للبقاء على قيد الحياة لزرع القلب تقويم العظام DCD. نفترض أن استخدام هذا النموذج الحيواني الكبير الانتقالي أمر بالغ الأهمية لتوضيح الآليات الجزيئية التي تساهم في التشخيص الوراثي قبل الزرع ، وكذلك للتحقيق في التدخلات المصممة لتحسين الحفاظ على الطعم الخيفي والأداء المبكر. يكرر هذا النموذج النهج المحيط بالجراحة والجراحية المستخدم في DCD HT سريريا ، مع تعديلات لحساب تشريح الخنازير وعلم وظائف الأعضاء. لن يوفر تطوير هذا النموذج الجراحي الحيواني الكبير رؤى ميكانيكية لتطوير التشخيص الوراثي قبل الزرع فحسب ، بل يمكن أيضا تعديله لتعزيز جهود البحث الانتقالية التي تهدف إلى تحسين تعافي الأعضاء بعد DCD HT.
Introduction
بالنسبة للمرضى الذين يعانون من قصور القلب في المرحلة النهائية المقاومة للإدارة الطبية ، تظل زراعة القلب هي العلاج المرتبط بأفضل بقاء على قيد الحياة على المدى الطويل ونوعية الحياة. تاريخيا ، تطلبت زراعة القلب استخدام طعم خيفي للقلب تم شراؤه من متبرع ميت دماغيا (DBD HT) ونقله أثناء الحفاظ عليه بتخزين ثابت منخفض الحرارة. ومع ذلك ، فإن عدد المرضى الذين يحتاجون إلى زراعة قلب يتجاوز عدد المتبرعين المتاحين. بينما يتم إجراء أكثر من 5,000 عملية زرع قلب سنويا في جميع أنحاء العالم ، تشير التقديرات إلى أن 50,000 مرشح ينتظرون عملية زرع قلب1. بالإضافة إلى ذلك، لا يزال استخدام أعضاء المتبرعين المحددين منخفضا بنسبة 30٪2. من أجل تحسين استخدام أعضاء المتبرع ، تم تطوير طرق بديلة للتبرع والشراء في السنوات الأخيرة ، بما في ذلك زراعة القلب بعد التبرع بعد الموت أثناء الدورة الدموية (DCD HT) 3 ، 4 ، 5 ، 6.
لا يستوفي المتبرعون ب DCD HT معايير الموت الدماغي الرسمية ولكن لديهم إصابة عصبية غير قابلة للاسترداد تعتبر الرعاية الطبية المستمرة غير مجدية. أثناء شراء DCD HT ، يتم سحب تدابير الحفاظ على الحياة ، ويتم مراقبة المريض بحثا عن تطوره إلى انقطاع النفس وتوقف الدورة الدموية. يتم الإعلان عن الوفاة في هذه الحالات من قبل طبيب لا يشارك في عملية الزرع أو شراء الأعضاء. بمجرد إعلان الوفاة، تكون هناك فترة مواجهة إضافية (عادة 5 دقائق) حيث يلاحظ المتبرع المحتمل لضمان عدم وجود شفاء أو علامات على الحياة، وبعد ذلك يعاد تأكيد إعلان الوفاة قبل الشروع في شراء الأعضاء7، 8. لذلك ، تتعرض الطعوم الخيفية DCD لفترة متغيرة من نقص التروية الدافئ (10 دقائق على الأقل) لا تتعرض لها الطعوم الخيفية المانحة ل DBD. هذه الفترة من نقص التروية الدافئة كانت تردع سابقا استخدام زراعة القلب مع المتبرعين ب DCD. ومع ذلك ، خلال السنوات الخمس الماضية ، تم تطوير طريقتين لإعادة تروية المشتريات لاستعادة الطعم الخيفي بعد الوقت الإقفاري الدافئ المرتبط ب DCD. أولا ، يتضمن الشراء المباشر والتروية (DPP) استئصال قلب المتبرع عند تأكيد وفاة الدورة الدموية ، يليه إنعاش الطعم الخيفي والحفاظ عليه عن طريق التروية خارج الجسم الحي. بدلا من ذلك ، يستخدم التروية الإقليمية للحرارة العادية (NRP) الدورة الدموية خارج الجسم مع استبعاد الدورة الدموية الدماغية لإعادة إحياء قلب المتبرع وإعادة إحيائه في الموقع قبل استئصال القلب9 ، 10 ، 11 ، 12.
حتى الآن ، كان البقاء على قيد الحياة على المدى القصير المرتبط ب DCD HT مشابها لتلك التي لوحظت مع DBD HT. ومع ذلك ، تشير الدراسات المبكرة أيضا إلى وجود خطر أعلى للإصابة بالخلل الوظيفي الأولي الوخيم (PGD) مع DCD HT مقارنة ب DBD HT3. التشخيص الوراثي قبل الزرع هو مصطلح يستخدم لوصف الظروف السريرية حيث تكون وظيفة الطعم الخيفي المبكرة غير كافية لتلبية احتياجات الدورة الدموية للمتلقي بعد زراعة القلب. تم وصف نظام لتصنيف شدة التشخيص الوراثي قبل الزرع من قبل الجمعية الدولية لزراعة القلب والرئة. في التشخيص الوراثي قبل الزرع الشديد ، يلزم دعم الدورة الدموية الميكانيكية لدعم الدورة الدموية الكافية في فترة ما بعد الزرع13. هذه الحالة هي المحرك الرئيسي للوفيات المبكرة بعد الجراحة بعد زراعة القلب. إن مسببات التشخيص الوراثي قبل الزرع لكل من DBD HT و DCD HT غير مفهومة جيدا ولكن من المحتمل أن تكون متعددة العوامل ، مع مساهمة متغيرات المانحة والحفظ والمتلقي. بالنسبة للطعوم الخيفية DCD ، فإن الإصابة الإقفارية الدافئة أثناء شراء DCD ، بالإضافة إلى الاستجابات الضارة الخاصة بالمتبرع ، بما في ذلك عدم الاستقرار الديناميكي الدموي ، والاضطرابات الأيضية ، والارتفاعات المفاجئة في الكاتيكولامينات ، والسيتوكينات ، واللاكتات ، والبوتاسيوم ، هي عوامل مقترحة قد تساهم في زيادة خطر الإصابة بالتشخيص الوراثي قبل الزرع مقارنة بالطعوم الخيفية DBD. 14،15،16. ومع ذلك ، فإن الآليات الكامنة وراء التشخيص الوراثي قبل الزرع في هذا السيناريو السريري غير مفهومة جيدا على المستوى الجزيئي. بالإضافة إلى ذلك ، ربما بسبب هذه المخاوف ، من المرجح أن تنخفض قلوب DCD بمقدار 3.37 مرة من أعضاء DBD17. نتيجة لذلك ، لا تزال هناك حاجة غير ملباة لتعزيز استخدام الأعضاء وتحسين نتائج الزرع من خلال تحسين عملية الحفاظ على الأعضاء.
في هذه الدراسة ، نصف DCD HT الخنازير باستخدام DPP الذي يعكس DPP DCD HT السريري الحالي بدقة عالية. يتضمن هذا النموذج عناصر طوال عملية زرع DCD: 1) شراء DCD ، 2) الحفاظ على التروية خارج الجسم الحي مع نظام العناية بالأعضاء (OCS) ، و 3) زرع المستلم. يوفر هذا النموذج الشامل فرصة لتوصيف الآليات الكامنة وراء التشخيص الوراثي قبل الزرع بشكل أفضل في DCD HT. يسمح هذا بعد ذلك بتطوير استراتيجيات علاجية مستهدفة وعقلانية تهدف إلى تحسين الحفاظ على الطعم الخيفي وأدائه. علاوة على ذلك ، يوفر هذا النموذج منصة للتقييم قبل السريري لمثل هذه العلاجات الجديدة ، والتي ستكون مهمة للمساعدة في تطوير مجال زراعة القلب بطريقة آمنة وسريعة.
Protocol
تمت الموافقة على جميع عمليات التربية والإجراءات من قبل لجنة رعاية المؤسسية واستخدامها في المركز الطبي بجامعة ديوك بما يتماشى مع لوائحها وإرشاداتها.
1. تحضير المتبرع قبل الجراحة
- اختر اثنين من خنازير يوركشاير المتطابقة من فصيلة الدم التي يزن 70-80 كجم (فصيلة الدم التي تقوم بها Looper Farms في جرانيت فولز ، نورث كارولاينا ، الولايات المتحدة الأمريكية). صياع كلا الخنازير لمدة لا تقل عن 6-8 ساعات قبل الجراحة.
- قم بإعداد وحدة نضح القلب وفقا لإرشادات الشركة المصنعة واختبارات نقطة الرعاية اللازمة (جدول المواد).
- قم بإعداد حل الصيانة لوحدة نضح القلب. يحتوي هذا المحلول على عناصر غذائية للقلب النشط الأيضي ، وكذلك الأدينوزين ، للمساعدة في الحفاظ على ضغط الدم المستهدف.
- أضف ما يلي: 500 مل من محلول التحضير الشفاف ، 100 مل من 25٪ ألبومين ، 100 مجم من سيبروفلوكساسين (200 مجم / 100 مل) ، قارورتان سعة 5 مل من حقن الفيتامينات المتعددة ، بيكربونات الصوديوم 20 مللي مكافئ ، 1 جم من سيفازولين الصوديوم ، و 250 مجم من ميثيل بريدنيزولون. قم برفع محلول التحضير وإضافة المحتويات إلى وحدة نضح القلب.
- بمجرد التحضير ، قم بحقن 50 وحدة دولية من الأنسولين المؤتلف البشري في الكيس.
- تحضير محلول الأدرينالين عن طريق حقن 0.25 مجم من الأدرينالين و 30 وحدة دولية من الأنسولين المؤتلف البشري في كيس سعة 500 مل من سكر العنب بنسبة 5٪ في الماء. ويهدف هذا الحل إلى استبدال الكاتيكولامينات بدلا من أن يكون لها تأثير تقلص عضلي. نقع المحلول بسرعة 10 مل / ساعة.
- تحضير محلول T4 عن طريق حقن 200 ميكروغرام من ليفوثيروكسين المعاد تكوينه في كيس ملحي عادي سعة 100 مل بنسبة 0.9٪. ينقع بمعدل 3 مل / ساعة.
- قم بإعداد حل الصيانة لوحدة نضح القلب. يحتوي هذا المحلول على عناصر غذائية للقلب النشط الأيضي ، وكذلك الأدينوزين ، للمساعدة في الحفاظ على ضغط الدم المستهدف.
- تخدير خنزير المتبرع المعين ب 4.4 ملغم/كغ من التيلازول و1.0 ملغم/كغ من البروبوفول متبوعا بإيزوفلوران مستنشق بنسبة 2٪-5٪ يتم تسليمه بواسطة قناع الوجه.
- أثناء وجود الخنزير في وضع ضعيف ، قم بالتنبيب بأنبوب بطاني قصغامي 8-10 مم للحفاظ على مجرى الهواء أثناء الجراحة. ثبت الأنبوب الرغامي في مكانه على الخطم. ضع مرهما بيطري على العينين للحفاظ على تزييت العين أثناء الجراحة.
- إدخال قسطرة وريدية (IV) في وريد الأذن لإعطاء السوائل الوريدية (سوائل الصيانة: محلول Lactated Ringer 10 مل/كغ/ساعة).
- البدء بالتسريب المستمر للفنتانيل لعلاج التسكين (25-100 ميكروغرام/ساعة) وإعطاء 0.2 ملغم/كغ من الفيكورونيوم للحفاظ على الشلل.
- ضع خيوط مخطط كهربية القلب ومقياس التأكسج النبضي للمراقبة المستمرة للنشاط الكهربائي والأكسجين.
- بدء التهوية الميكانيكية بحجم المد والجزر 10 مل / كجم / دقيقة ، بمعدل 10-15 نفسا في الدقيقة ، مع الحفاظ على الأيزوفلوران (1٪ -5٪) لبقية الإجراء. التخدير بالمعايرة والأدوية النشطة للأوعية الدموية مثل عدم وجود ردود الفعل ، ويبقى معدل ضربات القلب 61-99 نبضة في الدقيقة ، ويبقى ضغط الدم الانقباضي 90-130 مم زئبق.
- ضع الخنزير على طاولة العمليات مع وضع الأطراف العلوية رأسيا وتثبيتها خارج مجال الجراحة. تأمين الأطراف السفلية خارج مجال الجراحة.
- حدد المنطقة المراد تضمينها في المجال الجراحي من خلال الفك بشكل متفوق ، والخط الإبطي الأمامي ثنائيا ، وعرض إصبعين أسفل عملية الخنجري بشكل أدنى. قم بإعداد موقع الجراحة ولفه بشكل معقم ، باتباع الممارسات القياسية.
- قم بإجراء قطع الشريان السباتي على الجانب الأيمن.
- باستخدام شفرة # 10 ، قم بعمل شق جانبي مائل للرقبة اليمنى ، بعرض إصبعين جانبيا للقصبة الهوائية ، على طول الحدود الإنسية للعضلة القصية الترقوية الخشائية.
- احمل هذا الشق لأسفل من خلال الكي الكهربائي ، مما يضمن الإرقاء. بمجرد اجتياز platysma ، استخدم ضام ذاتي الاحتفاظ للمساعدة في التعرض.
- تشريح وعزل الشريان السباتي والوريد الوداجي الداخلي بعناية. ضع حلقة وعاء حول كل وعاء.
- ضع 10 مل من 2٪ ليدوكائين موضعيا لاستحمام الأوعية.
ملاحظة: يستخدم الليدوكائين لآثاره الموسعة للأوعية الدموية ، حيث تتشنج أوعية الخنازير بسهولة مع التلاعب ويمكن أن يصبح من الصعب تقمية. - باستخدام تقنية Seldinger ، قم بتقطيع الشريان السباتي مباشرة باستخدام ثقب دقيق 5 Fr ، متبوعا بغمد إدخال 6 Fr.
- قم بتوصيل غمد الإدخال بخط شرياني ومحول طاقة للمراقبة المستمرة للضغط الشرياني الجهازي أثناء العملية.
- سحب الدم من خط الشريان السباتي لفحص الدم المختبري قبل الجراحة (تعداد الدم الكامل ، لوحة التمثيل الغذائي الشاملة ، التروبونين ، اللاكتات ، والدم الكامل لعزل الخلايا أحادية النواة في الدم المحيطي).
- قنية الوريد الوداجي الداخلي باستخدام نفس التقنية كما في 1.11.5. اترك غمد 6 Fr في مكانه ، حيث سيتم استخدامه لإدخال قسطرة حلقة حجم الضغط للتقييمات الوظيفية في اتجاه مجرى النهر.
2. التبرع بعد الموت أثناء الدورة الدموية واستئصال القلب من المتبرع
- إجراء بضع القص.
- باستخدام شفرة # 10 ، قم بعمل شق طولي من الشق القصي إلى عملية الخنجري. باستخدام الكي الكهربائي ، انقل التشريح لأسفل عبر الأنسجة تحت الجلد ولفافة العضلات الصدرية.
- سجل خط الوسط من القص بالكي الكهربائي. قم بتشريح المرفقات الأربطية في المانوبريوم وحول عملية الخنجري.
- استخدم منشارا قصيا متذبذبا لتقسيم الطاولة الأمامية لعظم القص بعناية على طول خط الوسط. استخدم المنشار المتذبذب لتقسيم الطاولة الخلفية للقص بالكامل على مستوى المانوبريوم. احرص على تجنب إصابة الوريد غير المسمى في هذه الخطوة. أكمل التقسيم القصي للجدول الخلفي أسفل المانوبريوم باستخدام مقص ثقيل.
ملاحظة: يمكن أن يساعد التشريح الحاد اليدوي للمستوى بين الجانب السفلي من القص والتامور في تجنب إصابة القلب أثناء هذه الخطوة. - استخدم الكي الكهربائي للحصول على إرقاء الحواف القصية. ضع ضام قصي.
- قم بإزالة أنسجة وسادة الدهون الصعترية والتامور بالكي الكهربائي لتحسين تعرض التامور.
- افتح التامور بعناية باستخدام الكي الكهربائي. احمل الشق طوليا من قمة القلب إلى مستوى الشريان الأورطي.
- اصنع بئر التامور باستخدام غرز 2-0 من الحرير.
- إجراء تحليلات خط الأساس للطعم الخيفي للمتبرعين.
- أثناء تعرض قلب المتبرع وقبل أي تلاعب مباشر بالقلب ، قم بإجراء تحليلات خط الأساس. وتشمل هذه تخطيط صدى القلب النخابي المباشر ، وتقييم حلقة حجم الضغط ، وخزعات إبرة عضلة القلب.
- قم بإجراء تخطيط صدى القلب بطريقة معقمة للحصول على مناظر قياسية طويلة وقصيرة المحور مباشرة من سطح النخابي.
- من أجل إجراء تسجيلات حلقة ضغط الحجم ، أدخل قسطرة حجم ضغط الحالة الصلبة (5Fr ، 122 سم) بالتتابع في الشريان السباتي والوريد الوداجي الداخلي في البطينين الأيسر والأيمن ، على التوالي.
- قم بقياس طول القسطرة المراد إدخالها خارجيا (من موقع القنية إلى قمة القلب) قبل إدخالها في الغمد.
- أدخل القسطرة في غمد الشريان، ووجهها إلى البطين الأيسر باستخدام الموجات فوق الصوتية النخابي. تأكد من أن القسطرة لا تلامس جدار البطين مباشرة ، لأن ذلك قد يتداخل مع دقة القياس.
- بعد ذلك ، أدخل القسطرة في الغلاف الوريدي ، ووجهها إلى البطين الأيمن ، باستخدام الجس المباشر أو توجيه الموجات فوق الصوتية النخابي.
- إجراء خزعات عضلة القلب بالإبرة الأساسية لجمع الأنسجة لتحليلاتها لاحقا. قم بذلك في قمة البطين الأيسر. إذا كان هناك نزيف كبير من موقع الخزعة ، فضع غرزة إصلاح.
- جهز قلب المتبرع.
- قم بتشريح النافذة الأبهرية الرئوية لإتاحة مساحة لوضع المشبك المتقاطع.
- تشريح الوريد الأجوف العلوي (SVC) والوريد الأجوف السفلي (IVC) مع الكي الكهربائي.
- لمضاد التخثر، يتم تطبيق 300 وحدة/كجم من الهيبارين عن طريق الوريد (IV) قبل قنية الأبهر.
- استخدم خياطة بولي بروبيلين مزدوجة الذراع 4-0 لوضع سلسلة محفظة الأبهري في جذر الأبهر لقنية الأبهر. قنية مع قنية تنفيس جذر الأبهر 7 Fr (14G).
- قم بإزالة الهواء وتثبيته في مكانه باستخدام عاصبة روميل. اغسل أنبوب شلل القلب لإزالة الهواء وتأمين الخط إلى قنية جذر الأبهر.
- بعد ذلك ، للتحضير للقنية الوريدية في المستقبل ، ضع غرزة خيط محفظة في الزائدة الأذينية اليمنى وقم بتثبيتها باستخدام عاصبة روميل.
- إجراء الموت الدوري الخاضع للرصد.
- توفير 250 ميكروغرام من بلعة الفنتانيل الوريدية متبوعة بالتسريب المستمر (CRI) بمعدل 100 ميكروغرام / ساعة للتسكين الألمي. للإصابة بالشلل، يتم تطبيق 0.2 ملغم/كغ فيكورونيوم عن طريق الوريد.
- توقف عن التهوية الميكانيكية لبدء عملية الموت الدوري المتحكم فيها.
- مراقبة ضغط الدم الانقباضي ومتوسط ضغط الدم الشرياني باستمرار ، ونبض الخط الشرياني ، ونشاط القلب الكهربائي ، وحالة الأوكسجين.
ملاحظة: تبدأ المرحلة الناهضة عندما ينخفض ضغط الدم الانقباضي إلى أقل من 50 مم زئبق. في هذه المرحلة ، قد ينتد القلب. يتم تعريف الموت من خلال الانقباض الميكانيكي (النشاط الكهربائي بدون نبض) وعدم وجود علامات على الحياة. لا تعرف هذه الدراسة الموت بسبب الانقباض الكهربائي في هذا النموذج ، حيث يستمر النشاط الكهربائي البطيء بدون نبض في الخنازير لفترة زمنية أطول مما لوحظ في البشر ، مما قد يؤدي إلى زيادة الإهانة الإقفارية الخيفية أكثر من المقصود للنموذج. - انتظر لمدة 10 دقائق بعد وقت الوفاة / الانقباض قبل متابعة الخطوات التالية من البروتوكول. يحاكي هذا الفاصل الزمني فترة المواجهة بالإضافة إلى الوقت اللازم لدخول المنصف والتحضير في DCD HT السريري.
- قم بإجراء فتيلة جهاز التروية خارج الجسم الحي .
- باستخدام شفرة # 11 ، قم بعمل شق طعنة في الزائدة الأذينية اليمنى وقم بتقشير القنية الوريدية 34Fr التي توفرها الشركة المصنعة. قم بتأمين القنية باستخدام عاصبة رومل وقم بتوصيل القنية بحقيبة تجميع جهاز التروية خارج الجسم الحي .
- اجمع ما يقرب من 1200-1500 مل من دم المتبرع في كيس التجميع الذي توفره الشركة المصنعة. قبل الاستئصال ، تمت إضافة 30,000 وحدة من الهيبارين و 2 مجم من تيروفيبان حمض الهيدروكلوريك إلى كيس التجميع.
- قم بتصفية دم المتبرع وتوصيله إلى وحدة نضح القلب.
- إجراء استئصال القلب من المتبرع.
- بعد جمع دم المتبرع ، ضع المشبك المتقاطع الأبهري.
- لاحظ أن جذر الأبهر الخنازير والشريان الأورطي الصاعد أقصر بكثير مما هو عليه في البشر. احرص على تطبيق المشبك المتقاطع بالقرب قدر الإمكان لتجنب تثبيت القوس أو انسداد الشريان الأورطي بشكل غير كامل.
- قم بإعطاء 1 لتر من شلل القلب Del Nido في جذر الأبهر ، مستهدفا ضغط الجذر من 60-100 مم زئبق.
- يعبر الوريد الأجوف السفلي عند انعكاس التامور والزائدة الأذينية اليسرى للتنفيس عن البطينين الأيمن والأيسر أثناء ولادة شلل القلب.
- ضع طين معقم بارد على قلب المتبرع.
- قسم IVC و SVC والشريان الأورطي البعيد فقط عن الشريان غير المسمى والشريان الرئوي (PA) عند التشعب. قم بتمرير الأذين الأيسر للمتبرع (LA) ، مع ترك صفعة كافية من الأنسجة على الطعم الخيفي.
- أخرج القلب من الحقل وضعه في حوض مملوء بالطين المعقم والبارد لإعداد الطاولة الخلفية.
- ضع أربع خيوط مرتبة أفقية متساوية المسافة (4-0 بولي بروبيلين) داخل الطرف البعيد من الشريان الأورطي.
- بعد جمع دم المتبرع ، ضع المشبك المتقاطع الأبهري.
- نضح خارج الجسم الحي
- ضع محول الأبهر النضح خارج الجسم الحي في الشريان الأورطي البعيد وثبته بإحكام باستخدام خياطة حريرية 0-0 أو شريط سري يوضع أسفل الغرز المرهونة مباشرة.
- اترك PA و SVC و IVC وترك الأذين مفتوحا أثناء استخدام جهاز التروية خارج الجسم الحي .
ملاحظة: مع هذا التكوين ، لم يصادف انتفاخ البطين الأيسر. - انقل الطعم الخيفي إلى جهاز التروية خارج الجسم الحي وقم بتوصيل محول الأبهر. تأكد من أن السطح الخلفي للقلب متجها للأمام. تأكد من ملامسة السطح الأمامي للقلب مع الجهاز ووسادتين لإزالة الرجفان. حافظ على الطعم الخيفي عند 34 درجة مئوية. إزالة الرجفان حسب الحاجة لاستعادة أي اضطراب في نظم القلب البطيني إلى إيقاع منظم.
- في هذه المرحلة ، يمكن إدخال علاج في دائرة التروية خارج الجسم الحي من خلال منفذ شلل القلب. بدلا من ذلك ، يمكن تعديل الدائرة الفيزيائية أو الفيزيائية لتقييم الظروف التجريبية التي تهدف إلى تعزيز استعادة الطعم الخيفي DCD HT. على سبيل المثال ، لقد أظهرنا سابقا أن الريشة تحتاج إلى غسل الأجسام المضادة المعادلة مسبقا عبر موفر الخلية لتعزيز التنبيغ بالنواقل الفيروسية18،19،20.
- استخدم مختبرات نقاط الرعاية لتوجيه إعطاء بيكربونات الصوديوم وغلوكونات الكالسيوم وسكر العنب حسب الحاجة.
- الحصول على عينات من النفحات وفحص الدم وعينات خزعة الإبرة الأساسية خلال مرحلة التروية خارج الجسم الحي .
ملاحظة: في هذا النموذج ، يظل الطعم الخيفي على جهاز التروية خارج الجسم الحي لمدة 2-3 ساعات تقريبا قبل الزرع في المتلقي (الجدول 1). تم تحديد طول الفترة الزمنية التي تم فيها تقويض الطعم الخيفي خارج الجسم الحي من خلال طول الوقت الذي استغرقه إعداد المتلقي للزرع. ومع ذلك ، فإن وقت التروية خارج الجسم الحي هو متغير يمكن تعديله بناء على أهداف الدراسة.
3. استئصال القلب المتلقي والزرع وإعادة التروية
- قم بإعداد الخنزير المتلقي كما هو موضح في الخطوات 1.3-1.11.8.
- بالإضافة إلى ذلك ، ضع قسطرة الخط المركزي ثلاثي التجويف 7 Fr 20 سم في الوريد الوداجي الخارجي أو الداخلي الأيسر باستخدام توجيه الموجات فوق الصوتية وتقنية Seldinger. ضع خطا شرياني فخذي 5 فرن باستخدام توجيه الموجات فوق الصوتية.
- بعد لف الحقل المعقم ، قم بإعداد دائرة المجازة القلبية الرئوية (CPB) وإحضار الخطوط إلى الميدان.
- أعد تدويره من خلال الخطوط الشريانية والوريدية CPB لإزالة الهواء. المشبك وتقسيم الخطوط. تحضير الخط الوريدي للقنية ذات الرأسين.
- قم بإعطاء جرعة ما قبل الجراحة من 1 جم من ميثيل بريدنيزولون لمعالجة أي استجابات التهابية بسبب الرفض أو نقص التروية ، كما هو الحال في زراعة القلب السريرية في المؤسسة التي يتم فيها إجراء هذه الدراسة.
- قم بإجراء قطع الشريان السباتي الأيمن وبضع القص في خط الوسط كما هو موضح سابقا في الخطوتين 1.11 و 2.1.
- إجراء استئصال القلب المتلقي.
- قم بتشريح النافذة الأبهرية الرئوية كما كان من قبل. قم بتشريح SVC و IVC وضع الشريط السري المحيطي حول الأوعية.
- قبل القنية ، قم بإعطاء 400 وحدة / كجم من الهيبارين. المعايرة إلى هدف وقت التخثر المنشط (ACT) > 480 ثانية.
- ضع غرزة خيوط محفظة قنية الأبهري القياسية في الشريان الأورطي الصاعد البعيد (باستخدام خياطة بوليستر مضفرة مطلية بذراعين مزدوجة الذراع). قم بتأمينها باستخدام عاصبة روميل ومرقئ.
- تأكد من أن ضغط الدم الانقباضي أقل من 120 مم زئبق. استخدم شفرة # 11 لعمل شق طعنة كامل السماكة داخل سلسلة المحفظة. قم بتقشير الشريان الأورطي بقنية 15 Fr من خلال هذا الشق. قم بتأمين القنية في مكانها باستخدام عاصبة روميل.
- المشبك قنية الأبهر. بعد إلغاء تهوية خط المجازة الشريانية ، قم بتوصيل قنية الأبهر بدائرة CPB. تأكد من عدم وجود فقاعات هواء في الخط.
- اصنع خيطا آخر لمحفظة الأبهر وأدخل قنية تنفيس جذر الأبهر.
- قم بإجراء القنية الوريدية باستخدام تقنية ثنائية الرأسين مع قنيات ذات طرف معدني بزاوية قائمة 18-20 Fr في كل من SVC و IVC ، مثبتة بعاصبات Rummel. بعد ذلك ، قم بتوصيل هذه القنيات بالطرف الوريدي لدائرة CPB.
- ابدأ CPB إلى تدفق مستهدف يبلغ 2.4 لتر / دقيقة / م2 وتبرد إلى 32 درجة مئوية. معايرة التخدير ومثبطات الأوعية للحفاظ على متوسط الضغط الشرياني > 60 مم زئبق.
ملاحظة: يتم تنفيذ هذه الإجراءات مع أطباء تخدير القلب والصدر المعتمدين من مجلس الإدارة وأخصائيي التروية المعتمدين الذين يراقبون وينسقون إدارة ديناميكا الدم طوال فترة تشغيل CPB. - ضع المشبك الأبهري المتقاطع القريب على قنية الأبهر واستمر في شرح القلب الأصلي للمتلقي. اترك الأصفاد الأذينية اليمنى واليسرى سليمة كبيرة بما يكفي لتسهيل تقنية الزرع الأذيني الثنائي.
ملاحظة: يتم استخدام تقنية ثنائية الأذين في هذا النموذج لأن الأوعية الدموية الخنازير حساسة للغاية ، مما يجعل مفاغرة الأوعية الدموية IVC و SVC صعبة من الناحية الفنية في تقنية الثنائي الرأسين. - قم بتحويل الشريان الأورطي و PA بالقرب من الجذر قدر الإمكان للحفاظ على أقصى طول للوعاء. ضع القلب المزروع حديثا في محلول ملحي مخزن بالفوسفات المثلج (PBS) ليتم نقله ومعالجته في المختبر.
- إجراء زرع ثنائي الأذين المتلقي.
- قم بتبريد الطعم الخيفي على جهاز التروية خارج الجسم الحي وفقا لتعليمات الشركة المصنعة. قم بإعطاء 1 لتر من شلل القلب Del Nido البارد للتوقف القلبي مرة أخرى قبل إزالته من الجهاز.
- افصل محول الأبهر وانقل القلب في حوض من الطين المعقم والبارد إلى الطاولة الخلفية.
- افحص القلب بحثا عن أي حفرة أولية سالكة (PFO) أو مواقع إصابة غير مقصودة.
ملاحظة: الأهم من ذلك ، في الخنازير ، عادة ما يكون هناك وريد جهازي يستنزف على طول الحدود الأذينية اليسرى قبل تصريفه في الأذين الأيمن أو IVC. يمكن فتح هذا الوريد في عملية الشراء ، ويجب توخي الحذر لضمان ربطه قبل الشروع في الزرع. - قم بقص الشريان الأورطي مرة أخرى إلى الأنسجة السليمة أسفل موقع تأمين المحول.
- باستخدام مقص Metzenbaum ، قم بقص فتحة الأذين اليسرى لتتناسب مع حجم سوار LA المستلم. افعل الشيء نفسه مع الأذين الأيمن.
- ابدأ مفاغرة الأذين الأيسر بطريقة تشغيل باستخدام خياطة Prolene مزدوجة الذراع. استمر في استخدام مفاغرة PA الأيمن والأبهر والأيمن ، وكلها مكتملة أيضا بخيطة البرولين المستمرة 4-0.
- ابدأ في إعادة التسخين إلى الحرارة النورمال (37 درجة مئوية) قبل إزالة المشبك المتقاطع للأبهر.
- إجراء إعادة تروية الطعم الخيفي والفطام من CPB.
- بعد الانتهاء من جميع مفاغرة ، حرر المشبك المتقاطع الأبهري لإعادة تأثير الطعم الخيفي.
- تأكد من إرقاء جميع مفاغرة.
- انتظر عودة الإيقاع والانقباض الأصليين. ضع أسلاك تنظيم ضربات القلب وقم بالسرعة عند 100 نبضة في الدقيقة إذا كان معدل ضربات القلب الخيفي <100 نبضة في الدقيقة.
- بعد 60 دقيقة من إعادة التروية ، حاول الفطام عن CPB. يتم دعم المتلقين ب 0.05 ميكروغرام / كجم / دقيقة من الأدرينالين بالإضافة إلى حقن الأوعية الضاغطة حسب الحاجة للحفاظ على متوسط الضغط الشرياني (MAP) >65 مم زئبق.
- إجراء تحليلات مثل تخطيط صدى القلب ، وفحص الدم ، وخزعات عضلة القلب ، وتقييم حلقة حجم الضغط في كل من النقاط الزمنية المبكرة والمتأخرة لإعادة الضهار.
4. إنهاء التجربة والقتل الرحيم
ملاحظة: في هذه الدراسة ، تم دعم المتلقي للزرع لمدة ساعة واحدة بعد الانفصال عن CPB.
- عند الانتهاء من التجربة ، يتم إجراء القتل الرحيم عن طريق الإخراج تحت التخدير.
- قم باستخلاص الطعم الخيفي المزروع عن طريق تمرير خطوط الخياطة على طول جميع مفاغرة. احرص على عدم تضمين أي نسيج متلقي أصلي مع عينة الطعم الخيفي.
- ضع الطعم الخيفي على الفور في PBS المثلج ونقله إلى المختبر للمعالجة والتخزين.
النتائج
تم إجراء ما مجموعه 6 عمليات زرع DCD للخنازير لإجراء تحليل تجريبي باستخدام البروتوكول الموضح هنا. على مدار هذه التجارب التجريبية الست ، تم تنقيح مكونات البروتوكول لتناسب احتياجات النموذج بشكل أفضل ، وتعزيز قابلية التكرار ، ومراعاة القيود اللوجستية. يتم تلخيص البروتوكول الناتج النهائي ، كما هو مكتوب هنا ، في الشكل 1.
على عكس عملية الموت الدوري التي يتحكم فيها الإنسان ، استمرت قلوب الخنازير المعرضة لنقص التروية في النشاط الكهربائي لفترة أطول بكثير مما كان متوقعا ، حتى بعد توقف الانقباض. عند التعرف على هذا الاختلاف في التجربة الأولى ، اعتبر الانقباض الكهربائي غير موثوق به كمقياس لإعلان الوفاة. من أجل تجنب الضرر الإقفاري الدافئ للطعم الخيفي بشكل غير متناسب مع ذلك الذي شوهد في السياق السريري ، تم استخدام الانقباض الميكانيكي (النشاط الكهربائي بدون نبض) لتحديد وقت الوفاة لإجراءات الزرع المتبقية.
بالإضافة إلى ذلك ، كانت فترة المواجهة في البداية 15 دقيقة قبل الشروع في استئصال القلب من المتبرع. تم استخدام هذا في التجارب الثلاث الأولى من المجموعة التجريبية. كان جزء من الأساس المنطقي لفترة نقص التروية الدافئة هذه التي استمرت 15 دقيقة هو أننا كنا نهدف إلى الإصابة بإصابة خطيرة بما يكفي للحصول على درجة من الخلل الوظيفي في الكسب غير المشروع بعد الزرع والتي ستكون مناسبة للدراسة. وجدنا أن الخلل الوظيفي في الكسب غير المشروع في هذه التجارب المبكرة كان شديدا لدرجة أننا واجهنا صعوبة في الحفاظ على المتلقي لمدة ساعة بعد الانفصال عن CPB ، بحيث تطلب المتلقي جرعات عالية من دعم التقلص العضلي والضغط لتلبية النقطة الزمنية 1 ساعة. بالنظر إلى هذه الصعوبات ، قمنا بتقليل فترة الإصابة الإقفارية الدافئة إلى 10 دقائق ، وهو ما يقترب بشكل وثيق من DCD HT السريري مع التروية خارج الجسم الحي . يصور الشكل 2 صورا تمثيلية للطعم الخيفي في هذه المرحلة وكذلك أثناء التروية خارج الجسم الحي وبعد الزرع. أخيرا ، تم إجراء تعديلات على معايرة حقن الأوعية الدموية وحقن العضلات العضلية في مرحلة فطام ما بعد CPB لدعم القلب المزروع حديثا. لا يمكن التأكيد بشكل كاف على الحاجة إلى فريق متمرس يتمتع بخبرة محددة في تخدير القلب والأوعية الدموية لتعزيز النجاح في مرحلة ما بعد CPB.
تم تتبع أوقات الجراحة عبر 4 من 6 تجارب وتم تلخيصها في الجدول 1. في مرحلة شراء DCD من البروتوكول ، كان الوقت المنقضي من وقف تدابير الحفاظ على الحياة في الخنزير المتبرع إلى إعلان الوفاة 14.25 (+/- 2.6) دقيقة. ظل وقت المجازة القلبية الرئوية الجراحية ووقت المشبك المتقاطع ثابتين طوال التجارب التجريبية في حوالي 3 ساعات و 1.5 ساعة على التوالي. انتهت التجارب بالقتل الرحيم بعد حوالي ساعة واحدة من الانفصال عن CPB. كان هناك تباين في درجة استقرار في وقت القتل الرحيم. أظهرت بعض استقرارا جيدا نسبيا وخللا خفيفا في الكسب غير المشروع ، بينما أظهر البعض الآخر عدم استقرار ديناميكي الدم الكبير وخلل الكسب غير المشروع الشديد. يتم عرض شاشات تخطيط صدى القلب التمثيلية في الشكل 3. يمكن استخدام هذا التقييم الوظيفي وغيرها ، مثل الحلقات الكهروضوئية ، لتحديد الاختلافات في وظيفة الطعم الخيفي من خط الأساس وكذلك قبل وبعد إدخال التدخلات العلاجية.
يتم عرض ملخص للعينات التي تم جمعها ومعالجتها وتخزينها من خلال التجربة في الشكل 4. تم وضع القلوب المستزرعة على الفور في PBS المثلج وتخزينها في المختبر لتحليل الأنسجة والجزيئات. تم استخدام القلب الأصلي للمتلقي كعنصر تحكم ، بينما تم تخزين الطعم الخيفي المزروع كنسيج تجريبي. تم تقطيع القلوب إلى 4 مقاطع عرضية من القمة إلى القاعدة. من كل من هذه ، تم تجميد عينات الأنسجة التمثيلية لكل غرفة (البطين الأيسر والبطين الأيمن والحاجز وكلا الأذينين) في النيتروجين السائل وتخزينها عند -80 درجة مئوية لتحليلها في المستقبل. وبالمثل ، تم تحضين عينات الأنسجة التمثيلية من كل من هذه المستويات والغرف في الحمض النووي الريبي وتجميدها بسرعة. تم حفظ العينة المتبقية من الأنسجة في الفورمالين لتحليلها النسيجي المرضي. تم الحصول على عينات الدم من أي نقطة زمنية في نسختين وتخزينها في أنابيب EDTA أو CPT. تم تدوير الدم المخزن في أنابيب EDTA لعزل البلازما ، التي تم تجميدها بسرعة. تمت معالجة الدم في أنابيب CPT ل PBMCs باستخدام بروتوكول معدل مقدم من بائع أنبوب CPT.

الشكل 1: تخطيطي بروتوكول الخنازير DCD HT. يتم تصوير الجدول الزمني للأحداث التي تحدث في إجراء DCD HT الخنازير هنا. في هذه الدراسة التجريبية ، تم إجراء 6 HTs DCD. يتم إجراء تقييمات عضلة القلب الأساسية على طعم قلب خنزير المتبرع ، وبعد ذلك يبدأ موت الدورة الدموية المضبوط. بعد إعلان الوفاة ، هناك فترة مواجهة مدتها 10 دقائق. ثم يتم زرع الطعم الخيفي ونقله إلى جهاز التروية خارج الجسم الحي ، حيث يتم إعادة إدخاله لمدة 2-3 ساعات. بعد تحضير المتلقي ، يتم زرع الطعم الخيفي المتبرع بتقنية ثنائية الأذين. بعد 1 ساعة من إعادة التروية على CPB ، يتم فطام المتلقي عن دعم المجازة. يحدث القتل الرحيم بعد ساعة واحدة من الانفصال عن CPB. ثم تتم معالجة الطعم الخيفي المزروع لتحليل الأنسجة. DCD HT = زرع القلب بعد التبرع بعد الموت أثناء الدورة الدموية. CPB = المجازة القلبية الرئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
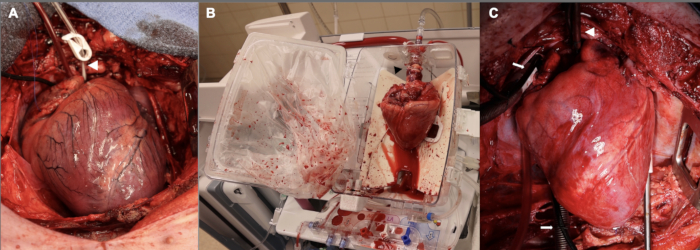
الشكل 2: طعم الخيف القلبي الخنازير في مراحل مختلفة على طول عملية DCD OHT. (أ) بعد الموت الدوراني المتحكم فيه ، يكون الطعم الخيفي للمتبرع منتفخا وإقفاريا ووذمة. يظهر رأس السهم الأبيض قنية جذر الأبهر. (ب) بمجرد استخلاص الطعم الخيفي من المتبرع ، يتم وضعه على جهاز EVP للتروية خارج الجسم الحي . لاحظ اتجاه القلب ، بحيث يكون الجانب الخلفي متجها للخارج. يشير رأس السهم الأسود إلى محول الأبهر المستخدم لتوصيل الطعم الخيفي بالجهاز. (ج) بعد الزرع في المتلقي ، يتم إعادة الطعم الخيفي على المجازة القلبية الرئوية لمدة ساعة واحدة قبل الفطام من CPB. يظهر رأس السهم الأبيض قنية الأبهر. تشير الأسهم البيضاء إلى القنيات الوريدية ذات القابلين. EVP = التروية خارج الجسم الحي . CPB = المجازة القلبية الرئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تخطيط صدى القلب النخابي القلبي. خلال إجراء DCD OHT ، تم الحصول على صور متعددة لتخطيط صدى القلب النخابي لتقييم وظيفة البطين. (أ) يتم عرض المحور القصير القياسي ، (ب) 4 غرف ، و (ج) غرفتين هنا. LV = البطين الأيسر. LA = الأذين الأيسر ؛ RV = البطين الأيمن. RA = الأذين الأيمن. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: سير عمل جمع العينات ومعالجتها. تخطيطي لجمع العينات ومعالجتها في كل خطوة من خطوات الإجراء. CBC = تعداد الدم الكامل ؛ CMP = لوحة التمثيل الغذائي الشاملة. PBMCs = خلايا الدم المحيطية أحادية النواة. تم إنشاء الشكل في BioRender. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| طول الوقت (دقيقة) | |
| (يعني ± SD؛ ن = 4) | |
| الفترة من توقف التنفس الصناعي إلى إعلان الوفاة | 14.25 (2.6) |
| مدة التروية خارج الجسم الحي | 147 (18) |
| مدة CPB | 174 (4) |
| وقت المشبك المتقاطع | 90 (12.5) |
| الوقت من فطام CPB إلى الموت | 50 (37) |
الجدول 1. المعلومات الإجرائية. متوسط مدة كل خطوة حرجة في إجراء DCD HT. CPB = المجازة القلبية الرئوية.
Discussion
على الرغم من فعالية زراعة القلب في علاج قصور القلب في المرحلة النهائية ، لا تزال هناك تحديات كبيرة في هذا المجال. لمكافحة التوافر المحدود للأعضاء المانحة ، ارتفعت التطورات في طرق الحفاظ على الطعم الخيفي للقلب (على سبيل المثال ، التروية الآلية القياسية) إلى المقدمة في السنوات الأخيرة. أدت هذه التطورات إلى اعتماد زرع الطعوم الخيفية القلبية بعد التبرع بعد الموت أثناء الدورة الدموية (DCD HT). في حين أن استخدام الطعوم الخيفية DCD HT وسع مجموعة المتبرعين وله نتائج قصيرة المدى غير أقل شأنا من الطعوم الخيفية DBD HT ، لا يزال هناك خطر بنسبة 5٪ تقريبا من الوفيات المبكرة في الفترة المحيطة بالزرع المرتبطة بكلا النوعين من المتبرعين3. إن خطر الوفاة المبكرة في زراعة القلب مدفوع في الغالب باضطراب الوراثة قبل الزرع (PGD). في حين أن التشخيص الوراثي قبل الزرع متعدد العوامل في المسببات مع بعض المساهمة في متغيرات المتبرع والمتلقي والحفظ المحددة ، فإن الآليات الجزيئية الكامنة وراء التشخيص الوراثي قبل الزرع لا تزال غير مفهومة بشكل عام. علاوة على ذلك ، بالنظر إلى الإصابة الإقفارية الدافئة المضافة التي تكبدتها عملية DCD HT ، فليس من المستغرب أن تكون هذه القلوب ، مقارنة بالطعوم الخيفية DBD ، أكثر عرضة للإصابة بالتشخيص الوراثي قبل الزرع. لذلك ، فإن الفهم الأفضل للتشخيص الوراثي قبل الزرع مهم للمساعدة في تقليل مخاطر الوفاة قصيرة المدى بعد زراعة القلب التقويمي ، وقد يكون هذا صحيحا بشكل خاص بالنسبة ل DCD HT.
هنا ، نصف نموذجا جراحيا عالي الدقة من DCD HT. لا تشمل فوائد نمذجة DCD HT في الجسم الحي في نموذج حيواني كبير القدرة على فهم التغيرات الفيزيولوجية المرضية التي تحدث في الطعم الخيفي الذي تم شراؤه أثناء DCD HT فحسب ، بل تشمل أيضا القدرة على اختبار التدخلات المستهدفة التي تهدف إلى ضمان الجودة المثلى للطعم الخيفي. يشير تقييم وظيفة البطين الأيسر بعد الزرع ، وتحليل حلقة حجم الضغط إلى أن هذا النموذج الجراحي للخنازير قادر على تلخيص الخلل الوظيفي المبكر للطعم الخيفي للقلب بعد DCD HT. وبالتالي ، فإن التقنية المفصلة هنا تخلق نموذجا حيوانيا كبيرا قابلا للتكرار من التشخيص الوراثي قبل الزرع بعد DCD HT وهي قابلة لتقييم الاستراتيجيات العلاجية في العديد من النقاط على طول عملية DCD HT. في الواقع ، يعد استخدام التروية خارج الجسم الحي كوسيلة لتقديم علاجات جديدة ، مثل العلاج الجيني بوساطة النواقل الفيروسية ، مجالا نشطا للتركيز في مختبرنا وآخرين18،19،20. لقد أظهرنا سابقا القدرة على توصيل جين معدل وراثيا بقوة وبشكل متجانس إلى طعم خيفي قلبي باستخدام نموذج HT غير DCD للخنازير. يمكن تطبيق نفس التقنيات على نموذج DCD HT19،20. تشمل الاستراتيجيات العلاجية المحتملة الأخرى التعديل الكيميائي للنفيوم ، وتوصيل الجزيئات الصغيرة التي تهدف إلى تقليل الإجهاد التأكسدي ، وتوفير ركائز أيضية لدعم عملية التمثيل الغذائي خلال فترة نقص تروية ، وما إلىذلك 16،21،22. علاوة على ذلك ، يمكن بسهولة تكييف النموذج المقدم هنا لتقييم المتغيرات المختلفة المرتبطة ب DCD HT ، بما في ذلك تقنيات الشراء المختلفة المستخدمة سريريا. على سبيل المثال ، نصف الشراء المباشر واستراتيجية التروية خارج الجسم الحي . ومع ذلك ، يمكن بسهولة تكييف النموذج لدمج طرق بديلة للتروية للمشتريات ، بما في ذلك التروية الإقليمية النورمثيرة.
تعكس التقنية الجراحية المستخدمة في هذا النموذج عن كثب تلك المستخدمة في البيئة السريرية. ومع ذلك ، هناك بعض الاختلافات الرئيسية. أولا ، يحدث بضع القص والتعرض للقلب قبل التوقف عن الدعم القلبي الرئوي ، والمرحلة المعاناة ، وتحديد الوفاة ، وفترة المواجهة المطلوبة أخلاقيا (نموذج الصدر المفتوح)23. يتم إجراء بضع القص بهذا الترتيب بحيث يمكن إجراء تقييم قلب المتبرع الأساسي ، بما في ذلك خزعات عضلة القلب. أظهر التقييم المسبق لتوقيت بضع القص في نموذج DCD HT الخنازير أن التقدم من سحب تدابير الحفاظ على الحياة إلى الموت (الوقت الإقفاري الدافئ) يكون أكثر سرعة مع التغيرات الديناميكية الدموية المصاحبة الأقل وضوحا في نموذج الصدر المفتوح. قد تواجه هذه الطعوم الخيفية ظروفا أقل ضررا أثناء الشراء. ومع ذلك ، لم تكن هناك فروق ذات دلالة إحصائية في القيم المعملية الكيميائية الحيوية (اللاكتات ، الجلوكوز ، الكاتيكولامين ، إلخ) أو علامات موت الخلايا بين مجموعات الصدر المغلقة والمفتوحة24. علاوة على ذلك ، نظرا لإدراج فترة المواجهة البالغة 10 دقائق في النموذج ، فإن الوقت من سحب التهوية إلى نقص التروية الدافئ الوظيفي في هذا النموذج يشبه إلى حد كبير توقيت مجموعة الصدر المغلقة للدراسة المذكورة. بالإضافة إلى ذلك ، ضمن هذا النموذج ، يعد وقت نقص التروية الدافئة الوظيفية متغيرا يمكن تعديله ليناسب الأهداف التجريبية لدراسة معينة. هناك اختلاف محتمل آخر بين النموذج المبلغ عنه هنا والإعداد السريري وهو أن النشاط الكهربائي بدون نبض (PEA ؛ الانقباض الميكانيكي) يستخدم لتحديد الموت في هذا النموذج. في السياق السريري ، يتم إصدار إعلان الوفاة من قبل طبيب لا يشارك في عملية الزرع. إما أن PEA ، إلى جانب عدم وجود علامات أخرى للحياة أو الانقباض الكهربائي ، سيكون مقبولا لتلبية معايير إعلان الوفاة. استمرت قلوب الخنازير في النشاط الكهربائي لفترة طويلة بعد توقف الانقباض. من أجل تجنب الضرر الإقفاري الدافئ الذي لا يتناسب مع ذلك الذي شوهد في السياق السريري ، تم استخدام الانقباض الميكانيكي (PEA) لتعريف الوفاة. بالنسبة للمحققين الذين يستخدمون نموذج الصدر المغلق ل DCD ، لا يزال من الممكن استخدام النشاط الكهربائي بدون نبض (نقص النبض على الخط الشرياني) كمعيار لتحديد الوفاة. لم نجد أن تشبع الأكسجين المحيطي كان علامة ذات صلة بتحديد بداية الفترة المعاناة أو لتحديد الوفاة.
أخيرا ، ما وصفناه هنا هو نموذج كثيف الاستخدام للوقت والموارد. من إعداد الخنزير المتبرع إلى موت المتلقي يستغرق حوالي 10 ساعات ويتطلب جهدا تعاونيا كبيرا. يضم الفريق الإجرائي جراحي القلب ذوي الخبرة وأطباء التخدير القلبي وأخصائيي التروية والموظفين البيطريين والمختبريين الذين يساعدون في جمع العينات ومعالجتها. فريق كبير مثل هذا جزء لا يتجزأ من الإجراء المعقد ل DCD HT. ومع ذلك ، مع فريق متمرس ، من الممكن إنشاء نموذج خنزير عالي الدقة ل DCD HT ، كما هو موضح في هذه المخطوطة.
Disclosures
تلقت CAM تعويضا عن الأسهم للعمل كمستشار لشركة TransMedics Inc.
Acknowledgements
نشكر الدعم الفني البيطري من Duke Laboratory Animal Resources ، ودعم التروية من Centrifugal Solutions ، وفرق التخدير القلبي الوعائي في Duke على دعمهم الذي لا يقدر بثمن لهذه التجارب الجراحية. كما نعرب عن تقديرنا الصادق ل Paul Lezberg و TransMedics، Inc. لدعمهم.
Materials
| Name | Company | Catalog Number | Comments |
| 0-0 silk suture with needle | DemeTECH | SK260026B0P | |
| 0-0 silk ties | DemeTECH | SK6X2600 | |
| 1/4" x 1/4" straight connector | Liva Nova | 5050400 | |
| 10% Formalin | VWR | 16004-126 | |
| 2-0 Ethibond SH | Covidien | 3369-51 | |
| 2-0 silk pops | Covidien | GS62M | |
| 2-0 silk suture with needle | DemeTECH | SK262026B0P | |
| 2-0 silk ties | DemeTECH | SK13X6620W | |
| 5 Fr micropuncture | Cook Medical | G48007 | |
| 6 Fr introducer sheath | Terumo | RSS605 | |
| 7.0 Fr Triple Lumen central venous line | Cook Medical | G47833 | |
| Aggrastat (tirofiban HCl) 2 mg | obtained from institutional pharmacy | N/A | |
| Albumin 25% 12.5 g/50 mL | obtained from institutional pharmacy | N/A | |
| Blood access sample for autologous blood recovery (spike with one-way stopcock) | Liva Nova | 7016000 | |
| Blood typing kit | Eldon Biologicals | 892165002056 | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Calcium gluconate 1 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Cefazolin 1 g | obtained from institutional pharmacy | N/A | |
| Ciprofloxacin in D5W 200 mg/100 mL | obtained from institutional pharmacy | N/A | |
| Core needle biopsies 18 G TEMNO Care Fusion | Merit Medical | CA1820 | |
| CPT 8ml tubes for PBMCs | BD Bioscience | 362761 | |
| Cryogenic laster labels for frozen vials and containers - 1.28" x 0.5" | LabTAG | LCS-23 | |
| D5W 500 mL | obtained from institutional pharmacy | N/A | |
| Del Nido cardioplegia 1 L | obtained from institutional pharmacy | N/A | |
| DLP 0.64cm (1/4 in) perfusion adapter | Medtronic | 10007 | |
| Dopamine 200 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Double-armed 4-0 prolene on BB needle | DemeTECH | PM1094017G0P | |
| Double-armed 4-0 prolene on RB-1 needle | DemeTECH | PM1094017C0P | |
| Echo probe covers | Microtek Medical | PC1292 | |
| EDTA 10 mL blood tubes: BD Vacutainer venous blood collection tubes BD Medical | VWR | BD-366643 | |
| Epicardial pacing wires | A&E Medical | 024-200 | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Epinephrine 1 mg/mL | obtained from institutional pharmacy | N/A | |
| Esmolol 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Heparin 10,000 unit/10 mL | obtained from institutional pharmacy | N/A | |
| Insulin regular (humulin R) 100 unit/1 mL | obtained from institutional pharmacy | N/A | |
| ISTAT Activated Clotting Time (ACT) Kaolin cartridges | Abbott | 03P87-25 | |
| ISTAT CG8+ cartridges | Abbott | 03P88-25 | |
| IV Amiodarone 150 mg/3 mL | obtained from institutional pharmacy | N/A | |
| IV Heparin 10,000 U/10 mL | obtained from institutional pharmacy | N/A | |
| IV Lidocaine | obtained from institutional pharmacy | N/A | |
| IV Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Lidocaine 2% hydrochloride injection USP 100 mg/5 mL | obtained from institutional pharmacy | N/A | |
| Long 3-0 prolene on SH needle | DemeTECH | PM1093026C0P | |
| Methylprednisolone 125 mg/2 mL | obtained from institutional pharmacy | N/A | |
| Microcentrifuge tube with flat screw-cap | VWR | 16466-060 | |
| Multivitamin (infuvite adult) | obtained from institutional pharmacy | N/A | |
| Nalgene sterile specimen cryogenic vial with screw closure | VWR | 66008-740 | |
| Norepinephrine 4 mg/4 mL | obtained from institutional pharmacy | N/A | |
| OCS disposable Heart kit | TransMedics | N/A | |
| Organ Care System (OCS) Heart Module | TransMedics | N/A | |
| Oxygen tank | TransMedics | N/A | |
| Pacing cables | Remington Medical | ADAP-2000 | |
| Phenylephrine hydrochloride 100 mg/10 mL | obtained from institutional pharmacy | N/A | |
| Pledgets | Covidien | 8677-01 | |
| Pressure-volume loop catheter (Ventricath 512, 5Fr, 122 cm) | AD Instruments | Ventricath-512 | |
| Protamine 50 mg/5 mL | obtained from institutional pharmacy | N/A | |
| RNAlater | Thermo Fisher | AM7024 | |
| Scigen Tissue-Plus O.C.T compound | FisherSci | 23-730-571 | |
| Smart Perfusion Pack: double rapid prime line stock | Liva Nova | 26020000 | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sodium bicarbonate 50 mEq/50 mL | obtained from institutional pharmacy | N/A | |
| Sterile water vial (10 mL) | obtained from institutional pharmacy | N/A | |
| Tissue-Tek Cryomold molds/adapters, Sakura Finetek | VWR | 25608-924 & 25608-916 | |
| Tissue-Tek Mega-Cassette System, Sakura Finetek | VWR | 25608-844 | |
| Umbilical tape | CP Medical | CP12A | |
| Vasopressin | obtained from institutional pharmacy | N/A | |
| Vecuronium 10 mg vial | obtained from institutional pharmacy | N/A | |
| Vessel loops | Medline | DYNJVL03 | |
| Weck Horizon Titanium Ligating Clips, Large | Teleflex | 4200 | |
| Weck Horizon Titanium Ligating Clips, Medium | Teleflex | 2200 | |
| Weck Horizon Titanium Ligating Clips, Small | Teleflex | 1201 |
References
- International Society for Heart and Lung Transplantation. , ISHLT fast facts. https://www.ishlt.org/education-and-publications/resource/ishlt-fast-facts (2024).
- Trivedi, J. R., et al. Predictors of donor heart utilization for transplantation in United States. Ann Thorac Surg. 103 (6), 1900-1906 (2017).
- Schroder, J. N., et al. Transplantation outcomes with donor hearts after circulatory death. N Engl J Med. 388 (23), 2121-2131 (2023).
- Messer, S., et al. A 5-year single-center early experience of heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 39 (12), 1463-1475 (2020).
- Messer, S., et al. Outcome after heart transplantation from donation after circulatory-determined death donors. J Heart Lung Transplant. 36 (12), 1311-1318 (2017).
- Jawitz, O. K., et al. Increasing the United States heart transplant donor pool with donation after circulatory death. J Thorac Cardiovasc Surg. 159 (5), e307-e309 (2020).
- White, C. W., et al. Transplantation of hearts donated after circulatory death. Front Cardiovasc Med. 5, 8(2018).
- Lee, C., Tsai, C., Adler, E., Pretorius, V. Emerging frontier in heart transplantation: donation after circulatory death. , American College of Cardiology. https://www.acc.org/Latest-in-Cardiology/Articles/2022/11/21/13/31/Emerging-Frontier-in-Heart-Transplantation (2022).
- Messer, S., et al. A national pilot of donation after circulatory death (DCD) heart transplantation within the United Kingdom. J Heart Lung Transplant. 42 (8), 1120-1130 (2023).
- Kwon, J. H., et al. Early outcomes of heart transplantation using donation after circulatory death donors in the United States. Circ Heart Fail. 15 (12), e009844(2022).
- Pasrija, C., Tipograf, Y., Shah, A. S., Trahanas, J. M. Normothermic regional perfusion for donation after circulatory death donors. Curr Opin Organ Transplant. 28 (2), 71-75 (2023).
- Benkert, A. R., et al. heart transplant experience with normothermic regional perfusion following donation after circulatory death. JACC Heart Fail. 12 (12), 2073-2083 (2024).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant. 33 (4), 327-340 (2014).
- Iyer, A., et al. Pathophysiological trends during withdrawal of life support: implications for organ donation after circulatory death. Transplantation. 100 (12), 2621-2629 (2016).
- White, C. W., et al. Physiologic changes in the heart following cessation of mechanical ventilation in a porcine model of donation after circulatory death: implications for cardiac transplantation. Am J Transplant. 16 (3), 783-793 (2016).
- Arnold, M., et al. Metabolic considerations in direct procurement and perfusion protocols with DCD heart transplantation. Int J Mol Sci. 25 (8), 4153(2024).
- Dann, T. M., et al. Donor heart refusal after circulatory death: an analysis of United Network for Organ Sharing refusal codes. J Thorac Cardiovasc Surg Open. 27 (18), 91-103 (2024).
- Pla, M. M., Bowles, D. E. Ex vivo gene therapy in organ transplantation: considerations and clinical translation. Hum Gene Ther. 35 (7-8), 284-297 (2024).
- Pla, M. M., et al. Ex vivo gene delivery to porcine cardiac allografts using a myocardial-enhanced adeno-associated viral vector. Hum Gene Ther. 34 (7-8), 303-313 (2023).
- Bishawi, M., et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep. 9 (1), 8029(2019).
- Silvis, M. J. M., et al. Damage-associated molecular patterns in myocardial infarction and heart transplantation: the road to translational success. Front Immunol. 11, 599511(2020).
- Zuurbier, C. J., et al. Cardiac metabolism as a driver and therapeutic target of myocardial infarction. J Cell Mol Med. 24 (11), 5937-5954 (2020).
- Heinis, F. I., et al. Considerations for the use of porcine organ donation models in preclinical organ donor intervention research. Anim Models Exp Med. 7, 283-296 (2024).
- Hubacher, V., et al. Open- vs. closed-chest pig models of donation after circulatory death. Front Cardiovasc Med. 11, 1325160(2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved