Method Article
Modelo de camundongo com ferida por faca para estudar hemorragia e inflamação em lesão cerebral traumática
Neste Artigo
Resumo
Modelos simplificados de traumatismo cranioencefálico (TCE) facilitaram o desenvolvimento de abordagens terapêuticas. Este protocolo descreve a criação de um córtex de camundongo ferido por facada usando agulhas, permitindo a análise de hemorragia e inflamação. O modelo de camundongo TBI com ferida por faca oferece a vantagem de ser realizado sem a necessidade de equipamento especializado.
Resumo
O traumatismo cranioencefálico (TCE) resulta de danos físicos, muitas vezes causados por acidentes ou incidentes relacionados ao esporte. As causas do TCE são diversas, incluindo concussões, contusões cerebrais, hematomas e fraturas cranianas. Para replicar essas diferentes causas, vários modelos de camundongos TBI foram desenvolvidos usando protocolos distintos. A lesão cerebral física leva a lesões cerebrais primárias e secundárias, que exacerbam a perda neuronal. A lesão primária ocorre imediatamente após o dano, geralmente devido a hemorragia, e subsequentemente desencadeia lesões secundárias, incluindo inflamação ao redor da lesão. O desenvolvimento de um modelo de TCE adequado para avaliar a extensão da hemorragia e a gravidade inflamatória é, portanto, crucial. Este protocolo apresenta um método para imitar a lesão cerebral penetrante, conhecido como modelo de camundongo com TCE por facada, para estudar os mecanismos de hemorragia, inflamação e perda neuronal associados à patologia do TCE. Este modelo é criado perfurando o crânio e o cérebro com agulhas e é simples de executar sem a necessidade de equipamentos experimentais especializados. Além disso, a pequena lesão infligida ao córtex cerebral do camundongo usando uma agulha não afeta o comportamento do animal após a cirurgia. Esse recurso permite que os pesquisadores estudem os efeitos localizados da lesão cerebral sem se preocupar com consequências comportamentais mais amplas. Dados de amostra de córtices cerebrais de camundongos feridos por facada demonstram a eficácia do modelo na avaliação do vazamento de sangue para o parênquima, ativação glial e produção de citocinas inflamatórias. Além disso, esse protocolo facilita a avaliação de coagulantes sanguíneos e compostos anti-inflamatórios, auxiliando no desenvolvimento de agentes terapêuticos para TCE.
Introdução
O traumatismo cranioencefálico (TCE) é causado por danos físicos, muitas vezes resultantes de acidentes, incluindo acidentes de trânsito e acidentes de queda. O TCE é classificado em dois tipos: lesão cerebral penetrante, que ocorre quando um objeto pontiagudo perfura o crânio e o cérebro, e lesão cerebral fechada, que é causada por tremor violento do cérebro interno sem ruptura no crânio1.
As causas do TCE são muito diversas, incluindo concussões, contusões cerebrais, hematomas e fraturas cranianas; portanto, modelos de camundongos TBI foram desenvolvidos usando vários protocolos para replicar essas diferentes causas. Por exemplo, um modelo de TCE concussivo repetitivo envolve tremores cerebrais, onde os camundongos são presos várias vezes usando um impactador de borracha controlado eletromagneticamente2. Além disso, no modelo de TCE de queda de peso, uma forte força externa é exercida na cabeça por um dispositivo padronizado de queda de peso, causando lesão contusa focal com crânio intacto3. Além disso, o modelo de TCE com ferimento por arma branca é preparado perfurando o crânio e o cérebro usando uma agulha4 (Figura 1A). Uma vez que vários modelos de TCE foram desenvolvidos, é importante escolher um modelo baseado na patologia específica que precisa ser observada.
A lesão cerebral causada por danos físicos leva a lesões cerebrais primárias e secundárias, que exacerbam ainda mais a perda neuronal. A lesão primária ocorre imediatamente após o dano, resultante da quebra da barreira hematoencefálica (BHE), hemorragia e hematoma. Portanto, minimizar a hemorragia e a expansão do hematoma é crucial, pois esses fatores podem exacerbar a gravidade dos sintomas do TCE. A lesão secundária é desencadeada por componentes sanguíneos intraparenquimatosos que, posteriormente, levam à inflamação ao redor dalesão5. O prognóstico após lesão cerebral depende da dinâmica inflamatória; portanto, é crucial mitigar rapidamente as lesões primárias e secundárias para um prognóstico favorável 6,7,8.
A BHE é composta por pericitos, junções apertadas entre as células endoteliais e os pés finais dos astrócitos, que trabalham juntos para restringir o vazamento de substâncias dos vasos sanguíneos em cérebros saudáveis9. No sistema de ferimento por arma branca apresentado, o BBB é fisicamente interrompido. Métodos comuns para avaliar a integridade da BHE incluem a coloração para imunoglobulina G (IgG) e a avaliação do vazamento de traçadores de fluorescência, como azul de Evans e dextrana 10,11. A coloração de IgG marca os componentes sanguíneos que vazam do local da lesão e se depositam no cérebro. À medida que a BHE se recupera, o vazamento de componentes sanguíneos para o cérebro diminui e esses depósitos são gradualmente degradados. Portanto, a coloração IgG é usada para avaliar a extensão da recuperação da BHE após lesão cerebral. Além disso, o nível de vazamento do marcador administrado por via intravenosa no parênquima cerebral reflete a recuperação da BHE. Este método fornece uma avaliação mais clara da dinâmica da BHE, pois o vazamento do traçador indica diretamente a transição dos componentes sanguíneos da corrente sanguínea para o parênquima cerebral. Além disso, minimizar a hemorragia leva a uma lesão primária mais leve, que é apoiada pela coagulação sanguínea imediata e fibrinólise oportuna. Portanto, quantificar a expressão de reguladores de coagulação sanguínea e fibrinólise é uma maneira eficaz de analisar esse processo. Em relação ao mecanismo molecular subjacente à coagulação, a hemorragia após lesão cerebral é interrompida pela formação de fibrina. Posteriormente, o trombo rico em fibrina é degradado pelo ativador do plasminogênio tecidual (tPA) e pelo ativador do plasminogênio da uroquinase (uPA). No modelo de camundongo com TCE por facada, a formação de fibrina atinge o pico 1 dia após a lesão e diminui depois disso10. Assim, o nível de recuperação da BHE pode ser previsto pela quantificação dos componentes sanguíneos e extravasamento do traçador para o parênquima cerebral, bem como a expressão dos fatores de coagulação sanguínea.
Os métodos de quantificação da inflamação no processo de lesão secundária incluem ativação glial e expressão de citocinas inflamatórias. A inflamação prolongada é induzida principalmente pelo acúmulo excessivo de micróglia e astrócitos ao redor do local da lesão. Por exemplo, em um modelo de TCE por arma branca, as feridas por arma branca estimulam a reativação das células gliais ao redor da lesão para remover os restos celulares e os componentes do sangue. Essa reativação glial geralmente atinge o pico 3 dias após a facada12,13. Além de sua função de fagocitose, as células gliais reativadas secretam citocinas inflamatórias excessivas, resultando em perda neuronal ao redor da lesão14. Tem sido relatado que a atenuação da inflamação glial contribui para um prognóstico favorável após lesão cerebral12,14. Determinar o nível de inflamação é útil para avaliar a gravidade e o prognóstico. Portanto, é essencial desenvolver um modelo de TCE adequado para avaliar a extensão da hemorragia e a gravidade inflamatória. Este estudo apresenta um modelo de camundongo com ferida aguda que imita lesão cerebral penetrante, com o objetivo de estudar os mecanismos de hemorragia, inflamação e perda neuronal na patologia do TCE.
Protocolo
Todos os protocolos de cuidados com os animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Ochanomizu, Japão, e foram realizados de acordo com as diretrizes estabelecidas pelo Ministério da Educação, Ciência e Cultura do Japão. Foram utilizadas fêmeas C57BL/6J adultas com seis semanas de idade (20-25 g). Todos os camundongos tiveram acesso ad libitum a comida e água em um ambiente limpo. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Cirurgia de facada no córtex cerebral
- Preparação de reagentes
NOTA: O protocolo anestésico é semelhante ao descrito anteriormente15. Se o biotério recomendar um anestésico específico, siga as instruções. Foi previamente confirmado que o pentobarbital sódico é eficaz para cirurgia de ferimento perfurocortante no córtex cerebral 4,13,16,17.- MMB anestésico combinado: Dissolva 1,875 mL de 1 mg/mL de medetomidina, 2,0 mL de 5 mg/mL de midazolam e 2,5 mL de tartarato de butorfanol 5 mg/mL em 18,625 mL de solução salina tamponada com fosfato (PBS) para criar um volume total de 25 mL. Esta mistura terá uma concentração de 75 mg/L de medetomidina, 400 mg/L de midazolam e 500 mg/L de tartarato de butorfanol. Conservar a 4 °C até 8 semanas antes da utilização.
- Antagonista da anestesia: Dissolva 150 μL de cloridrato de atipamezol 5 mg / mL em 9,85 mL de PBS para criar um volume total de 10 mL, com uma concentração de 75 mg / L de cloridrato de atipamezol. Conservar a 4 °C, protegido da luz, até 8 semanas antes da utilização.
- Procedimento cirúrgico
- Anestesia com camundongos: Anestesie temporariamente os camundongos usando um papel embebido em solução para inalação de isoflurano até que adormeçam. Em seguida, injete 10 μL/g de MMB anestésico combinado intraperitoneal usando uma seringa de 1 mL com uma agulha de 27 G x 3/4". Após 3-5 min, confirme a eficácia da anestesia realizando uma pinça do dedo do pé e verificando o reflexo de endireitamento.
NOTA: Certifique-se de prestar muita atenção para não dar uma overdose de anestesia ao usar solução inalatória de isoflurano. - Coloque o rato do lado ventral em uma toalha de papel. Após a transferência, reconfirme se o mouse ainda está anestesiado com uma pitada no dedo do pé.
- Raspe o pelo na pele da região occipital. Esterilize o pelo na parte de trás da cabeça do rato com etanol 70% usando um cotonete. Segure a pele occipital com uma pinça romba e faça uma incisão de 1,0-1,5 mm de largura para expor o osso occipital sem danificar o crânio ou qualquer órgão. Abra a incisão com cuidado e devagar-se para observar o limite entre o córtex cerebral e o cerebelo através do crânio (Figura 1B).
NOTA: Certifique-se de que nenhum dano ocorra ao crânio ou ao cérebro do mouse sem ferimentos. - Craniotomia de camundongo: Crie um pequeno orifício no hemisfério direito do osso occipital usando uma agulha de 19 G x 1•1/2". Gire suavemente a agulha para fazer um ponto de inserção para agulhamento de facada, tomando cuidado para não danificar o parênquima cerebral. O orifício deve ser posicionado no ponto médio da linha interaural do hemisfério direito entre lambda e borda (Figura 1B). Este orifício serve como guia para a inserção da agulha perfurada na etapa subsequente.
- Ferida por facada: Insira uma agulha de 27 G x 3/4" do ponto de inserção e esfaqueie o córtex cerebral ao longo do eixo rostrocaudal (Figura 1B, C). A agulha é inserida até entrar em contato com a frente do crânio e, em seguida, retirada suavemente. A profundidade apropriada é aquela em que a agulha pode ser vista através da superfície do córtex cerebral. O lado esquerdo do córtex cerebral é usado como controle não danificado.
- Suturar a incisão da pele usando uma sutura de nylon 3-0 com uma agulha de 1/2 rodada.
- Administre 10 μL / g do antagonista da anestesia por via intraperitoneal como o MMB anestésico combinado. O camundongo deve ser capaz de andar dentro de 8-16 h após a injeção do antagonista da anestesia.
- Anestesia com camundongos: Anestesie temporariamente os camundongos usando um papel embebido em solução para inalação de isoflurano até que adormeçam. Em seguida, injete 10 μL/g de MMB anestésico combinado intraperitoneal usando uma seringa de 1 mL com uma agulha de 27 G x 3/4". Após 3-5 min, confirme a eficácia da anestesia realizando uma pinça do dedo do pé e verificando o reflexo de endireitamento.
2. Avaliação da hemorragia e recuperação da ruptura da BHE
- Coloração imunoenzimática de uma seção cerebral ferida por arma branca para vazamento de IgG em camundongos
NOTA: Aqui, seções cerebrais congeladas montadas em lâminas foram usadas. Seções cerebrais congeladas flutuantes também são adequadas para este protocolo.- Anestesia com camundongo: Induza a anestesia colocando o camundongo perto de um papel embebido em solução para inalação de isoflurano até adormecer. Em seguida, administre imediatamente 100 μL/kg de MMB anestésico combinado por via intraperitoneal. Confirme o efeito da anestesia com uma pinça do dedo do pé e reflexo de endireitamento.
- Coloque o mouse de costas e prenda os braços e os pés na placa de dissecação.
- Toracotomia de camundongo: Segure a pele abdominal usando uma pinça romba e faça uma incisão de 1,0-1,5 cm através da pele e do peritônio para expor a caixa torácica. Abra cuidadosamente a caixa torácica com uma tesoura, evitando danos ao coração para expô-lo à perfusão cardíaca.
- Fixação de perfusão cardíaca: Prepare uma bomba de perfusão peristáltica e conecte um tubo com uma agulha de 19 G x 1•1/2" em uma extremidade. Encha o tubo com PBS ligando a bomba antes de usar. Em seguida, enquanto a bomba estiver funcionando, insira a ponta da agulha no ventrículo esquerdo e prenda-a com uma pinça. Faça uma incisão de 0,5-1,0 mm no átrio direito. Perfunda o camundongo18 a uma taxa de 4-6 mL / min por 5 min com pelo menos 20 mL de PBS para remover o sangue.
- Pare a bomba e transfira o tubo para uma solução de paraformaldeído (PFA) a 4% em PBS. Reinicie a bomba a uma taxa de 4-6 mL/min por 5 min com pelo menos 20 mL de PFA a 4% em PBS para fixação18.
NOTA: Se a bomba não estiver disponível, também é possível usar uma seringa de 50 mL com uma agulha de 19 G x 1•1/2" para perfusão. - Dissecção cerebral: Coloque o camundongo em seu lado ventral na placa de dissecação e exponha o crânio fazendo uma incisão na linha média da pele, da área occipital até o nariz. Exponha cuidadosamente o cérebro completamente, removendo o crânio com uma tesoura, tomando cuidado para não danificar o cérebro. Levante o cérebro com uma pinça curva e transfira-o para um tubo de 15 mL cheio de 10 mL de PFA a 4% em PBS.
- Incube o cérebro dissecado durante a noite no PFA a 4% em PBS a 4 ° C para fixação completa. Em seguida, incube o cérebro durante a noite em 10 mL de sacarose a 15% em PBS e transfira-o para 10 mL de sacarose a 30% em PBS por mais um dia em um agitador de gangorra. Essa substituição gradual de sacarose ajuda a prevenir danos aos tecidos causados pelo gelo quando o cérebro é armazenado posteriormente em um freezer.
- Incorporação cerebral: Incorpore o cérebro coronalmente em um meio de inclusão dentro de um molde de incorporação de tecido e, em seguida, congele usando 2-metilbutano com gelo seco19.
- Seções cerebrais congeladas: Usando um criostato, monte seções coronais seriais (20 μm de espessura) do cérebro embutido em um vidro deslizante carregado positivamente. As seções cerebrais são secas completamente ao ar em temperatura ambiente durante a noite e armazenadas em um freezer a -80 ° C.
- Preparação do tampão de bloqueio: Misture 10% de soro de bezerro recém-nascido, 30 mg/mL de albumina bovina, 10 mg/mL de glicina e 0,4% de Triton X-100 em TBS para criar o tampão de bloqueio. Conservar a 4 °C até 2 semanas antes da utilização.
- Coloração de IgG em camundongos: Depois que as seções do córtex cerebral feridas por facadas forem secas ao ar em temperatura ambiente por 1 h, pós-fixe-as com 500 μL de PFA a 4% por lâmina por 30 min. Em seguida, lave a seção com PBS (500 μL / lâmina) por 5 min, seguida de duas lavagens com solução salina tamponada com Tris (TBS, 500 μL / lâmina) por 5 min cada.
NOTA: Realize todos os procedimentos em uma caixa de hidratação para evitar que os tampões evaporem. - Extinguir a atividade enzimática endógena em seções com 10% de metanol e 3% de peróxido de hidrogênio em TBS por 5 min, seguido de duas lavagens com solução salina tamponada com Tris (TBS, 500 μL/lâmina) por 5 min cada.
- Execute o bloqueio usando um tampão de bloqueio (500 μL / lâmina) por 1 h à temperatura ambiente para evitar a ligação não específica do anticorpo. Em seguida, incubar as secções com um anticorpo IgG de ratinho conjugado com biotina (diluição de 1:300 com o tampão de bloqueio, 300 μL/lâmina) durante 1 h à temperatura ambiente.
- Durante a incubação com o anticorpo IgG de camundongo, prepare a mistura de 1 μL de reagente A e 1 μl de reagente B do kit do sistema de peroxidase à base de avidina/biotina em 300 μL do tampão de bloqueio. Incube esta mistura por 30 min em temperatura ambiente antes de usar. Após a incubação do anticorpo IgG do camundongo estar completa, lave as seções com TBS por 5 min, três vezes. Em seguida, incubar as secções com a mistura preparada de reagente A e B (300 μl/lâmina) durante 1 h à temperatura ambiente.
- Lave as seções com 0,1 M Tris-HCl pH 8,0 por 5 min, três vezes, ao longo de 1 h. Em seguida, desenvolva a cor usando 0,05% de 3,3'-diaminobenzidina (DAB) em 0,05% de peróxido de hidrogênio adicionado 0,1 M Tris-HCl pH 8,0 (500 μL / lâmina) por 5 min a 1 h ( Figura 2A ). Observe ao microscópio a mudança de cor antes de interromper a reação.
- Lave as seções com 0,1 M Tris-HCl pH 8,0 por 5 min três vezes e seque as seções ao ar por 15 min. Em seguida, desidrate as seções imergindo-as em etanol a 95% por 2 min duas vezes, seguido de etanol a 100% por 2 min, duas vezes. Limpe as seções em xileno por 5 min duas vezes. Cubra as seções usando um meio de montagem insolúvel em água e deixe-as secar.
- Análise da intensidade da coloração IgG do camundongo: Capture imagens das seções usando um microscópio com objetiva de 20x.
- Usando o software ImageJ, quantifique a intensidade da coloração medindo os valores médios de cinza em cinco campos selecionados aleatoriamente (8 × 8 μm2 para cada) de regiões coradas imunoenzimaticamente em cada seção. Normalize a intensidade da coloração usando o valor médio de cinza de cada contralateral; não há região ferida como correção de fundo. Calcule a média dos valores médios de cinza normalizados dos cinco campos para determinar o valor médio de cinza da coloração IgG de camundongo para cada seção.
- Avaliação do vazamento de azul de Evans para o parênquima cerebral
NOTA: O protocolo azul de Evans é semelhante ao método descrito anteriormente11. O dextrano marcado com isotiocianato de fluoresceína (FITC) também funciona para a recuperação da quebra do BBB10.- Injeção de azul de Evans: Administre 2% de azul de Evans em PBS (3 mL / kg) ao camundongo ferido por facada através da veia da cauda 1 h antes da dissecção.
- Extração de cérebro fresco: 1 h após a administração de azul de Evans, perfundir o camundongo com PBS conforme descrito nas etapas 2.1.1-2.1.4. Em seguida, disseque e corte o cérebro fresco coronalmente em seções de 1 mm de espessura usando um cortador de cérebro. Selecione quatro fatias e corte pedaços de cérebro (1 mm2 quadrados, cada) que incluam a região da ferida por facada ou regiões intactas no córtex cerebral sem ferida, de acordo com o papel milimetrado (Figura 1D).
- Quantificação do azul de Evans: Colete os quatro pedaços de cérebro em um tubo de 1,5 mL e homogeneize-os com 200 μL de ácido tricloroacético usando um moedor de tecido. Centrifugar o homogeneizado a 10.000 x g a 4 °C durante 20 min. Em seguida, recolher o sobrenadante com uma pipeta e diluí-lo com 600 μL de etanol. Prepare uma curva padrão de azul de Evans, variando de 0-1,0 ng/mL, para quantificar sua concentração. Medir a intensidade de fluorescência a 680 nm com um comprimento de onda de excitação de 620 nm utilizando um leitor de placas.
3. Avaliação do nível de inflamação no cérebro após ferimento por arma branca
- Coloração imunoenzimática de secção cerebral ferida por arma branca para células gliais
- Preparação das seções cerebrais: Faça os vidros de lâminas montados nas seções cerebrais conforme descrito nas etapas 2.1.1-2.1.9.
- Coloração glial: Após secar ao ar as seções do córtex cerebral feridas por facada por 1 h, fixe as seções novamente com PFA a 4% (500 μL / lâmina) por 30 min. Em seguida, lave os cortes com PBS (500 μL/lâmina) por 5 min, seguido de duas lavagens com TBS (500 μL/lâmina) por 5 min cada.
- Extinguir a atividade enzimática endógena em seções com 10% de metanol e 3% de peróxido de hidrogênio em TBS por 5 min, seguido de duas lavagens com solução salina tamponada com Tris (TBS, 500 μL/lâmina) por 5 min cada.
- Execute o bloqueio usando um tampão de bloqueio (500 μL / lâmina) por 1 h à temperatura ambiente para evitar a ligação não específica do anticorpo.
- Incubar as secções durante a noite com o anticorpo primário (300 μL/lâmina). Use as seguintes diluições para o anticorpo primário: diluição de 1:3.000 para Iba1 e diluição de 1:1.000 para GFAP, diluídas no tampão de bloqueio.
- Lave a seção três vezes com TBS por 5 min cada. Em seguida, incubar com o anticorpo secundário conjugado com biotina (diluição 1:300 com o tampão de bloqueio, 300 μL/lâmina) durante 1 h à temperatura ambiente.
- Durante a incubação com o anticorpo secundário, prepare a mistura de 1 μL de reagente A e 1 μl de reagente B do kit do sistema de peroxidase à base de avidina/biotina em 300 μL do tampão de bloqueio. Em seguida, incube a mistura em temperatura ambiente por 30 min antes de usar.
- Após a conclusão da incubação do anticorpo secundário, lave as seções três vezes com TBS por 5 min cada e incube as seções com a mistura preparada de Reagente A e B (300 μL / lâmina) por 1 h à temperatura ambiente.
- Lave as seções com 0,1 M Tris-HCl pH 8,0 por 5 min, três vezes, ao longo de 1 h. Em seguida, desenvolva a cor usando 0,05% DAB em 0,05% de peróxido de hidrogênio adicionado 0,1 M Tris-HCl pH 8,0 (500 μL / lâmina) por 30 min a 3 h. Observe ao microscópio a mudança de cor antes de interromper a reação.
- Lave as seções com 0,1 M Tris-HCl pH 8,0 por 5 min três vezes e seque as seções ao ar por 15 min. Depois disso, desidrate as seções imergindo-as em etanol a 95% por 2 min duas vezes, seguido de etanol a 100% por 2 min, duas vezes. Limpe as seções em xileno por 5 min duas vezes. Cubra as seções usando um meio de montagem insolúvel em água e deixe-as secar. Capture as imagens da seção usando o microscópio com uma objetiva de 20x.
- Coloração imunofluorescente de secção cerebral ferida por arma branca para células gliais
- Preparação das seções cerebrais: Faça os vidros de lâminas montados nas seções cerebrais conforme descrito nas etapas 2.1.1-2.1.9.
- Coloração glial: Após secar ao ar as seções do córtex cerebral feridas por facada por 1 h, fixe as seções novamente com PFA a 4% (500 μL / lâmina) por 30 min. Em seguida, lave os cortes com PBS (500 μL/lâmina) por 5 min, seguido de duas lavagens com TBS (500 μL/lâmina) por 5 min cada. Execute o bloqueio usando um tampão de bloqueio (500 μL / lâmina) por 1 h à temperatura ambiente para evitar a ligação não específica do anticorpo.
- Incubar as secções durante a noite com o anticorpo primário (300 μL/lâmina). Use as seguintes diluições para o anticorpo primário: diluição de 1:3.000 para Iba1 e diluição de 1:1.000 para GFAP, diluída em tampão de bloqueio.
- Lave a seção três vezes com TBS por 5 min cada. Em seguida, incubar com o anticorpo secundário conjugado com fluorescência (diluição de 1:300 com o tampão de bloqueio, 300 μL/lâmina) durante 1 h à temperatura ambiente.
- Lave as seções três vezes com TBS por 5 min cada e incube as seções com solução de DAPI 0,4 μg / mL em TBS (500 μL / lâmina) por 5 min em temperatura ambiente.
- Lave as seções com TBS (500 μL/lâmina) por 5 min e com água destilada (500 μL/lâmina) por 5 min. Depois de secar as seções ao ar por 15 min, cubra-as com um meio de montagem à base de água e deixe-as secar. Capture as imagens da seção usando um microscópio confocal com uma objetiva de 20x.
- QPCR em tempo real para marcadores de células gliais e citocinas inflamatórias
NOTA: As sequências de primers 16,20,21,22 usadas no protocolo apresentado estão listadas na Tabela 1.- Preparação de tecido cerebral fresco: Perfundir o camundongo com PBS conforme descrito nas etapas 2.1.1-2.1.4. Em seguida, extraia e corte o cérebro fresco em seções de 1 mm de espessura usando um cortador de cérebro. Selecione quatro fatias e corte pedaços de cérebro (1 mm2 quadrados, cada) que incluam a região da ferida por facada ou regiões intactas no lado contralateral do córtex cerebral, de acordo com o papel milimetrado. Determine a região a ser cortada, que inclui a lesão no centro (Figura 1D).
- Extração de RNA: Colete os quatro pedaços de cérebro em um tubo de 1,5 mL e homogeneize-os com 1 mL de reagente TRIzol por pipetagem. Incube a mistura por 5 min em temperatura ambiente. Em seguida, adicione 200 μL de clorofórmio, vortex bem e incube por mais 2 min em temperatura ambiente. Centrifugue a mistura a 12.000 x g por 15 min a 4 °C. Transfira cuidadosamente a camada superior e transparente para um novo tubo de 1,5 mL, evitando precipitados brancos, que contêm DNA e proteínas.
- Adicione 500 μL de isopropanol à camada superior coletada, misture bem e incube por 10 min em temperatura ambiente. Após centrifugação a 12.000 x g por 10 min a 4 °C, remova o sobrenadante e adicione 1 mL de etanol a 70% para lavar o pellet de RNA. Centrifugue a 7.500 x g por 5 min a 4 °C, remova completamente o sobrenadante e seque o pellet ao ar por 10 min. Dissolva o pellet de RNA em 15 μL de água livre de RNase e desnature o RNA por 10 min a 55 ° C.
- Meça a concentração de RNA usando um espectrofotômetro de microvolume. Conservar imediatamente o ARN a -80 °C.
- Síntese de cDNA: Para síntese de cDNA, use um kit de síntese de DNA disponível comercialmente. Prepare um total de 10 μL de tampão de reação em um tubo de 1,5 μL para cada amostra, que inclui 2 μL de 5 x tampão RT, 0,5 μL de mistura enzimática RT, 0,5 μL de mistura de primer, 1 μg de RNA e água livre de nuclease. Incubar a 37 °C durante 15 min para a reação de transcrição reversa e a 98 °C durante 5 min para a reação de inativação enzimática. Em seguida, adicione 90 μL de água livre de nuclease no tampão e misture bem. Conservar a solução de cDNA a -20°C.
- Quantificação da expressão de RNA: Para análise de qPCR em tempo real, use um kit de mistura principal de qPCR disponível comercialmente. Prepare a solução Mix para cada amostra combinando 5 μL de KOD SYBR qPCR Mix, 0,4 μL de 5 μM de primer direto, 0,4 μL de 5 μM de primer reverso e 0,2 μL de 50 x ROX em 2 μL de água livre de nuclease.
- Faça uma mistura de 2 μL de solução de cDNA e 8 μL de solução Mix em um tubo de 8 tiras, misture bem e gire.
- Inicie a reação de PCR com as seguintes condições de ciclagem: 98 °C por 2 min, seguido por 40 ciclos de 98 °C por 10 s, 60 °C por 10 s e 68 °C por 30 s. Execute a etapa de Análise da Curva de Fusão/Dissociação usando uma máquina de qPCR em tempo real.
- Análise de expressão de mRNA: Analise o nível de expressão de mRNA usando o método 2-Delta-Delta-Ct, que é realizado por normalização com um gene de manutenção, Gapdh, e depois com o do lado contralateral23.
Resultados
Para analisar a recuperação da quebra da BHE, o nível de hemorragia nos córtices cerebrais feridos por arma branca foi avaliado medindo o nível de extravasamento de IgG sérica em 1, 3, 5 e 7 dias após a lesão cerebral. As imagens de coloração de IgG de camundongos revelaram vazamento de sangue e deposição nos córtices cerebrais após lesão cerebral. Isso foi reduzido após mais de 7 dias, à medida que a BHE se recuperou e a proteína IgG se degradou (Figura 2B). Os níveis de extravasamento de IgG foram quantificados medindo a intensidade da coloração de IgG ao redor da área da ferida por arma branca, o que indicou que o extravasamento de IgG atingiu o pico 1 dia após a lesão cerebral (Figura 2C). Além de confirmar a recuperação do colapso da BHE, o vazamento de azul de Evans para o parênquima cerebral foi quantificado após o ferimento por arma branca. No cérebro intacto, o BBB impede que o azul de Evans vaze dos vasos sanguíneos para o cérebro. No entanto, após lesão cerebral, a quebra da BHE levou a vazamento imediato de azul de Evans ao redor do local da ferida (Figura 2D). A quantificação da concentração de azul de Evans, com base na intensidade da fluorescência, mostrou um aumento exponencial dentro de 1 h após o ferimento por arma branca, seguido por uma diminuição em 1 e 3 dias após a lesão (Figura 2E). Consistente com esses dados, foi relatado que a expressão de mRNA da integridade da BHE e fatores relacionados à junção apertada, como fosfatase alcalina e claudina-5, está diminuída 1 e 3 dias após a lesão17.
A coloração imunoenzimática e de imunofluorescência para o marcador microglial Iba1 e o marcador de astrócitos GFAP nos córtices cerebrais em 1, 3, 5 e 7 dias após a ferida por arma branca revelou um acúmulo de micróglia Iba1+ e astrócitos GFAP+ ao redor do local da lesão. O pico de acúmulo de micróglia Iba1+ ocorreu aproximadamente 5 dias após a lesão, enquanto os astrócitos GFAP+ atingiram o pico aproximadamente 3 dias após a lesão (Figura 3A, B). Consistente com os resultados da coloração, os níveis de expressão de mRNA de Iba1 e Gfap também aumentaram após a lesão, com melhorias observadas após o7º dia (Figura 3C,D). Além disso, o ferimento por arma branca aumentou os níveis de expressão de mRNA de citocinas inflamatórias, incluindo fator de necrose tumoral-α (Tnf-a), fator de crescimento transformador-β1 (Tgf-b1), interleucina-6 (Il-6) e interleucina-1β (Il-1b) nas regiões do ferimento por arma branca dos córtices cerebrais (Figura 3E-H). Esses aumentos na expressão de citocinas em 1 dia para Tnf-a, Il-6 e Il-1b e em 3 dias para Tgf-b1 após a ferida por arma branca foram concomitantes com o aumento nos níveis de mRNA de astrócitos e microgliais Como o momento da ativação glial e a expressão de citocinas inflamatórias se sobrepõem, é provável que astrócitos e microglias ativados sejam as fontes dessas citocinas inflamatórias. Além disso, as células imunes que vazaram para o cérebro devido à ferida por arma branca também podem contribuir para a produção de citocinas inflamatórias ao lado das células gliais24.
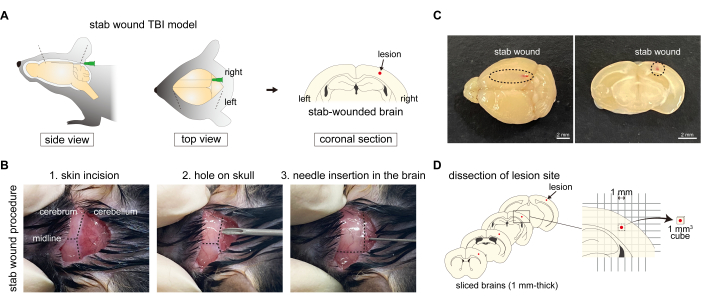
Figura 1: Procedimento de geração do modelo de camundongo com TCE por arma branca. (A) Diagrama esquemático do modelo de camundongo com TCE por arma branca, mostrando o procedimento de punção do hemisfério direito do córtex cerebral com agulhas, resultando em danos ao crânio. (B) Visão geral do protocolo de TCE por arma branca: (1) fazer uma incisão na pele na parte de trás da cabeça; (2) fazer um orifício no hemisfério direito do osso occipital com agulha; e (3) inserir uma agulha no córtex cerebral do hemisfério direito através do orifício no osso occipital. (C) Imagens macroscópicas da ferida por arma branca no córtex cerebral do eixo caudal ao rostral. Barras de escala: 2 mm. (D) Diagrama esquemático da dissecção do local da lesão usando o modelo de camundongo TBI com ferida por arma branca. Clique aqui para ver uma versão maior desta figura.
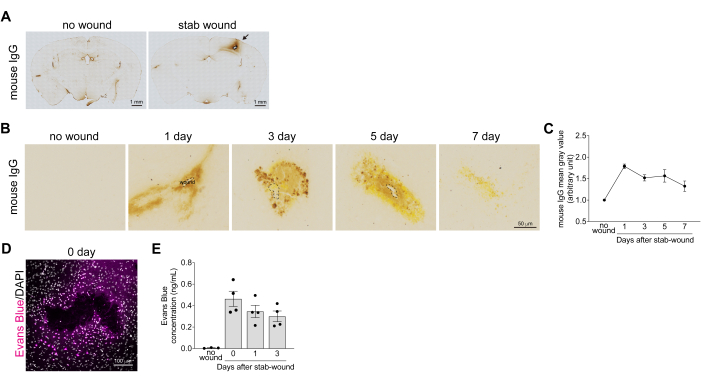
Figura 2: Quantificação da recuperação da quebra da barreira hematoencefálica em córtices feridos por facada. (A) Imagens de campo claro de seções cerebrais inteiras feridas por facadas imediatamente após a lesão foram coradas imunoenzimaticamente com um anticorpo contra IgG de camundongo. Nenhum córtex ferido é usado como um camundongo de controle negativo. A IgG de camundongo vazada e depositada, que é abundante no sangue, é de cor marrom. Barras de escala: 1 mm. (B) Imagens de campo claro dos córtices cerebrais feridos por arma branca em 1, 3, 5 e 7 dias após a lesão cerebral corada imunoenzimaticamente com um anticorpo contra IgG de camundongo. Nenhum córtex ferido é usado como um camundongo de controle negativo. Barra de escala: 50 μm. (C) O gráfico mostra o exemplo de referência para os valores médios de cinza da coloração IgG de camundongo. Todos os valores foram normalizados com o valor médio de cinza do hemisfério contralateral não lesado. Os dados são apresentados como média ± erro padrão da média, n > 3. (D) Imagens confocais do córtex cerebral ferido por arma branca 1 h após a lesão cerebral, após o camundongo ter sido injetado com solução de azul de Evans. As imagens foram adquiridas usando um microscópio confocal em um comprimento de onda de 633 nm. Azul Evans (magenta) e DAPI (cinza). Barra de escala: 100 μm. (E) O gráfico mostra um exemplo de referência para a mudança de concentração de azul de Evans em pedaços de córtices cerebrais feridos por facada. Os dados são apresentados como média ± erro padrão da média, n > 3. Os pontos indicam os resultados de cada tecido. Clique aqui para ver uma versão maior desta figura.

Figura 3: Quantificação da inflamação glial em córtices feridos por arma branca. (A, B) Imagens mostrando os córtices cerebrais feridos por arma branca em 1, 3, 5 e 7 dias após a lesão cerebral após coloração imunoenzimática (superior, barra de escala: 100 μm) e coloração imunofluorescente (inferior, barra de escala: 40 μm) com anticorpos contra Iba1 como marcador microglial (A) e GFAP como marcador de astrócitos (B). Nenhum córtex da ferida foi usado como controle negativo. (C, D) Os gráficos mostram os exemplos de referência para análises de qPCR em tempo real de alterações na expressão de mRNA de Iba1 (C) e Gfap (D) após uma facada nos córtices cerebrais. Os níveis de mRNA de Iba1 e Gfap foram normalizados com os de Gapdh. O nível de expressão em camundongos sem ferida foi considerado como 1, e todos os outros valores foram normalizados com esse valor. Os dados são apresentados como média ± erro padrão da média, n > 5. A ANOVA de uma via foi usada para análise estatística. Os pontos indicam os resultados de cada tecido. (E-H) Os gráficos mostram exemplos de referência para análises de qPCR em tempo real de alterações na expressão de mRNA de Tnf-a (E), Tgf-b1 (F), Il-6 (G) e Il-1b (H) após ferimentos por facada nos córtices cerebrais. Cada nível de mRNA foi normalizado com o de Gapdh. O nível de expressão em camundongos sem ferida foi considerado como 1, e todos os outros valores foram normalizados com esse valor. Os dados são apresentados como média ± erro padrão da média, n > 5. A ANOVA de uma via foi usada para análise estatística. Os pontos indicam os resultados de cada tecido. Clique aqui para ver uma versão maior desta figura.
| Nome do gene | Sequência de primer | ||
| Iba1 | Encaminhar | 5 ′ - GGATTTGCAGGGAGGAAAAG-3 ′ | |
| Inverter | 5 ′ -TGGGATCATCGAGGAATTG-3 ′ | ||
| Gfap | Encaminhar | 5 ′ - GAAGGTCCGCTTCCTGGAA-3 ′ | |
| Inverter | 5 ′ - GGCTCGAAGCTGGTTCAGTT-3 ′ | ||
| Tnf-a | Encaminhar | 5 ′ -ACAGAAAGCATGATCCGCG-3 ′ | |
| Inverter | 5′-GCCCCCCATCTTTTGGG-3′ | ||
| Tgf-b1 | Encaminhar | 5′-CCCTATTTGGAGCCTGGA-3′ | |
| Inverter | 5 ′ - CTTGCGACCCACGTAGTAGA-3 ′ | ||
| IL-6 | Encaminhar | 5′-CTGCAAGAGACTTCCATCCAGTT-3′ | |
| Inverter | 5 ′ - GAAGTAGGGAAGGCCGTGG-3 ′ | ||
| IL-1B | Encaminhar | 5 ′ - GCACACCCACCCTGCAG-3 ′ | |
| Inverter | 5 ′ - AACCGCTTTTCCATCTTCTTCTT-3 ′ | ||
| Gapdh | Encaminhar | 5 ′ - CGTGTTCTACCCCCAATGT-3 ′ | |
| Inverter | 5 ′ - TGTCATCATACTTGGCAGGTTTCT-3 ′ | ||
Tabela 1: Sequências de primers usadas para análise de qPCR em tempo real usando o modelo de camundongo TBI com ferida por facada
Discussão
Aqui, foi introduzido um protocolo para criar um modelo de camundongo TBI usando agulhas. Este protocolo permite uma avaliação quantitativa da recuperação da quebra da BHE e inflamação após lesão cerebral usando abordagens histológicas e biológicas moleculares. Protocolos alternativos, como o modelo de TCE concussivo repetitivo e o modelo de TCE de queda de peso, também podem ser usados para analisar a quebra e a inflamação da BHE. Esses modelos replicam a patologia do TCE sob condições controladas, incluindo parâmetros específicos para resistência ao impacto, alcance e região do cérebro, usando máquinas especializadas. Além disso, eles podem causar uma lesão cerebral fechada com um crânio intacto. Por outro lado, o modelo de TCE por facada proposto imita a lesão cerebral penetrante induzida por danos cerebrais e cranianos. Além disso, como o protocolo apresentado pode induzir danos cerebrais dentro de uma faixa estreita, é importante definir claramente a área de observação para analisar a quebra e a inflamação da BHE. Essa é a novidade desse protocolo, que foi possível com o uso de uma agulha mais fina do que o habitual 25,26. Outra característica única é que o modelo de mouse TBI pode ser facilmente criado facilmente sem o equipamento de coordenada estereotáxica27.
Os sintomas do TCE são classificados em leves, moderados ou graves com base no nível de comprometimento da consciência de acordo com a Escala de Coma de Glasgow (ECG)28. O modelo de TCE com faca é particularmente eficaz na replicação de sintomas correspondentes a TCE leve (GCS 13-15) a moderado (GCS 9-12) e é especialmente adequado para avaliar a quebra e a inflamação da BHE. No entanto, a técnica do modelo de TCE por arma branca pode ter algumas limitações, incluindo uma menor gravidade do dano cerebral, pois não induz mudança comportamental após a arma branca. Não realizamos testes comportamentais detalhados usando o modelo de TCE por arma branca, mas não houve defeitos visivelmente significativos na capacidade motora ou no comportamento social após acordar da anestesia. Portanto, outros modelos de TCE são mais adequados para rastrear as mudanças comportamentais após lesão cerebral. No entanto, o modelo de TCE com facada ainda pode revelar disfunção de aprendizagem e memória após uma análise detalhada. Por exemplo, um modelo de camundongo com TCE concussivo repetitivo exibiu deficiências comportamentais no labirinto aquático de Morris e no teste de reconhecimento social 2,29,30. O modelo de camundongo com TCE de queda de peso também mostrou redução da capacidade de aprendizado e memória, apesar de não ter efeito sobre as habilidades motoras no labirinto aquático de Morris31,32. Portanto, os modelos de TCE que induzem danos mais graves são mais adequados para análise comportamental. Além disso, o modelo de TCE por arma branca pode exibir variabilidade significativa nas condições de dano devido a diferenças na posição de inserção, ângulo e profundidade da agulha inserida no cérebro, que dependem da técnica de manuseio. No entanto, já foi demonstrado que o protocolo do modelo de TCE por arma branca pode fornecer dados confiáveis para análises de hemorragia e inflamação, aumentando o número de repetições. Um refinamento adicional do protocolo de ferimento por arma branca para reduzir a variabilidade e melhorar a reprodutibilidade pode aumentar a confiabilidade do modelo. Isso inclui padronizar a técnica e minimizar o risco de sangramento.
O protocolo apresentado aqui facilita a criação de um modelo de camundongo TBI, mas há considerações importantes para o procedimento de ferimento por arma branca. Ocasionalmente, os camundongos podem sangrar até a morte após o procedimento. Para minimizar esse risco, é fundamental fazer a incisão na pele para expor o osso occipital o menor possível, evitando danos aos vasos sanguíneos próximos ao redor das orelhas. Além disso, o tamanho do orifício no osso occipital deve ser grande o suficiente para acomodar uma agulha de 27 G x 3/4".
Durante a imuno-histoquímica, é provável que ocorra ligação inespecífica ao redor da região da ferida por arma branca, pois o anticorpo é facilmente capturado por componentes sanguíneos vazados. Portanto, é necessário avaliar a ligação inespecífica colorindo apenas com os anticorpos secundários, além da coloração usual.
O modelo de TCE com ferimento por arma branca é útil para esclarecer os mecanismos de coagulação no cérebro, pois permite a fácil identificação do local do sangramento. Isso o torna um modelo apropriado para analisar os reguladores de coagulação. A minimização da extensão da hemorragia, apoiada pela ativação imediata do sistema de coagulação e fibrinólise, leva à atenuação da inflamação após lesão cerebral10,33. O protocolo de TCE por arma branca apresentado pode ser usado para analisar a ativação plaquetária e a formação de fibrina no local da lesão10,33. Assim, demonstrando a importância do tratamento rápido com coagulante sanguíneo após TCE. Além disso, pode ser usado para avaliar a mitigação da lesão secundária, regulando a hemorragia após o TCE.
Não foi observado edema cerebral usando o modelo de TCE por arma branca. A TCE induz edema cerebral vasogênico, que é causado pelo acúmulo excessivo de líquido induzido por dano físico no espaço extravascular e extracelular, bem como edema cerebral citotóxico, que resulta do acúmulo de líquido intracelular34. O modelo de TCE por arma branca pode ser usado para observar edema cerebral, incluindo edema vasogênico e citotóxico, uma vez que a ferida por arma branca danifica os vasos sanguíneos e as células do modelo.
É possível analisar a apoptose neuronal após lesão cerebral usando o modelo de TCE por arma branca. Um estudo anterior indicou que a apoptose neuronal detectada pela caspase clivada 3 é evidente imediatamente e é limitada à área do cérebro ao redor do local da lesão, e atinge o pico 3 dias após a lesão cerebral. Além disso, a apoptose neuronal detectada pelo ensaio TUNEL mostrou uma mudança de ponto de tempo semelhante à análise da caspase clivada 314.
É aconselhável usar vários modelos de TCE para desenvolver abordagens terapêuticas, pois o TCE pode ocorrer em várias condições e circunstâncias. Este estudo demonstrou que o protocolo apresentado é suficiente para quantificar mudanças de padrão em dados de séries temporais para ativação glial, expressão de citocinas inflamatórias e perda neuronal após uma ferida por arma branca12,14. Além disso, pode demonstrar claramente a mudança da série temporal no processo de coagulação no TCE por arma branca10,33. A aplicação do método apresentado facilitará o exame de coagulantes sanguíneos e compostos anti-inflamatórios para o desenvolvimento de agentes terapêuticos para TCE. Além disso, o modelo de TCE com facada apresentado permite observar a ativação de astrócitos e micróglias imediatamente após a lesão cerebral, com sua subsequente quiescência ocorrendo dentro de 7 dias no córtex. Além disso, a resposta inflamatória e a ativação glial são atenuadas durante a quiescência glial. Além disso, a quebra da BBB é reparada dentro de um período semelhante à recuperação da recuperação da ativação glial17. Esses fenótipos indicaram que o modelo de TCE com faca reflete a fase aguda do TCE e não a fase crônica. Portanto, o modelo de TCE por arma branca apresentado é uma abordagem valiosa para o desenvolvimento de métodos terapêuticos para TCE, com o objetivo de prevenir a transição da fase aguda para a crônica.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Agradecemos a Ayana Hamano, Minori Yamashita, Misaki Endo, Hirono Kobayashi e Nito Nakahira por ajudarem com a imuno-histoquímica e qPCR em tempo real. Este trabalho foi apoiado pela JSPS KAKENHI 19K16122, Takeda Science Foundation, Astellas Foundation for Research on Metabolic Disorders, The Mitsubishi Foundation, Brain Science Foundation e The Uehara Memorial Foundation to K.H.
Materiais
| Name | Company | Catalog Number | Comments |
| 19 G x 1•1/2" needle | TERUMO | NN-1938R | |
| 27 G x 3/4" needle | TERUMO | NN-2719S | |
| anti-GFAP antibody | Sigma-Aldrich | G9269 | |
| anti-Iba1 antibody | Wako | 019-19741 | |
| Atipamezole Hydrochloride | Nippon Zenyaku Kogyo | Product name: Antisedan | |
| Biotin-conjugated mouse IgG antibody | Vector Laboratories | BA-9200 | |
| Biotin-conjugated rabbit IgG antibody | Vector Laboratories | BA-1000 | |
| Bovine albumin | Nacalai tesque | 01860-07 | |
| Brain Slicer | Visikol | BSLM-2 | |
| Butorphanol Tartrate | Meiji Animal Health | Product name: Vetorphale 5 mg | |
| Confocal microscope | Zeiss | LSM700 | |
| Cryostat | Leica | CM1520 | |
| DAB | Sigma-Aldrich | D5637-1G | |
| DAPI | Roche | 10236276001 | |
| Evans blue | Wako | 056-04061 | |
| Fluorescent-conjugated rabbit IgG antibody | Invitrogen | A-21206 | |
| Fluoromount-G | Invitrogen | 4958-02 | Water-based mounting medium |
| Isoflurane Inhalation Solution | Viatris | v002139 | |
| KOD SYBR qPCR Mix | TOYOBO | QKD-201 | qPCR master mix kit |
| Medetomidine | Nippon Zenyaku Kogyo | Product name: Domitor | |
| Microscope | Olympus | FSX100 | |
| Microvolume spectrophotometer | ThermoFisher Scientific | NanoDrop One | |
| Midazolam 10 mg/2 mL | Sandoz | 1124401A1060 | |
| MOUNT QUICK | Daido Sangyo | DM01 | Water insoluble mounting medium |
| Newborn calf serum | Gibco | 16010159 | |
| O.C.T. compound | Sakura Finetek Japan | 45833 | Embedding medium |
| Peel-A-Way, Truncated 22 mm Square Top | Ted Pella | 27118 | Tissue embedding mold |
| Peristaltic perfusion pump | ATTO | SJ-1211 | |
| Plate reader | Fisher Scientific | Cytation 3 | |
| Real-time qPCR machine | ThermoFisher Scientific | StepOne Plus | |
| ReverTra Ace qPCR RT Kit | TOYOBO | FSQ-101 | cDNA synthesis kit |
| Superfrost Plus Slide Glass | Fisher Scientific | 12-550-15 | Positive-charged slide glass |
| Suture with needle | Alfresa | HT2003NA75-KF2 | |
| TRIzol Reagent | Invitrogen | 15596026 | |
| VECTASTAIN ABC Standard Kit | Vector Laboratories | PK-4000 | Avidin/biotin-based peroxidase system kit |
Referências
- Narayan, R. K., et al. Clinical trials in head injury. J Neurotrauma. 19 (5), 503-557 (2002).
- Shitaka, Y., et al. Repetitive closed-skull traumatic brain injury in mice causes persistent multifocal axonal injury and microglial reactivity. J Neuropathol Exp Neurol. 70 (7), 551-567 (2011).
- Flierl, M. A., et al. Mouse closed head injury model induced by a weight-drop device. Nat Protoc. 4 (9), 1328-1337 (2009).
- Ikeshima-Kataoka, H., Shen, J. S., Eto, Y., Saito, S., Yuasa, S. Alteration of inflammatory cytokine production in the injured central nervous system of tenascin-deficient mice. In Vivo. 22 (4), 409-413 (2008).
- Zhou, Y., Wang, Y., Wang, J., Anne Stetler, R., Yang, Q. W. Inflammation in intracerebral hemorrhage: From mechanisms to clinical translation. Prog Neurobiol. 115, 25-44 (2014).
- Hijazi, N., et al. Endogenous plasminogen activators mediate progressive intracerebral hemorrhage after traumatic brain injury in mice. Blood. 125 (16), 2558-2567 (2015).
- Kataoka, K., et al. Roles of urokinase-type plasminogen activator in a brain stab-wound. Brain Res. 887 (1), 187-190 (2000).
- Wang, Y., et al. Early posttraumatic csf1r inhibition via plx3397 leads to time- and sex-dependent effects on inflammation and neuronal maintenance after traumatic brain injury in mice. Brain Behav Immun. 106, 49-66 (2022).
- Kaplan, L., Chow, B. W., Gu, C. Neuronal regulation of the blood-brain barrier and neurovascular coupling. Nat Rev Neurosci. 21 (8), 416-432 (2020).
- Endo, M., et al. 2-carba cyclic phosphatidic acid regulates blood coagulation and fibrinolysis system for repair after brain injury. Brain Res. 1818, 148511 (2023).
- Goldim, M. P. S., Della Giustina, A., Petronilho, F. Using Evans blue dye to determine blood-brain barrier integrity in rodents. Curr Protoc Immunol. 126 (1), e83 (2019).
- Hashimoto, K., et al. 2-carba cyclic phosphatidic acid suppresses inflammation via regulation of microglial polarization in the stab-wounded mouse cerebral cortex. Sci Rep. 8 (1), 9715 (2018).
- Ikeshima-Kataoka, H., Abe, Y., Yasui, M. Aquaporin 4-dependent expression of glial fibrillary acidic protein and tenascin-c in activated astrocytes in stab-wound mouse brain and in primary culture. J Neurosci Res. 93 (1), 121-129 (2015).
- Nakashima, M., et al. The neuroprotective function of 2-carba-cyclic phosphatidic acid: Implications for tenascin-c via astrocytes in traumatic brain injury. J Neuroimmunol. 361, 577749 (2021).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Ikeshima-Kataoka, H., Abe, Y., Abe, T., Yasui, M. Immunological function of aquaporin-4 in stab-wounded mouse brain in concert with a pro-inflammatory cytokine inducer, osteopontin. Mol Cell Neurosci. 56, 65-75 (2013).
- Ikeshima-Kataoka, H., Yasui, M. Correlation between astrocyte activity and recovery from blood-brain barrier breakdown caused by brain injury. Neuroreport. 27 (12), 894-900 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564 (2012).
- Botta, S., Chemiakine, A., Gennarino, V. A. Dual antibody strategy for high-resolution imaging of murine Purkinje cells and their dendrites across multiple layers. STAR Protoc. 3 (2), 101427 (2022).
- Amin, D. N., et al. Identification of stage biomarkers for human African trypanosomiasis. Am J Trop Med Hyg. 82 (6), 983-990 (2010).
- Jiang, J., et al. Therapeutic window for cyclooxygenase-2 related anti-inflammatory therapy after status epilepticus. Neurobiol Dis. 76, 126-136 (2015).
- Wei, J., et al. Microglia activation: One of the checkpoints in the CNS inflammation caused by angiostrongylus cantonensis infection in rodent model. Parasitol Res. 114 (9), 3247-3254 (2015).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative pcr and the 2(-delta delta c(t)) method. Methods. 25 (4), 402-408 (2001).
- Hazy, A., et al. Divergent age-dependent peripheral immune transcriptomic profile following traumatic brain injury. Sci Rep. 9 (1), 8564 (2019).
- Xia, Y., et al. Osthole confers neuroprotection against cortical stab-wound injury and attenuates secondary brain injury. J Neuroinflammation. 12, 155 (2015).
- Cieri, M. B., Villarreal, A., Gomez-Cuautle, D. D., Mailing, I., Ramos, A. J. Progression of reactive gliosis and astroglial phenotypic changes following stab-wound-induced traumatic brain injury in mice. J Neurochem. 167 (2), 183-203 (2023).
- Barreda-Manso, M. A., Yanguas-Casas, N., Nieto-Sampedro, M., Romero-Ramirez, L. Neuroprotection and blood-brain barrier restoration by salubrinal after a cortical stab injury. J Cell Physiol. 232 (6), 1501-1510 (2017).
- Rapp, P. E., et al. Patient characterization protocols for psychophysiological studies of traumatic brain injury and post-TBI psychiatric disorders. Front Neurol. 4, 91 (2013).
- Brody, D. L., Benetatos, J., Bennett, R. E., Klemenhagen, K. C., Mac Donald, C. L. The pathophysiology of repetitive concussive traumatic brain injury in experimental models; new developments and open questions. Mol Cell Neurosci. 66 (Pt B), 91-98 (2015).
- Meehan, W. P., Zhang, J., Mannix, R., Whalen, M. J. Increasing recovery time between injuries improves cognitive outcome after repetitive mild concussive brain injuries in mice. Neurosurgery. 71 (4), 885-891 (2012).
- Chen, C., et al. A novel simple traumatic brain injury mouse model. Chin Neurosurg J. 8 (1), 8 (2022).
- Machado, C. A., et al. Weight-drop model as a valuable tool to study potential neurobiological processes underlying behavioral and cognitive changes secondary to mild traumatic brain injury. J Neuroimmunol. 385, 578242 (2023).
- Hashimoto, K., Ikeda, N., Nakashima, M., Ikeshima-Kataoka, H., Miyamoto, Y. Vitronectin regulates the fibrinolytic system during the repair of cerebral cortex in stab-wounded mice. J Neurotrauma. 34 (22), 3183-3191 (2017).
- Unterberg, A. W., Stover, J., Kress, B., Kiening, K. L. Edema and brain trauma. Neuroscience. 129 (4), 1021-1029 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados