Method Article
Stichwunden-Mausmodell zur Untersuchung von Blutungen und Entzündungen bei traumatischen Hirnverletzungen
In diesem Artikel
Zusammenfassung
Vereinfachte Modelle für traumatische Hirnverletzungen (TBI) haben die Entwicklung von Therapieansätzen erleichtert. Dieses Protokoll beschreibt die Erstellung einer Stichwunden-Mausrinde mit Hilfe von Nadeln, die die Analyse von Blutungen und Entzündungen ermöglicht. Das Modell der Stich-SHT-Maus bietet den Vorteil, dass es ohne spezielle Ausrüstung durchgeführt werden kann.
Zusammenfassung
Ein Schädel-Hirn-Trauma (SHT) resultiert aus körperlichen Schäden, die häufig durch Unfälle oder Sportereignisse verursacht werden. Die Ursachen für SHT sind vielfältig und umfassen Gehirnerschütterungen, Gehirnquetschungen, Hämatome und Schädelfrakturen. Um diese verschiedenen Ursachen zu replizieren, wurden verschiedene TBI-Mausmodelle mit unterschiedlichen Protokollen entwickelt. Körperliche Hirnverletzungen führen sowohl zu primären als auch zu sekundären Hirnverletzungen, die den neuronalen Verlust verschlimmern. Die primäre Verletzung tritt unmittelbar nach der Schädigung auf, oft aufgrund einer Blutung, und löst anschließend sekundäre Verletzungen aus, einschließlich Entzündungen um die Läsion herum. Die Entwicklung eines SHT-Modells, das zur Beurteilung der Blutungsausdehnung und des Entzündungsschweregrads geeignet ist, ist daher von entscheidender Bedeutung. Dieses Protokoll führt eine Methode zur Nachahmung penetrierender Hirnverletzungen ein, die als Stichwund-SHT-Mausmodell bezeichnet wird, um Mechanismen von Blutungen, Entzündungen und neuronalem Verlust im Zusammenhang mit der SHT-Pathologie zu untersuchen. Dieses Modell wird durch Durchstechen des Schädels und des Gehirns mit Nadeln erstellt und ist einfach auszuführen, ohne dass spezielle experimentelle Geräte erforderlich sind. Darüber hinaus hat die geringfügige Verletzung, die der Großhirnrinde der Maus mit einer Nadel zugefügt wird, keinen Einfluss auf das Verhalten des Tieres nach der Operation. Diese Funktion ermöglicht es Forschern, die lokalisierten Auswirkungen von Hirnverletzungen zu untersuchen, ohne sich Gedanken über breitere Verhaltenskonsequenzen machen zu müssen. Beispieldaten von stichverwundeten Mäusen zeigen die Wirksamkeit des Modells bei der Beurteilung des Blutaustritts in das Parenchym, der Gliaaktivierung und der inflammatorischen Zytokinproduktion. Darüber hinaus erleichtert dieses Protokoll die Bewertung von Blutgerinnungsmitteln und entzündungshemmenden Verbindungen und hilft bei der Entwicklung von Therapeutika für SHT.
Einleitung
Ein Schädel-Hirn-Trauma (TBI) wird durch körperliche Schäden verursacht, die häufig durch Unfälle verursacht werden, einschließlich Verkehrsunfälle und Sturzunfälle. TBI wird in zwei Arten eingeteilt: penetrierende Hirnverletzungen, die auftreten, wenn ein scharfer Gegenstand sowohl den Schädel als auch das Gehirn perforiert, und geschlossene Hirnverletzungen, die durch heftiges Schütteln des Gehirns im Inneren ohne Bruch des Schädels verursacht werden1.
Die Ursachen für ein Schädel-Hirn-Trauma sind sehr vielfältig und umfassen Gehirnerschütterungen, Gehirnquetschungen, Hämatome und Schädelfrakturen. Daher wurden TBI-Mausmodelle entwickelt, die verschiedene Protokolle verwenden, um diese verschiedenen Ursachen zu replizieren. Bei einem sich wiederholenden erschütternden SHT-Modell geht es beispielsweise um Gehirnschütteln, bei dem Mäuse mit einem elektromagnetisch gesteuerten Gummiimpaktor mehrmals festgesteckt werden2. Zusätzlich wird beim Weight-Drop-TBI-Modell eine starke äußere Kraft durch ein standardisiertes Weight-Drop-Gerät auf den Kopf ausgeübt, was zu einer fokalen stumpfen Verletzung bei intaktem Schädelführt 3. Darüber hinaus wird das Stichwunden-SHT-Modell durch Punktion des Schädels und des Gehirns mit einer Nadelhergestellt 4 (Abbildung 1A). Da mehrere SHT-Modelle entwickelt wurden, ist es wichtig, ein Modell auszuwählen, das auf der spezifischen Pathologie basiert, die beobachtet werden muss.
Hirnverletzungen, die durch körperliche Schäden verursacht werden, führen zu primären und sekundären Hirnverletzungen, die den neuronalen Verlust weiter verschlimmern. Unmittelbar nach der Schädigung tritt eine primäre Verletzung auf, die aus dem Zusammenbruch der Blut-Hirn-Schranke (BHS), Blutungen und Hämatomen resultiert. Daher ist die Minimierung von Blutungen und Hämatomausdehnungen von entscheidender Bedeutung, da diese Faktoren die Schwere der SHT-Symptome verschlimmern können. Die sekundäre Schädigung wird durch intraparenchymale Blutbestandteile ausgelöst, die anschließend zu einer Entzündung um die Läsion herum führen5. Die Prognose nach einer Hirnverletzung hängt von der Entzündungsdynamik ab; Daher ist es für eine günstige Prognose entscheidend, sowohl primäre als auch sekundäre Verletzungen schnell zu mildern 6,7,8.
Die BHS besteht aus Perizyten, Tight Junctions zwischen Endothelzellen, und den Endfüßen von Astrozyten, die zusammenarbeiten, um das Austreten von Substanzen aus den Blutgefäßen in gesunden Gehirnen zu verhindern9. In dem vorgestellten Stich-Wund-System ist die BHS physikalisch gestört. Zu den gängigen Methoden zur Bewertung der BHS-Integrität gehören die Färbung auf Immunglobulin G (IgG) und die Beurteilung der Leckage von Fluoreszenztracern wie Evansblau und Dextran10,11. Die IgG-Färbung markiert Blutbestandteile, die aus der Läsionsstelle austreten und sich im Gehirn ablagern. Wenn sich die BHS erholt, nimmt das Austreten von Blutbestandteilen in das Gehirn ab, und diese Ablagerungen werden allmählich abgebaut. Daher wird die IgG-Färbung verwendet, um das Ausmaß der BHS-Erholung nach einer Hirnverletzung zu beurteilen. Darüber hinaus spiegelt das Ausmaß des Austretens von intravenös verabreichtem Tracer in das Hirnparenchym die Erholung der BHS wider. Diese Methode ermöglicht eine klarere Bewertung der BHS-Dynamik, da die Tracerleckage direkt auf den Übergang von Blutbestandteilen aus dem Blutkreislauf in das Hirnparenchym hinweist. Des Weiteren führt die Minimierung der Blutung zu einer milderen Primärverletzung, die durch eine zeitnahe Blutgerinnung und rechtzeitige Fibrinolyse unterstützt wird. Daher ist die Quantifizierung der Expression von Blutgerinnungs- und Fibrinolyseregulatoren ein effektiver Weg, um diesen Prozess zu analysieren. Was den molekularen Mechanismus betrifft, der der Gerinnung zugrunde liegt, so wird die Blutung nach einer Hirnverletzung durch die Fibrinbildung gestoppt. Anschließend wird der fibrinreiche Thrombus durch Gewebeplasminogenaktivator (tPA) und Urokinase-Plasminogenaktivator (uPA) abgebaut. Im Modell der Stichwund-SHT-Maus erreicht die Fibrinbildung 1 Tag nach der Verletzung ihren Höhepunkt und reduziert sich danachum 10. So kann das Wiederfindungsniveau der BHS durch Quantifizierung der Blutbestandteile und der Tracer-Extravasation in das Hirnparenchym sowie der Expression von Blutgerinnungsfaktoren vorhergesagt werden.
Zu den Quantifizierungsmethoden für Entzündungen im sekundären Verletzungsprozess gehören die Gliaaktivierung und die Expression von inflammatorischen Zytokinen. Eine anhaltende Entzündung wird hauptsächlich durch eine übermäßige Ansammlung von Mikroglia und Astrozyten um die Läsionsstelle herum induziert. In einem SHT-Modell mit Stichwunden stimulieren Stichwunden beispielsweise die Reaktivierung von Gliazellen um die Läsion herum, um die Zelltrümmer und Blutbestandteile zu entfernen. Diese gliale Reaktivierung erreicht typischerweise 3 Tage nach der Stichwunde ihren Höhepunkt 12,13. Zusätzlich zu ihrer Phagozytosefunktion sezernieren reaktivierte Gliazellen übermäßig entzündliche Zytokine, was zu einem neuronalen Verlust um die Läsion herum führt14. Es wurde berichtet, dass die Abschwächung der Gliaentzündung zu einer günstigen Prognose nach Hirnverletzungen beiträgt12,14. Die Bestimmung des Entzündungsgrades ist nützlich, um den Schweregrad und die Prognose zu beurteilen. Daher ist es wichtig, ein SHT-Modell zu entwickeln, das zur Beurteilung der Blutungsausdehnung und des Entzündungsschweregrads geeignet ist. In dieser Studie wird ein Stichwund-Mausmodell vorgestellt, das penetrierende Hirnverletzungen nachahmt, mit dem Ziel, die Mechanismen von Blutungen, Entzündungen und neuronalem Verlust in der SHT-Pathologie zu untersuchen.
Protokoll
Alle Tierhaltungsprotokolle wurden vom Institutional Animal Care and Use Committee der Ochanomizu University, Japan, genehmigt und in Übereinstimmung mit den Richtlinien des japanischen Ministeriums für Bildung, Wissenschaft und Kultur durchgeführt. Es wurden sechs Wochen alte adulte weibliche Mäuse mit C57BL/6J (20-25 g) verwendet. Alle Mäuse erhielten ad libitum Zugang zu Nahrung und Wasser in einer sauberen Umgebung. Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Stichwundoperation an der Großhirnrinde
- Vorbereitung der Reagenzien
HINWEIS: Das Anästhesieprotokoll ähnelt dem zuvor beschriebenen15. Wenn die Tiereinrichtung ein bestimmtes Betäubungsmittel empfiehlt, befolgen Sie bitte deren Anweisungen. Es wurde bereits bestätigt, dass Pentobarbital-Natrium bei Stichwundenoperationen in der Großhirnrinde wirksam ist 4,13,16,17.- Kombinationsanästhetikum MMB: Lösen Sie 1,875 ml 1 mg/ml Medetomidin, 2,0 ml 5 mg/ml Midazolam und 2,5 ml 5 mg/ml Butorphanoltartrat in 18,625 ml phosphatgepufferter Kochsalzlösung (PBS), um ein Gesamtvolumen von 25 ml zu erhalten. Dieses Gemisch hat eine Konzentration von 75 mg/l Medetomidin, 400 mg/l Midazolam und 500 mg/l Butorphanoltartrat-Gemisch. Vor Gebrauch bis zu 8 Wochen bei 4 °C lagern.
- Anästhesieantagonist: Löse 150 μl 5 mg/ml Atipamezolhydrochlorid in 9,85 ml PBS auf, um ein Gesamtvolumen von 10 ml mit einer Konzentration von 75 mg/l Atipamezolhydrochlorid zu erhalten. Vor Gebrauch bis zu 8 Wochen vor Gebrauch bei 4 °C lichtgeschützt lagern.
- Ablauf der Operation
- Mausanästhesie: Betäuben Sie die Mäuse vorübergehend mit einem in Isofluran-Inhalationslösung getränkten Papier, bis sie einschlafen. Injizieren Sie dann 10 μl/g Kombinationsanästhetikum MMB intraperitoneal mit einer 1-ml-Spritze mit einer 27 G x 3/4" Nadel. Nach 3-5 Minuten bestätigen Sie die Wirksamkeit der Anästhesie, indem Sie eine Zehenkneifung durchführen und den Aufrichtreflex überprüfen.
HINWEIS: Achten Sie darauf, dass Sie bei der Verwendung von Isofluran-Inhalationslösung nicht zu einer Überdosis Anästhesie übergehen. - Legen Sie die Maus auf der Bauchseite in ein Papiertuch. Vergewissern Sie sich nach der Übertragung erneut, dass die Maus immer noch mit einem Zehenkneifen betäubt ist.
- Rasieren Sie das Fell auf der Haut der Hinterhauptregion. Sterilisieren Sie das Fell auf dem Hinterkopf der Maus mit 70% Ethanol mit einem Wattestäbchen. Fassen Sie die Hinterhaupthaut mit einer stumpfen Pinzette und machen Sie einen 1,0 bis 1,5 mm breiten Schnitt, um das Hinterhauptbein freizulegen, ohne den Schädel oder ein Organ zu beschädigen. Öffnen Sie sanft und langsam den Schnitt, um die Grenze zwischen Großhirnrinde und Kleinhirn durch den Schädel zu beobachten (Abbildung 1B).
HINWEIS: Stellen Sie sicher, dass der Schädel oder das Gehirn bei der Maus ohne Wunde nicht beschädigt werden. - Mauskraniotomie: Mit einer 19 G x 1•1/2" Nadel ein kleines Loch in der rechten Hemisphäre des Hinterhauptbeins erzeugen. Drehen Sie die Nadel vorsichtig, um einen Einstichpunkt für die Stichwundnadelung zu schaffen, und achten Sie darauf, das Hirnparenchym nicht zu beschädigen. Das Loch sollte in der Mitte der interauralen Linie der rechten Hemisphäre zwischen Lambda und Rand positioniert werden (Abbildung 1B). Dieses Loch dient als Führung für das Einstechen der Stichnadel im nächsten Schritt.
- Stichwunde: Führen Sie eine 27 G x 3/4" große Nadel vom Einstichpunkt aus ein und stechen Sie in die Großhirnrinde entlang der rostrocaudalen Achse (Abbildung 1B,C). Die Nadel wird eingeführt, bis sie die Vorderseite des Schädels berührt, und dann vorsichtig zurückgezogen. Die geeignete Tiefe ist diejenige, in der die Nadel durch die Oberfläche der Großhirnrinde gesehen werden kann. Die linke Seite der Großhirnrinde wird als unbeschädigte Kontrolle verwendet.
- Nähen Sie den Hautschnitt mit einer Naht aus Nylon 3-0 mit einer 1/2-Rundnadel.
- Verabreichen Sie 10 μl/g des Anästhesieantagonisten intraperitoneal als Kombinationsanästhetikum MMB. Die Maus sollte innerhalb von 8-16 Stunden nach der Injektion des Anästhesieantagonisten in der Lage sein, zu gehen.
- Mausanästhesie: Betäuben Sie die Mäuse vorübergehend mit einem in Isofluran-Inhalationslösung getränkten Papier, bis sie einschlafen. Injizieren Sie dann 10 μl/g Kombinationsanästhetikum MMB intraperitoneal mit einer 1-ml-Spritze mit einer 27 G x 3/4" Nadel. Nach 3-5 Minuten bestätigen Sie die Wirksamkeit der Anästhesie, indem Sie eine Zehenkneifung durchführen und den Aufrichtreflex überprüfen.
2. Beurteilung der Blutung und Erholung nach dem BHS-Abbau
- Immunenzymatische Färbung eines stichverwundeten Hirnschnitts auf IgG-Leckage bei Mäusen
HINWEIS: Hier wurden diamontierbare gefrorene Hirnschnitte verwendet. Auch frei schwebende gefrorene Hirnschnitte eignen sich für dieses Protokoll.- Mausanästhesie: Induzieren Sie die Anästhesie, indem Sie die Maus in die Nähe eines mit Isofluran getränkten Papiers legen, bis sie einschläft. Dann sofort 100 μl/kg Kombinationsanästhetikum MMB intraperitoneal verabreichen. Bestätigen Sie die Wirkung der Anästhesie mit einem Zehenkneifen und einem Aufrichtreflex.
- Legen Sie die Maus auf den Rücken und stecken Sie beide Arme und Füße auf das Sezierbrett.
- Maus-Thorakotomie: Fassen Sie die Bauchhaut mit einer stumpfen Pinzette und machen Sie einen 1,0-1,5 cm langen Schnitt durch die Haut und das Bauchfell, um den Brustkorb freizulegen. Öffnen Sie den Brustkorb vorsichtig mit einer Schere und vermeiden Sie dabei eine Schädigung des Herzens, um es für die Herzperfusion freizulegen.
- Fixierung der Herzperfusion: Bereiten Sie eine peristaltische Perfusionspumpe vor und befestigen Sie an einem Ende einen Schlauch mit einer 19 G x 1•1/2" Nadel. Füllen Sie die Tube mit PBS, indem Sie die Pumpe vor Gebrauch einschalten. Führen Sie dann bei laufender Pumpe die Nadelspitze in die linke Herzkammer ein und befestigen Sie sie mit einer Pinzette. Machen Sie einen 0,5-1,0 mm großen Schnitt im rechten Vorhof. Perfundieren Sie die Maus18 mit einer Geschwindigkeit von 4-6 ml/min für 5 min mit mindestens 20 mL PBS, um das Blut zu entfernen.
- Stoppen Sie die Pumpe und geben Sie den Schlauch in eine Lösung von 4 % Paraformaldehyd (PFA) in PBS. Starten Sie die Pumpe 5 Minuten lang mit einer Geschwindigkeit von 4-6 ml/min mit mindestens 20 mL 4 % PFA in PBS zur Fixierungneu 18.
HINWEIS: Wenn die Pumpe nicht verfügbar ist, ist es auch möglich, eine 50-ml-Spritze mit einer 19 G x 1•1/2" Nadel für die Perfusion zu verwenden. - Dissektion des Gehirns: Legen Sie die Maus auf die Bauchseite auf das Präparierbrett und legen Sie den Schädel frei, indem Sie einen Schnitt durch die Mittellinie der Haut vom Hinterhauptbereich bis zur Nase machen. Legen Sie das Gehirn vorsichtig vollständig frei, indem Sie den Schädel mit einer Schere entfernen, und achten Sie darauf, das Gehirn nicht zu beschädigen. Heben Sie das Gehirn mit einer gekrümmten Pinzette an und übertragen Sie es in ein 15-ml-Röhrchen, das mit 10 ml 4% PFA in PBS gefüllt ist.
- Inkubieren Sie das präparierte Gehirn über Nacht in der 4%igen PFA in PBS bei 4 °C, um eine vollständige Fixierung zu erreichen. Inkubieren Sie das Gehirn anschließend über Nacht in 10 ml 15 % Saccharose in PBS und übertragen Sie es für einen weiteren Tag auf 10 ml 30 % Saccharose in PBS auf einen Wippschüttler. Dieser allmähliche Saccharoseersatz hilft, Gewebeschäden durch Eis zu verhindern, wenn das Gehirn später in einem Gefrierschrank gelagert wird.
- Einbettung des Gehirns: Das Gehirn wird koronal in ein Einbettungsmedium in eine Gewebeeinbettungsform eingebettet und dann mit 2-Methylbutan mit Trockeneiseingefroren 19.
- Gefrorene Hirnschnitte: Montieren Sie mit einem Kryostaten serielle koronale Schnitte (20 μm dick) des eingebetteten Gehirns auf ein positiv geladenes Objektträgerglas. Die Hirnabschnitte werden über Nacht bei Raumtemperatur vollständig an der Luft getrocknet und in einem -80 °C heißen Gefrierschrank gelagert.
- Vorbereitung des Blockierungspuffers: Mischen Sie 10 % Serum für neugeborene Kälber, 30 mg/ml Rinderalbumin, 10 mg/ml Glycin und 0,4 % Triton X-100 in TBS, um den Blockierungspuffer herzustellen. Vor Gebrauch bis zu 2 Wochen bei 4 °C lagern.
- Maus-IgG-Färbung: Nachdem die stichverwundeten Großhirnrindenschnitte 1 h lang bei Raumtemperatur an der Luft getrocknet wurden, werden sie 30 Minuten lang mit 500 μl 4% PFA pro Objektträger nachfixiert. Waschen Sie dann den Abschnitt 5 Minuten lang mit PBS (500 μL/Objektträger), gefolgt von zwei Wäschen mit Tris-gepufferter Kochsalzlösung (TBS, 500 μL/Objektträger) für jeweils 5 Minuten.
HINWEIS: Führen Sie alle Vorgänge in einer Befeuchtungsbox durch, um zu verhindern, dass die Puffer verdunsten. - Quenchen Sie die endogene Enzymaktivität in Abschnitten mit 10 % Methanol und 3 % Wasserstoffperoxid in TBS für 5 min, gefolgt von zwei Waschgängen mit Tris-gepufferter Kochsalzlösung (TBS, 500 μL/Objektträger) für jeweils 5 min.
- Führen Sie die Blockierung mit einem Blockierungspuffer (500 μl/Objektträger) für 1 h bei Raumtemperatur durch, um eine unspezifische Bindung des Antikörpers zu verhindern. Inkubieren Sie dann die Schnitte mit einem Biotin-konjugierten Maus-IgG-Antikörper (1:300 Verdünnung mit dem Blockierungspuffer, 300 μl/Objektträger) für 1 h bei Raumtemperatur.
- Bereiten Sie während der Inkubation mit dem Maus-IgG-Antikörper die Mischung aus 1 μl Reagenz A und 1 μl Reagenz B aus dem Avidin/Biotin-basierten Peroxidase-Systemkit in 300 μl des Blockierungspuffers vor. Inkubieren Sie diese Mischung vor Gebrauch 30 Minuten lang bei Raumtemperatur. Nachdem die Inkubation der Maus-IgG-Antikörper abgeschlossen ist, waschen Sie die Schnitte dreimal 5 Minuten lang mit TBS. Dann inkubieren Sie die Schnitte mit der vorbereiteten Mischung aus Reagenz A und B (300 μl/Objektträger) für 1 h bei Raumtemperatur.
- Waschen Sie die Abschnitte mit 0,1 M Tris-HCl pH 8,0 für 5 min, dreimal, über einen Zeitraum von 1 h. Entwickeln Sie dann die Farbe mit 0,05 % 3,3'-Diaminobenzidin (DAB) in 0,05 % Wasserstoffperoxid zugesetztem 0,1 M Tris-HCl pH 8,0 (500 μL/Objektträger) für 5 min bis 1 h (Abbildung 2A). Beobachten Sie unter einem Mikroskop die Farbveränderung, bevor Sie die Reaktion stoppen.
- Waschen Sie die Abschnitte dreimal 5 Minuten lang mit 0,1 M Tris-HCl pH 8,0 und trocknen Sie die Abschnitte 15 Minuten lang an der Luft. Danach dehydrieren Sie die Abschnitte, indem Sie sie zweimal 2 Minuten lang in 95 % Ethanol und anschließend zweimal 2 Minuten lang in 100 % Ethanol eintauchen. Reinigen Sie die Abschnitte zweimal 5 Minuten lang mit Xylol. Decken Sie die Abschnitte mit einem wasserunlöslichen Einbettmedium ab und lassen Sie sie trocknen.
- Analyse der IgG-Färbeintensität der Maus: Nehmen Sie Bilder der Schnitte mit einem Mikroskop mit einem 20-fachen Objektiv auf.
- Mit der ImageJ-Software können Sie die Färbeintensität quantifizieren, indem Sie die mittleren Grauwerte in fünf zufällig ausgewählten Feldern (jeweils 8 × 8 μm2 ) aus immunenzymatisch gefärbten Bereichen in jedem Abschnitt messen. Normalisieren Sie die Färbeintensität anhand des mittleren Grauwerts jedes Kontralaterals; Es gibt keine verwundete Region als Hintergrundkorrektur. Berechnen Sie den Durchschnitt der normalisierten mittleren Grauwerte aus den fünf Feldern, um den mittleren Grauwert der Maus-IgG-Färbung für jeden Abschnitt zu bestimmen.
- Beurteilung des Evans-Blau-Lecks in das Hirnparenchym
HINWEIS: Das Evans-Blue-Protokoll ähnelt der zuvor beschriebenen Methode11. Mit Fluorescein-Isothiocyanat (FITC)-markiertes Dextran wirkt auch zur Wiederherstellung nach dem BHS-Abbau10.- Evans-Blau-Injektion: Verabreichen Sie der stichverwundeten Maus 1 h vor der Dissektion 2 % Evans-Blau in PBS (3 ml/kg) durch die Schwanzvene.
- Extraktion aus frischem Gehirn: 1 h nach der Verabreichung von Evans Blue perfundieren Sie die Maus mit PBS, wie in den Schritten 2.1.1-2.1.4 beschrieben. Präparieren und schneiden Sie dann das frische Gehirn mit einem Hirnschneider koronal in 1 mm dicke Abschnitte. Wählen Sie vier Scheiben aus und schneiden Sie Gehirnstücke (jeweils 1 mm2 Quadrate) aus, die die stichverwundete Region oder intakte Regionen in der nicht verwundeten Großhirnrinde enthalten, gemäß dem Millimeterpapier (Abbildung 1D).
- Evans-Blau-Quantifizierung: Sammeln Sie die vier Gehirnstücke in einem 1,5-ml-Röhrchen und homogenisieren Sie sie mit 200 μl Trichloressigsäure unter Verwendung eines Gewebewolfs. Das Homogenat bei 10.000 x g bei 4 °C für 20 min zentrifugieren. Sammeln Sie dann den Überstand mit einer Pipette und verdünnen Sie ihn mit 600 μl Ethanol. Bereiten Sie eine Standardkurve von Evans-Blau im Bereich von 0-1,0 ng/ml vor, um die Konzentration zu quantifizieren. Messen Sie die Fluoreszenzintensität bei 680 nm mit einer Anregungswellenlänge von 620 nm mit einem Plattenreader.
3. Beurteilung des Entzündungsgrades im Gehirn nach Stichwunde
- Immunenzymatische Färbung von stichverwundeten Hirnschnitten für Gliazellen
- Vorbereitung der Hirnschnitte: Stellen Sie die Diabrillen aus den Hirnschnitten her, wie in den Schritten 2.1.1-2.1.9 beschrieben.
- Gliafärbung: Nach 1 h Lufttrocknung der stichwunden Großhirnrindenschnitte wieder mit 4% PFA (500 μL/Objektträger) für 30 min fixieren. Waschen Sie dann die Abschnitte 5 Minuten lang mit PBS (500 μL/Objektträger), gefolgt von zwei Wäschen mit TBS (500 μL/Objektträger) für jeweils 5 Minuten.
- Quenchen Sie die endogene Enzymaktivität in Abschnitten mit 10 % Methanol und 3 % Wasserstoffperoxid in TBS für 5 min, gefolgt von zwei Waschgängen mit Tris-gepufferter Kochsalzlösung (TBS, 500 μL/Objektträger) für jeweils 5 min.
- Führen Sie die Blockierung mit einem Blockierungspuffer (500 μl/Objektträger) für 1 h bei Raumtemperatur durch, um eine unspezifische Bindung des Antikörpers zu verhindern.
- Inkubieren Sie die Schnitte über Nacht mit dem Primärantikörper (300 μl/Objektträger). Für den Primärantikörper sind die folgenden Verdünnungen zu verwenden: 1:3.000 Verdünnung für Iba1 und 1:1.000 Verdünnung für GFAP, verdünnt im Blocking-Puffer.
- Waschen Sie den Abschnitt dreimal mit TBS für jeweils 5 Minuten. Anschließend mit dem Biotin-konjugierten Sekundärantikörper (1:300 Verdünnung mit dem Blockierungspuffer, 300 μl/Objektträger) für 1 h bei Raumtemperatur inkubieren.
- Bereiten Sie während der Inkubation mit dem Sekundärantikörper die Mischung aus 1 μl Reagenz A und 1 μl Reagenz B aus dem Avidin/Biotin-basierten Peroxidase-Systemkit in 300 μl des Blockierungspuffers vor. Dann die Mischung vor Gebrauch 30 Minuten bei Raumtemperatur inkubieren.
- Nachdem die Inkubation des Sekundärantikörpers abgeschlossen ist, waschen Sie die Schnitte dreimal jeweils 5 Minuten lang mit TBS und inkubieren Sie die Schnitte mit der vorbereiteten Mischung aus Reagenz A und B (300 μl/Objektträger) für 1 h bei Raumtemperatur.
- Waschen Sie die Abschnitte mit 0,1 M Tris-HCl pH 8,0 für 5 min, dreimal, über einen Zeitraum von 1 h. Entwickeln Sie dann die Farbe mit 0,05 % DAB in 0,05 % Wasserstoffperoxid zugesetztem 0,1 M Tris-HCl pH 8,0 (500 μl/Objektträger) für 30 min bis 3 h. Beobachten Sie unter einem Mikroskop die Farbveränderung, bevor Sie die Reaktion stoppen.
- Waschen Sie die Abschnitte dreimal 5 Minuten lang mit 0,1 M Tris-HCl pH 8,0 und trocknen Sie die Abschnitte 15 Minuten lang an der Luft. Danach dehydrieren Sie die Abschnitte, indem Sie sie zweimal 2 Minuten lang in 95 % Ethanol tauchen, gefolgt von 100 % Ethanol für 2 Minuten. Reinigen Sie die Abschnitte zweimal 5 Minuten lang mit Xylol. Decken Sie die Abschnitte mit einem wasserunlöslichen Einbettmedium ab und lassen Sie sie trocknen. Nehmen Sie die Schnittbilder mit dem Mikroskop mit einem Objektiv von 20x auf.
- Immunfluoreszenzfärbung von stichverwundeten Hirnschnitten für Gliazellen
- Vorbereitung der Hirnschnitte: Stellen Sie die Diabrillen aus den Hirnschnitten her, wie in den Schritten 2.1.1-2.1.9 beschrieben.
- Gliafärbung: Nach 1 h Lufttrocknung der stichwunden Großhirnrindenschnitte wieder mit 4% PFA (500 μL/Objektträger) für 30 min fixieren. Waschen Sie dann die Abschnitte 5 Minuten lang mit PBS (500 μL/Objektträger), gefolgt von zwei Wäschen mit TBS (500 μL/Objektträger) für jeweils 5 Minuten. Führen Sie die Blockierung mit einem Blockierungspuffer (500 μl/Objektträger) für 1 h bei Raumtemperatur durch, um eine unspezifische Bindung des Antikörpers zu verhindern.
- Inkubieren Sie die Schnitte über Nacht mit dem Primärantikörper (300 μl/Objektträger). Für den Primärantikörper sind die folgenden Verdünnungen zu verwenden: 1:3.000 Verdünnung für Iba1 und 1:1.000 Verdünnung für GFAP, verdünnt in Blockierungspuffer.
- Waschen Sie den Abschnitt dreimal mit TBS für jeweils 5 Minuten. Anschließend wird der fluoreszierende Sekundärantikörper (1:300 Verdünnung mit dem Blockierungspuffer, 300 μl/Objektträger) 1 h lang bei Raumtemperatur inkubiert.
- Waschen Sie die Schnitte dreimal mit TBS für jeweils 5 min und inkubieren Sie die Schnitte mit 0,4 μg/mL DAPI-Lösung in TBS (500 μL/Objektträger) für 5 min bei Raumtemperatur.
- Waschen Sie die Abschnitte 5 Minuten lang mit TBS (500 μL/Objektträger) und 5 Minuten lang mit destilliertem Wasser (500 μL/Objektträger). Nachdem Sie die Abschnitte 15 Minuten lang an der Luft getrocknet haben, decken Sie sie mit einem Einbettmedium auf Wasserbasis ab und lassen Sie sie trocknen. Nehmen Sie die Schnittbilder mit einem konfokalen Mikroskop mit einem 20-fach-Objektiv auf.
- Real-time qPCR für Gliazellmarker und inflammatorische Zytokine
HINWEIS: Die Primersequenzen 16,20,21,22, die im vorgestellten Protokoll verwendet werden, sind in Tabelle 1 aufgeführt.- Präparation von frischem Hirngewebe: Perfundieren Sie die Maus mit PBS, wie in den Schritten 2.1.1-2.1.4 beschrieben. Extrahieren Sie dann das frische Gehirn und schneiden Sie es mit einem Hirnschneider koronal in 1 mm dicke Abschnitte. Wählen Sie vier Scheiben aus und schneiden Sie Gehirnstücke (jeweils 1 mm2 Quadrate) aus, die die Stichwundregion oder intakte Regionen auf der kontralateralen Seite der Großhirnrinde enthalten, so das Millimeterpapier. Bestimmen Sie den Bereich, der herausgeschnitten werden soll, einschließlich der Läsion in der Mitte (Abbildung 1D).
- RNA-Extraktion: Sammeln Sie die vier Gehirnteile in einem 1,5-ml-Röhrchen und homogenisieren Sie sie durch Pipettieren mit 1 mL TRIzol-Reagenz. Inkubieren Sie die Mischung 5 Minuten lang bei Raumtemperatur. Fügen Sie dann 200 μl Chloroform hinzu, wirbeln Sie es gut durch und inkubieren Sie weitere 2 Minuten bei Raumtemperatur. Die Mischung bei 12.000 x g für 15 min bei 4 °C zentrifugieren. Übertragen Sie die obere, klare Schicht vorsichtig in ein neues 1,5-ml-Röhrchen und vermeiden Sie dabei weiße Ausfällungen, die DNA und Proteine enthalten.
- 500 μl Isopropanol in die gesammelte obere Schicht geben, gut mischen und 10 Minuten bei Raumtemperatur inkubieren. Nach der Zentrifugation bei 12.000 x g für 10 min bei 4 °C wird der Überstand entfernt und 1 ml 70 % Ethanol hinzugefügt, um das RNA-Pellet zu waschen. Zentrifugieren Sie bei 7.500 x g für 5 min bei 4 °C, entfernen Sie den Überstand vollständig und trocknen Sie das Pellet 10 min lang an der Luft. Lösen Sie das RNA-Pellet in 15 μl RNase-freiem Wasser auf und denaturieren Sie die RNA für 10 min bei 55°C.
- Messen Sie die RNA-Konzentration mit einem Mikrovolumen-Spektrophotometer. Lagern Sie die RNA sofort bei -80 °C.
- cDNA-Synthese: Verwenden Sie für die cDNA-Synthese ein kommerziell erhältliches DNA-Synthesekit. Bereiten Sie insgesamt 10 μl Reaktionspuffer in einem 1,5-μl-Röhrchen für jede Probe vor, darunter 2 μl 5 x RT-Puffer, 0,5 μl RT-Enzymmix, 0,5 μl Primer-Mix, 1 μg RNA und nukleasefreies Wasser. Inkubieren Sie bei 37 °C für 15 min für die reverse Transkriptionsreaktion und bei 98 °C für 5 min für die Enzyminaktivierungsreaktion. Geben Sie dann 90 μl nukleasefreies Wasser in den Puffer und mischen Sie es gut. Lagern Sie die cDNA-Lösung bei -20 °C.
- Quantifizierung der RNA-Expression: Verwenden Sie für die Echtzeit-qPCR-Analyse ein kommerziell erhältliches qPCR-Mastermix-Kit. Bereiten Sie die Mischlösung für jede Probe vor, indem Sie 5 μl KOD SYBR qPCR Mix, 0,4 μl 5 μM Forward Primer, 0,4 μl 5 μM Reverse Primer und 0,2 μl 50 x ROX in 2 μl nukleasefreiem Wasser kombinieren.
- Stellen Sie eine Mischung aus 2 μl cDNA-Lösung und 8 μl Mischlösung in einem 8-Streifen-Röhrchen her, mischen Sie es gut und schleudern Sie es herunter.
- Initiieren Sie die PCR-Reaktion unter den folgenden Zyklusbedingungen: 98 °C für 2 Minuten, gefolgt von 40 Zyklen mit 98 °C für 10 s, 60 °C für 10 s und 68 °C für 30 s. Führen Sie den Schritt Schmelz-/Dissoziationskurvenanalyse mit einem Echtzeit-qPCR-Gerät durch.
- mRNA-Expressionsanalyse: Analysieren Sie das mRNA-Expressionsniveau mit der 2-Delta-Delta-Ct-Methode, die durch Normalisierung mit einem Housekeeping-Gen, Gapdh, und dann mit dem der kontralateralen Seitedurchgeführt wird 23.
Ergebnisse
Um die Genesung vom BHS-Abbau zu analysieren, wurde das Blutungsniveau in den stichverwundeten Großhirnrinde durch Messung des Extravasationsspiegels von Serum-IgG 1, 3, 5 und 7 Tage nach der Hirnverletzung bestimmt. Die IgG-Färbebilder der Maus zeigten Blutleckagen und Ablagerungen in der Großhirnrinde nach einer Hirnverletzung. Diese reduzierte sich nach mehr als 7 Tagen, als sich die BHS erholte und das IgG-Protein abgebaut wurde (Abbildung 2B). Die IgG-Extravasationswerte wurden durch Messung der Intensität der IgG-Färbung im Bereich der Stichwunde quantifiziert, was darauf hindeutet, dass die IgG-Extravasation 1 Tag nach der Hirnverletzung ihren Höhepunkt erreichte (Abbildung 2C). Neben der Bestätigung der Genesung vom BHS-Abbau wurde auch das Evans-Blau-Austreten in das Hirnparenchym nach der Stichverletzung quantifiziert. Im intakten Gehirn verhindert die BHS, dass Evans-Blau aus den Blutgefäßen ins Gehirn gelangt. Nach einer Hirnverletzung führte der BHS-Abbau jedoch zu einem sofortigen Evans-Blau-Leck um die Wundstelle herum (Abbildung 2D). Die Quantifizierung der Evans-Blau-Konzentration, basierend auf der Fluoreszenzintensität, zeigte einen exponentiellen Anstieg innerhalb von 1 h nach der Stichwunde, gefolgt von einer Abnahme 1 und 3 Tage nach der Verletzung (Abbildung 2E). In Übereinstimmung mit diesen Daten wurde berichtet, dass die mRNA-Expression der BHS-Integrität und von Tight-Junction-bezogenen Faktoren wie alkalischer Phosphatase und Claudin-5 1 und 3 Tage nach der Verletzung verringert ist17.
Immunenzymatische und Immunfluoreszenzfärbungen für den Mikrogliamarker Iba1 und den Astrozytenmarker GFAP in der Großhirnrinde 1, 3, 5 und 7 Tage nach der Stichwunde zeigten eine Akkumulation von Iba1+-Mikroglia und GFAP+-Astrozyten um die Läsionsstelle. Die maximale Akkumulation von Iba1+-Mikroglia trat etwa 5 Tage nach der Verletzung auf, während die GFAP+-Astrozyten etwa 3 Tage nach der Verletzung ihren Höhepunkt erreichten (Abbildung 3A,B). In Übereinstimmung mit den Färbeergebnissen waren auch die mRNA-Expressionsniveaus von Iba1 und Gfap nach der Verletzung erhöht, wobei nach dem 7. Tag Verbesserungen beobachtet wurden (Abbildung 3C,D). Darüber hinaus erhöhte die Stichwunde die mRNA-Expressionsniveaus von inflammatorischen Zytokinen, einschließlich Tumornekrosefaktor-α (Tnf-a), transformierendem Wachstumsfaktor-β1 (Tgf-b1), Interleukin-6 (Il-6) und Interleukin-1β (Il-1b) in den Stichwundregionen der Großhirnrinde (Abbildung 3E-H). Diese Erhöhungen der Zytokinexpression nach 1 Tag für Tnf-a, Il-6 und Il-1b und nach 3 Tagen für Tgf-b1 nach der Stichwunde gingen mit dem Anstieg der Astrozyten- und Mikroglia-mRNA-Spiegel einher. Da sich der Zeitpunkt der Gliaaktivierung und der inflammatorischen Zytokinexpression überschnitt, ist es wahrscheinlich, dass aktivierte Astrozyten und Mikroglia die Quellen dieser inflammatorischen Zytokine sind. Darüber hinaus können Immunzellen, die aufgrund der Stichwunde in das Gehirn gelangt sind, neben den Gliazellen auch zur Produktion von entzündlichen Zytokinen beitragen24.
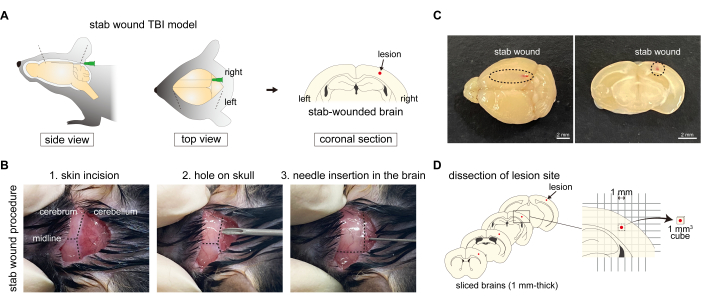
Abbildung 1: Verfahren zur Generierung des Stichwund-SHT-Mausmodells. (A) Schematische Darstellung des Stichwunden-SHT-Mausmodells, das das Verfahren zeigt, bei dem die rechte Hemisphäre der Großhirnrinde mit Nadeln durchstochen wird, was zu einer Schädelschädigung führt. (B) Überblick über das TBI-Protokoll für Stichwunden: (1) Einen Hautschnitt am Hinterkopf vornehmen; (2) mit einer Nadel ein Loch in die rechte Hemisphäre des Hinterhauptbeins bohren; und (3) das Einstechen einer Nadel in die Großhirnrinde der rechten Hemisphäre durch das Loch im Hinterhauptbein. (C) Makroskopische Bilder der Stichwunde zur Großhirnrinde von der kaudalen bis zur rostralen Achse. Maßstabsbalken: 2 mm. (D) Schematische Darstellung der Dissektion an der Läsionsstelle unter Verwendung des Stichwund-SHT-Mausmodells. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
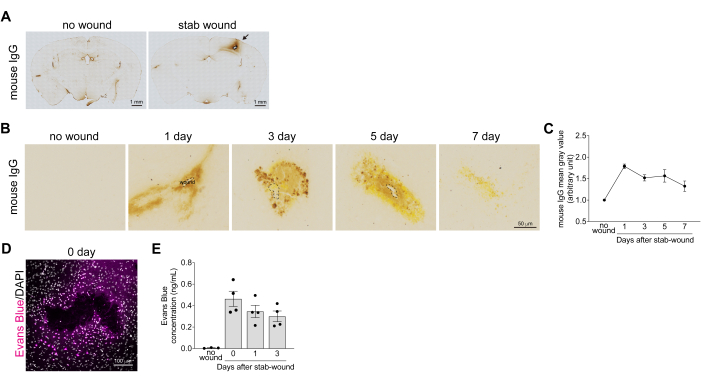
Abbildung 2: Quantifizierung der Quantifizierung der Genesung nach dem Zusammenbruch der Blut-Hirn-Schranke in stichverwundeten Kortexen. (A) Hellfeldbilder ganzer stichverwundeter Hirnabschnitte unmittelbar nach der Verletzung wurden immunenzymatisch mit einem Antikörper gegen Maus-IgG gefärbt. Es wird keine Wundrinde als Negativkontrollmaus verwendet. Das ausgelaufene und abgelagerte Maus-IgG, das reichlich im Blut vorhanden ist, wird braun gefärbt. Maßstabsbalken: 1 mm. (B) Hellfeldbilder der stichverwundeten Großhirnrinde 1, 3, 5 und 7 Tage nach der Hirnverletzung, immunenzymatisch gefärbt mit einem Antikörper gegen Maus-IgG. Es wird keine Wundrinde als Negativkontrollmaus verwendet. Maßstabsbalken: 50 μm. (C) Die Grafik zeigt das Referenzbeispiel für die mittleren Grauwerte der Maus-IgG-Färbung. Alle Werte wurden mit dem mittleren Grauwert der unverletzten kontralateralen Hemisphäre normiert. Die Daten werden als Mittelwert ± Standardfehler des Mittelwerts n > 3 dargestellt. (D) Konfokale Bilder der stichwunden Großhirnrinde 1 h nach der Hirnverletzung, nachdem der Maus die Evans-Blau-Lösung injiziert wurde. Die Bilder wurden mit einem konfokalen Mikroskop bei einer Wellenlänge von 633 nm aufgenommen. Evans-Blau (Magenta) und DAPI (Grau). Maßstabsbalken: 100 μm. (E) Die Grafik zeigt ein Referenzbeispiel für die Änderung der Evans-Blau-Konzentration in Stücken von stichverwundeten Großhirnrinden. Die Daten werden als Mittelwert ± Standardfehler des Mittelwerts n > 3 dargestellt. Punkte zeigen die Ergebnisse aus jedem Gewebe an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Quantifizierung der Gliaentzündung in stichverwundeten Kortexen. (A,B) Bilder zeigen die stichverwundeten Großhirnrinde 1, 3, 5 und 7 Tage nach der Hirnverletzung nach enzymatisch immunenzymatischer Färbung (oben, Skalenbalken: 100 μm) und Immunfluoreszenzfärbung (unterer, Skalenbalken: 40 μm) mit Antikörpern gegen Iba1 als Mikrogliamarker (A) und GFAP als Astrozytenmarker (B). Es wurde keine Wundrinde als Negativkontrolle verwendet. (C,D) Die Grafiken zeigen die Referenzbeispiele für real-time qPCR-Analysen von Iba1 (C) und Gfap (D) mRNA-Expressionsänderungen nach einer Stichwunde in der Großhirnrinde. Die Iba1- und Gfap-mRNA-Spiegel wurden mit denen von Gapdh normalisiert. Das Expressionsniveau bei Mäusen ohne Wunde wurde als 1 angesehen, und alle anderen Werte wurden mit diesem Wert normalisiert. Die Daten werden als Mittelwert ± Standardfehler des Mittelwerts n > 5 dargestellt. Für die statistische Analyse wurde eine unidirektionale ANOVA verwendet. Punkte zeigen die Ergebnisse aus jedem Gewebe an. (E-H) Die Grafiken zeigen Referenzbeispiele für real-time qPCR-Analysen von tnf-a (E), Tgf-b1 (F), Il-6 (G) und Il-1b (H) mRNA-Expressionsänderungen nach Stichwunden in der Großhirnrinde. Jeder mRNA-Spiegel wurde mit dem von Gapdh normalisiert. Das Expressionsniveau bei Mäusen ohne Wunde wurde als 1 angesehen, und alle anderen Werte wurden mit diesem Wert normalisiert. Die Daten werden als Mittelwert ± Standardfehler des Mittelwerts n > 5 dargestellt. Für die statistische Analyse wurde eine unidirektionale ANOVA verwendet. Punkte zeigen die Ergebnisse aus jedem Gewebe an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Name des Gens | Primer-Sequenz | ||
| Iba1 | Vorwärts | 5′-GGATTTGCAGGGAGGAAAAG-3′ | |
| Rückwärts | 5′-TGGGATCATCGAGGAATTG-3′ | ||
| Gfap | Vorwärts | 5′-GAAGGTCCGCTTCCTGGAA-3′ | |
| Rückwärts | 5′-GGCTCGAAGCTGGTTCAGTT-3′ | ||
| Tnf-a | Vorwärts | 5′-ACAGAAAGCATGATCCGCG-3′ | |
| Rückwärts | 5′-GCCCCCCATCTTTTGGG-3′ | ||
| Tgf-b1 | Vorwärts | 5′-CCCTATATTTGGAGCCTGGA-3′ | |
| Rückwärts | 5′-CTTGCGACCCACGTAGAGA-3′ | ||
| Il-6 | Vorwärts | 5′-CTGCAAGAGACTTCCATCCAGTT-3′ | |
| Rückwärts | 5′-GAAGTAGGGAAGGCCGTGG-3′ | ||
| IL-1B | Vorwärts | 5′-GCACACCCACCCTGCAG-3′ | |
| Rückwärts | 5′-AACCGCTTTTCCATCTTCTTCTT-3′ | ||
| Gapdh | Vorwärts | 5′-CGTGTTCTACCCCCAATGT-3′ | |
| Rückwärts | 5′-TGTCATCATACTTGGCAGGTTTCT-3′ | ||
Tabelle 1: Primersequenzen, die für die Echtzeit-qPCR-Analyse unter Verwendung des Stichwund-TBI-Mausmodells verwendet wurden
Diskussion
Hier wurde ein Protokoll zur Erstellung eines SHT-Mausmodells mit Hilfe von Nadeln vorgestellt. Dieses Protokoll ermöglicht eine quantitative Beurteilung der Genesung nach dem Abbau der BHS und der Entzündung nach Hirnverletzungen unter Verwendung histologischer und molekularbiologischer Ansätze. Alternative Protokolle, wie z. B. das repetitive erschütternde SHT-Modell und das Gewichtsabfall-SHT-Modell, können ebenfalls zur Analyse des BHS-Abbaus und der Entzündung verwendet werden. Diese Modelle replizieren die SHT-Pathologie unter kontrollierten Bedingungen, einschließlich spezifischer Parameter für Schlagstärke, Reichweite und Gehirnregion, mit speziellen Geräten. Zusätzlich können sie bei intaktem Schädel eine geschlossene Hirnverletzung verursachen. Umgekehrt ahmt das vorgeschlagene SHT-Modell sowohl Schädel- als auch Hirnschäden nach, die durch Schädel- und Hirnschäden verursacht werden. Da das vorgestellte Protokoll Hirnschäden in einem engen Bereich induzieren kann, ist es außerdem wichtig, den Beobachtungsbereich für die Analyse des BHS-Abbaus und der Entzündung klar zu definieren. Dies ist die Neuheit dieses Protokolls, das durch die Verwendung einer dünneren Nadel als üblich ermöglicht wurde25,26. Ein weiteres einzigartiges Merkmal ist, dass das TBI-Mausmodell ohne die Ausrüstung der Stereo-Taxikoordinate27 einfach erstellt werden kann.
SHT-Symptome werden als leicht, mittelschwer oder schwer eingestuft, basierend auf dem Grad der Bewusstseinsbeeinträchtigung gemäß der Glasgow Coma Scale (GCS)28. Das Stichwunden-SHT-Modell ist besonders effektiv bei der Replikation von Symptomen, die einem leichten (GCS 13-15) bis mittelschweren (GCS 9-12) SHT entsprechen, und eignet sich besonders für die Beurteilung des BHS-Abbaus und der Entzündung. Die SHT-Modelltechnik mit Stichwunden kann jedoch einige Einschränkungen aufweisen, einschließlich einer geringeren Schwere der Hirnschädigung, da sie nach der Stichverletzung keine Verhaltensänderung induziert. Wir führten keine detaillierten Verhaltenstests mit dem SHT-Modell durch, aber es gab keine sichtbar signifikanten Defekte in der Motorik oder im Sozialverhalten nach dem Aufwachen aus der Narkose. Daher sind andere SHT-Modelle besser geeignet, um die Verhaltensänderungen nach einer Hirnverletzung zu verfolgen. Das SHT-Modell mit Stichwunden könnte jedoch nach einer detaillierten Analyse immer noch Lern- und Gedächtnisstörungen aufzeigen. Zum Beispiel zeigte ein repetitives erschütterndes SHT-Mausmodell Verhaltensbeeinträchtigungen im Morris-Wasserlabyrinth und im sozialen Anerkennungstest 2,29,30. Das TBI-Mausmodell mit Gewichtsabfall zeigte ebenfalls eine verminderte Lern- und Gedächtnisfähigkeit, obwohl es keinen Einfluss auf die motorischen Fähigkeiten im Morris-Wasserlabyrinth hatte31,32. Daher eignen sich SHT-Modelle, die schwerere Schäden induzieren, besser für die Verhaltensanalyse. Darüber hinaus kann das SHT-Modell mit Stichwunden eine signifikante Variabilität in den Schadensbedingungen aufweisen, da die Einstichposition, der Winkel und die Tiefe der in das Gehirn eingeführten Nadel unterschiedlich sind, was von der Handhabungstechnik abhängt. Es wurde jedoch bereits gezeigt, dass das TBI-Modellprotokoll für Stichwunden durch Erhöhung der Anzahl der Replikate zuverlässige Daten für Blutungs- und Entzündungsanalysen liefern kann. Eine weitere Verfeinerung des Stab-Wound-Protokolls zur Reduzierung der Variabilität und zur Verbesserung der Reproduzierbarkeit könnte die Zuverlässigkeit des Modells erhöhen. Dazu gehört die Standardisierung der Technik und die Minimierung des Blutungsrisikos.
Das hier vorgestellte Protokoll erleichtert die Erstellung eines SHT-Mausmodells, aber es gibt wichtige Überlegungen für das Stich-Wund-Verfahren. Gelegentlich können Mäuse nach dem Eingriff verbluten. Um dieses Risiko zu minimieren, ist es wichtig, den Hautschnitt so klein wie möglich zu machen, um den Hinterhauptknochen freizulegen und eine Schädigung der nahe gelegenen Blutgefäße um die Ohren zu vermeiden. Außerdem sollte die Größe des Lochs im Hinterhauptbein gerade groß genug sein, um eine 27 G x 3/4" Nadel aufzunehmen.
Während der Immunhistochemie ist es wahrscheinlich, dass eine unspezifische Bindung um die Stichwundregion herum auftritt, da der Antikörper leicht von ausgetretenen Blutbestandteilen eingefangen werden kann. Daher ist es notwendig, die unspezifische Bindung zusätzlich zur üblichen Färbung durch Färbung nur mit den Sekundärantikörpern zu beurteilen.
Das Stich-Wund-SHT-Modell ist nützlich für die Aufklärung von Gerinnungsmechanismen im Gehirn, da es eine einfache Identifizierung der Blutungsstelle ermöglicht. Damit ist es ein geeignetes Modell für die Analyse der Gerinnungsregulatoren. Die Minimierung der Blutungsausdehnung, unterstützt durch eine sofortige Aktivierung des Gerinnungs- und Fibrinolysesystems, führt zu einer Abschwächung der Entzündung nach Hirnverletzungen10,33. Das vorgestellte TBI-Protokoll kann zur Analyse der Thrombozytenaktivierung und der Fibrinbildung in der Läsionsstelleverwendet werden 10,33. Dies zeigt, wie wichtig eine schnelle Behandlung der Blutgerinnungsmittel nach einem SHT ist. Darüber hinaus kann es verwendet werden, um die Milderung von sekundären Verletzungen zu beurteilen, indem es die Blutung nach einem SHT reguliert.
Ein Hirnödem wurde mit dem SHT-Modell mit Stichwunden nicht beobachtet. Ein SHT induziert ein vasogenes Hirnödem, das durch die durch körperliche Schäden verursachte übermäßige Flüssigkeitsansammlung im extravaskulären und extrazellulären Raum verursacht wird, sowie ein zytotoxisches Hirnödem, das aus der intrazellulären Flüssigkeitsansammlung resultiert34. Das Stichwunden-SHT-Modell könnte verwendet werden, um Hirnödeme zu beobachten, einschließlich vasogener und zytotoxischer Ödeme, da die Stichwunde sowohl die Blutgefäße als auch die Zellen im Modell schädigt.
Es ist möglich, die neuronale Apoptose nach Hirnverletzungen mit Hilfe des SHT-Modells zu analysieren. Eine frühere Studie deutete darauf hin, dass die neuronale Apoptose, die durch gespaltene Caspase 3 nachgewiesen wird, sofort offensichtlich ist und auf den Gehirnbereich um die Verletzungsstelle beschränkt ist und 3 Tage nach der Hirnverletzung ihren Höhepunkt erreicht. Darüber hinaus zeigte die neuronale Apoptose, die mit dem TUNEL-Assay nachgewiesen wurde, eine ähnliche Zeitpunktänderung wie die Analyse der gespaltenen Caspase 314.
Es ist ratsam, mehrere SHT-Modelle für die Entwicklung von Therapieansätzen zu verwenden, da ein SHT unter verschiedenen Bedingungen und Umständen auftreten kann. Diese Studie zeigte, dass das vorgestellte Protokoll ausreicht, um Musteränderungen in Zeitreihendaten für die Gliaaktivierung, die inflammatorische Zytokinexpression und den neuronalen Verlust nach einer Stichwunde zu quantifizieren12,14. Darüber hinaus kann die Zeitreihenänderung des Gerinnungsprozesses bei einem Stich-Hirn-Trauma deutlich nachgewiesenwerden 10,33. Die Anwendung des vorgestellten Verfahrens wird die Untersuchung von Blutgerinnungsmitteln und entzündungshemmenden Verbindungen für die Entwicklung von Therapeutika für SHT erleichtern. Darüber hinaus ermöglicht das vorgestellte SHT-Modell die Beobachtung der Aktivierung von Astrozyten und Mikroglia unmittelbar nach der Hirnverletzung, wobei ihre anschließende Ruhephase innerhalb von 7 Tagen im Kortex erfolgt. Darüber hinaus werden sowohl die Entzündungsreaktion als auch die Gliaaktivierung während der Gliaruhe abgeschwächt. Darüber hinaus wird der BHS-Abbau innerhalb eines Zeitraums repariert, der mit der Wiederherstellung der Gliaaktivierung vergleichbar ist17. Diese Phänotypen deuteten darauf hin, dass das SHT-Modell der Stichwunde eher die akute Phase des SHT als die chronische Phase widerspiegelt. Daher ist das vorgestellte Stich-Wund-SHT-Modell ein wertvoller Ansatz für die Entwicklung von Therapiemethoden für SHT, mit dem Ziel, den Übergang von der akuten in die chronische Phase zu verhindern.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken Ayana Hamano, Minori Yamashita, Misaki Endo, Hirono Kobayashi und Nito Nakahira für ihre Hilfe bei der Immunhistochemie und der Echtzeit-qPCR. Diese Arbeit wurde unterstützt von der JSPS KAKENHI 19K16122, der Takeda Science Foundation, der Astellas Foundation for Research on Metabolic Disorders, der Mitsubishi Foundation, der Brain Science Foundation und der Uehara Memorial Foundation to K.H.
Materialien
| Name | Company | Catalog Number | Comments |
| 19 G x 1•1/2" needle | TERUMO | NN-1938R | |
| 27 G x 3/4" needle | TERUMO | NN-2719S | |
| anti-GFAP antibody | Sigma-Aldrich | G9269 | |
| anti-Iba1 antibody | Wako | 019-19741 | |
| Atipamezole Hydrochloride | Nippon Zenyaku Kogyo | Product name: Antisedan | |
| Biotin-conjugated mouse IgG antibody | Vector Laboratories | BA-9200 | |
| Biotin-conjugated rabbit IgG antibody | Vector Laboratories | BA-1000 | |
| Bovine albumin | Nacalai tesque | 01860-07 | |
| Brain Slicer | Visikol | BSLM-2 | |
| Butorphanol Tartrate | Meiji Animal Health | Product name: Vetorphale 5 mg | |
| Confocal microscope | Zeiss | LSM700 | |
| Cryostat | Leica | CM1520 | |
| DAB | Sigma-Aldrich | D5637-1G | |
| DAPI | Roche | 10236276001 | |
| Evans blue | Wako | 056-04061 | |
| Fluorescent-conjugated rabbit IgG antibody | Invitrogen | A-21206 | |
| Fluoromount-G | Invitrogen | 4958-02 | Water-based mounting medium |
| Isoflurane Inhalation Solution | Viatris | v002139 | |
| KOD SYBR qPCR Mix | TOYOBO | QKD-201 | qPCR master mix kit |
| Medetomidine | Nippon Zenyaku Kogyo | Product name: Domitor | |
| Microscope | Olympus | FSX100 | |
| Microvolume spectrophotometer | ThermoFisher Scientific | NanoDrop One | |
| Midazolam 10 mg/2 mL | Sandoz | 1124401A1060 | |
| MOUNT QUICK | Daido Sangyo | DM01 | Water insoluble mounting medium |
| Newborn calf serum | Gibco | 16010159 | |
| O.C.T. compound | Sakura Finetek Japan | 45833 | Embedding medium |
| Peel-A-Way, Truncated 22 mm Square Top | Ted Pella | 27118 | Tissue embedding mold |
| Peristaltic perfusion pump | ATTO | SJ-1211 | |
| Plate reader | Fisher Scientific | Cytation 3 | |
| Real-time qPCR machine | ThermoFisher Scientific | StepOne Plus | |
| ReverTra Ace qPCR RT Kit | TOYOBO | FSQ-101 | cDNA synthesis kit |
| Superfrost Plus Slide Glass | Fisher Scientific | 12-550-15 | Positive-charged slide glass |
| Suture with needle | Alfresa | HT2003NA75-KF2 | |
| TRIzol Reagent | Invitrogen | 15596026 | |
| VECTASTAIN ABC Standard Kit | Vector Laboratories | PK-4000 | Avidin/biotin-based peroxidase system kit |
Referenzen
- Narayan, R. K., et al. Clinical trials in head injury. J Neurotrauma. 19 (5), 503-557 (2002).
- Shitaka, Y., et al. Repetitive closed-skull traumatic brain injury in mice causes persistent multifocal axonal injury and microglial reactivity. J Neuropathol Exp Neurol. 70 (7), 551-567 (2011).
- Flierl, M. A., et al. Mouse closed head injury model induced by a weight-drop device. Nat Protoc. 4 (9), 1328-1337 (2009).
- Ikeshima-Kataoka, H., Shen, J. S., Eto, Y., Saito, S., Yuasa, S. Alteration of inflammatory cytokine production in the injured central nervous system of tenascin-deficient mice. In Vivo. 22 (4), 409-413 (2008).
- Zhou, Y., Wang, Y., Wang, J., Anne Stetler, R., Yang, Q. W. Inflammation in intracerebral hemorrhage: From mechanisms to clinical translation. Prog Neurobiol. 115, 25-44 (2014).
- Hijazi, N., et al. Endogenous plasminogen activators mediate progressive intracerebral hemorrhage after traumatic brain injury in mice. Blood. 125 (16), 2558-2567 (2015).
- Kataoka, K., et al. Roles of urokinase-type plasminogen activator in a brain stab-wound. Brain Res. 887 (1), 187-190 (2000).
- Wang, Y., et al. Early posttraumatic csf1r inhibition via plx3397 leads to time- and sex-dependent effects on inflammation and neuronal maintenance after traumatic brain injury in mice. Brain Behav Immun. 106, 49-66 (2022).
- Kaplan, L., Chow, B. W., Gu, C. Neuronal regulation of the blood-brain barrier and neurovascular coupling. Nat Rev Neurosci. 21 (8), 416-432 (2020).
- Endo, M., et al. 2-carba cyclic phosphatidic acid regulates blood coagulation and fibrinolysis system for repair after brain injury. Brain Res. 1818, 148511 (2023).
- Goldim, M. P. S., Della Giustina, A., Petronilho, F. Using Evans blue dye to determine blood-brain barrier integrity in rodents. Curr Protoc Immunol. 126 (1), e83 (2019).
- Hashimoto, K., et al. 2-carba cyclic phosphatidic acid suppresses inflammation via regulation of microglial polarization in the stab-wounded mouse cerebral cortex. Sci Rep. 8 (1), 9715 (2018).
- Ikeshima-Kataoka, H., Abe, Y., Yasui, M. Aquaporin 4-dependent expression of glial fibrillary acidic protein and tenascin-c in activated astrocytes in stab-wound mouse brain and in primary culture. J Neurosci Res. 93 (1), 121-129 (2015).
- Nakashima, M., et al. The neuroprotective function of 2-carba-cyclic phosphatidic acid: Implications for tenascin-c via astrocytes in traumatic brain injury. J Neuroimmunol. 361, 577749 (2021).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Ikeshima-Kataoka, H., Abe, Y., Abe, T., Yasui, M. Immunological function of aquaporin-4 in stab-wounded mouse brain in concert with a pro-inflammatory cytokine inducer, osteopontin. Mol Cell Neurosci. 56, 65-75 (2013).
- Ikeshima-Kataoka, H., Yasui, M. Correlation between astrocyte activity and recovery from blood-brain barrier breakdown caused by brain injury. Neuroreport. 27 (12), 894-900 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564 (2012).
- Botta, S., Chemiakine, A., Gennarino, V. A. Dual antibody strategy for high-resolution imaging of murine Purkinje cells and their dendrites across multiple layers. STAR Protoc. 3 (2), 101427 (2022).
- Amin, D. N., et al. Identification of stage biomarkers for human African trypanosomiasis. Am J Trop Med Hyg. 82 (6), 983-990 (2010).
- Jiang, J., et al. Therapeutic window for cyclooxygenase-2 related anti-inflammatory therapy after status epilepticus. Neurobiol Dis. 76, 126-136 (2015).
- Wei, J., et al. Microglia activation: One of the checkpoints in the CNS inflammation caused by angiostrongylus cantonensis infection in rodent model. Parasitol Res. 114 (9), 3247-3254 (2015).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative pcr and the 2(-delta delta c(t)) method. Methods. 25 (4), 402-408 (2001).
- Hazy, A., et al. Divergent age-dependent peripheral immune transcriptomic profile following traumatic brain injury. Sci Rep. 9 (1), 8564 (2019).
- Xia, Y., et al. Osthole confers neuroprotection against cortical stab-wound injury and attenuates secondary brain injury. J Neuroinflammation. 12, 155 (2015).
- Cieri, M. B., Villarreal, A., Gomez-Cuautle, D. D., Mailing, I., Ramos, A. J. Progression of reactive gliosis and astroglial phenotypic changes following stab-wound-induced traumatic brain injury in mice. J Neurochem. 167 (2), 183-203 (2023).
- Barreda-Manso, M. A., Yanguas-Casas, N., Nieto-Sampedro, M., Romero-Ramirez, L. Neuroprotection and blood-brain barrier restoration by salubrinal after a cortical stab injury. J Cell Physiol. 232 (6), 1501-1510 (2017).
- Rapp, P. E., et al. Patient characterization protocols for psychophysiological studies of traumatic brain injury and post-TBI psychiatric disorders. Front Neurol. 4, 91 (2013).
- Brody, D. L., Benetatos, J., Bennett, R. E., Klemenhagen, K. C., Mac Donald, C. L. The pathophysiology of repetitive concussive traumatic brain injury in experimental models; new developments and open questions. Mol Cell Neurosci. 66 (Pt B), 91-98 (2015).
- Meehan, W. P., Zhang, J., Mannix, R., Whalen, M. J. Increasing recovery time between injuries improves cognitive outcome after repetitive mild concussive brain injuries in mice. Neurosurgery. 71 (4), 885-891 (2012).
- Chen, C., et al. A novel simple traumatic brain injury mouse model. Chin Neurosurg J. 8 (1), 8 (2022).
- Machado, C. A., et al. Weight-drop model as a valuable tool to study potential neurobiological processes underlying behavioral and cognitive changes secondary to mild traumatic brain injury. J Neuroimmunol. 385, 578242 (2023).
- Hashimoto, K., Ikeda, N., Nakashima, M., Ikeshima-Kataoka, H., Miyamoto, Y. Vitronectin regulates the fibrinolytic system during the repair of cerebral cortex in stab-wounded mice. J Neurotrauma. 34 (22), 3183-3191 (2017).
- Unterberg, A. W., Stover, J., Kress, B., Kiening, K. L. Edema and brain trauma. Neuroscience. 129 (4), 1021-1029 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten