Method Article
Modèle murin de blessure à l’arme blanche pour l’étude de l’hémorragie et de l’inflammation dans les lésions cérébrales traumatiques
Dans cet article
Résumé
Les modèles simplifiés de traumatismes crâniens (TCC) ont facilité le développement d’approches thérapeutiques. Ce protocole décrit la création d’un cortex de souris à l’aide d’aiguilles, permettant l’analyse de l’hémorragie et de l’inflammation. Le modèle de souris TBI à l’arme blanche offre l’avantage d’être réalisé sans nécessiter d’équipement spécialisé.
Résumé
Les traumatismes crâniens résultent de dommages physiques, souvent causés par des accidents ou des incidents sportifs. Les causes des traumatismes crâniens sont diverses, notamment les commotions cérébrales, les contusions cérébrales, les hématomes et les fractures du crâne. Pour reproduire ces différentes causes, divers modèles de souris TCC ont été développés à l’aide de protocoles distincts. Les lésions cérébrales physiques entraînent des lésions cérébrales primaires et secondaires, ce qui exacerbe la perte neuronale. Les blessures primaires surviennent immédiatement après les dommages, souvent en raison d’une hémorragie, et déclenchent par la suite des blessures secondaires, y compris une inflammation autour de la lésion. Il est donc crucial de développer un modèle de TCC adapté à l’évaluation de l’extension de l’hémorragie et de la gravité de l’inflammation. Ce protocole introduit une méthode d’imitation des lésions cérébrales pénétrantes, appelée modèle murin de traumatisme crânien, afin d’étudier les mécanismes d’hémorragie, d’inflammation et de perte neuronale associés à la pathologie des traumatismes crâniens. Ce modèle est créé en perforant le crâne et le cerveau avec des aiguilles et est simple à exécuter sans avoir besoin d’équipement expérimental spécialisé. De plus, la blessure mineure infligée au cortex cérébral de la souris à l’aide d’une aiguille n’affecte pas le comportement de l’animal après la chirurgie. Cette caractéristique permet aux chercheurs d’étudier les effets localisés des lésions cérébrales sans se soucier des conséquences comportementales plus larges. Des données d’échantillon provenant de cortex cérébral de souris blessées par arme blanche démontrent l’efficacité du modèle dans l’évaluation des fuites sanguines dans le parenchyme, de l’activation gliale et de la production de cytokines inflammatoires. De plus, ce protocole facilite l’évaluation des coagulants sanguins et des composés anti-inflammatoires, contribuant ainsi au développement d’agents thérapeutiques pour les TCC.
Introduction
Les traumatismes crâniens (TCC) sont causés par des dommages physiques, souvent résultant d’accidents, notamment des accidents de la circulation et des chutes. Les traumatismes crâniens sont classés en deux types : les lésions cérébrales pénétrantes, qui se produisent lorsqu’un objet pointu perfore le crâne ainsi que le cerveau, et les lésions cérébrales fermées, qui sont causées par de violentes secousses du cerveau à l’intérieur sans rupture du crâne1.
Les causes des traumatismes crâniens sont très diverses, notamment les commotions cérébrales, les contusions cérébrales, les hématomes et les fractures du crâne ; par conséquent, des modèles murins de TCC ont été développés à l’aide de divers protocoles pour reproduire ces différentes causes. Par exemple, un modèle de TCC commotionnel répétitif implique des secousses cérébrales, où les souris sont coincées plusieurs fois à l’aide d’un impacteur en caoutchouc contrôlé électromagnétiquement2. De plus, dans le modèle TBI de chute de poids, une forte force externe est exercée sur la tête par un dispositif de chute de poids standardisé, provoquant une blessure contondante focale avec un crâne intact3. De plus, le modèle de traumatisme crânien à l’arme blanche est préparé en perforant le crâne et le cerveau à l’aide d’une aiguille4 (figure 1A). Étant donné que plusieurs modèles de TCC ont été développés, il est important de choisir un modèle en fonction de la pathologie spécifique à observer.
Les lésions cérébrales causées par des dommages physiques entraînent des lésions cérébrales primaires et secondaires, qui exacerbent encore la perte neuronale. La blessure primaire survient immédiatement après les dommages, résultant de la rupture de la barrière hémato-encéphalique (BHE), d’une hémorragie et d’un hématome. Par conséquent, il est crucial de minimiser l’hémorragie et l’expansion de l’hématome, car ces facteurs peuvent exacerber la gravité des symptômes de TCC. Les lésions secondaires sont déclenchées par des composants sanguins intraparenchymateux, qui entraînent ensuite une inflammation autour de la lésion5. Le pronostic après une lésion cérébrale dépend de la dynamique inflammatoire ; Par conséquent, il est crucial d’atténuer rapidement les lésions primaires et secondaires pour un pronostic favorable 6,7,8.
La BHE est composée de péricytes, de jonctions serrées entre les cellules endothéliales et les extrémités des astrocytes, qui travaillent ensemble pour limiter la fuite de substances des vaisseaux sanguins dans les cerveaux sains9. Dans le système de blessure au couteau présenté, la BHE est physiquement perturbée. Les méthodes courantes d’évaluation de l’intégrité de la BHE comprennent la coloration de l’immunoglobuline G (IgG) et l’évaluation de la fuite de traceurs de fluorescence, tels que le bleu d’Evans et le dextran10,11. La coloration IgG marque les composants sanguins qui s’échappent du site de la lésion et se déposent dans le cerveau. Au fur et à mesure que la BHE se rétablit, les fuites de composants sanguins dans le cerveau diminuent et ces dépôts se dégradent progressivement. Par conséquent, la coloration IgG est utilisée pour évaluer l’étendue de la récupération de la BHE après une lésion cérébrale. De plus, le niveau de fuite du traceur administré par voie intraveineuse dans le parenchyme cérébral reflète la récupération de la BHE. Cette méthode permet une évaluation plus claire de la dynamique de la BHE, car la fuite du traceur indique directement la transition des composants sanguins de la circulation sanguine au parenchyme cérébral. De plus, la minimisation de l’hémorragie entraîne une lésion primaire plus bénigne, soutenue par une coagulation sanguine rapide et une fibrinolyse en temps opportun. Par conséquent, la quantification de l’expression des régulateurs de la coagulation sanguine et de la fibrinolyse est un moyen efficace d’analyser ce processus. En ce qui concerne le mécanisme moléculaire sous-jacent à la coagulation, l’hémorragie après une lésion cérébrale est stoppée par la formation de fibrine. Par la suite, le thrombus riche en fibrine est dégradé par l’activateur tissulaire du plasminogène (tPA) et l’activateur de l’urokinase (uPA). Dans le modèle murin de traumatisme crânien, la formation de fibrine atteint un pic 1 jour après la blessure et diminue par la suite10. Ainsi, le niveau de récupération de la BHE peut être prédit en quantifiant les composants sanguins et l’extravasation du traceur dans le parenchyme cérébral, ainsi que l’expression des facteurs de coagulation sanguine.
Les méthodes de quantification de l’inflammation dans le processus de lésion secondaire comprennent l’activation gliale et l’expression des cytokines inflammatoires. L’inflammation prolongée est principalement induite par une accumulation excessive de microglies et d’astrocytes autour du site de la lésion. Par exemple, dans un modèle de traumatisme crânien à l’arme blanche, les blessures à l’arme blanche stimulent la réactivation des cellules gliales autour de la lésion pour éliminer les débris cellulaires et les composants sanguins. Cette réactivation gliale culmine généralement 3 jours après l’attaque par arme blanche 12,13. En plus de leur fonction de phagocytose, les cellules gliales réactivées sécrètent des cytokines inflammatoires excessives, entraînant une perte neuronale autour de la lésion14. Il a été rapporté que l’atténuation de l’inflammation gliale contribue à un pronostic favorable après une lésion cérébrale12,14. Déterminer le niveau d’inflammation est utile pour évaluer la gravité et le pronostic. Par conséquent, il est essentiel de développer un modèle de TCC adapté à l’évaluation de l’extension de l’hémorragie et de la gravité de l’inflammation. Cette étude présente un modèle de souris poignardée qui imite une lésion cérébrale pénétrante, dans le but d’étudier les mécanismes de l’hémorragie, de l’inflammation et de la perte neuronale dans la pathologie des traumatismes crâniens.
Protocole
Tous les protocoles de soins aux animaux ont été approuvés par le Comité institutionnel de soin et d’utilisation des animaux de l’Université d’Ochanomizu, au Japon, et ont été exécutés conformément aux directives établies par le ministère de l’Éducation, des Sciences et de la Culture du Japon. Des souris femelles C57BL/6J adultes de six semaines (20-25 g) ont été utilisées. Toutes les souris ont eu un accès ad libitum à de la nourriture et à de l’eau dans un environnement propre. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans la table des matériaux.
1. Chirurgie du cortex cérébral
- Préparation des réactifs
REMARQUE : Le protocole d’anesthésie est similaire à celui décrit précédemment15. Si l’animalerie recommande un anesthésique spécifique, veuillez suivre ses instructions. Il a déjà été confirmé que le pentobarbital sodique est efficace pour la chirurgie des plaies à l’arme blanche dans le cortex cérébral 4,13,16,17.- Anesthésique combiné MMB : Dissoudre 1,875 mL de 1 mg/mL de médétomidine, 2,0 mL de midazolam 5 mg/mL et 2,5 mL de tartrate de butorphanol à 5 mg/mL dans 18,625 mL de solution saline tamponnée au phosphate (PBS) pour créer un volume total de 25 mL. Ce mélange aura une concentration de 75 mg/L de médétomidine, 400 mg/L de midazolam et 500 mg/L de tartrate de butorphanol. Conserver à 4 °C jusqu’à 8 semaines avant utilisation.
- Antagoniste de l’anesthésie : Dissoudre 150 μL de chlorhydrate d’atipamézole à 5 mg/mL dans 9,85 mL de PBS pour créer un volume total de 10 mL, avec une concentration de 75 mg/L de chlorhydrate d’atipamézole. Conserver à 4 °C, à l’abri de la lumière, jusqu’à 8 semaines avant utilisation.
- Procédure chirurgicale
- Anesthésie chez la souris : Anesthésie temporairement les souris à l’aide d’un papier imbibé d’une solution d’inhalation d’isoflurane jusqu’à ce qu’elles s’endorment. Ensuite, injectez 10 μL/g d’anesthésique combiné MMB par voie intrapéritonéale à l’aide d’une seringue de 1 mL avec une aiguille de 27 G x 3/4 po. Après 3 à 5 minutes, confirmez l’efficacité de l’anesthésie en effectuant un pincement des orteils et en vérifiant le réflexe de redressement.
REMARQUE : Assurez-vous de faire très attention à ne pas donner une surdose d’anesthésie lors de l’utilisation d’une solution d’inhalation d’isoflurane. - Placez la souris sur sa face ventrale dans une serviette en papier. Après le transfert, confirmez à nouveau que la souris est toujours anesthésiée avec un pincement des orteils.
- Rasez la fourrure sur la peau de la région occipitale. Stérilisez la fourrure à l’arrière de la tête de la souris avec de l’éthanol à 70 % à l’aide d’un coton-tige. Saisissez la peau occipitale avec une pince émoussée et faites une incision de 1,0 à 1,5 mm de large pour exposer l’os occipital sans endommager le crâne ou un organe. Ouvrez doucement et lentement l’incision pour observer la limite entre le cortex cérébral et le cervelet à travers le crâne (Figure 1B).
REMARQUE : Assurez-vous qu’aucun dommage n’est causé au crâne ou au cerveau pour la souris non blessée. - Craniotomie chez la souris : Créez un petit trou dans l’hémisphère droit de l’os occipital à l’aide d’une aiguille de 19 G x 1•1/2 po. Tournez doucement l’aiguille pour faire un point d’insertion pour l’aiguilletage à l’arme blanche, en prenant soin de ne pas endommager le parenchyme cérébral. Le trou doit être positionné au milieu de la ligne interaurale de l’hémisphère droit entre le lambda et le bord (Figure 1B). Ce trou sert de guide pour l’insertion de l’aiguille à poignarder dans l’étape suivante.
- Blessure à l’arme blanche : Insérez une aiguille de 27 G x 3/4 po à partir du point d’insertion et poignardez le cortex cérébral le long de l’axe rostro-caudal (figures 1B et C). L’aiguille est insérée jusqu’à ce qu’elle entre en contact avec l’avant du crâne, puis retirée doucement. La profondeur appropriée est celle où l’aiguille peut être vue à travers la surface du cortex cérébral. Le côté gauche du cortex cérébral est utilisé comme témoin non endommagé.
- Suturez l’incision cutanée à l’aide d’une suture en nylon 3-0 avec une aiguille ronde.
- Administrer 10 μL/g de l’antagoniste de l’anesthésie par voie intrapéritonéale sous forme d’anesthésique combiné MMB. La souris devrait être capable de marcher dans les 8 à 16 heures suivant l’injection d’antagoniste de l’anesthésie.
- Anesthésie chez la souris : Anesthésie temporairement les souris à l’aide d’un papier imbibé d’une solution d’inhalation d’isoflurane jusqu’à ce qu’elles s’endorment. Ensuite, injectez 10 μL/g d’anesthésique combiné MMB par voie intrapéritonéale à l’aide d’une seringue de 1 mL avec une aiguille de 27 G x 3/4 po. Après 3 à 5 minutes, confirmez l’efficacité de l’anesthésie en effectuant un pincement des orteils et en vérifiant le réflexe de redressement.
2. Évaluation de l’hémorragie et récupération de la dégradation de la BHE
- Coloration immunoenzymatique d’une section de cerveau blessée par un coup de couteau pour une fuite d’IgG chez la souris
REMARQUE : Ici, des sections de cerveau congelé montées sur diapositive ont été utilisées. Les sections de cerveau congelé flottantes conviennent également à ce protocole.- Anesthésie chez la souris : Induisez l’anesthésie en plaçant la souris près d’un papier imbibé d’une solution d’inhalation d’isoflurane jusqu’à ce qu’elle s’endorme. Ensuite, administrer immédiatement 100 μL/kg d’anesthésique combiné MMB par voie intrapéritonéale. Confirmez l’effet de l’anesthésie avec un pincement des orteils et un réflexe de redressement.
- Placez la souris sur son dos et épinglez les bras et les pieds sur la planche de dissection.
- Thoracotomie de souris : Saisissez la peau abdominale à l’aide d’une pince émoussée et faites une incision de 1,0 à 1,5 cm à travers la peau et le péritoine pour exposer la cage thoracique. Ouvrez soigneusement la cage thoracique avec des ciseaux tout en évitant d’endommager le cœur pour l’exposer à la perfusion cardiaque.
- Fixation de la perfusion cardiaque : Préparez une pompe de perfusion péristaltique et fixez un tube avec une aiguille de 19 G x 1•1/2" à une extrémité. Remplissez le tube de PBS en allumant la pompe avant utilisation. Ensuite, pendant que la pompe fonctionne, insérez la pointe de l’aiguille dans le ventricule gauche et fixez-la avec une pince. Faites une incision de 0,5 à 1,0 mm dans l’oreillette droite. Perfuser la souris18 à un débit de 4 à 6 mL/min pendant 5 min avec au moins 20 mL de PBS pour éliminer le sang.
- Arrêtez la pompe et transférez le tube dans une solution de paraformaldéhyde à 4 % (PFA) dans du PBS. Redémarrer la pompe à un débit de 4 à 6 mL/min pendant 5 min avec au moins 20 mL de PFA à 4 % dans PBS pour la fixation18.
REMARQUE : Si la pompe n’est pas disponible, il est également possible d’utiliser une seringue de 50 ml avec une aiguille de 19 G x 1•1/2" pour la perfusion. - Dissection cérébrale : Placez la souris sur son côté ventral sur la planche de dissection et exposez le crâne en faisant une incision à travers la ligne médiane de la peau de la région occipitale au nez. Expliquez soigneusement le cerveau complètement en retirant le crâne avec des ciseaux, en prenant soin de ne pas endommager le cerveau. Soulevez le cerveau à l’aide d’une pince incurvée et transférez-le dans un tube de 15 ml rempli de 10 ml de PFA à 4 % de PBS.
- Incuber le cerveau disséqué pendant la nuit dans le PFA à 4 % dans du PBS à 4 °C pour une fixation complète. Ensuite, incubez le cerveau pendant la nuit dans 10 ml de saccharose à 15 % dans du PBS et transférez-le dans 10 ml de saccharose à 30 % dans du PBS pendant une journée supplémentaire sur un agitateur à bascule. Ce remplacement progressif du saccharose aide à prévenir les dommages tissulaires causés par la glace lorsque le cerveau est ensuite stocké dans un congélateur.
- Intégration cérébrale : Intégrez le cerveau coronalement dans un milieu d’intégration à l’intérieur d’un moule d’enrobage tissulaire, puis congelez-le à l’aide de 2-méthylbutane avec de la glace sèche19.
- Coupes de cerveau congelé : À l’aide d’un cryostat, montez des coupes coronales en série (20 μm d’épaisseur) du cerveau encastré sur une vitre de lame chargée positivement. Les sections du cerveau sont complètement séchées à l’air libre à température ambiante pendant la nuit et stockées dans un congélateur à -80 °C.
- Préparation du tampon bloquant : Mélangez 10 % de sérum de veau nouveau-né, 30 mg/mL d’albumine bovine, 10 mg/mL de glycine et 0,4 % de Triton X-100 dans du TBS pour créer le tampon bloquant. Conserver à 4 °C jusqu’à 2 semaines avant l’utilisation.
- Coloration IgG chez la souris : Après avoir séché à l’air libre à température ambiante pendant 1 h les sections du cortex cérébral blessées par le poignard, les fixer ensuite avec 500 μL de PFA à 4 % par lame pendant 30 min. Ensuite, laver la section avec du PBS (500 μL/lame) pendant 5 min, suivie de deux lavages avec une solution saline tamponnée au Tris (TBS, 500 μL/diapositive) pendant 5 min chacun.
REMARQUE : Effectuez toutes les procédures dans une boîte d’hydratation pour éviter que les tampons ne s’évaporent. - Inhiber l’activité enzymatique endogène par sections avec 10 % de méthanol et 3 % de peroxyde d’hydrogène dans le TBS pendant 5 min, suivi de deux lavages avec une solution saline tamponnée au Tris (TBS, 500 μL/lame) pendant 5 min chacun.
- Effectuer le blocage à l’aide d’un tampon de blocage (500 μL/lame) pendant 1 h à température ambiante pour éviter la liaison non spécifique de l’anticorps. Ensuite, incubez les sections avec un anticorps IgG de souris conjugué à la biotine (dilution 1:300 avec le tampon de blocage, 300 μL/lame) pendant 1 h à température ambiante.
- Pendant l’incubation avec l’anticorps IgG de souris, préparez le mélange de 1 μL de réactif A et de 1 μL de réactif B à partir du kit du système de peroxydase à base d’avidine/biotine dans 300 μL du tampon de blocage. Incuber ce mélange pendant 30 min à température ambiante avant utilisation. Une fois l’incubation de l’anticorps IgG de souris terminée, laver les sections avec du TBS pendant 5 minutes, trois fois. Ensuite, incubez les sections avec le mélange préparé de réactifs A et B (300 μL/lame) pendant 1 h à température ambiante.
- Lavez les sections avec 0,1 M de Tris-HCl pH 8,0 pendant 5 min, trois fois, au cours de 1 h. Ensuite, développer la couleur à l’aide de 0,05 % de 3,3'-diaminobenzidine (DAB) dans 0,05 % de Tris-HCl de Tris-HCl ajouté par du peroxyde d’hydrogène à 0,0 (500 μL/lame) pendant 5 min à 1 h (Figure 2A). Observez au microscope le changement de couleur avant d’arrêter la réaction.
- Lavez les sections avec 0,1 M de Tris-HCl pH 8,0 pendant 5 minutes trois fois et séchez les sections à l’air libre pendant 15 minutes. Par la suite, déshydratez les sections en les immergeant deux fois dans de l’éthanol à 95 % pendant 2 minutes, puis dans de l’éthanol à 100 % pendant 2 minutes. Nettoyez les sections de xylène pendant 5 minutes deux fois. Lissez les sections à l’aide d’un support de montage insoluble dans l’eau et laissez-les sécher.
- Analyse de l’intensité de la coloration IgG chez la souris : Capture d’images des coupes à l’aide d’un microscope avec un objectif 20x.
- À l’aide du logiciel ImageJ, quantifiez l’intensité de la coloration en mesurant les valeurs moyennes de gris dans cinq champs sélectionnés au hasard (8 × 8 μm2 pour chacun) à partir de régions colorées par immunoenzyme dans chaque section. Normaliser l’intensité de la coloration à l’aide de la valeur de gris moyenne de chaque controlatéral ; Il n’y a pas de région blessée comme correction de fond. Calculez la moyenne des valeurs de gris moyennes normalisées des cinq champs pour déterminer la valeur de gris moyenne de la coloration IgG de souris pour chaque section.
- Évaluation de la fuite de bleu d’Evans dans le parenchyme cérébral
REMARQUE : Le protocole Evans blue est similaire à la méthode décrite précédemment11. Le dextran marqué à l’isothiocyanate de fluorescéine (FITC) fonctionne également pour la récupération de la dégradation de la BHE10.- Injection d’Evans blue : Administrer 2 % d’Evans blue dans du PBS (3 mL/kg) à la souris blessée par l’arme blanche par la veine de la queue 1 h avant la dissection.
- Extraction du cerveau frais : 1 h après l’administration d’Evans Blue, perfuser la souris avec du PBS comme décrit aux étapes 2.1.1-2.1.4. Ensuite, disséquez et coupez le cerveau frais en sections de 1 mm d’épaisseur à l’aide d’un trancheur de cerveau. Sélectionnez quatre tranches et découpez des morceaux de cerveau (1 mm2 carrés, chacune) qui incluent la région de la blessure au couteau ou des régions intactes du cortex cérébral non blessé, selon le papier millimétré (Figure 1D).
- Quantification du bleu d’Evans : Rassemblez les quatre morceaux de cerveau dans un tube de 1,5 mL et homogénéisez-les avec 200 μL d’acide trichloracétique à l’aide d’un broyeur de tissus. Centrifuger l’homogénat à 10 000 x g à 4 °C pendant 20 min. Ensuite, prélevez le surnageant à l’aide d’une pipette et diluez-le avec 600 μL d’éthanol. Préparez une courbe standard du bleu d’Evans, allant de 0 à 1,0 ng/mL, pour quantifier sa concentration. Mesurez l’intensité de fluorescence à 680 nm avec une longueur d’onde d’excitation de 620 nm à l’aide d’un lecteur de plaques.
3. Évaluation du niveau d’inflammation dans le cerveau après une blessure au couteau
- Coloration immunoenzymatique de cellules gliales dans une section de cerveau blessée par un coup de couteau
- Préparation des sections cérébrales : Fabriquez les lunettes de diapositives montées sur les sections cérébrales comme décrit aux étapes 2.1.1 à 2.1.9.
- Coloration gliale : Après avoir séché à l’air libre les sections du cortex cérébral blessées par le couteau pendant 1 h, fixez à nouveau les sections avec 4 % de PFA (500 μL/lame) pendant 30 min. Ensuite, lavez les sections avec du PBS (500 μL/diapositive) pendant 5 min, puis deux lavages avec du TBS (500 μL/diapositive) pendant 5 min chacun.
- Inhiber l’activité enzymatique endogène par sections avec 10 % de méthanol et 3 % de peroxyde d’hydrogène dans le TBS pendant 5 min, suivi de deux lavages avec une solution saline tamponnée au Tris (TBS, 500 μL/lame) pendant 5 min chacun.
- Effectuer le blocage à l’aide d’un tampon de blocage (500 μL/lame) pendant 1 h à température ambiante pour éviter la liaison non spécifique de l’anticorps.
- Incuber les sections pendant la nuit avec l’anticorps primaire (300 μL/lame). Utilisez les dilutions suivantes pour l’anticorps primaire : dilution 1:3 000 pour Iba1 et dilution 1:1 000 pour GFAP, diluée dans le tampon de blocage.
- Lavez la section trois fois avec du TBS pendant 5 minutes chacune. Ensuite, incuber avec l’anticorps secondaire conjugué à la biotine (dilution 1:300 avec le tampon de blocage, 300 μL/lame) pendant 1 h à température ambiante.
- Pendant l’incubation avec l’anticorps secondaire, préparer le mélange de 1 μL de réactif A et de 1 μL de réactif B à partir du kit du système de peroxydase à base d’avidine/biotine dans 300 μL du tampon de blocage. Incuber ensuite le mélange à température ambiante pendant 30 min avant utilisation.
- Une fois l’incubation de l’anticorps secondaire terminée, laver les sections trois fois avec du TBS pendant 5 minutes chacune, et incuber les sections avec le mélange préparé de réactifs A et B (300 μL/lame) pendant 1 h à température ambiante.
- Lavez les sections avec 0,1 M de Tris-HCl pH 8,0 pendant 5 min, trois fois, au cours de 1 h. Ensuite, développez la couleur en utilisant 0,05 % de DAB dans 0,05 % de Tris-HCl 0,1 M ajouté au peroxyde d’hydrogène pH 8,0 (500 μL/lame) pendant 30 min à 3 h. Observez au microscope le changement de couleur avant d’arrêter la réaction.
- Lavez les sections avec 0,1 M de Tris-HCl pH 8,0 pendant 5 minutes trois fois et séchez les sections à l’air libre pendant 15 minutes. Après cela, déshydratez les sections en les immergeant dans de l’éthanol à 95 % pendant 2 minutes deux fois, puis dans de l’éthanol à 100 % pendant 2 minutes, deux fois. Nettoyez les sections de xylène pendant 5 minutes deux fois. Lissez les sections à l’aide d’un support de montage insoluble dans l’eau et laissez-les sécher. Capturez les images de coupe à l’aide du microscope avec un objectif de 20x.
- Coloration immunofluorescente d’une section de cerveau blessée par arme blanche pour les cellules gliales
- Préparation des sections cérébrales : Fabriquez les lunettes de diapositives montées sur les sections cérébrales comme décrit aux étapes 2.1.1 à 2.1.9.
- Coloration gliale : Après avoir séché à l’air libre les sections du cortex cérébral blessées par le couteau pendant 1 h, fixez à nouveau les sections avec 4 % de PFA (500 μL/lame) pendant 30 min. Ensuite, lavez les sections avec du PBS (500 μL/diapositive) pendant 5 min, puis deux lavages avec du TBS (500 μL/diapositive) pendant 5 min chacun. Effectuer le blocage à l’aide d’un tampon de blocage (500 μL/lame) pendant 1 h à température ambiante pour éviter la liaison non spécifique de l’anticorps.
- Incuber les sections pendant la nuit avec l’anticorps primaire (300 μL/lame). Utilisez les dilutions suivantes pour l’anticorps primaire : dilution 1:3 000 pour Iba1 et dilution 1:1 000 pour GFAP, diluée dans un tampon de blocage.
- Lavez la section trois fois avec du TBS pendant 5 minutes chacune. Ensuite, incuber avec l’anticorps secondaire conjugué à la fluorescence (dilution 1:300 avec le tampon de blocage, 300 μL/lame) pendant 1 h à température ambiante.
- Lavez les sections trois fois avec du TBS pendant 5 min chacune et incubez les sections avec une solution de DAPI à 0,4 μg/mL dans du TBS (500 μL/lame) pendant 5 min à température ambiante.
- Lavez les sections avec du TBS (500 μL/diapositive) pendant 5 min et avec de l’eau distillée (500 μL/diapositive) pendant 5 min. Après avoir séché les sections à l’air libre pendant 15 min, couvrez-les avec un support de montage à base d’eau et laissez-les sécher. Capturez les images de coupe à l’aide d’un microscope confocal avec un objectif 20x.
- qPCR en temps réel pour les marqueurs de cellules gliales et les cytokines inflammatoires
REMARQUE : Les séquences d’amorces16, 20, 21, 22 utilisées dans le protocole présenté sont énumérées dans le tableau 1.- Préparation de tissus cérébraux frais : Perfuser la souris avec du PBS comme décrit aux étapes 2.1.1 à 2.1.4. Ensuite, extrayez et coupez le cerveau frais en sections de 1 mm d’épaisseur à l’aide d’un coupe-cerveau. Sélectionnez quatre tranches et découpez des morceaux de cerveau (1 mm2 carrés, chacun) qui incluent la région de la blessure au couteau ou des régions intactes du côté controlatéral du cortex cérébral, selon le papier millimétré. Déterminez la région à découper, qui comprend la lésion au centre (Figure 1D).
- Extraction de l’ARN : Recueillir les quatre morceaux de cerveau dans un tube de 1,5 mL et les homogénéiser avec 1 mL de réactif TRIzol par pipetage. Incuber le mélange pendant 5 min à température ambiante. Ensuite, ajoutez 200 μL de chloroforme, en utilisant bien le vortex et laissez incuber pendant 2 minutes supplémentaires à température ambiante. Centrifuger le mélange à 12 000 x g pendant 15 min à 4 °C. Transférez soigneusement la couche supérieure transparente dans un nouveau tube de 1,5 ml, en évitant les précipités blancs, qui contiennent de l’ADN et des protéines.
- Ajouter 500 μL d’isopropanol à la couche supérieure recueillie, bien mélanger et incuber pendant 10 minutes à température ambiante. Après centrifugation à 12 000 x g pendant 10 min à 4 °C, retirer le surnageant et ajouter 1 mL d’éthanol à 70 % pour laver la pastille d’ARN. Centrifugez à 7 500 x g pendant 5 min à 4 °C, retirez complètement le surnageant et séchez la pastille à l’air libre pendant 10 min. Dissoudre la pastille d’ARN dans 15 μL d’eau exempte de RNase et dénaturer l’ARN pendant 10 min à 55°C.
- Mesurez la concentration d’ARN à l’aide d’un spectrophotomètre à microvolume. Stockez immédiatement l’ARN à -80 °C.
- Synthèse de l’ADNc : Pour la synthèse de l’ADNc, utilisez un kit de synthèse d’ADN disponible dans le commerce. Préparez un total de 10 μL de tampon de réaction dans un tube de 1,5 μL pour chaque échantillon, qui comprend 2 μL de 5 tampons RT, 0,5 μL de mélange d’enzymes RT, 0,5 μL de mélange d’amorces, 1 μg d’ARN et de l’eau sans nucléases. Incuber à 37 °C pendant 15 min pour la réaction de transcription inverse et à 98 °C pendant 5 min pour la réaction d’inactivation enzymatique. Ensuite, ajoutez 90 μL d’eau sans nucléases dans le tampon et mélangez bien. Conservez la solution d’ADNc à -20°C.
- Quantification de l’expression de l’ARN : Pour une analyse qPCR en temps réel, utilisez un kit de mélange maître qPCR disponible dans le commerce. Préparez la solution de mélange pour chaque échantillon en combinant 5 μL de KOD SYBR qPCR Mix, 0,4 μL d’amorce directe de 5 μM, 0,4 μL d’amorce inverse de 5 μM et 0,2 μL de 50 x ROX dans 2 μL d’eau sans nucléases.
- Faites un mélange de 2 μL de solution d’ADNc et de 8 μL de solution de mélange dans un tube à 8 bandelettes, mélangez bien et tournez.
- Amorcez la réaction PCR dans les conditions de cycle suivantes : 98 °C pendant 2 min, suivi de 40 cycles de 98 °C pendant 10 s, 60 °C pendant 10 s et 68 °C pendant 30 s. Effectuez l’étape d’analyse de la courbe de fusion/dissociation à l’aide d’une machine qPCR en temps réel.
- Analyse de l’expression de l’ARNm : Analyser le niveau d’expression de l’ARNm à l’aide de la méthode 2-Delta-Delta-Ct, qui est réalisée par normalisation avec un gène de housekeeping, Gapdh, puis avec celui du côté controlatéral23.
Résultats
Pour analyser la récupération de la dégradation de la BHE, le niveau d’hémorragie dans les cortex cérébraux blessés par arme blanche a été évalué en mesurant le niveau d’extravasation des IgG sériques à 1, 3, 5 et 7 jours après une lésion cérébrale. Les images de coloration IgG de souris ont révélé des fuites de sang et des dépôts dans les cortex cérébraux à la suite d’une lésion cérébrale. Celle-ci a été réduite après plus de 7 jours, à mesure que la BHE se rétablissait et que la protéine IgG se dégradait (Figure 2B). Les niveaux d’extravasation d’IgG ont été quantifiés en mesurant l’intensité de la coloration IgG autour de la zone de la plaie de couteau, ce qui indique que l’extravasation d’IgG a atteint un pic 1 jour après la lésion cérébrale (Figure 2C). En plus de confirmer la récupération de la dégradation de la BHE, la fuite de bleu d’Evans dans le parenchyme cérébral a été quantifiée après une blessure à l’arme blanche. Dans le cerveau intact, la BHE empêche le bleu d’Evans de s’échapper des vaisseaux sanguins vers le cerveau. Cependant, après une lésion cérébrale, la dégradation de la BHE a entraîné une fuite immédiate de bleu d’Evans autour du site de la plaie (Figure 2D). La quantification de la concentration en bleu d’Evans, basée sur l’intensité de la fluorescence, a montré une augmentation exponentielle dans l’heure qui a suivi l’attaque au couteau, suivie d’une diminution 1 et 3 jours après la blessure (figure 2E). Conformément à ces données, il a été rapporté que l’expression de l’ARNm de l’intégrité de la BHE et des facteurs liés aux jonctions serrées, tels que la phosphatase alcaline et la claudine-5, diminue 1 et 3 jours après la lésion17.
La coloration immunoenzymatique et immunofluorée du marqueur microglial Iba1 et du marqueur astrocytaire GFAP dans les cortex cérébraux 1, 3, 5 et 7 jours après l’attaque au couteau a révélé une accumulation de microglie Iba1+ et d’astrocytes GFAP+ autour du site de la lésion. Le pic d’accumulation de microglie Iba1+ s’est produit environ 5 jours après la blessure, tandis que les astrocytes GFAP+ ont atteint un pic environ 3 jours après la blessure (figures 3A et B). Conformément aux résultats de coloration, les niveaux d’expression de l’ARNm d’Iba1 et de Gfap ont également augmenté après la lésion, avec des améliorations observées après le 7ème jour (Figure 3C,D). De plus, la blessure par arme blanche a augmenté les niveaux d’expression de l’ARNm des cytokines inflammatoires, y compris le facteur de nécrose tumorale-α (Tnf-a), le facteur de croissance transformant-β1 (Tgf-b1), l’interleukine-6 (Il-6) et l’interleukine-1β (Il-1b) dans les régions de la blessure au couteau des cortex cérébraux (Figure 3E-H). Ces augmentations de l’expression des cytokines à 1 jour pour Tnf-a, Il-6 et Il-1b et à 3 jours pour Tgf-b1 après la blessure au couteau étaient concomitantes à l’augmentation des niveaux d’astrocytes et d’ARNm microgliaux. Étant donné que le moment de l’activation gliale et de l’expression des cytokines inflammatoires se chevauche, il est probable que les astrocytes activés et la microglie soient les sources de ces cytokines inflammatoires. De plus, les cellules immunitaires qui se sont échappées dans le cerveau en raison de la blessure au couteau peuvent également contribuer à la production de cytokines inflammatoires aux côtés des cellules gliales24.
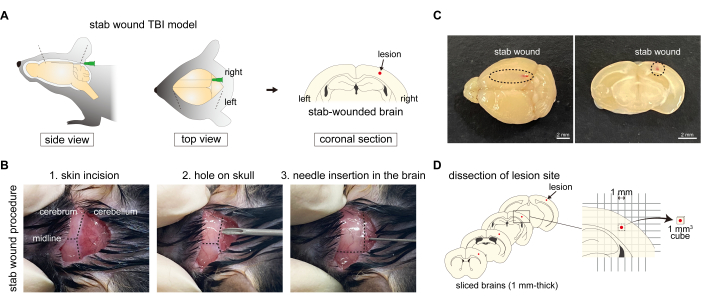
Figure 1 : Procédure de génération du modèle murin de TCC blessé par arme blanche. (A) Schéma de principe du modèle murin de TCC, montrant la procédure de perforation de l’hémisphère droit du cortex cérébral avec des aiguilles, entraînant des lésions du crâne. (B) Aperçu du protocole de traumatisme crânien par arme blanche : (1) incision cutanée à l’arrière de la tête ; (2) faire un trou dans l’hémisphère droit de l’os occipital à l’aide d’une aiguille ; et (3) l’insertion d’une aiguille dans le cortex cérébral de l’hémisphère droit à travers le trou de l’os occipital. (C) Images macroscopiques de la blessure par arme blanche au cortex cérébral de l’axe caudal à l’axe rostral. Barres d’échelle : 2 mm. (D) Schéma de la dissection du site de la lésion à l’aide du modèle murin TBI à l’arme blanche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
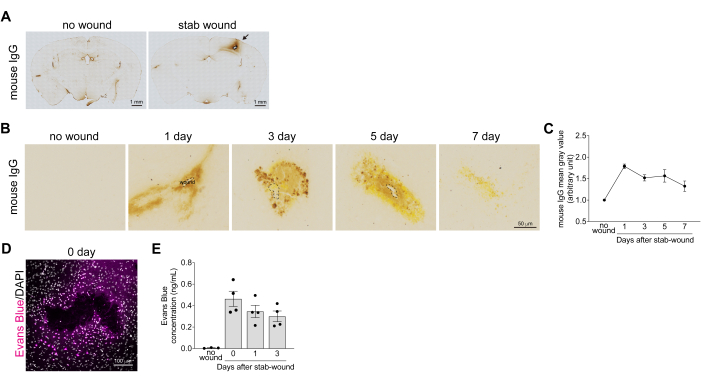
Figure 2 : Quantification de la récupération après la rupture de la barrière hémato-encéphalique dans les cortex blessés par arme blanche. (A) Des images en champ clair de sections entières de cerveau blessées immédiatement après la blessure ont été colorées immunoenzymatiquement avec un anticorps contre les IgG de souris. Aucun cortex blessé n’est utilisé comme souris de contrôle négatif. Les IgG de souris qui ont fui et qui se sont déposés, qui sont abondantes dans le sang, sont de couleur brune. Barres d’échelle : 1 mm. (B) Images en fond clair des cortex cérébraux blessés par arme blanche à 1, 3, 5 et 7 jours après la lésion cérébrale colorés immunoenzymatiquement avec un anticorps contre les IgG de souris. Aucun cortex blessé n’est utilisé comme souris de contrôle négatif. Barre d’échelle : 50 μm. (C) Le graphique montre l’exemple de référence pour les valeurs grises moyennes de la coloration IgG de la souris. Toutes les valeurs ont été normalisées avec la valeur de gris moyenne de l’hémisphère controlatéral non blessé. Les données sont présentées sous forme de moyenne ± d’erreur-type de la moyenne, n > 3. (D) Images confocales du cortex cérébral blessé par le couteau 1 h après la lésion cérébrale, après que la souris ait reçu une injection de solution de bleu d’Evans. Les images ont été acquises à l’aide d’un microscope confocal à une longueur d’onde de 633 nm. Bleu Evans (magenta) et DAPI (gris). Barre d’échelle : 100 μm. (E) Le graphique montre un exemple de référence pour le changement de concentration en bleu d’Evans dans des morceaux de cortex cérébral blessés par un coup de couteau. Les données sont présentées sous forme de moyenne ± d’erreur-type de la moyenne, n > 3. Les points indiquent les résultats de chaque tissu. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Quantification de l’inflammation gliale dans les cortex blessés par arme blanche. (A,B) Images montrant les cortex cérébraux blessés par arme blanche à 1, 3, 5 et 7 jours après la lésion cérébrale après coloration immunoenzymatique enzymatique (en haut, barre d’échelle : 100 μm) et coloration immunofluorescente (en bas, barre d’échelle : 40 μm) avec des anticorps contre Iba1 comme marqueur microglial (A) et GFAP comme marqueur astrocytaire (B). Aucun cortex de la plaie n’a été utilisé comme témoin négatif. (C, D) Les graphiques montrent les exemples de référence pour les analyses qPCR en temps réel des changements d’expression de l’ARNm d’Iba1 (C) et de Gfap (D) après une blessure par arme blanche dans les cortex cérébraux. Les niveaux d’ARNm d’Iba1 et de Gfap ont été normalisés avec ceux de Gapdh. Le niveau d’expression chez les souris sans blessure a été considéré comme 1, et toutes les autres valeurs ont été normalisées avec cette valeur. Les données sont présentées sous forme de moyenne ±'erreur-type de la moyenne, n > 5. L’ANOVA à un facteur a été utilisée pour l’analyse statistique. Les points indiquent les résultats de chaque tissu. (E-H) Les graphiques montrent des exemples de référence pour les analyses qPCR en temps réel des changements d’expression de l’ARNm Tnf-a (E), Tgf-b1 (F), Il-6 (G) et Il-1b (H) après des blessures par arme blanche dans les cortex cérébraux. Chaque niveau d’ARNm a été normalisé avec celui de Gapdh. Le niveau d’expression chez les souris sans blessure a été considéré comme 1, et toutes les autres valeurs ont été normalisées avec cette valeur. Les données sont présentées sous forme de moyenne ±'erreur type de la moyenne, n > 5. L’ANOVA à un facteur a été utilisée pour l’analyse statistique. Les points indiquent les résultats de chaque tissu. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Nom du gène | Séquence d’amorçage | ||
| Iba1 | En avant | 5′-GGATTTGCAGGGAGGAAAAG-3′ | |
| Inverse | 5′-TGGGATCATCGAGGAATTG-3′ | ||
| Gfap | En avant | 5′-GAAGGTCCGCTTCCTGGAA-3′ | |
| Inverse | 5′-GGCTCGAAGCTGGTTCAGTT-3′ | ||
| Tnf-a | En avant | 5′-ACAGAAAGCATGATCCGCG-3′ | |
| Inverse | 5′-GCCCCCCATCTTTTGGG-3′ | ||
| Tgf-b1 | En avant | 5′-CCCTATATTTGGAGCCTGGA-3′ | |
| Inverse | 5′-CTTGCGACCCACGTAGTAGA-3′ | ||
| Il-6 | En avant | 5′-CTGCAAGAGACTTCCATCCAGTT-3′ | |
| Inverse | 5′-GAAGTAGGGAAGGCCGTGG-3′ | ||
| Il-1b | En avant | 5′-GCACACCCACCCTGCAG-3′ | |
| Inverse | 5′-AACCGCTTTTTTCCATCTTCTTCTT-3′ | ||
| Gapdh | En avant | 5′-CGTGTTCTACCCCCAATGT-3′ | |
| Inverse | 5′-TGTCATCATACTTGGCAGGTTTCT-3′ | ||
Tableau 1 : Séquences d’amorces utilisées pour l’analyse qPCR en temps réel à l’aide du modèle murin TBI à l’arme blanche
Discussion
Ici, un protocole pour créer un modèle de souris TBI à l’aide d’aiguilles a été introduit. Ce protocole permet une évaluation quantitative de la récupération de la dégradation de la BHE et de l’inflammation après une lésion cérébrale à l’aide d’approches histologiques et de biologie moléculaire. D’autres protocoles, tels que le modèle de TCC commotionnel répétitif et le modèle de TCC de perte de poids, peuvent également être utilisés pour analyser la dégradation de la BHE et l’inflammation. Ces modèles reproduisent la pathologie des traumatismes crâniens dans des conditions contrôlées, y compris des paramètres spécifiques pour la force d’impact, la portée et la région du cerveau, à l’aide de machines spécialisées. De plus, ils peuvent causer une lésion cérébrale fermée avec un crâne intact. À l’inverse, le modèle proposé de traumatisme crânien imite à la fois les lésions cérébrales pénétrantes induites par des lésions crâniennes et cérébrales. De plus, étant donné que le protocole présenté peut induire des lésions cérébrales dans une plage étroite, il est important de définir clairement la zone d’observation pour l’analyse de la dégradation de la BHE et de l’inflammation. C’est la nouveauté de ce protocole, qui a été rendu possible grâce à l’utilisation d’une aiguille plus fine que d’habitude25,26. Une autre caractéristique unique est que le modèle de souris TBI peut être facilement créé sans l’équipement de coordonnées taxiques stéréo27.
Les symptômes du TCC sont classés comme légers, modérés ou graves en fonction du niveau de perte de conscience selon l’échelle de coma de Glasgow (GCS)28. Le modèle de traumatisme crânien par arme blanche est particulièrement efficace pour reproduire les symptômes correspondant à un traumatisme crânien léger (GCS 13-15) à modéré (GCS 9-12) et est particulièrement adapté à l’évaluation de la dégradation de la BHE et de l’inflammation. Cependant, la technique du modèle TBI peut avoir certaines limites, notamment une gravité plus faible des lésions cérébrales, car elle n’induit pas de changement de comportement après la blessure au couteau. Nous n’avons pas effectué de tests comportementaux détaillés à l’aide du modèle TBI, mais il n’y avait pas de défauts visiblement significatifs dans les capacités motrices ou le comportement social après le réveil de l’anesthésie. Par conséquent, d’autres modèles de TCC sont plus adaptés pour suivre les changements de comportement après une lésion cérébrale. Cependant, le modèle de TBI à l’arme blanche pourrait encore révéler un dysfonctionnement de l’apprentissage et de la mémoire après une analyse détaillée. Par exemple, un modèle murin de TCC commotionnel répétitif a montré des troubles comportementaux dans le labyrinthe d’eau de Morris et le test de reconnaissance sociale 2,29,30. Le modèle de souris TBI a également montré une réduction des capacités d’apprentissage et de mémoire, bien qu’il n’ait eu aucun effet sur les capacités motrices dans le labyrinthe aquatique Morris31,32. Par conséquent, les modèles de TCC qui induisent des dommages plus graves sont plus adaptés à l’analyse comportementale. De plus, le modèle de traumatisme crânien par arme blanche peut présenter une variabilité significative des conditions de dommages en raison des différences de position d’insertion, d’angle et de profondeur de l’aiguille insérée dans le cerveau, qui dépendent de la technique de manipulation. Cependant, il a déjà été démontré que le protocole du modèle TBI peut fournir des données fiables pour les analyses d’hémorragie et d’inflammation en augmentant le nombre de répétitions. D’autres améliorations du protocole d’enroulement par arme blanche afin de réduire la variabilité et d’améliorer la reproductibilité pourraient accroître la fiabilité du modèle. Cela comprend la standardisation de la technique et la minimisation du risque de saignement.
Le protocole présenté ici facilite la création d’un modèle de souris TBI, mais il y a des considérations importantes pour la procédure de blessure au couteau. Parfois, les souris peuvent saigner à mort après la procédure. Pour minimiser ce risque, il est crucial de faire l’incision cutanée pour exposer l’os occipital aussi petit que possible, en évitant d’endommager les vaisseaux sanguins voisins autour des oreilles. De plus, la taille du trou dans l’os occipital doit être juste assez grande pour accueillir une aiguille de 27 G x 3/4".
Au cours de l’immunohistochimie, une liaison non spécifique est susceptible de se produire autour de la région de la blessure au couteau, car l’anticorps est facilement capturé par les composants sanguins qui fuient. Par conséquent, il est nécessaire d’évaluer la liaison non spécifique par coloration avec uniquement les anticorps secondaires en plus de la coloration habituelle.
Le modèle TBI à l’arme blanche est utile pour clarifier les mécanismes de coagulation dans le cerveau, car il permet d’identifier facilement le site de saignement. Cela en fait un modèle approprié pour l’analyse des régulateurs de coagulation. La minimisation de l’extension de l’hémorragie, soutenue par l’activation immédiate du système de coagulation et de fibrinolyse, conduit à l’atténuation de l’inflammation après une lésion cérébrale10,33. Le protocole TBI présenté peut être utilisé pour analyser l’activation plaquettaire et la formation de fibrine dans le site de la lésion10,33. Démontrant ainsi l’importance d’un traitement rapide de la coagulation sanguine après un traumatisme crânien. De plus, il peut être utilisé pour évaluer l’atténuation des blessures secondaires en régulant l’hémorragie après un traumatisme crânien.
L’œdème cérébral n’a pas été observé à l’aide du modèle de traumatisme crânien par arme blanche. Les traumatismes crâniens induisent un œdème cérébral vasogénique, qui est causé par l’accumulation excessive de liquide induite par des dommages physiques dans l’espace extravasculaire et extracellulaire, ainsi qu’un œdème cérébral cytotoxique, qui résulte de l’accumulation de liquide intracellulaire34. Le modèle de traumatisme crânien peut être utilisé pour observer l’œdème cérébral, y compris l’œdème vasogénique et cytotoxique, car le traumatisme endommage à la fois les vaisseaux sanguins et les cellules du modèle.
Il est possible d’analyser l’apoptose neuronale après une lésion cérébrale à l’aide du modèle TBI. Une étude antérieure a indiqué que l’apoptose neuronale détectée par la caspase 3 clivée est évidente immédiatement et se limite à la zone du cerveau autour du site de la lésion, et atteint un pic 3 jours après la lésion cérébrale. De plus, l’apoptose neuronale détectée par le test TUNEL a montré un changement de point temporel similaire à celui de l’analyse de la caspase 3 clivée14.
Il est conseillé d’utiliser plusieurs modèles de TCC pour développer des approches thérapeutiques, car le TCC peut survenir dans diverses conditions et circonstances. Cette étude a démontré que le protocole présenté est suffisant pour quantifier les changements de modèle dans les données de séries chronologiques pour l’activation gliale, l’expression des cytokines inflammatoires et la perte neuronale après une blessure par arme blanche12,14. De plus, il peut clairement démontrer le changement de série chronologique dans le processus de coagulation dans le traumatisme crânien10,33. L’application de la méthode présentée facilitera l’examen des coagulants sanguins et des composés anti-inflammatoires pour le développement d’agents thérapeutiques pour les TCC. De plus, le modèle TBI présenté permet d’observer l’activation des astrocytes et de la microglie immédiatement après la lésion cérébrale, leur quiescence ultérieure se produisant dans les 7 jours dans le cortex. De plus, la réponse inflammatoire et l’activation gliale sont toutes deux atténuées pendant la quiescence gliale. De plus, la dégradation de la BHE est réparée dans un délai similaire à la récupération de l’activation gliale17. Ces phénotypes indiquent que le modèle de traumatisme crânien par arme blanche reflète la phase aiguë du traumatisme crânien plutôt que la phase chronique. Par conséquent, le modèle de traumatisme crânien présenté est une approche précieuse pour développer des méthodes thérapeutiques pour les traumatismes crâniens, visant à prévenir la transition de la phase aiguë à la phase chronique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Ayana Hamano, Minori Yamashita, Misaki Endo, Hirono Kobayashi et Nito Nakahira pour leur aide dans le cadre de l’immunohistochimie et de la qPCR en temps réel. Ce travail a été soutenu par la JSPS KAKENHI 19K16122, la Takeda Science Foundation, la Fondation Astellas pour la recherche sur les troubles métaboliques, la Fondation Mitsubishi, la Brain Science Foundation et la Uehara Memorial Foundation to K.H.
matériels
| Name | Company | Catalog Number | Comments |
| 19 G x 1•1/2" needle | TERUMO | NN-1938R | |
| 27 G x 3/4" needle | TERUMO | NN-2719S | |
| anti-GFAP antibody | Sigma-Aldrich | G9269 | |
| anti-Iba1 antibody | Wako | 019-19741 | |
| Atipamezole Hydrochloride | Nippon Zenyaku Kogyo | Product name: Antisedan | |
| Biotin-conjugated mouse IgG antibody | Vector Laboratories | BA-9200 | |
| Biotin-conjugated rabbit IgG antibody | Vector Laboratories | BA-1000 | |
| Bovine albumin | Nacalai tesque | 01860-07 | |
| Brain Slicer | Visikol | BSLM-2 | |
| Butorphanol Tartrate | Meiji Animal Health | Product name: Vetorphale 5 mg | |
| Confocal microscope | Zeiss | LSM700 | |
| Cryostat | Leica | CM1520 | |
| DAB | Sigma-Aldrich | D5637-1G | |
| DAPI | Roche | 10236276001 | |
| Evans blue | Wako | 056-04061 | |
| Fluorescent-conjugated rabbit IgG antibody | Invitrogen | A-21206 | |
| Fluoromount-G | Invitrogen | 4958-02 | Water-based mounting medium |
| Isoflurane Inhalation Solution | Viatris | v002139 | |
| KOD SYBR qPCR Mix | TOYOBO | QKD-201 | qPCR master mix kit |
| Medetomidine | Nippon Zenyaku Kogyo | Product name: Domitor | |
| Microscope | Olympus | FSX100 | |
| Microvolume spectrophotometer | ThermoFisher Scientific | NanoDrop One | |
| Midazolam 10 mg/2 mL | Sandoz | 1124401A1060 | |
| MOUNT QUICK | Daido Sangyo | DM01 | Water insoluble mounting medium |
| Newborn calf serum | Gibco | 16010159 | |
| O.C.T. compound | Sakura Finetek Japan | 45833 | Embedding medium |
| Peel-A-Way, Truncated 22 mm Square Top | Ted Pella | 27118 | Tissue embedding mold |
| Peristaltic perfusion pump | ATTO | SJ-1211 | |
| Plate reader | Fisher Scientific | Cytation 3 | |
| Real-time qPCR machine | ThermoFisher Scientific | StepOne Plus | |
| ReverTra Ace qPCR RT Kit | TOYOBO | FSQ-101 | cDNA synthesis kit |
| Superfrost Plus Slide Glass | Fisher Scientific | 12-550-15 | Positive-charged slide glass |
| Suture with needle | Alfresa | HT2003NA75-KF2 | |
| TRIzol Reagent | Invitrogen | 15596026 | |
| VECTASTAIN ABC Standard Kit | Vector Laboratories | PK-4000 | Avidin/biotin-based peroxidase system kit |
Références
- Narayan, R. K., et al. Clinical trials in head injury. J Neurotrauma. 19 (5), 503-557 (2002).
- Shitaka, Y., et al. Repetitive closed-skull traumatic brain injury in mice causes persistent multifocal axonal injury and microglial reactivity. J Neuropathol Exp Neurol. 70 (7), 551-567 (2011).
- Flierl, M. A., et al. Mouse closed head injury model induced by a weight-drop device. Nat Protoc. 4 (9), 1328-1337 (2009).
- Ikeshima-Kataoka, H., Shen, J. S., Eto, Y., Saito, S., Yuasa, S. Alteration of inflammatory cytokine production in the injured central nervous system of tenascin-deficient mice. In Vivo. 22 (4), 409-413 (2008).
- Zhou, Y., Wang, Y., Wang, J., Anne Stetler, R., Yang, Q. W. Inflammation in intracerebral hemorrhage: From mechanisms to clinical translation. Prog Neurobiol. 115, 25-44 (2014).
- Hijazi, N., et al. Endogenous plasminogen activators mediate progressive intracerebral hemorrhage after traumatic brain injury in mice. Blood. 125 (16), 2558-2567 (2015).
- Kataoka, K., et al. Roles of urokinase-type plasminogen activator in a brain stab-wound. Brain Res. 887 (1), 187-190 (2000).
- Wang, Y., et al. Early posttraumatic csf1r inhibition via plx3397 leads to time- and sex-dependent effects on inflammation and neuronal maintenance after traumatic brain injury in mice. Brain Behav Immun. 106, 49-66 (2022).
- Kaplan, L., Chow, B. W., Gu, C. Neuronal regulation of the blood-brain barrier and neurovascular coupling. Nat Rev Neurosci. 21 (8), 416-432 (2020).
- Endo, M., et al. 2-carba cyclic phosphatidic acid regulates blood coagulation and fibrinolysis system for repair after brain injury. Brain Res. 1818, 148511 (2023).
- Goldim, M. P. S., Della Giustina, A., Petronilho, F. Using Evans blue dye to determine blood-brain barrier integrity in rodents. Curr Protoc Immunol. 126 (1), e83 (2019).
- Hashimoto, K., et al. 2-carba cyclic phosphatidic acid suppresses inflammation via regulation of microglial polarization in the stab-wounded mouse cerebral cortex. Sci Rep. 8 (1), 9715 (2018).
- Ikeshima-Kataoka, H., Abe, Y., Yasui, M. Aquaporin 4-dependent expression of glial fibrillary acidic protein and tenascin-c in activated astrocytes in stab-wound mouse brain and in primary culture. J Neurosci Res. 93 (1), 121-129 (2015).
- Nakashima, M., et al. The neuroprotective function of 2-carba-cyclic phosphatidic acid: Implications for tenascin-c via astrocytes in traumatic brain injury. J Neuroimmunol. 361, 577749 (2021).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Ikeshima-Kataoka, H., Abe, Y., Abe, T., Yasui, M. Immunological function of aquaporin-4 in stab-wounded mouse brain in concert with a pro-inflammatory cytokine inducer, osteopontin. Mol Cell Neurosci. 56, 65-75 (2013).
- Ikeshima-Kataoka, H., Yasui, M. Correlation between astrocyte activity and recovery from blood-brain barrier breakdown caused by brain injury. Neuroreport. 27 (12), 894-900 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564 (2012).
- Botta, S., Chemiakine, A., Gennarino, V. A. Dual antibody strategy for high-resolution imaging of murine Purkinje cells and their dendrites across multiple layers. STAR Protoc. 3 (2), 101427 (2022).
- Amin, D. N., et al. Identification of stage biomarkers for human African trypanosomiasis. Am J Trop Med Hyg. 82 (6), 983-990 (2010).
- Jiang, J., et al. Therapeutic window for cyclooxygenase-2 related anti-inflammatory therapy after status epilepticus. Neurobiol Dis. 76, 126-136 (2015).
- Wei, J., et al. Microglia activation: One of the checkpoints in the CNS inflammation caused by angiostrongylus cantonensis infection in rodent model. Parasitol Res. 114 (9), 3247-3254 (2015).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative pcr and the 2(-delta delta c(t)) method. Methods. 25 (4), 402-408 (2001).
- Hazy, A., et al. Divergent age-dependent peripheral immune transcriptomic profile following traumatic brain injury. Sci Rep. 9 (1), 8564 (2019).
- Xia, Y., et al. Osthole confers neuroprotection against cortical stab-wound injury and attenuates secondary brain injury. J Neuroinflammation. 12, 155 (2015).
- Cieri, M. B., Villarreal, A., Gomez-Cuautle, D. D., Mailing, I., Ramos, A. J. Progression of reactive gliosis and astroglial phenotypic changes following stab-wound-induced traumatic brain injury in mice. J Neurochem. 167 (2), 183-203 (2023).
- Barreda-Manso, M. A., Yanguas-Casas, N., Nieto-Sampedro, M., Romero-Ramirez, L. Neuroprotection and blood-brain barrier restoration by salubrinal after a cortical stab injury. J Cell Physiol. 232 (6), 1501-1510 (2017).
- Rapp, P. E., et al. Patient characterization protocols for psychophysiological studies of traumatic brain injury and post-TBI psychiatric disorders. Front Neurol. 4, 91 (2013).
- Brody, D. L., Benetatos, J., Bennett, R. E., Klemenhagen, K. C., Mac Donald, C. L. The pathophysiology of repetitive concussive traumatic brain injury in experimental models; new developments and open questions. Mol Cell Neurosci. 66 (Pt B), 91-98 (2015).
- Meehan, W. P., Zhang, J., Mannix, R., Whalen, M. J. Increasing recovery time between injuries improves cognitive outcome after repetitive mild concussive brain injuries in mice. Neurosurgery. 71 (4), 885-891 (2012).
- Chen, C., et al. A novel simple traumatic brain injury mouse model. Chin Neurosurg J. 8 (1), 8 (2022).
- Machado, C. A., et al. Weight-drop model as a valuable tool to study potential neurobiological processes underlying behavioral and cognitive changes secondary to mild traumatic brain injury. J Neuroimmunol. 385, 578242 (2023).
- Hashimoto, K., Ikeda, N., Nakashima, M., Ikeshima-Kataoka, H., Miyamoto, Y. Vitronectin regulates the fibrinolytic system during the repair of cerebral cortex in stab-wounded mice. J Neurotrauma. 34 (22), 3183-3191 (2017).
- Unterberg, A. W., Stover, J., Kress, B., Kiening, K. L. Edema and brain trauma. Neuroscience. 129 (4), 1021-1029 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon