Method Article
用于研究创伤性脑损伤出血和炎症的刺伤小鼠模型
摘要
简化的创伤性脑损伤 (TBI) 模型促进了治疗方法的发展。该协议概述了使用针头创建刺伤小鼠皮层,从而能够分析出血和炎症。刺伤性 TBI 小鼠模型的优势在于无需专用设备即可执行。
摘要
创伤性脑损伤 (TBI) 是由物理损伤引起的,通常由事故或运动相关事件引起。TBI 的原因多种多样,包括脑震荡、脑挫伤、血肿和颅骨骨折。为了复制这些不同的原因,已经使用不同的方案开发了各种 TBI 小鼠模型。物理性脑损伤会导致原发性和继发性脑损伤,从而加剧神经元丢失。原发性损伤发生在损伤后立即发生,通常是由于出血,随后引发继发性损伤,包括病变周围的炎症。因此,开发适用于评估出血扩展和炎症严重程度的 TBI 模型至关重要。该方案引入了一种模拟穿透性脑损伤的方法,称为刺伤 TBI 小鼠模型,以研究与 TBI 病理相关的出血、炎症和神经元丢失的机制。该模型是通过用针刺穿颅骨和大脑来创建的,并且无需专门的实验设备即可轻松执行。此外,使用针头对小鼠大脑皮层造成的轻微伤害不会影响动物术后的行为。此功能使研究人员能够研究脑损伤的局部影响,而无需担心更广泛的行为后果。来自刺伤小鼠大脑皮层的样本数据证明了该模型在评估血液渗漏到实质、神经胶质细胞活化和炎性细胞因子产生方面的有效性。此外,该方案有助于评估凝血剂和抗炎化合物,有助于开发 TBI 治疗剂。
引言
创伤性脑损伤 (TBI) 是由物理损伤引起的,通常由事故引起,包括交通事故和跌倒事故。TBI 分为两种类型:穿透性脑损伤,当尖锐物体刺穿颅骨和大脑时发生,闭合性脑损伤,这是由于大脑内部剧烈摇晃而颅骨没有破裂而引起的1。
TBI 的原因非常多样化,包括脑震荡、脑挫伤、血肿和颅骨骨折;因此,已经使用各种方案开发了 TBI 小鼠模型来复制这些不同的原因。例如,重复性脑震荡 TBI 模型涉及大脑震动,其中小鼠使用电磁控制的橡胶撞击器2 被卡住数次。此外,在减重 TBI 模型中,标准化的减重装置对头部施加强大的外力,导致颅骨完好无损的局灶性钝器损伤3。此外,刺伤 TBI 模型是通过使用针4 刺穿颅骨和大脑来制备的(图 1A)。由于已经开发了几种 TBI 模型,因此根据需要观察的特定病理选择模型非常重要。
由物理损伤引起的脑损伤会导致原发性和继发性脑损伤,从而进一步加剧神经元丢失。原发性损伤发生在损伤后立即发生,由血脑屏障 (BBB) 破坏、出血和血肿引起。因此,尽量减少出血和血肿扩大至关重要,因为这些因素会加剧 TBI 症状的严重程度。继发性损伤是由实质内血液成分引发的,随后导致病变周围发炎5。脑损伤后的预后取决于炎症动力学;因此,快速减轻原发性和继发性损伤以获得良好的预后至关重要 6,7,8。
BBB 由周细胞、内皮细胞之间的紧密连接和星形胶质细胞的末端组成,它们共同作用以限制物质从健康大脑的血管中泄漏9。在所提出的刺伤系统中,BBB 被物理破坏。评估 BBB 完整性的常用方法包括免疫球蛋白 G (IgG) 染色和评估荧光示踪剂(如伊文思蓝和葡聚糖10,11)的泄漏。IgG 染色标记从病变部位渗漏并沉积在大脑中的血液成分。随着 BBB 的恢复,血液成分泄漏到大脑中的减少,这些沉积物逐渐降解。因此,IgG 染色用于评估脑损伤后 BBB 恢复的程度。此外,静脉内给药的示踪剂渗漏到脑实质中的水平反映了 BBB 的恢复。这种方法提供了对 BBB 动力学的更清晰评估,因为示踪剂渗漏直接表明血液成分从血流到脑实质的转变。此外,尽量减少出血会导致较轻的原发性损伤,这可以通过及时的血液凝固和及时的纤维蛋白溶解来支持。因此,量化凝血和纤维蛋白溶解调节剂的表达是分析这一过程的有效方法。关于凝血的分子机制,脑损伤后的出血通过纤维蛋白形成来阻止。随后,富含纤维蛋白的血栓被组织纤溶酶原激活剂 (tPA) 和尿激酶纤溶酶原激活剂 (uPA) 降解。在刺伤 TBI 小鼠模型中,纤维蛋白形成在受伤后 1 天达到峰值,此后减少10。因此,可以通过量化血液成分和示踪剂外渗到脑实质中以及凝血因子的表达来预测 BBB 的恢复水平。
继发性损伤过程中炎症的定量方法包括神经胶质细胞活化和炎性细胞因子表达。长期炎症主要由病灶部位周围过多的小胶质细胞和星形胶质细胞积累诱导。例如,在刺伤性 TBI 模型中,刺伤刺激病灶周围的神经胶质细胞重新激活,以去除细胞碎片和血液成分。这种神经胶质细胞再激活通常在刺伤后 3 天达到峰值12,13。除了吞噬作用外,再激活的神经胶质细胞还分泌过多的炎性细胞因子,导致病变周围的神经元丢失14。据报道,神经胶质炎症的减轻有助于脑损伤后的良好预后12,14。确定炎症水平有助于评估炎症的严重程度和预后。因此,必须开发适用于评估出血扩展和炎症严重程度的 TBI 模型。本研究介绍了一种模拟穿透性脑损伤的刺伤小鼠模型,旨在研究 TBI 病理学中出血、炎症和神经元丢失的机制。
研究方案
所有动物护理方案均已获得日本御茶水女子大学机构动物护理和使用委员会的批准,并按照日本教育、科学和文化部制定的指导方针执行。使用 6 周龄成年 C57BL/6J 雌性小鼠 (20-25 g)。所有小鼠均在清洁的环境中随意获取食物和水。所用试剂和设备的详细信息列在 材料表中。
1. 大脑皮层刺伤手术
- 试剂的制备
注意:麻醉方案与前面描述的15 相似。如果动物设施推荐特定的麻醉剂,请按照他们的指示进行作。先前已证实戊巴比妥钠对大脑皮层的刺伤手术有效 4,13,16,17。- 联合麻醉剂 MMB:将 1.875 mL 1 mg/mL 美托咪定、2.0 mL 5 mg/mL 咪达唑仑和 2.5 mL 5 mg/mL 酒石酸布托啡诺溶解在 18.625 mL 磷酸盐缓冲盐水 (PBS) 中,使总体积为 25 mL。该混合物的浓度为 75 mg/L 美托咪定、400 mg/L 咪达唑仑和 500 mg/L 酒石酸布托啡诺混合物。使用前在 4 °C 下储存长达 8 周。
- 麻醉拮抗剂:将 150 μL 5 mg/mL 盐酸阿替美唑溶于 9.85 mL PBS 中,产生 10 mL 的总体积,浓度为 75 mg/L 盐酸阿替美唑。使用前在 4 °C 下避光储存长达 8 周。
- 手术程序
- 小鼠麻醉:使用异氟醚吸入溶液浸泡的纸暂时麻醉小鼠,直到它们入睡。然后,使用带有 27 G x 3/4“ 针头的 1 mL 注射器腹膜内注射 10 μL/g 联合麻醉剂 MMB。3-5 分钟后,通过捏住脚趾并检查扶正反射来确认麻醉效果。
注意:使用异氟醚吸入溶液时,请务必密切注意不要过量麻醉。 - 将鼠标的腹侧放入纸巾中。转移后,再次确认鼠标仍处于麻醉状态,并捏住脚趾。
- 剃掉枕骨区域皮肤上的毛。使用棉签用 70% 乙醇对小鼠后脑勺的皮毛进行消毒。用钝钳抓住枕骨皮肤,做一个 1.0-1.5 毫米宽的切口,露出枕骨,而不会损坏颅骨或任何器官。轻轻缓慢地打开切口,通过颅骨观察大脑皮层和小脑之间的边界(图 1B)。
注意:确保无伤小鼠的颅骨或大脑不会受到损害。 - 小鼠开颅手术:使用 19 G x 1•1/2“ 针在枕骨的右半球开一个小孔。轻轻旋转针头,使针头成为刺伤针刺的插入点,注意不要损坏脑实质。孔应位于 lambda 和边缘之间的右半球耳间线的中点(图 1B)。这个孔用作后续步骤中插入刺绕针的导向。
- 刺绕式:从插入点插入一根 27 G x 3/4“ 针头,沿前尾轴刺入大脑皮层(图 1B、C)。插入针头直到接触颅骨前部,然后轻轻抽出。适当的深度是可以通过大脑皮层表面看到针头的深度。大脑皮层的左侧用作未受损的对照。
- 使用尼龙 3-0 缝合线和 1/2 圆针缝合皮肤切口。
- 腹膜内施用 10 μL/g 麻醉拮抗剂作为联合麻醉剂 MMB。小鼠应该能够在注射麻醉拮抗剂后 8-16 小时内行走。
- 小鼠麻醉:使用异氟醚吸入溶液浸泡的纸暂时麻醉小鼠,直到它们入睡。然后,使用带有 27 G x 3/4“ 针头的 1 mL 注射器腹膜内注射 10 μL/g 联合麻醉剂 MMB。3-5 分钟后,通过捏住脚趾并检查扶正反射来确认麻醉效果。
2. 出血评估和 BBB 分解恢复
- 刺伤脑切片的免疫酶染色用于小鼠 IgG 渗漏
注意:这里使用了载玻片安装的冷冻脑切片。自由漂浮的冷冻脑切片也适用于该方案。- 小鼠麻醉:将小鼠放在异氟醚吸入溶液浸泡的纸附近直至它睡着,以诱导麻醉。然后,立即腹膜内给予 100 μL/kg 联合麻醉剂 MMB。通过捏脚趾和扶正反射确认麻醉效果。
- 将鼠标放在它的背上,将手臂和脚固定在解剖板上。
- 小鼠开胸手术:用钝钳抓住腹部皮肤,在皮肤和腹膜上做一个 1.0-1.5 厘米的切口,露出胸腔。用剪刀小心地打开胸腔,同时避免损伤心脏,使其暴露在心脏灌注中。
- 心脏灌注固定:准备蠕动灌注泵,并在一端连接一根带有 19 G x 1•1/2“ 针头的管子。使用前打开泵,用 PBS 填充试管。然后,当泵运行时,将针尖插入左心室并用镊子固定。在右心房做一个 0.5-1.0 毫米的切口。以 4-6 mL/min 的速率灌注小鼠18 至少用 20 mL PBS 灌注 5 分钟以去除血液。
- 停止泵并将试管转移到 4% 多聚甲醛 (PFA) 的 PBS 溶液中。以 4-6 mL/min 的速率重新启动泵 5 分钟,加入至少 20 mL 4% PFA 的 PBS 溶液以固定18。
注:如果没有泵,也可以使用带有 19 G x 1•1/2“ 针头的 50 mL 注射器进行灌注。 - 脑解剖:将鼠标放在解剖板上的腹侧,从枕骨区域到鼻子的皮肤中线切开,露出颅骨。用剪刀去除头骨,小心地完全暴露大脑,注意不要损坏大脑。用弯曲的镊子提起大脑,并将其转移到装有 10 mL 4% PFA 的 PBS 溶液的 15 mL 管中。
- 将解剖的脑在 4 °C 的 PBS 中的 4% PFA 中孵育过夜以完全固定。在此之后,将大脑在 10 mL 15% 蔗糖的 PBS 溶液中孵育过夜,并将其转移到 10 mL 的 30% 蔗糖的 PBS 溶液中,在跷跷板振荡器上再孵育一天。这种逐渐的蔗糖替代品有助于防止大脑稍后存放在冰箱中时因冰而对组织造成损伤。
- 脑包埋:将脑冠状体包埋在组织包埋模具内的包埋介质中,然后使用 2-甲基丁烷和干冰19 冷冻。
- 冷冻脑切片:使用低温恒温器,将嵌入脑的连续冠状切片(20 μm 厚)安装在带正电荷的载玻片上。将脑切片在室温下完全风干过夜并储存在 -80 °C 冰箱中。
- 封闭缓冲液制备:将 10% 新生犊牛血清、30 mg/mL 牛白蛋白、10 mg/mL 甘氨酸和 0.4% Triton X-100 与 TBS 混合,以制备封闭缓冲液。使用前在 4 °C 下储存长达 2 周。
- 小鼠 IgG 染色:将刺伤的大脑皮层切片在室温下风干 1 小时后,每张载玻片用 500 μL 4% PFA 后固定 30 分钟。然后,用 PBS(500 μL/玻片)洗涤切片 5 分钟,然后用 Tris 缓冲盐水(TBS,500 μL/玻片)洗涤两次,每次 5 分钟。
注意:在保湿盒中执行所有程序,以防止缓冲液蒸发。 - 在 TBS 中用 10% 甲醇和 3% 过氧化氢溶液淬灭内源性酶活性 5 分钟,然后用 Tris 缓冲盐水(TBS,500 μL/玻片)洗涤两次,每次 5 分钟。
- 在室温下使用封闭缓冲液(500 μL/玻片)进行封闭 1 小时,以防止抗体的非特异性结合。然后,在室温下将切片与生物素偶联的小鼠 IgG 抗体(用封闭缓冲液以 1:300 稀释,300 μL/载玻片)孵育 1 小时。
- 与小鼠 IgG 抗体一起孵育时,在 300 μL 封闭缓冲液中制备 1 μL 基于亲和素/生物素的过氧化物酶系统试剂盒中的 1 μL 试剂 A 和 1 μL 试剂 B 的混合物。使用前,将此混合物在室温下孵育 30 分钟。小鼠 IgG 抗体孵育完成后,用 TBS 洗涤切片 5 分钟,共 3 次。然后,将切片与制备好的试剂 A 和 B 混合物(300 μL/玻片)在室温下孵育 1 小时。
- 用 0.1 M Tris-HCl pH 8.0 洗涤切片 5 分钟,3 次,持续 1 小时。然后,使用 0.05% 3,3'-二氨基联苯胺 (DAB) 在添加 0.05% 过氧化氢的 0.1 M Tris-HCl pH 8.0(500 μL/载玻片)中显色 5 分钟至 1 小时(图 2A)。在停止反应之前,在显微镜下观察颜色变化。
- 用 0.1 M Tris-HCl pH 8.0 洗涤切片 5 分钟,3 次,然后风干切片 15 分钟。此后,将切片浸入 95% 乙醇中 2 分钟,然后浸入 100% 乙醇 2 分钟,脱水,两次。将二甲苯中的切片清除 5 分钟两次。使用不溶于水的封固剂盖玻片并让其干燥。
- 小鼠 IgG 染色强度分析:使用具有 20 倍物镜的显微镜捕获切片图像。
- 使用 ImageJ 软件,通过测量每个切片中免疫酶染色区域的五个随机选择区域(每个区域 8 × 8 μm2 )中的平均灰度值来量化染色强度。使用来自每个对侧的平均灰度值标准化染色强度;没有受伤区域作为背景校正。计算来自五个字段的标准化平均灰度值的平均值,以确定每个切片的小鼠 IgG 染色的平均灰度值。
- 埃文思蓝渗漏到脑实质的评估
注:伊文思蓝协议与前面描述的方法11 类似。异硫氰酸荧光素 (FITC) 标记的葡聚糖也可用于从 BBB 分解中恢复10。- 伊文思蓝注射液:解剖前 1 小时,通过尾静脉向刺伤小鼠施用 2% 伊文思蓝的 PBS (3 mL/kg) 溶液。
- 新鲜脑提取:伊文思蓝给药后 1 小时,如步骤 2.1.1-2.1.4 所述,用 PBS 灌注小鼠。然后,使用脑切片机将新鲜的大脑冠状切片成 1 毫米厚的切片。根据方格纸,选择四个切片并切出脑块(每个 1 毫米2 平方),其中包括无伤口大脑皮层中的刺伤区域或完整区域(图 1D)。
- 伊文思蓝定量:将四个脑碎片收集在 1.5 mL 试管中,并使用组织研磨机用 200 μL 三氯乙酸匀浆。将匀浆在 4 °C 下以 10,000 x g 离心 20 分钟。然后,用移液管收集上清液并用 600 μL 乙醇稀释。准备伊文思蓝的标准曲线,范围为 0-1.0 ng/mL,以定量其浓度。使用读板器以 620 nm 的激发波长测量 680 nm 处的荧光强度。
3. 评估刺伤后大脑的炎症水平
- 神经胶质细胞刺伤脑切片的免疫酶染色
- 脑切片的准备:按照步骤 2.1.1-2.1.9 中的说明制作安装在脑切片上的载玻片。
- 神经胶质染色:将刺伤的大脑皮层切片风干 1 小时后,再次用 4% PFA(500 μL/载玻片)固定切片 30 分钟。然后,用 PBS(500 μL/玻片)洗涤切片 5 分钟,然后用 TBS(500 μL/玻片)洗涤两次,每次 5 分钟。
- 在 TBS 中用 10% 甲醇和 3% 过氧化氢溶液淬灭内源性酶活性 5 分钟,然后用 Tris 缓冲盐水(TBS,500 μL/玻片)洗涤两次,每次 5 分钟。
- 在室温下使用封闭缓冲液(500 μL/玻片)进行封闭 1 小时,以防止抗体的非特异性结合。
- 将切片与一抗(300 μL/玻片)孵育过夜。对一抗使用以下稀释度:Iba1 为 1:3,000 稀释,GFAP 为 1:1,000 稀释,在封闭缓冲液中稀释。
- 用 TBS 洗涤切片 3 次,每次 5 分钟。然后,在室温下与生物素偶联的二抗(用封闭缓冲液以 1:300 稀释,300 μL/玻片)孵育 1 小时。
- 与二抗孵育时,在 300 μL 封闭缓冲液中制备 1 μL 基于亲和素/生物素的过氧化物酶系统试剂盒中的 1 μL 试剂 A 和 1 μL 试剂 B 的混合物。然后在使用前将混合物在室温下孵育 30 分钟。
- 二抗孵育完成后,用 TBS 洗涤切片 3 次,每次 5 分钟,并在室温下将切片与制备的试剂 A 和 B 混合物(300 μL/载玻片)孵育 1 小时。
- 用 0.1 M Tris-HCl pH 8.0 洗涤切片 5 分钟,3 次,持续 1 小时。然后,使用 0.05% DAB 在添加 0.05% 过氧化氢的 0.1 M Tris-HCl pH 8.0(500 μL/载玻片)中显色 30 分钟至 3 小时。在停止反应之前,在显微镜下观察颜色变化。
- 用 0.1 M Tris-HCl pH 8.0 洗涤切片 5 分钟,3 次,然后风干切片 15 分钟。之后,将切片浸入 95% 乙醇中 2 分钟两次,然后浸入 100% 乙醇中 2 分钟,脱水两次。将二甲苯中的切片清除 5 分钟两次。使用不溶于水的封固剂盖玻片并让其干燥。使用显微镜以 20 倍的物镜捕获切片图像。
- 神经胶质细胞刺伤脑切片的免疫荧光染色
- 脑切片的准备:按照步骤 2.1.1-2.1.9 中的说明制作安装在脑切片上的载玻片。
- 神经胶质染色:将刺伤的大脑皮层切片风干 1 小时后,再次用 4% PFA(500 μL/载玻片)固定切片 30 分钟。然后,用 PBS(500 μL/玻片)洗涤切片 5 分钟,然后用 TBS(500 μL/玻片)洗涤两次,每次 5 分钟。在室温下使用封闭缓冲液(500 μL/玻片)进行封闭 1 小时,以防止抗体的非特异性结合。
- 将切片与一抗(300 μL/玻片)孵育过夜。对一抗使用以下稀释度:Iba1 为 1:3,000 稀释,GFAP 为 1:1,000 稀释,在封闭缓冲液中稀释。
- 用 TBS 洗涤切片 3 次,每次 5 分钟。然后,在室温下与荧光偶联的二抗(用封闭缓冲液以 1:300 稀释,300 μL/玻片)孵育 1 小时。
- 用 TBS 洗涤切片 3 次,每次 5 分钟,并在室温下用 0.4 μg/mL DAPI 的 TBS 溶液(500 μL/玻片)孵育切片 5 分钟。
- 用 TBS(500 μL/玻片)洗涤切片 5 分钟,然后用蒸馏水(500 μL/玻片)洗涤 5 分钟。风干切片 15 分钟后,用水基封固剂盖玻片并晾干。使用具有 20 倍物镜的共聚焦显微镜捕获切片图像。
- 神经胶质细胞标志物和炎性细胞因子的实时 qPCR
注意:表1列出了所提出的方案中使用的引物序列16,20,21,22。- 新鲜脑组织制备:如步骤 2.1.1-2.1.4 中所述,用 PBS 灌注小鼠。然后,使用脑切片机将新鲜的脑子冠状切片成 1 毫米厚的切片。根据方格纸,选择四个切片并切出脑片(每个 1 毫米2 平方),其中包括大脑皮层对侧的刺伤区域或完整区域。确定要切除的区域,其中包括中心的病变(图 1D)。
- RNA 提取:将四个脑碎片收集在 1.5 mL 试管中,并通过移液用 1 mL TRIzol 试剂匀浆。在室温下将混合物孵育 5 分钟。然后,加入 200 μL 氯仿,充分涡旋,并在室温下再孵育 2 分钟。将混合物在 4 °C 下以 12,000 x g 离心 15 分钟。 小心地将上层透明层转移到新的 1.5 mL 试管中,避免任何含有 DNA 和蛋白质的白色沉淀物。
- 向收集的上层添加 500 μL 异丙醇,充分混合,并在室温下孵育 10 分钟。在 4 °C 下以 12,000 x g 离心 10 分钟后,去除上清液并加入 1 mL 70% 乙醇以洗涤 RNA 沉淀。在 4 °C 下以 7,500 x g 离心 5 分钟,完全去除上清液,然后风干沉淀 10 分钟。将 RNA 沉淀溶解在 15 μL 不含 RNase 的水中,并在 55°C 下使 RNA 变性 10 分钟。
- 使用超微量分光光度计测量 RNA 浓度。立即将 RNA 储存在 -80 °C。
- cDNA 合成:对于 cDNA 合成,请使用市售的 DNA 合成试剂盒。为每个样品在 1.5 μL 试管中制备总共 10 μL 的反应缓冲液,其中包括 2 μL 5 x RT 缓冲液、0.5 μL RT 酶混合物、0.5 μL 引物混合物、1 μg RNA 和无核酸酶水。逆转录反应在 37 °C 下孵育 15 分钟,酶灭活反应在 98°C 下孵育 5 分钟。然后,向缓冲液中加入 90 μL 不含核酸酶的水并充分混合。将 cDNA 溶液储存在 -20°C 下。
- RNA 表达定量:对于实时 qPCR 分析,请使用市售的 qPCR 预混液试剂盒。通过将 5 μL KOD SYBR qPCR 混合物、0.4 μL 5 μM 正向引物、0.4 μL 5 μM 反向引物和 0.2 μL 50 x ROX 混合在 2 μL 无核酸酶水中,为每个样品制备 Mix 溶液。
- 在 8 联管中制备 2 μL cDNA 溶液和 8 μL Mix 溶液的混合物,充分混合,然后离心。
- 使用以下循环条件启动 PCR 反应:98 °C 2 分钟,然后是 98°C 10 秒、60°C 10 秒和 68°C 30 秒的 40 个循环。使用实时 qPCR 机器执行熔解/解离曲线分析步骤。
- mRNA 表达分析:使用 2-Delta-Delta-Ct 方法分析 mRNA 表达水平,该方法通过使用看家基因 Gapdh 进行归一化,然后用对侧23 的归一化进行。
结果
为了分析 BBB 分解的恢复情况,通过测量脑损伤后 1 、 3 、 5 和 7 天的血清 IgG 外渗水平来评估刺伤大脑皮层的出血水平。小鼠 IgG 染色图像显示脑损伤后大脑皮层中血液渗漏和沉积。随着 BBB 的恢复和 IgG 蛋白的降解,这在 7 天后减少(图 2B)。通过测量刺伤区域周围 IgG 染色的强度来量化 IgG 外渗水平,这表明 IgG 外渗在脑损伤后 1 天达到峰值(图 2C)。除了确认从 BBB 分解中恢复外,还在刺伤后量化了埃文斯蓝渗入脑实质的情况。在完整的大脑中,BBB 可防止埃文思蓝从血管渗漏到大脑中。然而,在脑损伤后,BBB 崩溃导致伤口部位周围立即出现埃文斯蓝渗漏(图 2D)。基于荧光强度的伊文思蓝浓度的定量显示刺伤后 1 小时内呈指数增加,随后在受伤后 1 天和 3 天下降(图 2E)。与这些数据一致,据报道,BBB 完整性和紧密连接相关因子(如碱性磷酸酶和密蛋白-5)的 mRNA 表达在损伤后 1 天和 3 天降低17。
刺伤后 1 、 3 、 5 和 7 天大脑皮层中小胶质细胞标志物 Iba1 和星形胶质细胞标志物 GFAP 的免疫酶和免疫荧光染色显示 Iba1 + 小胶质细胞和 GFAP+ 星形胶质细胞在病变部位周围积累。Iba1 + 小胶质细胞的积累高峰发生在受伤后约 5 天,而 GFAP+ 星形胶质细胞在受伤后约 3 天达到高峰(图 3A、B)。与染色结果一致,受伤后 Iba1 和 Gfap 的 mRNA 表达水平也增加,第 7 天后观察到改善(图 3C,D)。此外,刺伤增加了炎性细胞因子的 mRNA 表达水平,包括肿瘤坏死因子-α (Tnf-a)、转化生长因子-β1 (Tgf-b1)、白细胞介素-6 (Il-6) 和白细胞介素-1β (Il-1b) 在大脑皮层的刺伤区域(图 3E-H)。刺伤后 1 天 Tnf-a 、 Il-6 和 Il-1b 以及 Tgf-b1 细胞因子表达的增加与星形胶质细胞和小胶质细胞 mRNA 水平的升高同时发生。由于神经胶质细胞活化和炎性细胞因子表达的时间重叠,活化的星形胶质细胞和小胶质细胞很可能是这些炎性细胞因子的来源。此外,由于刺伤而泄漏到大脑中的免疫细胞也可能有助于与神经胶质细胞一起产生炎性细胞因子24。
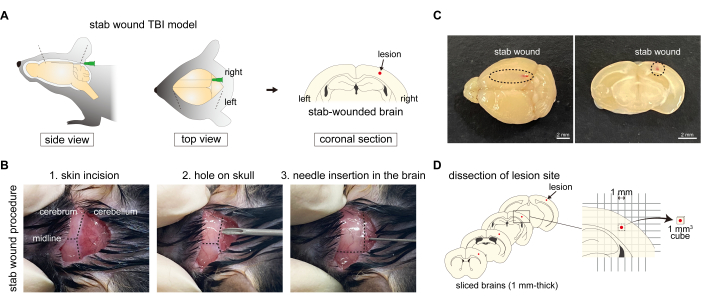
图 1:刺伤 TBI 小鼠模型的生成过程。 (A) 刺伤 TBI 小鼠模型的示意图,显示了用针刺穿大脑皮层右半球,导致颅骨损伤的过程。(B) 刺伤 TBI 方案概述:(1) 在后脑勺做一个皮肤切口;(2) 用针在枕骨的右半球打一个孔;(3) 通过枕骨上的孔将针插入右半球的大脑皮层。(C) 从尾部到喙轴的大脑皮层刺伤的宏观图像。比例尺:2 毫米。(D) 使用刺伤 TBI 小鼠模型进行病变部位解剖的示意图。 请单击此处查看此图的较大版本。
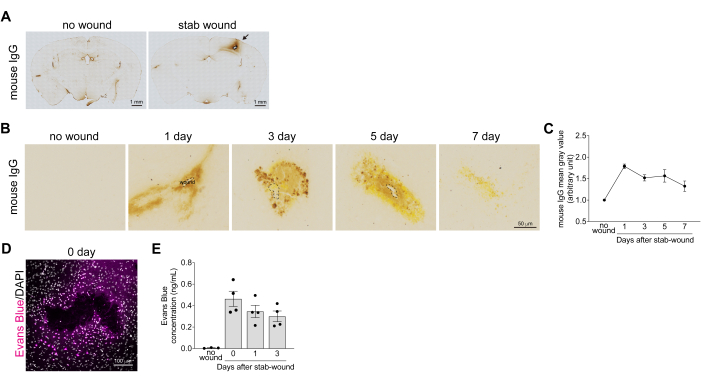
图 2:刺伤皮质中血脑屏障破裂恢复的量化。 (A) 用抗小鼠 IgG 抗体对损伤后立即整个刺伤脑切片的明场图像进行免疫酶染色。无伤口皮层用作阴性对照小鼠。血液中丰富的泄漏和沉积的小鼠 IgG 呈棕色。比例尺:1 毫米。(B) 脑损伤后 1、3、5 和 7 天刺伤大脑皮层的明场图像,用抗小鼠 IgG 抗体免疫酶染色。无伤口皮层用作阴性对照小鼠。比例尺:50 μm。(C) 该图显示了小鼠 IgG 染色平均灰度值的参考示例。所有值均使用未受伤对侧半球的平均灰度值进行归一化。数据以平均值±平均值 n > 3 的标准误差表示。(D) 脑损伤后 1 小时,小鼠注射埃文思蓝溶液后刺伤大脑皮层的共聚焦图像。使用波长为 633 nm 的共聚焦显微镜采集图像。Evans 蓝色(洋红色)和 DAPI(灰色)。比例尺:100 μm。(E) 该图显示了刺伤大脑皮层碎片中埃文思蓝浓度变化的参考示例。数据以平均值±平均值 n > 3 的标准误差表示。圆点表示每个组织的结果。 请单击此处查看此图的较大版本。

图 3:刺伤皮质细胞中神经胶质炎症的量化。(A,B) 图像显示酶学免疫酶染色(上,比例尺:100 μm)和免疫荧光染色(下,比例尺:40 μm)后脑损伤的脑皮层,以 Iba1 抗体作为小胶质细胞标志物 (A) 和 GFAP 作为星形胶质细胞标志物 (B)。无伤口皮层用作阴性对照。(C,D)这些图表显示了大脑皮层刺伤后 Iba1 (C) 和 Gfap (D) mRNA 表达变化的实时 qPCR 分析的参考示例。Iba1 和 Gfap mRNA 水平与 Gapdh 的水平正常化。无伤口小鼠的表达水平被视为 1,所有其他值均使用该值进行标准化。数据表示为平均值±平均值 n > 5 的标准误差。单因素方差分析用于统计分析。圆点表示每个组织的结果。(E-H)该图显示了大脑皮层刺伤后 Tnf-a (E)、Tgf-b1 (F)、Il-6 (G) 和 Il-1b (H) mRNA 表达变化的实时 qPCR 分析参考示例。每个 mRNA 水平都与 Gapdh 的水平标准化。无伤口小鼠的表达水平被视为 1,所有其他值均使用该值进行标准化。数据以平均值±平均值 n > 5 的标准误差表示。单因素方差分析用于统计分析。圆点表示每个组织的结果。请单击此处查看此图的较大版本。
| 基因名称 | 引物序列 | ||
| IBA1 | 向前 | 5'-GGATTTGCAGGGAGGAAAAG-3' | |
| 反向 | 5'-TGGGATCATCGAGGAATTG-3' | ||
| Gfap | 向前 | 5′-GAAGGTCCGCTTCCTGGAA-3′ | |
| 反向 | 5′-GGCTCGAAGCTGGTTCAGTT-3′ | ||
| TNF-a | 向前 | 5'-ACAGAAAGCATGATCCGCG-3' | |
| 反向 | 5′-GCCCCCCATCTTTTGGG-3′ | ||
| TGF-b1 | 向前 | 5′-CCCTATTTGGAGCCTGGA-3′ | |
| 反向 | 5'-CTTGCGACCCACGTAGTAGA-3' | ||
| IL-6 | 向前 | 5'-CTGCAAGAGACTTCCATCCAGTT-3' | |
| 反向 | 5'-GAAGTAGGGAAGGCCGTGG-3' | ||
| IL-1b | 向前 | 5'-GCACACCCACCCTGCAG-3' | |
| 反向 | 5′-AACCGCTTTTCCATCTTCTTCTT-3′ | ||
| 加普 | 向前 | 5′-CGTGTTCTACCCCCAATGT-3′ | |
| 反向 | 5'-TGTCATCATACTTGGCAGGTTTCT-3' | ||
表 1:使用刺伤式 TBI 小鼠模型进行实时 qPCR 分析的引物序列
讨论
在这里,介绍了使用针头创建 TBI 小鼠模型的方案。该方案允许使用组织学和分子生物学方法对脑损伤后 BBB 分解和炎症的恢复情况进行定量评估。替代方案,例如重复性脑震荡 TBI 模型和体重下降 TBI 模型,也可用于分析 BBB 分解和炎症。这些模型使用专用机器在受控条件下复制 TBI 病理学,包括冲击强度、范围和大脑区域的特定参数。此外,它们可能导致颅骨完整的闭合性脑损伤。相反,提出的刺伤 TBI 模型模拟颅骨和脑损伤诱导的穿透性脑损伤。此外,由于所提出的方案可以在狭窄的范围内诱导脑损伤,因此明确定义分析 BBB 分解和炎症的观察区域非常重要。这就是该协议的新颖之处,它是通过使用比通常更细的针头25,26 实现的。另一个独特的特点是,无需立体滑行坐标27 的设备,即可轻松创建 TBI 小鼠模型。
根据格拉斯哥昏迷量表 (GCS) 28,根据意识障碍的水平,TBI 症状分为轻度、中度或重度。刺伤 TBI 模型在复制对应于轻度 (GCS 13-15) 至中度 (GCS 9-12) TBI 的症状方面特别有效,特别适合评估 BBB 分解和炎症。然而,刺伤 TBI 模型技术可能有一些局限性,包括脑损伤的严重程度较低,因为它不会在刺伤后引起行为改变。我们没有使用刺伤 TBI 模型进行详细的行为测试,但从麻醉中醒来后,运动能力或社交行为没有明显的显着缺陷。因此,其他 TBI 模型更适合跟踪脑损伤后的行为变化。然而,经过详细分析后,刺伤性 TBI 模型可能仍会揭示学习和记忆功能障碍。例如,重复性脑震荡 TBI 小鼠模型在 Morris 水迷宫和社会识别测试中表现出行为障碍 2,29,30。体重下降 TBI 小鼠模型也显示学习和记忆能力降低,尽管对莫里斯水迷宫中的运动技能没有影响31,32。因此,诱导更严重损伤的 TBI 模型更适合于行为分析。此外,由于插入大脑的针头的插入位置、角度和深度不同,刺伤 TBI 模型可能在损伤条件下表现出显着变化,这取决于处理技术。然而,已经证明刺伤 TBI 模型方案可以通过增加重复次数为出血和炎症分析提供可靠的数据。进一步改进刺伤协议以减少可变性并提高可重复性可以提高模型的可靠性。这包括标准化技术和最大限度地降低出血风险。
这里介绍的协议有助于创建 TBI 小鼠模型,但刺伤手术有一些重要的考虑因素。有时,小鼠可能会在手术后流血致死。为了最大限度地降低这种风险,至关重要的是要使皮肤切口尽可能小地暴露枕骨,避免损伤耳朵周围的附近血管。此外,枕骨上孔的大小应刚好足以容纳 27 G x 3/4“ 的针头。
在免疫组织化学过程中,由于抗体很容易被泄漏的血液成分捕获,因此非特异性结合可能发生在刺伤区域周围。因此,除了通常的染色外,还需要通过仅使用二抗染色来评估非特异性结合。
刺伤 TBI 模型可用于阐明大脑中的凝血机制,因为它可以轻松识别出血部位。这使其成为分析凝血调节因子的合适模型。通过立即激活凝血和纤维蛋白溶解系统,最大限度地减少出血扩展,导致脑损伤后炎症减弱10,33。提出的刺伤 TBI 方案可用于分析病变部位的血小板活化和纤维蛋白形成10,33。从而证明了 TBI 后快速凝血治疗的重要性。此外,它可用于通过调节 TBI 后出血来评估继发性损伤的减轻。
使用刺伤 TBI 模型未观察到脑水肿。TBI 诱发血管源性脑水肿,这是由物理损伤诱导的血管外和细胞外间隙过多的液体积累引起的,以及细胞内液体积累引起的细胞毒性脑水肿34。刺伤 TBI 模型可用于观察脑水肿,包括血管源性和细胞毒性水肿,因为刺伤会损害模型中的血管和细胞。
可以使用刺伤 TBI 模型分析脑损伤后的神经元凋亡。先前的一项研究表明,裂解的 caspase 3 检测到的神经元凋亡立即很明显,并且仅限于损伤部位周围的大脑区域,并在脑损伤后 3 天达到峰值。此外,通过 TUNEL 测定检测到的神经元凋亡显示出与裂解的 caspase 3 分析相似的时间点变化14。
建议使用多个 TBI 模型来开发治疗方法,因为 TBI 可能发生在各种条件和情况下。这项研究表明,所提出的方案足以量化刺伤后神经胶质细胞活化、炎性细胞因子表达和神经元丢失的时间序列数据的模式变化12,14。此外,它可以清楚地证明刺伤性 TBI10,33 中凝血过程的时间序列变化。所提出的方法的应用将有助于检查凝血剂和抗炎化合物,以开发 TBI 的治疗剂。此外,所提出的刺伤 TBI 模型允许在脑损伤后立即观察星形胶质细胞和小胶质细胞的激活,随后它们在皮层中发生 7 天内的静止。此外,在神经胶质静止期间,炎症反应和神经胶质细胞活化都会减弱。此外,BBB 崩溃在类似于神经胶质细胞活化恢复17 的恢复期内得到修复。这些表型表明,刺伤 TBI 模型反映了 TBI 的急性期而不是慢性期。因此,所提出的刺伤 TBI 模型是开发 TBI 治疗方法的有价值的方法,旨在防止从急性期过渡到慢性期。
披露声明
作者没有什么可披露的。
致谢
我们感谢 Ayana Hamano、Minori Yamashita、Misaki Endo、Hirono Kobayashi 和 Nito Nakahira 在免疫组织化学和实时 qPCR 方面的帮助。这项工作得到了 JSPS KAKENHI 19K16122、武田科学基金会、安斯泰来代谢紊乱研究基金会、三菱基金会、脑科学基金会和 K.H. 上原纪念基金会的支持。
材料
| Name | Company | Catalog Number | Comments |
| 19 G x 1•1/2" needle | TERUMO | NN-1938R | |
| 27 G x 3/4" needle | TERUMO | NN-2719S | |
| anti-GFAP antibody | Sigma-Aldrich | G9269 | |
| anti-Iba1 antibody | Wako | 019-19741 | |
| Atipamezole Hydrochloride | Nippon Zenyaku Kogyo | Product name: Antisedan | |
| Biotin-conjugated mouse IgG antibody | Vector Laboratories | BA-9200 | |
| Biotin-conjugated rabbit IgG antibody | Vector Laboratories | BA-1000 | |
| Bovine albumin | Nacalai tesque | 01860-07 | |
| Brain Slicer | Visikol | BSLM-2 | |
| Butorphanol Tartrate | Meiji Animal Health | Product name: Vetorphale 5 mg | |
| Confocal microscope | Zeiss | LSM700 | |
| Cryostat | Leica | CM1520 | |
| DAB | Sigma-Aldrich | D5637-1G | |
| DAPI | Roche | 10236276001 | |
| Evans blue | Wako | 056-04061 | |
| Fluorescent-conjugated rabbit IgG antibody | Invitrogen | A-21206 | |
| Fluoromount-G | Invitrogen | 4958-02 | Water-based mounting medium |
| Isoflurane Inhalation Solution | Viatris | v002139 | |
| KOD SYBR qPCR Mix | TOYOBO | QKD-201 | qPCR master mix kit |
| Medetomidine | Nippon Zenyaku Kogyo | Product name: Domitor | |
| Microscope | Olympus | FSX100 | |
| Microvolume spectrophotometer | ThermoFisher Scientific | NanoDrop One | |
| Midazolam 10 mg/2 mL | Sandoz | 1124401A1060 | |
| MOUNT QUICK | Daido Sangyo | DM01 | Water insoluble mounting medium |
| Newborn calf serum | Gibco | 16010159 | |
| O.C.T. compound | Sakura Finetek Japan | 45833 | Embedding medium |
| Peel-A-Way, Truncated 22 mm Square Top | Ted Pella | 27118 | Tissue embedding mold |
| Peristaltic perfusion pump | ATTO | SJ-1211 | |
| Plate reader | Fisher Scientific | Cytation 3 | |
| Real-time qPCR machine | ThermoFisher Scientific | StepOne Plus | |
| ReverTra Ace qPCR RT Kit | TOYOBO | FSQ-101 | cDNA synthesis kit |
| Superfrost Plus Slide Glass | Fisher Scientific | 12-550-15 | Positive-charged slide glass |
| Suture with needle | Alfresa | HT2003NA75-KF2 | |
| TRIzol Reagent | Invitrogen | 15596026 | |
| VECTASTAIN ABC Standard Kit | Vector Laboratories | PK-4000 | Avidin/biotin-based peroxidase system kit |
参考文献
- Narayan, R. K., et al. Clinical trials in head injury. J Neurotrauma. 19 (5), 503-557 (2002).
- Shitaka, Y., et al. Repetitive closed-skull traumatic brain injury in mice causes persistent multifocal axonal injury and microglial reactivity. J Neuropathol Exp Neurol. 70 (7), 551-567 (2011).
- Flierl, M. A., et al. Mouse closed head injury model induced by a weight-drop device. Nat Protoc. 4 (9), 1328-1337 (2009).
- Ikeshima-Kataoka, H., Shen, J. S., Eto, Y., Saito, S., Yuasa, S. Alteration of inflammatory cytokine production in the injured central nervous system of tenascin-deficient mice. In Vivo. 22 (4), 409-413 (2008).
- Zhou, Y., Wang, Y., Wang, J., Anne Stetler, R., Yang, Q. W. Inflammation in intracerebral hemorrhage: From mechanisms to clinical translation. Prog Neurobiol. 115, 25-44 (2014).
- Hijazi, N., et al. Endogenous plasminogen activators mediate progressive intracerebral hemorrhage after traumatic brain injury in mice. Blood. 125 (16), 2558-2567 (2015).
- Kataoka, K., et al. Roles of urokinase-type plasminogen activator in a brain stab-wound. Brain Res. 887 (1), 187-190 (2000).
- Wang, Y., et al. Early posttraumatic csf1r inhibition via plx3397 leads to time- and sex-dependent effects on inflammation and neuronal maintenance after traumatic brain injury in mice. Brain Behav Immun. 106, 49-66 (2022).
- Kaplan, L., Chow, B. W., Gu, C. Neuronal regulation of the blood-brain barrier and neurovascular coupling. Nat Rev Neurosci. 21 (8), 416-432 (2020).
- Endo, M., et al. 2-carba cyclic phosphatidic acid regulates blood coagulation and fibrinolysis system for repair after brain injury. Brain Res. 1818, 148511 (2023).
- Goldim, M. P. S., Della Giustina, A., Petronilho, F. Using Evans blue dye to determine blood-brain barrier integrity in rodents. Curr Protoc Immunol. 126 (1), e83 (2019).
- Hashimoto, K., et al. 2-carba cyclic phosphatidic acid suppresses inflammation via regulation of microglial polarization in the stab-wounded mouse cerebral cortex. Sci Rep. 8 (1), 9715 (2018).
- Ikeshima-Kataoka, H., Abe, Y., Yasui, M. Aquaporin 4-dependent expression of glial fibrillary acidic protein and tenascin-c in activated astrocytes in stab-wound mouse brain and in primary culture. J Neurosci Res. 93 (1), 121-129 (2015).
- Nakashima, M., et al. The neuroprotective function of 2-carba-cyclic phosphatidic acid: Implications for tenascin-c via astrocytes in traumatic brain injury. J Neuroimmunol. 361, 577749 (2021).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Exp Anim. 60 (5), 481-487 (2011).
- Ikeshima-Kataoka, H., Abe, Y., Abe, T., Yasui, M. Immunological function of aquaporin-4 in stab-wounded mouse brain in concert with a pro-inflammatory cytokine inducer, osteopontin. Mol Cell Neurosci. 56, 65-75 (2013).
- Ikeshima-Kataoka, H., Yasui, M. Correlation between astrocyte activity and recovery from blood-brain barrier breakdown caused by brain injury. Neuroreport. 27 (12), 894-900 (2016).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), e3564 (2012).
- Botta, S., Chemiakine, A., Gennarino, V. A. Dual antibody strategy for high-resolution imaging of murine Purkinje cells and their dendrites across multiple layers. STAR Protoc. 3 (2), 101427 (2022).
- Amin, D. N., et al. Identification of stage biomarkers for human African trypanosomiasis. Am J Trop Med Hyg. 82 (6), 983-990 (2010).
- Jiang, J., et al. Therapeutic window for cyclooxygenase-2 related anti-inflammatory therapy after status epilepticus. Neurobiol Dis. 76, 126-136 (2015).
- Wei, J., et al. Microglia activation: One of the checkpoints in the CNS inflammation caused by angiostrongylus cantonensis infection in rodent model. Parasitol Res. 114 (9), 3247-3254 (2015).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative pcr and the 2(-delta delta c(t)) method. Methods. 25 (4), 402-408 (2001).
- Hazy, A., et al. Divergent age-dependent peripheral immune transcriptomic profile following traumatic brain injury. Sci Rep. 9 (1), 8564 (2019).
- Xia, Y., et al. Osthole confers neuroprotection against cortical stab-wound injury and attenuates secondary brain injury. J Neuroinflammation. 12, 155 (2015).
- Cieri, M. B., Villarreal, A., Gomez-Cuautle, D. D., Mailing, I., Ramos, A. J. Progression of reactive gliosis and astroglial phenotypic changes following stab-wound-induced traumatic brain injury in mice. J Neurochem. 167 (2), 183-203 (2023).
- Barreda-Manso, M. A., Yanguas-Casas, N., Nieto-Sampedro, M., Romero-Ramirez, L. Neuroprotection and blood-brain barrier restoration by salubrinal after a cortical stab injury. J Cell Physiol. 232 (6), 1501-1510 (2017).
- Rapp, P. E., et al. Patient characterization protocols for psychophysiological studies of traumatic brain injury and post-TBI psychiatric disorders. Front Neurol. 4, 91 (2013).
- Brody, D. L., Benetatos, J., Bennett, R. E., Klemenhagen, K. C., Mac Donald, C. L. The pathophysiology of repetitive concussive traumatic brain injury in experimental models; new developments and open questions. Mol Cell Neurosci. 66 (Pt B), 91-98 (2015).
- Meehan, W. P., Zhang, J., Mannix, R., Whalen, M. J. Increasing recovery time between injuries improves cognitive outcome after repetitive mild concussive brain injuries in mice. Neurosurgery. 71 (4), 885-891 (2012).
- Chen, C., et al. A novel simple traumatic brain injury mouse model. Chin Neurosurg J. 8 (1), 8 (2022).
- Machado, C. A., et al. Weight-drop model as a valuable tool to study potential neurobiological processes underlying behavioral and cognitive changes secondary to mild traumatic brain injury. J Neuroimmunol. 385, 578242 (2023).
- Hashimoto, K., Ikeda, N., Nakashima, M., Ikeshima-Kataoka, H., Miyamoto, Y. Vitronectin regulates the fibrinolytic system during the repair of cerebral cortex in stab-wounded mice. J Neurotrauma. 34 (22), 3183-3191 (2017).
- Unterberg, A. W., Stover, J., Kress, B., Kiening, K. L. Edema and brain trauma. Neuroscience. 129 (4), 1021-1029 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。