Method Article
Um modelo suíno de embolia pulmonar autóloga aguda
Neste Artigo
Resumo
Este estudo apresenta um modelo suíno de embolia pulmonar (EP) usando grandes êmbolos autólogos que replicam EP aguda de risco intermediário. O modelo é adequado para a avaliação da fisiopatologia e das respostas ao tratamento.
Resumo
A embolia pulmonar aguda (EP) é uma condição potencialmente fatal que causa obstrução abrupta das artérias pulmonares, levando à insuficiência cardíaca direita aguda. Novos métodos diagnósticos e terapias dirigidas por cateter estão sendo desenvolvidos rapidamente, e há uma necessidade óbvia de um modelo animal de EP realista que possa ser usado para avaliação fisiopatológica e testes pré-clínicos.
Este protocolo apresenta um modelo suíno que emprega grandes embolias pulmonares autólogas. As instrumentações são realizadas com técnicas minimamente invasivas, criando um modelo de tórax fechado que permite a investigação de várias opções de tratamento com alta reprodutibilidade. Três horas após a coleta de sangue para criar êmbolos autólogos ex vivo, a indução de EP causou um aumento imediato na pressão arterial pulmonar média (17 ± 3 mmHg para 33 ± 6 mmHg, p < 0,0001) e frequência cardíaca (50 ± 9 batimentos · min-1 para 63 ± 6 batimentos · min-1, p < 0,0003) acompanhada por uma diminuição do débito cardíaco (5,0 ± 0,8 L/min para 4,5 ± 0,9 L/min, p < 0,037) em comparação com a linha de base. A angiotomografia pulmonar revelou múltiplos êmbolos e a porcentagem de obstrução pulmonar aumentou em relação à linha de base (0% [0-0] para 57,1% [38,8-63,3], p < 0,0001). Na fase aguda, o fenótipo é comparável ao EP de risco intermediário.
O modelo representa um fenótipo realista e bem caracterizado de EP de risco intermediário e cria uma oportunidade para testar novos métodos diagnósticos, tratamentos intervencionistas e farmacêuticos e treinamento prático para profissionais de saúde em procedimentos intervencionistas.
Introdução
A embolia pulmonar aguda (EP) é a terceira causa mais comum de morte cardiovascular e é uma manifestação de tromboembolismo venoso (TEV)1. A incidência de tromboembolismo venoso varia entre 75 a 269 por 100.000 habitantes por ano e aumenta com a idadede 2 anos. Os sobreviventes iniciais enfrentam um risco de morte em 30 dias, variando de 0,5% para pacientes de baixo risco e até 22% para pacientes de alto risco3. A causa da morte é a insuficiência ventricular direita (VD), que ocorre predominantemente em poucas horas 4,5. Mesmo que os pacientes sobrevivam, ainda há risco de morbidade significativa e doença crônica.
As opções de tratamento na fase aguda da doença incluem embolectomia cirúrgica, trombólise sistêmica ou baseada em cateter, heparina de baixo peso molecular e anticoagulantes orais1. O número e a variedade de opções de tratamento estão se expandindo e novas técnicas e métodos para diagnóstico e avaliação da gravidade estão sendo continuamente desenvolvidos. Antes que os estudos clínicos possam ser realizados, a viabilidade e a segurança devem ser determinadas em uma configuração reprodutível e consistente, como pode ser alcançado em um modelo animal. Além disso, investigar a fisiopatologia aguda da EP requer um modelo animal com fisiologia cardiovascular e pulmonar quase humana. Modelos em roedores e animais maiores, ou seja, porcos, foram desenvolvidos6. A vantagem de um modelo animal de grande porte é a possibilidade de utilizar técnicas clínicas e avaliar equipamentos e intervenções cirúrgicas utilizadas na prática clínica. No entanto, a maioria desses modelos utiliza materiais artificiais, como esferas plásticas ou balões oclusivos, ou requer grandes procedimentos invasivos de bandagem arterial pulmonar para mimetizar insuficiência cardíaca direita aguda 7,8,9. Um estudo utilizou um filtro de veia cava inferior para criar trombose in situ10. No entanto, isso é demorado e a carga do coágulo é difícil de controlar. Outros estudos criaram êmbolos autólogos ex vivo, mas o EP tem sido menor em tamanho11,12. Portanto, esses modelos podem não ser adequados para testar procedimentos intervencionistas.
Há necessidade de um modelo animal que possa replicar a patologia humana da EP. Com base em estudos anteriores realizados por nosso grupo 13,14,15,16, pretendemos apresentar um modelo suíno de PE aguda.
Protocolo
Este estudo foi conduzido com a aprovação da Inspetoria de Animais Dinamarquesa (licença nº 2021-15-0201-00944) e em conformidade com as diretrizes dinamarquesas e universitárias sobre bem-estar e ética em animais de laboratório.
NOTA: Este estudo seguiu as diretrizes ARRIVE 2.017. Os princípios dos 3Rs (Substituição, Redução e Refinamento) foram respeitados avaliando cada animal repetidamente para servir como seu próprio controle, reduzindo assim o número de animais necessários e maximizando as informações coletadas. Os porcos usados neste modelo animal eram porcas de abate dinamarquesas fêmeas de 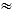 60 kg (um cruzamento de Yorkshire, Duroc e Danish Landrace). Todos os suínos seguiram o programa dinamarquês Specific Pathogen Free (SPF). Os porcos foram aclimatados na fazenda de pesquisa uma semana antes do estudo para treinar o contato humano. Os porcos foram alojados em currais com piso de concreto maciço e cama de palha. Cada curral media 2,35 m x 2,9 m com currais adjacentes para permitir o contato com o focinho. Os porcos tiveram livre acesso à água e foram alimentados duas vezes ao dia com uma dieta convencional de porcos, adicionando beterraba picada para diminuir o ganho de peso. O estábulo tinha um ciclo claro-escuro de 12:12 h (luzes acesas das 6h às 18h).
60 kg (um cruzamento de Yorkshire, Duroc e Danish Landrace). Todos os suínos seguiram o programa dinamarquês Specific Pathogen Free (SPF). Os porcos foram aclimatados na fazenda de pesquisa uma semana antes do estudo para treinar o contato humano. Os porcos foram alojados em currais com piso de concreto maciço e cama de palha. Cada curral media 2,35 m x 2,9 m com currais adjacentes para permitir o contato com o focinho. Os porcos tiveram livre acesso à água e foram alimentados duas vezes ao dia com uma dieta convencional de porcos, adicionando beterraba picada para diminuir o ganho de peso. O estábulo tinha um ciclo claro-escuro de 12:12 h (luzes acesas das 6h às 18h).
1. Anestesia, intubação e ventilação
- Pré-anestesiar o porco com uma injeção intramuscular (0,1 mL/kg) consistindo de 2,5 mL de tiletamina (25 mg/mL), 2,5 mL de zolazepam (25 mg/mL), 2,5 mL de burofanol (10 mg/mL), 1,25 mL de cetaminol (100 mg/mL) e 6,25 mL de xilazina (20 mg/mL) para reduzir a dor, o estresse e a ansiedade potenciais do animal antes do transporte do alojamento dos animais.
- Transporte o animal em uma caixa de transporte aprovada com cama de palha de trigo.
- Estabeleça o acesso intravenoso na chegada.
- Coloque um torniquete na parte proximal da orelha e aperte-o levemente para obter estase sanguínea venosa. Desinfete a pele sobre uma veia duas vezes com um cotonete de etanol.
- Use um cateter venoso de 20 G para perfurar a veia. Solte o torniquete. Fixe cuidadosamente o acesso adequadamente para evitar deslocamento.
- Verifique o posicionamento correto lavando o acesso com água salina isotônica.
NOTA: Uma protuberância subcutânea aparecerá se o cateter não estiver mais na veia. O estabelecimento de um segundo acesso intravenoso na orelha oposta pode ser considerado uma contingência.
- Mova o animal para uma mesa de operação e coloque-o em decúbito dorsal.
- Intubar o porco usando laringoscopia direta com tubo traqueal tamanho 7,5 e inflar o manguito traqueal. Fixe o tubo no focinho/cabeça do animal. Isso evitará a extubação não intencional. Verifique o posicionamento correto do tubo observando o valor expiratório de dióxido de carbono na tela do ventilador.
- Conecte o tubo a um ventilador pré-testado e inicie a ventilação mecânica.
- Escolha a configuração de ventilação controlada por pressão e controlada por volume e defina o volume corrente (TV) para 8 mL/kg com ventilação de baixo fluxo. Ajuste a pressão expiratória final positiva (PEEP) para 5 cmH2O.
- Defina a fração inspirada de oxigênio (FiO2) para normóxia (0,21) ou superior, dependendo do protocolo experimental. O valor alvo de dióxido de carbono expirado (EtCO2) é de aproximadamente 5,0-5,5 kPa. Ajuste a frequência respiratória (RR) para conseguir isso.
- Iniciar e manter a anestesia geral por via intravenosa na orelha com propofol a 4,0 mg/kg/h e fentanil a 12,5 μg/kg/h. Verifique se há falta de reflexos da córnea e respostas a estímulos dolorosos para garantir que anestesia suficiente esteja sendo administrada. Aumente a taxa de infusão se houver reflexos ou respostas e verifique se há reflexos em intervalos regulares.
CUIDADO: Não deixe o animal sozinho em nenhum momento durante o protocolo. Evite usar agentes bloqueadores neuromusculares, pois eles podem obscurecer os sinais de anestesia inadequada. - Conecte fios de eletrocardiograma (ECG) de 3 derivações e um sensor de oximetria de pulso para monitorar a frequência cardíaca, o ritmo cardíaco e a saturação de oxigênio.
- Monitore a temperatura central com um termômetro retal. Atingir uma temperatura normal para suínos de 38-39 °C. Se necessário, aqueça o animal usando um cobertor de aquecimento de ar forçado.
- Insira um cateter de bexiga urinária e conecte a extremidade externa a uma bolsa de amostra de urina.
- Aplique pomada para os olhos veterinários para evitar o ressecamento.
2. Acessos intravasculares guiados por ultrassom
NOTA: Os acessos intravasculares são estabelecidos conforme descrito anteriormente18.
- Estabeleça o acesso intravascular na veia jugular externa direita, na veia femoral direita e na artéria femoral esquerda, no mínimo.
NOTA: Mais acesso pode ser obtido dependendo do protocolo experimental.- Faça a barba e desinfete a pele com clorexidina.
- Sob procedimento estéril, use um dispositivo de ultrassom para guiar um cateter venoso de 17 G para a posição intravascular.
- Remova a agulha do cateter venoso e use a técnica de Seldinger para inserir um fio-guia. Remova o cateter venoso e deixe o fio-guia no lugar.
- No ponto de acesso, faça uma pequena incisão na pele e insira a bainha sobre o fio-guia.
- Para garantir a colocação correta das bainhas, retire o sangue de cada bainha usando uma seringa de 10 mL ou 20 mL. Uma bainha colocada corretamente não terá resistência quando o sangue for aspirado ou o acesso for lavado com solução salina.
- Suturar as bainhas na pele (tamanho 4,0).
- Conecte a bainha na artéria femoral a um transdutor de pressão. Calibre para a pressão atmosférica e observe a tela para obter uma curva de pressão arterial correta.
- Conecte as bombas de infusão com solução salina isotônica às bainhas venosas. Isso evita a coagulação sanguínea intraluminal.
- Para neutralizar a hipovolemia do jejum antes do experimento e coletar sangue para criar êmbolos, inicie uma infusão em bolus de 800 mL durante 30-60 minutos na bomba conectada à veia jugular externa direita.
- Para corrigir a perda de líquidos por hora da transpiração e micção, inicie uma infusão de 4 mL/kg/h na bomba conectada à veia femoral.
3. Formação de coágulos
- Desembale um sistema de oxigenação cardiopulmonar e localize os tubos de cloreto de polivinila (PVC) não revestidos com heparina com um diâmetro externo e interno de 1/2 polegada e 3/32 polegadas, respectivamente. Corte em pedaços de ~30 cm de comprimento. Fabrique sete tubos no total.
NOTA: Quaisquer tubos de PVC de diâmetro menor podem ser usados se forem preferidos êmbolos mais finos. - Fechamento de uma extremidade dos tubos com grande pinça hemostática.
- Pause a infusão de solução salina isotônica em uma das bainhas venosas e retire um total de 180 mL de sangue.
- Divida o sangue em seis tubos de PVC (30 mL x 6) e feche a parte superior do tubo de PVC com outra pinça hemostática. Pendure os tubos verticalmente por no mínimo 3 h em temperatura ambiente (RT) (Figura 1A).
- Lave a solução salina na bainha e reinicie a infusão de solução salina.
4. Inserção guiada por fluoroscopia da bainha 26 F
CUIDADO: Equipamentos de proteção, como aventais de chumbo e colares de tireoide, contra radiação ionizante, devem ser usados sempre que a fluoroscopia estiver em uso.
- Pause a bomba de infusão conectada à bainha na veia jugular externa direita.
- Insira um fio-guia longo e extra-rígido através da bainha. Use fluoroscopia para observar o fio saindo da bainha. Avance o fio, guiado por fluoroscopia, caudal através das veias centrais superiores, da veia cava superior (VCS), do átrio direito (AR) e da veia cava inferior (VCI).
NOTA: Eventos sistólicos prematuros podem ocorrer à medida que o fio passa pelo AD. Nenhuma resistência deve ser sentida em nenhum ponto durante o avanço do fio. - Extraia a bainha lentamente enquanto observa por fluoroscopia que o fio-guia permanece no VCI. Comprima o ponto de entrada com um guardanapo estéril ao retrair a bainha.
- Use a técnica de Seldinger para trocar a bainha por um dilatador de 16 F. Estenda a incisão na pele se houver muita resistência. Avance a bainha para a circulação venosa guiada por fluoroscopia. Pré-embeber com solução salina para minimizar a resistência (Figura 2B).
NOTA: É extremamente importante acompanhar o curso do fio-guia com o dilatador e certificar-se de que o dilatador não esteja se desviando do fio e, portanto, do lúmen do vaso. - Use a técnica de Seldinger para trocar o dilatador 16 F pela bainha 26 F. Estenda a incisão na pele em pelo menos 10 mm. Avance a bainha 26 F lentamente, guiada por fluoroscopia, através das veias grandes até que a ponta da bainha, indicada por um marcador radiopaco (não o dilatador), atinja a VCS (Figura 2D). Espere alguma resistência ao avançar através de camadas musculares.
NOTA: Se a resistência for muito grande, a bainha pode ser retraída e uma incisão maior e mais profunda pode ser feita para envolver o tecido muscular próximo ao ponto de entrada. - Sob a orientação da fluoroscopia, retraia cuidadosamente o dilatador e o fio-guia para fora do porco, garantindo que a bainha permaneça no lugar.
- Retire sangue para garantir que a bainha ainda esteja no lugar. Lave com 90 mL de solução salina para garantir que todo o comprimento da bainha seja lavado.
- Coloque uma pilha de guardanapos estéreis sob a extremidade externa da bainha (e sob a cortina estéril) para elevá-la acima do nível do coração e evitar reabastecer o sangue na bainha (Figura 2C).
- Reconecte a bomba de infusão e retome a infusão de solução salina.
5. Cateterismo cardíaco direito
- Lave ambas as portas de um cateter de Swan-Ganz (SG) com água salina. Verifique se o balão infla corretamente.
- Conecte cada uma das portas do cateter SG a uma torneira de 3 ou 4 vias. Conecte uma porta não utilizada da torneira aos transdutores de pressão. A porta restante de cada torneira pode ser usada posteriormente para amostragem de gasometria arterial venosa central e pulmonar.
- Redefina os transdutores para a pressão atmosférica segurando as portas distais do cateter SG no nível axilar médio do porco.
- Insira o cateter SG através da bainha 26 F (Figura 2C).
- Use fluoroscopia para observar quando a extremidade distal do cateter SG sai da bainha. Observe se o balão infla corretamente. A inflação deve ser livre de resistência.
NOTA: O balão pode ser danificado se inflado dentro da bainha. Uma visão ântero-posterior é usada para todos os procedimentos. Nunca retraia o cateter enquanto o balão estiver inflado. Isso pode fazer com que o balão se desloque ou danifique as válvulas e cordas. - Com o balão insuflado, avance lentamente o balão através das veias centrais, do AD, do ventrículo direito (VD) e para a artéria pulmonar principal (APM) (Figura 2E).
- Observe que o sinal de pressão e a forma da curva de pressão mudam à medida que a porta distal se move para o VD e novamente para o MPA.
- Certifique-se de que o sinal de pressão mude de 2-8 mmHg na circulação venosa central para uma pressão sistólica e diastólica do VD de 20-30 mmHg e 0-5 mmHg, respectivamente. Ao avançar para o MPA, certifique-se de que a pressão sistólica seja de 25-35 mmHg e diastólica de 10-15 mmHg.
- Esvazie o balão. Certifique-se de que o cateter SG ainda esteja no lugar usando fluoroscopia e superando os sinais e curvas de pressão.
NOTA: O experimento pode ser pausado neste ponto.
6. Montagem do dispositivo de entrega de êmbolo (Figura 3)
NOTA: O dispositivo de êmbolo consiste em duas partes, que são chamadas de parte A e parte B a partir de agora (Figura 3).
- Desembale o resto do sistema de oxigenação cardiopulmonar com uma linha de cardioplegia integrada e a cânula de perfusão aórtica em condições estéreis.
- No conjunto de autotransfusão, localize o tubo de silicone de 10 cm de comprimento (3/8 de polegada externo e 3/32 de polegada de diâmetro interno) preso ao fundo do recipiente de cardiotomia e a peça do conector de 3/8 a 1/4 de polegada conectada ao tubo de silicone (Figura 3A).
- Corte o tubo de silicone em dois tubos de tamanhos iguais. Deixe a metade sem o conector de lado por enquanto.
- Localize a linha de escorva rápida. Corte a linha a aproximadamente 20 cm da extremidade da trava Luer e prenda a extremidade aberta da linha de escorva rápida à extremidade de 1/4 de polegada da peça do conector (Figura 3A).
- Localize uma peça de conector de 3/8 a 1/2 polegada. Conecte-o à extremidade aberta do tubo de silicone. A Parte A está agora concluída (Figura 3A, C).
- Conecte a metade restante do tubo de silicone à extremidade distal da cânula de perfusão aórtica. Localize e conecte qualquer conector de 3/8 a 1/2 polegada à extremidade aberta do tubo de silicone. A Parte B está agora concluída (Figura 3B,C).
7. Avaliação inicial
NOTA: É importante obter estabilização hemodinâmica após a instrumentação e antes da avaliação inicial. As seguintes medidas são recomendadas. O escopo da medição de linha de base pode ser ajustado de acordo com o protocolo específico.
- Registre os valores das pressões arteriais sistêmica e pulmonar, bem como a pressão venosa central.
NOTA: As pressões arteriais pulmonares aceitáveis são uma pressão sistólica < 40 mmHg e pressão arterial pulmonar média (PAPm) ≤ 20 mmHg. - Registre a temperatura corporal central, a saturação periférica e a frequência cardíaca.
- No respirador, registre os valores de FiO2, EtCO2, VC, volume minuto (MV), FR e pressão de pico (Ppico).
- Colete amostras de sangue de 1 mL da bainha arterial e da porta distal (amarela) do cateter SG (venoso misto) para análise de gases sanguíneos.
- Se presente, corrija qualquer desequilíbrio eletrolítico e/ou baixa glicemia para atingir valores dentro da faixa normal.
- Dependendo do protocolo experimental, coletar amostras de sangue venoso em recipientes apropriados para análise posterior.
- Obter débito cardíaco (DC) por termodiluição através do cateter SG. Certifique-se de que uma média de três medições dentro de uma margem de 10% seja obtida.
- Obtenha a pressão capilar pulmonar (PAWP) através do cateter SG.
8. Avaliação do coágulo
NOTA: Após um mínimo de 3 h, os êmbolos estão prontos para serem induzidos. O tubo de PVC conterá o êmbolo formado e o sobrenadante líquido. Se o sangue não coagular, aguarde mais 30 minutos antes de recuperar outro êmbolo.
- Recupere um dos tubos de PVC contendo um êmbolo totalmente formado e coloque-o suavemente em um guardanapo cirúrgico, descartando o sobrenadante. Certifique-se de que o êmbolo esteja rígido e estável para injeção (Figura 1B).
9. Induzindo embolia pulmonar aguda (Figura 4)
- Coloque um saco de 1000 mL de solução salina isotônica em um saco de infusão de pressão. Insira um conjunto de infusão e encha o saco de pressão a pelo menos 200 mmHg (mas não além da pressão recomendada).
- Pegue a parte A do dispositivo de entrega de êmbolo e conecte-o à porta lateral da torneira de 3 vias (Figura 4A).
- Conecte o último tubo de PVC à extremidade aberta da parte A.
- Coloque um êmbolo no tubo e encha o sistema com solução salina (Figura 4B).
- Fixe a parte B na outra extremidade do tubo de PVC (Figura 4C).
NOTA: Certifique-se de que todo o sistema esteja cheio de solução salina. - Insira o dispositivo de êmbolo na bainha 26 F e infunda o êmbolo abrindo o fluxo de solução salina pressurizada por cerca de 5 s (Figura 4D).
CUIDADO: Observe cuidadosamente os parâmetros vitais antes e depois da injeção de um êmbolo. Se nenhuma resposta for observada, a embolia ainda pode estar em trânsito e liberar solução salina por mais 3 s.
10. Modelo de EP aguda (Figura 5 e Figura 6)
- Induza êmbolos até que a mPAP dobre em relação à linha de base ou até que todos os seis êmbolos sejam induzidos. Monitore a resposta hemodinâmica e aguarde a estabilização antes de induzir outro êmbolo.
CUIDADO: O porco pode ficar hemodinamicamente instável durante a indução de um êmbolo. Se a pressão arterial sistêmica média diminuir para 50 mmHg, um bolus de 0.02 mg de norepinefrina pode ser necessário. Repita o bolo, se necessário. - Depois de injetar o número adequado de êmbolos, o porco fica estável por 30 min.
NOTA: A manifestação da EP é uma condição hiperdinâmica. Portanto, a mPAP deve estar em um platô antes de prosseguir para a seção 11.
11. Hemodinâmica
- Após 30 min de estabilização, realize uma avaliação aguda de EP em registro para a avaliação inicial realizada na seção 7.
- Dependendo do protocolo, as intervenções podem começar agora.
12. Angiografia pulmonar por tomografia computadorizada (APTC) (Figura 7)
NOTA: Esta parte do protocolo pode ser excluída dependendo do escopo científico.
- Enquanto ainda intubado e anestesiado, conecte o porco a um ventilador mecânico transportável e transporte o porco para as instalações do CTPA.
- Realize a APTC durante a apneia inspiratória antes da indução da EP como parte da avaliação inicial.
- Use o controle automático de exposição a 120 KV com uma colimação definida para 0,5 x 80 mm.
- Através de uma veia da orelha por uma bomba de injeção automatizada, injete 75 mL de solução de contraste de Iomeron (350 mg / mL) com um fluxo de 0,5 mL / s seguido por 30 mL de solução salina injetada a 3,0 mL / s.
- Transporte o porco de volta para a sala do operador e continue com o protocolo.
- Após a indução de EP, repita as etapas 12.1-12.2 para uma avaliação de EP.
13. Outros métodos
- Dependendo do escopo do trabalho científico, avalie o porco de acordo.
NOTA: Inúmeros métodos de avaliação, não descritos em detalhes neste protocolo, podem ser aplicados no modelo: ressonância magnética, ecocardiografia transesofágica, registros de alça de pressão e volume biventricular, bioquímica, fisiologia ex vivo e análise histológica foram utilizados em trabalhos anteriores 13,14,15,16,18,19,20.
14. Eutanásia e necropsia
- Eutanasiar o porco com uma dose letal de pentobarbital (1,5 mL/kg, 400 mg/mL) ao final do protocolo.
NOTA: Dependendo do protocolo, uma necropsia pode ser realizada e a amostragem histológica pode ser obtida (Figura 8).
Resultados
Em uma análise conjunta de suínos incluídos em estudos anteriores, apresentamos os resultados que caracterizam o modelo de PE aguda descrito neste protocolo15,16. Dois porcos morreram de insuficiência cardíaca direita aguda após EP. No total, incluímos 24 porcos.
Hemodinâmica
A resposta após cada êmbolo é evidente na Figura 5. A indução de PE (5 ± 1) causou um aumento imediato da PAPm (17 ± 3 mmHg para 33±6 mmHg, p < 0,0001) e FC (50 ± 9 batimentos·min-1 para 63 ± 6 batimentos·min-1, p < 0,0003) acompanhado de diminuição do DC (5,0 ± 0,8 L/min para 4,5 ± 0,9 L/min, p < 0,037) e EtCO2 (Figura 5 e Figura 6). A PAM permaneceu inalterada (79 ± 9 mmHg a 77 ± 11 mmHg, p = 0,1955). (Figura 6). A indução da EP resultou em elevação da troponina T (TnT)13, aumento da pós-carga do VD, desacoplamento ventrículo-arterial do VD e dilatação do VD, tornando-a compatível com EP de risco intermediário (dados não mostrados)1,14.
Imagiologia
Para avaliar a carga de coágulo, foi calculado o percentual de obstrução pulmonar conforme descrito anteriormente (Figura 7)15. Em suma, o percentual foi calculado como 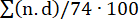 , onde n é a presença de êmbolo segmentar e d é o grau de obstrução em uma escala de 0 a 2, computando com um máximo de 74 pontos. A AFTC realizada no início do estudo não mostrou sinais de EP (Figura 7A), mas após a indução da EP, múltiplos êmbolos nas artérias pulmonares foram evidentes na APTC, resultando em um aumento na porcentagem de obstrução da TC (0 [0 - 0] para 57,1% [IIQ 38,8-63,3]) (Figura 7C-E).
, onde n é a presença de êmbolo segmentar e d é o grau de obstrução em uma escala de 0 a 2, computando com um máximo de 74 pontos. A AFTC realizada no início do estudo não mostrou sinais de EP (Figura 7A), mas após a indução da EP, múltiplos êmbolos nas artérias pulmonares foram evidentes na APTC, resultando em um aumento na porcentagem de obstrução da TC (0 [0 - 0] para 57,1% [IIQ 38,8-63,3]) (Figura 7C-E).

Figura 1: Formação de êmbolo. (A) Tubos de PVC preenchidos com 30 mL de sangue, cada um pendurado verticalmente por no mínimo 3 h. (B) Um êmbolo formado. Clique aqui para ver uma versão maior desta figura.
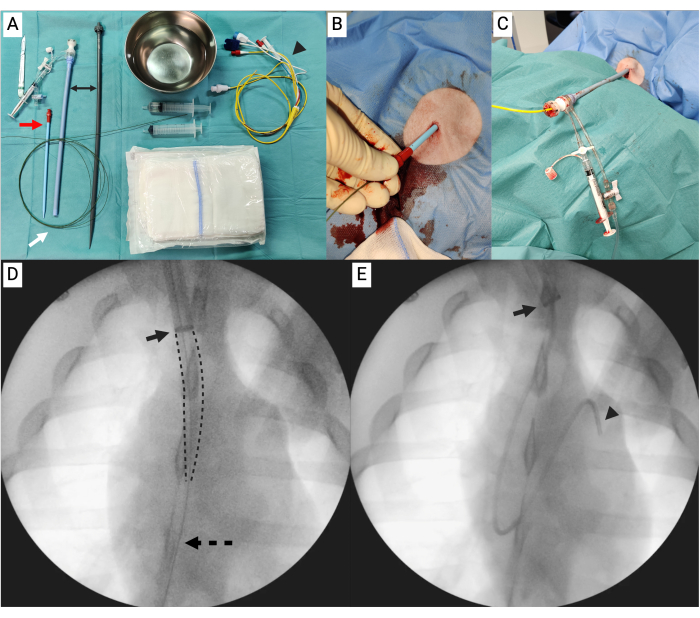
Figura 2: Inserção da bainha 26 F e cateterismo cardíaco direito. (A) Tabela com os equipamentos necessários para a substituição da bainha 8 F, utilizando-se um dilatador 16 F (seta vermelha) e fio-guia longo extra-rígido (seta branca), em uma bainha 26 F (seta dupla preta), incluindo o cateter de Swan-Ganz (SG) (cabeça de seta). (B) O fio com o dilatador 16 F. (C) A bainha 26 F no lugar com guardanapos sob a cortina estéril para elevar a extremidade. O SG é inserido na bainha 26 F. (D) Fluoroscopia mostrando o 26 F (seta indicando o anel radiopaco da bainha) com o dilatador (marcado por linhas pontilhadas) e o fio (seta pontilhada). (E) Fluoroscopia mostrando a bainha 26 F (seta) com o cateter SG (cabeça de seta). Clique aqui para ver uma versão maior desta figura.
Figura 3: Dispositivo de êmbolo. (A) Componentes desmontados para a parte A do dispositivo de êmbolo. (B) Componentes desmontados para a parte B do dispositivo de êmbolo. (C) Da esquerda para a direita: montou a parte A do dispositivo de êmbolo e a parte B do dispositivo de êmbolo. Clique aqui para ver uma versão maior desta figura.

Figura 4: Indução de êmbolo. (A) Da esquerda para a direita: montou a parte B do dispositivo de êmbolo, tubo de PVC e a parte A do dispositivo de êmbolo conectado à infusão definida pela porta lateral de 3 vias. (B) O tubo de PVC é conectado à parte A do dispositivo de êmbolo e um êmbolo é colocado no tubo. (C) Dispositivo de êmbolo totalmente montado com um êmbolo. (D) O dispositivo de êmbolo (seta pontilhada preta) com um êmbolo (seta preta) é inserido na bainha 26 F (seta branca) com o cateter de Swan Ganz (seta pontilhada branca) no lugar. Clique aqui para ver uma versão maior desta figura.
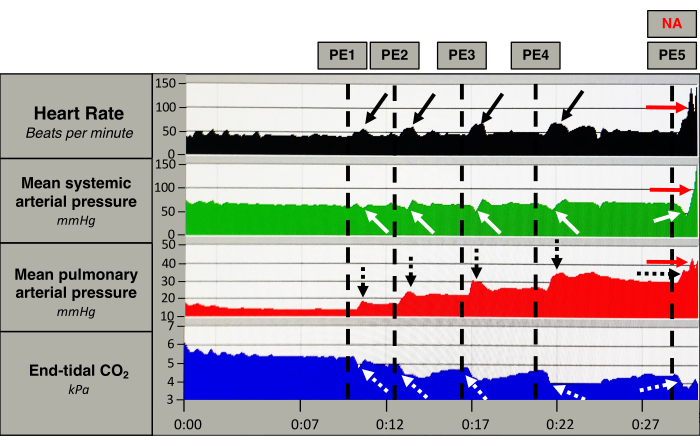
Figura 5: Resposta hemodinâmica aguda. Medições de frequência cardíaca (preto), pressão arterial sistêmica média (verde), pressão arterial pulmonar média (vermelho) e COexpirado 2 (azul) de um porco. As linhas pontilhadas verticais marcam a indução de um êmbolo (EP). Após a indução da EP, a freqüência cardíaca aumenta momentaneamente (setas pretas), juntamente com um aumento persistente da pressão arterial pulmonar média (seta pontilhada preta). A pressão arterial sistêmica média diminui ligeiramente após cada EP, e a diminuição torna-se maior após cada êmbolo (setas brancas). O COexpirado 2 diminui abruptamente após cada EP (setas pontilhadas brancas). Após a quinta EP, o porco recebe um bolus de norepinefrina (NA) que causa um aumento na frequência cardíaca e na pressão arterial sistêmica e pulmonar média (setas vermelhas). Clique aqui para ver uma versão maior desta figura.

Figura 6: Resposta fisiológica aguda. Comparação de (A) pressão arterial pulmonar média, (B) pressão arterial média, (C) frequência cardíaca e (D) débito cardíaco no início e após a indução de embolia pulmonar (EP). Os pontos de tempo são comparados com testes t de amostra pareados. Clique aqui para ver uma versão maior desta figura.
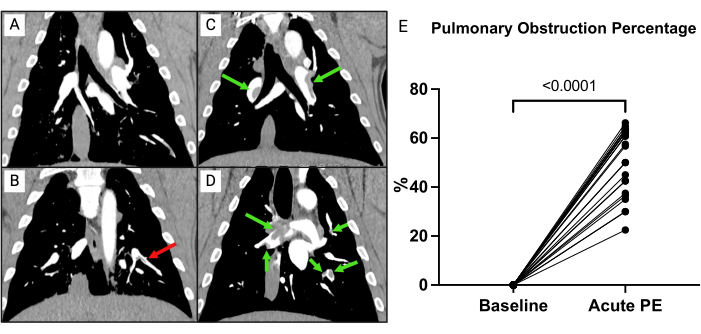
Figura 7: Angiografia pulmonar por TC (APCT). (A) Suíno após instrumentação completa, recebendo apenas solução salina. Sem sinais de material embólico. (B) CTPA de um porco após instrumentação completa recebendo apenas solução salina. Um êmbolo não recuado (seta vermelha) está presente. (C, D) Imediatamente após a indução de êmbolos (setas verdes) de dois porcos diferentes. (E) Porcentagem de obstrução pulmonar no início do estudo em comparação com após a indução de embolia pulmonar (EP). Os pontos de tempo são comparados com testes t de amostra pareados. Clique aqui para ver uma versão maior desta figura.
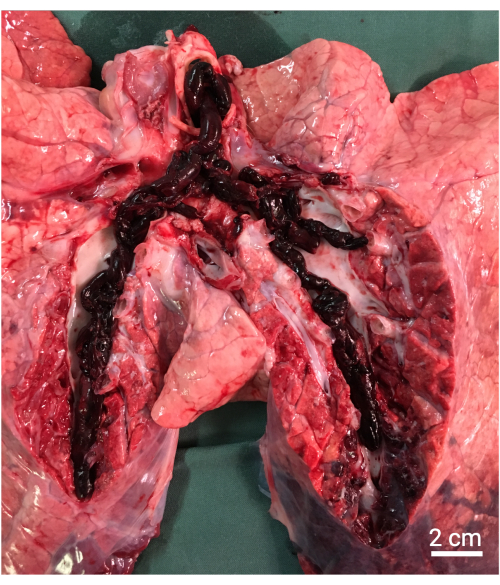
Figura 8: Necropsia. Macroscopicamente, achados mostrando os grandes êmbolos autólogos nas artérias pulmonares. Clique aqui para ver uma versão maior desta figura.
Discussão
Este artigo descreve um modelo suíno de EP aguda de risco intermediário usando êmbolos autólogos que são minimamente invasivos e reprodutíveis.
Existem algumas etapas críticas neste protocolo. Primeiro, a dilatação do acesso na veia jugular externa direita é crucial para o modelo, pois serve como ponto de acesso para os êmbolos. Ao avançar a bainha grande, é essencial seguir a orientação do fio rígido sob fluoroscopia contínua para evitar ruptura ou dissecção dos vasos principais ou das câmaras cardíacas direitas. Se houver resistência, não aplique pressão excessiva, mas substitua o fio e garanta a dilatação ideal do acesso. Além disso, os porcos são arritmogênicos e a instrumentação pode causar fibrilação atrial. É, portanto, crucial observar o porco de perto.
Em segundo lugar, o modelo tem um fenótipo hemodinâmico de EP de risco intermediário na fase aguda. A titulação cuidadosa do número ideal de êmbolos pode representar um desafio. Se o volume de êmbolos ultrapassar a capacidade do coração de suportar alta pressão, o porco pode sofrer insuficiência cardíaca direita aguda e morte. A abordagem de tórax fechado para indução de EP depende do investigador monitorar de perto a resposta hemodinâmica, como aumento da PAPm, diminuição do EtCO2, FC elevada ou redução da pressão arterial sistêmica, durante a indução do êmbolo. Se a hipotensão sistêmica for grave e prolongada, isso sugere que a carga máxima de trombo foi atingida. Ao permitir tempo suficiente entre os êmbolos, o risco de colapso súbito é reduzido. Se não houver resposta aparente, o êmbolo pode estar em trânsito dentro da bainha ou das câmaras do lado direito do coração. Em seguida, recomendamos relavar e aguardar como uma indução imediata de um novo êmbolo, o que pode levar a dois êmbolos simultâneos, que podem ser fatais.
Em terceiro lugar, o modelo é estabelecido sem o uso de heparina. O investigador deve prestar muita atenção para sempre ter solução salina conectada aos acessos e lembre-se de extrair o derramamento e lavar com solução salina antes de usar. Se não for feito isso, o material embólico se formará e poderá se desalojar, fazendo com que êmbolos menores sejam induzidos ao longo do protocolo que podem interferir nos resultados (Figura 4B).
O modelo contribui para uma resposta fisiológica realista, devido à configuração de tórax fechado, mas também devido à utilização de material embólico autólogo. Na busca do desenvolvimento de um fenótipo tromboembólico agudo em animais, vários modelos têm sido desenvolvidos, a maioria necessitando do uso de material inorgânico, tratamentos farmacológicos e/ou ligadura da artéria pulmonar para induzir hipertensão pulmonar aguda e insuficiência cardíaca do VD em um modelo animal de grandeporte 6,7,8,21,22 . Consequentemente, esses modelos não mimetizam a apresentação clínica de um paciente com EP. Um estudo criou o material tromboembólico in vivo por oclusão da veia cava inferior para criar uma trombose venosa profunda (TVP)10. No entanto, a criação da TVP é demorada e a indução da TVP é insuficiente para criar um modelo com disfunção do VD.
No presente modelo, o objetivo era criar um fenótipo hemodinâmico comparável ao PE de risco intermediário, o que foi alcançado no modelo após 5 ± 1 êmbolos. A carga do coágulo pode ser alterada dependendo do escopo do modelo para atingir um fenótipo hemodinâmico desejado, ou pode-se usar uma carga de trombo fixa. No entanto, um estudo de nosso grupo mostrou que as alterações hemodinâmicas da pressão pulmonar e a disfunção do VD não estão diretamente relacionadas apenas à carga do coágulo23. O estudo descobriu que a indução do primeiro êmbolo causou o maior aumento na mPAP em comparação com as induções embólicas seguintes. No entanto, a pós-carga do VD aumentou na indução do terceiro êmbolo.
O arranjo experimental utilizado neste estudo oferece ainda oportunidades para investigar a resposta fisiopatológica em relação às alterações de imagem e hemodinâmicas 13,14,15. Estudos têm investigado a resposta aguda do VD nas primeiras 12 horas após um evento de PE de risco intermediário14. Outro estudo utilizou o modelo para observar a resposta prolongada um mês após a indução de material embólico15. Além disso, o modelo tem sido utilizado para testar tratamentos farmacológicos na fase aguda e subaguda 16,21,22,24,25,26,27. Um dos estudos constatou que o uso de oxigenoterapia a 40% de FiO2 diminuiu a pós-carga e o trabalho mecânico do VD. O modelo provou ser versátil.
Existem algumas limitações no protocolo. Primeiro, os êmbolos são formados pouco antes da indução e criados ex vivo, o que pode ser uma limitação, pois o trombo criado in vitro consiste em menos fibrina28. No entanto, o benefício é que a carga do coágulo pode ser controlada enquanto ainda se usa material autólogo. Em segundo lugar, os animais são totalmente anestesiados durante o protocolo, e a anestesia pode afetar a resposta hemodinâmica. No entanto, fazer medições repetidas equaliza qualquer efeito.
O modelo é estabelecido em suínos de abate e não geneticamente modificados ou criados isoladamente. Os suínos podem estar sujeitos a doenças que podem afetar o sistema cardiovascular e a pressão pulmonar29. Portanto, é essencial realizar uma avaliação inicial do estado hemodinâmico.
Em conclusão, apresentamos um modelo de porco usando êmbolos autólogos. O modelo apresenta um fenótipo comparável ao EP de risco intermediário. Este modelo serve como uma ferramenta valiosa para testar novos tratamentos intervencionistas e farmacêuticos, bem como para treinar médicos e profissionais de saúde em procedimentos intervencionistas.
Divulgações
AA recebeu honorários de palestrante (ABBOTT, Gore Medical, Angiodynamics, EPS Vascular e Jannsen) e é consultor da Inari Medical.
Agradecimentos
Desejamos expressar nossa sincera gratidão pela tremenda dedicação e trabalho árduo demonstrado pela equipe do Departamento de Medicina Clínica da Universidade de Aarhus, na conclusão dos experimentos. Além disso, queremos agradecer aos nossos colaboradores do Departamento de Medicina Forense da Universidade de Aarhus e do Departamento de Radiologia do Hospital Geral de Massachusetts, pela inestimável assistência na condução e análise da angiografia pulmonar por TC. O trabalho foi apoiado pela Escola de Pós-Graduação da Universidade de Aarhus, Fundação Karen Elise Jensen, Fundação Dinamarquesa do Coração, concessão do NIH nº 1R01HL168040-01, Fundação Novo Nordisk [NNF17OC0024868], Holger og Ruth Hesse's Mindefond, Fundação Laerdal [3374], Fundação Alfred Benzons, AP Møller Fonden, Direktør Emil C. Hertz og hustru Inger Hertz Fond, PA Messerschmidt og Hustrus fond e Helga og Peter Kornings Fond.
Materiais
| Name | Company | Catalog Number | Comments |
| 12L-RS | GE Healthcare Japan | 5141337 | Ultrasound probe |
| 50 mL BD Luer-Lock | BD Plastipak | 300865 | |
| Adhesive Aperature Drape (OneMed) | evercare | 1515-01 | 75 cm x 90 cm (hole: 6 cm x 8 cm) |
| Alaris GP Guardrails plus | CareFusion | 9002TIG01-G | Infusion pump |
| Alaris Infusion set | BD Plastipak | 60593 | |
| Alcohol swap | MEDIQ Danmark | 3340012 | 82% ethanol, 0.5% chlorhexidin, skin disinfection |
| Amplatz Support Wire Guide Extra-Stiff | Cook Medical | THSF-25-260-AES | diameter: 0.025 inches, length: 260 cm |
| Aortic Perfusion Cannula | Edwards Lifesciences | AA024TFTA | Size: 24F. Length: 30 cm. |
| BD Connecta | BD | 394601 | Luer-Lock |
| BD Emerald | BD | 307736 | 10 mL syringe |
| BD Platipak | BD | 300613 | 20 mL syringe |
| BD Venflon Pro | Becton Dickinson Infusion Therapy | 393204 | 20 G |
| BD Venflon Pro | Becton Dickinson Infusion Therapy | 393208 | 17 G |
| Butomidor Vet | Richter Pharma AG | 531943 | 10 mg/mL |
| Chlorhexidine 0.5% | Meda AB | N/A | |
| Cios Connect S/N 20015 | Siemens Healthineers | N/A | C-arm |
| CP Oxygenation System Adult With Fusion and Cardioplegia 1/B | Medtronic | M450311W | Custom cardiopulmonary oxygenation system including a cardioplegia line. |
| D-LCC12A-01 | GE Healthcare Finland | N/A | Pressure measurement monitor |
| Durapore | 3M | N/A | Adhesive tape |
| E-PRESTIN-00 | GE Healthcare Finland | 6152932 | Respirator tubes |
| Euthanimal | Alfasan | 136278 | Pentobarbitalnatrium 400 mg/mL (0.5 mL/kg for euthanasia) |
| Favorita II | Aesculap | GT104 | |
| Fentanyl | B. Braun | 71036 | 50 µg/mL |
| Glucose isotonic | SAD | 419358 | 55 mg/mL Isotonic glucose (500 mL bag) |
| Gore DrySeal Flex Introducer Sheath | GORE | DSF2633 | Size: 26 French. Working length: 33 cm. |
| Ketaminol Vet | MSD/Intervet International B.V. | 511519 | 100 mg/mL |
| Lawton 85-0010 ZK1 | Lawton | N/A | Laryngoscope |
| Lectospiral | VYGON | 1159.90 | 400 cm (Luer-LOCK) |
| MBH qufora | MBH-International A/S | 13853401 | Urine bag |
| Natriumchlorid | Fresenius Kabi | 7340022100528 | 9 mg/mL Isotonic saline |
| Noradrenalin | Macure Pharma | 425318 | 1 mg/mL |
| PICO50 Aterial Blood Sampler | Radiometer | 956-552 | 2 mL |
| Portex Tracheal Tube | Smiths Medical | 100/150/075 | Cuffed Clear Oral/Nasal Murphy Eye |
| Pressure Extension set | CODAN | 7,14,020 | Tube for anesthetics, 150 cm long, inner diameter 0.9 mm |
| Propolipid | Fresenius Kabi | 21636 | Propofol, 10 mg/mL |
| Radiofocus Introducer II | Radiofocus/Terumo | RS+B80N10MQ | 7 + 8F sheaths |
| Rompun Vet | Beyer | 86450917 | Xylazin, 20 mg/mL |
| Rüsch Brilliant AquaFlate Glycerine | Teleflex | 178000 | Bladder catheter, size 14 |
| S/5 Avance | Datex-Ohmeda | N/A | Mechanical ventilator |
| Safersonic Conti Plus & Safergel | SECMA medical innovation | SAF.612.18120.WG.SEC | 18 cm x 120 cm (Safersonic Sterile Transducer Cover with Adhesive Area and Safergel) |
| Standard Dilator | Cook Medical | G01212 | Size: 16 French. Length: 20 cm. |
| Swan-Ganz CCOmbo | Edwards Lifesciences | 744F75 | 110 cm |
| TruWave Pressure Monitoring Set | Edwards Lifesciences | T434303A | 210 cm |
| Vigilance VGS Patient Monitor | Edwards Lifesciences | N/A | |
| Vivid iq | GE Medical Systems China | Vivid iq | |
| Zoletil 50 Vet (tiletamin 125 mg and zolazepam 125 mg) | Virbac | 83046805 | Zoletil Mix for pigs: 1 vial of Zoletil 50 Vet (dry matter); add 6.25 mL Xylozin (20 mg/mL), 1.25 mL ketamin (100 mg/mL) and 2.5 mL Butorphanol (10 mg/mL). Dose for pre-anesthesia: 0.1 mL/kg as intramuscular injection |
Referências
- Konstantinides, S. V., et al. ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The task force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur. Heart J. 41 (4), 543-603 (2019).
- Wendelboe, A. M., Raskob, G. E. Global burden of thrombosis. Circ. Res. 118 (9), 1340-1347 (2016).
- Becattini, C., et al. Acute pulmonary embolism: mortality prediction by the 2014 European Society of Cardiology risk stratification model. Eur. Respir. J. 48 (3), 780-786 (2016).
- Wood, K. E. Major Pulmonary embolism: Review of a pathophysiologic approach to the golden hour of hemodynamically significant pulmonary embolism. Chest. 121 (3), 877-905 (2002).
- Bĕlohlávek, J., Dytrych, V., Linhart, A. Pulmonary embolism, part I: Epidemiology, risk factors and risk stratification, pathophysiology, clinical presentation, diagnosis, and nonthrombotic pulmonary embolism. Exp Clin Cardiol. 18 (2), 129-138 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Tsang, J. Y., Lamm, W. J., Starr, I. R., Hlastala, M. P. Spatial pattern of ventilation-perfusion mismatch following acute pulmonary thromboembolism in pigs. J Appl Physiol. 98 (5), 1862-1868 (2005).
- Böttiger, B. W., et al. Inhaled nitric oxide selectively decreases pulmonary artery pressure and pulmonary vascular resistance following acute massive pulmonary microembolism in piglets. Chest. 110 (4), 1041-1047 (1996).
- Kudlička, J., et al. Pig model of pulmonary embolism: where is the hemodynamic break point. Physiol Res. 62 (Suppl 1), S173-S179 (2013).
- Barbash, I. M., et al. Experimental model of large pulmonary embolism employing controlled release of subacute caval thrombus in swine. J Vasc Interv Radiol. 22 (10), 1471-1477 (2011).
- Beam, D. M., et al. Comparison of isoflurane and α-chloralose in an anesthetized swine model of acute pulmonary embolism producing right ventricular dysfunction. Comp Med. 65 (1), 54-61 (2015).
- Pereira, D. J., et al. Near-fatal pulmonary embolism in an experimental model: hemodynamic, gasometric and capnographic variables. Rev Bras Cir Cardiovasc. 26 (3), 462-468 (2011).
- Schultz, J., et al. A porcine in-vivo model of acute pulmonary embolism. Pulm. Circ. 8 (1), 2045893217738217 (2018).
- Lyhne, M. D., et al. Right ventricular adaptation in the critical phase after acute intermediate-risk pulmonary embolism. Eur Heart J Acute Cardiovasc Care. 10 (3), 243-249 (2020).
- Dragsbaek, S. J., et al. A porcine model of human-like chronic thromboembolic pulmonary disease. Thromb. Res. 231, 25-28 (2023).
- Merit, V. T., et al. Changes in pulmonary vascular resistance and obstruction score following acute pulmonary embolism in pigs. Crit Care Explor. 6 (2), e1040 (2024).
- NC3Rs Reporting Guidelines Working Group. Animal research: reporting in vivo experiments: the ARRIVE guidelines. Exp Physiol. 95 (8), 842-844 (2010).
- Lyhne, M. D., et al. Closed chest biventricular pressure-volume loop recordings with admittance catheters in a porcine model. J Vis Exp. 171, e62661 (2021).
- Schultz, J., Andersen, A., Gade, I. L., Kjaergaard, B., Nielsen-Kudsk, J. E. Riociguat, sildenafil and inhaled nitric oxide reduces pulmonary vascular resistance and improves right ventricular function in a porcine model of acute pulmonary embolism. Eur Heart J Acute Cardiovasc Care. 9 (4), 293-301 (2019).
- Schultz, J., et al. Terlipressin increases systemic and lowers pulmonary arterial pressure in experimental acute pulmonary embolism. Crit Care Med. 48 (4), e308-e315 (2020).
- Schmitto, J. D., et al. Progressive right ventricular failure is not explained by myocardial ischemia in a pig model of right ventricular pressure overload. Eur J Cardiothorac Surg. 35 (2), 229-234 (2009).
- Greyson, C., Xu, Y., Lu, L., Schwartz, G. G. Right ventricular pressure and dilation during pressure overload determine dysfunction after pressure overload. Am J Physiol Heart Circ Physiol. 278 (5), H1414-H1420 (2000).
- Lyhne, M. D., et al. Immediate cardiopulmonary responses to consecutive pulmonary embolism: a randomized, controlled, experimental study. BMC Pulm Med. 24 (1), 233 (2024).
- Mortensen, C. S., et al. Impact of preload on right ventricular hemodynamics in acute pulmonary embolism. Crit Care Med. 48 (12), e1306-e1312 (2020).
- Lyhne, M. D., et al. Oxygen therapy lowers right ventricular afterload in experimental acute pulmonary embolism. Crit Care Med. 49 (9), e891-e901 (2021).
- Kramer, A., et al. Inhaled nitric oxide has pulmonary vasodilator efficacy both in the immediate and prolonged phase of acute pulmonary embolism. Eur Heart J Acute Cardiovasc Care. 10 (3), 265-272 (2020).
- Lyhne, M. D., et al. Levosimendan, milrinone, and dobutamine in experimental acute pulmonary embolism. Pulm Circ. 11 (3), 20458940211022977 (2021).
- Krueger, K., Deissler, P., Coburger, S., Fries, J. W. U., Lackner, K. How thrombus model impacts the in vitro study of interventional thrombectomy procedures. Invest Radiol. 39 (10), 641-648 (2004).
- Brockmeier, S. L., Halbur, P. G., Thacker, E. L. . Porcine Respiratory Disease Complex. Polymicrobial Diseases. , (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados