Method Article
Un modelo porcino de embolia pulmonar autóloga aguda
En este artículo
Resumen
En este estudio se presenta un modelo porcino de embolia pulmonar (EP) utilizando grandes émbolos autólogos que replican la embolia pulmonar aguda de riesgo intermedio. El modelo es adecuado para la evaluación tanto de la fisiopatología como de las respuestas al tratamiento.
Resumen
La embolia pulmonar aguda (EP) es una afección potencialmente mortal que causa una obstrucción abrupta de las arterias pulmonares, lo que conduce a una insuficiencia cardíaca derecha aguda. Se están desarrollando rápidamente nuevos métodos de diagnóstico y terapias dirigidas por catéteres, y existe una necesidad obvia de un modelo animal de EP realista que pueda utilizarse para la evaluación fisiopatológica y las pruebas preclínicas.
Este protocolo introduce un modelo porcino que emplea grandes embolias pulmonares autólogas. Las instrumentaciones se realizan con técnicas mínimamente invasivas, creando un modelo de tórax cerrado que permite investigar diversas opciones de tratamiento con alta reproducibilidad. Tres horas después de la extracción de sangre para crear émbolos autólogos ex vivo, la inducción de EP provocó un aumento inmediato de la presión arterial pulmonar media (17 ± 3 mmHg a 33 ± 6 mmHg, p < 0,0001) y de la frecuencia cardíaca (50 ± 9 latidos·min-1 a 63 ± 6 latidos·min-1, p < 0,0003) acompañada de una disminución del gasto cardíaco (5,0 ± 0,8 L/min a 4,5 ± 0,9 L/min, p < 0,037) en comparación con el valor basal. La angiografía pulmonar por TC reveló émbolos múltiples y el porcentaje de obstrucción pulmonar aumentó en comparación con el basal (0% [0-0] a 57,1% [38,8-63,3], p < 0,0001). En la fase aguda, el fenotipo es comparable al de la EP de riesgo intermedio.
El modelo representa un fenotipo realista y bien caracterizado de EP de riesgo intermedio y crea una oportunidad para probar nuevos métodos de diagnóstico, tratamientos intervencionistas y farmacéuticos, y capacitación práctica para los trabajadores de la salud en procedimientos intervencionistas.
Introducción
La embolia pulmonar aguda (EP) es la tercera causa más frecuente de muerte cardiovascular y es una manifestación de tromboembolismo venoso (TEV)1. La incidencia de TEV oscila entre 75 y 269 por 100.000 habitantes al año y aumenta con los2 años de edad. Los supervivientes iniciales se enfrentan a un riesgo de muerte a 30 días, que oscila entre el 0,5 % para los pacientes de bajo riesgo y el 22 % para los pacientes de alto riesgo3. La causa de la muerte es la insuficiencia del ventrículo derecho (VD), que ocurre predominantemente en cuestión de horas 4,5. Incluso si los pacientes sobreviven, todavía existe el riesgo de una morbilidad significativa y enfermedades crónicas.
Las opciones de tratamiento en la fase aguda de la enfermedad incluyen embolectomía quirúrgica, trombólisis sistémica o basada en catéter, heparina de bajo peso molecular y anticoagulantes orales1. El número y la variedad de opciones de tratamiento se están ampliando, y se están desarrollando continuamente nuevas técnicas y métodos para el diagnóstico y la evaluación de la gravedad. Antes de que se puedan realizar estudios clínicos, la viabilidad y la seguridad deben determinarse en una configuración reproducible y consistente, como se puede lograr en un modelo animal. Además, la investigación de la fisiopatología aguda de la EP requiere un modelo animal con una fisiología cardiovascular y pulmonar cercana a la humana. Se han desarrollado modelos tanto en roedores como en animales de mayor tamaño, es decir, cerdos6. La ventaja de un modelo animal grande es la posibilidad de utilizar técnicas clínicas y evaluar los equipos e intervenciones quirúrgicas utilizados en la práctica clínica. Sin embargo, la mayoría de estos modelos utilizan materiales artificiales, como esferas de plástico o globos oclusivos, o requieren procedimientos invasivos de gran tamaño para la colocación de bandas arteriales pulmonares para imitar la insuficiencia cardíaca derecha aguda 7,8,9. En un estudio se utilizó un filtro de vena cava inferior para crear trombosis in situ10. Sin embargo, esto lleva mucho tiempo y la carga de coágulos es difícil de controlar. Otros estudios han creado émbolos autólogos ex vivo, pero la EP ha sido de menor tamaño11,12. Por lo tanto, estos modelos podrían no ser adecuados para probar procedimientos intervencionistas.
Existe la necesidad de un modelo animal que pueda replicar la patología humana de la EP. Con base en estudios previos realizados por nuestro grupo 13,14,15,16, nos propusimos presentar un modelo porcino de EP aguda.
Protocolo
Este estudio se llevó a cabo con la aprobación de la Inspección Animal danesa (n.º de licencia 2021-15-0201-00944) y de conformidad con las directrices danesas y universitarias sobre el bienestar y la ética de los animales de laboratorio.
NOTA: Este estudio siguió las directrices ARRIVE 2.017. Se respetaron los principios de las 3R (Reemplazo, Reducción y Refinamiento) evaluando a cada animal repetidamente para que sirviera como su propio control, reduciendo así el número de animales necesarios y maximizando la información recopilada. Los cerdos utilizados en este modelo animal fueron hembras de matanza danesas de 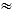 60 kg (un cruce de Yorkshire, Duroc y Landrace danés). Todos los cerdos siguieron el programa danés libre de patógenos específicos (SPF). Los cerdos fueron aclimatados en la granja de investigación una semana antes del estudio para entrenar el contacto humano. Los cerdos fueron alojados en corrales con pisos de concreto sólido y camas de paja. Cada corral medía 2,35 m x 2,9 m con corrales contiguos para permitir el contacto con el hocico. Los cerdos tenían libre acceso al agua y fueron alimentados dos veces al día con una dieta convencional para cerdos, añadiendo remolacha triturada para disminuir el aumento de peso. El establo tenía un ciclo de luz-oscuridad de 12:12 h (luces encendidas de 6 a 18 horas).
60 kg (un cruce de Yorkshire, Duroc y Landrace danés). Todos los cerdos siguieron el programa danés libre de patógenos específicos (SPF). Los cerdos fueron aclimatados en la granja de investigación una semana antes del estudio para entrenar el contacto humano. Los cerdos fueron alojados en corrales con pisos de concreto sólido y camas de paja. Cada corral medía 2,35 m x 2,9 m con corrales contiguos para permitir el contacto con el hocico. Los cerdos tenían libre acceso al agua y fueron alimentados dos veces al día con una dieta convencional para cerdos, añadiendo remolacha triturada para disminuir el aumento de peso. El establo tenía un ciclo de luz-oscuridad de 12:12 h (luces encendidas de 6 a 18 horas).
1. Anestesia, intubación y ventilación
- Preanestesiar al cerdo con una inyección intramuscular (0,1 mL/kg) que consiste en 2,5 mL de tiletamina (25 mg/mL), 2,5 mL de zolazepam (25 mg/mL), 2,5 mL de burofanol (10 mg/mL), 1,25 mL de ketaminol (100 mg/mL) y 6,25 mL de xilacina (20 mg/mL) para reducir el dolor, el estrés y la ansiedad potenciales del animal antes del transporte desde el establo de animales.
- Transportar al animal en una caja de transporte homologada con lecho de paja de trigo.
- Establecer acceso intravenoso a la llegada.
- Colocar un torniquete en la parte proximal de la oreja y apriétalo ligeramente para obtener estasis sanguínea venosa. Desinfecte la piel sobre una vena dos veces con un hisopo de etanol.
- Utilice un catéter venoso de 20 G para perforar la vena. Suelte el torniquete. Fije con cuidado el acceso correctamente para evitar desplazamientos.
- Compruebe la correcta colocación enjuagando el acceso con agua salina isotónica.
NOTA: Aparecerá una protuberancia subcutánea si el catéter ya no está en la vena. El establecimiento de un segundo acceso intravenoso en el oído opuesto puede considerarse como una contingencia.
- Mueva al animal a una mesa de operaciones y colóquelo en decúbito supino.
- Intuble al cerdo mediante laringoscopia directa con un tubo traqueal de tamaño 7,5 e inflar el manguito traqueal. Fije el tubo al hocico/cabeza del animal. Esto evitará la extubación involuntaria. Verifique la posición correcta del tubo observando el valor de dióxido de carbono espiratorio en la pantalla del ventilador.
- Conecte el tubo a un ventilador previamente probado y comience la ventilación mecánica.
- Elija la configuración de ventilación controlada por presión y dependiente por volumen y ajuste el volumen corriente (TV) a 8 mL/kg con ventilación de bajo flujo. Ajuste la presión positiva al final de la espiración (PEEP) a 5 cmH2O.
- Ajuste la fracción de oxígeno inspirado (FiO2) a normoxia (0,21) o superior, dependiendo del protocolo experimental. El valor objetivo de dióxido de carbono (EtCO2) al final de la espiración es de aproximadamente 5,0-5,5 kPa. Ajuste la frecuencia respiratoria (RR) para lograr esto.
- Iniciar y mantener la anestesia general a través del acceso intravenoso en el oído utilizando propofol a 4,0 mg/kg/h y fentanilo a 12,5 μg/kg/h. Verifique la falta de reflejos corneales y respuestas a estímulos dolorosos para asegurarse de que se esté administrando suficiente anestesia. Aumente la velocidad de infusión si hay reflejos o respuestas y compruebe si hay reflejos a intervalos regulares.
PRECAUCIÓN: No deje al animal desatendido en ningún momento durante el protocolo. Abstenerse de utilizar agentes bloqueantes neuromusculares, ya que pueden oscurecer los signos de una anestesia inadecuada. - Conecte cables de electrocardiograma (ECG) de 3 derivaciones y un sensor de oximetría de pulso para controlar la frecuencia cardíaca, el ritmo cardíaco y la saturación de oxígeno.
- Controle la temperatura central con un termómetro rectal. Apunte a una temperatura porcina normal de 38-39 °C. Si es necesario, caliente al animal con una manta térmica de aire forzado.
- Inserte un catéter de vejiga urinaria y conecte el extremo externo a una bolsa de muestras de orina.
- Aplique ungüento veterinario para los ojos para prevenir la sequedad.
2. Accesos intravasculares ecoguiados
NOTA: Los accesos intravasculares se establecen como se ha descrito anteriormente18.
- Establecer el acceso intravascular en la vena yugular externa derecha, la vena femoral derecha y la arteria femoral izquierda como mínimo.
NOTA: Se puede obtener más acceso dependiendo del protocolo experimental.- Afeitar y desinfectar la piel con clorhexidina.
- Bajo un procedimiento estéril, use un dispositivo de ultrasonido para guiar un catéter venoso de 17 G a la posición intravascular.
- Retire la aguja del catéter venoso y utilice la técnica de Seldinger para insertar una guía. Retire el catéter venoso y deje la guía en su lugar.
- En el punto de acceso, haga una pequeña incisión en la piel e inserte la funda sobre la guía.
- Para asegurar la colocación correcta de las vainas, extraiga sangre de cada vaina con una jeringa de 10 mL o 20 mL. Una vaina correctamente colocada no tendrá resistencia cuando se aspire sangre o se enjuague el acceso con solución salina.
- Suturar las vainas a la piel (talla 4.0).
- Conecte la vaina de la arteria femoral a un transductor de presión. Calibre a la presión atmosférica y observe la pantalla para ver si la curva de presión arterial es correcta.
- Conecte las bombas de infusión con solución salina isotónica a las vainas venosas. Esto evita la coagulación de la sangre intraluminal.
- Para contrarrestar la hipovolemia del ayuno previo al experimento y extraer sangre para crear émbolos, iniciar una infusión en bolo de 800 ml durante 30-60 min en la bomba conectada a la vena yugular externa derecha.
- Para corregir la pérdida horaria de líquidos por la transpiración y la micción, iniciar una infusión de 4 mL/kg/h en la bomba conectada a la vena femoral.
3. Formación de coágulos
- Desempaque un sistema de oxigenación cardiopulmonar y ubique los tubos de cloruro de polivinilo (PVC) no recubiertos de heparina con un diámetro externo e interno de 1/2 pulgadas y 3/32 pulgadas, respectivamente. Cortar en trozos de ~30 cm de longitud. Fabrica siete tubos en total.
NOTA: Se pueden usar tubos de PVC de menor diámetro si se prefieren émbolos más delgados. - Cierre de un extremo de los tubos con pinzas hemostáticas grandes.
- Pausa la infusión de solución salina isotónica en una de las vainas venosas y extrae un total de 180 mL de sangre.
- Divida la sangre en seis tubos de PVC (30 mL x 6) y cierre la parte superior del tubo de PVC con otra pinza de hemostático. Cuelgue los tubos verticalmente durante un mínimo de 3 h a temperatura ambiente (RT) (Figura 1A).
- Enjuague la solución salina en la vaina y reinicie la infusión de solución salina.
4. Inserción guiada por fluoroscopia de la vaina 26 F
PRECAUCIÓN: Se debe usar equipo de protección, como delantales de plomo y collarines tiroideos, contra la radiación ionizante siempre que se use fluoroscopia.
- Detenga la bomba de infusión conectada a la vaina en la vena yugular externa derecha.
- Inserte una guía larga y extra rígida a través de la funda. Utilice la fluoroscopia para observar el alambre que sale de la vaina. Avance el alambre, guiado por fluoroscopia, caudal a través de las venas centrales superiores, la vena cava superior (VCS), la aurícula derecha (AR) y hacia la vena cava inferior (VCI).
NOTA: Pueden ocurrir eventos sistólicos prematuros a medida que el cable pasa a través de la AR. No se debe sentir resistencia en ningún punto mientras se avanza el cable. - Extraiga la vaina lentamente mientras observa por fluoroscopia que la guía permanece en la VCI. Comprima el punto de entrada con una servilleta estéril al retraer la funda.
- Utilice la técnica de Seldinger para cambiar la vaina por un dilatador de 16 F. Extienda la incisión en la piel si hay demasiada resistencia. Avance de la vaina hacia la circulación venosa guiado por fluoroscopia. Remoje previamente con solución salina para minimizar la resistencia (Figura 2B).
NOTA: Es extremadamente importante seguir el curso de la guía con el dilatador y asegurarse de que el dilatador no se desvíe del alambre y, por lo tanto, de la luz del vaso. - Utilice la técnica de Seldinger para cambiar el dilatador 16 F por la vaina 26 F. Extienda la incisión cutánea al menos 10 mm. Avance la vaina 26 F lentamente, guiada por fluoroscopia, a través de las venas grandes hasta que la punta de la vaina, indicada por un marcador radiopaco (no el dilatador), llegue a la VCS (Figura 2D). Espere algo de resistencia al avanzar a través de capas de músculo.
NOTA: Si la resistencia es demasiado grande, se puede retraer la vaina y hacer una incisión más grande y profunda que abarque el tejido muscular cerca del punto de entrada. - Bajo la guía de la fluoroscopia, retraiga con cuidado el dilatador y la guía fuera del cerdo mientras se asegura de que la vaina permanezca en su lugar.
- Extraiga sangre para asegurarse de que la vaina aún esté en su lugar. Enjuague con 90 ml de solución salina para asegurarse de que se enjuague toda la longitud de la vaina.
- Coloque una pila de servilletas estériles debajo del extremo externo de la funda (y debajo de la cortina estéril) para elevarla por encima del nivel del corazón y evitar volver a llenar la sangre en la funda (Figura 2C).
- Vuelva a conectar la bomba de infusión y reanude la infusión de solución salina.
5. Cateterismo cardíaco derecho
- Enjuague ambos puertos de un catéter Swan-Ganz (SG) con agua salina. Comprueba si el globo se infla correctamente.
- Conecte cada uno de los puertos del catéter SG a una llave de paso de 3 o 4 vías. Conecte un puerto no utilizado de la llave de paso a los transductores de presión. El puerto restante de cada llave de paso se puede utilizar posteriormente para la toma de muestras de gases en sangre venosa y pulmonar arterial.
- Restablezca los transductores a la presión atmosférica sosteniendo los puertos distales del catéter SG en el nivel axilar medio del cerdo.
- Inserte el catéter SG a través de la vaina 26 F (Figura 2C).
- Utilice la fluoroscopia para observar cuándo el extremo distal del catéter SG sale de la vaina. Observa que el globo se infla correctamente. La inflación debe estar libre de resistencias.
NOTA: El globo puede dañarse si se infla dentro de la funda. Se utiliza una vista antero-posterior para todos los procedimientos. Nunca retraiga el catéter mientras el balón está inflado. Esto puede hacer que el globo se desprenda o dañe las válvulas y las cuerdas. - Con el balón inflado, avance lentamente el balón a través de las venas centrales, la AR, el ventrículo derecho (VD) y hasta la arteria pulmonar principal (AMP) (Figura 2E).
- Observe que la señal de presión y la forma de la curva de presión cambian a medida que el puerto distal se mueve hacia el RV y nuevamente hacia el MPA.
- Asegúrese de que la señal de presión cambie de 2-8 mmHg en la circulación venosa central a una presión sistólica y diastólica del VD de 20-30 mmHg y 0-5 mmHg, respectivamente. Al avanzar hacia el MPA, asegúrese de que la presión sistólica sea de 25-35 mmHg y la diastólica de 10-15 mmHg.
- Desinfla el globo. Asegúrese de que el catéter SG aún esté en su lugar mediante el uso de fluoroscopia y la sobrerradiación de las señales y curvas de presión.
NOTA: El experimento se puede pausar en este punto.
6. Montaje del dispositivo de administración de émbolo (Figura 3)
NOTA: El dispositivo de émbolo consta de dos partes, que a partir de ahora se denominan parte A y parte B (Figura 3).
- Descomprima el resto del sistema de oxigenación cardiopulmonar con una línea de cardioplejia integrada y la cánula de perfusión aórtica en condiciones estériles.
- Del equipo de autotransfusión, ubique el tubo de silicona de 10 cm de largo (3/8 de pulgada de diámetro externo y 3/32 de pulgada interno) conectado al fondo del recipiente de cardiotomía y la pieza de conexión de 3/8 a 1/4 de pulgada conectada al tubo de silicona (Figura 3A).
- Corta el tubo de silicona en dos tubos del mismo tamaño. Deje la mitad sin el conector a un lado por ahora.
- Localiza la línea principal rápida. Corte la línea aproximadamente a 20 cm del extremo de la cerradura Luer y conecte el extremo abierto de la línea de cebado rápido al extremo de 1/4 de pulgada de la pieza del conector (Figura 3A).
- Ubique una pieza de conector de 3/8 de pulgada a 1/2 pulgada. Conéctalo al extremo abierto del tubo de silicona. La Parte A ya está completa (Figura 3A, C).
- Conecte la mitad restante del tubo de silicona al extremo distal de la cánula de perfusión aórtica. Ubique y conecte cualquier conector de 3/8 de pulgada a 1/2 pulgada al extremo abierto del tubo de silicona. La parte B ya está completa (Figura 3B, C).
7. Evaluación de referencia
NOTA: Es importante lograr la estabilización hemodinámica después de la instrumentación y antes de la evaluación basal. Se recomiendan las siguientes medidas. El alcance de la medición de referencia se puede ajustar de acuerdo con el protocolo específico.
- Registre los valores de la presión arterial sistémica y pulmonar, así como la presión venosa central.
NOTA: Las presiones arteriales pulmonares aceptables son una presión sistólica < 40 mmHg y una presión arterial pulmonar media (mPAP) ≤ 20 mmHg. - Registre la temperatura corporal central, la saturación periférica y la frecuencia cardíaca.
- En el respirador, registre los valores de FiO2, EtCO2, TV, volumen por minuto (MV), RR y presión máxima (Ppeak).
- Extraiga muestras de sangre de 1 mL de la vaina arterial y del puerto distal (amarillo) del catéter SG (venoso mixto) para el análisis de gases en sangre.
- Si está presente, corrija cualquier desequilibrio electrolítico y/o glucosa baja en sangre para alcanzar valores dentro del rango normal.
- Dependiendo del protocolo experimental, se extraigan muestras de sangre venosa en recipientes apropiados para su posterior análisis.
- Obtención del gasto cardíaco (CO) por termodilución a través del catéter SG. Asegúrese de obtener un promedio de tres mediciones dentro de un margen del 10%.
- Obtener presión en cuña capilar pulmonar (PAWP) a través del catéter SG.
8. Evaluación de coágulos
NOTA: Después de un mínimo de 3 h, los émbolos están listos para ser inducidos. El tubo de PVC contendrá el émbolo formado y el sobrenadante líquido. Si la sangre no se ha coagulado, espere otros 30 minutos antes de extraer otro émbolo.
- Recupere uno de los tubos de PVC que contiene un émbolo completamente formado y colóquelo suavemente en una servilleta quirúrgica, desechando el sobrenadante. Asegúrese de que el émbolo se sienta rígido y estable para la inyección (Figura 1B).
9. Inducir embolia pulmonar aguda (Figura 4)
- Coloque una bolsa de 1000 ml de solución salina isotónica en una bolsa de infusión a presión. Inserte un equipo de infusión e infle la bolsa de presión hasta al menos 200 mmHg (pero no más allá de la presión recomendada).
- Tome la parte A del dispositivo de administración de émbolo y conéctelo al puerto lateral de la llave de paso de 3 vías (Figura 4A).
- Conecte el último tubo de PVC al extremo abierto de la pieza A.
- Coloque un émbolo en el tubo y llene el sistema con solución salina (Figura 4B).
- Conecte la pieza B al otro extremo del tubo de PVC (Figura 4C).
NOTA: Asegúrese de que todo el sistema esté lleno de solución salina. - Inserte el dispositivo de émbolo en la vaina de 26 F e infunda el émbolo abriendo el flujo de solución salina presurizado durante aproximadamente 5 s (Figura 4D).
PRECAUCIÓN: Observe cuidadosamente los parámetros vitales antes y después de la inyección de un émbolo. Si no se observa ninguna respuesta, es posible que la embolia aún esté en tránsito y que se lave la solución salina durante 3 s adicionales.
10. Modelo de EP aguda (Figura 5 y Figura 6)
- Induzca los émbolos hasta que la mPAP se haya duplicado desde el inicio o hasta que se induzcan los seis émbolos. Monitorizar la respuesta hemodinámica y esperar a que se estabilice antes de inducir otro émbolo.
PRECAUCIÓN: El cerdo puede volverse hemodinámicamente inestable durante la inducción de un émbolo. Si la presión arterial sistémica media disminuye a 50 mmHg, puede ser necesario un bolo de 0,02 mg de norepinefrina. Repita el bolo si es necesario. - Después de inyectar el número adecuado de émbolos, el cerdo está estable durante 30 min.
NOTA: La manifestación de la EP es una condición hiperdinámica. Por lo tanto, el mPAP debe estar en una meseta antes de proceder a la sección 11.
11. Hemodinamia
- Después de 30 min de estabilización, realizar una evaluación de EP aguda en el registro de la evaluación basal realizada en la sección 7.
- Dependiendo del protocolo, ahora pueden comenzar las intervenciones.
12. Angiografía pulmonar por tomografía computarizada (CTPA) (Figura 7)
NOTA: Esta parte del protocolo puede ser excluida dependiendo del alcance científico.
- Mientras aún está intubado y anestesiado, conecte el cerdo a un ventilador mecánico transportable y transpórtelo a las instalaciones del CTPA.
- Realizar la CTPA durante la apnea inspiratoria antes de la inducción de la EP como parte de la evaluación basal.
- Utilice el control automático de exposición a 120 KV con una colimación ajustada a 0,5 x 80 mm.
- A través de una vena del oído mediante una bomba de inyección automatizada, inyecte 75 mL de solución de contraste de Iomeron (350 mg/mL) con un flujo de 0,5 mL/s seguido de 30 mL de solución salina inyectada a 3,0 mL/s.
- Transporta el cerdo de vuelta a la sala del operador y continúa con el protocolo.
- Después de la inducción de la EP, repita los pasos 12.1-12.2 para una evaluación de la EP.
13. Otros métodos
- Dependiendo del alcance del trabajo científico, evalúe al cerdo en consecuencia.
NOTA: En el modelo se pueden aplicar numerosos métodos de evaluación, no descritos en detalle en este protocolo: resonancia magnética, ecocardiografía transesofágica, registros biventriculares del bucle presión-volumen, análisis bioquímicos, fisiológicos ex vivo e histológicos 13,14,15,16,18,19,20.
14. Eutanasia y necropsia
- Eutanasiar al cerdo con una dosis letal de pentobarbital (1,5 mL/kg, 400 mg/mL) al final del protocolo.
NOTA: Dependiendo del protocolo, se puede realizar una necropsia y obtener un muestreo histológico (Figura 8).
Resultados
En un análisis agrupado de cerdos incluido en estudios previos, presentamos los resultados que caracterizan el modelo de EP aguda descrito en este protocolo15,16. Dos cerdos murieron por insuficiencia cardíaca derecha aguda después de la embolia pulmonar. En total, incluimos 24 cerdos.
Hemodinámica
La respuesta después de cada émbolo es evidente en la Figura 5. La inducción de EP (5 ± 1) provocó un aumento inmediato de la PAPm (17 ± 3 mmHg a 33±6 mmHg, p < 0,0001) y de la FC (50 ± 9 latidos·min-1 a 63 ± 6 latidos·min-1, p < 0,0003) acompañada de una disminución del CO (5,0 ± 0,8 L/min a 4,5 ± 0,9 L/min, p < 0,037) y del EtCO2 (Figura 5 y Figura 6). La PAM se mantuvo inalterada (79 ± 9 mmHg a 77 ± 11 mmHg, p = 0,1955). (Figura 6). La inducción de la EP resultó en elevación de la troponina T (TnT)13, aumento de la poscarga del VD, desacoplamiento ventrículo-arterial del VD y dilatación del VD, lo que la hace compatible con la EP de riesgo intermedio (datos no mostrados)1,14.
Imagenológico
Para evaluar la carga de coágulos, se calculó un porcentaje de obstrucción pulmonar como se describió anteriormente (Figura 7)15. En resumen, el porcentaje se calculó como 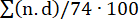 , donde n es la presencia de émbolo segmentario, y d es el grado de obstrucción en una escala de 0 a 2, calculando con un máximo de 74 puntos. La ATPC realizada al inicio del estudio no mostró signos de EP (Figura 7A), pero después de la inducción de la EP se evidenciaron múltiples émbolos en las arterias pulmonares en la CTPA, lo que produjo un aumento en el porcentaje de obstrucción de la TC (0 [0 - 0] a 57,1% [IQR 38,8-63,3]) (Figura 7C-E).
, donde n es la presencia de émbolo segmentario, y d es el grado de obstrucción en una escala de 0 a 2, calculando con un máximo de 74 puntos. La ATPC realizada al inicio del estudio no mostró signos de EP (Figura 7A), pero después de la inducción de la EP se evidenciaron múltiples émbolos en las arterias pulmonares en la CTPA, lo que produjo un aumento en el porcentaje de obstrucción de la TC (0 [0 - 0] a 57,1% [IQR 38,8-63,3]) (Figura 7C-E).

Figura 1: Formación de émbolo. (A) Tubos de PVC llenos de 30 mL de sangre, cada uno colgando verticalmente durante un mínimo de 3 h. (B) Se formó un émbolo. Haga clic aquí para ver una versión más grande de esta figura.
Figura 2: Inserción de la vaina 26 F y cateterismo cardíaco derecho. (A) Mesa con el equipo necesario para reemplazar la vaina 8 F, utilizando un dilatador 16 F (flecha roja) y una guía larga extrarrígida (flecha blanca), en una vaina 26 F (flecha doble negra), incluyendo el catéter Swan-Ganz (SG) (punta de flecha). (B) El alambre con el dilatador 16 F. (C) La funda 26 F en su lugar con las servilletas debajo de la cortina estéril para elevar el extremo. El SG se inserta en la funda 26 F. (D) Fluoroscopia que muestra la 26 F (flecha que indica el anillo radiopaco de la vaina) con el dilatador (marcado con líneas punteadas) y el alambre (flecha punteada). (E) Fluoroscopia que muestra la vaina 26 F (flecha) con el catéter SG (punta de flecha). Haga clic aquí para ver una versión más grande de esta figura.
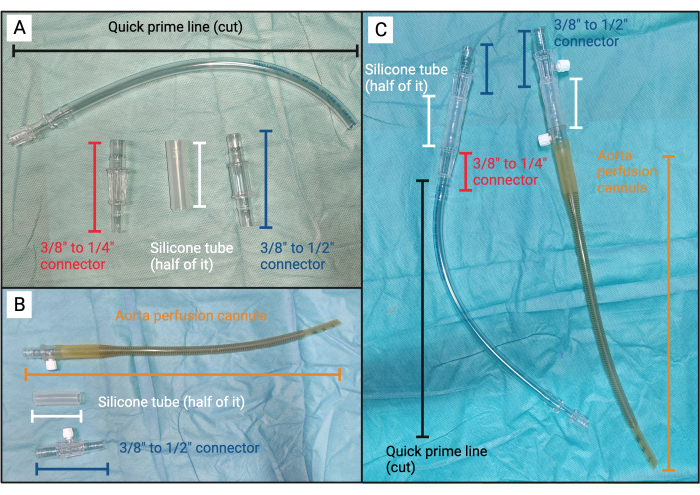
Figura 3: Dispositivo de émbolo. (A) Componentes sin ensamblar para la parte A del dispositivo de émbolo. (B) Componentes sin ensamblar para la parte B del dispositivo de émbolo. (C) De izquierda a derecha: parte A ensamblada del dispositivo de émbolo y parte B del dispositivo de émbolo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Inducción de émbolo. (A) De izquierda a derecha: la parte B ensamblada del dispositivo de émbolo, el tubo de PVC y la parte A del dispositivo de émbolo conectadas al equipo de infusión por el puerto lateral de 3 vías. (B) El tubo de PVC se conecta a la parte A del dispositivo de émbolo y se coloca un émbolo en el tubo. (C) Dispositivo de émbolo completamente ensamblado con un émbolo. (D) El dispositivo de émbolo (flecha punteada negra) con un émbolo (flecha negra) se inserta en la vaina 26 F (flecha blanca) con el catéter Swan Ganz (flecha punteada blanca) en su lugar. Haga clic aquí para ver una versión más grande de esta figura.
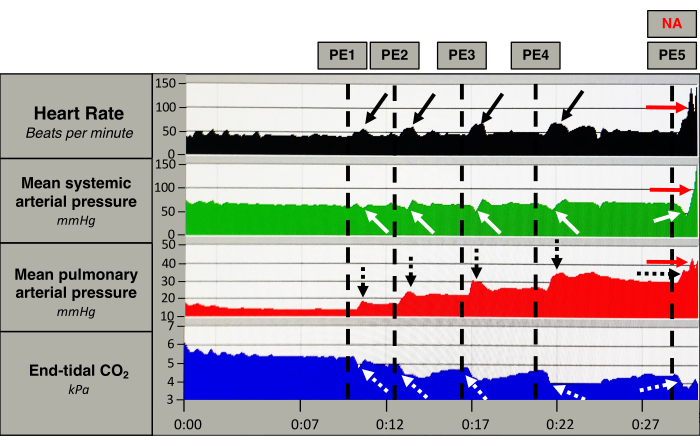
Figura 5: Respuesta hemodinámica aguda. Mediciones de la frecuencia cardíaca (negro), la presión arterial sistémica media (verde), la presión arterial pulmonar media (rojo) y el CO2 al final de la espiración (azul) de un cerdo. Las líneas punteadas verticales marcan la inducción de un émbolo (EP). Después de la inducción de la EP, la frecuencia cardíaca aumenta momentáneamente (flechas negras), junto con un aumento persistente de la presión arterial pulmonar media (flecha punteada negra). La presión arterial sistémica media disminuye ligeramente después de cada EP, y la disminución se hace mayor después de cada émbolo (flechas blancas). El CO2 al final de la espiración disminuye bruscamente después de cada PE (flechas punteadas blancas). Después de la quinta EP, el cerdo recibe un bolo de norepinefrina (NA) que provoca un aumento de la frecuencia cardíaca y de la presión arterial sistémica y pulmonar media (flechas rojas). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Respuesta fisiológica aguda. Comparación de (A) presión arterial pulmonar media, (B) presión arterial media, (C) frecuencia cardíaca y (D) gasto cardíaco al inicio y después de la inducción de embolia pulmonar (EP). Los puntos de tiempo se comparan con pruebas t de muestra emparejada. Haga clic aquí para ver una versión más grande de esta figura.
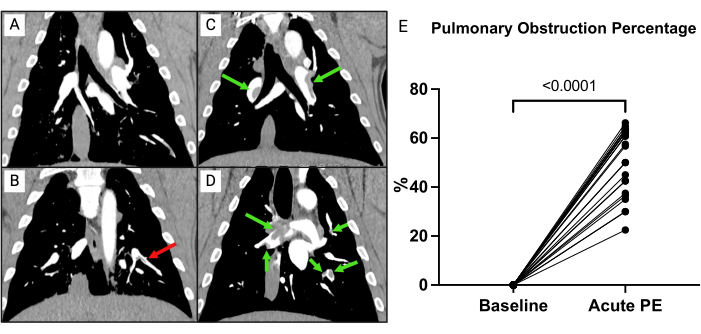
Figura 7: Angiografía pulmonar por tomografía computarizada (CTPA). (A) Cerdo después de la instrumentación completa, recibiendo solo solución salina. No hay signos de material embólico. (B) CTPA de un cerdo después de la instrumentación completa que recibe solo solución salina. Hay un émbolo sin hendidura (flecha roja). (C,D) Inmediatamente después de la inducción de émbolos (flechas verdes) de dos cerdos diferentes. (E) Porcentaje de obstrucción pulmonar al inicio en comparación con después de la inducción de embolia pulmonar (EP). Los puntos de tiempo se comparan con pruebas t de muestra emparejada. Haga clic aquí para ver una versión más grande de esta figura.
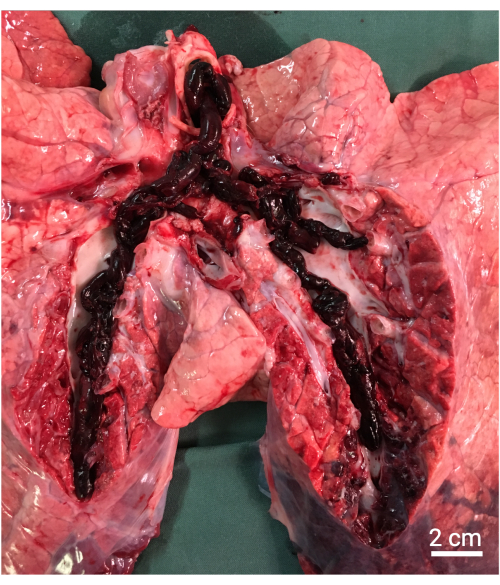
Figura 8: Necropsia. Hallazgos macroscópicos que muestran los grandes émbolos autólogos en las arterias pulmonares. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este trabajo se describe un modelo porcino de EP aguda de riesgo intermedio utilizando émbolos autólogos que es mínimamente invasivo y reproducible.
Hay algunos pasos críticos en este protocolo. En primer lugar, la dilatación del acceso en la vena yugular externa derecha es crucial para el modelo, ya que sirve como punto de acceso para los émbolos. Al avanzar la vaina grande, es esencial seguir la guía del alambre rígido bajo fluoroscopia continua para evitar la ruptura o disección de los vasos principales o las cámaras cardíacas derechas. Si se encuentra resistencia, no aplique una presión excesiva, sino que reemplace el cable y asegure una dilatación óptima del acceso. Además, los cerdos son arritmogénicos y la instrumentación puede causar fibrilación auricular. Por lo tanto, es crucial observar al cerdo de cerca.
En segundo lugar, el modelo tiene un fenotipo hemodinámico de EP de riesgo intermedio en la fase aguda. La valoración cuidadosa del número óptimo de émbolos puede suponer un reto. Si el volumen de los émbolos supera la capacidad del corazón para soportar una presión alta, el cerdo puede experimentar insuficiencia cardíaca derecha aguda y la muerte. El enfoque a tórax cerrado para la inducción de la embolia pulmonar se basa en que el investigador monitoree de cerca la respuesta hemodinámica, como el aumento de mPAP, la disminución de EtCO2, la FC elevada o la reducción de la presión arterial sistémica, durante la inducción del émbolo. Si la hipotensión sistémica es grave y prolongada, sugiere que se ha alcanzado la carga máxima de trombo. Al dejar pasar suficiente tiempo entre émbolos, se reduce el riesgo de colapso repentino. Si no hay una respuesta aparente, el émbolo puede estar en tránsito dentro de la vaina o las cavidades del lado derecho del corazón. A continuación, se recomienda volver a lavar y esperar como una inducción inmediata de un nuevo émbolo, que podría conducir a dos émbolos simultáneos, que pueden ser mortales.
En tercer lugar, el modelo se establece sin el uso de heparina. El investigador debe prestar mucha atención a tener siempre solución salina conectada a los accesos y recuerde extraer el derrame y enrasar con solución salina antes de usarla. Si no se hace, se formará material embólico que puede desprenderse, lo que hace que se induzcan émbolos más pequeños en todo el protocolo que pueden interferir con los resultados (Figura 4B).
El modelo contribuye a una respuesta fisiológica realista, debido a la configuración de tórax cerrado, pero también debido a la utilización de material embólico autólogo. En la búsqueda de desarrollar un fenotipo tromboembólico agudo en animales, se han desarrollado varios modelos, la mayoría de los cuales requieren el uso de material inorgánico, tratamientos farmacológicos y/o ligadura de la arteria pulmonar para inducir hipertensión pulmonar aguda e insuficiencia cardíaca VD en un modelo animal grande 6,7,8,21,22 . En consecuencia, estos modelos no imitan la presentación clínica de un paciente con EP. Un estudio ha creado el material tromboembólico in vivo por oclusión de la cueva de la vena inferior para crear una trombosis venosa profunda (TVP)10. Sin embargo, la creación de la TVP lleva mucho tiempo y la inducción de la TVP es insuficiente para crear un modelo con disfunción del VD.
En el presente modelo, el objetivo fue crear un fenotipo hemodinámico que sea comparable con la EP de riesgo intermedio, lo que se logró en el modelo después de 5 ± 1 émbolos. La carga del coágulo puede modificarse en función del alcance del modelo para lograr el fenotipo hemodinámico deseado, o se puede utilizar una carga fija de trombo. Sin embargo, un estudio de nuestro grupo demostró que los cambios hemodinámicos en la presión pulmonar y la disfunción del VD no están directamente relacionados con la carga de coágulos por sí sola23. El estudio encontró que la inducción del primer émbolo causó el mayor aumento en la mPAP en comparación con las inducciones embólicas posteriores. Sin embargo, la poscarga del VD aumentó con la inducción del tercer émbolo.
La configuración experimental utilizada en este estudio ofrece oportunidades adicionales para investigar la respuesta fisiopatológica en relación con las imágenes y los cambios hemodinámicos 13,14,15. Los estudios han investigado la respuesta aguda del VD en las primeras 12 horas después de un evento de EP de riesgo intermedio14. Otro estudio ha utilizado el modelo para observar la respuesta prolongada un mes después de la inducción de material embólico15. Además, el modelo se ha utilizado para probar tratamientos farmacológicos en fase aguda y subaguda 16,21,22,24,25,26,27. Uno de los estudios encontró que el uso de oxigenoterapia al 40% deFiO2 disminuyó la poscarga y el trabajo mecánico del VD. El modelo ha demostrado ser versátil.
El protocolo tiene algunas limitaciones. En primer lugar, los émbolos se forman poco antes de la inducción y se crean ex vivo, lo que puede ser una limitación, ya que se ha descubierto que el trombo creado in vitro consiste en menos fibrina28. Sin embargo, la ventaja es que la carga de coágulos se puede controlar mientras se sigue utilizando material autólogo. En segundo lugar, los animales están completamente anestesiados durante el protocolo, y la anestesia puede afectar la respuesta hemodinámica. Sin embargo, hacer mediciones repetidas iguala cualquier efecto.
El modelo se establece en cerdos de sacrificio y no modificados genéticamente ni criados de forma aislada. Los cerdos pueden ser propensos a enfermedades que pueden afectar el sistema cardiovascular y la presión pulmonar29. Por lo tanto, es fundamental realizar una evaluación basal del estado hemodinámico.
En conclusión, presentamos un modelo porcino utilizando émbolos autólogos. El modelo presenta un fenotipo comparable con la EP de riesgo intermedio. Este modelo sirve como una herramienta valiosa para probar nuevos tratamientos intervencionistas y farmacéuticos, así como para capacitar a médicos y trabajadores profesionales de la salud en procedimientos intervencionistas.
Divulgaciones
AA ha recibido honorarios de orador (ABBOTT, Gore Medical, Angiodynamics, EPS Vascular y Jannsen), y es consultor de Inari Medical.
Agradecimientos
Deseamos expresar nuestro más sincero agradecimiento por la tremenda dedicación y el arduo trabajo demostrado por el personal del Departamento de Medicina Clínica de la Universidad de Aarhus para completar los experimentos. Además, queremos agradecer a nuestros colaboradores del Departamento de Medicina Forense de la Universidad de Aarhus y del Departamento de Radiología del Hospital General de Massachusetts, por la inestimable ayuda en la realización y análisis de la angiografía pulmonar por TC. El trabajo ha sido apoyado por la Escuela de Graduados de la Universidad de Aarhus, la Fundación Karen Elise Jensen, la Fundación Danesa del Corazón, la subvención NIH nº 1R01HL168040-01, la Fundación Novo Nordisk [NNF17OC0024868], el Mindefond de Holger og Ruth Hesse, la Fundación Laerdal [3374], la Fundación Alfred Benzons, A.P. Møller Fonden, Direktør Emil C. Hertz og hustru Inger Hertz Fond, P.A. Messerschmidt og Hustrus fond, y Helga og Peter Kornings Fond.
Materiales
| Name | Company | Catalog Number | Comments |
| 12L-RS | GE Healthcare Japan | 5141337 | Ultrasound probe |
| 50 mL BD Luer-Lock | BD Plastipak | 300865 | |
| Adhesive Aperature Drape (OneMed) | evercare | 1515-01 | 75 cm x 90 cm (hole: 6 cm x 8 cm) |
| Alaris GP Guardrails plus | CareFusion | 9002TIG01-G | Infusion pump |
| Alaris Infusion set | BD Plastipak | 60593 | |
| Alcohol swap | MEDIQ Danmark | 3340012 | 82% ethanol, 0.5% chlorhexidin, skin disinfection |
| Amplatz Support Wire Guide Extra-Stiff | Cook Medical | THSF-25-260-AES | diameter: 0.025 inches, length: 260 cm |
| Aortic Perfusion Cannula | Edwards Lifesciences | AA024TFTA | Size: 24F. Length: 30 cm. |
| BD Connecta | BD | 394601 | Luer-Lock |
| BD Emerald | BD | 307736 | 10 mL syringe |
| BD Platipak | BD | 300613 | 20 mL syringe |
| BD Venflon Pro | Becton Dickinson Infusion Therapy | 393204 | 20 G |
| BD Venflon Pro | Becton Dickinson Infusion Therapy | 393208 | 17 G |
| Butomidor Vet | Richter Pharma AG | 531943 | 10 mg/mL |
| Chlorhexidine 0.5% | Meda AB | N/A | |
| Cios Connect S/N 20015 | Siemens Healthineers | N/A | C-arm |
| CP Oxygenation System Adult With Fusion and Cardioplegia 1/B | Medtronic | M450311W | Custom cardiopulmonary oxygenation system including a cardioplegia line. |
| D-LCC12A-01 | GE Healthcare Finland | N/A | Pressure measurement monitor |
| Durapore | 3M | N/A | Adhesive tape |
| E-PRESTIN-00 | GE Healthcare Finland | 6152932 | Respirator tubes |
| Euthanimal | Alfasan | 136278 | Pentobarbitalnatrium 400 mg/mL (0.5 mL/kg for euthanasia) |
| Favorita II | Aesculap | GT104 | |
| Fentanyl | B. Braun | 71036 | 50 µg/mL |
| Glucose isotonic | SAD | 419358 | 55 mg/mL Isotonic glucose (500 mL bag) |
| Gore DrySeal Flex Introducer Sheath | GORE | DSF2633 | Size: 26 French. Working length: 33 cm. |
| Ketaminol Vet | MSD/Intervet International B.V. | 511519 | 100 mg/mL |
| Lawton 85-0010 ZK1 | Lawton | N/A | Laryngoscope |
| Lectospiral | VYGON | 1159.90 | 400 cm (Luer-LOCK) |
| MBH qufora | MBH-International A/S | 13853401 | Urine bag |
| Natriumchlorid | Fresenius Kabi | 7340022100528 | 9 mg/mL Isotonic saline |
| Noradrenalin | Macure Pharma | 425318 | 1 mg/mL |
| PICO50 Aterial Blood Sampler | Radiometer | 956-552 | 2 mL |
| Portex Tracheal Tube | Smiths Medical | 100/150/075 | Cuffed Clear Oral/Nasal Murphy Eye |
| Pressure Extension set | CODAN | 7,14,020 | Tube for anesthetics, 150 cm long, inner diameter 0.9 mm |
| Propolipid | Fresenius Kabi | 21636 | Propofol, 10 mg/mL |
| Radiofocus Introducer II | Radiofocus/Terumo | RS+B80N10MQ | 7 + 8F sheaths |
| Rompun Vet | Beyer | 86450917 | Xylazin, 20 mg/mL |
| Rüsch Brilliant AquaFlate Glycerine | Teleflex | 178000 | Bladder catheter, size 14 |
| S/5 Avance | Datex-Ohmeda | N/A | Mechanical ventilator |
| Safersonic Conti Plus & Safergel | SECMA medical innovation | SAF.612.18120.WG.SEC | 18 cm x 120 cm (Safersonic Sterile Transducer Cover with Adhesive Area and Safergel) |
| Standard Dilator | Cook Medical | G01212 | Size: 16 French. Length: 20 cm. |
| Swan-Ganz CCOmbo | Edwards Lifesciences | 744F75 | 110 cm |
| TruWave Pressure Monitoring Set | Edwards Lifesciences | T434303A | 210 cm |
| Vigilance VGS Patient Monitor | Edwards Lifesciences | N/A | |
| Vivid iq | GE Medical Systems China | Vivid iq | |
| Zoletil 50 Vet (tiletamin 125 mg and zolazepam 125 mg) | Virbac | 83046805 | Zoletil Mix for pigs: 1 vial of Zoletil 50 Vet (dry matter); add 6.25 mL Xylozin (20 mg/mL), 1.25 mL ketamin (100 mg/mL) and 2.5 mL Butorphanol (10 mg/mL). Dose for pre-anesthesia: 0.1 mL/kg as intramuscular injection |
Referencias
- Konstantinides, S. V., et al. ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The task force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur. Heart J. 41 (4), 543-603 (2019).
- Wendelboe, A. M., Raskob, G. E. Global burden of thrombosis. Circ. Res. 118 (9), 1340-1347 (2016).
- Becattini, C., et al. Acute pulmonary embolism: mortality prediction by the 2014 European Society of Cardiology risk stratification model. Eur. Respir. J. 48 (3), 780-786 (2016).
- Wood, K. E. Major Pulmonary embolism: Review of a pathophysiologic approach to the golden hour of hemodynamically significant pulmonary embolism. Chest. 121 (3), 877-905 (2002).
- Bĕlohlávek, J., Dytrych, V., Linhart, A. Pulmonary embolism, part I: Epidemiology, risk factors and risk stratification, pathophysiology, clinical presentation, diagnosis, and nonthrombotic pulmonary embolism. Exp Clin Cardiol. 18 (2), 129-138 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Tsang, J. Y., Lamm, W. J., Starr, I. R., Hlastala, M. P. Spatial pattern of ventilation-perfusion mismatch following acute pulmonary thromboembolism in pigs. J Appl Physiol. 98 (5), 1862-1868 (2005).
- Böttiger, B. W., et al. Inhaled nitric oxide selectively decreases pulmonary artery pressure and pulmonary vascular resistance following acute massive pulmonary microembolism in piglets. Chest. 110 (4), 1041-1047 (1996).
- Kudlička, J., et al. Pig model of pulmonary embolism: where is the hemodynamic break point. Physiol Res. 62 (Suppl 1), S173-S179 (2013).
- Barbash, I. M., et al. Experimental model of large pulmonary embolism employing controlled release of subacute caval thrombus in swine. J Vasc Interv Radiol. 22 (10), 1471-1477 (2011).
- Beam, D. M., et al. Comparison of isoflurane and α-chloralose in an anesthetized swine model of acute pulmonary embolism producing right ventricular dysfunction. Comp Med. 65 (1), 54-61 (2015).
- Pereira, D. J., et al. Near-fatal pulmonary embolism in an experimental model: hemodynamic, gasometric and capnographic variables. Rev Bras Cir Cardiovasc. 26 (3), 462-468 (2011).
- Schultz, J., et al. A porcine in-vivo model of acute pulmonary embolism. Pulm. Circ. 8 (1), 2045893217738217 (2018).
- Lyhne, M. D., et al. Right ventricular adaptation in the critical phase after acute intermediate-risk pulmonary embolism. Eur Heart J Acute Cardiovasc Care. 10 (3), 243-249 (2020).
- Dragsbaek, S. J., et al. A porcine model of human-like chronic thromboembolic pulmonary disease. Thromb. Res. 231, 25-28 (2023).
- Merit, V. T., et al. Changes in pulmonary vascular resistance and obstruction score following acute pulmonary embolism in pigs. Crit Care Explor. 6 (2), e1040 (2024).
- NC3Rs Reporting Guidelines Working Group. Animal research: reporting in vivo experiments: the ARRIVE guidelines. Exp Physiol. 95 (8), 842-844 (2010).
- Lyhne, M. D., et al. Closed chest biventricular pressure-volume loop recordings with admittance catheters in a porcine model. J Vis Exp. 171, e62661 (2021).
- Schultz, J., Andersen, A., Gade, I. L., Kjaergaard, B., Nielsen-Kudsk, J. E. Riociguat, sildenafil and inhaled nitric oxide reduces pulmonary vascular resistance and improves right ventricular function in a porcine model of acute pulmonary embolism. Eur Heart J Acute Cardiovasc Care. 9 (4), 293-301 (2019).
- Schultz, J., et al. Terlipressin increases systemic and lowers pulmonary arterial pressure in experimental acute pulmonary embolism. Crit Care Med. 48 (4), e308-e315 (2020).
- Schmitto, J. D., et al. Progressive right ventricular failure is not explained by myocardial ischemia in a pig model of right ventricular pressure overload. Eur J Cardiothorac Surg. 35 (2), 229-234 (2009).
- Greyson, C., Xu, Y., Lu, L., Schwartz, G. G. Right ventricular pressure and dilation during pressure overload determine dysfunction after pressure overload. Am J Physiol Heart Circ Physiol. 278 (5), H1414-H1420 (2000).
- Lyhne, M. D., et al. Immediate cardiopulmonary responses to consecutive pulmonary embolism: a randomized, controlled, experimental study. BMC Pulm Med. 24 (1), 233 (2024).
- Mortensen, C. S., et al. Impact of preload on right ventricular hemodynamics in acute pulmonary embolism. Crit Care Med. 48 (12), e1306-e1312 (2020).
- Lyhne, M. D., et al. Oxygen therapy lowers right ventricular afterload in experimental acute pulmonary embolism. Crit Care Med. 49 (9), e891-e901 (2021).
- Kramer, A., et al. Inhaled nitric oxide has pulmonary vasodilator efficacy both in the immediate and prolonged phase of acute pulmonary embolism. Eur Heart J Acute Cardiovasc Care. 10 (3), 265-272 (2020).
- Lyhne, M. D., et al. Levosimendan, milrinone, and dobutamine in experimental acute pulmonary embolism. Pulm Circ. 11 (3), 20458940211022977 (2021).
- Krueger, K., Deissler, P., Coburger, S., Fries, J. W. U., Lackner, K. How thrombus model impacts the in vitro study of interventional thrombectomy procedures. Invest Radiol. 39 (10), 641-648 (2004).
- Brockmeier, S. L., Halbur, P. G., Thacker, E. L. . Porcine Respiratory Disease Complex. Polymicrobial Diseases. , (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados