Method Article
急性自家肺塞栓症のブタモデル
要約
この研究は、急性中リスクPEを再現する大きな自家塞栓を使用した肺塞栓症(PE)のブタモデルを示しています。このモデルは、病態生理学と治療反応の両方の評価に適しています。
要約
急性肺塞栓症(PE)は、肺動脈の突然の閉塞を引き起こし、急性右心不全を引き起こす生命を脅かす可能性のある状態です。新しい診断法やカテーテルを用いた治療法が急速に開発されており、病態生理学的評価や前臨床試験に使用できる現実的なPE動物モデルが明らかに必要とされています。
このプロトコルでは、大きな自家肺塞栓症を使用するブタモデルを導入します。インスツルメンテーションは低侵襲技術で行われ、高い再現性でさまざまな治療オプションを調査できる近接胸部モデルを作成します。ex vivoで自家塞栓を作製するために採血した3時間後、PEの誘導により 、 平均肺動脈圧(17 ± 3 mmHgから33 ± 6 mmHg、p < 0.0001)と心拍数(50 ± 9 beats·min-1 to 63 ± 6 beats·min-1, p < 0.0003)が直ちに上昇し、心拍出量の減少(5.0 ± 0.8 L/minから4.5 ± 0.9 L/min)、 p < 0.037) をベースラインと比較しました。CT肺血管造影では複数の塞栓が明らかになり、ベースラインと比較して肺閉塞率が増加した(0%[0-0]〜57.1%[38.8-63.3]、p<0.0001)。急性期では、表現型は中リスクPEに匹敵します。
このモデルは、中リスクPEの現実的で十分に特徴付けられた表現型を表しており、新しい診断方法、インターベンションおよび薬物治療、およびインターベンション手順の医療従事者向けの実践的なトレーニングをテストする機会を生み出します。
概要
急性肺塞栓症(PE)は、心血管死の3番目に多い原因であり、静脈血栓塞栓症(VTE)の症状です1。VTEの発生率は、人口10万人あたり年間75〜269人の範囲で、2歳とともに増加しています。最初の生存者は、低リスク患者で0.5%、高リスク患者で最大22%の範囲で、30日間の死亡リスクに直面します3。死因は右心室(RV)不全であり、これは主に数時間以内に発生します4,5。患者が生存したとしても、重大な罹患率と慢性疾患のリスクが依然としてあります。
この疾患の急性期における治療選択肢には、外科的塞栓摘出術、カテーテルベースまたは全身血栓溶解術、低分子ヘパリン、および経口抗凝固薬が含まれます1。治療の選択肢の数と種類は拡大しており、診断と重症度評価のための新しい技術と方法が継続的に開発されています。臨床試験を実施する前に、動物モデルで達成できるように、再現性のある一貫したセットアップで実現可能性と安全性を決定する必要があります。さらに、PEの急性病態生理学を調査するには、ヒトに近い心血管および肺の生理機能を持つ動物モデルが必要です。げっ歯類と大型動物、すなわちブタの両方のモデルが開発されている6。大型動物モデルの利点は、臨床技術を使用し、臨床診療で使用される機器や外科的介入を評価できることです。しかし、これらのモデルのほとんどは、プラスチック製の球体や閉塞性バルーンなどの人工材料を使用しているか、急性右心不全を模倣するために肺動脈バンディングのための大規模な侵襲的処置を必要とする7,8,9。1件の研究では、下大静脈フィルターを使用してin situ10で血栓症を作製した。しかし、これには時間がかかり、血栓の負担をコントロールするのが困難です。他の研究では、ex vivo で自家塞栓が作成されましたが、PE のサイズは11,12 が小さくなっています。したがって、これらのモデルは介入手順のテストには適していない可能性があります。
PEのヒトの病理を再現できる動物モデルが必要です。私たちのグループ13、14、15、16によって実施された以前の研究に基づいて、急性PEのブタモデルを提示することを目指しています。
プロトコル
この研究は、デンマーク動物検査官(ライセンス番号2021-15-0201-00944)の承認を得て、実験動物福祉と倫理に関するデンマークおよび大学のガイドラインに準拠して実施されました。
注:この研究は、ARRIVEガイドライン2.017に従っています。3R(Replacement, Reduction, and Refinement)の原則を尊重し、各動物を繰り返し評価することで、それぞれの動物を自己制御することで、必要な動物の数を減らし、収集した情報を最大化しました。この動物モデルで使用された豚は、 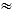 60 kgのデンマークの雌の屠殺豚(ヨークシャー、デュロック、デンマークランドレースの交配種)でした。すべての豚は、デンマークの特定病原体フリー(SPF)プログラムに従いました。ブタは、研究の1週間前に研究農場で順応し、人間との接触を訓練しました。豚は、頑丈なコンクリートの床とわらの寝具を備えた囲いに収容されました。各ペンのサイズは2.35 m x 2.9 mで、鼻が接触できるように隣接するペンがあります。豚は水を自由に利用でき、従来の豚の食事で1日2回給餌され、体重増加を減らすために細かく刻んだビートが追加されました。厩舎は12時12分の明暗サイクル(午前6時から午後6時まで点灯)でした。
60 kgのデンマークの雌の屠殺豚(ヨークシャー、デュロック、デンマークランドレースの交配種)でした。すべての豚は、デンマークの特定病原体フリー(SPF)プログラムに従いました。ブタは、研究の1週間前に研究農場で順応し、人間との接触を訓練しました。豚は、頑丈なコンクリートの床とわらの寝具を備えた囲いに収容されました。各ペンのサイズは2.35 m x 2.9 mで、鼻が接触できるように隣接するペンがあります。豚は水を自由に利用でき、従来の豚の食事で1日2回給餌され、体重増加を減らすために細かく刻んだビートが追加されました。厩舎は12時12分の明暗サイクル(午前6時から午後6時まで点灯)でした。
1.麻酔、挿管、換気
- 2.5 mLのタイルタミン(25 mg / mL)、2.5 mLのゾラゼパム(25 mg / mL)、2.5 mLのブロファノール(10 mg / mL)、1.25 mLのケタミノール(100 mg / mL)、および6.25 mLのキシラジン(20 mg / mL)からなる筋肉内注射(0.1 mL / kg)でブタに麻酔を事前にかけ、動物収容施設から輸送する前に動物の潜在的な痛み、ストレス、不安を軽減します。.
- 動物は、麦わらの寝具が付いた承認された輸送ボックスで輸送します。
- 到着時に静脈内アクセスを確立します。
- 耳の近位部分に止血帯を置き、軽く締めて静脈血うっ血を得ます。エタノール綿棒で静脈上の皮膚を2回消毒します。
- 20Gの静脈カテーテルを使用して静脈を穿刺します。止血帯を放します。ずれないように、アクセスを適切に慎重に固定してください。
- 等張性生理食塩水でアクセスを洗い流して、正しい配置を確認します。
注:カテーテルが静脈から外れると、皮下の膨らみが現れます。反対側の耳に2回目の静脈内アクセスを確立することは、不測の事態と見なされる場合があります。
- 動物を手術台に移し、仰臥位に置きます。
- サイズ7.5の気管チューブで直接喉頭鏡検査を使用してブタに挿管し、気管カフを膨らませます。チューブを動物の鼻/頭に固定します。これにより、意図しない抜管を防ぐことができます。人工呼吸器のスクリーンで呼気二酸化炭素の値を観察して、チューブの正しい位置を確認します。
- チューブを事前にテスト済みの人工呼吸器に接続し、機械換気を開始します。
- 圧力制御されたボリュームゲート換気設定を選択し、低流量換気で潮汐量(TV)を8 mL / kgに設定します。呼気終末陽圧(PEEP)を5cmH2Oに設定します。
- 実験プロトコルに応じて、吸気酸素(FiO2)の割合をノルモキシア(0.21)以上に設定します。目標潮汐終末二酸化炭素(EtCO2)値は約5.0〜5.5kPaです。これを達成するために呼吸数(RR)を調整します。
- 4.0 mg/kg/h のプロポフォールと 12.5 μg/kg/h のフェンタニルを使用して、耳に静脈内アクセスすることで全身麻酔を開始および維持します。角膜反射の欠如と痛みを伴う刺激への反応をチェックして、十分な麻酔が投与されていることを確認してください。反射神経や反応がある場合は注入速度を上げ、定期的に反射神経を確認します。.
注意:プロトコル中のどの時点でも動物を放置しないでください。神経筋遮断薬は、不十分な麻酔の兆候を不明瞭にする可能性があるため、使用を控えてください。. - 3誘導心電図(ECG)ワイヤーとパルスオキシメトリセンサーを取り付けて、心拍数、心臓のリズム、酸素飽和度を監視します。
- 直腸体温計でコア温度を監視します。通常の豚温は38〜39°Cを目標としています。 必要に応じて、強制空気加温ブランケットを使用して動物を加熱します。
- 膀胱カテーテルを挿入し、外部端を尿サンプルバッグに接続します。
- 乾燥を防ぐために獣医師の目の軟膏を塗ってください。
2. 超音波ガイド下血管内アクセス
注:血管内アクセスは、前述のように確立されます18。
- 少なくとも、右外頸静脈、右大腿静脈、および左大腿動脈に血管内アクセスを確立します。
注:実験プロトコルによっては、さらにアクセスを取得できます。- クロルヘキシジンで皮膚を剃り、消毒します。
- 滅菌手順では、超音波装置を使用して17G静脈カテーテルを血管内位置に導きます。
- 静脈カテーテルから針を取り外し、セルディンガー法を使用してガイドワイヤーを挿入します。静脈カテーテルを取り外し、ガイドワイヤーをそのままにしておきます。
- アクセスポイントで、皮膚に小さな切開部を切開し、ガイドワイヤーの上にシースを挿入します。
- シースを正しく配置するには、10 mLまたは20 mLのシリンジを使用して各シースから血液を採取します。正しく配置されたシースは、血液を吸引したり、アクセスを生理食塩水で洗い流したりしても抵抗がありません。
- 鞘を皮膚に縫合します(サイズ4.0)。
- 大腿動脈のシースを圧力トランスデューサーに接続します。大気圧に校正し、正しい動脈圧曲線について画面を観察します。
- 等張生理食塩水を使用した輸液ポンプを静脈シースに接続します。これにより、管腔内血液凝固が予防されます。
- 実験前の空腹時による血液量減少を打ち消し、血液を採取して塞栓を作成するには、右外頸静脈に接続されたポンプで800mLのボーラス注入を30〜60分で開始します。.
- 発汗と排尿による1時間ごとの水分損失を補正するには、大腿静脈に接続されたポンプで4 mL / kg / hの注入を開始します。.
3. 血栓形成
- 心肺酸素システムを開梱し、外径が1/2インチと内径がそれぞれ3/32インチの非ヘパリン被覆ポリ塩化ビニル(PVC)チューブを見つけます。長さ~30cmにカットします。全部で7本のチューブを製作します。
注:より細い塞栓が好ましい場合は、任意の小径のPVCチューブを使用することができます。 - 大きな止血鉗子でチューブの一端を閉じます。
- 静脈鞘の1つに等張生理食塩水の注入を一時停止し、合計180mLの血液を採取します。
- 血液を6本のPVCチューブ(30mL×6本)に分割し、別の止血鉗子でPVCチューブの上部を閉じます。チューブを室温(RT)で最低3時間垂直に吊るします(図1A)。
- 生理食塩水をシースに洗い流し、生理食塩水の注入を再開します。.
4. 透視ガイド下による26Fシースの挿入
注意: 鉛エプロンや甲状腺カラーなどの電離放射線に対する保護具は、透視検査を使用するときは常に着用する必要があります。
- 右外頸静脈のシースに接続された輸液ポンプを一時停止します。
- シースに長くて硬いガイドワイヤーを挿入します。透視法を使用して、シースから出るワイヤーを観察します。透視法によって導かれ、ワイヤーを上部中央静脈、上大静脈(SVC)、右心房(RA)、および下大静脈(IVC)に尾状に進めます。
注:ワイヤーがRAを通過するときに、早期の収縮期イベントが発生する可能性があります。ワイヤーを進めている間、どの時点でも抵抗を感じてはなりません。 - ガイドワイヤーがIVC内に留まることを透視法で観察しながら、ゆっくりとシースを取り出します。シースを引っ込めるときは、エントリポイントを滅菌ナプキンで圧縮します。
- セルディンガー技術を使用して、シースを16F拡張器と交換します。抵抗が多すぎる場合は、皮膚の切開部を伸ばします。透視法によって導かれてシースを静脈循環に進めます。抵抗を最小限に抑えるために生理食塩水に事前浸します(図2B)。
注意: 拡張器でガイドワイヤーのコースをたどり、拡張器がワイヤーから逸脱していないこと、したがって血管の内腔から逸脱していないことを確認することが非常に重要です。 - セルディンガー技術を使用して、16 Fディレーターを26 Fシースに交換します。皮膚の切開部を少なくとも10mm伸ばします。透視法に導かれて、26 F シースをゆっくりと進め、大きな静脈を通って、X線不透過性マーカー (拡張器ではない) で示されるシースの先端が SVC に到達するまで (図 2D)。筋肉の層を進むときは、ある程度の抵抗が予想されます。
注:抵抗が大きすぎる場合は、シースを引っ込めて、入口点に近い筋肉組織を包み込むように大きく深く切開することができます。 - 透視法の指導の下で、シースが所定の位置に留まることを確認しながら、拡張器とガイドワイヤーをブタから慎重に引っ込めます。
- 鞘がまだ所定の位置にあることを確認するために採血します。90 mLの生理食塩水で洗い流し、シースの全長が洗い流されるようにします。
- 滅菌ナプキンのスタックをシースの外側の端の下(および滅菌ドレープの下)に置いて、シースを心臓の高さより上に持ち上げ、シースに血液が補充されないようにします(図2C)。
- 輸液ポンプを再接続し、生理食塩水の注入を再開します。
5. 右心カテーテル法
- Swan-Ganz(SG)カテーテルの両方のポートを生理食塩水で洗い流します。バルーンが正しく膨らむか確認してください。
- 各SGカテーテルポートを3方向または4方向ストップコックに接続します。ストップコックの未使用のポートを圧力トランスデューサーに接続します。各ストップコックの残りのポートは、後で中心静脈および肺動脈血ガスのサンプリングに使用できます。
- SGカテーテルの遠位ポートをブタの腋窩中央レベルに保持することにより、トランスデューサーを大気圧にリセットします。
- SGカテーテルを26Fシースに挿入します(図2C)。
- 透視法を使用して、SGカテーテルの遠位端がシースを離れるタイミングを観察します。バルーンが適切に膨らむことを確認します。インフレは抵抗がないべきです。
注意: シースの内側に膨らませると、バルーンが損傷する可能性があります。すべての手順には、前後図が使用されます。バルーンが膨らんでいる間は、カテーテルを引っ込めないでください。これにより、バルーンがバルブや脊索から外れたり損傷したりする可能性があります。 - バルーンを膨らませた状態で、バルーンを中心静脈、関節リウマチ、右心室(RV)、そして主肺動脈(MPA)にゆっくりと進めます(図2E)。
- 遠位ポートがRVに移動し、再びMPAに移動すると、圧力信号と圧力曲線の形状が変化することに注意してください。
- 圧力信号が中心静脈循環の 2-8 mmHg から収縮期および拡張期の RV 圧力にそれぞれ 20-30 mmHg と 0-5 mmHg に変化することを確認します。MPAに進むときは、収縮期血圧が25〜35 mmHg、拡張期血圧が10〜15 mmHgであることを確認してください。
- バルーンを収縮させます。透視法を使用し、圧力信号と曲線を過剰に処理することにより、SGカテーテルがまだ所定の位置に留まっていることを確認します。
注: この時点で実験を一時停止できます。
6. 塞栓送達装置の組み立て(図3)
注意: 塞栓装置は、ここからパートAとパートBと呼ばれる2つの部分で構成されています(図3)。
- 無菌条件下で、統合された心臓麻痺ラインと大動脈灌流カニューレを使用して、心肺酸素化システムの残りの部分を開梱します。
- 自己輸血セットから、心臓切開容器の底に取り付けられた長さ10 cmのシリコンチューブ(外径3/8インチと内径3/32インチ)と、シリコンチューブに取り付けられた3/8〜1/4インチのコネクタピースを見つけます(図3A)。
- シリコンチューブを同じサイズの2本のチューブにカットします。とりあえず、コネクタのない半分を脇に置きます。
- クイックプライムラインを見つけます。ルアーロックの端から約20cmのところでラインを切り取り、クイックプライムラインの開放端をコネクタピースの1/4インチの端に取り付けます(図3A)。
- 3/8インチから1/2インチのコネクタピースを見つけます。シリコンチューブの開放端に接続します。これでパート A が完成しました (図 3A、C)。
- シリコンチューブの残りの部分を大動脈灌流カニューレの遠位端に取り付けます。シリコンチューブの開放端に3/8インチから1/2インチのコネクタを見つけて取り付けます。これでパートBが完成しました(図3B、C)。
7. ベースライン評価
注:計装後およびベースライン評価の前に血行動態の安定化を達成することが重要です。以下の対策を推奨します。ベースライン測定の範囲は、特定のプロトコルに従って調整できます。
- 全身動脈圧と肺動脈圧、および中心静脈圧の値を記録します。
注: 許容可能な肺動脈圧は、収縮期血圧 < 40 mmHg と平均肺動脈圧 (mPAP) ≤ 20 mmHg です。 - 中心体温、末梢飽和度、心拍数を記録します。
- 呼吸器に、FiO2、EtCO2、TV、分容量(MV)、RR、およびピーク圧力(Ppeak)の値を記録します。
- 動脈シースとSGカテーテル(混合静脈)の遠位(黄色)ポートから1mLの血液サンプルを採取し、血液ガス分析を行います。
- 存在する場合は、電解質の不均衡や低血糖を修正して、正常範囲内の値を達成します。
- 実験プロトコルに応じて、さらなる分析に適した容器に静脈血サンプルを採取します。
- SGカテーテルによる熱希釈により心拍出量(CO)を取得します。10% のマージン内で平均 3 つの測定値が得られることを確認します。
- SGカテーテルを介して肺毛細血管楔入圧(PAWP)を取得します。
8. 血栓評価
注:最低3時間後、塞栓を誘導する準備が整います。PVCチューブには、形成された塞栓と液体上清が含まれます。血液が凝固していない場合は、さらに30分待ってから別の塞栓を回収します。.
- 完全に形成された塞栓を含むPVCチューブの1つを取り出し、塞栓を手術用ナプキンにそっと置き、上清を捨てます。塞栓が注射に対して硬く安定していると感じることを確認してください(図1B)。
9. 急性肺塞栓症の誘発(図4)
- 等張生理食塩水の1000mLバッグを圧力注入バッグに入れます。.輸液セットを挿入し、圧力バッグを少なくとも200 mmHgまで膨らませます(ただし、推奨圧力を超えないようにします)。
- 塞栓送達装置のパートAを取り出し、3方向ストップコックのサイドポートに接続します(図4A)。
- 最後のPVCチューブをパーツAの開放端に接続します。
- チューブに1つの塞栓を配置し、システムに生理食塩水を満たします(図4B)。
- パーツBをPVCチューブのもう一方の端に取り付けます(図4C)。
注意: システム全体が生理食塩水で満たされていることを確認してください。 - 塞栓装置を26Fシースに挿入し、加圧生理食塩水の流れを約5秒間開いて塞栓を注入します(図4D)。
注意:塞栓の注射前後のバイタルパラメータを注意深く観察してください。反応が観察されない場合、塞栓症はまだ輸送中であり、生理食塩水をさらに3秒間洗い流します。
10. 急性期PEモデル(図5 、 図6)
- mPAPがベースラインから2倍になるまで、または6つの塞栓すべてが誘導されるまで塞栓を誘導します。血行動態反応を監視し、安定化を待ってから別の塞栓を誘発します。.
注意:ブタは塞栓の誘導中に血行動態が不安定になる可能性があります。平均全身動脈圧が50 mmHgに低下した場合、0.02 mgのノルエピネフリンのボーラスが必要になることがあります。.必要に応じてボーラスを繰り返します。 - 適切な数の塞栓を注入した後、ブタは30分間安定します。
注:PEの症状はハイパーダイナミック状態です。したがって、mPAPはセクション11に進む前に停滞しているはずです。
11. 血行動態
- 30 分間の安定化後、セクション 7 で実施したベースライン評価に記録して急性 PE 評価を実行します。
- プロトコルによっては、介入を開始できるようになりました。
12. コンピュータ断層撮影法 肺血管造影法 (CTPA) (図 7)
注:プロトコルのこの部分は、科学的な範囲によっては除外できます。
- 挿管され麻酔をかけられたまま、豚を可搬式人工呼吸器に接続し、豚をCTPA施設に輸送します。
- ベースライン評価の一環として、PE 導入前の吸気息止め中に CTPA を実行します。
- 120 KVで自動露出制御を使用し、コリメーションを0.5 x 80 mmに設定します。
- 自動注入ポンプで耳の静脈を介して、75 mLのIomeron(350 mg / mL)造影剤溶液を0.5 mL / sの流量で注入し、続いて30 mLの生理食塩水を3.0 mL / sで注入します。.
- 豚をオペレータールームに戻し、プロトコルを続行します。
- PE導入後、PE評価のために手順12.1〜12.2を繰り返します。
13. その他の方法
- 科学的研究の範囲に応じて、それに応じてブタを評価します。
注:このプロトコルで詳細に説明されていない多数の評価方法をモデルに適用することができます:磁気共鳴画像法、経食道心エコー検査、双心室圧力-体積ループ記録、生化学的、ex vivo-生理学および組織学的分析は、以前の研究13,14,15,16,18,19,20で使用されています。
14.安楽死と剖検
- プロトコルの最後に、致死量のペントバルビタール(1.5 mL / kg、400 mg / mL)でブタを安楽死させます。.
注:プロトコルによっては、剖検を行うことができ、組織学的サンプリングを得ることができます(図8)。
結果
以前の研究に含まれるブタのプール分析では、このプロトコル15,16で説明されている急性PEモデルを特徴付ける結果を提示します。2頭の豚がPE後の急性右心不全で死亡しました。合計で24頭の豚を含めました。
血行動態
各塞栓後の反応は、図5で明らかです。PE (5 ± 1) の誘導により、mPAP (17 ± 3 mmHg から 33±6 mmHg、p < 0.0001) と HR (50 ± 9 beats·min-1 to 63 ± 6 beats·min-1, p < 0.0003) が直ちに増加し、CO (5.0 ± 0.8 L/min から 4.5 ± 0.9 L/min, p < 0.037) と EtCO2 が減少しました (図 5 および 図 6)。MAPは変更されませんでした(79 ± 9 mmHgから77 ± 11 mmHg、p = 0.1955)。(図 6)。PE導入は、トロポニンT(TnT)13の上昇、RV後負荷の増加、RV心室-動脈の分離、およびRV拡張をもたらし、中リスクPE(データ示さず)1,14と互換性を持つようになりました。
イメージング
血栓の負荷を評価するために、前述のように肺閉塞率を計算しました(図7)15。要するに、パーセンテージは 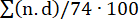 として計算され、n は分節塞栓の存在、d は閉塞の程度を 0 から 2 のスケールで計算し、最大 74 ポイントで計算しました。ベースラインで実施されたCTPAはPEの徴候を示さなかった(図7A)が、PE導入後、肺動脈の複数の塞栓がCTPAで明らかになり、CT閉塞率(0 [0-0]から57.1%[IQR 38.8-63.3])が増加しました(図7C-E)。
として計算され、n は分節塞栓の存在、d は閉塞の程度を 0 から 2 のスケールで計算し、最大 74 ポイントで計算しました。ベースラインで実施されたCTPAはPEの徴候を示さなかった(図7A)が、PE導入後、肺動脈の複数の塞栓がCTPAで明らかになり、CT閉塞率(0 [0-0]から57.1%[IQR 38.8-63.3])が増加しました(図7C-E)。

図1:塞栓形成 (A) 30mLの血液で満たされたPVCチューブ、それぞれが最低3時間垂直にぶら下がっている (B) 1つの塞栓が形成された。 この図の拡大版を表示するには、ここをクリックしてください。
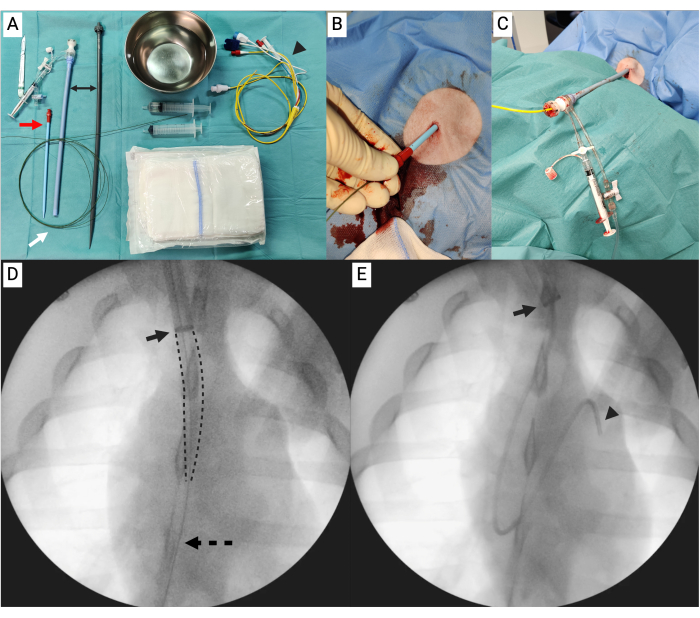
図2:26Fシースの挿入と右心カテーテル法 (A)16F拡張器(赤矢印)と長い超硬ガイドワイヤー(白矢印)を使用して、8FシースをSwan-Ganz(SG)カテーテル(矢印じり)を含む26Fシース(黒二重矢印)に交換するために必要な機器を含むテーブル。(B)16F拡張器付きのワイヤー。(C)26 Fシースを所定の位置に置き、滅菌ドレープの下にナプキンを付けて端を持ち上げます。SGは26Fシースに挿入されます。(D)26 F(シースのX線不透過性リングを示す矢印)と拡張器(点線でマーク)およびワイヤー(点線矢印)を示す透視法。(E)SGカテーテル(矢印)を備えた26Fシース(矢印)を示す透視法。 この図の拡大版を表示するには、ここをクリックしてください。
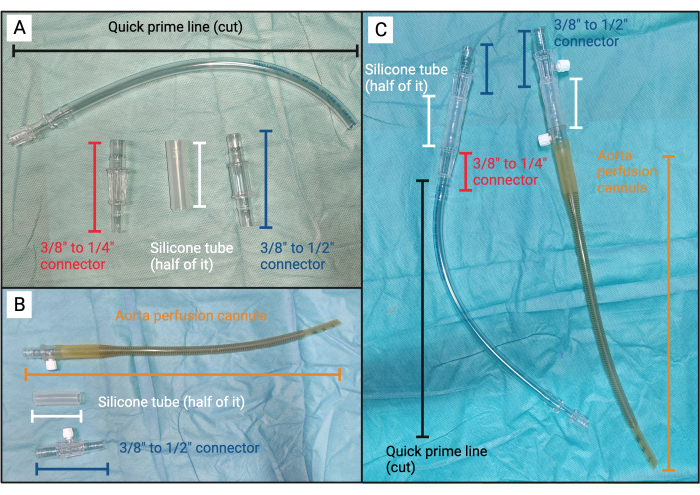
図3:塞栓装置。 (A)塞栓装置のパーツAの組み立てられていないコンポーネント。(B)塞栓装置のパーツBの組み立てられていないコンポーネント。(C)左から右へ:塞栓装置の組み立てられた部品Aと塞栓装置の部品B。 この図の拡大版を表示するには、ここをクリックしてください。

(A)左から右へ:塞栓装置の組み立てられたパートB、PVCチューブ、および3ウェイサイドポートによって設定された輸液に接続された塞栓装置のパートA。(B)PVCチューブを塞栓装置のパーツAに取り付け、チューブに塞栓を挿入します。(C)塞栓を備えた完全に組み立てられた塞栓装置。(D)塞栓(黒の矢印)を備えた塞栓装置(黒い点線の矢印)を、スワンガンツカテーテル(白い点線の矢印)を所定の位置にして26Fシース(白い矢印)に挿入します。この図の拡大版を表示するには、ここをクリックしてください。
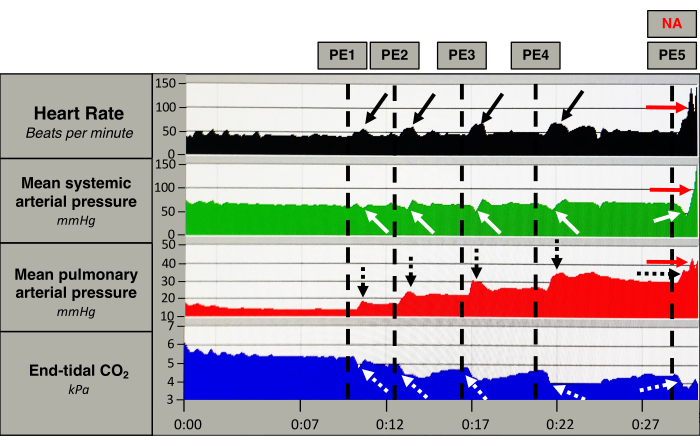
図5:急性血行動態反応。 1匹のブタからの心拍数(黒)、平均全身動脈圧(緑)、平均肺動脈圧(赤)、および呼気終末CO2 (青)の測定。縦の点線は塞栓症(PE)の誘導を示しています。PE導入後、心拍数は瞬間的に増加し(黒い矢印)、平均肺動脈圧が持続的に上昇します(黒い点線の矢印)。平均全身動脈圧は、各PEの後にわずかに低下し、各塞栓(白い矢印)の後に減少が大きくなります。呼気終末CO2 は、各PE(白い点線の矢印)の後に急激に減少します。5回目のPEの後、ブタはノルエピネフリン(NA)のボーラスを受け取り、心拍数と平均全身および肺動脈圧(赤い矢印)の増加を引き起こします。 この図の拡大版を表示するには、ここをクリックしてください。

図6:急性の生理学的反応。 (A) 平均肺動脈圧、(B) 平均動脈圧、(C) 心拍数、および (D) ベースライン時および肺塞栓 (PE) 導入後の心拍出量の比較。タイムポイントは、対応のあるサンプルのt検定と比較されます。 この図の拡大版を表示するには、ここをクリックしてください。
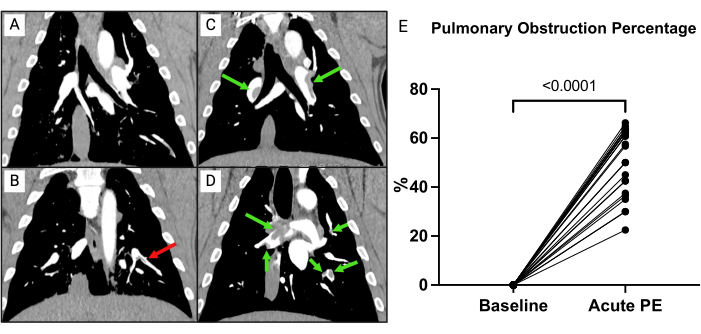
図7:CT肺血管造影(CTPA)(A)完全な器具使用後のブタ、生理食塩水のみを受けた状態。塞栓性物質の兆候はありません。(B)生理食塩水のみを受けた完全器具使用後のブタのCTPA。インデントされていない塞栓(赤い矢印)が存在します。(C,D)2つの異なるブタからの塞栓(緑の矢印)の誘導の直後。(E)肺塞栓(PE)の導入後と比較したベースラインでの肺閉塞率。タイムポイントは、対応のあるサンプルのt検定と比較されます。この図の拡大版を表示するには、ここをクリックしてください。
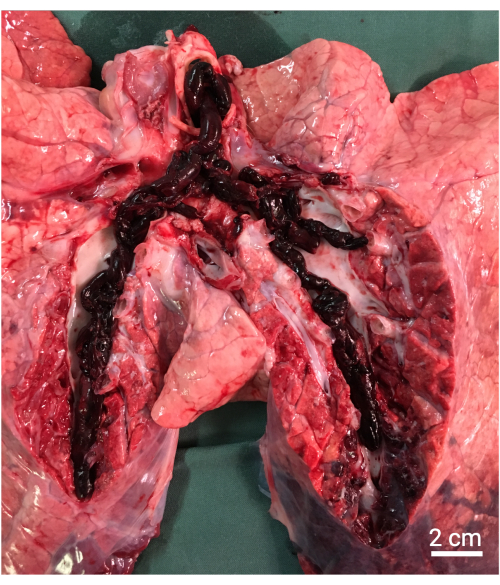
図8:剖検。 肺動脈の大きな自家塞栓を示す肉眼的な所見。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この論文では、低侵襲で再現性のある自家塞栓を使用した急性中リスクPEのブタモデルについて説明します。
このプロトコルには、いくつかの重要な手順があります。まず、右外頸静脈のアクセスの拡張は、塞栓のアクセスポイントとして機能するため、モデルにとって非常に重要です。大きなシースを前進させる際には、主要な血管や右心腔の破裂や解離を防ぐために、連続透視下で硬いワイヤーのガイダンスに従うことが不可欠です。抵抗が発生した場合は、過度の圧力をかけず、代わりにワイヤーを交換して、アクセスが最適に拡張されるようにしてください。さらに、ブタは不整脈原性があり、器具は心房細動を引き起こす可能性があります。したがって、豚を間近で観察することが重要です。
第二に、モデルは急性期に中リスクPEの血行動態表現型を持っています。最適な塞栓数を慎重に滴定することは、課題となる可能性があります。塞栓の容積が心臓の高圧に耐える能力を超えると、ブタは急性右心不全や死に至る可能性があります。PE 導入に対する閉鎖胸部アプローチは、研究者が塞栓導入中の mPAP の増加、EtCO2 の減少、HR の上昇、全身動脈圧の低下などの血行動態反応を綿密に監視することに依存しています。全身性低血圧が重度で長期化している場合は、血栓の最大負荷に達していることを示唆しています。塞栓の間に十分な時間を確保することで、突然の虚脱のリスクが減少します。明らかな反応がない場合、塞栓は心臓の鞘または右側室内で移動している可能性があります。その後、新しい塞栓の即時誘発として再洗浄して待つことをお勧めしますが、これは2つの同時塞栓につながる可能性があり、致命的となる可能性があります。
第三に、ヘパリンを使用せずにモデルが確立されます。研究者は、常に生理食塩水をアクセスに接続することに細心の注意を払い、使用前にこぼれて生理食塩水で洗い流すことを忘れないでください。そうしないと、塞栓性物質が形成されて剥がれ落ち、プロトコル全体で小さな塞栓が誘発され、結果を妨げる可能性があります(図4B)。
このモデルは、胸部が閉じているだけでなく、自家塞栓材料を利用しているため、現実的な生理学的反応に貢献しています。動物における急性血栓塞栓性表現型の開発を追求する中で、様々なモデルが開発されており、そのほとんどが無機材料の使用、薬理学的治療、および/または肺動脈の結紮を必要とし、大型動物モデル6,7,8,21,22で急性肺高血圧症およびRV心不全を誘発する。.したがって、これらのモデルは PE 患者の臨床症状を模倣していません。ある研究では、下大静脈の閉塞によりin vivoで血栓塞栓性物質を作成し、深部静脈血栓症(DVT)を作成しました10。しかし、DVTの作成には時間がかかり、RV機能障害のモデルを作成するにはDVTの誘導が不十分です。
現在のモデルでは、目標は中リスクPEに匹敵する血行動態表現型を作成することであり、これは5±1塞栓後のモデルで達成されました。血栓負荷は、モデルの範囲に応じて変更して、目的の血行動態表現型を達成することも、固定血栓負荷を使用することもできます。しかし、私たちのグループの研究では、肺圧の血行動態の変化と RV 機能障害は、血栓の負担だけに直接関連していないことが示されました23。この研究では、最初の塞栓の誘導が、塞栓誘発後と比較してmPAPの最大の増加を引き起こしたことがわかりました。しかし、RVの後負荷は3回目の塞栓の誘導時に増加しました。
この研究で使用された実験設定は、イメージングおよび血行動態の変化13,14,15に関連する病態生理学的応答を調査する機会をさらに提供します。研究では、中リスクPE14のイベント後の最初の12時間でのRVの急性反応を調査しています。別の研究では、このモデルを使用して、塞栓性物質の誘導から1か月後の応答の延長を調べています15。さらに、このモデルは、急性期および亜急性期16,21,22,24,25,26,27の薬理学的治療の試験に使用されています。ある研究では、40% FiO2 での酸素療法の使用により、RV のアフターロードと機械的作業が減少することがわかりました。このモデルは汎用性が高いことが証明されています。
プロトコルにはいくつかの制限があります。まず、塞栓は誘導の直前に形成され、ex vivoで作成されますが、in vitroで作成された血栓はフィブリンが少ないことがわかっているため、制限になる可能性があります28。しかし、その利点は、自家材料を使用しながら血栓の負担を制御できることです。第二に、動物はプロトコル中に完全に麻酔され、麻酔は血行動態反応に影響を与える可能性があります。ただし、測定を繰り返すと、効果は均一になります。
このモデルは屠殺豚で確立されており、遺伝子組み換えや孤立して繁殖したものではありません。ブタは、心血管系と肺圧に影響を与える可能性のある病気にかかりやすい可能性があります29。したがって、血行動態の状態のベースライン評価を実行することが不可欠です。
結論として、自家塞栓を用いたブタモデルを提示する。このモデルは、中リスクPEに匹敵する表現型を示しています。このモデルは、新しいインターベンション治療や薬物治療のテスト、およびインターベンション処置の医師や専門の医療従事者のトレーニングのための貴重なツールとして機能します。
開示事項
AAは、講演者(ABBOTT、Gore Medical、Angiodynamics、EPS Vascular、Jannsen)を受賞しており、Inari Medicalのコンサルタントを務めています。
謝辞
オーフス大学臨床医学教室のスタッフの多大な献身と努力により、実験を完成させたことに心から感謝申し上げます。さらに、オーフス大学法医学科とマサチューセッツ総合病院放射線科の協力者には、CT肺血管造影の実施と分析に貴重な支援を提供していただいたことに感謝したいと思います。この研究は、オーフス大学大学院、Karen Elise Jensen's Foundation、Danish Heart Foundation、NIH-grant no. 1R01HL168040-01、Novo Nordisk Foundation [NNF17OC0024868]、Holger og Ruth Hesse's Mindefond、Laerdal Foundation [3374]、Alfred Benzons Foundation、A.P. Møller Fonden、Direktør Emil C. Hertz og hustru Inger Hertz Fond、P.A. Messerschmidt og Hustrus fond、Helga og Peter Kornings Fondの支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 12L-RS | GE Healthcare Japan | 5141337 | Ultrasound probe |
| 50 mL BD Luer-Lock | BD Plastipak | 300865 | |
| Adhesive Aperature Drape (OneMed) | evercare | 1515-01 | 75 cm x 90 cm (hole: 6 cm x 8 cm) |
| Alaris GP Guardrails plus | CareFusion | 9002TIG01-G | Infusion pump |
| Alaris Infusion set | BD Plastipak | 60593 | |
| Alcohol swap | MEDIQ Danmark | 3340012 | 82% ethanol, 0.5% chlorhexidin, skin disinfection |
| Amplatz Support Wire Guide Extra-Stiff | Cook Medical | THSF-25-260-AES | diameter: 0.025 inches, length: 260 cm |
| Aortic Perfusion Cannula | Edwards Lifesciences | AA024TFTA | Size: 24F. Length: 30 cm. |
| BD Connecta | BD | 394601 | Luer-Lock |
| BD Emerald | BD | 307736 | 10 mL syringe |
| BD Platipak | BD | 300613 | 20 mL syringe |
| BD Venflon Pro | Becton Dickinson Infusion Therapy | 393204 | 20 G |
| BD Venflon Pro | Becton Dickinson Infusion Therapy | 393208 | 17 G |
| Butomidor Vet | Richter Pharma AG | 531943 | 10 mg/mL |
| Chlorhexidine 0.5% | Meda AB | N/A | |
| Cios Connect S/N 20015 | Siemens Healthineers | N/A | C-arm |
| CP Oxygenation System Adult With Fusion and Cardioplegia 1/B | Medtronic | M450311W | Custom cardiopulmonary oxygenation system including a cardioplegia line. |
| D-LCC12A-01 | GE Healthcare Finland | N/A | Pressure measurement monitor |
| Durapore | 3M | N/A | Adhesive tape |
| E-PRESTIN-00 | GE Healthcare Finland | 6152932 | Respirator tubes |
| Euthanimal | Alfasan | 136278 | Pentobarbitalnatrium 400 mg/mL (0.5 mL/kg for euthanasia) |
| Favorita II | Aesculap | GT104 | |
| Fentanyl | B. Braun | 71036 | 50 µg/mL |
| Glucose isotonic | SAD | 419358 | 55 mg/mL Isotonic glucose (500 mL bag) |
| Gore DrySeal Flex Introducer Sheath | GORE | DSF2633 | Size: 26 French. Working length: 33 cm. |
| Ketaminol Vet | MSD/Intervet International B.V. | 511519 | 100 mg/mL |
| Lawton 85-0010 ZK1 | Lawton | N/A | Laryngoscope |
| Lectospiral | VYGON | 1159.90 | 400 cm (Luer-LOCK) |
| MBH qufora | MBH-International A/S | 13853401 | Urine bag |
| Natriumchlorid | Fresenius Kabi | 7340022100528 | 9 mg/mL Isotonic saline |
| Noradrenalin | Macure Pharma | 425318 | 1 mg/mL |
| PICO50 Aterial Blood Sampler | Radiometer | 956-552 | 2 mL |
| Portex Tracheal Tube | Smiths Medical | 100/150/075 | Cuffed Clear Oral/Nasal Murphy Eye |
| Pressure Extension set | CODAN | 7,14,020 | Tube for anesthetics, 150 cm long, inner diameter 0.9 mm |
| Propolipid | Fresenius Kabi | 21636 | Propofol, 10 mg/mL |
| Radiofocus Introducer II | Radiofocus/Terumo | RS+B80N10MQ | 7 + 8F sheaths |
| Rompun Vet | Beyer | 86450917 | Xylazin, 20 mg/mL |
| Rüsch Brilliant AquaFlate Glycerine | Teleflex | 178000 | Bladder catheter, size 14 |
| S/5 Avance | Datex-Ohmeda | N/A | Mechanical ventilator |
| Safersonic Conti Plus & Safergel | SECMA medical innovation | SAF.612.18120.WG.SEC | 18 cm x 120 cm (Safersonic Sterile Transducer Cover with Adhesive Area and Safergel) |
| Standard Dilator | Cook Medical | G01212 | Size: 16 French. Length: 20 cm. |
| Swan-Ganz CCOmbo | Edwards Lifesciences | 744F75 | 110 cm |
| TruWave Pressure Monitoring Set | Edwards Lifesciences | T434303A | 210 cm |
| Vigilance VGS Patient Monitor | Edwards Lifesciences | N/A | |
| Vivid iq | GE Medical Systems China | Vivid iq | |
| Zoletil 50 Vet (tiletamin 125 mg and zolazepam 125 mg) | Virbac | 83046805 | Zoletil Mix for pigs: 1 vial of Zoletil 50 Vet (dry matter); add 6.25 mL Xylozin (20 mg/mL), 1.25 mL ketamin (100 mg/mL) and 2.5 mL Butorphanol (10 mg/mL). Dose for pre-anesthesia: 0.1 mL/kg as intramuscular injection |
参考文献
- Konstantinides, S. V., et al. ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The task force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur. Heart J. 41 (4), 543-603 (2019).
- Wendelboe, A. M., Raskob, G. E. Global burden of thrombosis. Circ. Res. 118 (9), 1340-1347 (2016).
- Becattini, C., et al. Acute pulmonary embolism: mortality prediction by the 2014 European Society of Cardiology risk stratification model. Eur. Respir. J. 48 (3), 780-786 (2016).
- Wood, K. E. Major Pulmonary embolism: Review of a pathophysiologic approach to the golden hour of hemodynamically significant pulmonary embolism. Chest. 121 (3), 877-905 (2002).
- Bĕlohlávek, J., Dytrych, V., Linhart, A. Pulmonary embolism, part I: Epidemiology, risk factors and risk stratification, pathophysiology, clinical presentation, diagnosis, and nonthrombotic pulmonary embolism. Exp Clin Cardiol. 18 (2), 129-138 (2013).
- Andersen, A., et al. Animal models of right heart failure. Cardiovasc Diagn Ther. 10 (5), 1561-1579 (2020).
- Tsang, J. Y., Lamm, W. J., Starr, I. R., Hlastala, M. P. Spatial pattern of ventilation-perfusion mismatch following acute pulmonary thromboembolism in pigs. J Appl Physiol. 98 (5), 1862-1868 (2005).
- Böttiger, B. W., et al. Inhaled nitric oxide selectively decreases pulmonary artery pressure and pulmonary vascular resistance following acute massive pulmonary microembolism in piglets. Chest. 110 (4), 1041-1047 (1996).
- Kudlička, J., et al. Pig model of pulmonary embolism: where is the hemodynamic break point. Physiol Res. 62 (Suppl 1), S173-S179 (2013).
- Barbash, I. M., et al. Experimental model of large pulmonary embolism employing controlled release of subacute caval thrombus in swine. J Vasc Interv Radiol. 22 (10), 1471-1477 (2011).
- Beam, D. M., et al. Comparison of isoflurane and α-chloralose in an anesthetized swine model of acute pulmonary embolism producing right ventricular dysfunction. Comp Med. 65 (1), 54-61 (2015).
- Pereira, D. J., et al. Near-fatal pulmonary embolism in an experimental model: hemodynamic, gasometric and capnographic variables. Rev Bras Cir Cardiovasc. 26 (3), 462-468 (2011).
- Schultz, J., et al. A porcine in-vivo model of acute pulmonary embolism. Pulm. Circ. 8 (1), 2045893217738217(2018).
- Lyhne, M. D., et al. Right ventricular adaptation in the critical phase after acute intermediate-risk pulmonary embolism. Eur Heart J Acute Cardiovasc Care. 10 (3), 243-249 (2020).
- Dragsbaek, S. J., et al. A porcine model of human-like chronic thromboembolic pulmonary disease. Thromb. Res. 231, 25-28 (2023).
- Merit, V. T., et al. Changes in pulmonary vascular resistance and obstruction score following acute pulmonary embolism in pigs. Crit Care Explor. 6 (2), e1040(2024).
- NC3Rs Reporting Guidelines Working Group. Animal research: reporting in vivo experiments: the ARRIVE guidelines. Exp Physiol. 95 (8), 842-844 (2010).
- Lyhne, M. D., et al. Closed chest biventricular pressure-volume loop recordings with admittance catheters in a porcine model. J Vis Exp. 171, e62661(2021).
- Schultz, J., Andersen, A., Gade, I. L., Kjaergaard, B., Nielsen-Kudsk, J. E. Riociguat, sildenafil and inhaled nitric oxide reduces pulmonary vascular resistance and improves right ventricular function in a porcine model of acute pulmonary embolism. Eur Heart J Acute Cardiovasc Care. 9 (4), 293-301 (2019).
- Schultz, J., et al. Terlipressin increases systemic and lowers pulmonary arterial pressure in experimental acute pulmonary embolism. Crit Care Med. 48 (4), e308-e315 (2020).
- Schmitto, J. D., et al. Progressive right ventricular failure is not explained by myocardial ischemia in a pig model of right ventricular pressure overload. Eur J Cardiothorac Surg. 35 (2), 229-234 (2009).
- Greyson, C., Xu, Y., Lu, L., Schwartz, G. G. Right ventricular pressure and dilation during pressure overload determine dysfunction after pressure overload. Am J Physiol Heart Circ Physiol. 278 (5), H1414-H1420 (2000).
- Lyhne, M. D., et al. Immediate cardiopulmonary responses to consecutive pulmonary embolism: a randomized, controlled, experimental study. BMC Pulm Med. 24 (1), 233(2024).
- Mortensen, C. S., et al. Impact of preload on right ventricular hemodynamics in acute pulmonary embolism. Crit Care Med. 48 (12), e1306-e1312 (2020).
- Lyhne, M. D., et al. Oxygen therapy lowers right ventricular afterload in experimental acute pulmonary embolism. Crit Care Med. 49 (9), e891-e901 (2021).
- Kramer, A., et al. Inhaled nitric oxide has pulmonary vasodilator efficacy both in the immediate and prolonged phase of acute pulmonary embolism. Eur Heart J Acute Cardiovasc Care. 10 (3), 265-272 (2020).
- Lyhne, M. D., et al. Levosimendan, milrinone, and dobutamine in experimental acute pulmonary embolism. Pulm Circ. 11 (3), 20458940211022977(2021).
- Krueger, K., Deissler, P., Coburger, S., Fries, J. W. U., Lackner, K. How thrombus model impacts the in vitro study of interventional thrombectomy procedures. Invest Radiol. 39 (10), 641-648 (2004).
- Brockmeier, S. L., Halbur, P. G., Thacker, E. L. Porcine Respiratory Disease Complex. Polymicrobial Diseases. , ASM Press. Washington (DC). (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved