Method Article
Usando oligonucleotídeos sintéticos modificados para testar enzimas metabolizadoras de ácidos nucleicos
Neste Artigo
Resumo
Aqui, é apresentado um protocolo para testar enzimas metabolizadoras de ácidos nucleicos, usando exemplos de enzimas ligase, nuclease e polimerase. O ensaio utiliza oligonucleotídeos marcados e não marcados com fluorescência que podem ser combinados para formar duplexes que imitam danos ao RNA e/ou DNA ou intermediários da via, permitindo a caracterização do comportamento enzimático.
Resumo
A disponibilidade de uma variedade de oligonucleotídeos sintéticos modificados de fornecedores comerciais permitiu o desenvolvimento de ensaios sofisticados para caracterizar diversas propriedades de enzimas metabolizadoras de ácidos nucleicos que podem ser executadas em qualquer laboratório de biologia molecular padrão. O uso de rótulos fluorescentes tornou esses métodos acessíveis a pesquisadores com equipamento de eletroforese PAGE padrão e um gerador de imagens habilitado para fluorescência, sem usar materiais radioativos ou exigir um laboratório projetado para o armazenamento e preparação de materiais radioativos, ou seja, um Hot Lab. A adição opcional de modificações padrão, como a fosforilação, pode simplificar a configuração do ensaio, enquanto a incorporação específica de nucleotídeos modificados que imitam danos ao DNA ou intermediários pode ser usada para sondar aspectos específicos do comportamento enzimático. Aqui, o projeto e a execução de ensaios para interrogar vários aspectos do processamento de DNA por enzimas usando oligonucleotídeos sintéticos disponíveis comercialmente são demonstrados. Isso inclui a capacidade das ligases de se unirem ou nucleases de degradar diferentes estruturas híbridas de DNA e RNA, uso diferencial de cofatores pela DNA ligase e avaliação da capacidade de ligação ao DNA das enzimas. Fatores a serem considerados ao projetar substratos de nucleotídeos sintéticos são discutidos e um conjunto básico de oligonucleotídeos que podem ser usados para uma variedade de ensaios de enzimas ligase de ácido nucleico, polimerase e nuclease são fornecidos.
Introdução
Todas as formas de vida requerem enzimas de processamento de ácido nucleico para realizar processos biológicos fundamentais, incluindo replicação, transcrição e reparo de DNA. As principais funcionalidades enzimáticas para essas vias são polimerases, que geram cópias de moléculas de RNA/DNA, ligases que unem substratos polinucleotídeos, nucleases que os degradam e helicases e topoisomerases, que fundem duplex de ácidos nucleicos ou alteram sua topologia 1,2,3,4,5,6,7,8,9,10 . Além disso, muitas dessas enzimas fornecem ferramentas moleculares essenciais para aplicações como clonagem, diagnóstico e sequenciamento de alto rendimento 11,12,13,14,15.
As características funcionais, cinética e especificidades de substrato dessas enzimas podem ser determinadas usando substratos de DNA/RNA marcados produzidos por oligonucleotídeos de recozimento. O rastreamento de substratos e produtos tem sido tradicionalmente alcançado pela introdução de um marcador radioativo (32P) na extremidade da fita 5 ', que pode então ser detectado por filme fotográfico ou com um sistema de imagem de fósforo16 , 17 . Embora os substratos radiomarcados ofereçam o benefício de maior sensibilidade experimental e não alterem as propriedades químicas de um nucleotídeo, os riscos potenciais à saúde decorrentes do trabalho com radioisótopos incentivaram o desenvolvimento da marcação de ácidos nucleicos não radioativos para fornecer uma alternativa mais segura para detecção de DNA e RNA 18,19,20. Dentre estes, a detecção de fluorescência, incluindo detecção direta de fluorescência, fluorescência resolvida no tempo e ensaios de transferência de energia/extinção de fluorescência se destacam como os mais versáteis 21,22,23,24. A extensa gama de fluoróforos permite diferentes designs de substratos de DNA / RNA com repórteres exclusivos em cada oligonucleotídeo25. Além disso, a estabilidade dos fluoróforos, quando comparados aos radioisótopos, permite que os usuários produzam e preservem quantidades significativas de substratos de DNA marcados com fluorescência19. Esses substratos marcados com fluoróforo podem ser incubados com a proteína de interesse, juntamente com diferentes combinações de cofatores de metal e nucleotídeos, para analisar a ligação e/ou a atividade enzimática. A visualização da ligação ou atividade pode ser observada usando vários canais de corante de fluoróforo com um sistema de imagem em gel. Como apenas os oligonucleotídeos marcados com fluorescência serão visíveis usando esta técnica, qualquer aumento ou diminuição no tamanho do oligonucleotídeo marcado será fácil de seguir. Os géis também podem ser corados posteriormente, com corantes de coloração de ácido nucleico para visualizar todas as bandas de DNA presentes no gel.
As ligases de ácidos polinucléicos são enzimas que unem fragmentos de DNA/RNA, catalisando a vedação de quebras pela formação de uma ligação fosfodiéster entre os terminais de DNA fosforilados 5' e o 3' OH do DNA. Eles podem ser divididos em dois grupos de acordo com sua necessidade de substrato de nucleotídeos. As ligases dependentes de NAD altamente conservadas são encontradas em todas as bactérias26, enquanto as enzimas dependentes de ATP estruturalmente diversas podem ser identificadas em todos os domínios da vida 8,27. As DNA ligases desempenham um papel importante no processamento do fragmento de Okazaki durante a replicação, além de estarem envolvidas em várias vias de reparo do DNA, como o reparo por excisão de nucleotídeos e bases, por meio do selamento de cortes espontâneos e cortes que são deixados após o reparo 8,10. Diferentes DNA ligases exibem capacidades variadas para unir diferentes conformações de quebras de DNA, incluindo cortes em um duplex, quebras de fita dupla, incompatibilidades e lacunas, bem como híbridos de RNA e DNA 28,29,30. Uma gama diversificada de substratos ligáveis pode ser montada por recozimento de oligonucleotídeos com um fosfato 5 'para gerar terminais justapostas de 5' e 3' em um duplex de ácido nucleico 31,32,33. O método de análise mais comum é a resolução por ureia PAGE em um formato de ensaio de ponto final; No entanto, inovações recentes incluíram o uso de eletroforese capilar em gel, que permite alto rendimento34, perfil espectrométrico de massa35, bem como um ensaio de farol molecular homogêneo, que permite o monitoramento resolvido no tempo36.
O primeiro passo em uma reação de ligação é a adenilação da enzima ligase por trifosfato de adenosina (ATP) ou dinucleotídeo de nicotinamida adenina (NAD), resultando em um intermediário enzimático covalente. A segunda etapa da reação é a adenilação do substrato de ácido nucleico na extremidade 5 'do local do corte, que é seguida pela ligação das fitas de ácido nucleico. Muitas enzimas ligase que são expressas recombinantemente em E. coli são purificadas na forma adenilada e, portanto, são capazes de ligar com sucesso ácidos nucléicos sem a adição de um cofator de nucleotídeo. Isso torna difícil determinar que tipo específico de cofator de nucleotídeo eles requerem para a ligação de ácidos nucléicos. Além de descrever ensaios para avaliar a atividade da DNA ligase, também é apresentado um método para determinar de forma confiável o uso de cofatores por meio da desadenilação da enzima usando substratos não marcados.
As nucleases são um grupo grande e diversificado de enzimas modificadoras de DNA / RNA e RNAs catalíticos que clivam as ligações fosfodiéster entre os ácidos nucléicos37. As funcionalidades da enzima nuclease são necessárias na replicação, reparo e processamento de RNA do DNA e podem ser classificadas por sua especificidade de açúcar para DNA, RNA ou ambos. As endonucleases hidrolisam as ligações fosfodiéster dentro de uma fita de DNA / RNA, enquanto as exonucleases hidrolisam as fitas de DNA / RNA um nucleotídeo de cada vez a partir da extremidade 3 'ou 5' e podem fazê-lo a partir da extremidade 3 'a 5' ou 5 'a 3' do DNA38.
Embora muitas proteínas de nuclease sejam inespecíficas e possam estar envolvidas em vários processos, outras são altamente específicas para uma sequência específica ou dano ao DNA 6,39,40. As nucleases específicas de sequência são usadas em uma ampla gama de aplicações biotecnológicas, como clonagem, mutagênese e edição de genoma. As nucleases populares para essas aplicações são nucleases de restrição41, nucleases de dedo de zinco42, nucleases efetoras semelhantes a ativadores transcricionais e, mais recentemente, as nucleases CRISPR projetadas guiadas por RNA43. Nucleases específicas de dano foram recentemente identificadas, como a nuclease EndoMS, que tem especificidade para incompatibilidades no DNA por meio de seu domínio de nuclease semelhante a RecB específico para incompatibilidade 5,44. Os ensaios de atividade da nuclease, historicamente, têm sido feitos como ensaios descontínuos com substratos radiomarcados; no entanto, além de suas outras desvantagens, elas não permitem a identificação do local que é cortado por uma proteína nuclease, o que é possível quando se utilizam substratos marcados com fluorescência45,46. Mais recentemente, foram desenvolvidos ensaios de nuclease contínua que funcionam usando diferentes corantes de DNA que interagem com o DNA em diferentes estados; por exemplo, emitindo um sinal fluorescente mais alto ao interagir com o dsDNA do que em seu estado não ligado, ou ligando-se especificamente a RNAs curtos47. Outros ensaios de nuclease contínua usam grampos de cabelo de DNA com um grupo fluoróforo na extremidade 5 'e um atenuador na extremidade 3', de modo que a fluorescência aumenta à medida que o oligonucleotídeo é degradado devido a uma separação do fluoróforo e do atenuador48. Embora esses ensaios permitam caracterizar a cinética das proteínas degradadoras do DNA, eles exigem conhecimento prévio da função e do substrato da enzima e também são limitados a enzimas que alteram a conformação do DNA para causar uma diferença na ligação do corante. Por esse motivo, os ensaios de endpoint que resolvem produtos de nuclease individuais ainda são desejáveis para fornecer informações sobre as modificações do DNA causadas pela atividade da proteína.
Aqui, um procedimento detalhado é apresentado para o projeto de oligonucleotídeos de DNA / RNA marcados com fluorescência que podem ser misturados e combinados para gerar substratos para testar a atividade de novas enzimas nuclease, polimerase e ligase. A validação deste conjunto básico de sequências de oligonucleotídeos simplifica o projeto experimental e facilita o perfil econômico de uma ampla gama de funcionalidades enzimáticas sem a necessidade de comprar um grande número de substratos sob medida. Um procedimento detalhado é fornecido para executar um ensaio enzimático de processamento de DNA padrão com esses substratos, usando o exemplo da atividade da DNA ligase e as modificações para testar e analisar as enzimas nuclease e polimerase são descritas. Além disso, um ensaio modificado para determinar a especificidade do cofator da enzima DNA ligase com alta precisão é fornecido, e sondas duplamente marcadas são usadas para avaliar a montagem de ligações multicomponentes. Finalmente, modificações no formato básico do ensaio são discutidas para permitir que ele seja usado para determinar as interações proteína-DNA com os mesmos substratos pelo ensaio de mudança de mobilidade eletroforética (EMSA).
Protocolo
1. Projeto e compra de oligonucleotídeos
NOTA: Projete oligonucleotídeos de fita simples para serem montados e recozidos nos duplex desejados. Uma ou mais fitas de um duplex devem conter uma fração fluorescente para rastrear o processamento de oligonucleotídeos pela enzima de interesse. Um conjunto básico de sequências de fita simples que podem ser montadas para uma variedade de atividades é fornecido na Tabela 1.
- Incorporar as modificações específicas necessárias para a enzima de interesse, conforme descrito abaixo.
- Para substratos de DNA ligase (Figura 1): Monte o substrato mais simples a partir de três oligonucleotídeos: uma fita doadora fosforilada 5' (NL2), uma fita aceptora marcada com 5' FAM (NL1) e um complemento que une as duas (NL3).
- Certifique-se de que os fios que fornecem o terminal 5' do corte ligável sejam fosforilados antes da montagem da mistura mestre do substrato na etapa 2. Encomende isso como uma modificação em NL2 (conforme indicado na Tabela 1) ou use fosforilação enzimática com polinucleotídeo quinase T4 após ressuspender os oligonucleotídeos.
- Inclua a fosforilação 5'-terminal de NL6 e NL8, que compreende o complemento de quebras de fita dupla representadas na Figura 1A (NL6 / NL7 e NL8 / NL9), pois isso se assemelha mais ao substrato natural produzido a partir de uma endonuclease de restrição. Use um substrato de rótulo duplo para determinar as extensões relativas da ligação para montagens de várias partes (consulte a etapa 6).
- Altere a fita complementar para produzir incompatibilidades (NL10) e lacunas (NL11).
NOTA: Variações no substrato cortado simples são representadas na Figura 1A. É possível usar outras sequências para produzir uma gama ainda maior de incompatibilidades ou lacunas mais longas, variando a posição sublinhada. - Substitua oligonucleotídeos de DNA por oligonucleotídeos de RNA.
NOTA: Variações no substrato cortado simples são representadas na Figura 1B. Uma gama mais ampla de duplexes de DNA / RNA pode ser gerada por combinações adicionais do conjunto de bases fornecido aqui para gerar, por exemplo, quebras de fita dupla contendo RNA e DNA. Um exemplo dessa variação é dado na etapa 6 abaixo, onde uma estratégia de rótulo duplo é usada.
- Para substratos de DNA polimerase: Montar os oligonucleotídeos NL1 e NL3 listados na Tabela 1 para obter um ensaio simples de extensão de primer. Investigue aspectos adicionais da atividade da polimerase introduzindo modificações nas fitas NL1 (primer) ou NL3 (molde).
- Incorpore análogos de base danificados no oligonucleotídeo NL3 antes da posição 20 para determinar a capacidade de contornar lesões danificadas na fita molde.
- Incorpore análogos de base danificados no oligonucleotídeo NL1 na posição 20 para determinar a capacidade de estender um primer danificado.
- Use RNL1 ou RNL3 no duplex para investigar a extensão de um primer de RNA ou o uso de um molde de RNA.
- Para substratos de nuclease (Figura 2): Monte oligonucleotídeos para fornecer uma faixa não exaustiva de substratos de fita dupla e simples ( Figura 2 Ai ), bem como uma variedade de junções batidas e abertas ( Figura 2 Aii ) e substratos danificados ( Figura 2B ).
- Para investigar as atividades da ribonuclease, substitua iterativamente NL1, NL2 e NL3 por RNL1, RNL2 e RNL3. Use versões adicionais de RNA de HJ5 e HJ6 para expandir ainda mais esse conjunto.
- Use os oligonucleotídeos MD5, MD6 e MD9 que tenham uma modificação posicionada centralmente que imita o dano oxidativo, um intermediário de reparo abásico ou um produto de desaminação ( Figura 2B ). Os substratos detectarão a clivagem do fio nesta posição. Rotule a fita NL3 do complemento com um fluoróforo ortogonal, como TAMRA, para detectar clivagem de fita dupla (consulte a etapa 6).
- Use a rotulagem ortogonal do complemento para detectar cortes de fita dupla nos locais incompatíveis nas fitas da sonda (NL5 e ND9) e do complemento (MD10 e NL10).
- Para substratos de DNA ligase (Figura 1): Monte o substrato mais simples a partir de três oligonucleotídeos: uma fita doadora fosforilada 5' (NL2), uma fita aceptora marcada com 5' FAM (NL1) e um complemento que une as duas (NL3).
- Solicite oligonucleotídeos sintéticos incorporando fluoróforos relevantes e outras modificações de um fornecedor comercial.
NOTA: Uma escala de síntese de 100 nM e purificação por HPLC subsequente à síntese são adequadas para os ensaios descritos.
2. Montagem e recozimento de duplex de ácido nucleico
- Ressuspensão e diluição de oligonucleotídeos
- Antes de abrir, centrifugue os oligonucleotídeos liofilizados em seus tubos de 2 mL em velocidade máxima em uma centrífuga de bancada por 2-5 min para garantir que o ácido nucléico esteja no fundo do tubo.
- Preparar uma matéria-prima de 100 μM ressuspendendo os oligonucleótidos em tampão TE [tris(hidroximetil)aminometano (Tris) 10 mM, ácido etilenodiaminotetracético (EDTA) 1 mM]. Certifique-se de que os oligonucleotídeos sejam completamente ressuspensos por vórtice suave repetido e centrifugação breve em velocidade máxima.
- Preparar uma matéria-prima de 10 μM diluindo uma alíquota de matéria-prima com tampão TE. Dilua o estoque de 10 μM com água ultrapura (água MQ) para preparar estoques de trabalho com concentrações de 0.5 μM, 0.7 μM ou 2.5 μM conforme a Tabela 2.
- Montagem e recozimento das misturas master de reação
- Utilizar as misturas principais de reacção para compor as combinações indicadas no quadro 2 e os volumes indicados no quadro 3. Para o ensaio de DNA ligase padrão e a maioria dos outros ensaios descritos aqui, a composição final do tampão é 50 mM Tris pH 8,0, 50 mM NaCl, 10 mM Ditiotreitol (DTT) com 10 mM Mg como cátion divalente.
- Recozer os oligonucleótidos num tubo de PCR ou de microcentrífuga aquecendo a 95 °C durante 5 minutos utilizando um bloco de aquecimento ou termociclador. Deixe esfriar até a temperatura ambiente por 30 min (volumes <1 mL) a 1 h (volumes >1 mL). Para oligonucleótidos mais longos (>40 nt), efectuar um arrefecimento mais lento utilizando um termociclador com uma rampa descendente de 95 °C a 25 °C durante 45 min, ou fazer flutuar o tubo que contém a mistura de recozimento num copo de 1 L de água a ferver e deixar arrefecer até à temperatura ambiente durante a noite.
- Adicione cofatores de nucleotídeos e outros componentes tampão sensíveis ao calor à mistura principal após o resfriamento à temperatura ambiente. Utilizar a mistura de reação final directamente para o ensaio por adição de enzima (ver passo 3 abaixo) ou conservar a -20 °C para utilização futura.
3. Configuração padrão do ensaio
- Montagem e início da reação do ensaio
- Combine 22,5 μL da mistura principal de substrato de interesse com 2,5 μL da DNA ligase ou outra enzima de interesse em um tubo de PCR. Execute reações em duplicata ou triplicada, especialmente se os resultados forem quantificados.
- Inclua um controle sem proteína (somente tampão) nas amostras de ensaio. Não inclua controles de cofator neste momento, se necessário.
NOTA: As enzimas podem ser armazenadas a -20 °C em glicerol a 50% v/v, permitindo que sejam pipetadas diretamente da solução. Certifique-se de que as soluções enzimáticas com glicerol estejam bem misturadas antes da adição, seja por pipetagem para misturar ou por vórtice suave.
- Transferir imediatamente as reações para uma máquina de PCR a 25 °C e incubar durante 30 min. Varie a temperatura e a duração dependendo das condições ideais para a atividade enzimática.
- Extinguir as reações adicionando 5 μL de corante de carga (95% de formamida, ácido etilenodiaminotetracético 0,5 M (EDTA), azul de bromofenol) e incubar a 95 °C por 5 min.
4. Análise dos resultados do ensaio
- Prepare os géis Tris-Borato-EDTA (TBE)-Ureia PAGE conforme descrito abaixo.
- Prepare um estoque de acrilamida a 20%, 7 M de ureia e 1x solução de TBE. Para o conjunto de oligonucleotídeos descrito aqui, use solução de acrilamida/bis na proporção de 29:1 para obter a resolução ideal.
- Para um gel, combine 10 mL de acrilamida a 20% e solução de ureia 7 M com 100 μL de APS (10%) e 3 μL de tetrametiletilenodiamina (TMED) e molde em um rodízio de gel.
- Depois que o gel solidificar, execute as amostras no gel de ureia TBE a 45 - 55 °C.
- Pré-execute o gel em 1x tampão TBE por 30 min a 10 mA por gel com aquecimento externo.
- Remova o excesso de uréia nos poços do gel lavando com 1x TBE usando uma pipeta de pastagem.
- Carregue 10 μL de cada reação e execute a 10 mA por 1,0-1,5 h com aquecimento externo.
- Visualize o gel no gerador de imagens com as configurações corretas para o fluoróforo escolhido. Para FAM, use um conjunto de filtros que forneça excitação/emissão a 495/519 nm, que é armazenado como uma predefinição na maioria dos geradores de imagens.
- Quantifique a intensidade da banda do produto e do substrato usando um software de processamento de imagem com o gerador de imagens ou um programa externo, como o ImageJ49,50, e calcule a porcentagem do produto usando a fórmula
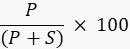
Onde P é o valor integrado da banda do produto e S é a área integrada da banda do substrato. No caso do exemplo da reação de DNA ligase, a banda do produto corre a 40 nucleotídeos (nt) e a banda do substrato a 20 nt.
5. Desadenilação da DNA ligase para testar a especificidade do cofator
- Preparação de master mixes de reação
- Preparar um conjunto de mistura principal contendo o oligonucleótido NL1 marcado com FAM, conforme descrito no quadro 4. Preparar um segundo conjunto contendo o oligonucleótido NL1 sem marcação FAM, conforme descrito no quadro 4.
- Separadamente, aqueça ambos os duplex de DNA a 95 ° C por 5 min e resfrie por 30 min a 1 h a 25 ° C. Não adicione cofator de nucleotídeo a nenhum dos master mixs.
- Montagem e início da reação de desadenilação
- Preparar uma única reacção de desadenilação para cada tipo/concentração de cofactor a ensaiar, combinando 10 μl da mistura principal não marcada com 2,5 μl de enzima ligase.
- Prepare tubos adicionais como controle sem cofator e sem controle de proteína (2,5 μL de tampão adicionado no lugar da enzima).
- Incubar as reações a uma temperatura específica para a atividade ideal da enzima, por 1-2 h. O tempo de incubação pode ser aumentado se a enzima ainda estiver adenilada
- Execute a reação de ligação com o cofator.
- Adicione 10 μL da mistura principal marcada e 2,5 μL dos cofatores de nucleotídeos desejados (por exemplo, ATP, NAD, ADP ou GTP) diretamente à reação desadenilada (concentração final de 0,1-1 mM).
- Adicione 2,5 μL de tampão de reação ao controle de cofator sem nucleotídeo.
- Incube as reações pelo mesmo período de tempo e temperatura usados anteriormente. Resfrie e visualize conforme descrito na etapa 4.
6. Usando substratos duplamente rotulados para ligadura imobilizada ou montagem de várias partes
- Projete e compre um oligonucleotídeo com uma porção fluorescente que tenha um espectro de excitação/emissão diferente do fluoróforo já usado.
- Na configuração descrita aqui, use o oligonucleotídeo NL2 (TAMRA) com 5-carboxitetrametilrodamina (TAMRA) na extremidade 3 '(Tabela 1).
- Monte a mistura master conforme descrito abaixo.
- Combine os componentes da reação descritos na etapa 2, incluindo proporções equimolares de todos os oligonucleotídeos usados na montagem, bem como cátions tampão e divalentes.
- Recozimento por aquecimento a 95 °C por 5 min e resfriamento a 25 °C por 30 min - 1 h. Adicione o cofator e a enzima e incube conforme descrito na etapa 3.
- Execute e crie imagens das amostras conforme descrito na etapa 4 usando os canais apropriados para o par de fluoróforos no substrato. No caso de FAM e TAMRA, esses são os canais de fluoresceína (FITC) e tetrametil rodamina (TRITC) presentes na maioria dos imageadores.
7. Avaliação da ligação ao DNA por Electrophoretic Mobility Shift Assay (EMSA) em gel nativo
- Prepare um gel TBE PAGE nativo a 10% conforme descrito abaixo.
- Combine 2,5 mL de acrilamida a 40%, 1 mL de 10x TBE, 100 μL de APS a 10%, 3 μL de TMED e 6,5 mL de água MQ e molde em um rodízio de gel.
- Monte a reação de ligação conforme descrito abaixo.
- Monte o substrato EMSA de acordo com a Tabela 5 de modo que o EDTA (10 mM) seja incluído e os íons metálicos sejam omitidos.
- Combine 20 μL da mistura principal de substrato EMSA com 5 μL da proteína em um tubo de PCR. Inclua uma amostra de controle sem proteína. Incubar durante 30 min a 25 °C.
- Analise por eletroforese nativa conforme descrito abaixo.
- Adicione 5 μL de corante de carga nativo 5x (EDTA 100 mM, azul de bromofenol a 0,25%, glicerol a 25% v/v e água MQ até 1 mL) às amostras.
- Carregue o gel preparado e deixe funcionar a 60 V por 2-3 h com resfriamento por circulação de água até que a frente do corante esteja alguns centímetros acima da extremidade do gel.
- Visualize e analise os géis conforme descrito na etapa 4.
Resultados
Ligação por DNA ligase
A atividade enzimática da DNA ligase resultará em um aumento no tamanho do oligonucleotídeo marcado com fluorescência quando visualizado em um gel PAGE de ureia. No caso dos substratos para ligação de DNA e RNA listados na Tabela 2, isso corresponde a uma duplicação de tamanho de 20 nt para 40 nt (Figura 3A). A atividade enzimática ideal pode ser determinada alterando as condições, como temperatura, concentração de proteína ou tempo de incubação ( Figura 3B ) cofatores de nucleotídeos, cofatores de metal ( Figura 3C ). As atividades relativas de uma ligase em diferentes substratos podem ser comparadas em paralelo (Figura 3D).
A quantificação das bandas do produto e do substrato é expressa como a porcentagem do substrato total ligado e, conforme mostrado na Figura 3, pode ser usada para avaliar a atividade específica da enzima ou para determinar a atividade ótima, como preferência de cátions divalentes, temperatura ou pH.
A DNA ligase bacteriana DV-1-1-Lig (Figura 3) é capaz de ligar substratos de DNA cortados e incompatíveis e pode utilizar magnésio e manganês para atividade de ligação, com preferência por magnésio. Mais detalhes sobre esta enzima são fornecidos em51.
Extensão do primer pela DNA polimerase
A atividade da DNA polimerase através da extensão do primer marcado com fluorescência de 20 nt resultará em um aumento de tamanho de até 40 nt ao usar o conjunto de oligonucleotídeos apresentado aqui ( Figura 4A ). Os produtos parcialmente estendidos aparecerão como uma escada de produtos até o tamanho do modelo (Figura 4B e Figura 4C). O ensaio de extensão do primer descrito aqui ( Figura 4C ) levou à síntese completa da fita do primer.
Degradação por nuclease
A atividade da nuclease resulta em uma redução no tamanho do oligonucleotídeo marcado com fluorescência quando visualizado em um gel de ureia PAGE. Nucleases com atividade de endonuclease específica podem resultar em um único produto de 20 nt ( Figura 5A-C ). Nucleases com atividade de exonuclease resultarão em oligonucleotídeos marcados com fluorescência de tamanhos variados (Figura 5D-F). Aqui, são mostrados os resultados de uma proteína nuclease do metagenoma antártico bacteriano, que exibe atividade de endonuclease específica no substrato de sítio abásico de fita dupla e atividade de exonuclease não específica no substrato de fita simples (Figura 5C e Figura 5F, respectivamente).
Ensaio de uso de codefator de codefator de ligase e nucleotídeo
Muitas enzimas ligase expressas recombinantemente são purificadas em um estado já adenilado a partir de ATP ou NAD eliminado de seu hospedeiro 51,52,53,54,55. A remoção desse intermediário de AMP covalente é necessária para a identificação precisa da faixa de cofatores de nucleotídeos que a enzima pode usar para a ligação de substratos de ácidos nucléicos51. A renovação da enzima ligase adenilada com substrato não marcado na ausência de um cofator de nucleotídeo exógeno esgotará o intermediário de adenilação. Usando substratos de DNA marcados com fluorescência e adicionando cofator de nucleotídeo apenas na segunda etapa, qualquer produto de ligação que seja visível ao usar um canal fluorescente (Fluoresceína-FITC) no gerador de imagens de gel é o resultado da adenilação com o cofator de nucleotídeo adicionado nesta etapa.
Ensaios de atividade configurados com uma ligase de DNA bacteriana expressa em um sistema de E. coli mostram que ela foi purificada em uma forma pré-adenilada e exibiu uma capacidade de fundo de ligar o DNA cortado sem cofator adicional ( Figura 6 Ai-ii ). A adição de ATP à ligase adenilada aumenta a quantidade de produto ligado formado na reação, mas isso nem sempre é confiável, pois essa atividade basal pode dar uma impressão incorreta do uso de cofatores de amplo espectro ou adições adicionais de cofatores de nucleotídeos a uma reação podem inibir a ligação do substrato. Ao incubar primeiro a ligase com uma versão não marcada do substrato de DNA cortado, o AMP é virado e nenhuma ligação é observada no substrato de corte de DNA marcado, a menos que o ATP seja adicionado à reação. O segundo ensaio de atividade (Figura 6B) mostra que a DNA ligase desadenilada melhorou a atividade de ligação no substrato de DNA nick com a adição de ATP e ADP. Há também alguma melhora na ligadura com a adição de GTP, que é maior do que a ligadura de fundo observada no controle sem cofator. A ligadura observada nas reações com NAD é comparável à ligação observada nas reações de controle sem cofator, o que exclui o NAD como um cofator para a ligadura.
Resultados do ensaio duplamente marcado
Os fluoróforos ortogonais podem ser usados para estabelecer atividade em diferentes partes de um substrato complexo. O exemplo na Figura 7 mostra a atividade de uma DNA ligase R2D56 recentemente descrita em comparação com a DNA ligase T4 em um duplex de DNA / RNA imobilizado. A ligação do aceptor de DNA à seção doadora de RNA do substrato foi detectada usando 6-FAM, enquanto a ligação do aceptor de RNA a um doador de DNA foi detectada com 5-TAMRA (Figura 7A). A extensão relativa da ligação do DNA para ambas as extremidades do substrato de RNA pode ser avaliada pela presença de uma banda de produto com fluorescência nos canais 6-FAM e 5-TAMRA, que aparece em amarelo na imagem composta, enquanto os individuais 6-FAM e 5-TAMRA são verdes e amarelos, respectivamente (Figura 7B). Conforme detalhado em uma publicação anterior56, apenas a ligase R2D foi capaz de ligar o DNA à extremidade 5' do RNA, enquanto ambas as ligases foram capazes de ligar o DNA à extremidade 3' do RNA. Ao ligar ambas as moléculas de DNA ao RNA em misturas de reação única, a ligase R2D pode ligar os oligos de DNA a ambas as extremidades do RNA, à medida que uma banda se desloca para cima e uma mudança de cor para amarelo é observada ( Figura 7C ).
O segundo exemplo na Figura 8 usa uma abordagem de marcação dupla para demonstrar a ligação de vários oligonucleotídeos em pH diferente. O substrato, montado a partir de uma mistura de sete oligonucleotídeos, foi usado para mostrar a capacidade da ligase R2D de montar fragmentos curtos. A fita 5 'tem uma fita de 14 nt marcada com fluoróforo FAM, enquanto a fita do complemento tem um fluoróforo TAMRA na extremidade 3' do oligonucleotídeo de 16 nt. A ligadura bem-sucedida pode ser observada por bandas mais altas adicionais para o oligo FAM (verde) e o oligo TAMRA (vermelho). A sobreposição de ambos os fluoróforos dá a banda de nucleotídeos em amarelo como fitas completamente ligadas do mesmo tamanho.
Resultados da ligação ao DNA de uma enzima DNA ligase usando EMSA
A ligação da enzima DNA ligase a um DNA cortado fosforilado resulta em um complexo que funciona com um peso molecular mais alto do que o oligonucleotídeo sozinho (Figura 9A). Aqui, a ligação de uma DNA ligase dependente de ATP bacteriana ao substrato de DNA de corte é mostrada. Em altas concentrações de proteína, a maior parte do substrato de DNA marcado é ligada e vista nas bandas de maior peso molecular; em concentrações proteicas mais baixas, predomina o substrato de DNA livre (Figura 9B).

Figura 1: Esquemas dos diferentes substratos de ácidos nucleicos projetados para testar a atividade enzimática da ligase. As estrelas representam a marcação com a 6-carboxifluoresceína no terminal 5' (5' FAM). As fitas marcadas são indicadas por uma linha preta ou azul escura/vermelha (no caso de duplexes de DNA/RNA), enquanto as porções não marcadas de duplex de substrato são indicadas por uma linha cinza ou azul-claro/vermelho (no caso de duplexes de DNA/RNA). Os fios rotulados são de 20 nt e, se os fios forem ligados, eles formam um produto de 40 nt. Os locais fosforilados 5' são indicados por um P em um círculo. As fitas de oligonucleotídeos são rotuladas e os nomes são referenciados na Tabela 1 e na Tabela 2. (A) Projeto de substratos de DNA de fita dupla com diferentes tipos de quebras, usados para testar a atividade enzimática de DNA ligases. (B) Projeto de substratos de fita dupla de RNA e RNA/DNA que incorporam oligonucleotídeos de DNA e RNA. Os substratos contêm um único local de corte e são usados para testar a capacidade das ligases de selar quebras de corte de duplexes de RNA / DNA. A linha vermelha representa oligonucleotídeos de RNA e as linhas azuis representam oligonucleotídeos de DNA. Clique aqui para ver uma versão maior desta figura.
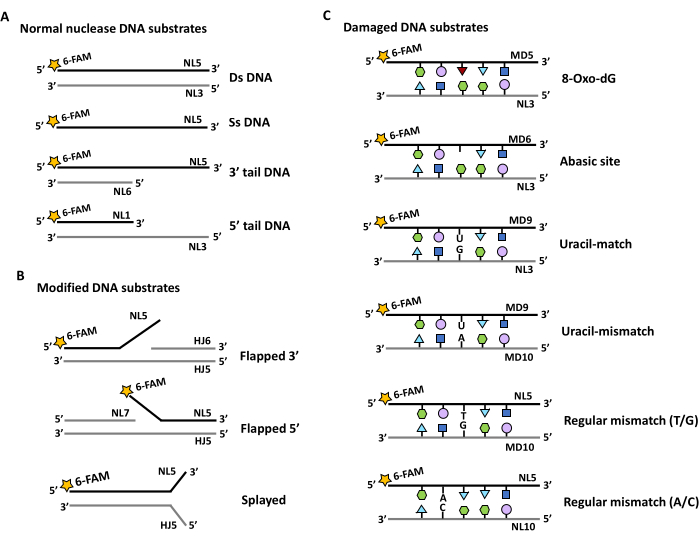
Figura 2: Esquemas dos diferentes substratos de ácidos nucleicos projetados para testar a atividade enzimática da nuclease. As estrelas representam a marcação com a 6-carboxifluoresceína no terminal 5' (5' FAM). As fitas rotuladas são indicadas por uma linha preta, enquanto as partes não rotuladas dos duplex de substrato são indicadas por uma linha cinza. Os locais fosforilados 5' são indicados por um P em um círculo. As fitas de oligonucleotídeos são rotuladas e os nomes são referenciados na Tabela 1 e na Tabela 2. (A) Projeto de substratos com porções de fita dupla e simples. (B) O design de substratos de DNA de fita dupla é modificado para gerar retalhos de fita simples na extremidade 3 'ou 5' (Flapped 3 ', 5' ou Flapped ambas as extremidades (espalhadas)). (C) Projeto de substratos de fita dupla incorporando bases danificadas ou descasamentos em uma posição central. Clique aqui para ver uma versão maior desta figura.
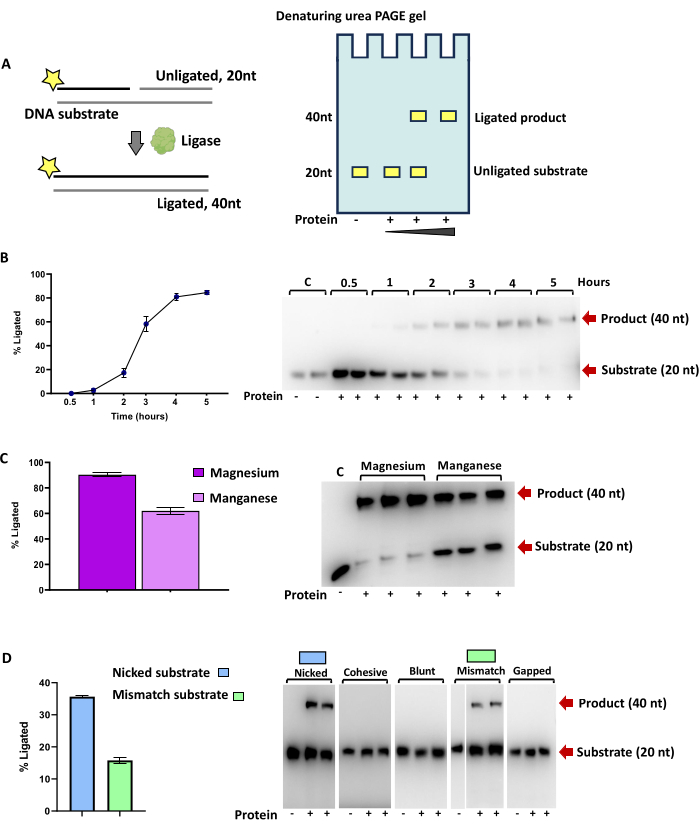
Figura 3: Teste da atividade de ligação de uma DNA ligase dependente de ATP bacteriana DV-1-1-Lig. (A) Esquema de ensaios enzimáticos para atividade de ligase em substratos de DNA com resultados analisados em um gel TBE ureia PAGE. As estrelas representam a marcação com a 6-carboxifluoresceína no terminal 5' (5' FAM). As fitas rotuladas são indicadas por uma linha preta, enquanto as partes não rotuladas de duplex de substrato que não são visíveis durante a análise são indicadas por linhas cinzas. (B) Quantificação da ligação por DV-1-1-Lig em DNA cortado em diferentes pontos de tempo. A atividade contra cada substrato foi realizada em duplicata. As reações foram incubadas por diferentes períodos de tempo (0,5 h, 1 h, 2 h, 3 h e 4 h) a 25 ° C, com concentração final de proteína de 4 μM, concentração final de ATP de 1 mM e concentração final de íon magnésio de 10 mM. (C) Ligação de substrato de DNA cortado com magnésio (Mg) ou manganês (Mn). As reações foram realizadas por 3 h, a 25 °C, com concentração final de ATP de 1 mM e concentrações finais de íons metálicos de 10 mM. (D) Resultados da ligação em diferentes substratos de DNA. As reações foram realizadas por 8 h, a 20 °C, com concentração final de proteína de 2 μM, concentração final de ATP de 1 mM e concentração final de magnésio de 10 mM. A adição de proteína à reação é indicada por um símbolo de mais (+). As reações de controle são indicadas por C, e a ausência de proteína contida é indicada por um símbolo de menos (-). O produto (40 nt) e o substrato (20 nt) são indicados por setas vermelhas. Os resultados dos ensaios de atividade foram visualizados usando um sistema de imagem. As bandas foram quantificadas por integração de intensidade usando o software ImageJ49 e os gráficos foram gerados usando um software gráfico. Clique aqui para ver uma versão maior desta figura.
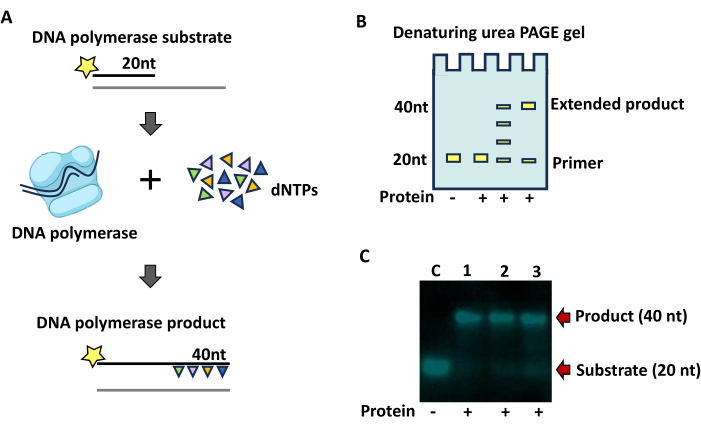
Figura 4: Ensaio de DNA polimerase. (A) Esquema do ensaio de extensão do primer em um substrato de DNA. As estrelas representam a marcação com a 6-carboxifluoresceína no terminal 5' (5' FAM). As fitas rotuladas são indicadas por uma linha preta, enquanto as partes não rotuladas de duplex de substrato que não são visíveis durante a análise são indicadas por linhas cinzas. (B) Esquema de um resultado antecipado do gel TBE Urea PAGE mostrando um aumento no comprimento do primer marcado com a adição de nucleotídeos. (C) Exemplo de extensão de primer com enzima DNA polimerase de fragmento de E. coli Klenow. A adição de proteína à reação é indicada por um símbolo de mais (+). Pista 1, 12,5 U; Pista 2, 2,5 U; Pista 3, 1.25U. As reações de controle são indicadas por um C, e a ausência de proteína contida é indicada por um símbolo de menos (-). As reações foram realizadas por 15 min a 25 ° C e continham 5 mM de MgCl2, 50 mM de Tris pH 8,0, 50 mM de NaCl2, 1 mM de DTT e 0,25 mM de dNTPs. O produto (40 nt) e o substrato (20 nt) são indicados por setas vermelhas. Os resultados dos ensaios de atividade foram visualizados usando um sistema de imagem. Clique aqui para ver uma versão maior desta figura.

Figura 5: Atividade de teste de uma nuclease do metagenoma antártico bacteriano usando diferentes substratos, metais e temperaturas de incubação. (A) Atividade de endonuclease específica do esquema de uma proteína nuclease no substrato do sítio abásico (indicado por um x). As estrelas representam a marcação com a 6-carboxifluoresceína no terminal 5' (5' FAM). As linhas pretas representam as fitas rotuladas e as linhas cinzas representam as fitas de DNA não marcadas. O corte específico pela nuclease é mostrado no lado direito do sítio abásico, mas também pode ocorrer no lado esquerdo. (B) Esquema de um gel de ureia desnaturante PAGE mostrando substrato não cortado (40 nt) na ausência de proteína indicada por um símbolo de menos (-) e o produto cortado (20 nt), na presença de uma nuclease indicada por um símbolo de mais (+). (C) Um exemplo de um gel TBE ureia PAGE mostrando resultados da atividade específica da nuclease endonuclease em um substrato de DNA de fita dupla com um sítio abásico. O ensaio foi realizado com uma concentração proteica de 1,0 μM e 1 mM de MgCl2. Duas reações de controle foram realizadas a 20 °C, uma sem proteína (poço 1) e outra sem metal (poço 2). As reações foram incubadas por 5 h em temperaturas crescentes de 1 °C a 50 °C, conforme indicado acima da imagem do gel. A adição da proteína é indicada por um símbolo de mais (+), e a ausência da proteína é indicada por um símbolo de menos (-). O substrato e o produto são indicados por setas vermelhas. (D) Esquema mostrando a atividade de exonuclease não específica de uma proteína nuclease em um substrato de fita simples. As estrelas representam a marcação com a 6-carboxifluoresceína no terminal 5' (5'FAM). As linhas pretas representam os fios rotulados. O corte não específico da nuclease resulta em fitas marcadas de comprimentos variados (<39 nt). (E) Esquema representando um gel PAGE de ureia desnaturante mostrando substrato não cortado (40 nt), onde nenhuma proteína foi adicionada (-), e mostrando substrato cortado de comprimentos variados, onde a proteína foi adicionada (+) que pode resultar da atividade de uma exonuclease não específica. (F) Os géis TBE ureia PAGE mostram um exemplo de atividade de exonuclease não específica da mesma nuclease do metagenoma antártico com um substrato de fita simples. O ensaio foi realizado a 20 °C por 4 h com proteína na concentração final de 1,5 μM e concentração final do íon metálico na concentração de 10 mM. O íon metálico usado é indicado acima da imagem. A adição da proteína é indicada por um símbolo de mais (+), e a ausência da proteína é indicada por um símbolo de menos (-). O substrato (40 nt) é indicado pela seta vermelha, e os produtos de diferentes comprimentos são indicados pela pinça vermelha. Os resultados de todas as reações de nuclease foram visualizados usando um sistema de imagem. Clique aqui para ver uma versão maior desta figura.
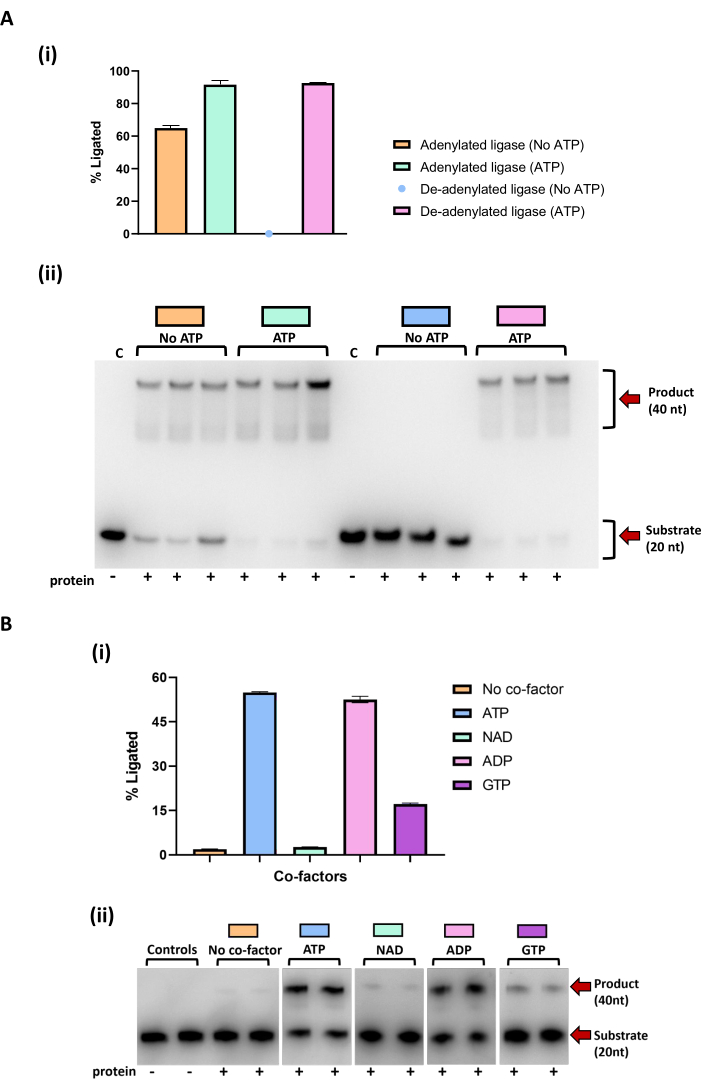
Figura 6: Resultados de ligação do substrato de DNA cortado por versões adeniladas e desadeniladas de uma DNA ligase bacteriana. (A) i) Quantificação da ligação pela enzima ligase adenilada e desadenilada, com e sem ATP. Os pontos no gráfico representam as médias de cada réplica de reação. Barras de erro padrão estão incluídas. ii) TBE ureia gel PAGE mostrando os resultados da ligação no substrato nick DNA pela enzima ligase adenilada e desadenilada, com e sem ATP. As reações foram realizadas em triplicata. A enzima desadenilada foi pré-incubada por 2 h a 25 °C com substrato de DNA nick não marcado e enzima 0,1 μM, seguida por uma incubação de 1 h com substrato de DNA nick marcado. A enzima adenilada não foi pré-incubada com o substrato não marcado. ATP (1 mM) foi adicionado às reações juntamente com a adição de substrato de DNA marcado. (B) i) Quantificação da ligadura pela ligase desadenilada no DNA de corte com diferentes cofatores (ATP, NAD, ADP e GTP). Os pontos no gráfico representam as médias de cada concentração. Barras de erro de desvio padrão estão incluídas. ii) TBE ureia PAGE mostrando resultados de ligadura pela ligase, com e sem adição de diferentes cofatores. A atividade contra cada substrato foi realizada em duplicata. As reações foram pré-incubadas por 2 h a 25 ° C com substrato de DNA cortado não marcado, proteína de 4 μM e íon de magnésio de 5 mM, seguido por uma incubação de 4 h com a adição de substrato de DNA cortado marcado, magnésio de 5 mM e diferentes cofatores na concentração final de 1 mM. A adição de proteína à reação é indicada por um símbolo de mais (+). Foram utilizadas reações de controle que não continham proteína (Controles, C) ou cofator (Sem cofator). O produto (40 nt) e o substrato (20 nt) são indicados por setas vermelhas. Os resultados dos ensaios de atividade foram visualizados usando um sistema de imagem. As bandas foram quantificadas por integração de intensidade usando o software ImageJ49. Os gráficos foram gerados usando um software gráfico. Clique aqui para ver uma versão maior desta figura.

Figura 7: Ligação de oligonucleotídeos de DNA marcados com fluorescência curtos em qualquer extremidade de um oligo de RNA fosforilado 5 ', posicionado por modelos de DNA. (A) Esquema da ligação DNA-RNA com ranhura de DNA mostrando como possíveis produtos de ligação podem ser visualizados usando uma estratégia de marcação dupla. (B) Esquema de possíveis produtos que se espera que sejam vistos em um gel Urea-PAGE fotografado em dois canais. (C) Resultados experimentais da ligação de fluoróforo duplo. As reações de ligação foram testadas usando T4 DNA Ligase e R2D ligase, ambas em reações isoladas onde o DNA foi ligado à extremidade 5' (pista 2-4) ou à extremidade 3' (pista 5-7) do RNA ou em uma única reação onde ambos os oligonucleotídeos de DNA foram ligados na mesma mistura de reação (pista 8-10). Nenhum controle proteico (NPC) não teve nenhuma enzima adicionada. As condições de reação e os oligonucleotídeos específicos usados neste exemplo são os mesmos dados em56. Clique aqui para ver uma versão maior desta figura.
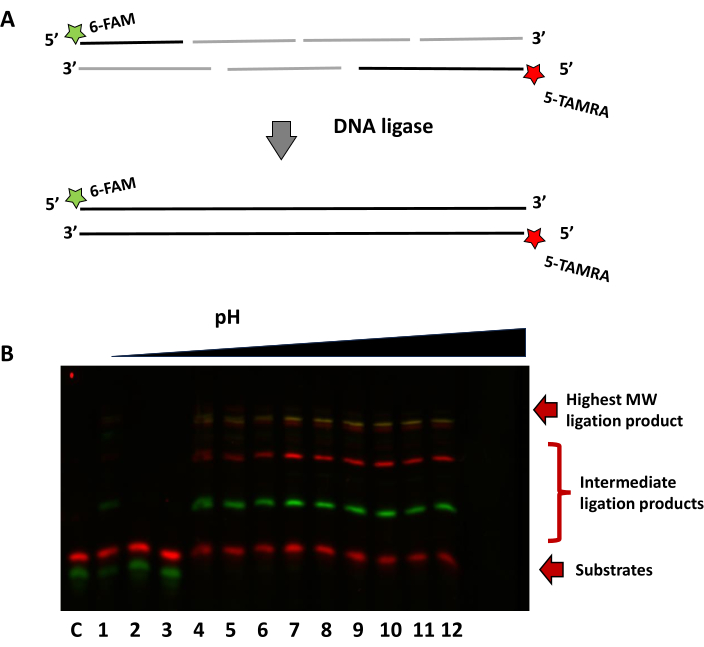
Figura 8: Ligação de múltiplos segmentos curtos de oligonucleotídeos com três variantes R2D em pH diferente. (A) Esquema da estratégia de ligação de várias partes. (B) Gel representativo mostrando a dependência do pH de um conjunto de várias partes, fotografado com os canais FAM e TAMRA. Pista C sem controle enzimático, Pistas 1-3 pH 6.0, Pista 4-6 pH 6.5, Pista 7-9 pH 7 e Pista 10-12 pH 7.5. Clique aqui para ver uma versão maior desta figura.
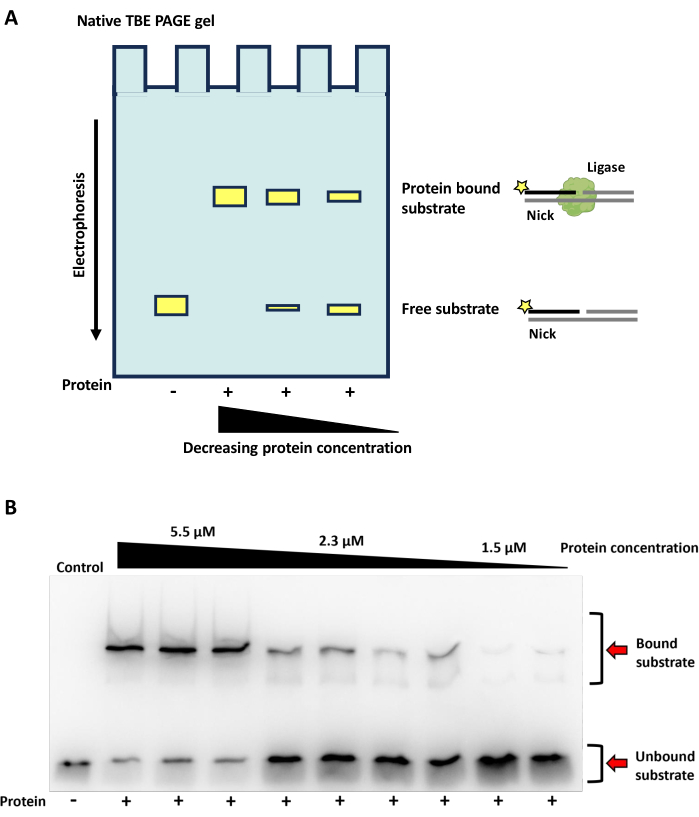
Figura 9: Resultados da EMSA. Gel TBE PAGE esquemático e nativo de um ensaio de mudança de mobilidade eletroforética (EMSA) visualizando a atividade de ligação de uma DNA ligase dependente de ATP (proveniente de dados de metagenoma dos Vales Secos de McMurdo, Antártica) em um substrato de DNA. (A) Esquema da atividade de ligação de EMSAs / DNA por uma DNA ligase no substrato de DNA nick. Os resultados da ligação são visualizados em um gel TBE PAGE não desnaturante. Os substratos de DNA ligados à enzima ligase migram mais lentamente através do gel, enquanto os substratos livres de enzimas migram mais rapidamente, resultando em uma mudança no tamanho da banda (caixas amarelas) visualizada no gel. À medida que os substratos são visualizados em um gel não desnaturante, os oligonucleotídeos permanecerão recozidos, permitindo que a fita marcada com FAM (estrela amarela) esteja presente em substratos livres e ligados. Um gradiente de concentração de proteína pode ser usado para determinar a concentração de proteína para uma ligação ideal. (B) Visualização de um EMSA em um gel TBE PAGE nativo, mostrando a capacidade de ligação de uma DNA ligase dependente de ATP a um substrato de DNA em diferentes concentrações de proteínas. A enzima foi incubada com substrato de DNA cortado por 30 min a 25 °C, com concentração final de ATP de 1 mM e EDTA de 40 mM. Três concentrações diferentes de proteínas foram usadas (5,5 μM, 2,3 μM e 1,5 μM). As reações foram executadas em um gel TBE nativo a 10%, com corante de carga nativo nas reações. Amostras contendo proteína foram esgotadas em triplicatas para diferentes concentrações de proteína. As faixas de controle contêm substrato de DNA cortado com 1 mM, ATP final e EDTA, mas nenhuma proteína. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Sequências de oligonucleotídeos de substrato de DNA usadas para construir substratos de ensaio. Os danos são indicados em negrito e sublinhado. As posições de incompatibilidades e lacunas no duplex final são sublinhadas. Abreviaturas: 5' 6-carboxifluorescien (5' FAM), 8-Oxo-desoxiguanosina (8OxodG), tetrohidrofurano abásico (dSpacer). Clique aqui para baixar esta tabela.
Tabela 2: Combinações de oligonucleotídeos usadas para montar misturas principais para diferentes ensaios enzimáticos. Clique aqui para baixar esta tabela.
Tabela 3: Configuração de misturas mestras de ensaio com até quatro oligonucleotídeos. Consulte a Tabela 2 para combinações de oligonucleotídeos a serem usadas para diferentes substratos de ensaio e texto para obter detalhes sobre as condições de reação. No mínimo, é necessário um oligonucleotídeo marcado - porções adicionais do duplex são indicadas por colchetes. Clique aqui para baixar esta tabela.
Tabela 4: Componentes para uma mistura master rotulada e não rotulada para fazer nick DNA duplex. Clique aqui para baixar esta tabela.
Tabela 5: Configuração de master mixes EMSA para diferentes combinações de duplex. Consulte a Tabela 3 para combinações de oligonucleotídeos a serem usadas para diferentes substratos EMSA e texto para obter detalhes sobre as condições de reação. Os substratos EMSA são projetados usando os mesmos oligonucleotídeos que os dos ensaios de atividade. Clique aqui para baixar esta tabela.
Discussão
Etapas críticas no protocolo
Projeto e compra de oligonucleotídeos: Ao comprar os oligonucleotídeos para formação duplex, é essencial considerar o design da sequência. Recomenda-se o uso de uma ferramenta de analisador de oligo para prever as propriedades da sequência de nucleotídeos, como conteúdo de GC, temperatura de fusão, estrutura secundária e potencial de dimerização, antes de solicitar57.
Montagem e recozimento de duplexes de ácido nucleico: Ao preparar duplexes de RNA/RNA-DNA, deve-se tomar cuidado para evitar a contaminação por RNase usando reagentes e água livres de RNase ou adicionando um inibidor de RNAse (desde que a enzima sob investigação não seja uma RNAse). Equipamentos, luvas e espaço de bancada devem ser tratados com uma solução de descontaminação de RNase antes de montar as misturas principais para evitar a degradação dos oligonucleotídeos58. Os estoques mestres dos oligonucleotídeos de RNA podem ser feitos em lotes menores em caso de contaminação.
As DNA ligases sempre requerem um cofator de nucleotídeo, ATP ou NAD, em uma concentração final entre 0,1 e 1 mM. As DNA polimerases requerem dNTPs para a síntese das fitas, e geralmente são adicionadas em proporções equimolares a 50 μM de cada. Ao preparar master mixes para duplex de ligase e polimerase, os cofatores de nucleotídeos, como ATP, NAD e dNTPs, devem ser adicionados à master mix após a mistura ter sido aquecida e resfriada à temperatura ambiente, pois são sensíveis ao calor.
O tampão 10x para recozimento dos oligonucleotídeos requer a adição de DTT, que tem uma meia-vida curta e, idealmente, precisa ser preparado fresco ou congelado antes do uso. Alíquotas menores do buffer 10x podem ser preparadas com antecedência e armazenadas a 4 °C, com a adição de TDT antes do uso.
Os estoques de oligonucleotídeos e as misturas-mestre devem ser armazenados a -20 °C para uso a longo prazo, e oligonucleotídeos marcados com fluorescência ou misturas envoltas em papel alumínio para evitar o fotobranqueamento do fluoróforo. Para evitar ciclos repetidos de congelamento e descongelamento que podem comprometer a integridade dos oligonucleotídeos, é aconselhável preparar e usar volumes menores (>1 mL).
Configuração do ensaio e análise dos resultados: A inclusão de controles é essencial para a interpretação correta dos resultados do ensaio. Um controle sem proteína (substrato de DNA com solução tampão) deve ser usado para garantir que a atividade aparente no substrato seja o resultado da enzima. No caso da nuclease, a degradação do substrato exógeno causará bandas de baixo peso molecular ou escada no controle, enquanto no caso da ligase ou polimerase, a desnaturação duplex incompleta resultará em uma banda de alto peso molecular no controle. Um controle positivo do tamanho do produto esperado é fornecido na Tabela 2 e deve ser incluído para verificar o tamanho correto do produto.
Parâmetros importantes na eletroforese bem-sucedida do produto do ensaio foram descritos em um protocolo anterior59. Isso inclui garantir que a porcentagem de acrilamida seja apropriada para o tamanho do substrato e o uso de um corante de carga apropriado, dependendo do tamanho do substrato e do tipo de gel necessário para a visualização dos resultados. O corante de rastreamento azul de bromofenol tem o tamanho aproximado de um oligonucleotídeo de 10 bases e, portanto, é adequado para o conjunto de oligonucleotídeos descrito aqui; No entanto, se houver uma banda de corante sobreposta ao produto fluorescente ou bandas de substrato ao usar nucleotídeos mais curtos, o corante de rastreamento pode ser trocado por xileno cianol, que corre mais lentamente60.
Para garantir uma boa resolução das bandas de substrato/produto, o tanque de gel deve ser aquecido externamente em banho-maria ou funcionando com alta tensão (por exemplo, 180 V). A pré-execução dos géis PAGE de ureia por pelo menos 30 min e a lavagem dos poços com uma pipeta para remover o excesso de ureia são essenciais para obter bandas retas e afiadas adequadas para quantificação.
Para quantificação de substratos e produtos, uma faixa de 20% a 80% do material total deve ser convertida em produto para permitir a integração precisa das bandas de gel fluorescente. Se estiver testando uma nova enzima, recomenda-se executar um gradiente de concentrações de proteínas para permitir que medições subsequentes sejam feitas nessa faixa. Muitos geradores de imagens de fluorescência possuem recursos de integração de banda embutidos que podem ser usados para essa finalidade. Se estiver usando um programa externo como o ImageJ49, certifique-se de que a imagem do gel seja exportada em alta qualidade no formato tiff.
Modificações e solução de problemas da técnica
Projeto e compra de oligonucleotídeos: Os oligonucleotídeos fornecidos neste protocolo são pontos de partida úteis e podem ser expandidos, conforme sugerido na seção de métodos, alterando as sequências de oligonucleotídeos e incorporando modificações.
Configuração padrão do ensaio e análise dos resultados: Experimentos piloto são essenciais ao testar a atividade de uma nova enzima, pois as condições ideais de reação variam entre diferentes proteínas; Os parâmetros indicados no presente protocolo destinam-se apenas a ser um ponto de partida. Fatores como concentração de enzimas, temperatura de reação, duração da incubação, cofator e composição/pH do tampão podem variar durante a mistura principal e a montagem da reação do ensaio. As concentrações de cofatores são especialmente importantes, pois o excesso de cofatores de nucleotídeos ou íons metálicos pode ser inibitório, e é aconselhável testar uma faixa de concentrações de cada um. Para DNA polimerases, as concentrações de dNTP recomendadas variam de 20 a 200 μM no total, no entanto, altas concentrações de dNTP diminuem a fidelidade61. Da mesma forma, as polinucleotídeos ligases são tipicamente testadas com cofator de nucleotídeo de 0,1-1,0 mM, mas concentrações excessivas causam DNA acumulado para adenilato e inibição da reação62.
O protocolo padrão aqui usa Mg como um cátion divalente; no entanto, algumas enzimas são mais ativas com manganês (Mn) ou zinco (Zn). As misturas principais contendo Mn ou Zn devem ser preparadas com um tampão de pH mais baixo (<7,5) e os metais devem ser adicionados após o aquecimento. As misturas principais devem ser usadas no mesmo dia para evitar precipitação e inibição da atividade enzimática.
Aditivos, incluindo agentes de aglomeração como o polietilenoglicol (PEG) ou estabilizadores como a albumina do soro bovino, podem ser usados para aumentar a atividade de algumas enzimas63,64. Estes devem ser adicionados após a etapa de recozimento devido à sua termolabilidade. Todos os reagentes de origem biológica devem ser de grau de biologia molecular para evitar a introdução de nucleases contaminantes.
O volume de tampão de têmpera de formamida usado neste protocolo é adequado para o conjunto básico de oligonucleotídeos. No entanto, para oligonucleotídeos mais longos, o volume de formamida deve ser aumentado para entre 10 μL e 20 μL para garantir a separação completa da fita, e as reações extintas podem ser resfriadas em gelo e armazenadas a 4 ° C até a eletroforese.
Com algumas enzimas, a ligação apertada da proteína ao substrato / produto pode impedir a migração dos oligonucleotídeos para o gel durante a eletroforese, especialmente quando a enzima é usada em altas concentrações. Isso aparecerá como uma falta de bandas de produto/substrato no gel e, muitas vezes, um acúmulo de material fluorescente (produto e/ou substrato complexado com proteína) nos poços. Para interromper esses complexos, a mistura de ensaio pode ser tratada com proteinase K antes da adição do tampão de têmpera, ou o dodecil sulfato de sódio (SDS) pode ser adicionado durante a têmpera.
A atividade da DNA ligase produz duas bandas discretas, que são fáceis de quantificar. É possível usar o mesmo método para quantificar a atividade da endonuclease no substrato de dano ao DNA, onde um único produto de 20 nucleotídeos é antecipado, ou ensaios EMSA onde os estados ligados/não ligados são claramente distinguidos. A quantificação precisa da atividade da polimerase e da nuclease processiva é difícil pela integração de bandas e, em geral, recomenda-se o uso de ensaios em tempo real com sondas ou balizas, conforme descrito na introdução.
Desadenilação e especificidade do cofator da DNA ligase: Alguma otimização deste protocolo pode ser necessária para remover toda a atividade de fundo, que será então restaurada pela adição do(s) cofator(es) de nucleotídeos. Se a atividade da ligase de fundo permanecer após a desadenilação (vista como ligação no controle sem cofator), o tempo de incubação da etapa de desadenilação pode ser aumentado ou a concentração de ligase diminuída. Certifique-se de que o DNA nick duplex sem rótulo seja mais concentrado do que a proteína (> 4:1::substrate: protein). Se a adição de um cofator na presença de DNA marcado não restaurar a ligação para nenhum dos cofatores testados, é possível que a enzima tenha desnaturado e a etapa de desadenilação deve ser encurtada. Para uma nova ligase ou um novo lote de enzima recombinante, é útil determinar a extensão da ligação de fundo com a enzima adenilada na ausência de cofatores de nucleotídeos adicionais. Isso envolve a criação de outra reação em que 10 μL de master mix não marcado, 10 μL de master mix marcado e 2,5 μL de uma enzima fresca que não foi desadenilada são incubados simultaneamente.
Use substratos com rótulo duplo: Este protocolo requer o projeto e a compra de um oligonucleotídeo com uma porção fluorescente que tenha um espectro de excitação/emissão diferente do fluoróforo originalmente usado e, em seguida, a montagem deste em um duplex para que os dois fluoróforos ortogonais rotulem diferentes porções do substrato. Em caso de dúvida, vários visualizadores espectrais on-line estão disponíveis para verificar os espectros de excitação e emissão, por exemplo, FPbase Spectra Viewer e BD Spectrum Viewer, que podem ser usados para verificar a compatibilidade do par de fluoróforos e as configurações mais apropriadas do gerador de imagens. As configurações específicas usadas para visualizar o gel dependerão do modelo do gerador de imagens e do(s) fluoróforo(s) usado(s). A imagem composta gravará o sinal de ambos os canais no gel único, e a banda onde ambos os fluoróforos estão ligados ao mesmo produto será exibida como uma cor intermediária. Imagens separadas de canais individuais podem ser analisadas para quantificar a extensão da ligadura ou degradação em fitas marcadas diferencialmente.
Limitações da técnica
Embora trabalhar com substratos marcados com fluorescência tenha muitas vantagens, como baixos riscos à saúde, existem algumas limitações que devem ser consideradas ao trabalhar com esses tipos de substratos marcados. Um deles é o custo relativamente alto de encomendar esses oligonucleotídeos com marcadores ou modificações de fluoróforos, como a adição de bases danificadas, em comparação com a radiomarcação interna. Outra é que equipamentos e softwares especializados de imaginação são necessários para a detecção de fios marcados. No entanto, esses recursos agora estão incluídos na maioria dos novos sistemas de imagem em gel. Deve-se também considerar o potencial dos fluoróforos para alterar as propriedades de ligação das proteínas de interação alvo. A fluoresceína e seu derivado FAM são comumente usados para marcar oligonucleotídeos e são sensíveis a mudanças no pH e na extinção de nucleobases65. Essas limitações devem ser cuidadosamente consideradas ao decidir o tipo e a colocação de fluoróforos no oligonucleotídeo para o projeto duplex.
Divulgações
A SEG e a UR são funcionários da ArcticZymes Technologies AS, que distribui a ligase R2D. AW, ER-S e RS não têm interesses concorrentes.
Agradecimentos
AW é apoiado por uma Rutherford Discovery Fellowship (20-UOW-004). RS recebeu uma bolsa de estudos da New Zealand Post Antarctic. A SG e a UR agradecem ao Instituto de Química da Universidade de Tromsø - Universidade Norueguesa do Ártico pelo suporte técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| 30% Acrylamide/Bis Solution (29:1) | BioRad | 1610156 | |
| Adenosine triphosphate (ATP) | Many suppliers | ||
| Ammonium persulfate (APS) | Many suppliers | ||
| Benchtop centrifuge | Many suppliers | ||
| Borate | Many suppliers | ||
| Bromophenol blue | Many suppliers | ||
| Dithiothreitol (DTT) | Many suppliers | ||
| Electrophoresis system with circulating water bath | Many suppliers | ||
| Ethylenediaminetetraacetic acid (EDTA) | Many suppliers | ||
| Fluoresnence imager, e.g. iBright FL1000 | Thermo Fisher Scientific | A32752 | |
| Formamide | Many suppliers | ||
| Gel casting system | Many suppliers | ||
| Heating block | Many suppliers | ||
| Magnesium Chloride | Many suppliers | Other metal ions may be preferred depending on the protein studied | |
| Microcentrifuge tubes (1.5 mL) | Many suppliers | ||
| Micropipettes and tips | Many suppliers | 1 mL, 0.2 mL, 0.02 mL, 0.002 mL | |
| Nicotinamide adenine dinucleotide (NAD+) | Many suppliers | ||
| Oligonucleotides | Integrated DNA Technologies | NA | Thermo Fisher, Sigma-Aldrich, Genscript and others also supply these |
| pasture pipette | Many suppliers | ||
| PCR thermocycler | Many suppliers | ||
| PCR tubes | Many suppliers | ||
| RNAse away | ThermoFisher | 7002PK | Only needed when working with RNA oligos |
| RNase AWAY | Merck | 83931-250ML | Surfactant for removal of RNAse contamination on surfaces |
| RNAse-free water | New England Biolabs | B1500L | Only needed when working with RNA oligos |
| Sodium Chloride | Many suppliers | ||
| SUPERase IN RNase inhibitor | Thermo Fisher Scientific | AM2694 | Broad spectrum RNAse inhibitir (protein-based) |
| SYBR Gold | Thermo Fisher Scientific | S11494 | This may be used to post-stain gels and visualise unlabelled oligonucleotides |
| Tetramethylethylenediamine (TMED) | Many suppliers | ||
| Tris, or tris(hydroxymethyl)aminomethane | Many suppliers | ||
| Ultrapure water (Milli-Q) | Merck | ||
| urea | Many suppliers | ||
| Vortex | Many suppliers |
Referências
- Gao, Y., et al. Structures and operating principles of the replisome. Science. 363 (6429), 7003 (2019).
- Yang, W., Gao, Y. Translesion and repair DNA polymerases: Diverse structure and mechanism. Annu Rev Biochem. 87, 239-261 (2018).
- Lohman, T. M., Fazio, N. T. How does a helicase unwind DNA? Insights from RecBCD Helicase. Bioessays. 40 (6), e1800009 (2018).
- Ahdash, Z., et al. Mechanistic insight into the assembly of the HerA-NurA helicase-nuclease DNA end resection complex. Nucleic Acids Res. 45 (20), 12025-12038 (2017).
- Wozniak, K. J., Simmons, L. A. Bacterial DNA excision repair pathways. Nat Rev Microbiol. 20 (8), 465-477 (2022).
- Zhang, L., Jiang, D., Wu, M., Yang, Z., Oger, P. M. New insights into DNA repair revealed by NucS endonucleases from hyperthermophilic Archaea. Front Microbiol. 11, 1263 (2020).
- Saathoff, J. H., Kashammer, L., Lammens, K., Byrne, R. T., Hopfner, K. P. The bacterial Mre11-Rad50 homolog SbcCD cleaves opposing strands of DNA by two chemically distinct nuclease reactions. Nucleic Acids Res. 46 (21), 11303-11314 (2018).
- Williamson, A., Leiros, H. S. Structural insight into DNA joining: from conserved mechanisms to diverse scaffolds. Nucleic Acids Res. 48 (15), 8225-8242 (2020).
- Caglayan, M. Interplay between DNA polymerases and DNA ligases: Influence on substrate channeling and the fidelity of DNA ligation. J Mol Biol. 431 (11), 2068-2081 (2019).
- Shuman, S. DNA ligases: Progress and prospects. J Biol Chem. 284 (26), 17365-17369 (2009).
- Lohman, G. J., Tabor, S., Nichols, N. M. DNA ligases. Curr Prot Mol Biol. , (2011).
- Rittié, L., Perbal, B. Enzymes used in molecular biology: a useful guide. J Cell Commun Signal. 2 (1-2), 25-45 (2008).
- Chandrasegaran, S., Carroll, D. Origins of programmable nucleases for genome engineering. J Mol Biol. 428 (5), 963-989 (2016).
- Aschenbrenner, J., Marx, A. DNA polymerases and biotechnological applications. Curr Opin Biotechnol. 48, 187-195 (2017).
- Loenen, W. A. M., Dryden, D. T. F., Raleigh, E. A., Wilson, G. G., Murray, N. E. Highlights of the DNA cutters: a short history of the restriction enzymes. Nucleic Acids Res. 42 (1), 3-19 (2013).
- Voytas, D., Ke, N. Detection and quantitation of radiolabeled proteins and DNA in gels and blots. Curr Protoc Immunol. , (2002).
- Phillips, D. H. Detection of DNA modifications by the 32P-postlabelling assay. Mutat Res. 378 (1-2), 1-12 (1997).
- Huang, C., Yu, Y. T. Synthesis and labeling of RNA in vitro. Curr Prot Mol Biol. , (2013).
- Ballal, R., Cheema, A., Ahmad, W., Rosen, E. M., Saha, T. Fluorescent oligonucleotides can serve as suitable alternatives to radiolabeled oligonucleotides. J Biomol Tech. 20 (4), 190-194 (2009).
- Anderson, B. J., Larkin, C., Guja, K., Schildbach, J. F. Using fluorophore-labeled oligonucleotides to measure affinities of protein-DNA interactions. Meth Enzymol. 450, 253-272 (2008).
- Liu, W., et al. Establishment of an accurate and fast detection method using molecular beacons in loop-mediated isothermal amplification assay. Sci Rep. 7 (1), 40125 (2017).
- Ma, C., et al. Simultaneous detection of kinase and phosphatase activities of polynucleotide kinase using molecular beacon probes. Anal Biochem. 443 (2), 166-168 (2013).
- Li, J., Cao, Z. C., Tang, Z., Wang, K., Tan, W. Molecular beacons for protein-DNA interaction studies. Meth Mol Biol. 429, 209-224 (2008).
- Yang, C. J., Li, J. J., Tan, W. Using molecular beacons for sensitive fluorescence assays of the enzymatic cleavage of nucleic acids. Meth Mol Biol. 335, 71-81 (2006).
- Nikiforov, T. T., Roman, S. Fluorogenic DNA ligase and base excision repair enzyme assays using substrates labeled with single fluorophores. Anal Biochem. 477, 69-77 (2015).
- Pergolizzi, G., Wagner, G. K., Bowater, R. P. Biochemical and structural characterisation of DNA ligases from bacteria and Archaea. Biosci Rep. 36 (5), 00391 (2016).
- Martin, I. V., MacNeill, S. A. ATP-dependent DNA ligases. Genome Biol. 3 (4), (2002).
- Bilotti, K., et al. Mismatch discrimination and sequence bias during end-joining by DNA ligases. Nucleic Acids Res. 50 (8), 4647-4658 (2022).
- Bauer, R. J., et al. Comparative analysis of the end-joining activity of several DNA ligases. PLoS One. 12 (12), e0190062 (2017).
- Lohman, G. J. S., Zhang, Y., Zhelkovsky, A. M., Cantor, E. J., Evans, T. C. Efficient DNA ligation in DNA-RNA hybrid helices by Chlorella virus DNA ligase. Nucleic Acids Res. 42 (3), 1831-1844 (2014).
- Bullard, D. R., Bowater, R. P. Direct comparison of nick-joining activity of the nucleic acid ligases from bacteriophage T4. Biochem J. 398 (1), 135-144 (2006).
- Magnet, S., Blanchard, J. S. Mechanistic and kinetic study of the ATP-dependent DNA ligase of Neisseria meningitidis. Biochemistry. 43 (3), 710-717 (2004).
- Williamson, A., Grgic, M., Leiros, H. S. DNA binding with a minimal scaffold: structure-function analysis of Lig E DNA ligases. Nucleic Acids Res. 46 (16), 8616-8629 (2018).
- Lohman, G. J., et al. A high-throughput assay for the comprehensive profiling of DNA ligase fidelity. Nucleic Acids Res. 44 (2), e14 (2016).
- Kim, J., Mrksich, M. Profiling the selectivity of DNA ligases in an array format with mass spectrometry. Nucleic Acids Res. 38 (1), e2 (2010).
- Tang, Z. W., et al. Real-time monitoring of nucleic acid ligation in homogenous solutions using molecular beacons. Nucleic Acids Res. 31 (23), e148 (2003).
- Yang, W. Nucleases: diversity of structure, function and mechanism. Q Rev Biophys. 44 (1), 1-93 (2011).
- Marti, T. M., Fleck, O. DNA repair nucleases. Cell Mol Life Sci. 61 (3), 336-354 (2004).
- Wang, B. B., et al. Review of DNA repair enzymes in bacteria: With a major focus on AddAB and RecBCD. DNA Repair. 118, 103389 (2022).
- Pidugu, L. S., et al. Structural insights into the mechanism of base excision by MBD4. J Mol Biol. 433 (15), 167097 (2021).
- Roberts, R. J. How restriction enzymes became the workhorses of molecular biology. Proc Natl Acad Sci U S A. 102 (17), 5905-5908 (2005).
- Miller, J. C., et al. An improved zinc-finger nuclease architecture for highly specific genome editing. Nat Biotechnol. 25 (7), 778-785 (2007).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Takemoto, N., Numata, I., Su'etsugu, M., Miyoshi-Akiyama, T. Bacterial EndoMS/NucS acts as a clamp-mediated mismatch endonuclease to prevent asymmetric accumulation of replication errors. Nucleic Acids Res. 46 (12), 6152-6165 (2018).
- Reardon, J. T., Sancar, A. Molecular anatomy of the human excision nuclease assembled at sites of DNA damage. Mol Cell Biol. 22 (16), 5938-5945 (2002).
- Kunkel, T. A., Soni, A. Exonucleolytic proofreading enhances the fidelity of DNA synthesis by chick embryo DNA polymerase-gamma. J Biol Chem. 263 (9), 4450-4459 (1988).
- Sheppard, E. C., Rogers, S., Harmer, N. J., Chahwan, R. A universal fluorescence-based toolkit for real-time quantification of DNA and RNA nuclease activity. Sci Rep. 9 (1), 8853 (2019).
- Li, J. J., Geyer, R., Tan, W. Using molecular beacons as a sensitive fluorescence assay for enzymatic cleavage of single-stranded DNA. Nucleic Acids Res. 28 (11), e52 (2000).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Meth. 9 (7), 671-675 (2012).
- Sharma, J. K., et al. Methods for competitive enrichment and evaluation of superior DNA ligases. Meth Enzymol. 644, 209-225 (2020).
- Rzoska-Smith, E., Stelzer, R., Monterio, M., Cary, S. C., Williamson, A. DNA repair enzymes of the Antarctic Dry Valley metagenome. Front Microbiol. 14, 1156817 (2023).
- Williamson, A., Pedersen, H. Recombinant expression and purification of an ATP-dependent DNA ligase from Aliivibrio salmonicida. Protein Expres Purif. 97, 29-36 (2014).
- Akey, D., et al. Crystal structure and nonhomologous end-joining function of the ligase component of Mycobacterium DNA ligase D. J Biol Chem. 281 (19), 13412-13423 (2006).
- Kim, D. J., et al. ATP-dependent DNA ligase from Archaeoglobus fulgidus displays a tightly closed conformation. Acta Crystallogr Sect F Struct Biol Cryst Commun. 65, 544-550 (2009).
- Nishida, H., Kiyonari, S., Ishino, Y., Morikawa, K. The closed structure of an archaeal DNA ligase from Pyrococcus furiosus. J Mol Biol. 360 (5), 956-967 (2006).
- Gundesø, S., et al. R2D ligase: Unveiling a novel DNA ligase with surprising DNA-to-RNA ligation activity. Biotechnol J. 19 (3), e2300711 (2024).
- Hendling, M., Barišić, I. In silico design of DNA oligonucleotides: Challenges and approaches. Comput Struct Biotechnol J. 17, 1056-1065 (2019).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harb Prot. 2019 (2), (2019).
- Summer, H., Grämer, R., Dröge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). J Vis Exp. (32), e1485 (2009).
- Smith, D. R. Gel Electrophoresis of DNA. Mol Biometh Handbook. , 17-33 (1998).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. (63), e3998 (2012).
- Rousseau, M., et al. Characterisation and engineering of a thermophilic RNA ligase from Palaeococcus pacificus. Nucleic Acids Res. 52 (7), 3924-3937 (2024).
- Kestemont, D., Herdewijn, P., Renders, M. Enzymatic synthesis of backbone-modified oligonucleotides using T4 DNA ligase. Curr Prot Chem Biol. 11 (2), e62 (2019).
- Farell, E. M., Alexandre, G. Bovine serum albumin further enhances the effects of organic solvents on increased yield of polymerase chain reaction of GC-rich templates. BMC Res Notes. 5, 257 (2012).
- Nazarenko, I., Pires, R., Lowe, B., Obaidy, M., Rashtchian, A. Effect of primary and secondary structure of oligodeoxyribonucleotides on the fluorescent properties of conjugated dyes. Nucleic Acids Res. 30 (9), 2089-2195 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados