Method Article
שימוש באוליגונוקלאוטידים סינתטיים שעברו שינוי כדי להעריך אנזימים לחילוף חומרים של חומצות גרעין
In This Article
Summary
כאן מוצג פרוטוקול לבדיקת אנזימים לחילוף חומרים של חומצות גרעין, תוך שימוש בדוגמאות של אנזימי ליגאז, נוקלאז ופולימראז. הבדיקה משתמשת באוליגונוקלאוטידים מסומנים פלואורסצנטית ולא מסומנים שניתן לשלב ליצירת דופלקסים המחקים נזקי RNA ו/או DNA או מתווכי מסלול, ומאפשרים אפיון התנהגות אנזימים.
Abstract
הזמינות של מגוון אוליגונוקלאוטידים סינתטיים מותאמים מספקים מסחריים אפשרה פיתוח של בדיקות מתוחכמות כדי לאפיין תכונות מגוונות של אנזימים מטבוליזם חומצת גרעין שניתן להריץ בכל מעבדה סטנדרטית לביולוגיה מולקולרית. השימוש בתוויות פלואורסצנטיות הפך את השיטות הללו לנגישות לחוקרים עם ציוד אלקטרופורזה סטנדרטי של PAGE ומכשיר הדמיה פלואורסצנטי, ללא שימוש בחומרים רדיואקטיביים וללא צורך במעבדה המיועדת לאחסון והכנה של חומרים רדיואקטיביים, כלומר מעבדת הוט. התוספת האופציונלית של שינויים סטנדרטיים כגון זרחן יכולה לפשט את הגדרת המבחן, בעוד שניתן להשתמש בשילוב ספציפי של נוקלאוטידים שעברו שינוי המחקים נזקי DNA או מתווכים כדי לחקור היבטים ספציפיים של התנהגות אנזימים. כאן, התכנון והביצוע של בדיקות כדי לחקור מספר היבטים של עיבוד DNA על ידי אנזימים באמצעות אוליגונוקלאוטידים סינתטיים זמינים מסחרית מודגמים. אלה כוללים את היכולת של ליגאזות להצטרף או nucleases כדי לפרק מבנים היברידיים שונים של DNA ו- RNA, שימוש בקו-פקטור דיפרנציאלי על ידי ליגאז DNA, והערכה של יכולת קשירת DNA של אנזימים. נדונים גורמים שיש לקחת בחשבון בעת תכנון מצעי נוקלאוטידים סינתטיים, ומסופקת קבוצה בסיסית של אוליגונוקלאוטידים שניתן להשתמש בהם עבור מגוון של חומצות גרעין ליגאז, פולימראז ובדיקות אנזימי נוקלאז.
Introduction
כל צורות החיים דורשות אנזימים לעיבוד חומצות גרעין כדי לבצע תהליכים ביולוגיים בסיסיים, כולל שכפול, שעתוק ותיקון DNA. פונקציות אנזימטיות עיקריות עבור מסלולים אלה הן פולימראזות, אשר מייצרות עותקים של מולקולות RNA/DNA, ליגאזות המצטרפות למצעי פולינוקלאוטידים, נוקלאזות המשפילות אותן, ומנחתים וטופואיזומראזות, אשר ממיסים דופלקסים של חומצות גרעין או משנים את הטופולוגיה שלהם 1,2,3,4,5,6,7,8,9,10 . בנוסף, רבים מהאנזימים הללו מספקים כלים מולקולריים חיוניים ליישומים כגון שיבוט, אבחון וריצוף בתפוקה גבוהה 11,12,13,14,15.
המאפיינים הפונקציונליים, הקינטיקה וייחודיות המצע של אנזימים אלה ניתנים לקביעה באמצעות מצעי DNA/RNA מסומנים המיוצרים על ידי חישול אוליגונוקלאוטידים. מעקב אחר מצעים ומוצרים הושג באופן מסורתי על ידי הצגת תווית רדיואקטיבית (32P) בקצה גדיל 5 ', אשר לאחר מכן ניתן לזהות על ידי סרט צילום או עם מערכת הדמיה זרחן16,17. בעוד שמצעים עם תווית רדיואקטיבית מציעים את היתרון של רגישות ניסויית מוגברת ואינם משנים את התכונות הכימיות של נוקלאוטיד, הסיכונים הבריאותיים הפוטנציאליים מעבודה עם רדיואיזוטופים עודדו את הפיתוח של תיוג חומצות גרעין לא רדיואקטיביות כדי לספק חלופה בטוחה יותר לזיהוי DNA ו- RNA 18,19,20 . בין אלה, זיהוי פלואורסצנטי, כולל זיהוי פלואורסצנטיות ישיר, פלואורסצנטיות שנפתרה בזמן ומבחני העברת אנרגיה/פלואורסצנטיות בולטים כ-21,22,23,24 הרב-תכליתיים ביותר. המערך הנרחב של פלואורופורים מאפשר עיצובים שונים של מצעי DNA/RNA הכוללים כתבים ייחודיים על כל אוליגונוקלאוטיד25. בנוסף, יציבותם של פלואורופורים, בהשוואה לרדיואיזוטופים, מאפשרת למשתמשים לייצר ולשמר כמויות משמעותיות של מצעי DNA המסומנים באופן פלואורסצנטי19. ניתן לדגור על מצעים אלה המסומנים בפלואורופור עם החלבון המעניין, יחד עם שילובים שונים של גורמים משלימים של מתכת ונוקלאוטידים, כדי לנתח את פעילות הקישור או האנזים. הדמיה של קשירה או פעילות ניתן לראות באמצעות תעלות צבע פלואורופור שונות עם מערכת הדמיה ג'ל. מכיוון שרק אוליגונוקלאוטידים המסומנים באופן פלואורסצנטי יהיו גלויים באמצעות טכניקה זו, כל עלייה או ירידה בגודל האוליגונוקלאוטיד המסומן תהיה קלה לעקוב. ג'לים יכולים גם להיות מוכתמים לאחר מכן, עם צבעים מכתימים חומצת גרעין כדי לדמיין את כל רצועות ה- DNA הקיימות על הג'ל.
ליגאזות של חומצות גרעין הן אנזימים המצטרפים למקטעים של DNA/RNA, ומזרזים את אטימת השברים על ידי יצירת קשר פוספודיסטר בין טרמיני DNA פוספורילציה 5' לבין 3' OH של DNA. ניתן לחלק אותם לשתי קבוצות בהתאם לדרישת מצע הנוקלאוטידים שלהם. הליגאזות התלויות ב-NAD שהשתמרו מאוד נמצאות בכל חיידקי26 ואילו את האנזימים תלויי ה-ATP המגוונים מבחינה מבנית ניתן לזהות בכל תחומי החיים 8,27. ליגאזות DNA ממלאות תפקיד חשוב בעיבוד מקטעי אוקזקי במהלך השכפול, כמו גם מעורבות במסלולי תיקון DNA שונים, כגון נוקלאוטיד ותיקון כריתת בסיס, באמצעות איטום ניקים וניקים ספונטניים שנותרים לאחר תיקון 8,10. ליגאזות דנ"א שונות מציגות יכולות שונות להצטרף לקונפורמציות שונות של שברי דנ"א, כולל ניקים בדופלקס, שברים דו-גדיליים, אי-התאמות ורווחים, כמו גם היברידיות RNA ו-DNA 28,29,30. ניתן להרכיב מגוון רחב של מצעים ניתנים לליגה על ידי חישול אוליגונוקלאוטידים עם פוספט 5' כדי ליצור טרמיני 5' ו-3' בדופלקס חומצות גרעין 31,32,33. שיטת הניתוח הנפוצה ביותר היא רזולוציה על ידי אוריאה PAGE בפורמט בדיקת נקודת קצה; עם זאת, חידושים אחרונים כללו שימוש באלקטרופורזה של ג'ל נימי, המאפשר תפוקה גבוהה34, פרופיל ספקטרומטרי מסה35, כמו גם בדיקת משואות מולקולרית הומוגנית, המאפשרת ניטור בזמן36.
הצעד הראשון בתגובת קשירה הוא אדנילציה של אנזים ליגאז על ידי אדנוזין טריפוספט (ATP) או ניקוטינאמיד אדנין דינוקלאוטיד (NAD), וכתוצאה מכך אנזים קוולנטי מתווך. השלב השני בתגובה הוא אדנילציה של מצע חומצת הגרעין בקצה 5' של אתר הניק, ואחריו קשירה של גדילי ניק חומצת הגרעין. אנזימי ליגאז רבים המתבטאים באופן רקומביננטי ב- E. coli מטוהרים בצורה אדנילציה, ולכן מסוגלים לשדר בהצלחה חומצות גרעין ללא תוספת של קו-פקטור נוקלאוטיד. זה מקשה לקבוע איזה סוג מסוים של קו-פקטור נוקלאוטידים הם דורשים עבור קשירת חומצות גרעין. בנוסף לתיאור בדיקות להערכת פעילות ליגאז DNA, מוצגת גם שיטה לקביעת שימוש בקו-פקטור באופן מהימן על ידי דה-אדנילציה של האנזים באמצעות מצעים לא מסומנים.
נוקלאזות הן קבוצה גדולה ומגוונת של אנזימים לשינוי DNA/RNA ורנ"א קטליטי המנתקים את קשרי הפוספודיסטרים בין חומצות גרעין37. תפקודי אנזימי נוקלאז נדרשים בשכפול, תיקון ועיבוד DNA וניתן לסווגם לפי ספציפיות הסוכר שלהם עבור DNA, RNA או שניהם. אנדונוקלאזות מבצעות הידרוליזה של קשרי פוספודיזטר בתוך גדיל דנ"א/רנ"א, בעוד אקסונוקלאזות הידרוליזות של גדילי דנ"א/רנ"א גוועדות נוקלאוטיד אחד בכל פעם מקצה ה-3' או ה-5' או ה-5' עד הקצה ה-5' של הדנ"א38'.
בעוד חלבוני נוקלאז רבים אינם ספציפיים ועשויים להיות מעורבים בתהליכים מרובים, אחרים ספציפיים מאוד עבור רצף מסוים או נזק לדנ"א 6,39,40. נוקלאזות ספציפיות לרצף משמשות במגוון רחב של יישומים ביוטכנולוגיים, כגון שיבוט, מוטגנזה ועריכת גנום. נוקלאזות פופולריות ליישומים אלה הן נוקלאזות הגבלה41, נוקלאזות אצבע אבץ42, נוקלאזות אפקט דמוי מפעיל שעתוק 43, ולאחרונה, נוקלאזות CRISPR מהונדסות מונחות רנ"א43. לאחרונה זוהו נוקלאזות ספציפיות לנזק, כגון נוקלאז EndoMS, שיש לו ספציפיות לאי-התאמות בדנ"א באמצעות תחום הנוקלאז דמוי RecB 5,44 הספציפי לאי-התאמה. מבחני פעילות נוקלאז, מבחינה היסטורית, נעשו כבדיקות לא רציפות עם מצעים מסומנים ברדיו; עם זאת, בנוסף לחסרונות האחרים שלהם, אלה אינם מאפשרים זיהוי של האתר שנחתך על ידי חלבון נוקלאז, אשר אפשרי בעת שימוש במצעים מסומנים פלואורסצנטית45,46. לאחרונה פותחו מבחני נוקלאז רציפים הפועלים באמצעות צבעי דנ"א שונים המקיימים אינטראקציה עם דנ"א במצבים שונים; לדוגמה, פליטת אות פלואורסצנטי גבוה יותר בעת אינטראקציה עם dsDNA מאשר במצבו הלא קשור, או קשירה ספציפית לרנ"א קצר47. בדיקות נוקלאז רציפות אחרות משתמשות בסיכות ראש DNA עם קבוצת פלואורופורים בקצה 5' ומרווה בקצה 3', כך שהפלואורסצנטיות עולה ככל שהאוליגונוקלאוטיד מתפרק עקב הפרדה בין הפלואורופור למרווה48. בעוד שבדיקות אלה מאפשרות לאפיין את הקינטיקה של חלבונים מפרקים DNA, הן דורשות ידע מוקדם על תפקוד האנזים והמצע ומוגבלות גם לאנזימים המשנים את קונפורמציית הדנ"א כדי לגרום להבדל בקישור הצבע. מסיבה זו, מבחני נקודות קצה שפותרים תוצרי נוקלאז בודדים עדיין רצויים כדי לספק תובנה לגבי שינויים בדנ"א הנגרמים על ידי פעילות החלבון.
כאן, מוצג הליך מפורט לתכנון אוליגונוקלאוטידים של DNA/RNA המסומנים באופן פלואורסצנטי שניתן לערבב ולהתאים ליצירת מצעים לבדיקת הפעילות של אנזימי נוקלאז, פולימראז וליגאז חדשים. האימות של קבוצה בסיסית זו של רצפי אוליגונוקלאוטידים מפשט את התכנון הניסיוני ומאפשר פרופיל חסכוני של מגוון רחב של פונקציות אנזימטיות ללא צורך לרכוש מספר רב של מצעים בהתאמה אישית. הליך מפורט מסופק להפעלת בדיקת אנזים סטנדרטית לעיבוד DNA עם מצעים אלה, תוך שימוש בדוגמה של פעילות ליגאז DNA ומתוארים שינויים להערכה וניתוח של אנזימי נוקלאז ופולימראז. בנוסף, ניתנת בדיקה שונה לקביעת ספציפיות הקו-פקטור של אנזים ליגאז ה- DNA בדיוק גבוה, ובדיקות בעלות תווית כפולה משמשות להערכת הרכבה של קשירה מרובת רכיבים. לבסוף, שינויים בפורמט הבדיקה הבסיסית נדונים כדי לאפשר להשתמש בו כדי לקבוע אינטראקציות חלבון-DNA עם אותם מצעים על ידי בדיקת שינוי ניידות אלקטרופורטית (EMSA).
Protocol
1. תכנון ורכישה של אוליגונוקלאוטידים
הערה: תכננו אוליגונוקלאוטידים חד-גדיליים שיורכבו ויחושלו לדופלקסים הרצויים. אחד או יותר מהגדילים בדופלקס חייב לשאת מואטי פלואורסצנטי למעקב אחר עיבוד אוליגונוקלאוטיד על ידי האנזים המעניין. קבוצת בסיס של רצפים חד-גדיליים שניתן להרכיב למגוון פעילויות מוצגת בטבלה 1.
- שלבו את השינויים הספציפיים הדרושים לאנזים המעניין כמתואר להלן.
- עבור מצעי ליגאז דנ"א (איור 1): הרכיבו את המצע הפשוט ביותר משלושה אוליגונוקלאוטידים: גדיל תורם זרחני 5' (NL2), גדיל מקבל 5' FAM (NL1), ומשלים שמגשר בין השניים (NL3).
- ודא שגדילים המספקים את הקצה של 5 אינץ' של הניק הניתן לליגה עוברים פוספורילציה לפני הרכבת תערובת האב של המצע בשלב 2. הזמינו זאת כשינוי ב-NL2 (כפי שניתן בטבלה 1) או השתמשו בזרחן אנזימטי עם פולינוקלאוטיד קינאז T4 לאחר השעיה מחדש של האוליגונוקלאוטידים.
- כללו זרחן 5'-טרמינלי של NL6 ו-NL8, המהווים את המשלים של שברים דו-גדיליים המתוארים באיור 1A (NL6/NL7 ו-NL8/NL9), שכן זה דומה ביותר למצע הטבעי המופק מאנדונוקלאז הגבלה. השתמש במצע בעל תווית כפולה כדי לקבוע את ההיקפים היחסיים של קשירה עבור הרכבות מרובות חלקים (ראה שלב 6).
- שנה את גדיל המשלים כדי ליצור אי-התאמות (NL10) ורווחים (NL11).
הערה: וריאציות על המצע הפשוט מתוארות באיור 1A. ניתן להשתמש ברצפים אחרים כדי ליצור טווח רחב עוד יותר של אי-התאמות או רווחים ארוכים יותר על ידי שינוי המיקום המסומן בקו תחתון. - תחליף אוליגונוקלאוטידים של DNA באוליגונוקלאוטידים של RNA.
הערה: וריאציות על המצע הפשוט מתוארות באיור 1B. טווח רחב יותר של דופלקסים של דנ"א/רנ"א יכול להיווצר על ידי שילובים נוספים של קבוצת הבסיס שניתנה כאן כדי ליצור, למשל, הפסקות דו-גדיליות המכילות גם רנ"א וגם דנ"א. דוגמה לווריאציה זו ניתנת בשלב 6 להלן, שבו נעשה שימוש באסטרטגיית תווית כפולה.
- עבור מצעי DNA פולימראז: הרכיבו את האוליגונוקלאוטידים NL1 ו-NL3 המפורטים בטבלה 1 כדי לתת בדיקת הרחבת פריימר פשוטה. חקור היבטים נוספים של פעילות פולימראז על-ידי הכנסת שינויים לגדילים NL1 (פריימר) או NL3 (תבנית).
- שלב אנלוגים בסיסיים פגומים באוליגונוקלאוטיד NL3 לפני מיקום 20 כדי לקבוע את היכולת לעקוף נגעים פגומים על גדיל התבנית.
- שלב אנלוגים בסיסיים פגומים באוליגונוקלאוטיד NL1 במיקום 20 כדי לקבוע את היכולת להאריך פריימר פגום.
- השתמש ב- RNL1 או ב- RNL3 בדופלקס כדי לחקור את ההרחבה של פריימר RNA או את השימוש בתבנית RNA.
- עבור מצעי נוקלאז (איור 2): הרכיבו אוליגונוקלאוטידים כדי לתת טווח לא ממצה של מצעים כפולים וחד-גדיליים (איור 2Ai), כמו גם טווח של צמתים מנופפים ומשובצים (איור 2Aii) ומצעים פגומים (איור 2B).
- כדי לחקור פעילויות ריבונוקלאז, החלף באופן איטרטיבי את NL1, NL2 ו- NL3 ב- RNL1, RNL2 ו- RNL3. השתמש בגרסאות RNA נוספות של HJ5 ו- HJ6 כדי להרחיב קבוצה זו עוד יותר.
- השתמשו באוליגונוקלאוטידים MD5, MD6 ו-MD9 שיש להם שינוי במיקום מרכזי שמחקה נזק חמצוני, חומר ביניים לתיקון בסיסי או תוצר דה-אמינציה (איור 2B). המצעים יזהו שסע של הגדיל במיקום זה. תייג את גדיל NL3 המשלים עם פלואורופור אורתוגונלי כגון TAMRA כדי לזהות מחשוף דו-גדילי (ראה שלב 6).
- השתמש בתיוג אורתוגונלי של המשלים כדי לזהות חיתוך דו-גדילי באתרים שאינם תואמים הן על גדילי הבדיקה (NL5 ו- ND9) והן על גדילי המשלים (MD10 ו- NL10).
- עבור מצעי ליגאז דנ"א (איור 1): הרכיבו את המצע הפשוט ביותר משלושה אוליגונוקלאוטידים: גדיל תורם זרחני 5' (NL2), גדיל מקבל 5' FAM (NL1), ומשלים שמגשר בין השניים (NL3).
- להזמין אוליגונוקלאוטידים סינתטיים המשלבים פלואורופורים רלוונטיים ושינויים אחרים מספק מסחרי.
הערה: סולם סינתזה של 100 ננומטר וטיהור HPLC לאחר סינתזה מתאימים לבדיקות המתוארות.
2. הרכבה וחישול של דופלקסים של חומצות גרעין
- השעיה ודילול של אוליגונוקלאוטידים
- לפני הפתיחה, צנטריפוגו את האוליגונוקלאוטידים הליופיליים בצינורות 2 מ"ל שלהם במהירות מלאה בצנטריפוגה על ספסל למשך 2-5 דקות כדי להבטיח שחומצת הגרעין נמצאת בתחתית הצינור.
- הכינו מלאי אב של 100 מיקרומטר על ידי השעיה מחדש של האוליגונוקלאוטידים במאגר TE (10 mM tris(hydroxymethyl)aminomethane (Tris), 1 mM ethylenediaminetetraacetic acid (EDTA)). ודא שהאוליגונוקלאוטידים מושהים מחדש ביסודיות על ידי מערבולות עדינות חוזרות ונשנות וצנטריפוגות קצרות במלוא המהירות.
- הכינו מלאי של 10 מיקרומטר על ידי דילול אליציטוט של מלאי מאסטר עם מאגר TE. יש לדלל את מלאי ה-10 מיקרומטר במים אולטרה-טהורים (MQ water) כדי להכין מלאי עבודה בריכוזים של 0.5 מיקרומטר, 0.7 מיקרומטר או 2.5 מיקרומטר לפי טבלה 2.
- הרכבה וחישול של תערובות מאסטר התגובה
- השתמש במניות עבודה כדי להרכיב את תערובות האב לתגובה באמצעות הצירופים המופיעים בטבלה 2 והנפחים המופיעים בטבלה 3. עבור בדיקת ליגאז DNA סטנדרטית ורוב הבדיקות האחרות המתוארות כאן, הרכב החיץ הסופי הוא 50 mM Tris pH 8.0, 50 mM NaCl, 10 mM Dithiothreitol (DTT) עם 10 mM Mg כקטיון דו-ערכי.
- אנאל את האוליגונוקלאוטידים בצינור PCR או מיקרוצנטריפוגה על ידי חימום ב 95 ° C במשך 5 דקות באמצעות בלוק חימום או thermocycler. מצננים לטמפרטורת החדר למשך 30 דקות (נפחים <1 מ"ל) עד שעה אחת (נפחים >1 מ"ל). עבור אוליגונוקלאוטידים ארוכים יותר (>40 nt), בצע קירור איטי יותר באמצעות thermocycler עם רמפה למטה של 95 ° C עד 25 ° C במשך 45 דקות, או לצוף את הצינור המכיל תערובת חישול בכוס 1 L של מים רותחים ולאפשר להתקרר לטמפרטורת החדר במשך הלילה.
- הוסף גורמים משלימים של נוקלאוטידים ורכיבי חיץ רגישים אחרים לחום לתערובת האב לאחר קירור לטמפרטורת החדר. השתמש בתערובת התגובה הסופית ישירות לבדיקה על ידי תוספת של אנזים (ראה שלב 3 להלן) או לאחסן ב -20 ° C לשימוש עתידי.
3. הגדרת בדיקה סטנדרטית
- הרכבה וייזום של תגובת הבדיקה
- שלב 22.5 μL של תערובת האב המצע של עניין עם 2.5 μL של ליגאז DNA או אנזים אחר של עניין בצינור PCR. הפעל תגובות כפולות או משולשות, במיוחד אם התוצאות יכומתו.
- כלול בקרה ללא חלבון (מאגר בלבד) בדגימות הבדיקה. אין לכלול בקרות קו-פקטור בשלב זה, במידת הצורך.
הערה: ניתן לאחסן אנזימים בטמפרטורה של -20°C בגליצרול 50% v/v, מה שמאפשר לגרוף אותם ישירות מתמיסה. ודא שתמיסות אנזימים עם גליצרול מעורבבות היטב לפני התוספת, בין אם על ידי פיפטינג לערבוב או על ידי ערבול עדין.
- מיד להעביר את התגובות למכונת PCR ב 25 ° C ולדגור במשך 30 דקות. שנו את הטמפרטורה ואת משך הזמן בהתאם לתנאים האופטימליים לפעילות האנזים.
- להרוות את התגובות על ידי הוספת 5 μL של צבע העמסה (95% פורממיד, 0.5 M Ethylenediaminetetraacetic חומצה (EDTA), bromophenol כחול) ולדגור על 95 ° C במשך 5 דקות.
4. ניתוח תוצאות הבדיקה
- הכינו ג'לים Tris-Borate-EDTA (TBE)-Urea PAGE כמתואר להלן.
- הכינו מלאי של 20% אקרילאמיד, 7 M Urea ותמיסת TBE 1x. עבור ערכת האוליגונוקלאוטידים המתוארת כאן, השתמש בתמיסת אקרילאמיד/ביס ביחס של 29:1 לקבלת רזולוציה אופטימלית.
- עבור ג'ל אחד, ערבבו 10 מ"ל של 20% אקרילאמיד ותמיסת אוריאה 7M עם 100 μL של APS (10%) ו-3 μL של טטרמתילאתילאנדיאמין (TMED) ויצקו ביציקת ג'ל.
- לאחר שהג'ל מתמצק, הפעל את הדגימות על ג'ל אוריאה TBE ב 45 - 55 מעלות צלזיוס.
- הפעילו מראש את הג'ל במאגר TBE אחד למשך 30 דקות ב-10 mA לג'ל עם חימום חיצוני.
- הסר עודף אוריאה בבארות של ג'ל על ידי שטיפה עם 1x TBE באמצעות פיפטה מרעה.
- טען 10 μL מכל תגובה והפעל ב 10 mA במשך 1.0-1.5 שעות עם חימום חיצוני.
- דמיינו את הג'ל במכונת ההדמיה עם ההגדרות הנכונות עבור הפלואורופור שנבחר. ל-FAM, השתמשו בערכת מסננים המעניקה עירור/פליטה ברזולוציה של 495/519 ננומטר, המאוחסנת כקביעה מוגדרת מראש ברוב מכשירי ההדפוס.
- לכמת את עוצמת הפס של המוצר והמצע באמצעות תוכנת עיבוד תמונה עם מכונת ההדמייה, או תוכנה חיצונית כגון ImageJ49,50 ולחשב את אחוז המוצר באמצעות הנוסחה
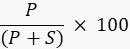
כאשר P הוא הערך המשולב של פס המכפלות, ו - S הוא האזור המשולב של רצועת המצע. במקרה של דוגמת תגובת ליגאז DNA, רצועת המכפלה פועלת ב-40 נוקלאוטידים (nt) ורצועת המצע ב-20 nt.
5. דה-אדנילציה של ליגאז ה-DNA לבדיקת ספציפיות קו-פקטור
- הכנת תערובות מאסטר תגובה
- הכינו ערכה אחת של תערובת האב המכילה את אוליגונוקלאוטיד NL1 המסומן בתווית FAM כמתואר בטבלה 4. הכינו ערכה שנייה המכילה את האוליגונוקלאוטיד NL1 ללא תווית FAM, כמתואר בטבלה 4.
- בנפרד, חממו את שני דופלקסי הדנ"א ל-95°C למשך 5 דקות וקררו למשך 30 דקות עד שעה ב-25°C. אין להוסיף קו-פקטור נוקלאוטידים לאף אחת מתערובות האב.
- הרכבה וייזום של תגובת דה-אדנילציה
- הכינו תגובת דה-אדנילציה יחידה עבור כל סוג / ריכוז קו-פקטור שייבדקו על ידי שילוב של 10 μL של תערובת האב ללא תווית עם 2.5 μL של אנזים ליגאז.
- הכינו צינורות נוספים כבקרה ללא קו-פקטור וללא בקרת חלבונים (2.5 מיקרוליטר של חיץ שנוסף במקום אנזים).
- לדגור על התגובות בטמפרטורה ספציפית לפעילות האופטימלית של האנזים, למשך 1-2 שעות. זמן הדגירה יכול להיות מוגבר אם האנזים הוא עדיין adenylated.
- הפעל את תגובת הקשירה עם הקו-פקטור.
- הוסף 10 μL של תערובת האב המסומנת ו- 2.5 μL של הגורמים משלימים של הנוקלאוטידים הרצויים (לדוגמה, ATP, NAD, ADP או GTP) ישירות לתגובה דה-אדניל (ריכוז סופי של 0.1-1 mM).
- הוסף 2.5 μL של מאגר תגובה לבקרת הקו-פקטור ללא נוקלאוטידים.
- לדגור את התגובות עבור אותו פרק זמן וטמפרטורה כמו בשימוש בעבר. הרוו והציגו באופן חזותי כמתואר בשלב 4.
6. שימוש במצעים בעלי תווית כפולה לקשירת סד או הרכבה מרובת חלקים
- תכננו ורכשו אוליגונוקלאוטיד עם מואטי פלורסנטי בעל ספקטרום עירור / פליטה שונה לפלואורופור שכבר נמצא בשימוש.
- במערך המתואר כאן, השתמש באוליגונוקלאוטיד NL2 (TAMRA) בעל 5-Carboxytetramethylrhodamine (TAMRA) בקצה 3' (טבלה 1).
- הרכיבו את תערובת האב כמתואר להלן.
- שלב את מרכיבי התגובה המתוארים בשלב 2, כולל יחסים שווי ערך של כל האוליגונוקלאוטידים המשמשים בהרכבה, כמו גם קטיונים חוצצים ודיוולנטיים.
- אנאל על ידי חימום ב 95 ° C במשך 5 דקות וקירור ב 25 ° C במשך 30 דקות - 1 שעות. הוסף את הקו-פקטור ואת האנזים ודגור כמתואר בשלב 3.
- הפעל וצלם את הדגימות כמתואר בשלב 4 באמצעות התעלות המתאימות לזוג הפלואורופורים במצע. במקרה של FAM ו-TAMRA, אלה הם תעלות פלואורסצאין (FITC) וטטרמתיל רודאמין (TRITC) הקיימות ברוב מכשירי ההדמיה.
7. הערכה של קשירת DNA על ידי Electrophoretic Mobility Shift Assay (EMSA) על ג'ל טבעי
- הכינו ג'ל TBE PAGE מקורי 10% כמתואר להלן.
- יש לערבב 2.5 מ"ל של 40% אקרילאמיד, 1 מ"ל של 10x TBE, 100 μL של 10% APS, 3 μL של TMED ו-6.5 מ"ל של מי MQ ולצקת ביציקת ג'ל.
- הרכיבו את התגובה המחייבת כמתואר להלן.
- הרכיבו את מצע ה-EMSA לפי טבלה 5 כך שייכלל EDTA (10 מילימטר) ויושמטו יוני מתכת.
- ערבבו 20 μL של תערובת האב של מצע EMSA עם 5 μL של החלבון בצינור PCR. כלול דגימה ללא בקרת חלבון. יש לדגור במשך 30 דקות ב-25°C.
- נתח על ידי אלקטרופורזה טבעית כמתואר להלן.
- הוסף 5 μL של צבע העמסה טבעי 5x (100 mM EDTA, 0.25% ברומופנול כחול, 25% v/v גליצרול, ומי MQ עד 1 מ"ל) לדגימות.
- מעמיסים על הג'ל המוכן ופועלים במתח של 60 וולט למשך 2-3 שעות עם קירור על ידי סירקולציית מים עד שחזית הצבע נמצאת כמה סנטימטרים מעל קצה הג'ל.
- הצג ונתח ג'לים כמתואר בשלב 4.
תוצאות
קשירה על ידי DNA ligase
פעילות אנזימטית של ליגאז DNA תגרום להגדלת גודלו של האוליגונוקלאוטיד המסומן באופן פלואורסצנטי כאשר הוא מוצג על ג'ל PAGE של אוריאה. במקרה של הסובסטרטים עבור קשירת דנ"א ורנ"א המפורטים בטבלה 2, זה מתאים להכפלת הגודל מ-20 nt ל-40 nt (איור 3A). פעילות אנזימים אופטימלית יכולה להיקבע על-ידי תנאים משתנים כגון טמפרטורה, ריכוז חלבונים או זמן דגירה (איור 3B), גורמים משלימים של נוקלאוטידים, גורמים משלימים של מתכת (איור 3C). ניתן להשוות את הפעילות היחסית של ליגאז על מצעים שונים במקביל (איור 3D).
כימות פסי המכפלה והמצע מבוטא כאחוז מסך כל הסובסטרט הקשור, וכפי שניתן לראות באיור 3, ניתן להשתמש בו כדי להעריך את הפעילות הספציפית של האנזים או לקבוע פעילות אופטימלית כגון העדפת קטיון דו-ערכי, טמפרטורה או pH.
ליגאז הדנ"א החיידקי DV-1-1-Lig (איור 3) מסוגל לקשור מצעי דנ"א שאינם תואמים ויכול לנצל גם מגנזיום וגם מנגן לפעילות קשירה, עם העדפה למגנזיום. פרטים נוספים על אנזים זה ניתניםב-51.
הרחבת פריימר על ידי DNA פולימראז
פעילות DNA פולימראז באמצעות הרחבה של פריימר 20 nt המסומן באופן פלואורסצנטי תגרום להגדלת גודל של עד 40 nt בעת שימוש בערכת אוליגונוקלאוטידים המוצגת כאן (איור 4A). מוצרים מורחבים חלקית יופיעו כסולם של מוצרים עד לגודל התבנית (איור 4B ואיור 4C). בדיקת הרחבת הפריימר המתוארת כאן (איור 4C) הובילה לסינתזה מלאה של גדיל הפריימר.
השפלה על ידי נוקלאז
פעילות הנוקלאז גורמת לירידה בגודל האוליגונוקלאוטיד המסומן פלואורסצנטית כאשר הוא מוצג על ג'ל PAGE של אוריאה. Nucleases עם פעילות אנדונוקלאז ספציפית עשויים לגרום למוצר יחיד של 20 nt (איור 5A-C). נוקלאזות עם פעילות אקסונוקלאז יגרמו לאוליגונוקלאוטידים מסומנים פלואורסצנטית בגדלים שונים (איור 5D-F). כאן מוצגות התוצאות של חלבון נוקלאז מטא-גנום אנטארקטי חיידקי, אשר מציג פעילות אנדונוקלאז ספציפית על מצע האתר הבסיסי הדו-גדילי ופעילות אקסונוקלאז לא ספציפית על המצע החד-גדילי (איור 5C ואיור 5F, בהתאמה).
בדיקת שימוש ב-Ligase de-adenylation ו-nucleotide cofactor
אנזימי ליגאז רבים בעלי ביטוי רקומביננטי מטוהרים במצב שכבר עבר אדנילציה מ-ATP או NAD שנלקחו מהמארח שלהם 51,52,53,54,55. הסרת מתווך AMP קוולנטי זה נחוצה לזיהוי מדויק של טווח הקו-פקטורים של הנוקלאוטידים שהאנזים יכול להשתמש בהם לקשירת מצעי חומצת גרעין51. תחלופה של אנזים ליגאז adenylated עם סובסטרט לא מסומן בהיעדר קופקטור נוקלאוטיד אקסוגני ידלדל את ביניים adenylation. על ידי שימוש במצעי DNA המסומנים באופן פלואורסצנטי והוספת קו-פקטור נוקלאוטידים בשלב השני בלבד, כל מוצר קשירה הנראה לעין בעת שימוש בתעלה פלואורסצנטית (Fluorescein-FITC) על מצלמת הג'ל הוא תוצאה של אדנילציה עם קופקטור הנוקלאוטיד שנוסף בשלב זה.
מבחני פעילות שהוקמו עם ליגאז דנ"א חיידקי המבוטא במערכת E. coli מראים שהוא טוהר בצורה טרום אדנילציה והפגין יכולת רקע לקשור את הדנ"א המנוקד ללא קופקטור נוסף (איור 6Ai-ii). הוספת ATP לליגאז האדנילציה אכן מגדילה את כמות תוצר הקשירה שנוצר בתגובה, אך זה לא תמיד אמין מכיוון שפעילות בסיסית זו עלולה לתת רושם שגוי של שימוש בקו-פקטור רחב טווח או תוספות נוספות של קו-פקטורים נוקלאוטידים לתגובה עלולות לעכב קשירה של המצע. על ידי הדגירה הראשונה של הליגאז עם גרסה לא מסומנת של מצע הדנ"א המתוקן, AMP מתהפך, ולא נצפתה קשירה על מצע ה- DNA nick המסומן אלא אם כן ATP נוסף לתגובה. בדיקת הפעילות השנייה (איור 6B) מראה כי ליגאז הדנ"א נטול האדנילציה שיפר את פעילות הקשירה על מצע הדנ"א של ניק עם תוספת של ATP ו-ADP. יש גם שיפור מסוים בקשירה עם תוספת של GTP, שהוא גדול יותר מקשירת הרקע שנצפתה בבקרת ללא קו-פקטור. הקשירה שנצפתה בתגובות עם NAD דומה לקשירה הנראית בתגובות ללא קו-פקטור, מה ששולל את NAD כקופקטור לקשירה.
תוצאות בדיקה עם תווית כפולה
ניתן להשתמש בפלואורופורים האורתוגונליים כדי לבסס פעילות בחלקים שונים של מצע מורכב. הדוגמה באיור 7 מראה את הפעילות של ליגאז דנ"א R2D56 שתואר לאחרונה בהשוואה לליגאז דנ"א T4 על דופלקס דנ"א/רנ"א מקובע. קשירה של מקבל הדנ"א לאזור תורם הרנ"א במצע זוהתה באמצעות 6-FAM, ואילו קשירה של מקבל הדנ"א לתורם דנ"א זוהתה באמצעות 5-TAMRA (איור 7A). ההיקף היחסי של קשירת דנ"א לשני הקצוות של מצע הרנ"א יכול להיות מוערך על-ידי נוכחות של רצועת מוצרים עם פלואורסצנטיות הן בתעלות 6-FAM והן בתעלות 5-TAMRA, שמופיעה כצהובה בתמונה המרוכבת, בעוד שה-6-FAM וה-5-TAMRA הבודדים הם ירוקים וצהובים, בהתאמה (איור 7B). כפי שפורט בפרסום קודם56, רק ליגאז R2D היה מסוגל לקשר DNA עד 5'end של RNA, בעוד שתי ליגאזות היו מסוגלות לקשור DNA עד 3'end של RNA. כאשר קושרים את שתי מולקולות הדנ"א לרנ"א בתערובות של תגובה אחת, ליגאז R2D יכול לקשור את אוליגוס הדנ"א לשני קצוות הרנ"א, כאשר רצועה נעה כלפי מעלה ונצפה שינוי צבע לצהוב (איור 7C).
הדוגמה השנייה באיור 8 משתמשת בגישת תיוג כפול כדי להדגים קשירה של אוליגונוקלאוטידים מרובים ברמות חומציות שונות. המצע, שהורכב מתערובת של שבעה אוליגונוקלאוטידים, שימש כדי להראות את יכולתו של ליגאז R2D להרכיב מקטעים קצרים. לגדיל 5' יש גדיל FAM פלואורופור המסומן 14 nt, ואילו לגדיל המשלים יש פלואורופור TAMRA בקצה 3' של אוליגונוקלאוטיד 16 nt. קשירה מוצלחת ניתן לראות על ידי פסים גבוהים נוספים עבור אוליגו FAM (ירוק) ואוליגו TAMRA (אדום). החפיפה בין שני הפלואורופורים מעניקה לרצועת הנוקלאוטידים בצהוב גדילים קשורים לחלוטין באותו גודל.
תוצאות קשירת DNA מאנזים ליגאז DNA באמצעות EMSA
הקישור של אנזים ליגאז הדנ"א לדנ"א מנוקה זרחני יוצר קומפלקס בעל משקל מולקולרי גבוה יותר מהאוליגונוקלאוטיד לבדו (איור 9A). כאן מוצגת קשירה של ליגאז DNA חיידקי תלוי ATP למצע DNA ניק. בריכוזי חלבון גבוהים, רוב מצע הדנ"א המסומן קשור ונראה ברצועות המשקל המולקולריות הגבוהות יותר; בריכוזי חלבון נמוכים יותר, מצע דנ"א חופשי שולט (איור 9B).

איור 1: סכמות של מצעי חומצות גרעין שונים המיועדים לבדיקת פעילות אנזימטית של ליגאז. כוכבים מייצגים תיוג עם 6- carboxyfluorescein במסוף 5' (5' FAM). גדילים מסומנים מסומנים בקו שחור או כחול כהה/אדום (במקרה של דופלקסים DNA/RNA), בעוד שחלקים לא מסומנים של דופלקסים של המצע מסומנים בקו אפור או כחול בהיר/אדום (במקרה של דופלקסים DNA/RNA). הגדילים המסומנים הם 20 nt, ואם הגדילים קשורים, הם יוצרים מוצר 40 nt. 5' אתרי פוספורילציה מסומנים על ידי P במעגל. גדילי אוליגונוקלאוטידים מסומנים, והשמות מוזכרים בטבלה 1 ובטבלה 2. (A) תכנון מצעי דנ"א דו-גדיליים עם סוגים שונים של הפסקות, המשמשים לבדיקת הפעילות האנזימטית של ליגאזות דנ"א. (B) תכנון מצעי RNA ו-RNA/DNA דו-גדיליים המשלבים אוליגונוקלאוטידים של DNA ו-RNA. המצע מכיל אתר ניק יחיד ומשמש לבדיקת יכולתן של ליגאזות לאטום שברי ניק של דופלקסים RNA/DNA. הקו האדום מייצג אוליגונוקלאוטידים של RNA, והקווים הכחולים מייצגים אוליגונוקלאוטידים של DNA. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
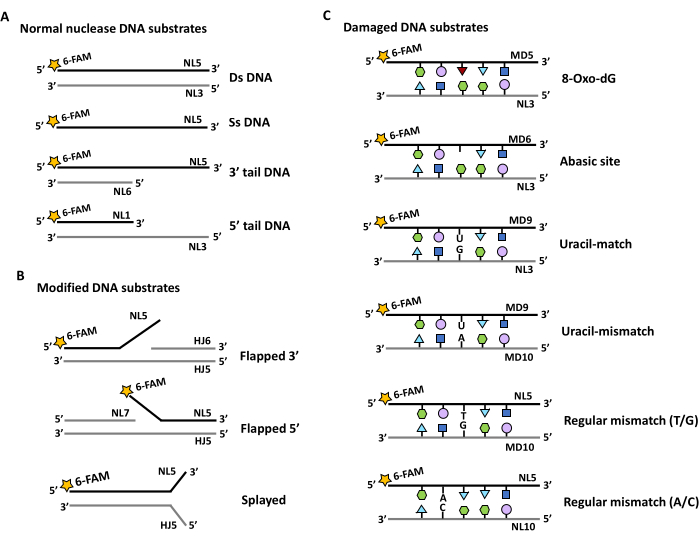
איור 2: סכמות של מצעי חומצות גרעין שונים שתוכננו לבדיקת פעילות אנזימטית של נוקלאז. כוכבים מייצגים תיוג עם 6- carboxyfluorescein במסוף 5' (5' FAM). גדילים מסומנים מסומנים בקו שחור, בעוד חלקים לא מסומנים של דופלקסים של מצע מסומנים בקו אפור. 5' אתרי פוספורילציה מסומנים על ידי P במעגל. גדילי אוליגונוקלאוטידים מסומנים, והשמות מוזכרים בטבלה 1 ובטבלה 2. (א) תכנון מצעים בעלי חלקים כפולים וחד-גדילים. (B) העיצוב של מצעי דנ"א דו-גדיליים משתנה כדי ליצור דשים חד-גדיליים בקצה של 3' או 5' (דש 3', דש 5', או דש בשני הקצוות (מנופח)). (C) תכנון מצעים דו-גדיליים המשלבים בסיסים פגומים או אי-התאמות במיקום מרכזי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
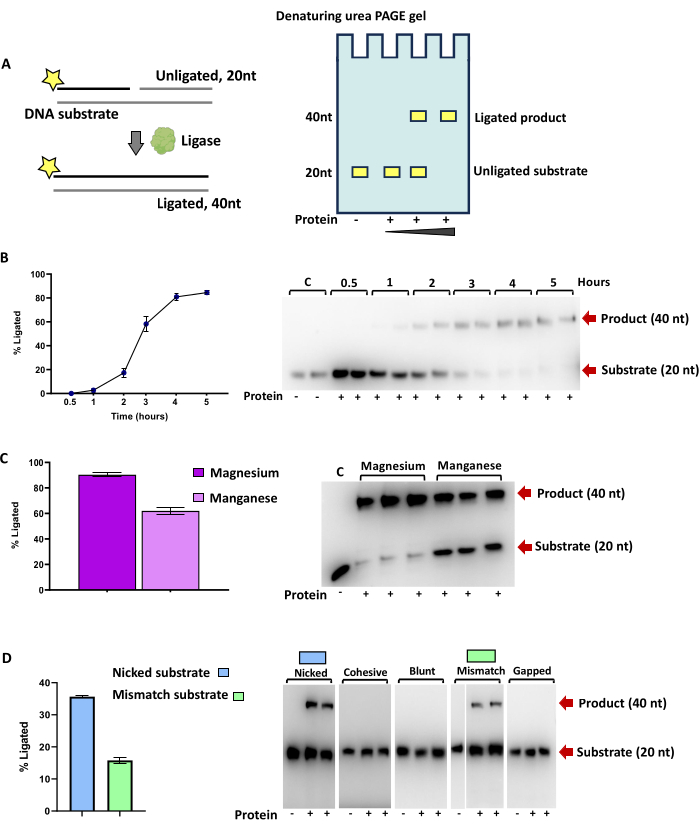
איור 3: בדיקת פעילות קשירה של DNA ligase DV-1-1-Lig חיידקי תלוי ATP. (A) סכמטיות של בדיקות אנזימים לפעילות ליגאז על מצעי דנ"א עם תוצאות שנותחו על ג'ל TBE urea PAGE. כוכבים מייצגים תיוג עם 6-carboxyfluorescein במסוף 5' (5' FAM). גדילים מסומנים מסומנים בקו שחור, בעוד חלקים לא מסומנים של דופלקסים מצע שאינם נראים במהלך הניתוח מסומנים על ידי קווים אפורים. (B) כימות קשירה על ידי DV-1-1-Lig על גבי DNA מחורר בנקודות זמן שונות. הפעילות נגד כל מצע בוצעה בכפילות. התגובות הודגרו לפרקי זמן שונים (0.5 שעות, שעה אחת, שעתיים, 3 שעות ו-4 שעות) בטמפרטורה של 25 מעלות צלזיוס, עם ריכוז חלבון סופי של 4 מיקרומטר, ריכוז ATP סופי של 1 מילימטר וריכוז יוני מגנזיום סופי של 10 מילימטר. (C) קשירה של מצע DNA עם מגנזיום (Mg) או מנגן (Mn). התגובות בוצעו במשך 3 שעות, בטמפרטורה של 25 מעלות צלזיוס, עם ריכוז ATP סופי של 1 מילימטר וריכוז יוני מתכת סופי של 10 מילימטר. (D) תוצאות קשירה על מצעי DNA שונים. התגובות בוצעו במשך 8 שעות, בטמפרטורה של 20 מעלות צלזיוס, עם ריכוז סופי של 2 מיקרומטר חלבון, ריכוז סופי של 1 מילימטר של ATP וריכוז סופי של מגנזיום של 10 מילימול. תוספת החלבון לתגובה מסומנת על ידי סמל פלוס (+). תגובות בקרה מסומנות על ידי C, והיעדר חלבון הכלול מסומן על ידי סמל מינוס (-). המוצר (40 nt) והמצע (20 nt) מסומנים בחצים אדומים. תוצאות מבחני הפעילות הודגמו באמצעות מערכת הדמיה. הפסים כומתו על ידי שילוב של עוצמה באמצעות תוכנת ImageJ49 והגרפים נוצרו באמצעות תוכנת גרפים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
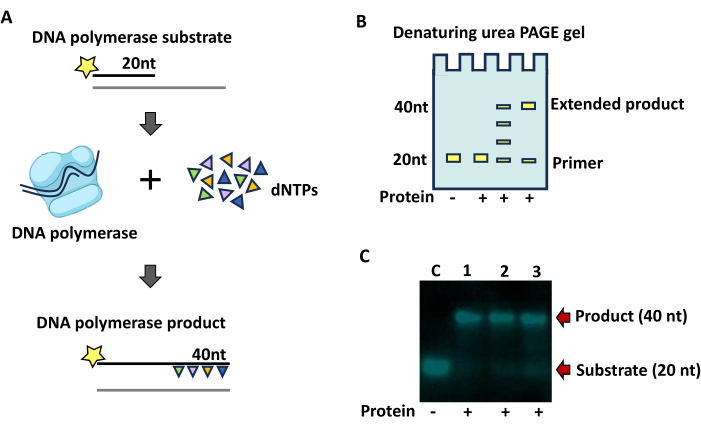
איור 4: בדיקת DNA פולימראז. (A) סכמה של בדיקת הרחבת פריימר על מצע DNA. כוכבים מייצגים תיוג עם 6-carboxyfluorescein במסוף 5' (5' FAM). גדילים מסומנים מסומנים בקו שחור, בעוד חלקים לא מסומנים של דופלקסים מצע שאינם נראים במהלך הניתוח מסומנים על ידי קווים אפורים. (B) סכמה של תוצאות ג'ל TBE Urea PAGE צפויות המראות עלייה באורך הפריימר המסומן בתוספת נוקלאוטידים. (C) דוגמה להרחבת פריימר עם אנזים E . coli Klenow fragment DNA polymerase. תוספת החלבון לתגובה מסומנת על ידי סמל פלוס (+). נתיב 1, 12.5 U; נתיב 2, 2.5 U; נתיב 3, 1.25U. תגובות בקרה מסומנות על ידי C, והיעדר החלבון הכלול מסומן על ידי סמל מינוס (-). התגובות בוצעו במשך 15 דקות ב-25°C והכילו 5 mM MgCl2, 50 mM Tris pH 8.0, 50 mM NaCl2, 1 mM DTT ו-0.25 mM dNTPs. המוצר (40 nt) והמצע (20 nt) מסומנים בחצים אדומים. תוצאות מבחני הפעילות הודגמו באמצעות מערכת הדמיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: בדיקת פעילות של נוקלאז מטא-גנום אנטארקטי חיידקי באמצעות מצעים שונים, מתכות וטמפרטורות דגירה שונות. (A) פעילות אנדונוקלאז ספציפית סכמטית של חלבון נוקלאז באתר הבסיסי (מסומן על-ידי x). כוכבים מייצגים תיוג עם 6-carboxyfluorescein במסוף 5' (5' FAM). קווים שחורים מייצגים את הגדילים המסומנים, וקווים אפורים מייצגים את גדילי ה- DNA שאינם מסומנים. חיתוך ספציפי על ידי הנוקלאז מוצג בצד ימין של האתר הבסיסי אך עשוי להתרחש גם בצד שמאל. (B) סכמטי של ג'ל PAGE של אוריאה דנטורינג המציג מצע לא חתוך (40 nt) בהיעדר חלבון המסומן בסמל מינוס (-) ובמוצר החתוך (20 nt), בנוכחות נוקלאז המסומן בסימן פלוס (+). (C) דוגמה לג'ל TBE urea PAGE המראה תוצאות של פעילות נוקלאז אנדונוקלאז ספציפית על מצע DNA דו-גדילי עם אתר לא בסיסי. הבדיקה בוצעה עם ריכוז חלבון של 1.0 מיקרומטר ו 1 mM MgCl2. שתי תגובות בקרה בוצעו ב 20 מעלות צלזיוס, אחת ללא חלבון (באר 1) ואחת ללא מתכת (באר 2). התגובות הודגרו במשך 5 שעות בטמפרטורות עולות מ -1 ° C ל -50 ° C, כפי שמצוין מעל תמונת הג'ל. תוספת החלבון מסומנת על ידי סמל פלוס (+), והיעדר החלבון מסומן על ידי סמל מינוס (-). המצע והמוצר מסומנים בחצים אדומים. (D) סכמטי המראה פעילות אקסונוקלאז לא ספציפית של חלבון נוקלאז על מצע חד-גדילי. כוכבים מייצגים תיוג עם 6-carboxyfluorescein במסוף 5' (5'FAM). קווים שחורים מייצגים את הגדילים המסומנים. חיתוך לא ספציפי של הנוקלאז גורם לגדילים מסומנים באורכים משתנים (<39 nt). (E) סכמטי המייצג ג'ל PAGE של אוריאה דנטורינג המציג מצע לא חתוך (40 nt), שבו לא נוסף חלבון (-), ומראה מצע חתוך באורכים משתנים, שבו נוסף החלבון (+) שעשוי לנבוע מפעילות של אקסונוקלאז לא ספציפי. (F) ג'ל TBE urea PAGE מציג דוגמה לפעילות אקסונוקלאז לא ספציפית של אותו נוקלאז מטא-גנום אנטארקטי עם מצע חד-גדילי. הבדיקה בוצעה ב 20 ° C במשך 4 שעות עם חלבון בריכוז סופי של 1.5 מיקרומטר וריכוז סופי של יון מתכת ב 10 mM. יון המתכת המשמש מצוין מעל התמונה. תוספת החלבון מסומנת על ידי סמל פלוס (+), והיעדר החלבון מסומן על ידי סמל מינוס (-). המצע (40 nt) מסומן על ידי החץ האדום, והמוצרים באורכים שונים מסומנים על ידי המהדק האדום. התוצאות של כל תגובות הנוקלאז הודגמו באמצעות מערכת הדמיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
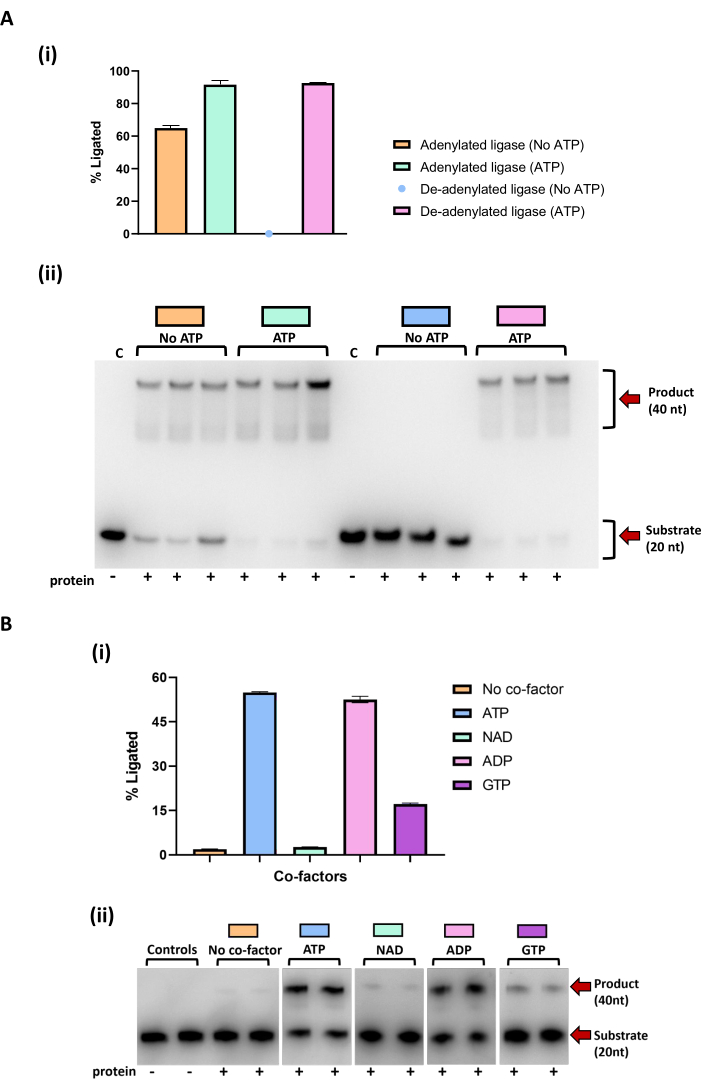
איור 6: תוצאות קשירה של מצע דנ"א מנוקד על-ידי גרסאות אדנילציה ודה-אדנילציה של ליגאז דנ"א חיידקי. (A) i) כימות קשירה על ידי אנזים ליגאז אדנילציה ודה-אדנילציה, עם ובלי ATP. נקודות בגרף מייצגות ממוצעים של כל תגובה משוכפלת. קווי שגיאה סטנדרטיים כלולים. ii) ג'ל TBE urea PAGE המציג את תוצאות הקשירה על מצע ה-DNA של ניק על ידי אנזים ליגאז אדנילציה ודה-אדנילציה, עם וללא ATP. התגובות בוצעו בשלשה. האנזים נטול האדנילציה הודגר מראש במשך שעתיים בטמפרטורה של 25°C עם מצע DNA של ניק ללא תווית ואנזים של 0.1 מיקרומטר, ולאחר מכן דגירה של שעה אחת עם מצע DNA שכותרתו nick. האנזים האדניל לא הודגר מראש עם הסובסטרט הלא מסומן. ATP (1 מילימול) נוסף לתגובות לצד הוספת מצע DNA מסומן. (B) i) כימות של קשירה על ידי ליגאז de-adenylated על DNA nick עם גורמים משלימים שונים (ATP, NAD, ADP ו-GTP). נקודות בגרף מייצגות ממוצעים של כל ריכוז. קווי שגיאה של סטיית תקן כלולים. ii) דף אוריאה TBE המציג תוצאות של קשירה על ידי הליגאז, עם וללא תוספת של גורמים משלימים שונים. הפעילות נגד כל מצע בוצעה בכפילות. התגובות הודגרו מראש במשך שעתיים בטמפרטורה של 25°C עם מצע DNA לא מסומן, חלבון 4 μM ויון מגנזיום של 5 mM, ולאחר מכן דגירה של 4 שעות עם תוספת של מצע DNA מסומן, 5 mM מגנזיום וקו-פקטורים שונים בריכוז סופי של 1 mMm. תוספת החלבון לתגובה מסומנת על ידי סמל פלוס (+). נעשה שימוש בתגובות בקרה שלא הכילו חלבון (Controls, C) או קופקטור (No cofactor). המוצר (40 nt) והמצע (20 nt) מסומנים בחצים אדומים. תוצאות מבחני הפעילות הודגמו באמצעות מערכת הדמיה. הפסים כומתו על ידי שילוב של עוצמה באמצעות תוכנת ImageJ49. הגרפים נוצרו באמצעות תוכנת גרפים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 7: קשירה של אוליגונוקלאוטידים קצרים של דנ"א עם תווית פלואורסצנטית לשני הקצוות של אוליגו RNA פוספורילציה בגודל 5 אינץ', הממוקמים על-ידי תבניות דנ"א. (A) סכמה של קשירת DNA-RNA עם סד DNA המראה כיצד ניתן להמחיש מוצרי קשירה אפשריים באמצעות אסטרטגיית תיוג כפול. (B) סכמה של מוצרים אפשריים הצפויים להיראות על ג'ל Urea-PAGE שצולם בשני ערוצים. (C) תוצאות ניסוי מקשירת פלואורופור כפולה. תגובות הקשירה נבדקו באמצעות ליגאז דנ"א T4 וליגאז R2D, שתיהן בתגובות מבודדות שבהן הדנ"א היה קשור לקצה 5' (נתיב 2-4) או לקצה 3' (נתיב 5-7) של הרנ"א, או בתגובה אחת שבה שני אוליגונוקלאוטידים של דנ"א נקשרו באותה תערובת תגובה (נתיב 8-10). ללא בקרת חלבונים (NPC) לא הוסף אנזים. תנאי התגובה והאוליגונוקלאוטידים הספציפיים המשמשים בדוגמה זו זהים לאלה שניתנוב-56. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
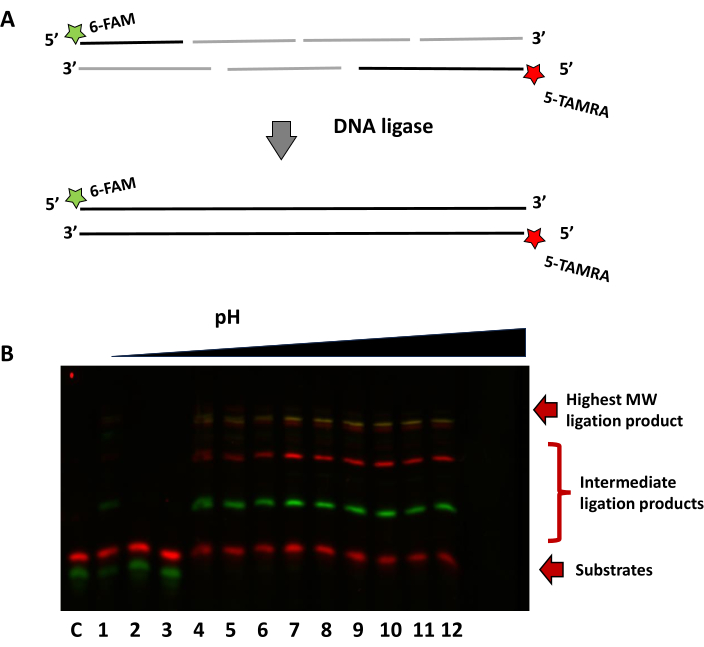
איור 8: קשירה של מקטעי אוליגונוקלאוטידים קצרים מרובים עם שלוש גרסאות R2D ברמות pH שונות. (A) סכמטי של אסטרטגיית קשירה מרובת חלקים. (B) ג'ל מייצג המציג תלות pH של הרכבה מרובת חלקים, בתמונה עם ערוצי FAM ו-TAMRA. נתיב C ללא בקרת אנזימים, נתיבים 1-3 pH 6.0, נתיב 4-6 pH 6.5, נתיב 7-9 pH 7, ונתיב 10-12 pH 7.5. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
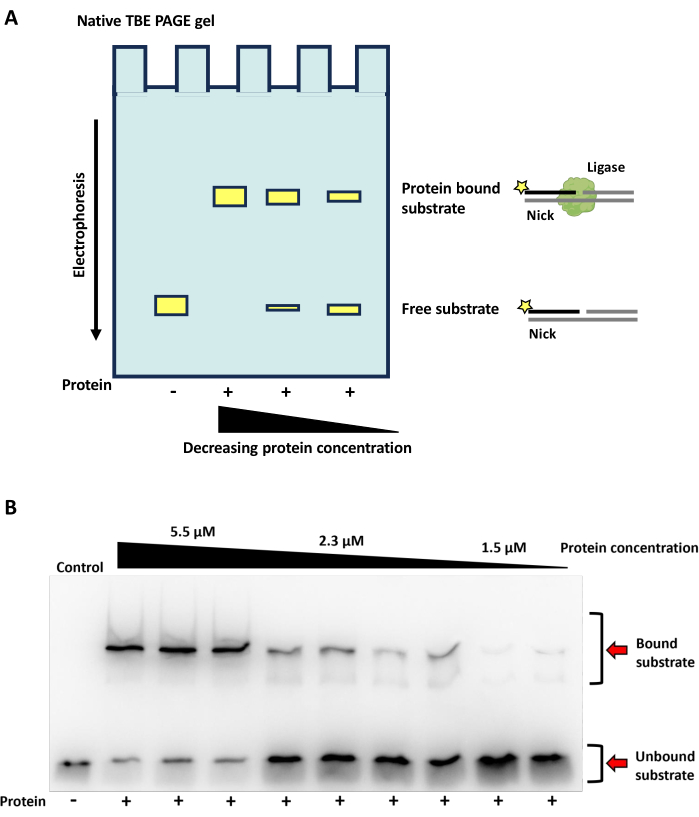
איור 9: תוצאות EMSA. ג'ל TBE PAGE סכמטי ומקורי של בדיקת שינוי ניידות אלקטרופורטית (EMSA) המדמה את פעילות הקישור של ליגאז DNA תלוי ATP (שמקורו בנתוני מטה-גנום מהעמקים היבשים McMurdo, אנטארקטיקה) על מצע DNA. (A) סכמטי של פעילות קשירת EMSAs/DNA על ידי ליגאז DNA על מצע DNA ניק. תוצאות הקשירה מוצגות באופן חזותי על ג'ל TBE PAGE שאינו דנטורציה. מצעי DNA הקשורים לאנזים ליגאז נודדים לאט יותר דרך הג'ל, בעוד שסובסטרטים נטולי אנזימים נודדים מהר יותר, וכתוצאה מכך משתנה גודל הרצועה (קופסאות צהובות) המוצג על הג'ל. כאשר המצעים מוצגים על ג'ל שאינו דנטורציה, האוליגונוקלאוטידים יישארו מחושלים, מה שיאפשר לגדיל המסומן FAM (כוכב צהוב) להיות נוכח הן על מצעים חופשיים והן על מצעים קשורים. ניתן להשתמש בשיפוע ריכוז חלבון כדי לקבוע את ריכוז החלבון לקשירה אופטימלית. (B) הדמיה של EMSA על ג'ל TBE PAGE מקורי, המראה את יכולת הקישור של ליגאז DNA תלוי ATP למצע DNA nick בריכוזי חלבונים שונים. האנזים הודגר עם מצע DNA במשך 30 דקות בטמפרטורה של 25°C, עם ריכוז ATP סופי של 1 מילימטר ו-40 מילימטר EDTA. נעשה שימוש בשלושה ריכוזי חלבון שונים (5.5 מיקרומטר, 2.3 מיקרומטר ו-1.5 מיקרומטר). התגובות אזלו על ג'ל TBE מקורי של 10%, עם צבע העמסה טבעי בתגובות. דגימות שהכילו חלבון אזלו בטריפליקטים עבור ריכוזי חלבון שונים. נתיבי הבקרה מכילים מצע DNA עם 1 mM, ATP סופי ו-EDTA, אך ללא חלבון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: רצפי אוליגונוקלאוטידים של מצע DNA המשמשים לבניית מצעי בדיקה. הנזקים מסומנים בהדגשה ובקו תחתון. מיקומים של אי-התאמות ופערים בדופלקס הסופי מסומנים בקו תחתון. קיצורים: 5' 6-carboxyfluorescien (5' FAM), 8-Oxo-deoxyguanosine (8OxodG), tetrohydrofuran בסיסי (dSpacer). אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: שילובים של אוליגונוקלאוטידים המשמשים להרכבת תערובות אב לבדיקות אנזימים שונות. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: הגדרת תערובות מאסטר בדיקה עם עד ארבעה אוליגונוקלאוטידים. ראה טבלה 2 עבור שילובים של אוליגונוקלאוטידים לשימוש עבור מצעי בדיקה שונים וטקסט לקבלת פרטים על תנאי תגובה. לכל הפחות, נדרש אוליגונוקלאוטיד מסומן - חלקים נוספים של הדופלקס מסומנים בסוגריים. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: רכיבים לתערובת אב מסומנת וללא תווית להכנת דופלקס DNA של ניק. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 5: הגדרת תערובות מאסטר EMSA עבור שילובים שונים של דופלקסים. ראה טבלה 3 עבור שילובים של אוליגונוקלאוטידים לשימוש עבור מצעי EMSA שונים וטקסט לקבלת פרטים על תנאי תגובה. מצעי EMSA מתוכננים תוך שימוש באותם אוליגונוקלאוטידים כמו אלה של מבחני הפעילות. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
שלבים קריטיים בפרוטוקול
תכנון ורכישה של אוליגונוקלאוטידים: בעת רכישת אוליגונוקלאוטידים ליצירת דופלקס, חיוני לשקול תכנון רצף. מומלץ להשתמש בכלי אנלייזר אוליגו לחיזוי תכונות רצף הנוקלאוטידים, כגון תכולת GC, טמפרטורת התכה, מבנה משני ופוטנציאל דימריזציה, לפני הזמנת57.
הרכבה וחישול של דופלקסים של חומצות גרעין: בעת הכנת דופלקסים מסוג RNA/RNA-DNA, יש להקפיד למנוע זיהום RNase על ידי שימוש בריאגנטים ומים נטולי RNase או הוספת מעכב RNAse (כל עוד האנזים הנחקר אינו RNAse בעצמו). ציוד, כפפות וחלל ספסל יש לטפל בתמיסת טיהור RNase לפני הרכבת תערובות האב כדי למנוע השפלה של אוליגונוקלאוטידים58. מלאי מאסטר של אוליגונוקלאוטידים RNA יכול להיות מורכב בקבוצות קטנות יותר במקרה של זיהום.
ליגאזות DNA דורשות תמיד קו-פקטור של נוקלאוטידים, ATP או NAD, בריכוז סופי בין 0.1 ל-1 מילימול. DNA פולימראז דורש dNTPs עבור סינתזת גדילים, ואלה מתווספים בדרך כלל ביחסים שווי ערך של 50 מיקרומטר של כל אחד. בעת הכנת תערובות אב לדופלקסים של ליגאז ופולימראז, יש להוסיף לתערובת האב גורמים משלימים של נוקלאוטידים, כגון ATP, NAD ו-dNTPs, לאחר חימום וקירור התערובת לטמפרטורת החדר, מכיוון שהם רגישים לחום.
חיץ 10x לחישול האוליגונוקלאוטידים דורש תוספת של DTT, שיש לו זמן מחצית חיים קצר ובאופן אידיאלי צריך להיות מוכן טרי או קפוא לפני השימוש. ניתן להכין מראש אליציטוטים קטנים יותר של חיץ 10x ולאחסן בטמפרטורה של 4°C, בתוספת DTT לפני השימוש.
מלאי אוליגונוקלאוטידים ותערובות מאסטר יש לאחסן בטמפרטורה של -20 מעלות צלזיוס לשימוש ארוך טווח, ואוליגונוקלאוטידים או תערובות עם תווית פלואורסצנטית עטופות בנייר כסף כדי למנוע הלבנה של הפלואורופור. כדי להימנע ממחזורי הקפאה-הפשרה חוזרים ונשנים שעלולים לפגוע בשלמות האוליגונוקלאוטידים, מומלץ להכין ולהשתמש בנפחים קטנים יותר (>1 מ"ל).
הגדרת בדיקה וניתוח של תוצאות: הכללת פקדים חיונית לפרשנות נכונה של תוצאות המבחן. יש להשתמש בבקרה ללא חלבון (מצע DNA עם תמיסת חיץ) כדי להבטיח שהפעילות הנראית לעין על המצע היא תוצאה של האנזים. במקרה של נוקלאז, התפרקות המצע האקסוגנית תגרום לרצועות משקל מולקולרי נמוך או סולם בשליטה, ואילו במקרה של ליגאז או פולימראז, דנטורציה דו-צדדית לא שלמה תגרום לפס בעל משקל מולקולרי גבוה בשליטה. בקרה חיובית על גודל המוצר הצפוי מסופקת בטבלה 2 ויש לכלול אותה כדי לאמת את גודל המוצר הנכון.
פרמטרים חשובים באלקטרופורזה מוצלחת של מוצר הבדיקה תוארו בפרוטוקול קודם59. אלה כוללים הבטחת אחוז האקרילאמיד המתאים לגודל המצע ושימוש בצבע העמסה מתאים בהתאם לגודל המצע וסוג הג'ל הנדרש להדמיית התוצאות. צבע המעקב ברומופנול כחול פועל בגודל המשוער של אוליגונוקלאוטיד בעל 10 בסיסים ולכן מתאים לקבוצת האוליגונוקלאוטידים המתוארת כאן; עם זאת, אם יש רצועת צבע החופפת למוצר הפלואורסצנטי או לפסי המצע בעת שימוש בנוקלאוטידים קצרים יותר, צבע המעקב עשוי להיות מוחלף לקסילן ציאנול, הפועל לאט יותר60.
כדי להבטיח רזולוציה טובה של המצע / רצועות המוצר, מיכל הג'ל צריך להיות מחומם חיצונית באמצעות אמבט מים או על ידי הפעלת מתח גבוה (למשל, 180 V). הפעלת ג'ל PAGE של אוריאה מראש למשך 30 דקות לפחות ושטיפת הבארות עם פיפטה כדי להסיר עודפי אוריאה חיונית לקבלת רצועות חדות וישרות המתאימות לכימות.
לצורך כימות מצעים ומוצרים, יש להמיר טווח של 20%-80% מכלל החומר למוצר כדי לאפשר אינטגרציה מדויקת של רצועות הג'ל הפלואורסצנטיות. אם משתמשים באנזים חדש, מומלץ להריץ שיפוע של ריכוזי חלבונים כדי לאפשר ביצוע מדידות עוקבות בטווח זה. למצלמות פלואורסצנטיות רבות יש תכונות משולבות פס מובנות שניתן להשתמש בהן למטרה זו. אם אתם משתמשים בתוכנה חיצונית כמו ImageJ49, ודאו שתמונת הג'ל מיוצאת באיכות גבוהה בפורמט tiff.
שינויים ופתרון בעיות של הטכניקה
תכנון ורכישה של אוליגונוקלאוטידים: האוליגונוקלאוטידים הניתנים בפרוטוקול זה הם נקודות התחלה שימושיות וניתן להרחיבם, כפי שמוצע בסעיף השיטות, על ידי שינוי רצפי האוליגונוקלאוטידים ושילוב שינויים.
הגדרת בדיקה סטנדרטית וניתוח תוצאות: ניסויי פיילוט חיוניים בעת בדיקת פעילותו של אנזים חדש מכיוון שתנאי התגובה האופטימליים ישתנו בין חלבונים שונים; הפרמטרים המופיעים בפרוטוקול זה נועדו להוות נקודת מוצא בלבד. גורמים כגון ריכוז אנזימים, טמפרטורת תגובה, משך הדגירה, קו-פקטור והרכב חיץ/pH עשויים להשתנות במהלך התמהיל הראשי ומכלול תגובת הבדיקה. ריכוזי קו-פקטור חשובים במיוחד מכיוון שעודף של קופקטורים נוקלאוטידים או יוני מתכת יכול להיות מעכב, ומומלץ לבדוק טווח של ריכוזים של כל אחד מהם. עבור DNA פולימראזות, ריכוזי dNTP מומלצים נעים בין 20 ל -200 מיקרומטר בסך הכל, עם זאת, ריכוזי dNTP גבוהים מפחיתים את נאמנות61. כמו כן, ליגאזות פולינוקלאוטידים נבדקות בדרך כלל עם קופקטור נוקלאוטיד 0.1-1.0 mM, אך ריכוזים מופרזים גורמים לדנ"א מצטבר לאדנילט ולעיכוב תגובה62.
הפרוטוקול הסטנדרטי כאן משתמש ב- Mg כקטיון דו-ערכי; עם זאת, אנזימים מסוימים פעילים יותר עם מנגן (Mn) או אבץ (Zn). תערובות מאסטר המכילות Mn או Zn צריכות להיות מוכנות עם חיץ pH נמוך יותר (<7.5), ויש להוסיף מתכות לאחר חימום. יש להשתמש בתערובות מאסטר באותו היום כדי למנוע משקעים ועיכוב של פעילות האנזים.
תוספים, כולל חומרי צפיפות כגון פוליאתילן גליקול (PEG) או מייצבים כגון אלבומין בסרום בקר, ניתן להשתמש כדי להגביר את הפעילות של אנזימים מסוימים63,64. אלה יש להוסיף לאחר שלב החישול בשל thermolability שלהם. כל ריאגנטים שמקורם ביולוגי צריכים להיות בדרגת ביולוגיה מולקולרית כדי למנוע החדרת נוקלאזות מזהמות.
נפח חיץ מרווה פורממיד המשמש בפרוטוקול זה מתאים לקבוצת הבסיס של אוליגונוקלאוטידים. עם זאת, עבור אוליגונוקלאוטידים ארוכים יותר, יש להגדיל את נפח הפורממיד ל-10 μL עד 20 μL כדי להבטיח הפרדה מלאה של הגדיל, וניתן לקרר תגובות מרוות על קרח ב-4°C עד לאלקטרופורזה.
עם אנזימים מסוימים, קשירה הדוקה של החלבון למצע / מוצר עשויה למנוע נדידה של אוליגונוקלאוטידים לתוך הג'ל במהלך אלקטרופורזה, במיוחד כאשר האנזים משמש בריכוזים גבוהים. זה יופיע כחוסר בפסי מוצר/מצע על הג'ל ולעיתים קרובות הצטברות של חומר פלואורסצנטי (מוצר ו/או מצע מורכב עם חלבון) בבארות. כדי לשבש קומפלקסים אלה, ניתן לטפל בתערובת הבדיקה עם פרוטאינאז K לפני הוספת מאגר מרווה, או נתרן דודציל סולפט (SDS) ניתן להוסיף במהלך מרווה.
פעילות ליגאז הדנ"א מייצרת שתי רצועות בדידות, שקל לכמת אותן. ניתן להשתמש באותה שיטה כדי לכמת פעילות אנדונוקלאז על מצע נזק לדנ"א שבו צפוי מוצר יחיד של 20 נוקלאוטידים, או בדיקות EMSA שבהן מבחינים בבירור בין המצבים הכבולים/לא קשורים. כימות מדויק של פולימראז ופעילות נוקלאז תהליכית קשה על ידי שילוב פסים, ובאופן כללי, מומלץ להשתמש בבדיקה בזמן אמת עם בדיקות או משואות, כמתואר במבוא.
דה-אדנילציה וספציפיות קו-פקטור של ליגאז DNA: ייתכן שיהיה צורך באופטימיזציה מסוימת של פרוטוקול זה כדי להסיר את כל פעילות הרקע, אשר לאחר מכן תשוחזר על ידי הוספת הקו-פקטור(ים) של הנוקלאוטידים. אם פעילות ליגאז הרקע נשארת לאחר דה-אדנילציה (נתפסת כקשירה בבקרה ללא קו-פקטור), ניתן להגדיל את זמן הדגירה של שלב הדה-אדנילציה, או להקטין את ריכוז הליגאז. יש לוודא שהדנ"א הדו-צדדי ללא תווית מרוכז יותר מהחלבון (> 4:1::מצע: חלבון). אם הוספת קופקטור בנוכחות DNA מסומן אינה מחזירה את הקשירה עבור אף אחד מהקו-פקטורים שנבדקו, ייתכן שהאנזים עבר דנטורציה, ויש לקצר את שלב הדה-אדנילציה. עבור ליגאז חדש או אצווה חדשה של אנזים רקומביננטי, כדאי לקבוע את מידת קשירת הרקע עם האנזים אדנילציה בהיעדר גורמים משלימים נוספים של נוקלאוטידים. זה כרוך ביצירת תגובה נוספת שבה 10 μL של תערובת מאסטר ללא תווית, 10 μL של תערובת מאסטר מסומן, ו 2.5 μL של אנזים טרי שלא עבר de-adenylated מודגרים בו זמנית.
השתמש במצעים עם תווית כפולה: פרוטוקול זה דורש תכנון ורכישה של אוליגונוקלאוטיד עם מואטי פלורסנטי בעל ספקטרום עירור / פליטה שונה מהפלואורופור ששימש במקור ולאחר מכן הרכבה שלו לדופלקס כך ששני הפלואורופורים האורתוגונליים יסמנו חלקים שונים של המצע. אם יש ספק, מספר צופים ספקטרליים מקוונים זמינים לבדיקת ספקטרום עירור ופליטה, לדוגמה, FPbase Spectra Viewer ו- BD Spectrum Viewer, שניתן להשתמש בהם כדי לבדוק הן את התאימות של זוג הפלואורופורים והן את הגדרות התמונה המתאימות ביותר. ההגדרות הספציפיות המשמשות להדמיית הג'ל יהיו תלויות בדגם של ההדמיה ובפלואורופור(ים) המשמשים. התמונה המורכבת תקליט את האות משני הערוצים בג'ל היחיד, והרצועה שבה שני הפלואורופורים מחוברים לאותו מוצר תופיע כצבע ביניים. ניתן לנתח תמונות נפרדות מערוצים בודדים כדי לכמת את מידת הקשירה או ההשפלה על גדילים המסומנים באופן דיפרנציאלי.
מגבלות הטכניקה
בעוד שלעבודה עם מצעים המסומנים באופן פלואורסצנטי יש יתרונות רבים, כגון סיכונים בריאותיים נמוכים, ישנן כמה מגבלות שיש לקחת בחשבון כאשר עובדים עם סוגים אלה של מצעים מסומנים. אחד מהם הוא העלות הגבוהה יחסית של הזמנת אוליגונוקלאוטידים אלה עם תוויות פלואורופור או שינויים, כגון הוספת בסיסים פגומים, בהשוואה לתיוג רדיו פנימי. סיבה נוספת היא שנדרשים ציוד ותוכנה מיוחדים לזיהוי גדילים מסומנים. עם זאת, תכונות אלה כלולות כעת ברוב מערכות הדמיון הג'ל החדשות. יש לשקול גם את הפוטנציאל של הפלואורופורים לשנות את תכונות הקישור של חלבוני אינטראקציית המטרה. פלואורסצאין ונגזרתו FAM משמשים בדרך כלל לסימון אוליגונוקלאוטידים ורגישים לשינויים ב-pH וב-Nucleobase-quenching65. מגבלות אלה יש לשקול בזהירות כאשר מחליטים על סוג ומיקום של fluorophores על אוליגונוקלאוטיד עבור עיצוב דופלקס.
Disclosures
SEG ו-UR הם עובדים של ArcticZymes Technologies AS, המפיצה את ליגאז R2D. ל-AW, ER-S ו-RS אין אינטרסים מתחרים.
Acknowledgements
AW נתמך על ידי מלגת Rutherford Discovery Fellowship (20-UOW-004). RS היא זוכת מלגת ניו זילנד פוסט אנטארקטיקה. SG ו- UR מודים למכון הכימי באוניברסיטת טרומסו - האוניברסיטה הארקטית הנורבגית לתמיכה טכנית.
Materials
| Name | Company | Catalog Number | Comments |
| 30% Acrylamide/Bis Solution (29:1) | BioRad | 1610156 | |
| Adenosine triphosphate (ATP) | Many suppliers | ||
| Ammonium persulfate (APS) | Many suppliers | ||
| Benchtop centrifuge | Many suppliers | ||
| Borate | Many suppliers | ||
| Bromophenol blue | Many suppliers | ||
| Dithiothreitol (DTT) | Many suppliers | ||
| Electrophoresis system with circulating water bath | Many suppliers | ||
| Ethylenediaminetetraacetic acid (EDTA) | Many suppliers | ||
| Fluoresnence imager, e.g. iBright FL1000 | Thermo Fisher Scientific | A32752 | |
| Formamide | Many suppliers | ||
| Gel casting system | Many suppliers | ||
| Heating block | Many suppliers | ||
| Magnesium Chloride | Many suppliers | Other metal ions may be preferred depending on the protein studied | |
| Microcentrifuge tubes (1.5 mL) | Many suppliers | ||
| Micropipettes and tips | Many suppliers | 1 mL, 0.2 mL, 0.02 mL, 0.002 mL | |
| Nicotinamide adenine dinucleotide (NAD+) | Many suppliers | ||
| Oligonucleotides | Integrated DNA Technologies | NA | Thermo Fisher, Sigma-Aldrich, Genscript and others also supply these |
| pasture pipette | Many suppliers | ||
| PCR thermocycler | Many suppliers | ||
| PCR tubes | Many suppliers | ||
| RNAse away | ThermoFisher | 7002PK | Only needed when working with RNA oligos |
| RNase AWAY | Merck | 83931-250ML | Surfactant for removal of RNAse contamination on surfaces |
| RNAse-free water | New England Biolabs | B1500L | Only needed when working with RNA oligos |
| Sodium Chloride | Many suppliers | ||
| SUPERase IN RNase inhibitor | Thermo Fisher Scientific | AM2694 | Broad spectrum RNAse inhibitir (protein-based) |
| SYBR Gold | Thermo Fisher Scientific | S11494 | This may be used to post-stain gels and visualise unlabelled oligonucleotides |
| Tetramethylethylenediamine (TMED) | Many suppliers | ||
| Tris, or tris(hydroxymethyl)aminomethane | Many suppliers | ||
| Ultrapure water (Milli-Q) | Merck | ||
| urea | Many suppliers | ||
| Vortex | Many suppliers |
References
- Gao, Y., et al. Structures and operating principles of the replisome. Science. 363 (6429), 7003 (2019).
- Yang, W., Gao, Y. Translesion and repair DNA polymerases: Diverse structure and mechanism. Annu Rev Biochem. 87, 239-261 (2018).
- Lohman, T. M., Fazio, N. T. How does a helicase unwind DNA? Insights from RecBCD Helicase. Bioessays. 40 (6), e1800009 (2018).
- Ahdash, Z., et al. Mechanistic insight into the assembly of the HerA-NurA helicase-nuclease DNA end resection complex. Nucleic Acids Res. 45 (20), 12025-12038 (2017).
- Wozniak, K. J., Simmons, L. A. Bacterial DNA excision repair pathways. Nat Rev Microbiol. 20 (8), 465-477 (2022).
- Zhang, L., Jiang, D., Wu, M., Yang, Z., Oger, P. M. New insights into DNA repair revealed by NucS endonucleases from hyperthermophilic Archaea. Front Microbiol. 11, 1263 (2020).
- Saathoff, J. H., Kashammer, L., Lammens, K., Byrne, R. T., Hopfner, K. P. The bacterial Mre11-Rad50 homolog SbcCD cleaves opposing strands of DNA by two chemically distinct nuclease reactions. Nucleic Acids Res. 46 (21), 11303-11314 (2018).
- Williamson, A., Leiros, H. S. Structural insight into DNA joining: from conserved mechanisms to diverse scaffolds. Nucleic Acids Res. 48 (15), 8225-8242 (2020).
- Caglayan, M. Interplay between DNA polymerases and DNA ligases: Influence on substrate channeling and the fidelity of DNA ligation. J Mol Biol. 431 (11), 2068-2081 (2019).
- Shuman, S. DNA ligases: Progress and prospects. J Biol Chem. 284 (26), 17365-17369 (2009).
- Lohman, G. J., Tabor, S., Nichols, N. M. DNA ligases. Curr Prot Mol Biol. , (2011).
- Rittié, L., Perbal, B. Enzymes used in molecular biology: a useful guide. J Cell Commun Signal. 2 (1-2), 25-45 (2008).
- Chandrasegaran, S., Carroll, D. Origins of programmable nucleases for genome engineering. J Mol Biol. 428 (5), 963-989 (2016).
- Aschenbrenner, J., Marx, A. DNA polymerases and biotechnological applications. Curr Opin Biotechnol. 48, 187-195 (2017).
- Loenen, W. A. M., Dryden, D. T. F., Raleigh, E. A., Wilson, G. G., Murray, N. E. Highlights of the DNA cutters: a short history of the restriction enzymes. Nucleic Acids Res. 42 (1), 3-19 (2013).
- Voytas, D., Ke, N. Detection and quantitation of radiolabeled proteins and DNA in gels and blots. Curr Protoc Immunol. , (2002).
- Phillips, D. H. Detection of DNA modifications by the 32P-postlabelling assay. Mutat Res. 378 (1-2), 1-12 (1997).
- Huang, C., Yu, Y. T. Synthesis and labeling of RNA in vitro. Curr Prot Mol Biol. , (2013).
- Ballal, R., Cheema, A., Ahmad, W., Rosen, E. M., Saha, T. Fluorescent oligonucleotides can serve as suitable alternatives to radiolabeled oligonucleotides. J Biomol Tech. 20 (4), 190-194 (2009).
- Anderson, B. J., Larkin, C., Guja, K., Schildbach, J. F. Using fluorophore-labeled oligonucleotides to measure affinities of protein-DNA interactions. Meth Enzymol. 450, 253-272 (2008).
- Liu, W., et al. Establishment of an accurate and fast detection method using molecular beacons in loop-mediated isothermal amplification assay. Sci Rep. 7 (1), 40125 (2017).
- Ma, C., et al. Simultaneous detection of kinase and phosphatase activities of polynucleotide kinase using molecular beacon probes. Anal Biochem. 443 (2), 166-168 (2013).
- Li, J., Cao, Z. C., Tang, Z., Wang, K., Tan, W. Molecular beacons for protein-DNA interaction studies. Meth Mol Biol. 429, 209-224 (2008).
- Yang, C. J., Li, J. J., Tan, W. Using molecular beacons for sensitive fluorescence assays of the enzymatic cleavage of nucleic acids. Meth Mol Biol. 335, 71-81 (2006).
- Nikiforov, T. T., Roman, S. Fluorogenic DNA ligase and base excision repair enzyme assays using substrates labeled with single fluorophores. Anal Biochem. 477, 69-77 (2015).
- Pergolizzi, G., Wagner, G. K., Bowater, R. P. Biochemical and structural characterisation of DNA ligases from bacteria and Archaea. Biosci Rep. 36 (5), 00391 (2016).
- Martin, I. V., MacNeill, S. A. ATP-dependent DNA ligases. Genome Biol. 3 (4), (2002).
- Bilotti, K., et al. Mismatch discrimination and sequence bias during end-joining by DNA ligases. Nucleic Acids Res. 50 (8), 4647-4658 (2022).
- Bauer, R. J., et al. Comparative analysis of the end-joining activity of several DNA ligases. PLoS One. 12 (12), e0190062 (2017).
- Lohman, G. J. S., Zhang, Y., Zhelkovsky, A. M., Cantor, E. J., Evans, T. C. Efficient DNA ligation in DNA-RNA hybrid helices by Chlorella virus DNA ligase. Nucleic Acids Res. 42 (3), 1831-1844 (2014).
- Bullard, D. R., Bowater, R. P. Direct comparison of nick-joining activity of the nucleic acid ligases from bacteriophage T4. Biochem J. 398 (1), 135-144 (2006).
- Magnet, S., Blanchard, J. S. Mechanistic and kinetic study of the ATP-dependent DNA ligase of Neisseria meningitidis. Biochemistry. 43 (3), 710-717 (2004).
- Williamson, A., Grgic, M., Leiros, H. S. DNA binding with a minimal scaffold: structure-function analysis of Lig E DNA ligases. Nucleic Acids Res. 46 (16), 8616-8629 (2018).
- Lohman, G. J., et al. A high-throughput assay for the comprehensive profiling of DNA ligase fidelity. Nucleic Acids Res. 44 (2), e14 (2016).
- Kim, J., Mrksich, M. Profiling the selectivity of DNA ligases in an array format with mass spectrometry. Nucleic Acids Res. 38 (1), e2 (2010).
- Tang, Z. W., et al. Real-time monitoring of nucleic acid ligation in homogenous solutions using molecular beacons. Nucleic Acids Res. 31 (23), e148 (2003).
- Yang, W. Nucleases: diversity of structure, function and mechanism. Q Rev Biophys. 44 (1), 1-93 (2011).
- Marti, T. M., Fleck, O. DNA repair nucleases. Cell Mol Life Sci. 61 (3), 336-354 (2004).
- Wang, B. B., et al. Review of DNA repair enzymes in bacteria: With a major focus on AddAB and RecBCD. DNA Repair. 118, 103389 (2022).
- Pidugu, L. S., et al. Structural insights into the mechanism of base excision by MBD4. J Mol Biol. 433 (15), 167097 (2021).
- Roberts, R. J. How restriction enzymes became the workhorses of molecular biology. Proc Natl Acad Sci U S A. 102 (17), 5905-5908 (2005).
- Miller, J. C., et al. An improved zinc-finger nuclease architecture for highly specific genome editing. Nat Biotechnol. 25 (7), 778-785 (2007).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Takemoto, N., Numata, I., Su'etsugu, M., Miyoshi-Akiyama, T. Bacterial EndoMS/NucS acts as a clamp-mediated mismatch endonuclease to prevent asymmetric accumulation of replication errors. Nucleic Acids Res. 46 (12), 6152-6165 (2018).
- Reardon, J. T., Sancar, A. Molecular anatomy of the human excision nuclease assembled at sites of DNA damage. Mol Cell Biol. 22 (16), 5938-5945 (2002).
- Kunkel, T. A., Soni, A. Exonucleolytic proofreading enhances the fidelity of DNA synthesis by chick embryo DNA polymerase-gamma. J Biol Chem. 263 (9), 4450-4459 (1988).
- Sheppard, E. C., Rogers, S., Harmer, N. J., Chahwan, R. A universal fluorescence-based toolkit for real-time quantification of DNA and RNA nuclease activity. Sci Rep. 9 (1), 8853 (2019).
- Li, J. J., Geyer, R., Tan, W. Using molecular beacons as a sensitive fluorescence assay for enzymatic cleavage of single-stranded DNA. Nucleic Acids Res. 28 (11), e52 (2000).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Meth. 9 (7), 671-675 (2012).
- Sharma, J. K., et al. Methods for competitive enrichment and evaluation of superior DNA ligases. Meth Enzymol. 644, 209-225 (2020).
- Rzoska-Smith, E., Stelzer, R., Monterio, M., Cary, S. C., Williamson, A. DNA repair enzymes of the Antarctic Dry Valley metagenome. Front Microbiol. 14, 1156817 (2023).
- Williamson, A., Pedersen, H. Recombinant expression and purification of an ATP-dependent DNA ligase from Aliivibrio salmonicida. Protein Expres Purif. 97, 29-36 (2014).
- Akey, D., et al. Crystal structure and nonhomologous end-joining function of the ligase component of Mycobacterium DNA ligase D. J Biol Chem. 281 (19), 13412-13423 (2006).
- Kim, D. J., et al. ATP-dependent DNA ligase from Archaeoglobus fulgidus displays a tightly closed conformation. Acta Crystallogr Sect F Struct Biol Cryst Commun. 65, 544-550 (2009).
- Nishida, H., Kiyonari, S., Ishino, Y., Morikawa, K. The closed structure of an archaeal DNA ligase from Pyrococcus furiosus. J Mol Biol. 360 (5), 956-967 (2006).
- Gundesø, S., et al. R2D ligase: Unveiling a novel DNA ligase with surprising DNA-to-RNA ligation activity. Biotechnol J. 19 (3), e2300711 (2024).
- Hendling, M., Barišić, I. In silico design of DNA oligonucleotides: Challenges and approaches. Comput Struct Biotechnol J. 17, 1056-1065 (2019).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harb Prot. 2019 (2), (2019).
- Summer, H., Grämer, R., Dröge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). J Vis Exp. (32), e1485 (2009).
- Smith, D. R. Gel Electrophoresis of DNA. Mol Biometh Handbook. , 17-33 (1998).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. (63), e3998 (2012).
- Rousseau, M., et al. Characterisation and engineering of a thermophilic RNA ligase from Palaeococcus pacificus. Nucleic Acids Res. 52 (7), 3924-3937 (2024).
- Kestemont, D., Herdewijn, P., Renders, M. Enzymatic synthesis of backbone-modified oligonucleotides using T4 DNA ligase. Curr Prot Chem Biol. 11 (2), e62 (2019).
- Farell, E. M., Alexandre, G. Bovine serum albumin further enhances the effects of organic solvents on increased yield of polymerase chain reaction of GC-rich templates. BMC Res Notes. 5, 257 (2012).
- Nazarenko, I., Pires, R., Lowe, B., Obaidy, M., Rashtchian, A. Effect of primary and secondary structure of oligodeoxyribonucleotides on the fluorescent properties of conjugated dyes. Nucleic Acids Res. 30 (9), 2089-2195 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved