Method Article
Uso de oligonucleótidos sintéticos modificados para analizar enzimas metabolizadoras de ácidos nucleicos
En este artículo
Resumen
Aquí, se presenta un protocolo para analizar las enzimas metabolizadoras de ácidos nucleicos, utilizando ejemplos de enzimas ligasa, nucleasa y polimerasa. El ensayo utiliza oligonucleótidos marcados con fluorescencia y sin marcar que pueden combinarse para formar dúplex que imitan el ARN y/o los daños en el ADN o los intermediarios de la vía, lo que permite la caracterización del comportamiento de las enzimas.
Resumen
La disponibilidad de una gama de oligonucleótidos sintéticos modificados de proveedores comerciales ha permitido el desarrollo de ensayos sofisticados para caracterizar diversas propiedades de las enzimas metabolizadoras de ácidos nucleicos que se pueden ejecutar en cualquier laboratorio de biología molecular estándar. El uso de etiquetas fluorescentes ha hecho que estos métodos sean accesibles para los investigadores con un equipo de electroforesis PAGE estándar y un generador de imágenes habilitado para fluorescentes, sin usar materiales radiactivos ni requerir un laboratorio diseñado para el almacenamiento y la preparación de materiales radiactivos, es decir, un laboratorio caliente. La adición opcional de modificaciones estándar, como la fosforilación, puede simplificar la configuración del ensayo, mientras que la incorporación específica de nucleótidos modificados que imitan daños en el ADN o intermedios se puede utilizar para sondear aspectos específicos del comportamiento de las enzimas. Aquí, se demuestra el diseño y la ejecución de ensayos para interrogar varios aspectos del procesamiento del ADN por enzimas utilizando oligonucleótidos sintéticos disponibles comercialmente. Estos incluyen la capacidad de las ligasas para unirse o de las nucleasas para degradar diferentes estructuras híbridas de ADN y ARN, el uso diferencial de cofactores por parte de la ADN ligasa y la evaluación de la capacidad de unión al ADN de las enzimas. Se analizan los factores a tener en cuenta al diseñar sustratos de nucleótidos sintéticos y se proporciona un conjunto básico de oligonucleótidos que se pueden utilizar para una variedad de ensayos de ligasas de ácidos nucleicos, polimerasas y enzimas nucleasas.
Introducción
Todas las formas de vida requieren enzimas de procesamiento de ácidos nucleicos para llevar a cabo procesos biológicos fundamentales, como la replicación, la transcripción y la reparación del ADN. Las funcionalidades enzimáticas clave para estas vías son las polimerasas, que generan copias de moléculas de ARN/ADN, las ligasas que se unen a sustratos de polinucleótidos, las nucleasas que los degradan, y las helicasas y topoisomerasas, que funden dúplex de ácidos nucleicos o cambian su topología 1,2,3,4,5,6,7,8,9,10 . Además, muchas de estas enzimas proporcionan herramientas moleculares esenciales para aplicaciones como la clonación, el diagnóstico y la secuenciación de alto rendimiento 11,12,13,14,15.
Las características funcionales, cinéticas y especificidades del sustrato de estas enzimas se pueden determinar utilizando sustratos de ADN/ARN marcados producidos por oligonucleótidos de recocido. El seguimiento de sustratos y productos se ha logrado tradicionalmente mediante la introducción de una etiqueta radiactiva (32P) en el extremo de la hebra 5', que luego puede ser detectada por película fotográfica o con un sistema de imagen de fósforo16,17. Si bien los sustratos radiomarcados ofrecen el beneficio de una mayor sensibilidad experimental y no alteran las propiedades químicas de un nucleótido, los peligros potenciales para la salud de trabajar con radioisótopos han alentado el desarrollo de marcadores de ácidos nucleicos no radiactivos para proporcionar una alternativa más segura para la detección de ADN y ARN 18,19,20. Entre estos, la detección de fluorescencia, incluida la detección directa de fluorescencia, la fluorescencia resuelta en el tiempo y los ensayos de transferencia de energía/extinción de fluorescencia, se destacan como los más versátiles 21,22,23,24. La amplia gama de fluoróforos permite diferentes diseños de sustratos de ADN/ARN con reporteros únicos en cada oligonucleótido25. Además, la estabilidad de los fluoróforos, en comparación con los radioisótopos, permite a los usuarios producir y preservar cantidades significativas de sustratos de ADN marcados con fluorescencia19. Estos sustratos marcados con fluoróforos se pueden incubar con la proteína de interés, junto con diferentes combinaciones de cofactores metálicos y nucleótidos, para analizar la actividad de unión y/o enzimática. La visualización de la unión o la actividad se puede observar utilizando varios canales de colorante de fluoróforo con un sistema de imágenes en gel. Dado que solo los oligonucleótidos marcados con fluorescencia serán visibles con esta técnica, cualquier aumento o disminución en el tamaño del oligonucleótido marcado será fácil de seguir. Los geles también se pueden teñir después, con tintes de tinción de ácidos nucleicos para visualizar todas las bandas de ADN presentes en el gel.
Las ligasas de ácidos polinucleicos son enzimas que unen fragmentos de ADN/ARN, catalizando el sellado de roturas mediante la formación de un enlace fosfodiéster entre los extremos 5' del ADN fosforilado y el 3' OH del ADN. Se pueden dividir en dos grupos según su requerimiento de sustrato de nucleótidos. Las ligasas dependientes de NAD altamente conservadas se encuentran en todas las bacterias26, mientras que las enzimas dependientes de ATP estructuralmente diversas pueden identificarse en todos los dominios de la vida 8,27. Las ligasas de ADN desempeñan un papel importante en el procesamiento de fragmentos de Okazaki durante la replicación, además de estar involucradas en varias vías de reparación del ADN, como la reparación por escisión de nucleótidos y bases, a través del sellado de muescas espontáneas y muescas que quedan después de la reparación 8,10. Las diferentes ligasas de ADN exhiben capacidades variables para unirse a diferentes conformaciones de roturas de ADN, incluidas muescas en un dúplex, roturas de doble cadena, desajustes y brechas, así como híbridos de ARN y ADN 28,29,30. Se puede ensamblar una amplia gama de sustratos ligables mediante el recocido de oligonucleótidos con un fosfato 5' para generar terminales 5' y 3' yuxtapuestos en un dúplex de ácido nucleico 31,32,33. El método de análisis más común es la resolución por urea PAGE en un formato de ensayo de punto final; Sin embargo, las innovaciones recientes han incluido el uso de la electroforesis en gel capilar, que permite un alto rendimiento34, el perfil de espectrometría de masas35, así como un ensayo de baliza molecular homogénea, que permite el monitoreo resuelto en el tiempo36.
El primer paso en una reacción de ligadura es la adenilación de la enzima ligasa por trifosfato de adenosina (ATP) o dinucleótido de nicotinamida y adenina (NAD), lo que da como resultado un intermediario enzimático covalente. El segundo paso en la reacción es la adenilación del sustrato de ácido nucleico en el extremo 5' del sitio de la muesca, que es seguida por la ligadura de las hebras de ácido nucleico. Muchas enzimas ligasas que se expresan recombinantemente en E. coli se purifican en forma adenilada y, por lo tanto, pueden ligar con éxito ácidos nucleicos sin la adición de un cofactor de nucleótidos. Esto hace que sea difícil determinar qué tipo particular de cofactor de nucleótidos requieren para la ligadura de ácidos nucleicos. Además de describir los ensayos para evaluar la actividad de la ADN ligasa, también se presenta un método para determinar de forma fiable el uso del cofactor mediante la desadenilación de la enzima utilizando sustratos no marcados.
Las nucleasas son un grupo grande y diverso de enzimas modificadoras de ADN/ARN y ARN catalítico que escinden los enlaces fosfodiéster entre los ácidos nucleicos37. Las funcionalidades de la enzima nucleasa son necesarias en la replicación, reparación y procesamiento del ARN del ADN y se pueden clasificar por su especificidad de azúcar para el ADN, el ARN o ambos. Las endonucleasas hidrolizan los enlaces fosfodiéster dentro de una cadena de ADN/ARN, mientras que las exonucleasas hidrolizan las cadenas de ADN/ARN un nucleótido a la vez desde el extremo 3' o 5' y pueden hacerlo desde el extremo 3' a 5' o el extremo 5' a 3' del ADN38.
Mientras que muchas proteínas nucleasas son inespecíficas y pueden estar involucradas en múltiples procesos, otras son altamente específicas para una secuencia particular o daño en el ADN 6,39,40. Las nucleasas de secuencia específica se utilizan en una amplia gama de aplicaciones biotecnológicas, como la clonación, la mutagénesis y la edición del genoma. Las nucleasas populares para estas aplicaciones son las nucleasasde restricción 41, las nucleasas de dedos de zinc42, las nucleasas efectoras de tipo activador transcripcional y, más recientemente, las nucleasas CRISPR43 diseñadas guiadas por ARN. Recientemente se han identificado nucleasas específicas de daño, como la nucleasa EndoMS, que tiene especificidad para las discordancias en el ADN a través de su dominiode nucleasa similar a RecB específico de discordancia 5,44. Los ensayos de actividad nucleasa, históricamente, se han realizado como ensayos discontinuos con sustratos radiomarcados; Sin embargo, además de sus otros inconvenientes, estos no permiten la identificación del sitio que es cortado por una proteína nucleasa, lo que es posible cuando se utilizan sustratos marcados con fluorescencia 45,46. Más recientemente, se han desarrollado ensayos continuos de nucleasas que funcionan mediante el uso de diferentes tintes de ADN que interactúan con el ADN en diferentes estados; por ejemplo, emitiendo una señal fluorescente más alta al interactuar con el ADNd que en su estado no unido, o uniéndose específicamente a ARN cortos47. Otros ensayos de nucleasa continua utilizan horquillas de ADN con un grupo fluoróforo en el extremo 5' y un extintor en el extremo 3' para que la fluorescencia aumente a medida que el oligonucleótido se degrada debido a una separación del fluoróforo y el extintor. Si bien estos ensayos permiten caracterizar la cinética de las proteínas que degradan el ADN, requieren un conocimiento previo de la función y el sustrato de la enzima y también se limitan a las enzimas que cambian la conformación del ADN para causar una diferencia en la unión del colorante. Por esta razón, los ensayos de punto final que resuelven productos individuales de nucleasa siguen siendo deseables para proporcionar información sobre las modificaciones del ADN causadas por la actividad de las proteínas.
Aquí, se presenta un procedimiento detallado para el diseño de oligonucleótidos de ADN/ARN marcados con fluorescencia que se pueden mezclar y combinar para generar sustratos para probar la actividad de nuevas enzimas nucleasa, polimerasa y ligasa. La validación de este conjunto básico de secuencias de oligonucleótidos simplifica el diseño experimental y facilita el perfilado económico de una amplia gama de funcionalidades enzimáticas sin necesidad de comprar un gran número de sustratos a medida. Se proporciona un procedimiento detallado para ejecutar un ensayo estándar de enzimas de procesamiento de ADN con estos sustratos, utilizando el ejemplo de la actividad de la ADN ligasa y se describen las modificaciones para analizar las enzimas nucleasa y polimerasa. Además, se proporciona un ensayo modificado para determinar la especificidad del cofactor de la enzima ADN ligasa con alta precisión, y se utilizan sondas de doble marcado para evaluar el ensamblaje de ligaduras multicomponente. Finalmente, se discuten las modificaciones al formato básico del ensayo para permitir su uso para determinar las interacciones proteína-ADN con los mismos sustratos mediante el ensayo de cambio de movilidad electroforética (EMSA).
Protocolo
1. Diseño y compra de oligonucleótidos
NOTA: Diseñe oligonucleótidos monocatenarios para ensamblarlos y recocerlos en los dúplex deseados. Una o más de las hebras de un dúplex deben tener una fracción fluorescente para rastrear el procesamiento de oligonucleótidos por parte de la enzima de interés. En el Cuadro 1 se proporciona un conjunto básico de secuencias monocatenarias que pueden ensamblarse para una serie de actividades.
- Incorpore las modificaciones específicas necesarias para la enzima de interés como se describe a continuación.
- Para sustratos de ADN ligasa (Figura 1): Ensamble el sustrato más simple a partir de tres oligonucleótidos: una hebra donante fosforilada 5' (NL2), una hebra aceptora marcada con FAM 5' (NL1) y un complemento que une las dos (NL3).
- Asegúrese de que las hebras que proporcionan el extremo 5' de la muesca ligable estén fosforiladas antes del ensamblaje de la mezcla maestra de sustrato en el paso 2. Solicite esto como una modificación en NL2 (como se muestra en la Tabla 1) o use la fosforilación enzimática con la polinucleótido quinasa T4 después de resuspender los oligonucleótidos.
- Incluir la fosforilación 5'-terminal de NL6 y NL8, que comprenden el complemento de las roturas de doble cadena representadas en la Figura 1A (NL6/NL7 y NL8/NL9), ya que es la que más se asemeja al sustrato natural producido a partir de una endonucleasa de restricción. Utilice un sustrato de doble etiqueta para determinar los alcances relativos de la ligadura para ensamblajes de varias partes (consulte el paso 6).
- Alterar la hebra del complemento para producir desajustes (NL10) y espacios (NL11).
NOTA: Las variaciones en el sustrato mellado simple se representan en la Figura 1A. Es posible utilizar otras secuencias para producir una gama aún más amplia de desajustes o espacios más largos variando la posición subrayada. - Oligonucleótidos de ADN sustitutivos de oligonucleótidos de ARN.
NOTA: Las variaciones en el sustrato mellado simple se muestran en la Figura 1B. Se puede generar una gama más amplia de dúplex de ADN/ARN mediante combinaciones adicionales del conjunto de bases que se proporciona aquí para generar, por ejemplo, roturas de doble cadena que contienen ARN y ADN. Un ejemplo de esta variación se da en el paso 6 a continuación, donde se utiliza una estrategia de doble etiqueta.
- Para sustratos de ADN polimerasa: Ensamble los oligonucleótidos NL1 y NL3 enumerados en la Tabla 1 para proporcionar un ensayo simple de extensión de cebador. Investigar aspectos adicionales de la actividad de la polimerasa mediante la introducción de modificaciones en las hebras NL1 (cebador) o NL3 (plantilla).
- Incorporar análogos de bases dañadas en el oligonucleótido NL3 antes de la posición 20 para determinar la capacidad de evitar las lesiones dañadas en la hebra molde.
- Incorpore análogos de base dañados en el oligonucleótido NL1 en la posición 20 para determinar la capacidad de extender un cebador dañado.
- Utilice RNL1 o RNL3 en el dúplex para investigar la extensión de un cebador de ARN o el uso de una plantilla de ARN.
- Para sustratos de nucleasas (Figura 2): Ensamble oligonucleótidos para proporcionar una gama no exhaustiva de sustratos bicatenarios y monocatenarios (Figura 2Ai), así como una gama de uniones aleteadas y separadas (Figura 2Aii) y sustratos dañados (Figura 2B).
- Para sondear las actividades de la ribonucleasa, sustituya iterativamente NL1, NL2 y NL3 por RNL1, RNL2 y RNL3. Utilice versiones adicionales de ARN de HJ5 y HJ6 para ampliar aún más este conjunto.
- Utilice los oligonucleótidos MD5, MD6 y MD9 que tienen una modificación situada en el centro que imita el daño oxidativo, un intermediario de reparación abásico o un producto de desaminación (Figura 2B). Los sustratos detectarán la escisión de la hebra en esta posición. Etiquete la hebra NL3 del complemento con un fluoróforo ortogonal como TAMRA para detectar la escisión de doble hebra (consulte el paso 6).
- Utilice el marcaje ortogonal del complemento para detectar cortes de doble cadena en los sitios no coincidentes en las hebras de la sonda (NL5 y ND9) y del complemento (MD10 y NL10).
- Para sustratos de ADN ligasa (Figura 1): Ensamble el sustrato más simple a partir de tres oligonucleótidos: una hebra donante fosforilada 5' (NL2), una hebra aceptora marcada con FAM 5' (NL1) y un complemento que une las dos (NL3).
- Pida oligonucleótidos sintéticos que incorporen fluoróforos relevantes y otras modificaciones a un proveedor comercial.
NOTA: Una escala de síntesis de 100 nM y la purificación por HPLC posterior a la síntesis son adecuadas para los ensayos descritos.
2. Ensamblaje y recocido de dúplex de ácido nucleico
- Resuspensión y dilución de oligonucleótidos
- Antes de abrir, centrifugar los oligonucleótidos liofilizados en sus tubos de 2 ml a toda velocidad en una centrífuga de sobremesa durante 2-5 minutos para asegurarse de que el ácido nucleico esté en el fondo del tubo.
- Prepare un material maestro de 100 μM resuspendiendo los oligonucleótidos en tampón TE (10 mM de tris(hidroximetil)aminometano (Tris), 1 mM de ácido etilendiaminotetraacético (EDTA)). Asegúrese de que los oligonucleótidos se resuspendan completamente mediante un vórtice suave repetido y una centrifugación breve a toda velocidad.
- Prepare un stock de 10 μM diluyendo una alícuota de material maestro con tampón TE. Diluya el material de 10 μM con agua ultrapura (agua MQ) para preparar material de trabajo con concentraciones de 0,5 μM, 0,7 μM o 2,5 μM según la Tabla 2.
- Montaje y recocido de las mezclas maestras de reacción
- Utilice existencias de trabajo para formar las mezclas maestras de reacción utilizando las combinaciones proporcionadas en la Tabla 2 y los volúmenes indicados en la Tabla 3. Para el ensayo estándar de ADN ligasa y la mayoría de los otros ensayos descritos aquí, la composición final del tampón es 50 mM de Tris pH 8.0, 50 mM de NaCl, 10 mM de ditiotreitol (DTT) con 10 mM de Mg como catión divalente.
- Recocer los oligonucleótidos en un tubo de PCR o microcentrífuga calentándolos a 95 °C durante 5 min utilizando un bloque calefactor o un termociclador. Deje enfriar a temperatura ambiente durante 30 min (volúmenes <1 mL) a 1 h (volúmenes >1 mL). Para oligonucleótidos más largos (>40 nt), realice un enfriamiento más lento utilizando un termociclador con una rampa descendente de 95 °C a 25 °C durante 45 min, o haga flotar el tubo que contiene la mezcla de recocido en un vaso de precipitados de 1 L con agua hirviendo y deje enfriar a temperatura ambiente durante la noche.
- Agregue cofactores de nucleótidos y otros componentes tampón sensibles al calor a la mezcla maestra después de enfriar a temperatura ambiente. Utilice la mezcla de reacción final directamente para el ensayo mediante la adición de enzima (consulte el paso 3 a continuación) o almacene a -20 °C para su uso futuro.
3. Configuración estándar del ensayo
- Montaje e inicio de la reacción del ensayo
- Combine 22,5 μL de la mezcla maestra de sustrato de interés con 2,5 μL de la ADN ligasa u otra enzima de interés en un tubo de PCR. Ejecute reacciones por duplicado o triplicado, especialmente si los resultados se van a cuantificar.
- Incluya un control sin proteínas (solo tampón) en las muestras del ensayo. No incluya controles de cofactor en este punto, si es necesario.
NOTA: Las enzimas pueden almacenarse a -20 °C en glicerol al 50% v/v, lo que permite pipetearlas directamente de la solución. Asegúrese de que las soluciones enzimáticas con glicerol estén bien mezcladas antes de la adición, ya sea pipeteando para mezclar o mediante un vórtice suave.
- Transfiera inmediatamente las reacciones a una máquina de PCR a 25 °C e incube durante 30 min. Variar la temperatura y la duración en función de las condiciones óptimas para la actividad enzimática.
- Apagar las reacciones añadiendo 5 μL de colorante de carga (formamida al 95%, ácido etilendiaminotetraacético (EDTA) 0,5 M, azul de bromofenol) e incubar a 95 °C durante 5 min.
4. Análisis de los resultados de los ensayos
- Prepare los geles de Tris-Borato-EDTA (TBE)-Urea PAGE como se describe a continuación.
- Prepare un caldo de acrilamida al 20%, urea 7 M y 1 solución de TBE. Para el conjunto de oligonucleótidos descrito aquí, utilice la solución de acrilamida/Bis en una proporción de 29:1 para obtener una resolución óptima.
- Para un gel, combine 10 ml de acrilamida al 20% y una solución de urea al 7 M con 100 μl de APS (10 %) y 3 μl de tetrametilendidiamina (TMED) y colóquelo en una fundición de gel.
- Después de que el gel se solidifique, pase las muestras en el gel de urea TBE a 45 - 55 °C.
- Ejecute previamente el gel en 1x tampón TBE durante 30 minutos a 10 mA por gel con calentamiento externo.
- Elimine el exceso de urea en los pocillos del gel enjuagando con 1x TBE con una pipeta de pasto.
- Cargue 10 μL de cada reacción y funcione a 10 mA durante 1,0-1,5 h con calentamiento externo.
- Visualice el gel en el generador de imágenes con la configuración correcta para el fluoróforo elegido. Para FAM, utilice un conjunto de filtros que proporcione excitación/emisión a 495/519 nm, que se almacena como un ajuste preestablecido en la mayoría de los generadores de imágenes.
- Cuantifique la intensidad de la banda del producto y el sustrato utilizando un software de procesamiento de imágenes con el generador de imágenes, o un programa externo como ImageJ49,50 y calcule el porcentaje del producto utilizando la fórmula
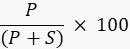
Donde P es el valor integrado de la banda del producto y S es el área integrada de la banda del sustrato. En el caso del ejemplo de la reacción de ADN ligasa, la banda del producto corre a 40 nucleótidos (nt) y la banda del sustrato a 20 nt.
5. Deadenilación de la ADN ligasa para probar la especificidad del cofactor
- Preparación de mezclas maestras de reacción
- Prepare un juego de la mezcla maestra que contenga el oligonucleótido NL1 marcado con FAM, como se describe en la Tabla 4. Prepare un segundo juego que contenga el oligonucleótido NL1 sin marcador FAM, como se describe en la Tabla 4.
- Por separado, caliente ambos dúplex de ADN a 95 °C durante 5 minutos y enfríe de 30 minutos a 1 h a 25 °C. No añada cofactor de nucleótidos a ninguna de las mezclas maestras.
- Montaje e inicio de la reacción de desadenilación
- Prepare una única reacción de desadenilación para cada tipo/concentración de cofactor que se vaya a probar combinando 10 μL de la mezcla maestra no marcada con 2,5 μL de enzima ligasa.
- Prepare tubos adicionales como control sin cofactor y sin control de proteínas (se agregaron 2,5 μL de tampón en lugar de enzima).
- Incubar las reacciones a una temperatura específica para la actividad óptima de la enzima, durante 1-2 h. El tiempo de incubación puede aumentarse si la enzima aún está adenilada.
- Ejecute la reacción de ligadura con el cofactor.
- Añada 10 μL de la mezcla maestra marcada y 2,5 μL de los cofactores de nucleótidos deseados (por ejemplo, ATP, NAD, ADP o GTP) directamente a la reacción desadenilada (concentración final de 0,1-1 mM).
- Añada 2,5 μL de tampón de reacción al control sin cofactor de nucleótidos.
- Incubar las reacciones durante el mismo período de tiempo y temperatura que se utilizaron anteriormente. Apague y visualice como se describe en el paso 4.
6. Uso de sustratos de doble etiqueta para la ligadura entablillada o el ensamblaje de varias piezas
- Diseñar y comprar un oligonucleótido con una fracción fluorescente que tenga un espectro de excitación/emisión diferente al fluoróforo ya utilizado.
- En la configuración descrita aquí, use el oligonucleótido NL2 (TAMRA) que tiene 5-carboxitetrametilrodamina (TAMRA) en el extremo 3' (Tabla 1).
- Ensamble la mezcla maestra como se describe a continuación.
- Combine los componentes de la reacción descrita en el paso 2, incluidas las proporciones equimolares de todos los oligonucleótidos utilizados en el ensamblaje, así como los cationes tampón y divalentes.
- Recocido calentando a 95 °C durante 5 min y enfriando a 25 °C durante 30 min - 1 h. Agregue el cofactor y la enzima e incube como se describe en el paso 3.
- Ejecute y obtenga imágenes de las muestras como se describe en el paso 4 utilizando los canales apropiados para el par de fluoróforos en el sustrato. En el caso de FAM y TAMRA, estos son los canales de fluoresceína (FITC) y tetrametilrodamina (TRITC) presentes en la mayoría de los generadores de imágenes.
7. Evaluación de la unión al ADN mediante el ensayo de cambio de movilidad electroforética (EMSA) en gel nativo
- Prepare un 10% de gel nativo de TBE PAGE como se describe a continuación.
- Combine 2,5 ml de acrilamida al 40 %, 1 ml de 10x TBE, 100 μl de APS al 10 %, 3 μl de TMED y 6,5 ml de agua MQ y colóquelo en una rueda de gel.
- Ensamble la reacción de unión como se describe a continuación.
- Ensamble el sustrato EMSA de acuerdo con la Tabla 5 de modo que se incluya EDTA (10 mM) y se omitan los iones metálicos.
- Combine 20 μL de la mezcla maestra de sustrato de EMSA con 5 μL de la proteína en un tubo de PCR. Incluya una muestra de control sin proteínas. Incubar durante 30 min a 25 °C.
- Analice mediante electroforesis nativa como se describe a continuación.
- Añada 5 μL de colorante de carga nativa 5x (100 mM de EDTA, 0,25 % de azul de bromofenol, 25 % v/v de glicerol y MQ de agua hasta 1 mL) a las muestras.
- Cargue el gel preparado y haga funcionar a 60 V durante 2-3 h con enfriamiento por circulación de agua hasta que el frente del tinte esté unos cm por encima del extremo del gel.
- Visualice y analice los geles como se describe en el paso 4.
Resultados
Ligadura por ADN ligasa
La actividad enzimática de la ADN ligasa dará como resultado un aumento en el tamaño del oligonucleótido marcado con fluorescencia cuando se visualice en un gel de urea PAGE. En el caso de los sustratos para la ligadura de ADN y ARN enumerados en la Tabla 2, esto corresponde a una duplicación de tamaño de 20 nt a 40 nt (Figura 3A). La actividad enzimática óptima puede determinarse cambiando condiciones como la temperatura, la concentración de proteínas o el tiempo de incubación (Figura 3B), cofactores de nucleótidos, cofactores metálicos (Figura 3C). Las actividades relativas de una ligasa en diferentes sustratos se pueden comparar en paralelo (Figura 3D).
La cuantificación de las bandas de producto y sustrato se expresa como el porcentaje del sustrato total ligado y, como se muestra en la Figura 3, se puede utilizar para evaluar la actividad específica de la enzima o para determinar los óptimos de actividad, como la preferencia de cationes divalentes, la temperatura o el pH.
La ADN ligasa bacteriana DV-1-1-Lig (Figura 3) es capaz de ligar sustratos de ADN y puede utilizar tanto magnesio como manganeso para la actividad de ligadura, con preferencia por el magnesio. Enla figura 51 se proporcionan más detalles sobre esta enzima.
Extensión del cebador por ADN polimerasa
La actividad de la ADN polimerasa a través de la extensión del cebador marcado con fluorescencia de 20 nt dará como resultado un aumento de tamaño de hasta 40 nt cuando se utilice el conjunto de oligonucleótidos presentado aquí (Figura 4A). Los productos parcialmente extendidos aparecerán como una escalera de productos hasta el tamaño de la plantilla (Figura 4B y Figura 4C). El ensayo de extensión del cebador representado aquí (Figura 4C) condujo a la síntesis completa de la hebra de cebador.
Degradación por nucleasa
La actividad de la nucleasa da como resultado una reducción en el tamaño del oligonucleótido marcado con fluorescencia cuando se visualiza en un gel de urea PAGE. Las nucleasas con actividad endonucleasa específica pueden dar lugar a un único producto de 20 nt (Figura 5A-C). Las nucleasas con actividad exonucleasa darán lugar a oligonucleótidos marcados con fluorescencia de diferentes tamaños (Figura 5D-F). Aquí, se muestran los resultados de una proteína nucleasa del metagenoma antártico bacteriano, que exhibe actividad endonucleasa específica en el sustrato del sitio abásico bicatenario y actividad exonucleasa no específica en el sustrato monocatenario (Figura 5C y Figura 5F, respectivamente).
Ensayo de uso de codenilación de ligasa y cofactor de nucleótidos
Muchas enzimas ligasa expresadas recombinantemente se purifican en un estado ya adenilado a partir de ATP o NAD eliminado de su huésped 51,52,53,54,55. La eliminación de este intermediario AMP covalente es necesaria para la identificación precisa de la gama de cofactores de nucleótidos que la enzima puede utilizar para la ligadura de sustratos de ácidos nucleicos51. El recambio de la enzima ligasa adenilada con sustrato no marcado en ausencia de un cofactor de nucleótido exógeno agotará el intermediario de adenilación. Mediante el uso de sustratos de ADN marcados con fluorescencia y la adición de cofactor de nucleótidos solo en el segundo paso, cualquier producto de ligadura que sea visible cuando se usa un canal fluorescente (Fluoresceína-FITC) en el generador de imágenes en gel es el resultado de la adenilación con el cofactor de nucleótido agregado en este paso.
Los ensayos de actividad realizados con una ADN ligasa bacteriana expresada en un sistema de E. coli muestran que se purificó en una forma preadenilada y exhibió una capacidad de fondo para ligar el ADN mellado sin cofactor adicional (Figura 6Ai-ii). La adición de ATP a la ligasa adenilada aumenta la cantidad de producto ligado que se forma en la reacción, pero esto no siempre es fiable, ya que esta actividad basal podría dar una impresión incorrecta del uso de cofactores de amplio espectro o adiciones adicionales de cofactores de nucleótidos a una reacción podrían inhibir la ligadura del sustrato. Al incubar primero la ligasa con una versión no marcada del sustrato de ADN mellado, el AMP se invierte y no se observa ninguna ligadura en el sustrato de muesca de ADN marcado a menos que se agregue ATP a la reacción. El segundo ensayo de actividad (Figura 6B) muestra que la ADN ligasa desadenilada ha mejorado la actividad de ligadura en el sustrato de ADN de corte con la adición de ATP y ADP. También hay cierta mejora en la ligadura con la adición de GTP, que es mayor que la ligadura de fondo observada en el control sin cofactor. La ligadura observada en las reacciones con NAD es comparable a la ligadura observada en las reacciones de control sin cofactor, lo que descarta el NAD como cofactor para la ligadura.
Resultados del ensayo de doble marcado
Los fluoróforos ortogonales se pueden utilizar para establecer actividad en diferentes partes de un sustrato complejo. El ejemplo de la Figura 7 muestra la actividad de una ADN ligasa R2D56 recientemente descrita en comparación con la ADN ligasa T4 en un dúplex ADN/ARN entablillado. La ligadura del aceptor de ADN a la sección donante de ARN del sustrato se detectó mediante 6-FAM, mientras que la ligadura del aceptor de ARN a un donante de ADN se detectó con 5-TAMRA (Figura 7A). La extensión relativa de la ligadura del ADN a ambos extremos del sustrato de ARN podría evaluarse mediante la presencia de una banda de producto con fluorescencia en los canales 6-FAM y 5-TAMRA, que aparece como amarilla en la imagen compuesta, mientras que los individuales 6-FAM y 5-TAMRA son verdes y amarillos, respectivamente (Figura 7B). Como se detalló en una publicación anterior56, solo la ligasa R2D fue capaz de ligar el ADN al extremo 5' del ARN, mientras que ambas ligasas fueron capaces de ligar el ADN al extremo 3' del ARN. Al ligar ambas moléculas de ADN al ARN en mezclas de reacción única, la ligasa R2D puede ligar los oligonucleótidos de ADN a ambos extremos del ARN, a medida que una banda se desplaza hacia arriba y se observa un cambio de color a amarillo (Figura 7C).
El segundo ejemplo de la Figura 8 utiliza un enfoque de etiquetado dual para demostrar la ligadura de múltiples oligonucleótidos a diferentes pH. El sustrato, ensamblado a partir de una mezcla de siete oligonucleótidos, se utilizó para mostrar la capacidad de la ligasa R2D para ensamblar fragmentos cortos. La hebra 5' tiene una hebra de 14 nt marcada con fluoróforo FAM, mientras que la hebra del complemento tiene un fluoróforo TAMRA en el extremo 3' del oligonucleótido de 16 nt. El éxito de la ligadura se puede ver por bandas más altas adicionales para el oligonucleótido FAM (verde) y el oligonucleótido TAMRA (rojo). La superposición de ambos fluoróforos da la banda de nucleótidos en amarillo como hebras completamente ligadas del mismo tamaño.
Resultados de la unión al ADN de una enzima ligasa de ADN mediante EMSA
La unión de la enzima ADN ligasa a un ADN mellado fosforilado da como resultado un complejo que funciona a un peso molecular mayor que el oligonucleótido solo (Figura 9A). Aquí, se muestra la unión de una ligasa de ADN bacteriana dependiente de ATP al sustrato de ADN de corte. A altas concentraciones de proteínas, la mayor parte del sustrato de ADN marcado se une y se ve en las bandas de mayor peso molecular; a concentraciones más bajas de proteína, predomina el sustrato de ADN libre (Figura 9B).

Figura 1: Esquemas de los diferentes sustratos de ácidos nucleicos diseñados para probar la actividad enzimática de la ligasa. Las estrellas representan el marcaje con la 6-carboxifluoresceína en el extremo 5' (5' FAM). Las hebras marcadas se indican con una línea negra o azul oscuro/rojo (en el caso de los dúplex de ADN/ARN), mientras que las partes no marcadas de los dúplex de sustrato se indican con una línea gris o azul claro/rojo (en el caso de los dúplex de ADN/ARN). Las hebras etiquetadas son de 20 nt, y si las hebras están ligadas, forman un producto de 40 nt. Los sitios fosforilados 5' se indican con una P en un círculo. Las hebras de oligonucleótidos están marcadas y los nombres se mencionan en la Tabla 1 y la Tabla 2. (A) Diseño de sustratos de ADN bicatenario con diferentes tipos de roturas, utilizados para probar la actividad enzimática de las ligasas de ADN. (B) Diseño de sustratos bicatenarios de ARN y ARN/ADN que incorporan oligonucleótidos de ADN y ARN. Los sustratos contienen un solo sitio de muesca y se utilizan para probar la capacidad de las ligasas para sellar roturas de muescas de dúplex de ARN/ADN. La línea roja representa los oligonucleótidos de ARN y las líneas azules representan los oligonucleótidos de ADN. Haga clic aquí para ver una versión más grande de esta figura.
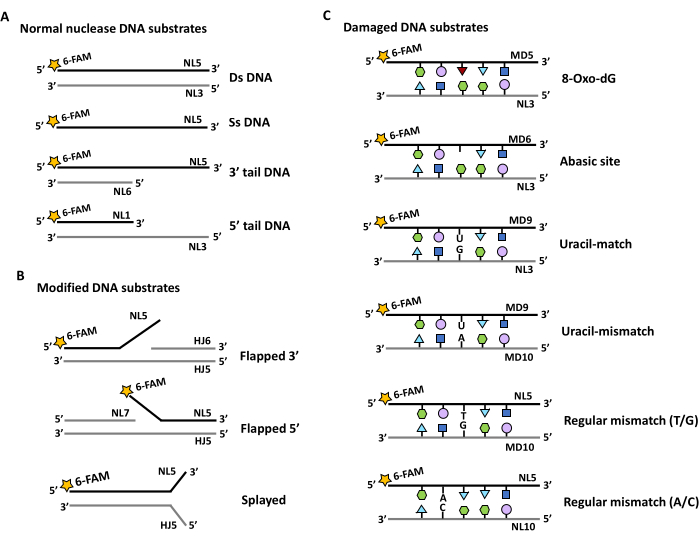
Figura 2: Esquemas de los diferentes sustratos de ácidos nucleicos diseñados para probar la actividad enzimática de la nucleasa. Las estrellas representan el marcaje con la 6-carboxifluoresceína en el terminal 5' (5' FAM). Las hebras etiquetadas se indican con una línea negra, mientras que las partes no etiquetadas de los dúplex de sustrato se indican con una línea gris. Los sitios fosforilados 5' se indican con una P en un círculo. Las hebras de oligonucleótidos están marcadas y los nombres se mencionan en la Tabla 1 y la Tabla 2. (A) Diseño de sustratos con porciones bicadenarias y monocatenarias. (B) El diseño de los sustratos de ADN bicatenario se modifica para generar colgajos monocatenarios en el extremo de 3' o 5' (Flapped 3', flap 5' o flaps en ambos extremos (extendidos)). (C) Diseño de sustratos de doble cadena que incorporen bases dañadas o desajustes en una posición central. Haga clic aquí para ver una versión más grande de esta figura.
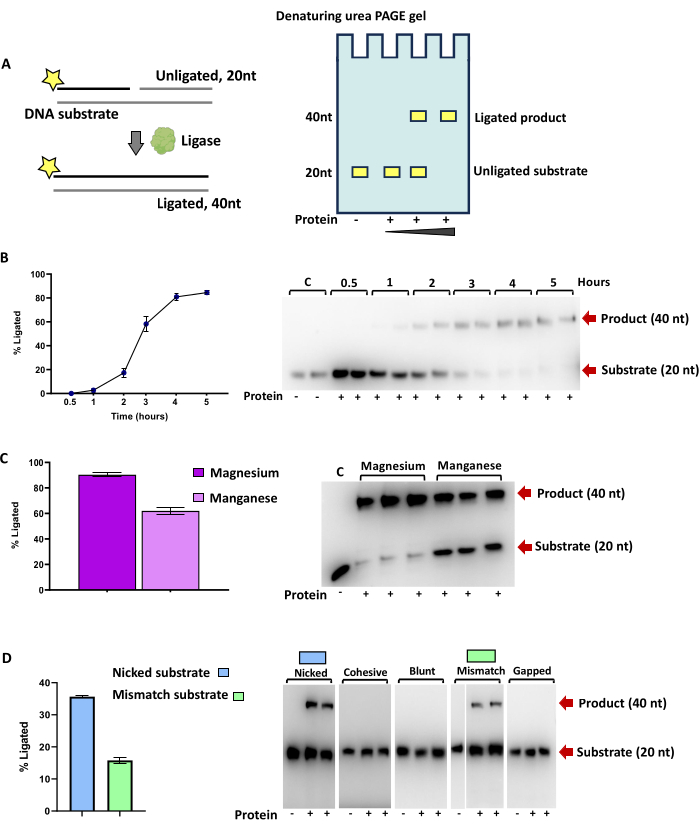
Figura 3: Prueba de la actividad de ligadura de una ligasa de ADN bacteriana dependiente de ATP DV-1-1-Lig. (A) Esquema de los ensayos enzimáticos para la actividad de la ligasa en sustratos de ADN con resultados analizados en un gel de urea TBE PAGE. Las estrellas representan el marcaje con la 6-carboxifluoresceína en el terminal 5' (5' FAM). Las hebras etiquetadas se indican con una línea negra, mientras que las partes no etiquetadas de los dúplex de sustrato que no son visibles durante el análisis se indican con líneas grises. (B) Cuantificación de la ligadura por DV-1-1-Lig en ADN mellado en diferentes puntos temporales. La actividad contra cada sustrato se llevó a cabo por duplicado. Las reacciones se incubaron durante diferentes períodos de tiempo (0,5 h, 1 h, 2 h, 3 h y 4 h) a 25 °C, con una concentración final de proteína de 4 μM, una concentración final de ATP de 1 mM y una concentración final de iones de magnesio de 10 mM. (C) Ligadura de sustrato de ADN mellado con magnesio (Mg) o manganeso (Mn). Las reacciones se llevaron a cabo durante 3 h, a 25 °C, con una concentración final de ATP de 1 mM y una concentración final de iones metálicos de 10 mM. (D) Resultados de la ligadura en diferentes sustratos de ADN. Las reacciones se llevaron a cabo durante 8 h, a 20 °C, con una concentración final de proteína de 2 μM, una concentración final de ATP de 10 mM y una concentración final de magnesio de 10 mM. La adición de proteínas a la reacción se indica mediante un símbolo más (+). Las reacciones de control se indican con C, y la ausencia de proteína contenida se indica con un símbolo menos (-). El producto (40 nt) y el sustrato (20 nt) se indican con flechas rojas. Los resultados de los ensayos de actividad se visualizaron utilizando un sistema de imagen. Las bandas se cuantificaron mediante la integración de la intensidad utilizando el software ImageJ49 y los gráficos se generaron utilizando un software de graficación. Haga clic aquí para ver una versión más grande de esta figura.
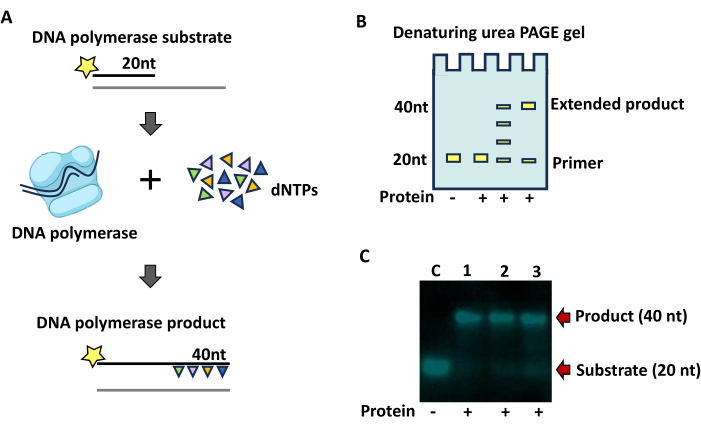
Figura 4: Ensayo de ADN polimerasa. (A) Esquema del ensayo de extensión del cebador en un sustrato de ADN. Las estrellas representan el marcaje con la 6-carboxifluoresceína en el terminal 5' (5' FAM). Las hebras etiquetadas se indican con una línea negra, mientras que las partes no etiquetadas de los dúplex de sustrato que no son visibles durante el análisis se indican con líneas grises. (B) Esquema de los resultados anticipados de un gel de urea PAGE TBE que muestra un aumento en la longitud del cebador marcado con la adición de nucleótidos. (C) Ejemplo de extensión de cebador con enzima ADN polimerasa de fragmento de E . coli Klenow. La adición de proteínas a la reacción se indica mediante un símbolo más (+). Carril 1, 12.5 U; Carril 2, 2.5 U; Carril 3, 1.25U. Las reacciones de control se indican con una C, y la ausencia de proteína contenida se indica con un símbolo menos (-). Las reacciones se llevaron a cabo durante 15 min a 25 °C y contenían 5 mM de MgCl2, 50 mM de Tris pH 8.0, 50 mM de NaCl2, 1 mM de DTT y 0.25 mM de dNTPs. El producto (40 nt) y el sustrato (20 nt) se indican con flechas rojas. Los resultados de los ensayos de actividad se visualizaron utilizando un sistema de imagen. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Actividad de prueba de una nucleasa del metagenoma antártico bacteriano utilizando diferentes sustratos, metales y temperaturas de incubación. (A) Actividad endonucleasa específica del esquema de una proteína nucleasa en el sustrato del sitio abásico (indicado por una x). Las estrellas representan el marcaje con la 6-carboxifluoresceína en el terminal 5' (5' FAM). Las líneas negras representan las hebras etiquetadas y las líneas grises representan las hebras de ADN sin etiquetar. El corte específico de la nucleasa se muestra en el lado derecho del sitio abásico, pero también puede ocurrir en el lado izquierdo. (B) Esquema de un gel PAGE de urea desnaturalizante que muestra el sustrato sin cortar (40 nt) en ausencia de proteína indicado por un símbolo menos (-) y el producto cortado (20 nt), en presencia de una nucleasa indicada por un símbolo más (+). (C) Un ejemplo de un gel de urea TBE PAGE que muestra resultados de la actividad de la endonucleasa específica en un sustrato de ADN de doble cadena con un sitio abásico. El ensayo se llevó a cabo con una concentración de proteína de 1,0 μM y 1 mM de MgCl2. Se llevaron a cabo dos reacciones control a 20 °C, una sin proteína (pocillo 1) y otra sin metal (pocillo 2). Las reacciones se incubaron durante 5 h a temperaturas crecientes de 1 °C a 50 °C, como se indica arriba en la imagen del gel. La adición de la proteína se indica con un símbolo más (+) y la ausencia de la proteína se indica con un símbolo menos (-). El sustrato y el producto se indican con flechas rojas. (D) Esquema que muestra la actividad exonucleasa no específica de una proteína nucleasa en un sustrato monocatenario. Las estrellas representan el marcaje con la 6-carboxifluoresceína en el extremo 5' (5'FAM). Las líneas negras representan las hebras etiquetadas. El corte inespecífico de la nucleasa da como resultado hebras marcadas de diferentes longitudes (<39 nt). (E) Esquema que representa un gel PAGE de urea desnaturalizante que muestra sustrato sin cortar (40 nt), donde no se agregó ninguna proteína (-), y que muestra sustrato cortado de longitudes variables, donde se agregó la proteína (+) que puede resultar de la actividad de una exonucleasa no específica. (F) Los geles de urea TBE PAGE muestran un ejemplo de actividad exonucleasa no específica de la misma nucleasa del metagenoma antártico con un sustrato monocatenario. El ensayo se llevó a cabo a 20 °C durante 4 h con proteína a una concentración final de 1,5 μM y una concentración final del ion metálico a 10 mM. El ion metálico utilizado se indica encima de la imagen. La adición de la proteína se indica con un símbolo más (+) y la ausencia de la proteína se indica con un símbolo menos (-). El sustrato (40 nt) se indica con la flecha roja, y los productos de diferentes longitudes se indican con la abrazadera roja. Los resultados de todas las reacciones de nucleasa se visualizaron utilizando un sistema de imágenes. Haga clic aquí para ver una versión más grande de esta figura.
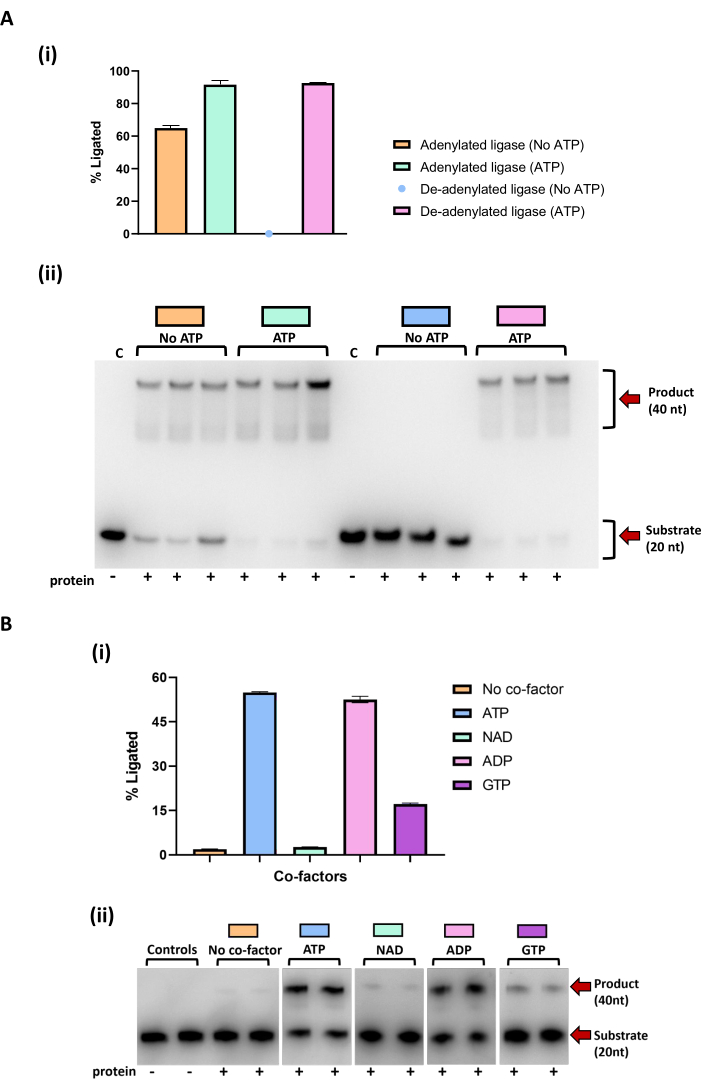
Figura 6: Resultados de la ligadura de sustrato de ADN mellado por versiones adeniladas y deadeniladas de una ADN ligasa bacteriana. (A) i) Cuantificación de la ligadura por enzima ligasa adenilada y desadenilada, con y sin ATP. Los puntos en el gráfico representan promedios de cada reacción replicada. Se incluyen barras de error estándar. ii) Gel de urea PAGE TBE que muestra los resultados de la ligadura en sustrato de ADN de corte por enzima ligasa adenilada y desadenilada, con y sin ATP. Las reacciones se realizaron por triplicado. La enzima desadenilada se preincubó durante 2 h a 25 °C con sustrato de ADN de níquel sin marcar y enzima de 0,1 μM, seguido de una incubación de 1 h con sustrato de ADN de níquel marcado. La enzima adenilada no se preincubó con el sustrato no marcado. Se añadió ATP (1 mM) a las reacciones junto con la adición de sustrato de ADN marcado. (B) i) Cuantificación de la ligadura por la ligasa desadenilada en el ADN de nick con diferentes cofactores (ATP, NAD, ADP y GTP). Los puntos en el gráfico representan promedios de cada concentración. Se incluyen barras de error de desviación estándar. ii) TBE urea PAGE que muestra los resultados de la ligasa por la ligasa, con y sin la adición de diferentes cofactores. La actividad contra cada sustrato se llevó a cabo por duplicado. Las reacciones se preincubaron durante 2 h a 25 °C con sustrato de ADN mellado sin marcar, 4 μM de proteína y 5 mM de iones de magnesio, seguido de una incubación de 4 h con la adición de sustrato de ADN mellado marcado, 5 mM de magnesio y diferentes cofactores a una concentración final de 1 mM. La adición de proteínas a la reacción se indica mediante un símbolo más (+). Se utilizaron reacciones de control que no contenían proteína (Controles, C) ni cofactor (No cofactor). El producto (40 nt) y el sustrato (20 nt) se indican con flechas rojas. Los resultados de los ensayos de actividad se visualizaron utilizando un sistema de imagen. Las bandas se cuantificaron mediante la integración de la intensidad mediante el software ImageJ49. Los gráficos se generaron utilizando un software de gráficos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Ligadura de oligonucleótidos cortos de ADN marcados con fluorescencia a cada extremo de un oligonucleótido de ARN fosforilado 5', posicionados por plantillas de ADN. (A) Esquema de la ligadura de ADN-ARN entablillada con ADN que muestra cómo se pueden visualizar los posibles productos de ligadura utilizando una estrategia de doble marcaje. (B) Esquema de los posibles productos que se espera ver en un gel de Urea-PAGE fotografiado en dos canales. (C) Resultados experimentales de la ligadura dual de fluoróforos. Las reacciones de ligadura se probaron utilizando ADN ligasa T4 y ligasa R2D, tanto en reacciones aisladas en las que el ADN se ligó al extremo 5' (carril 2-4) o al extremo 3' (carril 5-7) del ARN, o en una sola reacción en la que ambos oligonucleótidos de ADN se ligaron en la misma mezcla de reacción (carril 8-10). Ningún control de proteínas (NPC) no tenía ninguna enzima añadida. Las condiciones de reacción y los oligonucleótidos específicos utilizados en este ejemplo son los mismos que se dan en56. Haga clic aquí para ver una versión más grande de esta figura.
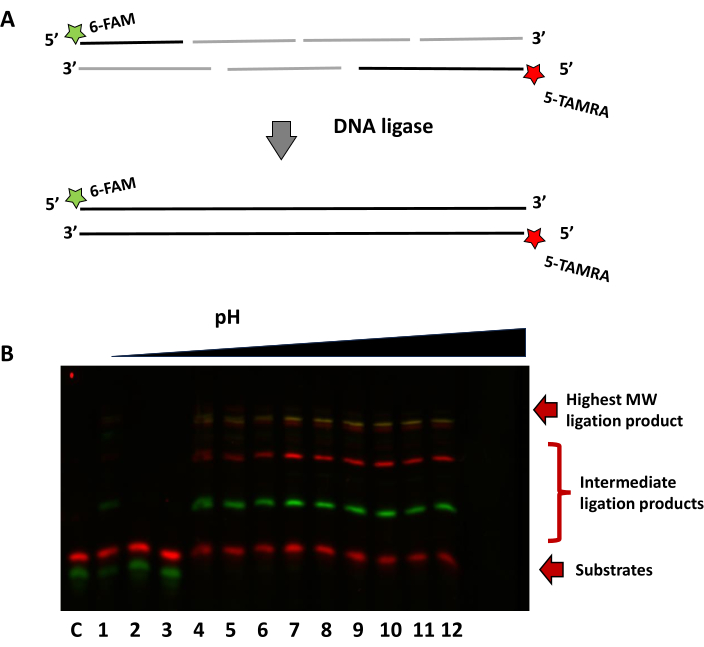
Figura 8: Ligadura de múltiples segmentos cortos de oligonucleótidos con tres variantes de R2D a diferente pH. (A) Esquema de la estrategia de ligadura multiparte. (B) Gel representativo que muestra la dependencia del pH de un ensamblaje de varias piezas, fotografiado con canales FAM y TAMRA. Carril C sin control enzimático, Carriles 1-3 pH 6.0, Carril 4-6 pH 6.5, Carril 7-9 pH 7 y Carril 10-12 pH 7.5. Haga clic aquí para ver una versión más grande de esta figura.
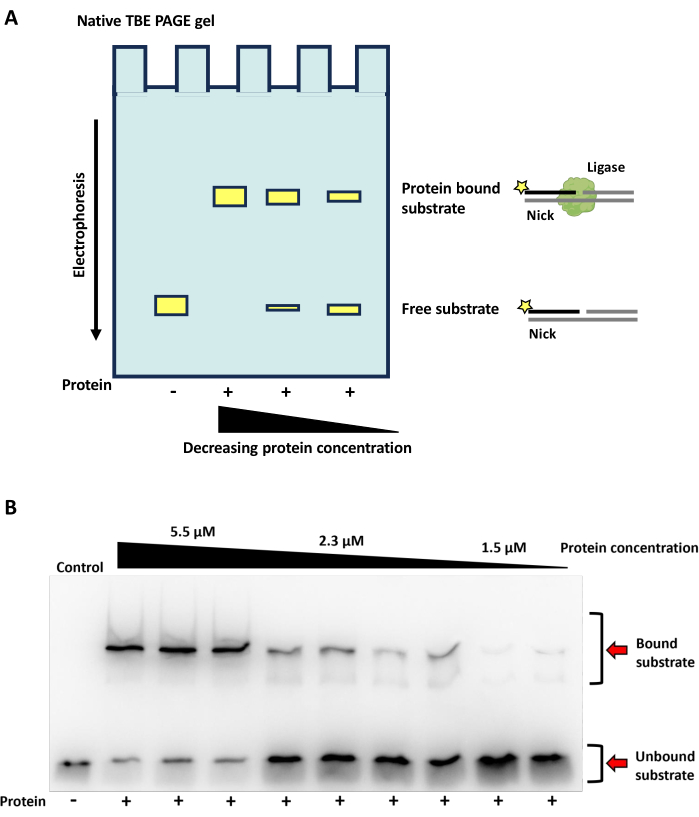
Figura 9: Resultados de la EMSA. Gel esquemático y nativo de TBE PAGE de un ensayo de cambio de movilidad electroforética (EMSA) que visualiza la actividad de unión de una ligasa de ADN dependiente de ATP (obtenida de datos del metagenoma de los valles secos deMc Murdo, Antártida) sobre un sustrato de ADN. (A) Esquema de la actividad de unión de EMSAs/ADN por una ligasa de ADN sobre un sustrato de ADN de corte. Los resultados de la unión se visualizan en un gel TBE PAGE no desnaturalizante. Los sustratos de ADN unidos a la enzima ligasa migran más lentamente a través del gel, mientras que los sustratos sin enzimas migran más rápido, lo que resulta en un cambio en el tamaño de la banda (cuadros amarillos) visualizados en el gel. A medida que los sustratos se visualizan en un gel no desnaturalizante, los oligonucleótidos permanecerán recocidos, lo que permitirá que la hebra marcada con FAM (estrella amarilla) esté presente tanto en sustratos libres como unidos. Se puede utilizar un gradiente de concentración de proteínas para determinar la concentración de proteínas para una unión óptima. (B) Visualización de una EMSA en un gel nativo de TBE PAGE, que muestra la capacidad de unión de una ADN ligasa dependiente de ATP a un sustrato de ADN de corte a diferentes concentraciones de proteínas. La enzima se incubó con sustrato de ADN mellado durante 30 min a 25 °C, con una concentración final de ATP de 1 mM y 40 mM de EDTA. Se utilizaron tres concentraciones de proteínas diferentes (5,5 μM, 2,3 μM y 1,5 μM). Las reacciones se ejecutaron en un gel TBE nativo al 10 %, con colorante de carga nativo en las reacciones. Las muestras que contenían proteínas se procesaron por triplicados para diferentes concentraciones de proteínas. Los carriles de control contienen sustrato de ADN mellado con 1 mM, ATP final y EDTA, pero no proteína. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Secuencias de oligonucleótidos de sustrato de ADN utilizadas para construir sustratos de ensayo. Los daños se indican en negrita y subrayados. Se subrayan las posiciones de desajustes y huecos en el dúplex final. Abreviaturas: 5' 6-carboxifluorescien (5' FAM), 8-Oxo-desoxiguanosina (8OxodG), tetrohidrofurano abásico (dSpacer). Haga clic aquí para descargar esta tabla.
Tabla 2: Combinaciones de oligonucleótidos utilizados para ensamblar mezclas maestras para diferentes ensayos enzimáticos. Haga clic aquí para descargar esta tabla.
Tabla 3: Configuración de mezclas maestras de ensayo con hasta cuatro oligonucleótidos. Consulte la Tabla 2 para conocer las combinaciones de oligonucleótidos que se deben utilizar para diferentes sustratos de ensayo y el texto para obtener detalles de las condiciones de reacción. Como mínimo, se requiere un oligonucleótido marcado: las porciones adicionales del dúplex se indican entre paréntesis. Haga clic aquí para descargar esta tabla.
Tabla 4: Componentes de una mezcla maestra etiquetada y no etiquetada para la fabricación de dúplex de ADN de corte. Haga clic aquí para descargar esta tabla.
Tabla 5: Configuración de las mezclas maestras de EMSA para diferentes combinaciones de dúplex. Consulte la Tabla 3 para conocer las combinaciones de oligonucleótidos que se deben utilizar para diferentes sustratos de EMSA y el texto para obtener detalles de las condiciones de reacción. Los sustratos de EMSA se diseñan utilizando los mismos oligonucleótidos que los de los ensayos de actividad. Haga clic aquí para descargar esta tabla.
Discusión
Pasos críticos en el protocolo
Diseño y compra de oligonucleótidos: Al comprar los oligonucleótidos para la formación de dúplex, es esencial considerar el diseño de secuencias. Se recomienda utilizar una herramienta de análisis de oligonucleótidos para predecir las propiedades de la secuencia de nucleótidos, como el contenido de GC, la temperatura de fusión, la estructura secundaria y el potencial de dimerización, antes de realizar el pedido57.
Ensamblaje y recocido de dúplex de ácidos nucleicos: Al preparar dúplex de ARN/ARN-ADN, se debe tener cuidado de prevenir la contaminación por ARNasa mediante el uso de reactivos y agua que estén libres de ARNasa o la adición de un inhibidor de ARNasa (siempre que la enzima bajo investigación no sea en sí misma una ARNasa). El equipo, los guantes y el espacio del banco deben tratarse con una solución de descontaminación de RNasa antes de ensamblar las mezclas maestras para evitar la degradación de los oligonucleótidos58. Las existencias maestras de los oligonucleótidos de ARN pueden formarse en lotes más pequeños en caso de contaminación.
Las ligasas de ADN siempre requieren un cofactor de nucleótidos, ya sea ATP o NAD, a una concentración final entre 0,1 y 1 mM. Las ADN polimerasas requieren dNTP para la síntesis de hebras, y estas generalmente se agregan en proporciones equimolares a 50 μM de cada una. Al preparar mezclas maestras para dúplex de ligasa y polimerasa, los cofactores de nucleótidos, como ATP, NAD y dNTP, deben agregarse a la mezcla maestra después de que la mezcla se haya calentado y enfriado a temperatura ambiente, ya que son sensibles al calor.
El tampón 10x para el recocido de los oligonucleótidos requiere la adición de DTT, que tiene una vida media corta e idealmente debe prepararse fresco o congelado antes de su uso. Las alícuotas más pequeñas del tampón 10x se pueden preparar con anticipación y almacenar a 4 °C, con la adición de TDT antes de su uso.
Las existencias de oligonucleótidos y las mezclas maestras deben almacenarse a -20 °C para su uso a largo plazo, y los oligonucleótidos o mezclas marcados con fluorescencia deben envolverse en papel de aluminio para evitar el fotoblanqueo del fluoróforo. Para evitar ciclos repetidos de congelación-descongelación que pueden comprometer la integridad de los oligonucleótidos, es aconsejable preparar y utilizar volúmenes más pequeños (>1 mL).
Configuración del ensayo y análisis de los resultados: La inclusión de controles es esencial para la correcta interpretación de los resultados del ensayo. Se debe utilizar un control sin proteínas (sustrato de ADN con solución tampón) para garantizar que la actividad aparente sobre el sustrato sea el resultado de la enzima. En el caso de la nucleasa, la degradación del sustrato exógeno causará bandas de bajo peso molecular o escalonamiento en el control, mientras que en el caso de la ligasa o la polimerasa, la desnaturalización dúplex incompleta dará como resultado una banda de alto peso molecular en el control. En la Tabla 2 se proporciona un control positivo del tamaño del producto esperado y debe incluirse para verificar el tamaño correcto del producto.
Los parámetros importantes para el éxito de la electroforesis del producto del ensayo se han descrito en un protocolo anterior59. Estos incluyen garantizar que el porcentaje de acrilamida sea apropiado para el tamaño del sustrato y el uso de un tinte de carga adecuado según el tamaño del sustrato y el tipo de gel requerido para la visualización de los resultados. El colorante de seguimiento azul de bromofenol tiene el tamaño aproximado de un oligonucleótido de base 10 y, por lo tanto, es adecuado para el conjunto de oligonucleótidos descrito aquí; Sin embargo, si hay una banda de colorante que se superpone con el producto fluorescente o las bandas del sustrato cuando se utilizan nucleótidos más cortos, el colorante de seguimiento puede cambiarse por xilencianol, que corre más lentamente60.
Para garantizar una buena resolución de las bandas de sustrato/producto, el tanque de gel debe calentarse externamente mediante un baño de agua o mediante un alto voltaje (por ejemplo, 180 V). Es esencial hacer funcionar previamente los geles PAGE de urea durante al menos 30 minutos y lavar los pocillos con una pipeta para eliminar el exceso de urea para obtener bandas afiladas y rectas adecuadas para la cuantificación.
Para la cuantificación de sustratos y productos, un rango de 20% a 80% del material total debe convertirse en producto para permitir una integración precisa de las bandas de gel fluorescente. Si se ensaya una nueva enzima, se recomienda ejecutar un gradiente de concentraciones de proteínas para permitir que se realicen mediciones posteriores en este rango. Muchos generadores de imágenes de fluorescencia tienen características de integración de banda incorporadas que se pueden utilizar para este propósito. Si utiliza un programa externo como ImageJ49, asegúrese de que la imagen de gel se exporte en alta calidad en formato tiff.
Modificaciones y solución de problemas de la técnica
Diseño y compra de oligonucleótidos: Los oligonucleótidos proporcionados en este protocolo son puntos de partida útiles y pueden ampliarse, como se sugiere en la sección de métodos, alterando las secuencias de oligonucleótidos e incorporando modificaciones.
Configuración de ensayos estándar y análisis de resultados: Los experimentos piloto son esenciales cuando se prueba la actividad de una nueva enzima, ya que las condiciones óptimas de reacción variarán entre las diferentes proteínas; Los parámetros indicados en este protocolo son solo un punto de partida. Factores como la concentración de enzimas, la temperatura de reacción, la duración de la incubación, el cofactor y la composición del tampón/pH pueden variar durante el ensamblaje de la mezcla maestra y la reacción del ensayo. Las concentraciones de cofactores son especialmente importantes, ya que un exceso de cofactores de nucleótidos o iones metálicos puede ser inhibidor, y es aconsejable probar un rango de concentraciones de cada uno. Para las ADN polimerasas, las concentraciones recomendadas de dNTP oscilan entre 20 y 200 μM en total, sin embargo, las concentraciones altas de dNTP disminuyen la fidelidad61. Del mismo modo, las ligasas de polinucleótidos se analizan típicamente con un cofactor de nucleótidos de 0,1-1,0 mM, pero las concentraciones excesivas hacen que el ADN acumulado se adenilate y la inhibición de la reacción62.
El protocolo estándar aquí utiliza Mg como catión divalente; sin embargo, algunas enzimas son más activas con el manganeso (Mn) o el zinc (Zn). Las mezclas maestras que contengan Mn o Zn deben prepararse con un tampón de pH más bajo (<7.5), y los metales deben agregarse después del calentamiento. Las mezclas maestras deben usarse el mismo día para evitar la precipitación y la inhibición de la actividad enzimática.
Los aditivos, incluyendo agentes de aglomeración como el polietilenglicol (PEG) o estabilizantes como la albúmina sérica bovina, pueden utilizarse para aumentar la actividad de algunas enzimas63,64. Estos deben agregarse después del paso de recocido debido a su termolabilidad. Todos los reactivos de origen biológico deben ser de grado de biología molecular para evitar la introducción de nucleasas contaminantes.
El volumen de tampón de enfriamiento de formamida utilizado en este protocolo es adecuado para el conjunto básico de oligonucleótidos. Sin embargo, para oligonucleótidos más largos, el volumen de formamida debe aumentarse entre 10 μL y 20 μL para garantizar la separación completa de la hebra, y las reacciones templadas pueden enfriarse rápidamente en hielo y almacenarse a 4 °C hasta la electroforesis.
Con algunas enzimas, la unión estrecha de la proteína al sustrato/producto puede impedir la migración de los oligonucleótidos al gel durante la electroforesis, especialmente cuando la enzima se usa en altas concentraciones. Esto aparecerá como una falta de bandas de producto/sustrato en el gel y, a menudo, una acumulación de material fluorescente (producto y/o sustrato complejado con proteína) en los pocillos. Para interrumpir estos complejos, la mezcla de ensayo se puede tratar con proteinasa K antes de la adición de tampón de enfriamiento, o se puede agregar dodecil sulfato de sodio (SDS) durante el enfriamiento.
La actividad de la ADN ligasa produce dos bandas discretas, que son fáciles de cuantificar. Es posible utilizar el mismo método para cuantificar la actividad de la endonucleasa en el sustrato de daño del ADN, donde se anticipa un solo producto de 20 nucleótidos, o ensayos EMSA donde los estados unidos/no unidos se distinguen claramente. La cuantificación precisa de la actividad de la polimerasa y la nucleasa procesiva es difícil mediante la integración de bandas y, en general, se recomienda utilizar ensayos en tiempo real con sondas o balizas, como se describe en la introducción.
Deadenilación y especificidad del cofactor de la ADN ligasa: Es posible que se requiera cierta optimización de este protocolo para eliminar toda la actividad de fondo, que luego se restaurará mediante la adición de los cofactores de nucleótidos. Si la actividad de la ligasa de fondo permanece después de la desadenilación (observada como ligadura en el control sin cofactor), se puede aumentar el tiempo de incubación de la etapa de desadenilación o disminuir la concentración de ligasa. Asegúrese de que el dúplex de nick de ADN sin etiqueta esté más concentrado que la proteína (> 4:1::sustrato: proteína). Si la adición de un cofactor en presencia de ADN marcado no restaura la ligadura de ninguno de los cofactores probados, es posible que la enzima se haya desnaturalizado y el paso de desadenilación deba acortarse. Para una nueva ligasa o un nuevo lote de enzima recombinante, es útil determinar el grado de ligadura de fondo con la enzima adenilada en ausencia de cofactores de nucleótidos adicionales. Esto implica establecer otra reacción en la que se incuban simultáneamente 10 μL de mezcla maestra sin marcar, 10 μL de mezcla maestra marcada y 2,5 μL de una enzima fresca que no ha sido desadenilada.
Utilice sustratos de doble etiqueta: Este protocolo requiere el diseño y la compra de un oligonucleótido con una fracción fluorescente que tiene un espectro de excitación/emisión diferente al fluoróforo utilizado originalmente y luego el ensamblaje de este en un dúplex para que los dos fluoróforos ortogonales etiqueten diferentes porciones del sustrato. En caso de duda, hay disponibles varios visores espectrales en línea para comprobar los espectros de excitación y emisión, por ejemplo, FPbase Spectra Viewer y BD Spectrum Viewer, que pueden utilizarse para comprobar tanto la compatibilidad del par de fluoróforos como los ajustes más adecuados del generador de imágenes. Los ajustes específicos utilizados para visualizar el gel dependerán del modelo del generador de imágenes y de los fluoróforos utilizados. La imagen compuesta registrará la señal de ambos canales en el gel único, y la banda donde ambos fluoróforos están unidos al mismo producto se mostrará como un color intermedio. Se pueden analizar imágenes separadas de canales individuales para cuantificar el grado de ligadura o degradación en hebras marcadas diferencialmente.
Limitaciones de la técnica
Si bien trabajar con sustratos marcados con fluorescencia tiene muchas ventajas, como bajos riesgos para la salud, existen algunas limitaciones que se deben considerar cuando se trabaja con este tipo de sustratos marcados. Uno de ellos es el costo relativamente alto de pedir estos oligonucleótidos con marcadores de fluoróforos o modificaciones, como la adición de bases dañadas, en comparación con el radiomarcaje interno. Otra es que se requieren equipos y software especializados en imágenes para la detección de hebras marcadas. Sin embargo, estas características ahora se incluyen en la mayoría de los nuevos sistemas de imágenes en gel. También se debe considerar el potencial de los fluoróforos para alterar las propiedades de unión de las proteínas de interacción objetivo. La fluoresceína y su derivado FAM se usan comúnmente para marcar oligonucleótidos y son sensibles a los cambios en el pH y la extinción de nucleobases65. Estas limitaciones deben considerarse cuidadosamente al decidir el tipo y la ubicación de los fluoróforos en el oligonucleótido para el diseño dúplex.
Divulgaciones
SEG y UR son empleados de ArcticZymes Technologies AS, que distribuye la ligasa R2D. AW, ER-S y RS no tienen intereses contrapuestos.
Agradecimientos
AW cuenta con el apoyo de una beca Rutherford Discovery (20-UOW-004). RS es el beneficiario de una beca postantártica de Nueva Zelanda. SG y UR agradecen al Instituto de Química de la Universidad de Tromsø - la Universidad Ártica Noruega por su apoyo técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| 30% Acrylamide/Bis Solution (29:1) | BioRad | 1610156 | |
| Adenosine triphosphate (ATP) | Many suppliers | ||
| Ammonium persulfate (APS) | Many suppliers | ||
| Benchtop centrifuge | Many suppliers | ||
| Borate | Many suppliers | ||
| Bromophenol blue | Many suppliers | ||
| Dithiothreitol (DTT) | Many suppliers | ||
| Electrophoresis system with circulating water bath | Many suppliers | ||
| Ethylenediaminetetraacetic acid (EDTA) | Many suppliers | ||
| Fluoresnence imager, e.g. iBright FL1000 | Thermo Fisher Scientific | A32752 | |
| Formamide | Many suppliers | ||
| Gel casting system | Many suppliers | ||
| Heating block | Many suppliers | ||
| Magnesium Chloride | Many suppliers | Other metal ions may be preferred depending on the protein studied | |
| Microcentrifuge tubes (1.5 mL) | Many suppliers | ||
| Micropipettes and tips | Many suppliers | 1 mL, 0.2 mL, 0.02 mL, 0.002 mL | |
| Nicotinamide adenine dinucleotide (NAD+) | Many suppliers | ||
| Oligonucleotides | Integrated DNA Technologies | NA | Thermo Fisher, Sigma-Aldrich, Genscript and others also supply these |
| pasture pipette | Many suppliers | ||
| PCR thermocycler | Many suppliers | ||
| PCR tubes | Many suppliers | ||
| RNAse away | ThermoFisher | 7002PK | Only needed when working with RNA oligos |
| RNase AWAY | Merck | 83931-250ML | Surfactant for removal of RNAse contamination on surfaces |
| RNAse-free water | New England Biolabs | B1500L | Only needed when working with RNA oligos |
| Sodium Chloride | Many suppliers | ||
| SUPERase IN RNase inhibitor | Thermo Fisher Scientific | AM2694 | Broad spectrum RNAse inhibitir (protein-based) |
| SYBR Gold | Thermo Fisher Scientific | S11494 | This may be used to post-stain gels and visualise unlabelled oligonucleotides |
| Tetramethylethylenediamine (TMED) | Many suppliers | ||
| Tris, or tris(hydroxymethyl)aminomethane | Many suppliers | ||
| Ultrapure water (Milli-Q) | Merck | ||
| urea | Many suppliers | ||
| Vortex | Many suppliers |
Referencias
- Gao, Y., et al. Structures and operating principles of the replisome. Science. 363 (6429), 7003 (2019).
- Yang, W., Gao, Y. Translesion and repair DNA polymerases: Diverse structure and mechanism. Annu Rev Biochem. 87, 239-261 (2018).
- Lohman, T. M., Fazio, N. T. How does a helicase unwind DNA? Insights from RecBCD Helicase. Bioessays. 40 (6), e1800009 (2018).
- Ahdash, Z., et al. Mechanistic insight into the assembly of the HerA-NurA helicase-nuclease DNA end resection complex. Nucleic Acids Res. 45 (20), 12025-12038 (2017).
- Wozniak, K. J., Simmons, L. A. Bacterial DNA excision repair pathways. Nat Rev Microbiol. 20 (8), 465-477 (2022).
- Zhang, L., Jiang, D., Wu, M., Yang, Z., Oger, P. M. New insights into DNA repair revealed by NucS endonucleases from hyperthermophilic Archaea. Front Microbiol. 11, 1263 (2020).
- Saathoff, J. H., Kashammer, L., Lammens, K., Byrne, R. T., Hopfner, K. P. The bacterial Mre11-Rad50 homolog SbcCD cleaves opposing strands of DNA by two chemically distinct nuclease reactions. Nucleic Acids Res. 46 (21), 11303-11314 (2018).
- Williamson, A., Leiros, H. S. Structural insight into DNA joining: from conserved mechanisms to diverse scaffolds. Nucleic Acids Res. 48 (15), 8225-8242 (2020).
- Caglayan, M. Interplay between DNA polymerases and DNA ligases: Influence on substrate channeling and the fidelity of DNA ligation. J Mol Biol. 431 (11), 2068-2081 (2019).
- Shuman, S. DNA ligases: Progress and prospects. J Biol Chem. 284 (26), 17365-17369 (2009).
- Lohman, G. J., Tabor, S., Nichols, N. M. DNA ligases. Curr Prot Mol Biol. , (2011).
- Rittié, L., Perbal, B. Enzymes used in molecular biology: a useful guide. J Cell Commun Signal. 2 (1-2), 25-45 (2008).
- Chandrasegaran, S., Carroll, D. Origins of programmable nucleases for genome engineering. J Mol Biol. 428 (5), 963-989 (2016).
- Aschenbrenner, J., Marx, A. DNA polymerases and biotechnological applications. Curr Opin Biotechnol. 48, 187-195 (2017).
- Loenen, W. A. M., Dryden, D. T. F., Raleigh, E. A., Wilson, G. G., Murray, N. E. Highlights of the DNA cutters: a short history of the restriction enzymes. Nucleic Acids Res. 42 (1), 3-19 (2013).
- Voytas, D., Ke, N. Detection and quantitation of radiolabeled proteins and DNA in gels and blots. Curr Protoc Immunol. , (2002).
- Phillips, D. H. Detection of DNA modifications by the 32P-postlabelling assay. Mutat Res. 378 (1-2), 1-12 (1997).
- Huang, C., Yu, Y. T. Synthesis and labeling of RNA in vitro. Curr Prot Mol Biol. , (2013).
- Ballal, R., Cheema, A., Ahmad, W., Rosen, E. M., Saha, T. Fluorescent oligonucleotides can serve as suitable alternatives to radiolabeled oligonucleotides. J Biomol Tech. 20 (4), 190-194 (2009).
- Anderson, B. J., Larkin, C., Guja, K., Schildbach, J. F. Using fluorophore-labeled oligonucleotides to measure affinities of protein-DNA interactions. Meth Enzymol. 450, 253-272 (2008).
- Liu, W., et al. Establishment of an accurate and fast detection method using molecular beacons in loop-mediated isothermal amplification assay. Sci Rep. 7 (1), 40125 (2017).
- Ma, C., et al. Simultaneous detection of kinase and phosphatase activities of polynucleotide kinase using molecular beacon probes. Anal Biochem. 443 (2), 166-168 (2013).
- Li, J., Cao, Z. C., Tang, Z., Wang, K., Tan, W. Molecular beacons for protein-DNA interaction studies. Meth Mol Biol. 429, 209-224 (2008).
- Yang, C. J., Li, J. J., Tan, W. Using molecular beacons for sensitive fluorescence assays of the enzymatic cleavage of nucleic acids. Meth Mol Biol. 335, 71-81 (2006).
- Nikiforov, T. T., Roman, S. Fluorogenic DNA ligase and base excision repair enzyme assays using substrates labeled with single fluorophores. Anal Biochem. 477, 69-77 (2015).
- Pergolizzi, G., Wagner, G. K., Bowater, R. P. Biochemical and structural characterisation of DNA ligases from bacteria and Archaea. Biosci Rep. 36 (5), 00391 (2016).
- Martin, I. V., MacNeill, S. A. ATP-dependent DNA ligases. Genome Biol. 3 (4), (2002).
- Bilotti, K., et al. Mismatch discrimination and sequence bias during end-joining by DNA ligases. Nucleic Acids Res. 50 (8), 4647-4658 (2022).
- Bauer, R. J., et al. Comparative analysis of the end-joining activity of several DNA ligases. PLoS One. 12 (12), e0190062 (2017).
- Lohman, G. J. S., Zhang, Y., Zhelkovsky, A. M., Cantor, E. J., Evans, T. C. Efficient DNA ligation in DNA-RNA hybrid helices by Chlorella virus DNA ligase. Nucleic Acids Res. 42 (3), 1831-1844 (2014).
- Bullard, D. R., Bowater, R. P. Direct comparison of nick-joining activity of the nucleic acid ligases from bacteriophage T4. Biochem J. 398 (1), 135-144 (2006).
- Magnet, S., Blanchard, J. S. Mechanistic and kinetic study of the ATP-dependent DNA ligase of Neisseria meningitidis. Biochemistry. 43 (3), 710-717 (2004).
- Williamson, A., Grgic, M., Leiros, H. S. DNA binding with a minimal scaffold: structure-function analysis of Lig E DNA ligases. Nucleic Acids Res. 46 (16), 8616-8629 (2018).
- Lohman, G. J., et al. A high-throughput assay for the comprehensive profiling of DNA ligase fidelity. Nucleic Acids Res. 44 (2), e14 (2016).
- Kim, J., Mrksich, M. Profiling the selectivity of DNA ligases in an array format with mass spectrometry. Nucleic Acids Res. 38 (1), e2 (2010).
- Tang, Z. W., et al. Real-time monitoring of nucleic acid ligation in homogenous solutions using molecular beacons. Nucleic Acids Res. 31 (23), e148 (2003).
- Yang, W. Nucleases: diversity of structure, function and mechanism. Q Rev Biophys. 44 (1), 1-93 (2011).
- Marti, T. M., Fleck, O. DNA repair nucleases. Cell Mol Life Sci. 61 (3), 336-354 (2004).
- Wang, B. B., et al. Review of DNA repair enzymes in bacteria: With a major focus on AddAB and RecBCD. DNA Repair. 118, 103389 (2022).
- Pidugu, L. S., et al. Structural insights into the mechanism of base excision by MBD4. J Mol Biol. 433 (15), 167097 (2021).
- Roberts, R. J. How restriction enzymes became the workhorses of molecular biology. Proc Natl Acad Sci U S A. 102 (17), 5905-5908 (2005).
- Miller, J. C., et al. An improved zinc-finger nuclease architecture for highly specific genome editing. Nat Biotechnol. 25 (7), 778-785 (2007).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Takemoto, N., Numata, I., Su'etsugu, M., Miyoshi-Akiyama, T. Bacterial EndoMS/NucS acts as a clamp-mediated mismatch endonuclease to prevent asymmetric accumulation of replication errors. Nucleic Acids Res. 46 (12), 6152-6165 (2018).
- Reardon, J. T., Sancar, A. Molecular anatomy of the human excision nuclease assembled at sites of DNA damage. Mol Cell Biol. 22 (16), 5938-5945 (2002).
- Kunkel, T. A., Soni, A. Exonucleolytic proofreading enhances the fidelity of DNA synthesis by chick embryo DNA polymerase-gamma. J Biol Chem. 263 (9), 4450-4459 (1988).
- Sheppard, E. C., Rogers, S., Harmer, N. J., Chahwan, R. A universal fluorescence-based toolkit for real-time quantification of DNA and RNA nuclease activity. Sci Rep. 9 (1), 8853 (2019).
- Li, J. J., Geyer, R., Tan, W. Using molecular beacons as a sensitive fluorescence assay for enzymatic cleavage of single-stranded DNA. Nucleic Acids Res. 28 (11), e52 (2000).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Meth. 9 (7), 671-675 (2012).
- Sharma, J. K., et al. Methods for competitive enrichment and evaluation of superior DNA ligases. Meth Enzymol. 644, 209-225 (2020).
- Rzoska-Smith, E., Stelzer, R., Monterio, M., Cary, S. C., Williamson, A. DNA repair enzymes of the Antarctic Dry Valley metagenome. Front Microbiol. 14, 1156817 (2023).
- Williamson, A., Pedersen, H. Recombinant expression and purification of an ATP-dependent DNA ligase from Aliivibrio salmonicida. Protein Expres Purif. 97, 29-36 (2014).
- Akey, D., et al. Crystal structure and nonhomologous end-joining function of the ligase component of Mycobacterium DNA ligase D. J Biol Chem. 281 (19), 13412-13423 (2006).
- Kim, D. J., et al. ATP-dependent DNA ligase from Archaeoglobus fulgidus displays a tightly closed conformation. Acta Crystallogr Sect F Struct Biol Cryst Commun. 65, 544-550 (2009).
- Nishida, H., Kiyonari, S., Ishino, Y., Morikawa, K. The closed structure of an archaeal DNA ligase from Pyrococcus furiosus. J Mol Biol. 360 (5), 956-967 (2006).
- Gundesø, S., et al. R2D ligase: Unveiling a novel DNA ligase with surprising DNA-to-RNA ligation activity. Biotechnol J. 19 (3), e2300711 (2024).
- Hendling, M., Barišić, I. In silico design of DNA oligonucleotides: Challenges and approaches. Comput Struct Biotechnol J. 17, 1056-1065 (2019).
- Green, M. R., Sambrook, J. How to win the battle with RNase. Cold Spring Harb Prot. 2019 (2), (2019).
- Summer, H., Grämer, R., Dröge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). J Vis Exp. (32), e1485 (2009).
- Smith, D. R. Gel Electrophoresis of DNA. Mol Biometh Handbook. , 17-33 (1998).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis Exp. (63), e3998 (2012).
- Rousseau, M., et al. Characterisation and engineering of a thermophilic RNA ligase from Palaeococcus pacificus. Nucleic Acids Res. 52 (7), 3924-3937 (2024).
- Kestemont, D., Herdewijn, P., Renders, M. Enzymatic synthesis of backbone-modified oligonucleotides using T4 DNA ligase. Curr Prot Chem Biol. 11 (2), e62 (2019).
- Farell, E. M., Alexandre, G. Bovine serum albumin further enhances the effects of organic solvents on increased yield of polymerase chain reaction of GC-rich templates. BMC Res Notes. 5, 257 (2012).
- Nazarenko, I., Pires, R., Lowe, B., Obaidy, M., Rashtchian, A. Effect of primary and secondary structure of oligodeoxyribonucleotides on the fluorescent properties of conjugated dyes. Nucleic Acids Res. 30 (9), 2089-2195 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados