Method Article
Geração e Verificação Funcional de Células T Receptoras de Antígeno Quimérico Sensíveis à Hipóxia
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui apresentamos um protocolo para a geração e verificação funcional de células T receptoras de antígeno quimérico (CAR)-sensíveis à hipóxia. Este protocolo apresenta a geração baseada em lentivírus de células CAR-T sensíveis à hipóxia e sua caracterização, incluindo a validação da expressão de CAR dependente de hipóxia e citotoxicidade seletiva.
Resumo
Estudos extensivos comprovaram a promessa da terapia com células T do receptor de antígeno quimérico (CAR-T) no tratamento de neoplasias hematológicas. No entanto, o tratamento de tumores sólidos continua sendo um desafio, como exemplificado pelas preocupações de segurança que surgem quando as células CAR-T atacam células normais que expressam os antígenos-alvo. Os pesquisadores exploraram várias abordagens para aumentar a seletividade tumoral da terapia com células CAR-T. Uma estratégia representativa nessa linha é a construção de células CAR-T sensíveis à hipóxia, que são projetadas pela fusão de um domínio de degradação dependente de oxigênio à porção CAR e são estrategizadas para atingir alta expressão de CAR apenas em um ambiente hipóxico - o microambiente tumoral (TME). Este trabalho apresenta um protocolo para a geração de tais células CAR-T e sua caracterização funcional, incluindo métodos para analisar as mudanças na expressão e capacidade de matar CAR em resposta a diferentes níveis de oxigênio estabelecidos por uma câmara incubadora móvel. Prevê-se que as células CAR-T construídas demonstrem expressão e citotoxicidade de CAR de maneira sensível ao oxigênio, apoiando assim sua capacidade de distinguir entre TME hipóxico e tecidos normais normóxicos para ativação seletiva.
Introdução
A terapia com células T receptoras de antígeno quimérico (CAR-T) representou um avanço significativo no tratamento do câncer. Desde que a Food and Drug Administration (FDA) aprovou a primeira terapia CAR-T para o tratamento de linfoma avançado/resistente e leucemia linfoblástica aguda em 2017 1,2,3, 10 terapias CAR-T direcionadas ao CD19 ou antígeno de maturação de células B (BCMA) receberam aprovação globalmente4. No entanto, apesar de extensas pesquisas, replicar a notável eficácia da terapia CAR-T no tratamento de neoplasias hematológicas permanece um desafio para sua aplicação em tumores sólidos 5,6,7,8.
O microambiente tumoral imunossupressor (TME) é o principal contribuinte para a baixa eficácia do CAR-T no cenário de tumores sólidos. O TME impede a atividade e a sobrevivência das células CAR-T devido à insuficiência de nutrientes, hipóxia, pH ácido e acúmulo de resíduos metabólicos 9,10,11,12. Outra hostilidade vem da infiltração de células imunossupressoras, como células T reguladoras (Tregs), células supressoras derivadas de mielóides (MDSCs) e macrófagos associados a tumores (TAM), que, juntamente com as células tumorais, secretam citocinas imunossupressoras que causam inibição adicional das células CAR-T quando entram no tumor13,14.
Além da eficiência terapêutica insatisfatória, as questões de segurança são outro calcanhar de Aquiles das células CAR-T quando se trata de tumores sólidos15,16. A preocupação com a segurança surge do fato de que nenhum dos antígenos específicos do tumor (TSA) identificados até agora está estritamente restrito às células tumorais. Em outras palavras, os antígenos associados ao tumor (TAA) escolhidos como alvo da CAR, embora apresentem maior expressão em células tumorais, muitas vezes também são expressos por tecidos normais17. Os efeitos no alvo e fora do tumor podem, portanto, ocorrer a partir da ativação inesperada de células CAR-T no reconhecimento eficiente de tecidos normais, levando à síndrome de liberação de citocinas (CRS), síndrome de encefalopatia relacionada a CAR-T (CRES) 18 e outros resultados adversos19.
Muitas estratégias foram exploradas para evitar tais efeitos, incluindo a diminuição da afinidade do CAR para permitir que as células CAR-T distingam as células tumorais das células normais com base nos níveis de expressão do TAA alvo; equipar as células CAR-T com um botão de desligar, como um gene suicida ou marcador de eliminação para promover sua eliminação após ativação inesperada; particionar os sinais CD3ζ e co-estimulatórios em duas porções CAR, cujo engajamento simultâneo é consequentemente necessário para a ativação efetiva das células CAR-T; utilizando um circuito sintético baseado em Notch (synNotch) que restringe a atividade das células CAR-T a células-alvo que co-expressam dois TAAs diferentes; e engenharia de células CAR-T para atingir a sensibilidade TME, implementando um mecanismo para ajustar a expressão de CAR às mudanças ambientais 20,21,22,23,24,25,26.
Uma consideração importante na opção de sensibilidade do TME descrita acima é o baixo nível de oxigênio no TME devido à rápida proliferação de células tumorais. A acomodação das células tumorais à hipóxia depende da ativação do fator induzível por hipóxia-1 (HIF-1), um fator transcricional heterodimérico que consiste em uma subunidade induzível, HIF-1α, e uma subunidade expressa constitutivamente, HIF-1β27. Em condições normóxicas, a proteína HIF-1α sofre ubiquitinação e rápida degradação proteassômica, dependente de seu domínio de degradação dependente de oxigênio (TOD)28. Quando o suprimento celular de oxigênio se torna limitado, o HIF-1 é estabilizado e ativa a transcrição de seus genes-alvo a jusante, ligando-se a elementos de resposta à hipóxia (HREs) 29 . Dada a natureza do ODD e HRE como elementos sensíveis ao oxigênio, eles foram explorados para realizar a expressão condicional de CARs dentro do TME hipóxico30. Aqui, apresentamos um protocolo com foco em métodos para caracterização fenotípica e funcional de células CAR-T sensíveis à hipóxia, precedido por uma breve descrição do desenho do CAR e dos procedimentos de preparação dessas células. Este protocolo pretende fornecer uma diretriz útil para explorar o CAR responsivo à hipóxia para gerar células CAR-T com toxicidade fora do tumor restringida.
Protocolo
Neste estudo, HER2-BBz-ODD, um CAR sensível à hipóxia direcionado ao HER2 (Gene ID: 2064) foi comparado com sua contraparte regular, HER2-BBz. Os esquemas dos dois CARs são ilustrados na Figura 1A, que mostra que HER2-BBz-ODD é derivado de HER2-BBz adicionando a sequência ODD ao C-terminal de CD3ξ. A construção de vetores lentivirais expressando os dois CARs e a geração do lentivírus correspondente por transfecção de células 293T foi descrita anteriormente31.
1. Geração de células CAR-T sensíveis à hipóxia por infecção lentiviral
- Descongelar rapidamente as células mononucleares do sangue periférico humano criopreservadas (PBMCs) a 37 °C em banho-maria. Transfira os PBMCs descongelados para um tubo de 15 mL contendo 9 mL de meio de cultura de linfócitos isento de soro suplementado com 400 UI de IL-2, 5 ng/mL de IL-7 e 10 ng/mL de IL-15 (meio de crescimento de células T humanas, referido como TGM posteriormente).
- Depois de tomar uma alíquota para contagem de células, centrifugue o tubo a 300 × g por 5 min. Ressuspenda os PBMCs peletizados com TGM a uma densidade de 4 × 106 células/mL e transfira a suspensão para uma placa de 6 poços.
- Prepare imunoesferas revestidas com anti-hCD3/hCD28.
- Transfira 100 μL de grânulos magnéticos de IgG de camundongo para um tubo de microcentrífuga de 1,5 mL e lave-os 2 vezes usando um suporte magnético com PBS.
- Ressuspenda as esferas em 100 μL de PBS e adicione 0,2 μg de anticorpo anti-CD3 humano de camundongo e 2 μg de anticorpo anti-CD28 humano de camundongo. Misture delicadamente a mistura usando uma pipeta e agite durante a noite a 4 °C.
- Lave as esferas 2 vezes usando um suporte magnético com PBS e ressuspenda-as em 100 μL de PBS.
- Adicione imunoesferas revestidas com anti-hCD3 / hCD28 à placa na etapa 1.2 em uma proporção de grânulo para célula de 1: 1. Coloque a placa em uma incubadora umidificada com 5% de CO2 a 37 °C.
- Após 48 h de incubação, transfira a suspensão celular para um tubo de centrífuga de 15 mL após misturar suavemente as células com uma pipeta. Coloque o tubo em um suporte magnético por 3 min e, em seguida, transfira cuidadosamente o sobrenadante para um novo tubo de 15 mL para remover as imunoesferas dos PBMCs.
- Pegue uma alíquota para contagem de células e, em seguida, semeie os PBMCs a 5 ×10 5 células/poço em 300 μL de TGM em uma placa plana de 48 poços. Adicione 200 μL de estoque lentiviral nos poços correspondentes e adicione sulfato de protamina a uma concentração final de 10 μg / mL.
- Centrifugue a placa a 1.000 × g a 32 °C por 1,5 h e remova e descarte cuidadosamente 300 μL de sobrenadante de cada poço usando uma pipeta. Em seguida, adicione 1 mL de TGM fresco usando uma pipeta e coloque a placa em uma incubadora umidificada com 5% de CO2 a 37 °C.
- Adicione TGM fresco para ajustar a densidade celular para 0,5-2 × 106 células/mL a cada 2-3 dias. Comece transferindo as células primeiro para uma placa de 12 poços e depois para uma placa de 6 poços. Continue a cultivar as células até que o número total atinja 6 × 106 em um volume de 4 mL.
NOTA: Paralelamente, conduza a transdução CAR de células T Jurkat seguindo os mesmos procedimentos descritos acima, exceto que o TGM é substituído por RPMI1640 meio contendo 10% de soro fetal bovino (FBS).
2. Avaliação da expressão de CAR dependente de oxigênio em células CAR-T usando citometria de fluxo
- Coloque as células T transduzidas por CAR da etapa 1.8 em duas placas de 12 poços a uma densidade de 2,5 × 106 células/poço em 2 mL de TGM. Colocar uma placa directamente numa incubadora humidificada com 5% de CO2 a 37 °C (condição normóxica, uma vez que a condição padrão para a cultura de células tem 21% de O2) e colocar a outra placa numa câmara de incubadora móvel de CO2/O2/N2 com o nível de O2 predefinido a 1% (condição hipóxica) e, em seguida, manter a câmara num humidificado, 5% CO2/94% N2 incubadora a 37 °C.
- A cada 24 h, coletar 5 × 105 células das placas em condições hipóxicas ou normóxicas em tubos de microcentrífuga de 1,5 mL. Centrifugue os tubos a 500 × g por 5 min, remova o sobrenadante e ressuspenda suavemente as células em 1 mL de PBS por pipetagem. Repita a lavagem PBS mais uma vez.
- Ressuspenda as células peletizadas em 50 μL de tampão FACS (PBS suplementado com 2% de FBS) em cada tubo. Adicione 50 μL de uma diluição de 1:100 de anticorpo anti-Flag conjugado com PE (0,2 μg/mL) e misture bem por pipetagem. Incubar no escuro à temperatura ambiente durante 20 min.
- No final da incubação, adicione 1 mL de tampão FACS a cada tubo. Misture bem por pipetagem e centrifugue a 500 × g por 5 min.
- Remova e descarte cuidadosamente o sobrenadante usando uma pipeta e repita a etapa 2.4 mais uma vez.
- Remova e descarte cuidadosamente o sobrenadante usando uma pipeta. Ressuspenda as células em 200 μL de tampão FACS e, em seguida, transfira a suspensão celular resultante para tubos de fluxo de 5 mL.
- Realize citometria de fluxo na suspensão celular na etapa 2.6 para determinar a expressão de CAR na superfície. Incluir células T não transfectadas como controle negativo.
- Use as portas FSC/SSC e FSC-A/FSC-H para rastrear células individuais ativas. Colete 1 × 104 eventos únicos ao vivo para cada amostra. Gate as células positivas para EGFP (um marcador constitutivo transportado no vetor lentiviral como um indicador de células T transduzidas com sucesso) e, em seguida, as células positivas para ficoeritrina (PE) (células que expressam CAR) para medir a positividade de PE e a intensidade média de fluorescência (MFI).
3. Análise da dependência de oxigênio da expressão de CAR em células T Jurkat modificadas por CAR por western blot
- Plaquear as células T Jurkat transduzidas por CAR da seção 1 em duas placas de 48 poços a uma densidade de 5 × 105 células por poço (500 μL de volume de cultura) em meio RPMI1640 com 10% de FBS.
- Para uma placa, adicione CoCl2 aos poços experimentais até uma concentração final de 0 μM, 50 μM ou 200 μM. Em seguida, coloque a placa em uma incubadora umidificada de CO5 2 a 37 °C (condição normóxica). Para a outra placa, não adicione CoCl2 e coloque-o em uma câmara de incubadora móvel de CO2/O2/N2 com o nível de O2 predefinido em 1% (condição hipóxica) antes de transferi-lo para a mesma incubadora.
- Após 24 h de incubação, transfira as suspensões celulares para tubos de microcentrífuga de 1,5 mL. Centrifugue os tubos a 500 × g por 5 min. Remova e descarte completamente os sobrenadantes primeiro usando uma pipeta de 1 mL, depois uma pipeta de 100 μL e ressuspenda os grânulos de células em 50 μL de 1x tampão de amostra SDS-PAGE.
- Aqueça as amostras em banho-maria fervente por 10 min. Coloque imediatamente o tubo no gelo por 30 s e, em seguida, centrifugue a 16.000 × g por 30 s.
- Carregue 30 μL das amostras limpas em cada ranhura de um gel SDS PAGE de 10 poços e 10% com espessura de 1,5 mm. Execute o gel a 80 V por 30 min, depois aumente a tensão para 100 V e funcione por 1,5 h.
- No final da eletroforese, transfira proteínas do gel para uma membrana de PVDF usando o método padrão de transferência úmida, com a corrente e a duração definidas em 400 mA e 1 h, respectivamente.
- Bloqueie a membrana no tampão de bloqueio (5% de leite (p / v) em PBST (PBS + 0,05% Tween-20)) por 1 h em temperatura ambiente. Em seguida, corte a peça entre 30 kD e 40 kD para detecção do controle de carga GAPDH e a peça entre 50 kD e 70k D para detecção das moléculas de CAR.
- Incube os pedaços de 30-40 kD e 50-70 kD com um anticorpo anti-GAPDH de camundongo (diluição de 1:2.000) e um anticorpo anti-Flag de camundongo (diluição de 1:2.000), respectivamente, em 3 mL de tampão de bloqueio à temperatura ambiente por 2 h ou a 4 °C durante a noite.
- Lave as membranas com PBST à temperatura ambiente em um balancim de plataforma por 3 x 5 min.
- Incubar as membranas com anticorpo anti-camundongo de cabra conjugado com HRP (diluição 1:5.000) em 3 mL de tampão de bloqueio à temperatura ambiente por 1 h; em seguida, lave a membrana com PBST por 5 x 10 min.
- Desenvolva as membranas incubando-as com um substrato HRP e, em seguida, visualize as bandas de proteína detectadas usando um analisador de imagem luminescente.
4. Avaliação in vitro da dependência de oxigênio da citotoxicidade mediada por células CAR-T sensíveis à hipóxia
- No dia 0, semeie 1 × 104 células-alvo (células SKOV3-Luc) por poço experimental em 200 μL de DMEM contendo 10% de FBS em duas placas pretas de cultura de tecidos de fundo plano de 96 poços.
- No dia 1, remova cuidadosamente 100 μL do sobrenadante do topo de cada poço. Adicione células CAR-T ou células T não transduzidas em proporções efetor-alvo de 1:1, 2:1 e 4:1 em 100 μL de meio DMEM contendo 10% de FBS.
- Colocar uma placa numa atmosfera de 21% O2 e a outra numa atmosfera de 1% O2 utilizando uma câmara incubadora móvel de CO2/O2/N2 , conforme descrito no passo 2.1.
NOTA: Se uma câmara incubadora móvel de CO2/O2/N2 não estiver disponível, a adição de CoCl2 ao meio de cultura pode ser usada para imitar uma condição hipóxica. - No dia 2, após 24 h de co-cultura, transfira cuidadosamente todo o sobrenadante (aproximadamente 150-200 μL) para uma nova placa de 96 poços com fundo em U usando uma pipeta. Conservar a -20 °C para posterior deteção de citocinas, seguindo os procedimentos descritos na secção 5.
- Adicione 60 μL de tampão de lise passiva 1x a cada poço experimental das placas pretas de fundo plano de 96 poços da etapa 4.4. Em seguida, coloque as placas em um shaker e agite por 30 min para garantir uma lise celular eficiente.
- Adicione 60 μL de substrato de luciferase de vaga-lume a cada poço experimental e meça a atividade da luciferase imediatamente usando um leitor de microplacas.
- Calcular a citotoxicidade normalizada (%) utilizando a equação (1):
Citotoxicidade normalizada (%) = 100 -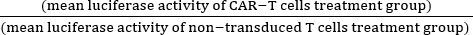 ×100 (1)
×100 (1)
5. Detecção de secreção de IL-2 e IFN-γ por células CAR-T sensíveis à hipóxia
- No Dia 0, prepare uma diluição de 1:250 de anticorpo de captura de IL-2 ou IFN-γ no tampão de revestimento. Adicione 100 μL do anticorpo diluído a cada alvéolo de uma placa ELISA de 96 poços e incube a placa a 4 °C durante a noite.
NOTA: O tampão de revestimento é feito dissolvendo 7.13 g de NaHCO3 e 1.59 g de Na2CO3 em 1 L de água destilada e ajustando o pH para 9.5. - No dia 1, remova o anticorpo de captura não adsorvido virando vigorosamente a placa de cabeça para baixo e, em seguida, lave os poços 3x com 200 μL de tampão de lavagem (PBS contendo 0,05% de Tween 20).
- Adicione 200 μL de diluente de ensaio (PBS contendo 10% de FBS) a cada poço e incube em temperatura ambiente por 1 h.
- Descarte a solução virando vigorosamente a placa de cabeça para baixo; em seguida, lave os poços 3x com 200 μL de tampão de lavagem.
- Descongele as amostras/placas sobrenadantes congeladas da etapa 4.4 à temperatura ambiente. Depois de completamente descongelado, dilua as amostras e os padrões com o Diluente de Ensaio. Adicionar 100 μL de amostras ou padrões diluídos a cada alvéolo da placa ELISA revestida e incubar à temperatura ambiente durante 2 h.
NOTA: Para a detecção de IL-2, recomenda-se uma diluição de 10 vezes, enquanto para a detecção de IFN-γ, é preferível uma diluição de 50 vezes. - Remova as amostras e os padrões virando vigorosamente a placa de cabeça para baixo e, em seguida, lave os poços 5x com 200 μL de tampão de lavagem por poço.
- Preparar uma solução de detecção funcional diluindo o anticorpo de detecção de IL-2 ou o anticorpo de detecção de IFN-γ/estreptavididina-HRP (SAv-HRP) na proporção de 1:250 no diluente do ensaio. Adicione 100 μL da solução de detecção de trabalho a cada poço e incube a placa em temperatura ambiente por 1 h com agitação suave.
- Descarte a solução e lave os poços 7x com 200 μL de tampão de lavagem.
- Adicione 100 μL de reagente de substrato a cada poço e incube a placa em temperatura ambiente por 30 minutos no escuro.
- Adicione 50 μL de solução de parada (1 M H2SO4) a cada poço. Ler imediatamente a absorvância a 450 nm utilizando um leitor de microplacas.
Resultados
A fusão do domínio ODD de HIF-1α à porção CAR representa uma estratégia primária para gerar um CAR sensível à hipóxia. O CAR direcionado a HER2 sensível à hipóxia analisado neste estudo, denominado HER2-BBz-ODD, foi construído usando essa estratégia integrando a sequência ODD em seu HER2-BBz convencional (Figura 1A). Neste estudo, usamos transdução lentiviral para expressar HER2-BBz-ODD CAR ou HER2-BBz CAR e, posteriormente, examinamos sua sensibilidade ao oxigênio em dois tipos de células: PBMCs humanas e células T Jurkat.
O primeiro exame é a expressão de CAR em condições hipóxicas versus condições normóxicas, que foi conduzido em células T derivadas de PBMC transduzidas por CAR por citometria de fluxo e células T Jurkat transduzidas por CAR por western blotting. No cenário de células T derivadas de PBMC transduzidas por CAR, observamos que HER2-BBz-ODD CAR teve expressão significativamente maior sob 1% O2 do que sob 21% O2 em termos de porcentagem de células CAR-positivas e intensidade de fluorescência mediana (MFI) (Figura 1B). A análise de immunoblotting de células T Jurkat transduzidas por CAR também confirmou a indução dependente de hipóxia de HER2-BBz-ODD.
Vale ressaltar que, nesse contexto, a condição hipóxica pode ser convenientemente mimetizada pela adição de CoCl2, um indutor químico de hipóxia, ao meio de cultura. Conforme ilustrado na Figura 1C, nossos resultados de immunoblotting demonstraram que a exposição a 50 ou 200 μM de CoCl2 recapitulou o efeito da exposição a 1% de O2, induzindo acentuadamente a expressão do CARCAR HER2-BBz-ODD, mas não a do CAR. A caracterização funcional do CAR sensível à hipóxia foi conduzida com células CAR-T derivadas de PBMC. No estudo, uma linha celular SKOV-3 portadora de luciferase de vaga-lume foi utilizada como linha celular alvo. Essa configuração nos permitiu medir a atividade da luciferase associada à célula-alvo como um proxy para avaliar a citotoxicidade mediada por células CAR-T co-cultivadas.
Conforme mostrado na Figura 1D, as medições indicaram que as células CAR-T HER2-BBz matam efetivamente as células-alvo, independentemente de a atmosfera ser normóxica ou hipóxica. Em contraste, as células CAR-T HER2-BBz-ODD exibiram citotoxicidade significativamente mais fraca sob condições normóxicas para todas as três relações E:T examinadas. No entanto, sua citotoxicidade foi significativamente aumentada quando exposta a condições hipóxicas. Os níveis sobrenadantes de IL-2 e IFN-γ também foram medidos por ELISA após co-cultivo de células CAR-T com células-alvo por 24 h. Para ambas as citocinas, foi observada maior secreção abaixo de 1% O2 em comparação com 21% O2 para células CAR-T HER2-BBz-ODD, o que é consistente com os dados de citotoxicidade. Em contraste, as células CAR-T HER2-BBz mostraram menor secreção das duas citocinas abaixo de 1% O2 em comparação com 21% O2, indicando um impacto adverso da hipóxia na atividade celular (Figura 1E). Tomados em conjunto, esses resultados validaram de forma convincente a natureza sensível à hipóxia do CAR.
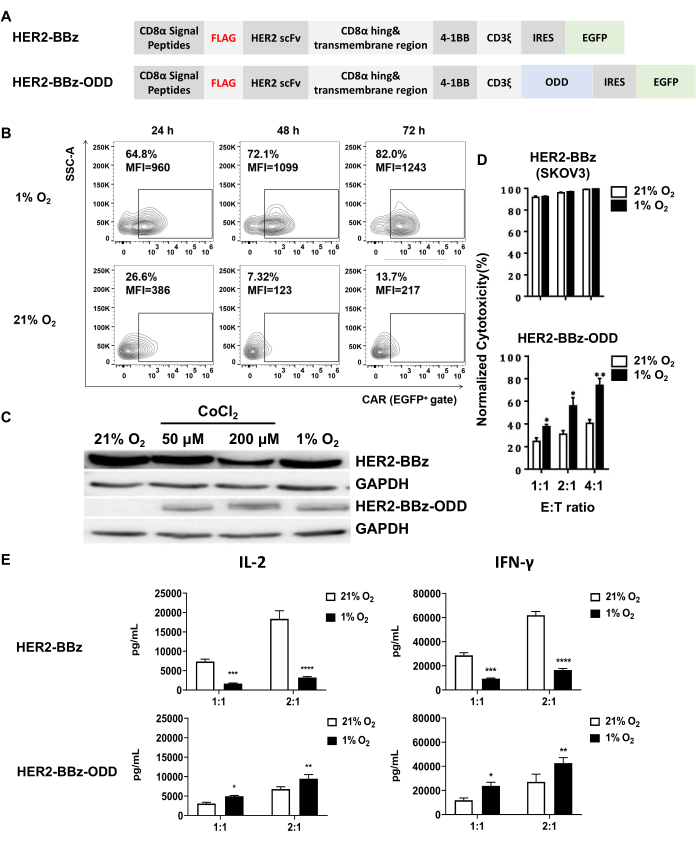
Figura 1: Construção e caracterização de células CAR-T sensíveis à hipóxia. (A) Representação esquemática dos projetos de um CAR sensível à hipóxia, HER2-BBz-ODD, e sua contraparte convencional, HER2-BBz. Ambos os CARs consistem em um peptídeo sinal CD8α N-terminal, uma marca FLAG, um scFv direcionado a HER2 humano, uma dobradiça CD8 e um domínio transmembrana e uma porção intracelular composta por um domínio coestimulatório de 4-1BB, um domínio de sinalização CD3ξ, um IRES e um EGFP. HER2-BBz-ODD difere de HER2-BBz na fusão de um domínio ODD com o C-terminal do domínio de sinalização CD3ξ, permitindo sua expressão dependente de hipóxia promovendo sua degradação dependente de ubiquitina sob condições normóxicas. (B, C) Avaliações da expressão dependente de oxigênio de HER2-BBz-ODD CAR. (B) Uma avaliação foi realizada com células CAR-T derivadas de PBMC humano após cultura sob 1% ou 21% de O2 por 24, 48 ou 72 h usando citometria de fluxo. (C) A outra avaliação foi com células T Jurkat transduzidas por CAR, onde os lisados celulares foram colhidos 24 h após a cultura sob 21% de O2, 50 ou 200 μM de CoCl2, ou 1% de O2 e analisados quanto à expressão de CAR usando western blotting, com células transduzidas por CAR HER2-BBz incluídas como controle. (D, E) Citotoxicidade in vitro e secreção de citocinas de células CAR-T sob diferentes condições de oxigênio. (D) As células CAR-T foram co-cultivadas com células SKOV3 que expressam luciferase de vaga-lume em razões E:T indicadas abaixo de 1% ou 21% O2. Após 24 h de co-cultura, a eficiência de morte de células-alvo foi determinada medindo a mudança na atividade de luciferase de vaga-lumes associada à célula em relação àquela com células T não transduzidas. (E) Os sobrenadantes foram coletados para a detecção de IL-2 e IFN-γ secretados. Os resultados são apresentados como a média ± EPM (n = 3 doadores saudáveis) (****p < 0,0001). Abreviaturas: scFv = variável de fragmento de cadeia única; CAR = receptor de antígeno quimérico. Os painéis C e D são adaptados de Liao et al.31. Clique aqui para ver uma versão maior desta figura.
Discussão
As preocupações com a segurança são questões significativas que devem ser abordadas para que qualquer terapia com células CAR-T avance para o uso clínico. A utilização das propriedades únicas das células tumorais ou do TME tornou-se uma direção de pesquisa primária com foco no desenvolvimento de células CAR-T que visam seletivamente os tecidos tumorais. Projetar um CAR-T sensível à hipóxia é uma estratégia atraente nessa direção, com várias abordagens sendo exploradas, incluindo a apresentada neste estudo - fundindo a porção CAR com o domínio da proteína ODD sensível à hipóxia de ocorrência natural. Uma abordagem alternativa envolve a substituição de um promotor constitutivo comumente usado para conduzir a expressão de CAR por um elemento de resposta à hipóxia (HRE), que se mostrou promissor em estudos anteriores. Acredita-se que a combinação de elementos HRE e ODD (versões de tipo selvagem ou de engenharia que oferecem um controle mais rígido da expressão) representa um design ideal para um CAR induzível por hipóxia.
Este protocolo descreve procedimentos experimentais para gerar e validar células CAR-T sensíveis à hipóxia. A implementação deste protocolo envolve várias considerações importantes. Uma consideração primária é a criação de condições hipóxicas. Entre as duas abordagens, a adição de CoCl2 ao meio de cultura tem sido predominantemente utilizada em estudos anteriores relacionados à hipóxia, em grande parte graças à sua conveniência32,33. No entanto, é impossível medir o grau de hipóxia mimetizado por essa abordagem. Em contraste, o uso de uma câmara de incubação móvel de CO2 / O2 / N2 é vantajoso, pois os níveis de O2 podem ser definidos com precisão e, portanto, é adequado para uma análise fina da sensibilidade à hipóxia das células CAR-T. Nesse aspecto, o nível de hipóxia dentro dos tumores varia entre os diferentes tipos de tumores sólidos e os diferentes períodos de progressão tumoral34, enquanto apenas 1% de O2 é exemplificado no protocolo. É uma prática ideal para os pesquisadores ajustar o nível de oxigênio de acordo com a demanda real. Se o método de CoCl2 for a única abordagem disponível, recomendamos incluir uma faixa de concentrações de CoCl2 no ensaio para simular vários níveis de oxigênio.
A escolha de um método apropriado para examinar a expressão de CAR dependente de hipóxia é outra consideração importante. Embora a análise de immunoblotting de células T Jurkat transduzidas por CAR seja uma opção conveniente durante a otimização da construção de CAR, analisar o efeito dos níveis de oxigênio na expressão de CAR de superfície em PBMCs humanos transduzidos por CAR por citometria de fluxo serve como a validação final. É ideal examinar a dinâmica da expressão de CAR em resposta à transição de condições hipóxicas para normóxicas, como fizemos anteriormente com uma versão aprimorada de CAR sensível à hipóxia, ou seja, HiTA-CAR35. Isso demonstraria ainda mais a expressão de CAR restrita à hipóxia.
Para verificação funcional de células CAR-T sensíveis à hipóxia, o ensaio de citotoxicidade descrito no protocolo envolve o uso de células-alvo portadoras de luciferase de vaga-lume. Este ensaio baseado em repórter pode ser substituído por outros métodos de avaliação de morte, como o método CCK8 e o método de análise celular em tempo real (RTCA), onde células tumorais não modificadas podem ser usadas. A análise RTCA também é vantajosa para medir a cinética de morte em tempo real das células CAR-T. Para medir a citotoxicidade específica causada pelas células CAR-T, PBMCs não transduzidas devem ser incluídas como controle. A alta eficiência de transdução de PBMCs é desejável para evitar preocupações de que as diferenças na citotoxicidade detectada entre os grupos experimental e controle surjam de morte inespecífica mediada por quantidades variáveis de células efetoras adicionadas.
Existem várias limitações neste protocolo. As condições hipóxicas podem afetar a viabilidade das células-alvo e das células T36,37, o que introduz a preocupação de que a morte celular não relacionada à citotoxicidade mediada por células CAR-T possa confundir a interpretação dos resultados do ensaio. Garantir que as células CAR-T e as células-alvo tenham excelente viabilidade imediatamente antes do ensaio é sugerido para evitar ou minimizar tais preocupações. Deve-se notar também que a validação in vitro não garante o sucesso da tradução in vivo. Avaliações in vivo são sempre necessárias para confirmar se o candidato CAR-T sensível à hipóxia pode evitar atingir tecidos normais que expressam o antígeno alvo
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi apoiado por doações do Programa Nacional de Pesquisa e Desenvolvimento da China (2016YFC1303402), do Megaprojeto Nacional sobre Doenças Infecciosas Essenciais (2017ZX10202102, 2017ZX10304402-002-007) e do Programa Geral da Comissão Municipal de Saúde de Xangai (201740194).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL Centrifuge tube | QSP | 509-GRD-Q | Supernatants and cells cellection Protocol Step 2,3,4 |
| 10% ExpressCast PAGE | NCM biotech | P2012 | Immunoblotting Protocol Step 3 |
| 10x PBS | NCM biotech | 20220812 | Cell culture Protocol Step 4 |
| 10 mL pipette | Yueyibio | YB-25H | Pipetting Protocol Step 1 |
| 10xTRIS-Glycine-SDS electrophoresis buffer | Epizyme | 3673020 | Immunoblotting Protocol Step 3 |
| 15 mL Centrifuge tube | Thermo Scientific | 339650 | Supernatants and cells cellection Protocol Step 1 |
| 25 cm2 EasYFlask | Thermo Scientific | 156367 | Cell culture Protocol Step 3,4 |
| 4x Protein SDS PAGE Loading Buffer | Takara | 9173 | Immunoblotting Protocol Step 3 |
| 6-well flat-bottom tissue culture plates | Thermo Scientific | 140675 | T Cells culture Protocol Step 1 |
| 96-well black flat-bottom tissue culture plates | Greiner | 655090 | Cytotoxicity assay Protocol Step 4 |
| 96-well ELISA plates | Corning | 3590 | ELISA Protocol Step 5 |
| 96-well plate shaker | QILINBEIER | MH-2 | Shake Protocol Step 4 |
| 96-well U-bottom tissue culture plates | Thermo Scientific | 268200 | Supernatants cellection Protocol Step 4,5 |
| anti-FLAG antibody | Sigma | F1804-50UG | Immunoblotting Protocol Step 3 |
| Carbinol | Sinopharm | 10010061 | Immunoblotting Protocol Step 3 |
| Carbon dioxide incubator | Thermo Scientific | 360 | Cell culture Protocol Step 1,2,3,4 |
| Cell counting plate | Hausser scientific | 1492 | Cell counting Protocol Step 1,3,4 |
| CELLection Pan Mouse IgG Kit | Thermo Scientific | 11531D | Mouse IgG magnetic beads Protocol Step 1 |
| Centrifuge | Thermo Scientific | 75002432 | Cell culture Protocol Step 1,3,4 |
| Chemiluminescence gel imaging system | BIO-RAD | 12003154 | Immunoblotting Protocol Step 3 |
| Cobalt chloride solution (0.5 M) | bioleaper | BR4000203 | Hypoxic condition Protocol Step 2,3,4 |
| DMEM | Corning | 10-103-CV | Cell culture Protocol Step 4 |
| Electronic balance | Sartorius | PRACTUM612-1CN | weigh Protocol Step 5 |
| FBS | BI | 04-001-1ACS | Cell culture Protocol Step 3,4 |
| GAPDH Mouse mAb | ABclonal | AC002 | Immunoblotting Protocol Step 3 |
| Gel electrophoresis apparatus | BIO-RAD | 1645070 | Immunoblotting Protocol Step 3 |
| GloMax Microplate Readers | Promega | GM3000 | luciferase activity measurement Protocol Step 4 |
| Goat anti-Mouse IgG (H+L) | Yeasen | P1126151 | Immunoblotting Protocol Step 3 |
| High speed microfreezing centrifuge | eppendorf | 5810 R | Cell culture Protocol Step 1 |
| Human IFN-γ ELISA Set | BD | 555142 | ELISA Protocol Step 5 Items: Recombinant Human IFN-γ Lyophilized Standard, Detection Antibody Biotin Anti-Human IFN-γ , Capture Antibody Purified Anti-Human IFN-γ, Enzyme Reagent Streptavidin-horseradish peroxidase conjugate (SAv-HRP) |
| Human IL-2 ELISA Set | BD | 555190 | ELISA Protocol Step 5 Items: Recombinant Human IL-2 Lyophilized Standard, Detection Antibody Biotin Anti-Human IL-2 , Capture Antibody Purified Anti-Human IL-2, Enzyme Reagent Streptavidin-horseradish peroxidase conjugate (SAv-HRP) |
| IL-15 | R&D systems | P40933 | T Cells culture Protocol Step 1 |
| IL-21 | Novoprotein | GMP-CC45 | T Cells culture Protocol Step 1 |
| IL-7 | R&D systems | P13232 | T Cells culture Protocol Step 1 |
| Inverted microscope | Olympus | CKX41 | Cell culture Protocol Step 1,3,4 |
| Jurkat | ATCC | TIB-152 | CAR-Jurkat construction Protocol Step 3 |
| LSRFortessa | BD | LSRFortessa | Flow cytometry Protocol Step 2 |
| Luciferase Assay System | Promega | E1501 | luciferase reporter assay Protocol Step 4 Items: Passive lysis buffer, firefly luciferase substrate |
| Microplate reader | BioTek | HTX | ELISA Protocol Step 5 |
| mobile CO2/O2/N2 Incubator Chamber | China Innovation Instrument Co., Ltd. | Smartor118 | Hypoxic condition Protocol Step 2, 3, 4 |
| Mouse Anti-Hexa Histidine tag | Sigma | SAB2702218 | Immunoblotting Protocol Step 3 |
| NcmBlot Rapid Transfer Buffer | NCM biotech | WB4600 | Immunoblotting |
| NcmECL Ultra | NCM biotech | P10300 | Immunoblotting Protocol Step 3 Items: NcmECL Ultra Luminol/Enhancer Reagent (A) ,NcmECL Ultra Stabilized Peroxide Reagent (B) |
| NovoNectin -coated 48-well flat plates | Novoprotein | GMP-CH38 | CAR-T cells construction Protocol Step 1 |
| OPD (o-phenylenediamine dihydrochloride) tablet set | Sigma | P9187 | Substrate Reagent Protocol Step 5 Items: OPD tablet (silver foil),urea hydrogen peroxide tablet (gold foil) |
| PE-conjugated anti-DYKDDDDK | Biolegend | 637310 | Flow cytometry Protocol Step 2 |
| Protamine sulfate | Sigma | P3369-1OG | Lentivirus infection Protocol Step 1 |
| Protein Marker 10 Kda-250 KDa | Epizyme | WJ102 | Immunoblotting Protocol Step 3 |
| Purifed NA/LE Mouse Anti-Human CD3 | BD | 566685 | T Cells culture Protocol Step 1 |
| Purified NA/LE Mouse Anti-Human CD28 | BD | 555725 | T Cells culture Protocol Step 1 |
| PVDF membrane | Millipore | 168627 | Immunoblotting Protocol Step 3 |
| RPMI 1640 | Corning | 10-040-CVRC | Cell culture Protocol Step 3 |
| Skim milk powder | Yeasen | S9129060 | Immunoblotting Protocol Step 3 |
| SKOV3-Luc | ATCC | HTB-77 | Cytotoxicity assay Protocol Step 4 |
| Trypsin-EDTA | NCM biotech | C125C1 | Cell culture Protocol Step 4 |
| Tween 20 | Sinopharm | 30189328 | Immunoblotting Protocol Step 3 |
| Water bath | keelrein | NB014467 | Heating Protocol Step 1 |
| X-VIVO 15 | LONZA | 04-418Q | Serum-free lymphocyte culture medium Protocol Step 1 |
Referências
- Boardman, A. P., Salles, G. CAR T-cell therapy in large B cell lymphoma. Hematol Oncol. 41 (S1), 112-118 (2023).
- Chen, Y. -. J., Abila, B., Mostafa Kamel, Y. CAR-T: What is next. Cancers. 15 (3), 663 (2023).
- Barsan, V., et al. Tisagenlecleucel utilisation and outcomes across refractory, first relapse and multiply relapsed B-cell acute lymphoblastic leukemia: A retrospective analysis of real-world patterns. eClinicalMedicine. 65, 102268 (2023).
- Liu, Y., et al. Oncolytic herpes simplex virus delivery of dual CAR targets of CD19 and BCMA as well as immunomodulators to enhance therapeutic efficacy in solid tumors combined with CAR-T cell therapy. Front Oncol. 12, 1037934 (2022).
- Liu, C., Qi, T., Milner, J. J., Lu, Y., Cao, Y. Speed and location both matter: Antigen stimulus dynamics controls CAR-T cell response. Front Immunol. 12, 748768 (2021).
- Li, N., et al. Improving the anti-solid tumor efficacy of CAR-T cells by inhibiting adenosine signaling pathway. Oncoimmunology. 9 (1), 1824643 (2020).
- Derenzo, C., Gottschalk, S. Genetic modification strategies to enhance CAR T cell persistence for patients with solid tumors. Front Immunol. 10, 218 (2019).
- Fu, R., et al. Delivery techniques for enhancing CAR T cell therapy against solid tumors. Advanced Functional Materials. 31 (44), 2009489 (2021).
- Johnson, A., Townsend, M., O'Neill, K. Tumor microenvironment immunosuppression: A roadblock to CAR T-cell advancement in solid tumors. Cells. 11 (22), 3626 (2022).
- Liu, Z., et al. Immunosuppression in tumor immune microenvironment and its optimization from CAR-T cell therapy. Theranostics. 12 (14), 6273-6290 (2022).
- Luo, Z., et al. Modulating tumor physical microenvironment for fueling CAR-T cell therapy. Adv Drug Deliv Rev. 185, 114301 (2022).
- Martinez, M., Moon, E. K. CAR T cells for solid tumors: New strategies for finding, infiltrating, and surviving in the tumor microenvironment. Front Immunol. 10, 128 (2019).
- Zhang, X., et al. The immunosuppressive microenvironment and immunotherapy in human glioblastoma. Front Immunol. 13, 1003651 (2022).
- Tie, Y., Tang, F., Wei, Y. Q., Wei, X. W. Immunosuppressive cells in cancer: Mechanisms and potential therapeutic targets. J Hematol Oncol. 15 (1), 61 (2022).
- Wu, Y., et al. Engineering CAR T cells for enhanced efficacy and safety. APL Bioeng. 6 (1), 011502 (2022).
- Al-Haideri, M., et al. cell combination therapy: The next revolution in cancer treatment. Cancer Cell Int. 22 (1), 365 (2022).
- Fuca, G., Reppel, L., Landoni, E., Savoldo, B., Dotti, G. Enhancing chimeric antigen receptor T-cell efficacy in solid tumors. Clin Cancer Res. 26 (11), 2444-2451 (2020).
- Neelapu, S. S., et al. Chimeric antigen receptor T-cell therapy - assessment and management of toxicities. Nat Rev Clin Oncol. 15 (1), 47-62 (2018).
- Mi, J., Ye, Q., Min, Y. Advances in nanotechnology development to overcome current roadblocks in CAR-T therapy for solid tumors. Front Immunol. 13, 849759 (2022).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: Current limitations and potential strategies. Blood Cancer J. 11 (4), 69 (2021).
- Yu, S., Yi, M., Qin, S., Wu, K. Next generation chimeric antigen receptor T cells: Safety strategies to overcome toxicity. Mol Cancer. 18 (1), 125 (2019).
- Dana, H., et al. CAR-T cells: Early successes in blood cancer and challenges in solid tumors. Acta Pharm Sin B. 11 (5), 1129-1147 (2021).
- Van Der Schans, J. J., Van De Donk, N., Mutis, T. Dual targeting to overcome current challenges in multiple myeloma CAR T-cell treatment. Front Oncol. 10, 1362 (2020).
- Andrea, A. E., Chiron, A., Bessoles, S., Hacein-Bey-Abina, S. Engineering next-generation car-t cells for better toxicity management. Int J Mol Sci. 21 (22), 8620 (2020).
- Flugel, C. L., et al. Overcoming on-target, off-tumour toxicity of CAR T cell therapy for solid tumours. Nat Rev Clin Oncol. 20 (1), 49-62 (2023).
- Rababah, F., et al. Chimeric antigen receptor T cells therapy in solid tumors. Clin Transl Oncol. 25 (8), 2279-2296 (2023).
- Masoud, G. N., Li, W. Hif-1alpha pathway: Role, regulation and intervention for cancer therapy. Acta Pharm Sin B. 5 (5), 378-389 (2015).
- Semenza, G. L. Targeting hif-1 for cancer therapy. Nat Rev Cancer. 3 (10), 721-732 (2003).
- Harris, A. L. Hypoxia--a key regulatory factor in tumour growth. Nat Rev Cancer. 2 (1), 38-47 (2002).
- Juillerat, A., et al. An oxygen sensitive self-decision making engineered CAR T-cell. Sci Rep. 7, 39833 (2017).
- Liao, Q., et al. Engineering T cells with hypoxia-inducible chimeric antigen receptor (HiCAR) for selective tumor killing. Biomark Res. 8 (1), 56 (2020).
- Ivan, M., et al. Hifα targeted for vhl-mediated destruction by proline hydroxylation: Implications for o2 sensing. Science. 292 (5516), 464-468 (2001).
- Wang, G. L., Semenza, G. L. Purification and characterization of hypoxia-inducible factor 1. J Biol Chem. 270 (3), 1230-1237 (1995).
- D'alonzo, R. A., et al. In vivo noninvasive preclinical tumor hypoxia imaging methods: A review. Int J Radiat Biol. 97 (5), 593-631 (2021).
- He, H., et al. Conditioned car-t cells by hypoxia-inducible transcription amplification (hita) system significantly enhances systemic safety and retains antitumor efficacy. J Immunother Cancer. 9 (10), e002755 (2021).
- Barsoum, I. B., Smallwood, C. A., Siemens, D. R., Graham, C. H. A mechanism of hypoxia-mediated escape from adaptive immunity in cancer cells. Cancer Res. 74 (3), 665-674 (2014).
- Kroemer, G., Pouyssegur, J. Tumor cell metabolism: Cancer's achilles' heel. Cancer Cell. 13 (6), 472-482 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados