Method Article
低酸素感受性キメラ抗原受容体T細胞の作製と機能検証
* これらの著者は同等に貢献しました
要約
ここでは、低酸素感受性キメラ抗原受容体(CAR)-T細胞の作製と機能検証のためのプロトコールを紹介します。このプロトコルは、レンチウイルスベースの低酸素感受性CAR-T細胞の作製と、低酸素依存性CAR発現および選択的細胞毒性の検証を含むそれらの特性評価を示しています。
要約
広範な研究により、血液悪性腫瘍の治療におけるキメラ抗原受容体T(CAR-T)細胞療法の有望性が証明されています。しかし、固形腫瘍の治療は依然として困難であり、CAR-T細胞が標的抗原を発現する正常細胞を攻撃する際に生じる安全性の懸念に代表されるようになっています。研究者らは、CAR-T細胞療法の腫瘍選択性を高めるためのさまざまなアプローチを模索してきました。この方針に沿った代表的な戦略の1つは、酸素依存性分解ドメインをCAR部分に融合させることによって設計され、低酸素環境、つまり腫瘍微小環境(TME)でのみ高いCAR発現を達成するように戦略化された低酸素感受性CAR-T細胞の構築です。この論文では、このようなCAR-T細胞の作製とその機能特性評価のためのプロトコルを提示し、移動型インキュベーターチャンバーによって確立されたさまざまな酸素レベルに応じたCAR発現と殺傷能力の変化を分析する方法を含めます。構築されたCAR-T細胞は、酸素感受性でCAR発現と細胞毒性を示すことが期待されており、したがって、低酸素TMEと正常酸素正常組織を区別して選択的活性化を行う能力をサポートします。
概要
キメラ抗原受容体T細胞(CAR-T)療法は、がん治療における大きなブレークスルーを表しています。2017年に米国食品医薬品局(FDA)が進行性/抵抗性リンパ腫および急性リンパ性白血病の治療薬として初めてCAR-T療法を承認して以来、CD19またはB細胞成熟抗原(BCMA)を標的とするCAR-T療法は、全世界で1、2、3、10が承認を受けています4。しかし、広範な研究にもかかわらず、血液悪性腫瘍の治療におけるCAR-T療法の顕著な有効性を再現することは、固形腫瘍5,6,7,8への適用にとって依然として困難です。
免疫抑制性腫瘍微小環境(TME)は、固形腫瘍環境におけるCAR-Tの有効性が低い主な原因です。TMEは、不十分な栄養素、低酸素症、酸性pH、および代謝老廃物の蓄積により、CAR-T細胞の活性と生存を妨げます9,10,11,12。さらなる敵意は、制御性T細胞(Treg)、骨髄由来抑制細胞(MDSC)、腫瘍関連マクロファージ(TAM)などの免疫抑制細胞への浸潤から生じ、腫瘍細胞とともに免疫抑制性サイトカインを分泌し、CAR-T細胞が腫瘍に侵入するとさらに阻害する13,14。
不十分な治療効率は別として、安全性の問題は、固形腫瘍15,16を扱う際のCAR-T細胞の別のアキレス腱です。安全性の懸念は、これまでに同定された腫瘍特異的抗原(TSA)のいずれも腫瘍細胞に厳密に限定されていないという事実から生じます。言い換えれば、CARの標的として選択された腫瘍関連抗原(TAA)は、腫瘍細胞でより高い発現を示すが、しばしば正常組織によっても発現される17。したがって、オンターゲット、オフ腫瘍効果は、CARが正常組織を効率的に認識すると、CAR-T細胞が予期せず活性化することで発生し、サイトカイン放出症候群(CRS)、CAR-T関連脳症症候群(CRES)18、およびその他の有害な結果につながる可能性があります19。
このような影響を回避するために、CAR-T細胞が標的TAAの発現レベルに基づいて腫瘍細胞と正常細胞を区別できるようにCARの親和性を低下させるなど、多くの戦略が検討されてきました。CAR-T細胞に自殺遺伝子や排泄マーカーなどのオフスイッチを装備して、予期せぬ活性化時にそれらの排泄を促進するステップと、CD3ζシグナルと共刺激シグナルを2つのCAR部分に分割し、その結果、CAR-T細胞の効果的な活性化には、その同時関与が必要となる。CAR-T細胞の活性を2つの異なるTAAを共発現する標的細胞に制限する合成Notch(synNotch)ベースの回路を利用し、また、変化する環境の手がかり20,21,22,23,24,25,26に対してCAR発現を調整するメカニズムを実装することにより、TME感度を達成するためのCAR-T細胞をエンジニアリングします。
上記のTME感度オプションにおける重要な考慮事項は、腫瘍細胞の急速な増殖によるTMEの酸素レベルが低いことです。腫瘍細胞の低酸素への適応は、誘導性サブユニットであるHIF-1αと構成的に発現するサブユニットであるHIF-1βからなるヘテロ二量体転写因子である低酸素誘導因子-1(HIF-1)の活性化にかかっています27。正常酸素条件下では、HIF-1αタンパク質は、その酸素依存性分解ドメイン(ODD)28に依存して、ユビキチン化および急速なプロテアソーム分解を受ける。細胞内の酸素供給が制限されると、HIF-1は安定化され、低酸素応答要素(HRE)29に結合することにより、その下流の標的遺伝子の転写を活性化する。ODDとHREが酸素感受性要素としての性質を持つことから、低酸素TME30におけるCARの条件付き発現を実現するために研究が進められてきました。ここでは、低酸素感受性CAR-T細胞の表現型および機能特性評価の方法に焦点を当てたプロトコルを提示し、その前にCAR設計とこれらの細胞の調製手順について簡単に説明します。このプロトコルは、低酸素反応性CARを利用して、腫瘍外毒性を抑制したCAR-T細胞を生成するための有用なガイドラインを提供することを目的としています。
プロトコル
本研究では、HER2(Gene ID:2064)を標的とする低酸素感受性CARであるHER2-BBz-ODDと、通常のHER2-BBzと比較しました。2つのCARの概略図を 図1Aに示し、HER2-BBz-ODDは、CD3ξのC末端にODD配列を追加することでHER2-BBzから得られることを示しています。2つのCARを発現するレンチウイルスベクターの構築と、293T細胞トランスフェクションによる対応するレンチウイルスの生成は、以前に説明されている31。
1. レンチウイルス感染による低酸素感受性CAR-T細胞の作製
- 凍結保存されたヒト末梢血単核細胞(PBMC)を37°Cで水浴中で急速に解凍します。解凍したPBMCを、400 IUのIL-2、5 ng/mL IL-7、および10 ng/mL IL-15を添加した9 mLの無血清リンパ球培養培地(ヒトT細胞増殖培地、 以下 TGM と呼ぶ)を含む15 mLチューブに移します。
- 細胞計数用の分注を取った後、チューブを300 × g で5分間遠心分離します。ペレット化したPBMCをTGMで4×106 細胞/mLの密度で再懸濁し、懸濁液を6ウェルプレートに移します。
- 抗hCD3/hCD28コーティング免疫ビーズを調製します。
- 100 μLのマウスIgG磁気ビーズを1.5 mLの微量遠心チューブに移し、PBS付き磁気スタンドを使用して2回洗浄します。
- ビーズを100 μLのPBSに再懸濁し、0.2 μgのマウス抗ヒトCD3抗体と2 μgのマウス抗ヒトCD28抗体を加えます。ピペットを使用して混合物を穏やかに混合し、4°Cで一晩揺らします。
- PBS入りマグネットスタンドでビーズを2回洗浄し、PBS100μLに再懸濁します。
- ステップ1.2で、抗hCD3/hCD28でコーティングされた免疫ビーズをビーズ対細胞比1:1でプレートに添加します。プレートを5%CO2 の加湿インキュベーターに37°Cで置きます。
- インキュベーションの48時間後、ピペットで細胞を穏やかに混合した後、細胞懸濁液を15 mLの遠心チューブに移します。チューブを磁気スタンドに3分間置き、上清を新しい15 mLチューブに慎重に移して、PBMCから免疫ビーズを除去します。
- 細胞計数用のアリコートを取り、300 μLのTGM中の5×105 細胞/ウェルのPBMCを48ウェルフラットプレートに播種します。200 μLのレンチウイルスストックを対応するウェルに添加し、硫酸プロタミンを最終濃度10 μg/mLまで添加します。
- プレートを1,000 × g、32°Cで1.5時間遠心分離し、ピペットを使用して各ウェルから300 μLの上清を慎重に除去して廃棄します。次に、ピペットを使用して1 mLの新鮮なTGMを加え、プレートを5%CO2 で37°Cの加湿インキュベーターに入れます。
- 新鮮なTGMを添加して、細胞密度を0.5-2×2〜3日ごとに106 細胞/ mLに調整します。まず、細胞を12ウェルプレートに移し、次に6ウェルプレートに移します。総数が4mLの容量で6×106 に達するまで細胞を培養し続けます。
注:並行して、上記と同じ手順に従ってJurkat T細胞のCAR形質導入を実施するが、TGMが10%ウシ胎児血清(FBS)を含む培地RPMI1640置換される点を除いて。
2. フローサイトメトリーを用いたCAR-T細胞における酸素依存性CAR発現の評価
- ステップ1.8のCAR形質導入T細胞を、2.5 × 106細胞/ウェルの密度で2つの12ウェルプレートに2つのTGM中にプレート化します。1つのプレートを5%のCO2を37°Cで加湿したインキュベーターに直接入れ(細胞培養の標準条件は21%のO2であるため、正常酸素状態)、もう1つのプレートをO2レベルが1%にプリセットされた移動式CO2/O2/N2インキュベーターチャンバー(低酸素状態)に置き、チャンバーを加湿状態に保ちます。 5% CO2/94% N2 インキュベーター、37 °C。
- 24時間ごとに、低酸素または正常酸素条件下でプレートから5個×10個の5 細胞を1.5mLの微量遠心チューブに収集します。チューブを500 × g で5分間遠心分離し、上清を取り除き、ピペッティングにより細胞を1 mLのPBSに穏やかに再懸濁します。PBSウォッシュをもう一度繰り返します。
- ペレット化した細胞を、各チューブ内の50 μLのFACSバッファー(PBSに2% FBSを添加)に再懸濁します。1:100希釈のPE標識抗Flag抗体(0.2 μg/mL)を50 μL加え、ピペッティングで十分に混合します。暗所で室温で20分間インキュベートします。
- インキュベーションの終了時に、各チューブに1 mLのFACSバッファーを加えます。ピペッティングで十分に混合し、500 × g で5分間遠心分離します。
- ピペットを使用して上清を慎重に取り除いて廃棄し、手順2.4をもう一度繰り返します。
- ピペットを使用して上清を慎重に取り除き、廃棄します。細胞を200μLのFACSバッファーに再懸濁し、得られた細胞懸濁液を5mLのフローチューブに移します。
- ステップ2.6で細胞懸濁液のフローサイトメトリーを行い、表面のCAR発現を決定します。トランスフェクションされていないT細胞をネガティブコントロールとして含めます。
- FSC/SSCおよびFSC-A/FSC-Hゲートを使用して、生細胞をスクリーニングします。サンプルごとに 1 つ× 10つの 4 つのライブ シングル イベントを収集します。EGFP(形質導入に成功したT細胞の指標としてレンチウイルスベクターに運ばれる構成マーカー)に陽性の細胞をゲートし、次にフィコエリトリン(PE)に陽性の細胞(CAR発現細胞)をゲートして、PE陽性と蛍光強度中央値(MFI)を測定します。
3. CAR修飾Jurkat T細胞におけるCAR発現の酸素依存性をウェスタンブロットで解析
- セクション1のCAR形質導入Jurkat T細胞を、ウェルあたり5×10個の5 細胞/ウェル(培養容量500μL)の密度で2つの48ウェルプレートに10%FBSの培地でRPMI1640プレート化します。
- 1枚のプレートについて、CoCl2を実験ウェルに添加し、最終濃度を0 μM、50 μM、または200 μMにします。次に、プレートを加湿した5%CO2インキュベーターに37°C(正常酸素状態)で置きます。もう一方のプレートについては、CoCl2を添加せず、O2レベルを1%(低酸素状態)にプリセットした移動式CO2/O2/N2インキュベーターチャンバーに入れてから、同じインキュベーターに移してください。
- インキュベーションの24時間後、細胞懸濁液を1.5 mLの微量遠心チューブに移します。チューブを500 × g で5分間遠心分離します。まず 1 mL ピペット、次に 100 μL ピペットを使用して上清を完全に除去して廃棄し、細胞ペレットを 50 μL の 1x SDS-PAGE サンプルバッファーに再懸濁します。
- サンプルを沸騰水浴で10分間加熱します。直ちにチューブを氷上に30秒間置き、次に16,000 × g で30秒間遠心分離します。
- 透明化したサンプル30 μLを、厚さ1.5 mmの10ウェル10% SDS PAGEゲルの各スロットにロードします。ゲルを80Vで30分間運転し、その後電圧を100Vに上げて1.5時間運転します。
- 電気泳動の最後に、電流と持続時間をそれぞれ400mAと1時間に設定する標準的な湿式転写法を使用して、ゲルからPVDFメンブレンにタンパク質を移します。
- メンブレンをブロッキングバッファー(PBST(PBS+0.05% Tween-20)の5%ミルク(w/v))で室温で1時間ブロッキングします。次に、GAPDHローディング制御の検出用に30 kDから40 kDのピースを切り取り、CAR分子の検出用に50 kDから70 kDのピースを切り取ります。
- 30-40 kDおよび50-70 kDのピースを、マウス抗GAPDH抗体(1:2,000希釈)およびマウス抗フラグ抗体(1:2,000希釈)とそれぞれ3 mLのブロッキングバッファーで、室温で2時間または4°Cで一晩インキュベートします。
- メンブレンをPBSTで室温でプラットフォームロッカーで3 x 5分間洗浄します。
- HRP標識ヤギ抗マウス抗体(1:5,000希釈)とメンブレンを3 mLのブロッキングバッファーで室温で1時間インキュベートします。次に、メンブレンをPBSTで5 x 10分間洗浄します。
- HRP基質とインキュベートしてメンブレンを作製し、検出されたタンパク質バンドを発光イメージアナライザーで可視化します。
4. 低酸素感受性CAR-T細胞による細胞毒性の酸素依存性に関する in vitro 評価
- 0日目に、2つの黒色平底96ウェル組織培養プレートに10%FBSを含むDMEMの200μLに、実験ウェルごとに1×10個の4 つの標的細胞(SKOV3-Luc細胞)をシードします。
- 1日目に、各ウェルの上部から100μLの上清を慎重に取り除きます。10% FBSを含むDMEM培地100 μLに、CAR-T細胞または非形質導入T細胞を、エフェクター対ターゲット比1:1、2:1、および4:1で添加します。
- ステップ2.1で説明したように、移動式のCO2/O2/N2インキュベーターチャンバーを使用して、1つのプレートを21%O2雰囲気に置き、もう1つのプレートを1%O2雰囲気に置きます。
注:移動式のCO2/O2/N2 インキュベーターチャンバーが利用できない場合は、CoCl2 を培地に添加して低酸素状態を模倣することができます。 - 2日目に、24時間の共培養後、ピペットを使用して、すべての上清(約150〜200μL)を新しいU底96ウェルプレートに慎重に移します。後でサイトカインを検出するために、セクション5で概説した手順に従って、-20°Cで保存してください。
- ステップ4.4の黒色平底96ウェルプレートの各実験ウェルに、1xパッシブ溶解バッファー60 μLを添加します。次に、プレートをシェーカーに置き、30分間振とうして、効率的な細胞溶解を確保します。
- 各実験ウェルに60 μLのホタルルシフェラーゼ基質を添加し、マイクロプレートリーダーを使用してルシフェラーゼ活性を直ちに測定します。
- 式 (1) を使用して正規化された細胞毒性 (%) を計算します。
正規化された細胞毒性 (%) = 100 -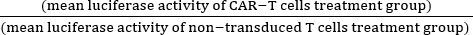 ×100 (1)
×100 (1)
5. 低酸素感受性CAR-T細胞によるIL-2およびIFN-γ分泌物の検出
- 0日目に、コーティングバッファーでIL-2またはIFN-γ捕捉抗体を1:250に希釈して調製します。希釈した抗体100 μLを96ウェルELISAプレートの各ウェルに加え、プレートを4°Cで一晩インキュベートします。
注:コーティングバッファーは、7.13 gのNaHCO3 と1.59 gのNa2CO3 を1 Lの蒸留水に溶解し、pHを9.5に調整することによって作成されます。 - 1日目に、プレートを激しく逆さまにして未吸着の捕捉抗体を除去し、200 μLのWash Buffer(0.05% Tween 20を含むPBS)でウェルを3回洗浄します。
- 200 μLのアッセイ希釈液(10% FBSを含むPBS)を各ウェルに加え、室温で1時間インキュベートします。
- プレートを激しく逆さまにして溶液を捨てます。次に、ウェルを200 μLのWash Bufferで3回洗浄します。
- ステップ4.4で採取した凍結した上清サンプル/プレートを室温で解凍します。完全に解凍したら、サンプルとスタンダードをAssay Diluentで希釈します。希釈したサンプルまたは標準試料100 μLをコーティングしたELISAプレートの各ウェルに加え、室温で2時間インキュベートします。
注:IL-2検出には10倍希釈が推奨されますが、IFN-γ検出には50倍希釈が推奨されます。 - プレートを激しく裏返してサンプルとスタンダードを取り出し、ウェルごとに200μLのウォッシュバッファーでウェルを5回洗浄します。
- IL-2検出抗体またはIFN-γ検出抗体/ストレプトアビジン-HRP(SAv-HRP)をアッセイ希釈液中で1:250の比率で希釈することにより、有効な検出溶液を調製します。100 μLの作業検出溶液を各ウェルに加え、プレートを室温で1時間、穏やかに振とうしながらインキュベートします。
- 溶液を廃棄し、200 μLのWash Bufferでウェルを7回洗浄します。
- 各ウェルに100 μLのSubstrate Reagentを添加し、プレートを室温で暗所で30分間インキュベートします。
- 各ウェルに50 μLのストップ溶液(1 M H2SO4)を加えます。マイクロプレートリーダーを使用して、すぐに450nmの吸光度を読み取ります。
結果
HIF-1αのODDドメインをCAR部分に融合させることは、低酸素感受性CARを生成するための主要な戦略です。この研究で分析された低酸素感受性HER2標的CARは、HER2-BBz-ODDと名付けられ、ODD配列を従来のHER2-BBzに統合することにより、この戦略を使用して構築されました(図1A)。本研究では、レンチウイルス形質導入を用いてHER2-BBz-ODD CARまたはHER2-BBz CARを発現させ、その後、ヒトPBMCとJurkat T細胞の2種類の細胞で酸素感受性を調べました。
最初の試験は、低酸素条件下でのCARの発現と正常酸素条件下でのCARの発現であり、フローサイトメトリーによるCAR形質導入PBMC由来T細胞とウェスタンブロッティングによるCAR形質導入Jurkat T細胞の両方で行われました。CAR形質導入PBMC由来T細胞の設定では、HER2-BBz-ODD CARは、CAR陽性細胞の割合と蛍光強度(MFI)の中央値の両方において、1%O2 未満の方が21%O2 未満よりも有意に高い発現を示したことが観察されました(図1B)。CAR形質導入Jurkat T細胞の免疫ブロッティング分析では、HER2-BBz-ODDの低酸素依存性誘導も確認されました。
この文脈では、低酸素症の化学的誘導物質であるCoCl2を培地に添加することで、低酸素状態を便利に模倣できることは注目に値します。 図1Cに示すように、当社のイムノブロッティングの結果は、50または200μMのCoCl2 への曝露が1%O2への曝露の影響を再現し、HER2-BBz-ODD CARの発現を顕著に誘導したが、HER2-BBz CARの発現は顕著に誘導しなかったことを実証した。低酸素感受性CARの機能特性評価は、PBMC由来のCAR-T細胞を用いて行いました。この研究では、ホタルルシフェラーゼを保有するSKOV-3細胞株を標的細胞株として利用しました。この設定により、共培養されたCAR-T細胞によって媒介される細胞毒性を評価するためのプロキシとして、標的細胞関連ルシフェラーゼ活性を測定することができました。
図1Dに示すように、HER2-BBz CAR-T細胞は、大気が正常酸素性か低酸素性かに関係なく、標的細胞を効果的に殺すことが示されました。対照的に、HER2-BBz-ODD CAR-T細胞は、調査した3つのE:T比すべてについて、正常酸素条件下で有意に弱い細胞毒性を示しました。しかし、それらの細胞毒性は、低酸素状態にさらされると有意に増加しました。IL-2およびIFN-γの上清レベルも、CAR-T細胞を標的細胞と24時間共培養した後、ELISAによって測定されました。どちらのサイトカインでも、HER2-BBz-ODD CAR-T細胞では、21%O2と比較して1%O2未満の分泌が高いことが観察され、これは細胞毒性データと一致しています。対照的に、HER2-BBz CAR-T細胞は、21%O2と比較して1%O2未満の2つのサイトカインの分泌が低いことを示し、低酸素が細胞活性に悪影響を与えることを示しています(図1E)。まとめると、これらの結果は、HER2-BBz-ODD CARの低酸素感受性を説得力を持って検証しました。
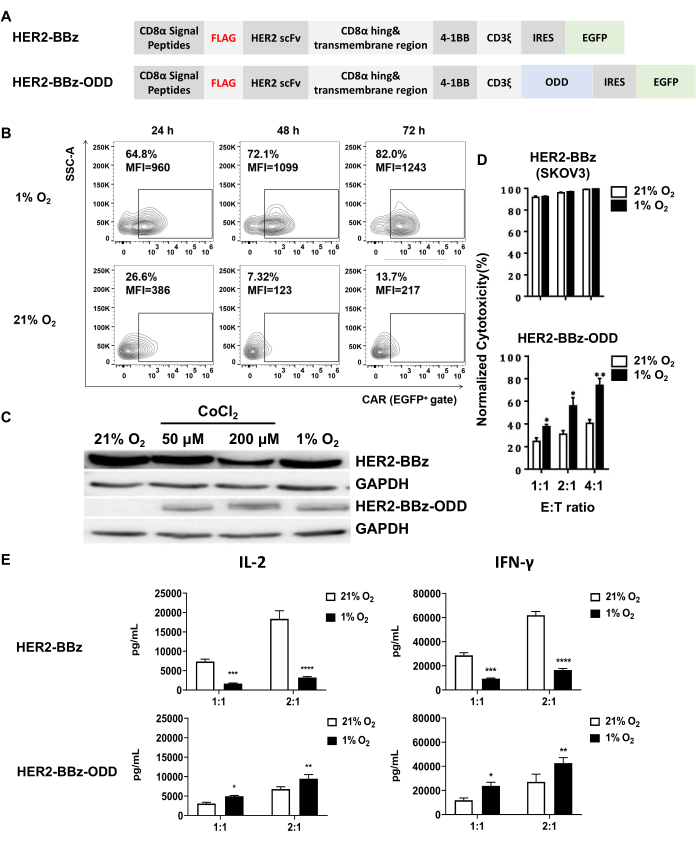
図1:低酸素感受性CAR-T細胞の構築と特性評価 (A)低酸素感受性CARであるHER2-BBz-ODDと、その従来型に対応するHER2-BBzの設計の概略図。両CARは、N末端CD8αシグナルペプチド、FLAGタグ、ヒトHER2標的scFv、CD8ヒンジおよび膜貫通ドメイン、および4-1BBの共刺激ドメイン、CD3ξシグナル伝達ドメイン、IRES、およびEGFPからなる細胞内部分から構成されています。HER2-BBz-ODDは、ODDドメインがCD3ξシグナル伝達ドメインのC末端に融合している点がHER2-BBzと異なり、正常酸素条件下でユビキチン依存性の分解を促進することにより、低酸素依存性発現を可能にします。(B,C)HER2-BBz-ODD CARの酸素依存性発現の評価。(B)1つの評価は、フローサイトメトリーを使用して1%または21%O2 未満で24時間、48時間、または72時間培養した後、ヒトPBMC由来CAR-T細胞で実施されました。(C)もう1つの評価は、CAR形質導入Jurkat T細胞を用いたもので、細胞溶解物を21%O2、50または200μMCoCl 2、または1%O2 未満で培養してから24時間後に回収し、ウェスタンブロッティングを用いてCAR発現について分析し、HER2-BBz CAR形質導入細胞を対照として含めた。(D,E)異なる酸素条件下でのCAR-T細胞の in vitro 細胞毒性とサイトカイン分泌。(D)CAR-T細胞を、ホタルルシフェラーゼ発現SKOV3細胞と示されたE:T比が1%または21%O2未満で共培養した。共培養の24時間後、非形質導入T細胞と比較した細胞関連ホタルルシフェラーゼ活性の変化を測定することにより、標的細胞の殺傷効率を決定しました。(E)上清は、分泌されたIL-2およびIFN-γを検出するために収集されました。結果は、平均± SEM (n = 3 人の健康なドナー) として表示されます (****p < 0.0001)。略語: scFv = single-chain fragment variable;CAR=キメラ抗原受容体。パネル C と D はLiao et al.31から採用されています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
安全性に関する懸念は、CAR-T細胞療法が臨床使用に進むために対処しなければならない重要な問題です。腫瘍細胞またはTMEのユニークな特性を利用することは、腫瘍組織を選択的に標的とするCAR-T細胞の開発に焦点を当てた主要な研究の方向性となっています。低酸素感受性CAR-Tの設計は、この方向での魅力的な戦略であり、この研究で提示されたアプローチ、つまりCAR部分を天然に存在する低酸素感知ODDタンパク質ドメインと融合させるアプローチなど、いくつかのアプローチが検討されています。別のアプローチとして、CAR発現を促進するために一般的に使用される構成的プロモーターを、以前の研究で有望視されている低酸素応答要素(HRE)に置き換える方法があります。HRE要素とODD要素(野生型または発現をより厳密に制御できるエンジニアリングバージョン)を組み合わせることは、低酸素誘導性CARの最適な設計であると考えられています。
このプロトコルは、低酸素感受性CAR-T細胞を生成および検証するための実験手順を概説しています。このプロトコルの実装には、いくつかの重要な考慮事項が含まれます。主な考慮事項は、低酸素状態の作成です。この2つのアプローチの間で、CoCl2の培養培地への添加は、主にその利便性のおかげで、以前の低酸素関連研究で広く使用されてきた32,33。ただし、このアプローチで模倣される低酸素症の程度を測定することは不可能です。対照的に、移動式のCO2/O2/N2インキュベーションチャンバーを使用すると、O2レベルを正確に設定できるため、CAR-T細胞の低酸素感受性の精密分析に適しているという利点があります。この点で、腫瘍内の低酸素レベルは、固形腫瘍の異なるタイプおよび腫瘍進行の異なる期間34間で異なり、一方、プロトコルではわずか1%のO2が例示されている。研究者にとっては、実際の需要に応じて酸素レベルを調整するのが最適な方法です。CoCl2法が唯一の利用可能なアプローチである場合は、さまざまな酸素レベルをシミュレートするために、アッセイにさまざまなCoCl2濃度を含めることをお勧めします。
低酸素依存性CAR発現を調べるための適切な方法を選択することも、重要な検討事項です。CAR形質導入Jurkat T細胞のイムノブロッティング解析は、CARコンストラクトの最適化において便利な選択肢ですが、フローサイトメトリーによるCAR形質導入ヒトPBMCの表面CAR発現に対する酸素レベルの影響の解析は、究極の検証となります。低酸素感受性CARの改良版、すなわちHiTA-CAR35で以前に行ったように、低酸素状態から正常酸素状態への移行に応じたCAR発現のダイナミクスを調べるのが最適です。これは、低酸素制限CAR発現をさらに実証します。
低酸素感受性CAR-T細胞の機能検証のために、プロトコルで概説されている細胞毒性アッセイには、ホタルルシフェラーゼを運ぶ標的細胞を使用することが含まれます。このレポーターベースのアッセイは、CCK8法やリアルタイム細胞解析(RTCA)法など、非改変腫瘍細胞を使用できる他の殺傷評価法に置き換えることができます。RTCA分析は、CAR-T細胞のリアルタイムの殺傷速度を測定するのにも有利です。CAR-T細胞によって引き起こされる特異的な細胞毒性を測定するには、形質導入されていないPBMCをコントロールとして含める必要があります。PBMCの高い形質導入効率は、実験群と対照群の間で検出される細胞毒性の違いが、添加されるエフェクター細胞の量が異なることによって媒介される非特異的な殺傷から生じるという懸念を回避するために望ましい。
このプロトコルにはいくつかの制限があります。低酸素状態は、標的細胞とT細胞の両方の生存率に影響を与える可能性があり36,37、これは、CAR-T細胞媒介性細胞毒性に無関係の細胞死がアッセイ結果の解釈を混乱させる可能性があるという懸念をもたらす。アッセイの直前に、CAR-T細胞と標的細胞の両方が優れた生存率を持っていることを確認することが、このような懸念を回避または最小限に抑えるために提案されています。また、in vitroバリデーションはin vivo翻訳の成功を保証するものではないことにも注意してください。低酸素感受性CAR-T候補が、標的抗原を発現する正常組織を標的とすることを避けることができるかどうかを確認するためには、常にin vivo評価が必要です
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
この研究は、National Key Research and Development Program of China(2016YFC1303402)、National Megaproject on Key Infectious Diseases(2017ZX10202102、2017ZX10304402-002-007)、および上海市衛生委員会のGeneral Program(201740194)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL Centrifuge tube | QSP | 509-GRD-Q | Supernatants and cells cellection Protocol Step 2,3,4 |
| 10% ExpressCast PAGE | NCM biotech | P2012 | Immunoblotting Protocol Step 3 |
| 10x PBS | NCM biotech | 20220812 | Cell culture Protocol Step 4 |
| 10 mL pipette | Yueyibio | YB-25H | Pipetting Protocol Step 1 |
| 10xTRIS-Glycine-SDS electrophoresis buffer | Epizyme | 3673020 | Immunoblotting Protocol Step 3 |
| 15 mL Centrifuge tube | Thermo Scientific | 339650 | Supernatants and cells cellection Protocol Step 1 |
| 25 cm2 EasYFlask | Thermo Scientific | 156367 | Cell culture Protocol Step 3,4 |
| 4x Protein SDS PAGE Loading Buffer | Takara | 9173 | Immunoblotting Protocol Step 3 |
| 6-well flat-bottom tissue culture plates | Thermo Scientific | 140675 | T Cells culture Protocol Step 1 |
| 96-well black flat-bottom tissue culture plates | Greiner | 655090 | Cytotoxicity assay Protocol Step 4 |
| 96-well ELISA plates | Corning | 3590 | ELISA Protocol Step 5 |
| 96-well plate shaker | QILINBEIER | MH-2 | Shake Protocol Step 4 |
| 96-well U-bottom tissue culture plates | Thermo Scientific | 268200 | Supernatants cellection Protocol Step 4,5 |
| anti-FLAG antibody | Sigma | F1804-50UG | Immunoblotting Protocol Step 3 |
| Carbinol | Sinopharm | 10010061 | Immunoblotting Protocol Step 3 |
| Carbon dioxide incubator | Thermo Scientific | 360 | Cell culture Protocol Step 1,2,3,4 |
| Cell counting plate | Hausser scientific | 1492 | Cell counting Protocol Step 1,3,4 |
| CELLection Pan Mouse IgG Kit | Thermo Scientific | 11531D | Mouse IgG magnetic beads Protocol Step 1 |
| Centrifuge | Thermo Scientific | 75002432 | Cell culture Protocol Step 1,3,4 |
| Chemiluminescence gel imaging system | BIO-RAD | 12003154 | Immunoblotting Protocol Step 3 |
| Cobalt chloride solution (0.5 M) | bioleaper | BR4000203 | Hypoxic condition Protocol Step 2,3,4 |
| DMEM | Corning | 10-103-CV | Cell culture Protocol Step 4 |
| Electronic balance | Sartorius | PRACTUM612-1CN | weigh Protocol Step 5 |
| FBS | BI | 04-001-1ACS | Cell culture Protocol Step 3,4 |
| GAPDH Mouse mAb | ABclonal | AC002 | Immunoblotting Protocol Step 3 |
| Gel electrophoresis apparatus | BIO-RAD | 1645070 | Immunoblotting Protocol Step 3 |
| GloMax Microplate Readers | Promega | GM3000 | luciferase activity measurement Protocol Step 4 |
| Goat anti-Mouse IgG (H+L) | Yeasen | P1126151 | Immunoblotting Protocol Step 3 |
| High speed microfreezing centrifuge | eppendorf | 5810 R | Cell culture Protocol Step 1 |
| Human IFN-γ ELISA Set | BD | 555142 | ELISA Protocol Step 5 Items: Recombinant Human IFN-γ Lyophilized Standard, Detection Antibody Biotin Anti-Human IFN-γ , Capture Antibody Purified Anti-Human IFN-γ, Enzyme Reagent Streptavidin-horseradish peroxidase conjugate (SAv-HRP) |
| Human IL-2 ELISA Set | BD | 555190 | ELISA Protocol Step 5 Items: Recombinant Human IL-2 Lyophilized Standard, Detection Antibody Biotin Anti-Human IL-2 , Capture Antibody Purified Anti-Human IL-2, Enzyme Reagent Streptavidin-horseradish peroxidase conjugate (SAv-HRP) |
| IL-15 | R&D systems | P40933 | T Cells culture Protocol Step 1 |
| IL-21 | Novoprotein | GMP-CC45 | T Cells culture Protocol Step 1 |
| IL-7 | R&D systems | P13232 | T Cells culture Protocol Step 1 |
| Inverted microscope | Olympus | CKX41 | Cell culture Protocol Step 1,3,4 |
| Jurkat | ATCC | TIB-152 | CAR-Jurkat construction Protocol Step 3 |
| LSRFortessa | BD | LSRFortessa | Flow cytometry Protocol Step 2 |
| Luciferase Assay System | Promega | E1501 | luciferase reporter assay Protocol Step 4 Items: Passive lysis buffer, firefly luciferase substrate |
| Microplate reader | BioTek | HTX | ELISA Protocol Step 5 |
| mobile CO2/O2/N2 Incubator Chamber | China Innovation Instrument Co., Ltd. | Smartor118 | Hypoxic condition Protocol Step 2, 3, 4 |
| Mouse Anti-Hexa Histidine tag | Sigma | SAB2702218 | Immunoblotting Protocol Step 3 |
| NcmBlot Rapid Transfer Buffer | NCM biotech | WB4600 | Immunoblotting |
| NcmECL Ultra | NCM biotech | P10300 | Immunoblotting Protocol Step 3 Items: NcmECL Ultra Luminol/Enhancer Reagent (A) ,NcmECL Ultra Stabilized Peroxide Reagent (B) |
| NovoNectin -coated 48-well flat plates | Novoprotein | GMP-CH38 | CAR-T cells construction Protocol Step 1 |
| OPD (o-phenylenediamine dihydrochloride) tablet set | Sigma | P9187 | Substrate Reagent Protocol Step 5 Items: OPD tablet (silver foil),urea hydrogen peroxide tablet (gold foil) |
| PE-conjugated anti-DYKDDDDK | Biolegend | 637310 | Flow cytometry Protocol Step 2 |
| Protamine sulfate | Sigma | P3369-1OG | Lentivirus infection Protocol Step 1 |
| Protein Marker 10 Kda-250 KDa | Epizyme | WJ102 | Immunoblotting Protocol Step 3 |
| Purifed NA/LE Mouse Anti-Human CD3 | BD | 566685 | T Cells culture Protocol Step 1 |
| Purified NA/LE Mouse Anti-Human CD28 | BD | 555725 | T Cells culture Protocol Step 1 |
| PVDF membrane | Millipore | 168627 | Immunoblotting Protocol Step 3 |
| RPMI 1640 | Corning | 10-040-CVRC | Cell culture Protocol Step 3 |
| Skim milk powder | Yeasen | S9129060 | Immunoblotting Protocol Step 3 |
| SKOV3-Luc | ATCC | HTB-77 | Cytotoxicity assay Protocol Step 4 |
| Trypsin-EDTA | NCM biotech | C125C1 | Cell culture Protocol Step 4 |
| Tween 20 | Sinopharm | 30189328 | Immunoblotting Protocol Step 3 |
| Water bath | keelrein | NB014467 | Heating Protocol Step 1 |
| X-VIVO 15 | LONZA | 04-418Q | Serum-free lymphocyte culture medium Protocol Step 1 |
参考文献
- Boardman, A. P., Salles, G. CAR T-cell therapy in large B cell lymphoma. Hematol Oncol. 41 (S1), 112-118 (2023).
- Chen, Y. -. J., Abila, B., Mostafa Kamel, Y. CAR-T: What is next. Cancers. 15 (3), 663 (2023).
- Barsan, V., et al. Tisagenlecleucel utilisation and outcomes across refractory, first relapse and multiply relapsed B-cell acute lymphoblastic leukemia: A retrospective analysis of real-world patterns. eClinicalMedicine. 65, 102268 (2023).
- Liu, Y., et al. Oncolytic herpes simplex virus delivery of dual CAR targets of CD19 and BCMA as well as immunomodulators to enhance therapeutic efficacy in solid tumors combined with CAR-T cell therapy. Front Oncol. 12, 1037934 (2022).
- Liu, C., Qi, T., Milner, J. J., Lu, Y., Cao, Y. Speed and location both matter: Antigen stimulus dynamics controls CAR-T cell response. Front Immunol. 12, 748768 (2021).
- Li, N., et al. Improving the anti-solid tumor efficacy of CAR-T cells by inhibiting adenosine signaling pathway. Oncoimmunology. 9 (1), 1824643 (2020).
- Derenzo, C., Gottschalk, S. Genetic modification strategies to enhance CAR T cell persistence for patients with solid tumors. Front Immunol. 10, 218 (2019).
- Fu, R., et al. Delivery techniques for enhancing CAR T cell therapy against solid tumors. Advanced Functional Materials. 31 (44), 2009489 (2021).
- Johnson, A., Townsend, M., O'Neill, K. Tumor microenvironment immunosuppression: A roadblock to CAR T-cell advancement in solid tumors. Cells. 11 (22), 3626 (2022).
- Liu, Z., et al. Immunosuppression in tumor immune microenvironment and its optimization from CAR-T cell therapy. Theranostics. 12 (14), 6273-6290 (2022).
- Luo, Z., et al. Modulating tumor physical microenvironment for fueling CAR-T cell therapy. Adv Drug Deliv Rev. 185, 114301 (2022).
- Martinez, M., Moon, E. K. CAR T cells for solid tumors: New strategies for finding, infiltrating, and surviving in the tumor microenvironment. Front Immunol. 10, 128 (2019).
- Zhang, X., et al. The immunosuppressive microenvironment and immunotherapy in human glioblastoma. Front Immunol. 13, 1003651 (2022).
- Tie, Y., Tang, F., Wei, Y. Q., Wei, X. W. Immunosuppressive cells in cancer: Mechanisms and potential therapeutic targets. J Hematol Oncol. 15 (1), 61 (2022).
- Wu, Y., et al. Engineering CAR T cells for enhanced efficacy and safety. APL Bioeng. 6 (1), 011502 (2022).
- Al-Haideri, M., et al. cell combination therapy: The next revolution in cancer treatment. Cancer Cell Int. 22 (1), 365 (2022).
- Fuca, G., Reppel, L., Landoni, E., Savoldo, B., Dotti, G. Enhancing chimeric antigen receptor T-cell efficacy in solid tumors. Clin Cancer Res. 26 (11), 2444-2451 (2020).
- Neelapu, S. S., et al. Chimeric antigen receptor T-cell therapy - assessment and management of toxicities. Nat Rev Clin Oncol. 15 (1), 47-62 (2018).
- Mi, J., Ye, Q., Min, Y. Advances in nanotechnology development to overcome current roadblocks in CAR-T therapy for solid tumors. Front Immunol. 13, 849759 (2022).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: Current limitations and potential strategies. Blood Cancer J. 11 (4), 69 (2021).
- Yu, S., Yi, M., Qin, S., Wu, K. Next generation chimeric antigen receptor T cells: Safety strategies to overcome toxicity. Mol Cancer. 18 (1), 125 (2019).
- Dana, H., et al. CAR-T cells: Early successes in blood cancer and challenges in solid tumors. Acta Pharm Sin B. 11 (5), 1129-1147 (2021).
- Van Der Schans, J. J., Van De Donk, N., Mutis, T. Dual targeting to overcome current challenges in multiple myeloma CAR T-cell treatment. Front Oncol. 10, 1362 (2020).
- Andrea, A. E., Chiron, A., Bessoles, S., Hacein-Bey-Abina, S. Engineering next-generation car-t cells for better toxicity management. Int J Mol Sci. 21 (22), 8620 (2020).
- Flugel, C. L., et al. Overcoming on-target, off-tumour toxicity of CAR T cell therapy for solid tumours. Nat Rev Clin Oncol. 20 (1), 49-62 (2023).
- Rababah, F., et al. Chimeric antigen receptor T cells therapy in solid tumors. Clin Transl Oncol. 25 (8), 2279-2296 (2023).
- Masoud, G. N., Li, W. Hif-1alpha pathway: Role, regulation and intervention for cancer therapy. Acta Pharm Sin B. 5 (5), 378-389 (2015).
- Semenza, G. L. Targeting hif-1 for cancer therapy. Nat Rev Cancer. 3 (10), 721-732 (2003).
- Harris, A. L. Hypoxia--a key regulatory factor in tumour growth. Nat Rev Cancer. 2 (1), 38-47 (2002).
- Juillerat, A., et al. An oxygen sensitive self-decision making engineered CAR T-cell. Sci Rep. 7, 39833 (2017).
- Liao, Q., et al. Engineering T cells with hypoxia-inducible chimeric antigen receptor (HiCAR) for selective tumor killing. Biomark Res. 8 (1), 56 (2020).
- Ivan, M., et al. Hifα targeted for vhl-mediated destruction by proline hydroxylation: Implications for o2 sensing. Science. 292 (5516), 464-468 (2001).
- Wang, G. L., Semenza, G. L. Purification and characterization of hypoxia-inducible factor 1. J Biol Chem. 270 (3), 1230-1237 (1995).
- D'alonzo, R. A., et al. In vivo noninvasive preclinical tumor hypoxia imaging methods: A review. Int J Radiat Biol. 97 (5), 593-631 (2021).
- He, H., et al. Conditioned car-t cells by hypoxia-inducible transcription amplification (hita) system significantly enhances systemic safety and retains antitumor efficacy. J Immunother Cancer. 9 (10), e002755 (2021).
- Barsoum, I. B., Smallwood, C. A., Siemens, D. R., Graham, C. H. A mechanism of hypoxia-mediated escape from adaptive immunity in cancer cells. Cancer Res. 74 (3), 665-674 (2014).
- Kroemer, G., Pouyssegur, J. Tumor cell metabolism: Cancer's achilles' heel. Cancer Cell. 13 (6), 472-482 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved