Method Article
Generazione e verifica funzionale di cellule T del recettore dell'antigene chimerico sensibili all'ipossia
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui presentiamo un protocollo per la generazione e la verifica funzionale di cellule T sensibili al recettore chimerico dell'antigene (CAR)-T sensibili all'ipossia. Questo protocollo presenta la generazione di cellule CAR-T sensibili all'ipossia basate su lentivirus e la loro caratterizzazione, inclusa la convalida dell'espressione CAR ipossia-dipendente e della citotossicità selettiva.
Abstract
Studi approfonditi hanno dimostrato la promettenza della terapia cellulare con recettore dell'antigene chimerico T (CAR-T) nel trattamento delle neoplasie ematologiche. Tuttavia, il trattamento dei tumori solidi rimane impegnativo, come esemplificato dai problemi di sicurezza che sorgono quando le cellule CAR-T attaccano le cellule normali che esprimono gli antigeni bersaglio. I ricercatori hanno esplorato vari approcci per migliorare la selettività tumorale della terapia cellulare CAR-T. Una strategia rappresentativa in questo senso è la costruzione di cellule CAR-T sensibili all'ipossia, che sono progettate fondendo un dominio di degradazione dipendente dall'ossigeno con la porzione CAR e sono strategiche per ottenere un'elevata espressione di CAR solo in un ambiente ipossico, il microambiente tumorale (TME). Questo articolo presenta un protocollo per la generazione di tali cellule CAR-T e la loro caratterizzazione funzionale, inclusi metodi per analizzare i cambiamenti nell'espressione di CAR e nella capacità di uccisione in risposta a diversi livelli di ossigeno stabiliti da una camera di incubazione mobile. Si prevede che le cellule CAR-T costruite dimostrino l'espressione e la citotossicità di CAR in modo sensibile all'ossigeno, supportando così la loro capacità di distinguere tra TME ipossico e tessuti normali normossici per l'attivazione selettiva.
Introduzione
La terapia con cellule T del recettore dell'antigene chimerico (CAR-T) ha rappresentato una svolta significativa nel trattamento del cancro. Da quando la Food and Drug Administration (FDA) ha approvato la prima terapia CAR-T per il trattamento del linfoma avanzato/resistente e della leucemia linfoblastica acuta nel 2017 1,2,3, 10 terapie CAR-T mirate al CD19 o all'antigene di maturazione delle cellule B (BCMA) hanno ricevuto l'approvazione a livello globale4. Tuttavia, nonostante un'ampia ricerca, replicare la notevole efficacia della terapia CAR-T nel trattamento delle neoplasie ematologiche rimane difficile per la sua applicazione ai tumori solidi 5,6,7,8.
Il microambiente tumorale immunosoppressivo (TME) è uno dei principali fattori che contribuiscono alla scarsa efficacia delle CAR-T nel contesto dei tumori solidi. Il TME ostacola l'attività e la sopravvivenza delle cellule CAR-T a causa dell'insufficienza dei nutrienti, dell'ipossia, del pH acido e dell'accumulo di scorie metaboliche 9,10,11,12. Un'ulteriore ostilità deriva dall'infiltrazione di cellule immunosoppressive come le cellule T regolatorie (Treg), le cellule soppressori di derivazione mieloide (MDSC) e i macrofagi associati al tumore (TAM), che, insieme alle cellule tumorali, secernono citochine immunosoppressive che causano un'ulteriore inibizione delle cellule CAR-T una volta entrate nel tumore13,14.
A parte l'insoddisfacente efficienza terapeutica, i problemi di sicurezza sono un altro tallone d'Achille delle cellule CAR-T quando si tratta di tumori solidi15,16. Il problema della sicurezza deriva dal fatto che nessuno degli antigeni tumore-specifici (TSA) identificati finora è strettamente limitato alle cellule tumorali. In altre parole, gli antigeni associati al tumore (TAA) scelti come bersaglio del CAR, sebbene mostrino una maggiore espressione nelle cellule tumorali, sono spesso espressi anche dai tessuti normali17. Effetti on-target e off-tumor potrebbero quindi verificarsi dall'attivazione inaspettata delle cellule CAR-T dopo il riconoscimento efficiente dei tessuti normali da parte del CAR, portando alla sindrome da rilascio di citochine (CRS), alla sindrome da encefalopatia correlata a CAR-T (CRES)18 e ad altri esiti avversi19.
Sono state esplorate molte strategie per evitare tali effetti, tra cui la diminuzione dell'affinità del CAR per consentire alle cellule CAR-T di distinguere le cellule tumorali dalle cellule normali in base ai livelli di espressione del TAA bersaglio; dotare le cellule CAR-T di un interruttore di spegnimento, come un gene suicida o un marcatore di eliminazione, per promuoverne l'eliminazione in caso di attivazione inaspettata; suddividere i segnali CD3ζ e co-stimolatori in due gruppi CAR, il cui coinvolgimento simultaneo è di conseguenza necessario per un'efficace attivazione delle cellule CAR-T; utilizzando un circuito sintetico basato su Notch (synNotch) che limita l'attività delle cellule CAR-T alle cellule bersaglio che co-esprimono due diversi TAA; e ingegnerizzazione delle cellule CAR-T per raggiungere la sensibilità al TME implementando un meccanismo per sintonizzare l'espressione del CAR al cambiamento dei segnali ambientali 20,21,22,23,24,25,26.
Una considerazione chiave nell'opzione di sensibilità alla TME descritta sopra è il basso livello di ossigeno nella TME dovuto alla rapida proliferazione delle cellule tumorali. L'accomodazione delle cellule tumorali all'ipossia dipende dall'attivazione del fattore 1 inducibile dall'ipossia (HIF-1), un fattore trascrizionale eterodimerico costituito da una subunità inducibile, HIF-1α, e da una subunità costitutivamente espressa, HIF-1β27. In condizioni normossiche, la proteina HIF-1α subisce ubiquitinazione e una rapida degradazione proteasomiale, dipendente dal suo dominio di degradazione ossigeno-dipendente (ODD)28. Quando l'apporto cellulare di ossigeno diventa limitato, HIF-1 si stabilizza e attiva la trascrizione dei suoi geni bersaglio a valle legandosi agli elementi di risposta all'ipossia (HRE)29. Data la natura dell'ODD e dell'HRE come elementi sensibili all'ossigeno, sono stati studiati per realizzare l'espressione condizionale dei CAR all'interno dell'ipossica TME30. Qui, presentiamo un protocollo incentrato sui metodi per la caratterizzazione fenotipica e funzionale delle cellule CAR-T sensibili all'ipossia, preceduto da una breve descrizione del design CAR e delle procedure di preparazione di queste cellule. Questo protocollo intende fornire una linea guida utile per sfruttare il CAR sensibile all'ipossia per generare cellule CAR-T con ridotta tossicità off-tumore.
Protocollo
In questo studio, HER2-BBz-ODD, un CAR sensibile all'ipossia che ha come bersaglio HER2 (ID gene: 2064) è stato confrontato con la sua controparte regolare, HER2-BBz. Gli schemi dei due CAR sono illustrati nella Figura 1A, che mostra che HER2-BBz-ODD è derivato da HER2-BBz aggiungendo la sequenza ODD al C-terminale di CD3ξ. La costruzione di vettori lentivirali che esprimono i due CAR e la generazione del lentivirus corrispondente mediante trasfezione cellulare 293T è stata precedentemente descritta31.
1. Generazione di cellule CAR-T sensibili all'ipossia mediante infezione lentivirale
- Scongelare rapidamente le cellule mononucleate del sangue periferico umano crioconservate (PBMC) a 37 °C in un bagno d'acqua. Trasferire le PBMC scongelate in una provetta da 15 mL contenente 9 mL di terreno di coltura linfocitaria privo di siero integrato con 400 UI di IL-2, 5 ng/mL di IL-7 e 10 ng/mL di IL-15 (terreno di crescita delle cellule T umane, di seguito denominato TGM ).
- Dopo aver prelevato un'aliquota per il conteggio delle cellule, centrifugare la provetta a 300 × g per 5 minuti. Risospendere le PBMC pellettate con TGM a una densità di 4 × 106 cellule/mL e trasferire la sospensione in una piastra a 6 pozzetti.
- Preparare immunosfere rivestite con anti-hCD3/hCD28.
- Trasferire 100 μL di microsfere magnetiche di topo IgG in una provetta da microcentrifuga da 1,5 mL e lavarle 2 volte utilizzando un supporto magnetico con PBS.
- Risospendere le perle in 100 μL di PBS e aggiungere 0,2 μg di anticorpo CD3 umano di topo e 2 μg di anticorpo CD28 anti-umano di topo. Mescolare delicatamente il composto con una pipetta e agitare per una notte a 4 °C.
- Lavare le perle 2 volte utilizzando un supporto magnetico con PBS e risospenderle in 100 μL di PBS.
- Aggiungere immunosfere rivestite con anti-hCD3/hCD28 alla piastra al passaggio 1.2 con un rapporto perlina/cellula di 1:1. Porre la piastra in un'incubatrice umidificata con il 5% di CO2 a 37 °C.
- Dopo 48 ore di incubazione, trasferire la sospensione cellulare in una provetta da centrifuga da 15 mL dopo aver mescolato delicatamente le cellule con una pipetta. Posizionare la provetta su un supporto magnetico per 3 minuti, quindi trasferire con cura il surnatante in una nuova provetta da 15 ml per rimuovere le immunosfere dalle PBMC.
- Prelevare un'aliquota per il conteggio delle cellule, quindi seminare le PBMC a 5 × 105 cellule/pozzetto in 300 μL di TGM in una piastra piana a 48 pozzetti. Aggiungere 200 μL di stock lentivirale nei pozzetti corrispondenti e aggiungere solfato di protamina a una concentrazione finale di 10 μg/mL.
- Centrifugare la piastra a 1.000 × g a 32 °C per 1,5 ore e rimuovere ed eliminare con cura 300 μl di surnatante da ciascun pozzetto utilizzando una pipetta. Quindi, aggiungere 1 mL di TGM fresco utilizzando una pipetta e posizionare la piastra in un incubatore umidificato con il 5% di CO2 a 37 °C.
- Aggiungere TGM fresco per regolare la densità cellulare a 0,5-2 × 106 cellule/mL ogni 2-3 giorni. Iniziare trasferendo le cellule prima in una piastra a 12 pozzetti e poi in una piastra a 6 pozzetti. Continuare a coltivare le cellule fino a quando il numero totale raggiunge 6 × 106 in un volume di 4 ml.
NOTA: Parallelamente, condurre la trasduzione CAR delle cellule T Jurkat seguendo le stesse procedure descritte sopra, tranne per il fatto che la TGM viene sostituita con RPMI1640 terreno contenente il 10% di siero fetale bovino (FBS).
2. Valutazione dell'espressione di CAR ossigeno-dipendente in cellule CAR-T mediante citometria a flusso
- Piastra delle cellule T trasdotte da CAR dal passaggio 1.8 in due piastre da 12 pozzetti a una densità di 2,5 × 106 cellule/pozzetto in 2 mL di TGM. Posizionare una piastra direttamente in un incubatore umidificato con il 5% di CO2 a 37 °C (condizione normossica, poiché la condizione standard per la coltura di cellule ha il 21% di O2) e posizionare l'altra piastra in una camera mobile dell'incubatore CO2/O2/N2 con il livello di O2 preimpostato all'1% (condizione ipossica) e quindi mantenere la camera in un ambiente umidificato, Incubatore al 5% CO2/94% N2 a 37 °C.
- Ogni 24 ore, raccogliere 5 × 105 cellule dalle piastre in condizioni ipossiche o normossiche in provette da microcentrifuga da 1,5 mL. Centrifugare le provette a 500 × g per 5 minuti, rimuovere il surnatante e risospendere delicatamente le cellule in 1 mL di PBS mediante pipettaggio. Ripetere il lavaggio PBS ancora una volta.
- Risospendere le cellule pellettate in 50 μl di tampone FACS (PBS integrato con il 2% di FBS) in ciascuna provetta. Aggiungere 50 μl di diluizione 1:100 di anticorpo anti-Flag coniugato con PE (0,2 μg/mL) e miscelare accuratamente mediante pipettaggio. Incubare al buio a temperatura ambiente per 20 min.
- Al termine dell'incubazione, aggiungere 1 mL di tampone FACS a ciascuna provetta. Miscelare accuratamente pipettando, quindi centrifugare a 500 × g per 5 minuti.
- Rimuovere ed eliminare con cautela il surnatante utilizzando una pipetta e ripetere il passaggio 2.4 ancora una volta.
- Rimuovere con cautela ed eliminare il surnatante utilizzando una pipetta. Risospendere le cellule in 200 μl di tampone FACS, quindi trasferire la sospensione cellulare risultante in provette di flusso da 5 mL.
- Eseguire la citometria a flusso sulla sospensione cellulare nella fase 2.6 per determinare l'espressione di CAR di superficie. Includere le cellule T non trasfettate come controllo negativo.
- Utilizzare i gate FSC/SSC e FSC-A/FSC-H per lo screening di singole celle in tempo reale. Raccogli 1 × 104 eventi singoli dal vivo per ogni campione. Gate le cellule positive per EGFP (un marcatore costitutivo trasportato nel vettore lentivirale come indicatore di cellule T trasdotte con successo) e quindi, le cellule positive per la ficoeritrina (PE) (cellule che esprimono CAR) per misurare la positività all'EP e l'intensità mediana della fluorescenza (MFI).
3. Analisi della dipendenza dall'ossigeno dell'espressione di CAR in cellule T Jurkat modificate con CAR mediante western blot
- Piastre le cellule T Jurkat trasdotte con CAR dalla sezione 1 in due piastre da 48 pozzetti a una densità di 5 × 105 cellule per pozzetto (500 μL di volume di coltura) in RPMI1640 terreno con il 10% di FBS.
- Per una piastra, aggiungere CoCl2 ai pozzetti sperimentali fino a una concentrazione finale di 0 μM, 50 μM o 200 μM. Quindi, posizionare la piastra in un'incubatrice umidificata al 5% di CO2 a 37 °C (condizione normossica). Per l'altra piastra, non aggiungere CoCl2 e posizionarla in una camera mobile dell'incubatrice CO2/O2/N2 con il livello di O2 preimpostato all'1% (condizione ipossica) prima di trasferirla nella stessa incubatrice.
- Dopo 24 ore di incubazione, trasferire le sospensioni cellulari in provette da microcentrifuga da 1,5 mL. Centrifugare le provette a 500 × g per 5 min. Rimuovere completamente ed eliminare i surnatanti utilizzando prima una pipetta da 1 mL, poi una pipetta da 100 μL e risospendere i pellet cellulari in 50 μL di 1 tampone campione SDS-PAGE.
- Riscaldare i campioni in un bagno d'acqua bollente per 10 minuti. Posizionare immediatamente la provetta sul ghiaccio per 30 s, quindi centrifugare a 16.000 × g per 30 s.
- Caricare 30 μl dei campioni chiarificati in ciascuna fessura di un gel SDS PAGE a 10 pozzetti, al 10% con uno spessore di 1,5 mm. Far funzionare il gel a 80 V per 30 minuti, quindi aumentare la tensione a 100 V e far funzionare per 1,5 ore.
- Al termine dell'elettroforesi, trasferire le proteine dal gel a una membrana in PVDF utilizzando il metodo standard di trasferimento a umido, con la corrente e la durata impostate rispettivamente a 400 mA e 1 ora.
- Bloccare la membrana nel tampone bloccante (5% latte (p/v) in PBST (PBS+0,05% Tween-20)) per 1 ora a temperatura ambiente. Quindi, ritagliare il pezzo tra 30 kD e 40 kD per il rilevamento del controllo del carico GAPDH e il pezzo tra 50 kD e 70k D per il rilevamento delle molecole CAR.
- Incubare i pezzi da 30-40 kD e 50-70 kD con un anticorpo anti-GAPDH di topo (diluizione 1:2.000) e un anticorpo anti-Flag di topo (diluizione 1:2.000), rispettivamente, in 3 mL di tampone bloccante a temperatura ambiente per 2 ore o a 4 °C durante la notte.
- Lavare le membrane con PBST a temperatura ambiente su una piattaforma a bilanciere per 3 x 5 min.
- Incubare le membrane con anticorpo anti-topo di capra coniugato con HRP (diluizione 1:5.000) in 3 mL di tampone bloccante a temperatura ambiente per 1 ora; quindi lavare la membrana con PBST per 5 x 10 min.
- Sviluppare le membrane incubandole con un substrato HRP, quindi visualizzare le bande proteiche rilevate utilizzando un analizzatore di immagini luminescenti.
4. Valutazione in vitro della dipendenza dall'ossigeno della citotossicità mediata da cellule CAR-T sensibili all'ipossia
- Il giorno 0, il seme 1 ×10 4 cellule bersaglio (cellule SKOV3-Luc) per pozzetto sperimentale in 200 μL di DMEM contenente il 10% di FBS in due piastre di coltura tissutale nere a fondo piatto a 96 pozzetti.
- Il giorno 1, rimuovere con cautela 100 μl di surnatante dalla parte superiore di ciascun pozzetto. Aggiungere cellule CAR-T o cellule T non trasdotte con rapporti effettore/bersaglio di 1:1, 2:1 e 4:1 in 100 μL di terreno DMEM contenente il 10% di FBS.
- Porre una piastra in un'atmosfera di 21% O2 e l'altra in un'atmosfera di 1% O2 utilizzando una camera di incubazione mobile di CO2/O2/N2 , come descritto al punto 2.1.
NOTA: Se non è disponibile una camera di incubazione mobile per CO2/O2/N2 , è possibile utilizzare l'aggiunta di CoCl2 al terreno di coltura per simulare una condizione di ipossia. - Il giorno 2, dopo 24 ore di co-coltura, trasferire con cura tutto il surnatante (circa 150-200 μl) in una nuova piastra a 96 pozzetti con fondo a U utilizzando una pipetta. Conservare a -20 °C per la successiva rilevazione delle citochine, seguendo le procedure descritte nel paragrafo 5.
- Aggiungere 60 μl di tampone di lisi passiva 1x a ciascun pozzetto sperimentale delle piastre nere a fondo piatto da 96 pozzetti del passaggio 4.4. Quindi, posizionare le piastre su uno shaker e agitare per 30 minuti per garantire un'efficiente lisi cellulare.
- Aggiungere 60 μL di substrato di luciferasi di lucciola a ciascun pozzetto sperimentale e misurare immediatamente l'attività della luciferasi utilizzando un lettore di micropiastre.
- Calcolare la citotossicità normalizzata (%) utilizzando l'equazione (1):
Citotossicità normalizzata (%) = 100 -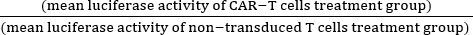 ×100 (1)
×100 (1)
5. Rilevamento della secrezione di IL-2 e IFN-γ da parte delle cellule CAR-T sensibili all'ipossia
- Il giorno 0, preparare una diluizione 1:250 dell'anticorpo di cattura IL-2 o IFN-γ nel tampone di rivestimento. Aggiungere 100 μl di anticorpo diluito a ciascun pozzetto di una piastra ELISA a 96 pozzetti e incubare la piastra a 4 °C per una notte.
NOTA: Il tampone di rivestimento viene prodotto sciogliendo 7,13 g di NaHCO3 e 1,59 g di Na2CO3 in 1 L di acqua distillata e regolando il pH a 9,5. - Il giorno 1, rimuovere l'anticorpo di cattura non adsorbito capovolgendo energicamente la piastra, quindi lavare i pozzetti 3 volte con 200 μl di tampone di lavaggio (PBS contenente lo 0,05% di Tween 20).
- Aggiungere 200 μl di Diluente per saggi (PBS contenente il 10% di FBS) a ciascun pozzetto e incubare a temperatura ambiente per 1 ora.
- Scartare la soluzione capovolgendo energicamente la piastra; quindi, lavare i pozzetti 3 volte con 200 μL di tampone di lavaggio.
- Scongelare i campioni/piastra surnatante congelati dal passaggio 4.4 a temperatura ambiente. Una volta completamente scongelati, diluire i campioni e gli standard con il diluente Assay. Aggiungere 100 μl di campioni o standard diluiti a ciascun pozzetto della piastra ELISA rivestita e incubare a temperatura ambiente per 2 ore.
NOTA: Per la rilevazione di IL-2, si raccomanda una diluizione di 10 volte, mentre per la rilevazione di IFN-γ è preferibile una diluizione di 50 volte. - Rimuovere i campioni e gli standard capovolgendo energicamente la piastra, quindi lavare i pozzetti 5 volte con 200 μL di tampone di lavaggio per pozzetto.
- Preparare una soluzione di rilevazione funzionante diluendo l'anticorpo di rilevazione IL-2 o l'anticorpo di rilevazione IFN-γ/streptavidina-HRP (SAv-HRP) in un rapporto di 1:250 nel diluente del saggio. Aggiungere 100 μl della soluzione di rivelazione di lavoro a ciascun pozzetto e incubare la piastra a temperatura ambiente per 1 ora agitando delicatamente.
- Scartare la soluzione e lavare i pozzetti 7 volte con 200 μL di tampone di lavaggio.
- Aggiungere 100 μl di reagente del substrato a ciascun pozzetto e incubare la piastra a temperatura ambiente per 30 minuti al buio.
- Aggiungere 50 μL di soluzione di arresto (1 M H2SO4) a ciascun pozzetto. Leggere immediatamente l'assorbanza a 450 nm utilizzando un lettore di micropiastre.
Risultati
La fusione del dominio ODD di HIF-1α con la porzione CAR rappresenta una strategia primaria per generare un CAR sensibile all'ipossia. Il CAR bersaglio di HER2 sensibile all'ipossia analizzato in questo studio, denominato HER2-BBz-ODD, è stato costruito utilizzando questa strategia integrando la sequenza ODD nel suo HER2-BBz convenzionale (Figura 1A). In questo studio, abbiamo utilizzato la trasduzione lentivirale per esprimere HER2-BBz-ODD CAR o HER2-BBz CAR e successivamente abbiamo esaminato la loro sensibilità all'ossigeno in due tipi di cellule: PBMC umane e cellule T Jurkat.
Il primo esame è l'espressione di CAR in condizioni di ipossia rispetto a condizioni normossiche, che è stato condotto sia in cellule T derivate da PBMC trasdotte con CAR mediante citometria a flusso che in cellule T Jurkat trasdotte con CAR mediante western blotting. Nel contesto delle cellule T derivate da PBMC trasdotte con CAR, abbiamo osservato che HER2-BBz-ODD CAR aveva un'espressione significativamente più alta inferiore all'1% O2 rispetto al 21% O2 in termini sia di percentuale di cellule CAR-positive che di intensità mediana di fluorescenza (MFI) (Figura 1B). L'analisi di immunoblotting delle cellule T Jurkat trasdotte con CAR ha anche confermato l'induzione ipossia-dipendente di HER2-BBz-ODD.
Vale la pena notare che, in questo contesto, la condizione ipossica può essere convenientemente imitata aggiungendo CoCl2, un induttore chimico dell'ipossia, al terreno di coltura. Come illustrato nella Figura 1C, i risultati dell'immunoblotting hanno dimostrato che l'esposizione a 50 o 200 μM di CoCl2 ricapitola l'effetto dell'esposizione all'1% di O2, inducendo marcatamente l'espressione di HER2-BBz-ODD CAR ma non quella di HER2-BBz CAR. La caratterizzazione funzionale delle CAR sensibili all'ipossia è stata condotta con cellule CAR-T derivate da PBMC. Nello studio, come linea cellulare bersaglio è stata utilizzata una linea cellulare SKOV-3 che trasporta la luciferasi della lucciola. Questa configurazione ci ha permesso di misurare l'attività della luciferasi associata alle cellule bersaglio come proxy per valutare la citotossicità mediata da cellule CAR-T co-coltivate.
Come mostrato nella Figura 1D, le misurazioni hanno indicato che le cellule CAR-T HER2-BBz uccidono efficacemente le cellule bersaglio, indipendentemente dal fatto che l'atmosfera fosse normossica o ipossica. Al contrario, le cellule CAR-T HER2-BBz-ODD hanno mostrato una citotossicità significativamente più debole in condizioni normossiche per tutti e tre i rapporti E:T esaminati. Tuttavia, la loro citotossicità è risultata significativamente aumentata se esposti a condizioni di ipossia. Anche i livelli di surnatante di IL-2 e IFN-γ sono stati misurati mediante ELISA dopo aver co-coltivato cellule CAR-T con cellule bersaglio per 24 ore. Per entrambe le citochine, è stata osservata una secrezione più elevata inferiore all'1% di O2 rispetto al 21% di O2 per le cellule CAR-T HER2-BBz-ODD, il che è coerente con i dati di citotossicità. Al contrario, le cellule CAR-T HER2-BBz hanno mostrato una secrezione inferiore delle due citochine inferiore all'1% di O2 rispetto al 21% di O2, indicando un impatto avverso dell'ipossia sull'attività cellulare (Figura 1E). Nel loro insieme, questi risultati hanno convalidato in modo convincente la natura sensibile all'ipossia di HER2-BBz-ODD CAR.
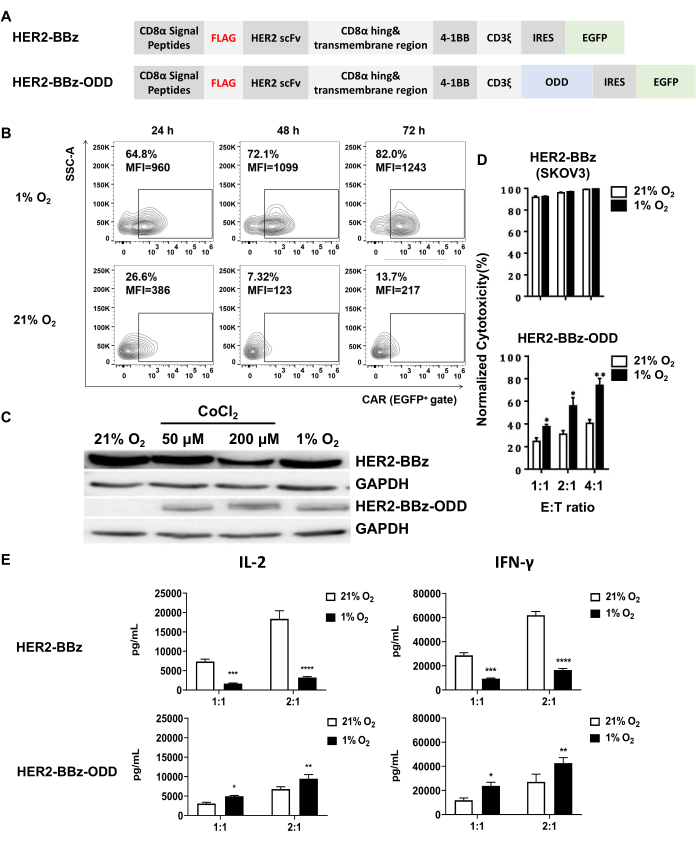
Figura 1: Costruzione e caratterizzazione di cellule CAR-T sensibili all'ipossia. (A) Rappresentazione schematica dei disegni di un CAR sensibile all'ipossia, HER2-BBz-ODD, e della sua controparte convenzionale, HER2-BBz. Entrambe le CAR sono costituite da un peptide segnale CD8α N-terminale, un tag FLAG, un scFv umano mirato a HER2, una cerniera CD8 e un dominio transmembrana e una porzione intracellulare composta da un dominio costimolatorio da 4-1BB, un dominio di segnalazione CD3ξ, un IRES e un EGFP. HER2-BBz-ODD differisce da HER2-BBz per la fusione di un dominio ODD con il C-terminale del dominio di segnalazione CD3ξ, consentendo la sua espressione ipossico-dipendente promuovendo la sua degradazione ubiquitina-dipendente in condizioni normossiche. (B,C) Valutazioni dell'espressione ossigeno-dipendente di HER2-BBz-ODD CAR. (B) Una valutazione è stata eseguita con cellule CAR-T umane derivate da PBMC dopo aver coltivato meno dell'1% o del 21% di O2 per 24, 48 o 72 ore utilizzando la citometria a flusso. (C) L'altra valutazione è stata effettuata con le cellule T Jurkat trasdotte con CAR, in cui i lisati cellulari sono stati raccolti 24 ore dopo la coltura con meno del 21% di O2, 50 o 200 μM di CoCl2, o dell'1% di O2 e analizzati per l'espressione di CAR utilizzando il western blotting, con cellule trasdotte da CAR HER2-BBz incluse come controllo. (D,E) Citotossicità in vitro e secrezione di citochine di cellule CAR-T in diverse condizioni di ossigeno. (D) Le cellule CAR-T sono state co-coltivate con cellule SKOV3 che esprimono luciferasi di lucciola con rapporti E:T indicati inferiori all'1% o al 21% di O2. Dopo 24 ore di co-coltura, l'efficienza di uccisione delle cellule bersaglio è stata determinata misurando la variazione dell'attività della luciferasi della lucciola associata alla cellula rispetto a quella delle cellule T non trasdotte. (E) I surnatanti sono stati raccolti per la rilevazione di IL-2 secreti e IFN-γ. I risultati vengono visualizzati come media ± SEM (n = 3 donatori sani) (****p < 0,0001). Abbreviazioni: scFv = variabile frammento a catena singola; CAR = recettore chimerico dell'antigene. I pannelli C e D sono adattati da Liao et al.31. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
I problemi di sicurezza sono questioni significative che devono essere affrontate affinché qualsiasi terapia cellulare CAR-T passi all'uso clinico. L'utilizzo delle proprietà uniche delle cellule tumorali o della TME è diventata una direzione di ricerca primaria incentrata sullo sviluppo di cellule CAR-T che colpiscono selettivamente i tessuti tumorali. La progettazione di un CAR-T sensibile all'ipossia è una strategia interessante in questa direzione, con diversi approcci in fase di esplorazione, tra cui quello presentato in questo studio, che fonde la porzione CAR con il dominio proteico ODD naturale sensibile all'ipossia. Un approccio alternativo prevede la sostituzione di un promotore costitutivo comunemente utilizzato per guidare l'espressione di CAR con un elemento di risposta all'ipossia (HRE), che si è dimostrato promettente in studi precedenti. Si ritiene che la combinazione di elementi HRE e ODD (versioni wild-type o ingegneristiche che offrono un controllo più stretto dell'espressione) rappresenti un design ottimale per un CAR inducibile dall'ipossia.
Questo protocollo delinea le procedure sperimentali per la generazione e la validazione di cellule CAR-T sensibili all'ipossia. L'attuazione di questo protocollo comporta diverse considerazioni chiave. Una considerazione primaria è la creazione di condizioni ipossiche. Tra i due approcci, l'aggiunta di CoCl2 al terreno di coltura è stata prevalentemente utilizzata in precedenti studi correlati all'ipossia, in gran parte grazie alla sua convenienza32,33. Tuttavia, è impossibile misurare il grado di ipossia imitato da questo approccio. Al contrario, l'utilizzo di una camera di incubazione mobile di CO2/O2/N2 è vantaggioso in quanto i livelli di O2 possono essere impostati con precisione ed è quindi adatto per un'analisi fine della sensibilità all'ipossia delle cellule CAR-T. A questo proposito, il livello di ipossia all'interno dei tumori varia tra i diversi tipi di tumori solidi e i diversi periodi di progressione tumorale34, mentre solo l'1% di O2 è esemplificato nel protocollo. È una pratica ottimale per i ricercatori regolare il livello di ossigeno in base alla domanda effettiva. Se il metodo CoCl2 è l'unico approccio disponibile, si consiglia di includere un intervallo di concentrazioni di CoCl2 nel test per simulare vari livelli di ossigeno.
La scelta di un metodo appropriato per esaminare l'espressione CAR ipossia-dipendente è un'altra considerazione chiave. Mentre l'analisi dell'immunoblotting delle cellule T Jurkat trasdotte con CAR è un'opzione conveniente durante l'ottimizzazione del costrutto CAR, l'analisi dell'effetto dei livelli di ossigeno sull'espressione di CAR di superficie nelle PBMC umane trasdotte da CAR mediante citometria a flusso serve come convalida definitiva. È ottimale esaminare la dinamica dell'espressione di CAR in risposta alla transizione da condizioni ipossiche a condizioni normossiche, come abbiamo fatto in precedenza con una versione migliorata di CAR sensibile all'ipossia, ovvero HiTA-CAR35. Ciò dimostrerebbe ulteriormente l'espressione di CAR ristretta all'ipossia.
Per la verifica funzionale delle cellule CAR-T sensibili all'ipossia, il test di citotossicità delineato nel protocollo prevede l'utilizzo di cellule bersaglio che trasportano luciferasi di lucciola. Questo test basato su reporter può essere sostituito da altri metodi di valutazione dell'uccisione, come il metodo CCK8 e il metodo di analisi cellulare in tempo reale (RTCA), in cui è possibile utilizzare cellule tumorali non modificate. L'analisi RTCA è vantaggiosa anche per misurare la cinetica di uccisione in tempo reale delle cellule CAR-T. Per misurare la citotossicità specifica causata dalle cellule CAR-T, le PBMC non trasdotte devono essere incluse come controllo. Un'elevata efficienza di trasduzione delle PBMC è auspicabile per evitare preoccupazioni che le differenze nella citotossicità rilevata tra i gruppi sperimentali e di controllo derivino da un'uccisione non specifica mediata da quantità variabili di cellule effettrici aggiunte.
Ci sono diverse limitazioni in questo protocollo. Le condizioni di ipossia possono influenzare la vitalità sia delle cellule bersaglio che delle cellule T36,37, il che introduce la preoccupazione che la morte cellulare non correlata alla citotossicità cellulo-mediata CAR-T possa confondere l'interpretazione dei risultati del test. Si consiglia di garantire che sia le cellule CAR-T che le cellule bersaglio abbiano un'eccellente vitalità immediatamente prima del test per evitare o ridurre al minimo tali problemi. Va inoltre notato che la convalida in vitro non garantisce il successo della traduzione in vivo. Le valutazioni in vivo sono sempre necessarie per confermare se il candidato CAR-T sensibile all'ipossia potrebbe evitare di colpire i tessuti normali che esprimono l'antigene bersaglio
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni del National Key Research and Development Program of China (2016YFC1303402), del National Megaproject on Key Infectious Diseases (2017ZX10202102, 2017ZX10304402-002-007) e del Programma generale della Commissione sanitaria municipale di Shanghai (201740194).
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL Centrifuge tube | QSP | 509-GRD-Q | Supernatants and cells cellection Protocol Step 2,3,4 |
| 10% ExpressCast PAGE | NCM biotech | P2012 | Immunoblotting Protocol Step 3 |
| 10x PBS | NCM biotech | 20220812 | Cell culture Protocol Step 4 |
| 10 mL pipette | Yueyibio | YB-25H | Pipetting Protocol Step 1 |
| 10xTRIS-Glycine-SDS electrophoresis buffer | Epizyme | 3673020 | Immunoblotting Protocol Step 3 |
| 15 mL Centrifuge tube | Thermo Scientific | 339650 | Supernatants and cells cellection Protocol Step 1 |
| 25 cm2 EasYFlask | Thermo Scientific | 156367 | Cell culture Protocol Step 3,4 |
| 4x Protein SDS PAGE Loading Buffer | Takara | 9173 | Immunoblotting Protocol Step 3 |
| 6-well flat-bottom tissue culture plates | Thermo Scientific | 140675 | T Cells culture Protocol Step 1 |
| 96-well black flat-bottom tissue culture plates | Greiner | 655090 | Cytotoxicity assay Protocol Step 4 |
| 96-well ELISA plates | Corning | 3590 | ELISA Protocol Step 5 |
| 96-well plate shaker | QILINBEIER | MH-2 | Shake Protocol Step 4 |
| 96-well U-bottom tissue culture plates | Thermo Scientific | 268200 | Supernatants cellection Protocol Step 4,5 |
| anti-FLAG antibody | Sigma | F1804-50UG | Immunoblotting Protocol Step 3 |
| Carbinol | Sinopharm | 10010061 | Immunoblotting Protocol Step 3 |
| Carbon dioxide incubator | Thermo Scientific | 360 | Cell culture Protocol Step 1,2,3,4 |
| Cell counting plate | Hausser scientific | 1492 | Cell counting Protocol Step 1,3,4 |
| CELLection Pan Mouse IgG Kit | Thermo Scientific | 11531D | Mouse IgG magnetic beads Protocol Step 1 |
| Centrifuge | Thermo Scientific | 75002432 | Cell culture Protocol Step 1,3,4 |
| Chemiluminescence gel imaging system | BIO-RAD | 12003154 | Immunoblotting Protocol Step 3 |
| Cobalt chloride solution (0.5 M) | bioleaper | BR4000203 | Hypoxic condition Protocol Step 2,3,4 |
| DMEM | Corning | 10-103-CV | Cell culture Protocol Step 4 |
| Electronic balance | Sartorius | PRACTUM612-1CN | weigh Protocol Step 5 |
| FBS | BI | 04-001-1ACS | Cell culture Protocol Step 3,4 |
| GAPDH Mouse mAb | ABclonal | AC002 | Immunoblotting Protocol Step 3 |
| Gel electrophoresis apparatus | BIO-RAD | 1645070 | Immunoblotting Protocol Step 3 |
| GloMax Microplate Readers | Promega | GM3000 | luciferase activity measurement Protocol Step 4 |
| Goat anti-Mouse IgG (H+L) | Yeasen | P1126151 | Immunoblotting Protocol Step 3 |
| High speed microfreezing centrifuge | eppendorf | 5810 R | Cell culture Protocol Step 1 |
| Human IFN-γ ELISA Set | BD | 555142 | ELISA Protocol Step 5 Items: Recombinant Human IFN-γ Lyophilized Standard, Detection Antibody Biotin Anti-Human IFN-γ , Capture Antibody Purified Anti-Human IFN-γ, Enzyme Reagent Streptavidin-horseradish peroxidase conjugate (SAv-HRP) |
| Human IL-2 ELISA Set | BD | 555190 | ELISA Protocol Step 5 Items: Recombinant Human IL-2 Lyophilized Standard, Detection Antibody Biotin Anti-Human IL-2 , Capture Antibody Purified Anti-Human IL-2, Enzyme Reagent Streptavidin-horseradish peroxidase conjugate (SAv-HRP) |
| IL-15 | R&D systems | P40933 | T Cells culture Protocol Step 1 |
| IL-21 | Novoprotein | GMP-CC45 | T Cells culture Protocol Step 1 |
| IL-7 | R&D systems | P13232 | T Cells culture Protocol Step 1 |
| Inverted microscope | Olympus | CKX41 | Cell culture Protocol Step 1,3,4 |
| Jurkat | ATCC | TIB-152 | CAR-Jurkat construction Protocol Step 3 |
| LSRFortessa | BD | LSRFortessa | Flow cytometry Protocol Step 2 |
| Luciferase Assay System | Promega | E1501 | luciferase reporter assay Protocol Step 4 Items: Passive lysis buffer, firefly luciferase substrate |
| Microplate reader | BioTek | HTX | ELISA Protocol Step 5 |
| mobile CO2/O2/N2 Incubator Chamber | China Innovation Instrument Co., Ltd. | Smartor118 | Hypoxic condition Protocol Step 2, 3, 4 |
| Mouse Anti-Hexa Histidine tag | Sigma | SAB2702218 | Immunoblotting Protocol Step 3 |
| NcmBlot Rapid Transfer Buffer | NCM biotech | WB4600 | Immunoblotting |
| NcmECL Ultra | NCM biotech | P10300 | Immunoblotting Protocol Step 3 Items: NcmECL Ultra Luminol/Enhancer Reagent (A) ,NcmECL Ultra Stabilized Peroxide Reagent (B) |
| NovoNectin -coated 48-well flat plates | Novoprotein | GMP-CH38 | CAR-T cells construction Protocol Step 1 |
| OPD (o-phenylenediamine dihydrochloride) tablet set | Sigma | P9187 | Substrate Reagent Protocol Step 5 Items: OPD tablet (silver foil),urea hydrogen peroxide tablet (gold foil) |
| PE-conjugated anti-DYKDDDDK | Biolegend | 637310 | Flow cytometry Protocol Step 2 |
| Protamine sulfate | Sigma | P3369-1OG | Lentivirus infection Protocol Step 1 |
| Protein Marker 10 Kda-250 KDa | Epizyme | WJ102 | Immunoblotting Protocol Step 3 |
| Purifed NA/LE Mouse Anti-Human CD3 | BD | 566685 | T Cells culture Protocol Step 1 |
| Purified NA/LE Mouse Anti-Human CD28 | BD | 555725 | T Cells culture Protocol Step 1 |
| PVDF membrane | Millipore | 168627 | Immunoblotting Protocol Step 3 |
| RPMI 1640 | Corning | 10-040-CVRC | Cell culture Protocol Step 3 |
| Skim milk powder | Yeasen | S9129060 | Immunoblotting Protocol Step 3 |
| SKOV3-Luc | ATCC | HTB-77 | Cytotoxicity assay Protocol Step 4 |
| Trypsin-EDTA | NCM biotech | C125C1 | Cell culture Protocol Step 4 |
| Tween 20 | Sinopharm | 30189328 | Immunoblotting Protocol Step 3 |
| Water bath | keelrein | NB014467 | Heating Protocol Step 1 |
| X-VIVO 15 | LONZA | 04-418Q | Serum-free lymphocyte culture medium Protocol Step 1 |
Riferimenti
- Boardman, A. P., Salles, G. CAR T-cell therapy in large B cell lymphoma. Hematol Oncol. 41 (S1), 112-118 (2023).
- Chen, Y. -. J., Abila, B., Mostafa Kamel, Y. CAR-T: What is next. Cancers. 15 (3), 663 (2023).
- Barsan, V., et al. Tisagenlecleucel utilisation and outcomes across refractory, first relapse and multiply relapsed B-cell acute lymphoblastic leukemia: A retrospective analysis of real-world patterns. eClinicalMedicine. 65, 102268 (2023).
- Liu, Y., et al. Oncolytic herpes simplex virus delivery of dual CAR targets of CD19 and BCMA as well as immunomodulators to enhance therapeutic efficacy in solid tumors combined with CAR-T cell therapy. Front Oncol. 12, 1037934 (2022).
- Liu, C., Qi, T., Milner, J. J., Lu, Y., Cao, Y. Speed and location both matter: Antigen stimulus dynamics controls CAR-T cell response. Front Immunol. 12, 748768 (2021).
- Li, N., et al. Improving the anti-solid tumor efficacy of CAR-T cells by inhibiting adenosine signaling pathway. Oncoimmunology. 9 (1), 1824643 (2020).
- Derenzo, C., Gottschalk, S. Genetic modification strategies to enhance CAR T cell persistence for patients with solid tumors. Front Immunol. 10, 218 (2019).
- Fu, R., et al. Delivery techniques for enhancing CAR T cell therapy against solid tumors. Advanced Functional Materials. 31 (44), 2009489 (2021).
- Johnson, A., Townsend, M., O'Neill, K. Tumor microenvironment immunosuppression: A roadblock to CAR T-cell advancement in solid tumors. Cells. 11 (22), 3626 (2022).
- Liu, Z., et al. Immunosuppression in tumor immune microenvironment and its optimization from CAR-T cell therapy. Theranostics. 12 (14), 6273-6290 (2022).
- Luo, Z., et al. Modulating tumor physical microenvironment for fueling CAR-T cell therapy. Adv Drug Deliv Rev. 185, 114301 (2022).
- Martinez, M., Moon, E. K. CAR T cells for solid tumors: New strategies for finding, infiltrating, and surviving in the tumor microenvironment. Front Immunol. 10, 128 (2019).
- Zhang, X., et al. The immunosuppressive microenvironment and immunotherapy in human glioblastoma. Front Immunol. 13, 1003651 (2022).
- Tie, Y., Tang, F., Wei, Y. Q., Wei, X. W. Immunosuppressive cells in cancer: Mechanisms and potential therapeutic targets. J Hematol Oncol. 15 (1), 61 (2022).
- Wu, Y., et al. Engineering CAR T cells for enhanced efficacy and safety. APL Bioeng. 6 (1), 011502 (2022).
- Al-Haideri, M., et al. cell combination therapy: The next revolution in cancer treatment. Cancer Cell Int. 22 (1), 365 (2022).
- Fuca, G., Reppel, L., Landoni, E., Savoldo, B., Dotti, G. Enhancing chimeric antigen receptor T-cell efficacy in solid tumors. Clin Cancer Res. 26 (11), 2444-2451 (2020).
- Neelapu, S. S., et al. Chimeric antigen receptor T-cell therapy - assessment and management of toxicities. Nat Rev Clin Oncol. 15 (1), 47-62 (2018).
- Mi, J., Ye, Q., Min, Y. Advances in nanotechnology development to overcome current roadblocks in CAR-T therapy for solid tumors. Front Immunol. 13, 849759 (2022).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: Current limitations and potential strategies. Blood Cancer J. 11 (4), 69 (2021).
- Yu, S., Yi, M., Qin, S., Wu, K. Next generation chimeric antigen receptor T cells: Safety strategies to overcome toxicity. Mol Cancer. 18 (1), 125 (2019).
- Dana, H., et al. CAR-T cells: Early successes in blood cancer and challenges in solid tumors. Acta Pharm Sin B. 11 (5), 1129-1147 (2021).
- Van Der Schans, J. J., Van De Donk, N., Mutis, T. Dual targeting to overcome current challenges in multiple myeloma CAR T-cell treatment. Front Oncol. 10, 1362 (2020).
- Andrea, A. E., Chiron, A., Bessoles, S., Hacein-Bey-Abina, S. Engineering next-generation car-t cells for better toxicity management. Int J Mol Sci. 21 (22), 8620 (2020).
- Flugel, C. L., et al. Overcoming on-target, off-tumour toxicity of CAR T cell therapy for solid tumours. Nat Rev Clin Oncol. 20 (1), 49-62 (2023).
- Rababah, F., et al. Chimeric antigen receptor T cells therapy in solid tumors. Clin Transl Oncol. 25 (8), 2279-2296 (2023).
- Masoud, G. N., Li, W. Hif-1alpha pathway: Role, regulation and intervention for cancer therapy. Acta Pharm Sin B. 5 (5), 378-389 (2015).
- Semenza, G. L. Targeting hif-1 for cancer therapy. Nat Rev Cancer. 3 (10), 721-732 (2003).
- Harris, A. L. Hypoxia--a key regulatory factor in tumour growth. Nat Rev Cancer. 2 (1), 38-47 (2002).
- Juillerat, A., et al. An oxygen sensitive self-decision making engineered CAR T-cell. Sci Rep. 7, 39833 (2017).
- Liao, Q., et al. Engineering T cells with hypoxia-inducible chimeric antigen receptor (HiCAR) for selective tumor killing. Biomark Res. 8 (1), 56 (2020).
- Ivan, M., et al. Hifα targeted for vhl-mediated destruction by proline hydroxylation: Implications for o2 sensing. Science. 292 (5516), 464-468 (2001).
- Wang, G. L., Semenza, G. L. Purification and characterization of hypoxia-inducible factor 1. J Biol Chem. 270 (3), 1230-1237 (1995).
- D'alonzo, R. A., et al. In vivo noninvasive preclinical tumor hypoxia imaging methods: A review. Int J Radiat Biol. 97 (5), 593-631 (2021).
- He, H., et al. Conditioned car-t cells by hypoxia-inducible transcription amplification (hita) system significantly enhances systemic safety and retains antitumor efficacy. J Immunother Cancer. 9 (10), e002755 (2021).
- Barsoum, I. B., Smallwood, C. A., Siemens, D. R., Graham, C. H. A mechanism of hypoxia-mediated escape from adaptive immunity in cancer cells. Cancer Res. 74 (3), 665-674 (2014).
- Kroemer, G., Pouyssegur, J. Tumor cell metabolism: Cancer's achilles' heel. Cancer Cell. 13 (6), 472-482 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon