Method Article
التوليد والتحقق الوظيفي من الخلايا التائية لمستقبلات المستضد الخيمري الحساسة لنقص الأكسجة
* These authors contributed equally
In This Article
Summary
نقدم هنا بروتوكولا لتوليد الخلايا التائية لمستقبلات المستضد الخيمري الحساسة لنقص الأكسجة (CAR) والتحقق الوظيفي. يعرض هذا البروتوكول الجيل القائم على فيروس العدس من الخلايا التائية ذات مستقبلات المستضدات الوهمية الحساسة لنقص الأكسجة وتوصيفها ، بما في ذلك التحقق من صحة تعبير CAR المعتمد على نقص الأكسجة والسمية الخلوية الانتقائية.
Abstract
أثبتت الدراسات المكثفة وعد العلاج بالخلايا التائية (CAR-T) لمستقبلات المستضد الخيمري في علاج الأورام الخبيثة الدموية. ومع ذلك ، لا يزال علاج الأورام الصلبة يمثل تحديا ، كما يتضح من مخاوف السلامة التي تنشأ عندما تهاجم الخلايا التائية ذات مستقبلات المستضدات الوهمية الخلايا الطبيعية التي تعبر عن المستضدات المستهدفة. استكشف الباحثون طرقا مختلفة لتعزيز انتقائية الورم للعلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية. تتمثل إحدى الاستراتيجيات التمثيلية على طول هذا الخط في بناء خلايا CAR-T الحساسة لنقص الأكسجة ، والتي تم تصميمها عن طريق دمج مجال تدهور يعتمد على الأكسجين في مجموعة CAR ويتم وضعها استراتيجيا لتحقيق تعبير CAR عالي فقط في بيئة نقص الأكسجين - البيئة المكروية للورم (TME). تقدم هذه الورقة بروتوكولا لتوليد مثل هذه الخلايا التائية ذات مستقبلات المستضدات الوهمية وتوصيفها الوظيفي ، بما في ذلك طرق تحليل التغيرات في تعبير CAR والقدرة على القتل استجابة لمستويات الأكسجين المختلفة التي تحددها غرفة حاضنة متنقلة. من المتوقع أن تظهر الخلايا التائية ذات مستقبلات المستضدات الوهمية التي تم إنشاؤها تعبير CAR والسمية الخلوية بطريقة حساسة للأكسجين ، وبالتالي دعم قدرتها على التمييز بين TME ناقص الأكسجين والأنسجة الطبيعية العادية للتنشيط الانتقائي.
Introduction
يمثل العلاج بالخلايا التائية لمستقبلات المستضد الخيمري (CAR-T) طفرة كبيرة في علاج السرطان. منذ أن وافقت إدارة الغذاء والدواء (FDA) على أول علاج CAR-T لعلاج سرطان الغدد الليمفاوية المتقدم / المقاوم وسرطان الدم الليمفاوي الحاد في عام 2017 ، حصلت1،2،3 ، 10 علاجات CAR-T تستهدف CD19 أو مستضد نضج الخلايا البائية (BCMA) على الموافقة على مستوىالعالم 4. ومع ذلك ، على الرغم من الأبحاث المكثفة ، فإن تكرار الفعالية الرائعة للعلاج CAR-T في علاج الأورام الخبيثة الدموية لا يزال يمثل تحديا لتطبيقه على الأورام الصلبة5،6،7،8.
تعد البيئة المكروية للورم المثبط للمناعة (TME) مساهما أساسيا في ضعف فعالية CAR-T في إعداد الورم الصلب. يعيق TME نشاط وبقاء الخلايا التائية ذات مستقبلات المستضدات الوهمية بسبب عدم كفاية العناصر الغذائية ، ونقص الأكسجة ، ودرجة الحموضة الحمضية ، وتراكم النفايات الأيضية9،10،11،12. يأتي المزيد من العداء من تسلل الخلايا المثبطة للمناعة مثل الخلايا التائية التنظيمية (Tregs) ، والخلايا المثبطة المشتقة من النخاع (MDSCs) ، والبلاعم المرتبطة بالورم (TAM) ، والتي ، إلى جانب الخلايا السرطانية ، تفرز السيتوكينات المثبطة للمناعة التي تسبب تثبيطا إضافيا للخلايا التائية ذات مستقبلات المستضدات الوهمية بمجرد دخولها الورم13,14.
بصرف النظر عن الكفاءة العلاجية غير المرضية ، فإن مشكلات السلامة هي كعب أخيل آخر للخلايا التائية ذات مستقبلات المستضدات الوهمية عند التعامل مع الأورام الصلبة15,16. ينشأ القلق بشأن السلامة من حقيقة أن أيا من المستضدات الخاصة بالورم (TSA) التي تم تحديدها حتى الآن تقتصر بشكل صارم على الخلايا السرطانية. وبعبارة أخرى ، فإن المستضدات المرتبطة بالورم (TAA) التي تم اختيارها كهدف ل CAR ، على الرغم من أنها تظهر تعبيرا أعلى في الخلايا السرطانية ، غالبا ما يتم التعبير عنها أيضا بواسطة الأنسجة الطبيعية17. وبالتالي ، يمكن أن تحدث تأثيرات خارج الورم على الهدف من التنشيط غير المتوقع للخلايا التائية ذات مستقبلات المستضدات الوهمية عند التعرف بكفاءة على الأنسجة الطبيعية ، مما يؤدي إلى متلازمة إطلاق السيتوكين (CRS) ، ومتلازمة اعتلال الدماغ المرتبط ب CAR-T (CRES) 18 ، والنتائج السلبية الأخرى19.
وقد تم استكشاف العديد من الاستراتيجيات لتجنب مثل هذه الآثار، بما في ذلك تقليل تقارب مستقبلات المستضدات الخيمرية للسماح للخلايا التائية ذات مستقبلات المستضدات الوهمية بتمييز الخلايا السرطانية عن الخلايا الطبيعية بناء على مستويات التعبير عن TAA المستهدفة؛ تجهيز الخلايا التائية ذات مستقبلات المستضدات الوهمية بمفتاح إيقاف ، مثل جين الانتحار أو علامة الاستبعاد لتعزيز القضاء عليها عند التنشيط غير المتوقع ؛ تقسيم إشارات CD3ζ والتحفيز المشترك إلى شقيقتين من CAR ، وبالتالي فإن المشاركة المتزامنة مطلوبة للتنشيط الفعال لخلايا CAR-T ؛ استخدام دائرة اصطناعية قائمة على الشق (synNotch) تقيد نشاط الخلايا التائية ذات مستقبلات المستضدات الوهمية للخلايا المستهدفة التي تشترك في التعبير عن اثنين مختلفين من TAAs ؛ وهندسة خلايا CAR-T لتحقيق حساسية TME من خلال تنفيذ آلية لضبط تعبير CAR لتغيير الإشارات البيئية20،21،22،23،24،25،26.
أحد الاعتبارات الرئيسية في خيار حساسية TME الموضح أعلاه هو انخفاض مستوى الأكسجين في TME بسبب الانتشار السريع للخلايا السرطانية. يتوقف استيعاب الخلايا السرطانية لنقص الأكسجة على تنشيط العامل المحرض لنقص الأكسجة -1 (HIF-1) ، وهو عامل نسخ غير متجانس يتكون من وحدة فرعية محفزة ، HIF-1α ، ووحدة فرعية معبر عنها بشكل أساسي ، HIF-1β27. في ظل الظروف المعيارية ، يخضع بروتين HIF-1α للانتشار في كل مكان وتدهور سريع للبروتيازوم ، اعتمادا على مجال التحلل المعتمد على الأكسجين (ODD) 28. عندما يصبح الإمداد الخلوي للأكسجين محدودا ، يستقر HIF-1 وينشط نسخ جيناته المستهدفة النهائية عن طريق الارتباط بعناصر استجابة نقص الأكسجة (HREs) 29. نظرا لطبيعة اضطراب العناد الشارد والتربية على حقوق الإنسان كعناصر حساسة للأكسجين ، فقد تم استكشافها لتحقيق التعبير الشرطي ل CARs داخل TME30 ناقص الأكسجين. هنا ، نقدم بروتوكولا يركز على طرق التوصيف الظاهري والوظيفي للخلايا التائية ذات مستقبلات المستضدات الوهمية الحساسة لنقص الأكسجة ، مسبوقا بوصف موجز لتصميم CAR وإجراءات تحضير هذه الخلايا. يهدف هذا البروتوكول إلى توفير إرشادات مفيدة لاستغلال CAR المستجيب لنقص الأكسجة لتوليد خلايا CAR-T ذات سمية مقيدة خارج الورم.
Protocol
في هذه الدراسة ، تمت مقارنة HER2-BBz-ODD ، وهو CAR حساس لنقص الأكسجة يستهدف HER2 (معرف الجين: 2064) مع نظيره العادي ، HER2-BBz. يتم توضيح مخططات اثنين من CARs في الشكل 1A ، والذي يوضح أن HER2-BBz-ODD مشتق من HER2-BBz عن طريق إضافة تسلسل ODD إلى الطرف C ل CD3ξ. تم وصف بناء ناقلات الفيروسات العدسية التي تعبر عن اثنين من CARs وتوليد الفيروس العدسي المقابل بواسطة نقل الخلايا التائية 293T سابقا31.
1. توليد الخلايا التائية ذات مستقبلات المستضدات الوهمية الحساسة لنقص الأكسجة عن طريق العدوى الفيروسية العدسية
- قم بإذابة خلايا الدم البشرية أحادية النواة المحفوظة بالتبريد (PBMCs) بسرعة عند 37 درجة مئوية في حمام مائي. انقل PBMCs المذابة إلى أنبوب سعة 15 مل يحتوي على 9 مل من وسط زراعة الخلايا الليمفاوية الخالية من المصل مع 400 وحدة دولية من IL-2 و 5 نانوغرام / مل IL-7 و 10 نانوغرام / مل IL-15 (وسط نمو الخلايا التائية البشرية ، يشار إليه باسم TGM بعد ذلك).
- بعد أخذ القسمة لعد الخلايا ، قم بطرد الأنبوب عند 300 × جم لمدة 5 دقائق. أعد تعليق PBMCs الحبيبية باستخدام TGM بكثافة 4 × 106 خلايا / مل ونقل التعليق إلى لوحة 6 آبار.
- تحضير الخرز المناعي المغلف ب hCD3 / hCD28.
- نقل 100 ميكرولتر من الخرز المغناطيسي IgG الماوس إلى أنبوب الطرد المركزي 1.5 مل وغسلها 2 مرات باستخدام حامل مغناطيسي مع برنامج تلفزيوني.
- أعد تعليق الخرزات في 100 ميكرولتر من PBS وأضف 0.2 ميكروغرام من الجسم المضاد CD3 المضاد للفأر و 2 ميكروغرام من الجسم المضاد للفأر CD28 المضاد للإنسان. اخلطي الخليط برفق باستخدام ماصة وصخرة طوال الليل على حرارة 4 درجات مئوية.
- غسل الخرز 2 مرات باستخدام حامل مغناطيسي مع PBS وإعادة تعليقها في 100 ميكرولتر من PBS.
- أضف حبيبات مناعية مغلفة ب hCD3 / hCD28 إلى اللوحة في الخطوة 1.2 بنسبة حبة إلى خلية تبلغ 1: 1. ضع اللوحة في حاضنة مرطبة مع 5٪ CO2 عند 37 درجة مئوية.
- بعد 48 ساعة من الحضانة ، انقل تعليق الخلية إلى أنبوب طرد مركزي سعة 15 مل بعد خلط الخلايا برفق مع ماصة. ضع الأنبوب على حامل مغناطيسي لمدة 3 دقائق ، ثم انقل المادة الطافية بعناية إلى أنبوب جديد سعة 15 مل لإزالة حبيبات المناعة من PBMCs.
- خذ حصة لعد الخلايا ، ثم قم بزرع PBMCs في 5 × 105 خلايا / بئر في 300 ميكرولتر من TGM في صفيحة مسطحة 48 بئرا. أضف 200 ميكرولتر من مخزون الفيروسات العدسية إلى الآبار المقابلة وأضف كبريتات البروتامين إلى تركيز نهائي قدره 10 ميكروغرام / مل.
- قم بطرد اللوحة عند 1000 × جم عند 32 درجة مئوية لمدة 1.5 ساعة وقم بإزالة 300 ميكرولتر من المادة الطافية بعناية والتخلص منها من كل بئر باستخدام ماصة. ثم أضف 1 مل من TGM الطازج باستخدام ماصة وضع اللوحة في حاضنة مرطبة مع 5٪ CO2 عند 37 درجة مئوية.
- أضف TGM الطازج لضبط كثافة الخلية إلى 0.5-2 × 106 خلايا / مل كل 2-3 أيام. ابدأ بنقل الخلايا أولا إلى لوحة ذات 12 بئرا ثم إلى لوحة ذات 6 آبار. استمر في زراعة الخلايا حتى يصل العدد الإجمالي إلى 6 × 106 في حجم 4 مل.
ملاحظة: بالتوازي مع ذلك ، قم بإجراء نقل CAR لخلايا Jurkat T باتباع نفس الإجراءات الموضحة أعلاه ، باستثناء استبدال TGM بوسط RPMI1640 يحتوي على 10٪ مصل بقري جنيني (FBS).
2. تقييم تعبير مستقبلات المستضدات الخيمرية المعتمد على الأكسجين في الخلايا التائية ذات مستقبلات المستضدات الوهمية باستخدام قياس التدفق الخلوي
- قم بصفيحة الخلايا التائية المحولة مستقبلات المستضدات الخيمرية من الخطوة 1.8 إلى لوحين من 12 بئرا بكثافة 2.5 × 106 خلايا / بئر في 2 مل من TGM. ضع صفيحة واحدة مباشرة في حاضنة مرطبة مع 5٪ CO2 عند 37 درجة مئوية (حالة normoxic ، حيث أن الشرط القياسي لزراعة الخلايا يحتوي على 21٪ O2) وضع اللوحة الأخرى في غرفة حاضنة CO2 / O2 / N2 متنقلة مع ضبط مستوى O2 مسبقا عند 1٪ (حالة نقص الأكسجين) ثم احتفظ بالغرفة في مرطب ، 5٪ CO2/94٪ N2 حاضنة عند 37 درجة مئوية.
- كل 24 ساعة ، اجمع 5 × 105 خلايا من الألواح تحت ظروف نقص الأكسجين أو النورموكسيك في أنابيب الطرد المركزي الدقيقة 1.5 مل. أجهزة الطرد المركزي الأنابيب في 500 × غرام لمدة 5 دقائق ، وإزالة المادة الطافية ، وإعادة تعليق الخلايا برفق في 1 مل من PBS عن طريق ماصة. كرر غسل PBS مرة أخرى.
- إعادة تعليق الخلايا المحببة في 50 ميكرولتر من المخزن المؤقت FACS (PBS المكمل ب 2٪ FBS) في كل أنبوب. أضف 50 ميكرولتر من تخفيف 1: 100 من الجسم المضاد المضاد للعلم المترافق PE (0.2 ميكروغرام / مل) واخلطه جيدا عن طريق الماصة. احتضان في الظلام في درجة حرارة الغرفة لمدة 20 دقيقة.
- في نهاية الحضانة ، أضف 1 مل من المخزن المؤقت FACS إلى كل أنبوب. تخلط جيدا عن طريق سحب ، ثم أجهزة الطرد المركزي في 500 × غرام لمدة 5 دقائق.
- قم بإزالة المادة الطافية والتخلص منها بعناية باستخدام ماصة وكرر الخطوة 2.4 مرة أخرى.
- قم بإزالة المادة الطافية والتخلص منها بعناية باستخدام ماصة. أعد تعليق الخلايا في 200 ميكرولتر من المخزن المؤقت FACS ، ثم انقل تعليق الخلية الناتج إلى أنابيب تدفق 5 مل.
- قم بإجراء قياس التدفق الخلوي على تعليق الخلية في الخطوة 2.6 لتحديد تعبير CAR السطحي. قم بتضمين الخلايا التائية غير المنقولة كعنصر تحكم سلبي.
- استخدم بوابات FSC/SSC وFSC-A/FSC-H لفحص الخلايا الفردية الحية. اجمع 1 × 104 أحداث فردية حية لكل عينة. بوابة الخلايا موجبة ل EGFP (علامة تأسيسية محمولة في ناقل الفيروس العدسي كمؤشر على الخلايا التائية المتحولة بنجاح) ثم الخلايا الإيجابية ل phycoerythrin (PE) (الخلايا المعبرة عن CAR) لقياس إيجابية PE ومتوسط شدة التألق (MFI).
3. تحليل الاعتماد على الأكسجين لتعبير CAR في خلايا Jurkat T المعدلة بواسطة CAR بواسطة اللطخة الغربية
- قم بطلاء خلايا Jurkat T المحولة ب CAR من القسم 1 في لوحين من 48 بئرا بكثافة 5 × 105 خلايا لكل بئر (حجم مزرعة 500 ميكرولتر) في وسط RPMI1640 بنسبة 10٪ FBS.
- بالنسبة للوحة واحدة ، أضف CoCl2 إلى الآبار التجريبية إلى تركيز نهائي يبلغ 0 ميكرومتر أو 50 ميكرومتر أو 200 ميكرومتر. ثم ضع اللوحة في حاضنة CO2 رطبة بنسبة 5٪ عند 37 درجة مئوية (حالة طبيعية). بالنسبة للوحة الأخرى ، لا تقم بإضافة CoCl2 ووضعها في غرفة حاضنة CO2 / O2 / N2 متنقلة مع ضبط مستوى O2 مسبقا عند 1٪ (حالة نقص الأكسجين) قبل نقلها إلى نفس الحاضنة.
- بعد 24 ساعة من الحضانة ، انقل تعليق الخلية إلى أنابيب طرد مركزي دقيقة سعة 1.5 مل. أجهزة الطرد المركزي الأنابيب في 500 × غرام لمدة 5 دقائق. قم بإزالة المواد الطافية والتخلص منها تماما أولا باستخدام ماصة سعة 1 مل ، ثم ماصة سعة 100 ميكرولتر ، وأعد تعليق كريات الخلية في 50 ميكرولتر من المخزن المؤقت لعينة 1x SDS-PAGE.
- سخني العينات في حمام مائي مغلي لمدة 10 دقائق. ضع الأنبوب على الفور على الجليد لمدة 30 ثانية ، ثم جهاز الطرد المركزي عند 16000 × جم لمدة 30 ثانية.
- قم بتحميل 30 ميكرولتر من العينات التي تم تطهيرها في كل فتحة من جل SDS PAGE المكون من 10 آبار و 10٪ بسمك 1.5 مم. قم بتشغيل الجل عند 80 فولت لمدة 30 دقيقة ، ثم قم بزيادة الجهد إلى 100 فولت وتشغيله لمدة 1.5 ساعة.
- في نهاية الرحلان الكهربائي ، قم بنقل البروتينات من الجل إلى غشاء PVDF باستخدام طريقة النقل الرطب القياسية ، مع ضبط التيار والمدة على 400 مللي أمبير و 1 ساعة على التوالي.
- سد الغشاء في المخزن المؤقت المانع (5٪ حليب (وزن / حجم) في PBST (PBS + 0.05٪ Tween-20)) لمدة 1 ساعة في درجة حرارة الغرفة. بعد ذلك ، قم بقطع القطعة بين 30 كيلو دال و 40 كيلو دال للكشف عن التحكم في تحميل GAPDH والقطعة بين 50 كيلو دال و 70 كيلو ديسيبل للكشف عن جزيئات CAR.
- احتضان القطع 30-40 kD و 50-70 kD مع الجسم المضاد للفأر GAPDH (1: 2000 تخفيف) والجسم المضاد للفأر (1: 2000 تخفيف) ، على التوالي ، في 3 مل من المخزن المؤقت المانع إما في درجة حرارة الغرفة لمدة 2 ساعة أو عند 4 درجات مئوية طوال الليل.
- اغسل الأغشية باستخدام PBST في درجة حرارة الغرفة على منصة هزازة لمدة 3 × 5 دقائق.
- احتضان الأغشية بجسم مضاد مضاد للفأر للماعز مترافق HRP (1: 5000 تخفيف) في 3 مل من المخزن المؤقت المانع في درجة حرارة الغرفة لمدة ساعة واحدة ؛ ثم اغسل الغشاء باستخدام PBST لمدة 5 × 10 دقائق.
- قم بتطوير الأغشية باستخدام احتضانها بركيزة HRP ، ثم تصور نطاقات البروتين المكتشفة باستخدام محلل صور الانارة.
4. التقييم في المختبر لاعتماد الأكسجين للسمية الخلوية بوساطة الخلايا التائية ذات مستقبلات المستضدات الوهمية الحساسة لنقص الأكسجة
- في اليوم 0 ، البذور 1 × 104 خلايا مستهدفة (خلايا SKOV3-Luc) لكل بئر تجريبي في 200 ميكرولتر من DMEM تحتوي على 10٪ FBS في لوحين أسودين مسطحي القاع 96 بئرا لزراعة الأنسجة.
- في اليوم 1 ، قم بإزالة 100 ميكرولتر من المادة الطافية بعناية من أعلى كل بئر. أضف خلايا CAR-T أو الخلايا التائية غير المحولة بنسب مستجيب إلى هدف تبلغ 1: 1 و 2: 1 و 4: 1 في 100 ميكرولتر من وسط DMEM يحتوي على 10٪ FBS.
- ضع طبقا واحدا في جو 21٪ O2 والآخر في جو 1٪ O2 باستخدام غرفة حاضنة CO2 / O2 / N2 متنقلة ، كما هو موضح في الخطوة 2.1.
ملاحظة: في حالة عدم توفر غرفة حاضنة CO2 / O2 / N2 المتنقلة ، يمكن استخدام إضافة CoCl2 إلى وسط الاستزراع لتقليد حالة نقص الأكسجين. - في اليوم 2 ، بعد 24 ساعة من الزراعة المشتركة ، انقل بعناية كل المادة الطافية (حوالي 150-200 ميكرولتر) إلى صفيحة جديدة ذات 96 بئرا على شكل حرف U باستخدام ماصة. يخزن في درجة حرارة -20 درجة مئوية للكشف عن السيتوكين لاحقا، باتباع الإجراءات الموضحة في القسم 5.
- أضف 60 ميكرولتر من 1x مخزن مؤقت للتحلل السلبي إلى كل بئر تجريبي من ألواح 96 بئرا سوداء مسطحة القاع من الخطوة 4.4. بعد ذلك ، ضع الألواح على شاكر ورجها لمدة 30 دقيقة لضمان تحلل الخلايا بكفاءة.
- أضف 60 ميكرولتر من ركيزة لوسيفيراز اليراع إلى كل بئر تجريبي ، وقم بقياس نشاط لوسيفيراز على الفور باستخدام قارئ الصفيحة الدقيقة.
- احسب السمية الخلوية الطبيعية (٪) باستخدام المعادلة (1):
السمية الخلوية الطبيعية (٪) = 100 -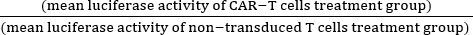 ×100 (1)
×100 (1)
5. الكشف عن إفراز IL-2 و IFN-γ بواسطة خلايا CAR-T الحساسة لنقص الأكسجة
- في اليوم 0 ، قم بإعداد تخفيف 1: 250 من IL-2 أو IFN-γ التقاط الجسم المضاد في طلاء العازلة. أضف 100 ميكرولتر من الجسم المضاد المخفف إلى كل بئر من صفيحة ELISA المكونة من 96 بئرا واحتضان اللوحة عند 4 درجات مئوية طوال الليل.
ملاحظة: يتم تصنيع عازل الطلاء عن طريق إذابة 7.13 جم من NaHCO3 و 1.59 جم من Na2CO3 في 1 لتر من الماء المقطر وضبط الرقم الهيدروجيني إلى 9.5. - في اليوم 1 ، قم بإزالة الجسم المضاد للالتقاط غير الممتز عن طريق قلب اللوحة بقوة رأسا على عقب ، ثم اغسل الآبار 3x ب 200 ميكرولتر من Wash Buffer (تحتوي PBS على 0.05٪ Tween 20).
- أضف 200 ميكرولتر من مخفف الفحص (PBS يحتوي على 10٪ FBS) إلى كل بئر واحتضانه في درجة حرارة الغرفة لمدة 1 ساعة.
- تخلص من المحلول عن طريق قلب اللوحة بقوة رأسا على عقب ؛ ثم اغسل الآبار 3x ب 200 ميكرولتر من Wash Buffer.
- قم بإذابة عينات / لوحة الطافات المجمدة من الخطوة 4.4 في درجة حرارة الغرفة. بمجرد إذابتها تماما ، قم بتخفيف العينات والمعايير باستخدام Assay Dimoent. أضف 100 ميكرولتر من العينات أو المعايير المخففة إلى كل بئر من لوحة ELISA المطلية واحتضانها في درجة حرارة الغرفة لمدة 2 ساعة.
ملاحظة: للكشف عن IL-2 ، يوصى بتخفيف 10 أضعاف ، بينما بالنسبة للكشف عن IFN-γ ، يفضل تخفيف 50 ضعفا. - قم بإزالة العينات والمعايير عن طريق قلب اللوحة بقوة رأسا على عقب ، ثم اغسل الآبار 5x مع 200 ميكرولتر من Wash Buffer لكل بئر.
- قم بإعداد حل كشف عملي عن طريق تخفيف الجسم المضاد للكشف عن IL-2 أو الجسم المضاد للكشف عن IFN-γ / Streptavidin-HRP (SAv-HRP) بنسبة 1: 250 في مخفف الفحص. أضف 100 ميكرولتر من محلول الكشف عن العمل إلى كل بئر واحتضان اللوحة في درجة حرارة الغرفة لمدة 1 ساعة مع اهتزاز لطيف.
- تخلص من المحلول واغسل الآبار 7x ب 200 ميكرولتر من Wash Buffer.
- أضف 100 ميكرولتر من كاشف الركيزة إلى كل بئر واحتضن اللوحة في درجة حرارة الغرفة لمدة 30 دقيقة في الظلام.
- أضف 50 ميكرولتر من محلول التوقف (1 م H2SO4) إلى كل بئر. اقرأ على الفور الامتصاص عند 450 نانومتر باستخدام قارئ microplate.
النتائج
يمثل دمج مجال ODD الخاص ب HIF-1α في مجموعة CAR استراتيجية أساسية لتوليد CAR حساس لنقص الأكسجة. تم إنشاء CAR الذي يستهدف HER2 الحساس لنقص الأكسجة والذي تم تحليله في هذه الدراسة ، المسمى HER2-BBz-ODD ، باستخدام هذه الإستراتيجية من خلال دمج تسلسل ODD في HER2-BBz التقليدي (الشكل 1 أ). في هذه الدراسة ، استخدمنا نقل الفيروسات العدسية للتعبير عن HER2-BBz-ODD CAR أو HER2-BBz CAR وفحصنا بعد ذلك حساسية الأكسجين في نوعين من الخلايا: PBMCs البشرية وخلايا Jurkat T.
الفحص الأول هو التعبير عن CAR في ظل ظروف نقص الأكسجين مقابل الظروف المعيارية ، والذي تم إجراؤه في كل من الخلايا التائية المشتقة من PBMC المنقولة ب CAR عن طريق قياس التدفق الخلوي وخلايا Jurkat T المحولة ب CAR عن طريق النشاف الغربي. في إعداد الخلايا التائية المشتقة من PBMC المحولة مستقبلات المستضدات الخيمرية ، لاحظنا أن HER2-BBz-ODD CAR كان له تعبير أعلى بكثير تحت 1٪ O2 من أقل من 21٪ O2 من حيث كل من النسبة المئوية للخلايا الإيجابية CAR ومتوسط شدة التألق (MFI) (الشكل 1B). كما أكد تحليل النشاف المناعي لخلايا Jurkat T المحولة بمستقبلات المستضدات الوهمية الحث المعتمد على نقص الأكسجة ل HER2-BBz-ODD.
تجدر الإشارة إلى أنه في هذا السياق ، يمكن محاكاة حالة نقص الأكسجين بسهولة عن طريق إضافة CoCl2 ، وهو محفز كيميائي لنقص الأكسجة ، إلى وسط الثقافة. كما هو موضح في الشكل 1C ، أظهرت نتائج المناعة لدينا أن التعرض ل 50 أو 200 ميكرومتر CoCl2 يلخص تأثير التعرض ل 1٪ O2 ، مما يؤدي بشكل ملحوظ إلى التعبير عن HER2-BBz-ODD CAR ولكن ليس تعبير HER2-BBz CAR. تم إجراء التوصيف الوظيفي لمستقبلات المستضدات الخيمرية الحساسة لنقص الأكسجة باستخدام الخلايا التائية ذات مستقبلات المستضدات الوهمية المشتقة من PBMC. في الدراسة ، تم استخدام خط خلية SKOV-3 الحامل لليراع كخط خلية مستهدف. سمح لنا هذا الإعداد بقياس نشاط لوسيفيراز المرتبط بالخلية المستهدفة كوكيل لتقييم السمية الخلوية بوساطة الخلايا التائية ذات المستضدات الوهمية المشتركة.
كما هو موضح في الشكل 1 د ، أشارت القياسات إلى أن خلايا HER2-BBz CAR-T تقتل الخلايا المستهدفة بشكل فعال ، بغض النظر عما إذا كان الغلاف الجوي طبيعيا أو ناقص الأكسجين. في المقابل ، أظهرت خلايا HER2-BBz-ODD CAR-T سمية خلوية أضعف بشكل ملحوظ في ظل الظروف المعيارية لجميع نسب E: T الثلاثة التي تم فحصها. ومع ذلك ، تم تعزيز السمية الخلوية بشكل كبير عند تعرضها لظروف نقص الأكسجين. كما تم قياس مستويات الخلايا الطافية من IL-2 و IFN-γ بواسطة ELISA بعد زراعة خلايا CAR-T مع الخلايا المستهدفة لمدة 24 ساعة. بالنسبة لكلا السيتوكينات ، لوحظ إفراز أعلى أقل من 1٪ O2 مقارنة ب 21٪ O2 لخلايا HER2-BBz-ODD CAR-T ، وهو ما يتوافق مع بيانات السمية الخلوية. في المقابل ، أظهرت خلايا HER2-BBz CAR-T إفرازا أقل للسيتوكينات تحت 1٪ O2 مقارنة ب 21٪ O2 ، مما يشير إلى وجود تأثير سلبي لنقص الأكسجة على النشاط الخلوي (الشكل 1E). مجتمعة ، أثبتت هذه النتائج بشكل مقنع الطبيعة الحساسة لنقص الأكسجة ل HER2-BBz-ODD CAR.
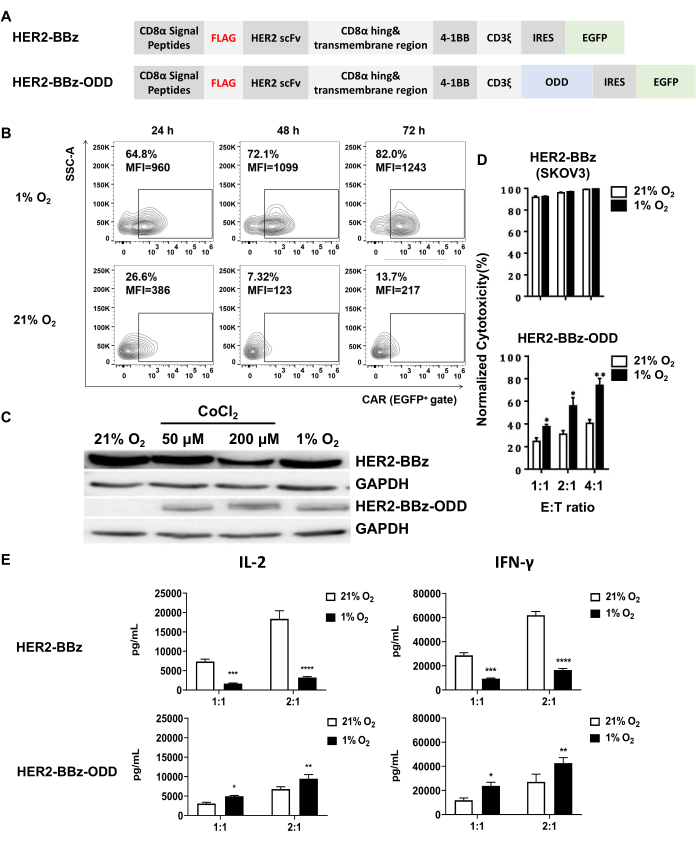
الشكل 1: بناء وتوصيف الخلايا التائية ذات مستقبلات المستضدات الوهمية الحساسة لنقص الأكسجة. (أ) تمثيل تخطيطي لتصاميم مستقبلات المستضدات الوهمية الحساسة لنقص الأكسجة، HER2-BBz-ODD، ونظيرتها التقليدية، HER2-BBz. يتكون كلا CARs من ببتيد إشارة CD8α N-terminal ، وعلامة FLAG ، و SCFV البشري الذي يستهدف HER2 ، ومفصلة CD8 ومجال عبر الغشاء ، وجزء داخل الخلايا يتكون من مجال مكلف من 4-1BB ، ومجال إشارات CD3ξ ، و IRES ، و EGFP. يختلف HER2-BBz-ODD عن HER2-BBz في اندماج مجال ODD إلى الطرف C لمجال إشارات CD3ξ ، مما يسمح بتعبيره المعتمد على نقص الأكسجين من خلال تعزيز تدهوره المعتمد على يوبيكويتين في ظل ظروف normoxic. (ب، ج) تقييمات التعبير المعتمد على الأكسجين ل HER2-BBz-ODD CAR. (ب) أجري تقييم واحد باستخدام الخلايا التائية ذات مستقبلات المستضدات الوهمية المشتقة من PBMC بعد زراعة أقل من 1٪ أو 21٪ O2 لمدة 24 أو 48 أو 72 ساعة باستخدام قياس التدفق الخلوي. (ج) كان التقييم الآخر مع خلايا Jurkat T المتحولة مستقبلات المستضدات الخيمرية ، حيث تم حصاد محللات الخلايا على بعد 24 ساعة من الزراعة تحت 21٪ O2 أو 50 أو 200 μM CoCl2 أو 1٪ O2 وتحليلها لتعبير CAR باستخدام النشاف الغربي ، مع تضمين الخلايا المحولة HER2-BBz CAR كعنصر تحكم. (د، ه) السمية الخلوية في المختبر وإفراز السيتوكين للخلايا التائية ذات مستقبلات المستضدات الوهمية في ظل ظروف الأكسجين المختلفة. (د) تمت زراعة الخلايا التائية ذات مستقبلات المستضدات الوهمية مع خلايا SKOV3 المعبرة عن اليراع لوسيفيراز بنسب E: T المشار إليها تحت 1٪ أو 21٪ O2. بعد 24 ساعة من الزراعة المشتركة ، تم تحديد كفاءة قتل الخلايا المستهدفة عن طريق قياس التغير في نشاط لوسيفيراز اليراع المرتبط بالخلية بالنسبة إلى ذلك مع الخلايا التائية غير المحولة. (ه) جمعت المواد الطافية للكشف عن إفراز IL-2 و IFN-γ. يتم عرض النتائج كمتوسط ± SEM (n = 3 متبرعين أصحاء) (****p < 0.0001). الاختصارات: scFv = متغير جزء أحادي السلسلة ؛ CAR = مستقبلات المستضد الخيمري. اللوحتان C و D مقتبسة من Liao et al.31. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تعد مخاوف السلامة من القضايا المهمة التي يجب معالجتها لأي علاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية للتقدم إلى الاستخدام السريري. أصبح استخدام الخصائص الفريدة للخلايا السرطانية أو TME اتجاها بحثيا أساسيا يركز على تطوير الخلايا التائية ذات مستقبلات المستضدات الوهمية التي تستهدف أنسجة الورم بشكل انتقائي. يعد تصميم CAR-T الحساس لنقص الأكسجة استراتيجية جذابة في هذا الاتجاه ، مع استكشاف العديد من الأساليب ، بما في ذلك النهج المقدم في هذه الدراسة - دمج مجموعة CAR مع مجال بروتين ODD المستشعر لنقص الأكسجة بشكل طبيعي. يتضمن النهج البديل استبدال المروج التأسيسي الذي يشيع استخدامه لدفع تعبير CAR بعنصر استجابة نقص الأكسجة (HRE) ، والذي أظهر نتائج واعدة في الدراسات السابقة. يعتقد أن الجمع بين عناصر التربية على حقوق الإنسان و ODD (الإصدارات البرية أو الهندسية التي توفر تحكما أكثر إحكاما في التعبير) يمثل تصميما مثاليا ل CAR المحرض لنقص الأكسجة.
يحدد هذا البروتوكول الإجراءات التجريبية لتوليد الخلايا التائية الحساسة لنقص الأكسجة والتحقق من صحتها. ينطوي تنفيذ هذا البروتوكول على عدة اعتبارات رئيسية. الاعتبار الأساسي هو خلق ظروف نقص الأكسجين. بين النهجين ، تم استخدام إضافة CoCl2 إلى وسط الثقافة بشكل سائد في الدراسات السابقة المتعلقة بنقص الأكسجة ، ويرجع الفضل في ذلك إلى حد كبير إلى ملاءمتها32,33. ومع ذلك ، من المستحيل قياس درجة نقص الأكسجة التي يحاكيها هذا النهج. في المقابل ، يعد استخدام غرفة حضانة CO2 / O2 / N2 المتنقلة مفيدا في أنه يمكن ضبط مستويات O2 بدقة وبالتالي فهي مناسبة لإجراء تحليل دقيق لحساسية نقص الأكسجة لخلايا CAR-T. في هذا الصدد ، يختلف مستوى نقص الأكسجة داخل الأورام بين أنواع مختلفة من الأورام الصلبة وفترات مختلفة من تطور الورم34 ، في حين أن 1٪ O2 فقط في البروتوكول. إنها ممارسة مثالية للباحثين لضبط مستوى الأكسجين وفقا للطلب الفعلي. إذا كانت طريقة CoCl2 هي الطريقة الوحيدة المتاحة ، فإننا نوصي بتضمين مجموعة من تركيزات CoCl2 في الفحص لمحاكاة مستويات الأكسجين المختلفة.
يعد اختيار طريقة مناسبة لفحص تعبير CAR المعتمد على نقص الأكسجة أحد الاعتبارات الرئيسية الأخرى. في حين أن تحليل النشاف المناعي لخلايا Jurkat T المتحولة مستقبلات المستضدات الخيمرية هو خيار مناسب أثناء تحسين بناء CAR ، فإن تحليل تأثير مستويات الأكسجين على تعبير CAR السطحي في PBMCs البشرية المنقولة ب CAR عن طريق قياس التدفق الخلوي بمثابة التحقق النهائي. من الأفضل فحص ديناميكيات تعبير CAR استجابة للانتقال من ظروف نقص الأكسجين إلى ظروف normoxic ، كما فعلنا سابقا مع نسخة محسنة من CAR الحساسة لنقص الأكسجة ، وهي HiTA-CAR35. هذا من شأنه أن يوضح بشكل أكبر تعبير CAR المقيد بنقص الأكسجة.
للتحقق الوظيفي من الخلايا التائية ذات مستقبلات المستضدات الوهمية الحساسة لنقص الأكسجة ، يتضمن اختبار السمية الخلوية الموضح في البروتوكول استخدام الخلايا المستهدفة الحاملة ل luciferase اليراع. يمكن استبدال هذا الاختبار القائم على المراسل بطرق أخرى لتقييم القتل ، مثل طريقة CCK8 وطريقة التحليل الخلوي في الوقت الفعلي (RTCA) ، حيث يمكن استخدام الخلايا السرطانية غير المعدلة. يعد تحليل RTCA مفيدا أيضا لقياس حركية القتل في الوقت الفعلي لخلايا CAR-T. لقياس السمية الخلوية المحددة التي تسببها الخلايا التائية ذات مستقبلات المستضدات الوهمية ، يجب تضمين PBMCs غير المحولة كعنصر تحكم. من المستحسن أن تكون كفاءة النقل العالية ل PBMCs لتجنب المخاوف من أن الاختلافات في السمية الخلوية المكتشفة بين المجموعات التجريبية والضابطة تنشأ من القتل غير المحدد بوساطة كميات متفاوتة من الخلايا المستجيبة المضافة.
هناك العديد من القيود في هذا البروتوكول. يمكن أن تؤثر ظروف نقص الأكسجين على صلاحية كل من الخلايا المستهدفة والخلايا التائية36،37 ، مما يثير القلق من أن موت الخلايا غير المرتبط بالسمية الخلوية بوساطة الخلايا التائية ذات مستقبلات المستضدات الوهمية قد يربك تفسير نتائج الفحص. التأكد من أن كل من الخلايا التائية ذات مستقبلات المستضدات الوهمية والخلايا المستهدفة تتمتع بصلاحية ممتازة مباشرة قبل اقتراح الفحص لتجنب أو تقليل هذه المخاوف. وتجدر الإشارة أيضا إلى أن التحقق في المختبر لا يضمن نجاح الترجمة في الجسم الحي . هناك حاجة دائما إلى تقييمات في الجسم الحي لتأكيد ما إذا كان مرشح CAR-T الحساس لنقص الأكسجة يمكنه تجنب استهداف الأنسجة الطبيعية التي تعبر عن المستضد المستهدف
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم هذا العمل بمنح من البرنامج الوطني للبحث والتطوير الرئيسي في الصين (2016YFC1303402) ، والمشروع الوطني الضخم للأمراض المعدية الرئيسية (2017ZX10202102 ، 2017ZX10304402-002-007) ، والبرنامج العام للجنة الصحة البلدية في شنغهاي (201740194).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Centrifuge tube | QSP | 509-GRD-Q | Supernatants and cells cellection Protocol Step 2,3,4 |
| 10% ExpressCast PAGE | NCM biotech | P2012 | Immunoblotting Protocol Step 3 |
| 10x PBS | NCM biotech | 20220812 | Cell culture Protocol Step 4 |
| 10 mL pipette | Yueyibio | YB-25H | Pipetting Protocol Step 1 |
| 10xTRIS-Glycine-SDS electrophoresis buffer | Epizyme | 3673020 | Immunoblotting Protocol Step 3 |
| 15 mL Centrifuge tube | Thermo Scientific | 339650 | Supernatants and cells cellection Protocol Step 1 |
| 25 cm2 EasYFlask | Thermo Scientific | 156367 | Cell culture Protocol Step 3,4 |
| 4x Protein SDS PAGE Loading Buffer | Takara | 9173 | Immunoblotting Protocol Step 3 |
| 6-well flat-bottom tissue culture plates | Thermo Scientific | 140675 | T Cells culture Protocol Step 1 |
| 96-well black flat-bottom tissue culture plates | Greiner | 655090 | Cytotoxicity assay Protocol Step 4 |
| 96-well ELISA plates | Corning | 3590 | ELISA Protocol Step 5 |
| 96-well plate shaker | QILINBEIER | MH-2 | Shake Protocol Step 4 |
| 96-well U-bottom tissue culture plates | Thermo Scientific | 268200 | Supernatants cellection Protocol Step 4,5 |
| anti-FLAG antibody | Sigma | F1804-50UG | Immunoblotting Protocol Step 3 |
| Carbinol | Sinopharm | 10010061 | Immunoblotting Protocol Step 3 |
| Carbon dioxide incubator | Thermo Scientific | 360 | Cell culture Protocol Step 1,2,3,4 |
| Cell counting plate | Hausser scientific | 1492 | Cell counting Protocol Step 1,3,4 |
| CELLection Pan Mouse IgG Kit | Thermo Scientific | 11531D | Mouse IgG magnetic beads Protocol Step 1 |
| Centrifuge | Thermo Scientific | 75002432 | Cell culture Protocol Step 1,3,4 |
| Chemiluminescence gel imaging system | BIO-RAD | 12003154 | Immunoblotting Protocol Step 3 |
| Cobalt chloride solution (0.5 M) | bioleaper | BR4000203 | Hypoxic condition Protocol Step 2,3,4 |
| DMEM | Corning | 10-103-CV | Cell culture Protocol Step 4 |
| Electronic balance | Sartorius | PRACTUM612-1CN | weigh Protocol Step 5 |
| FBS | BI | 04-001-1ACS | Cell culture Protocol Step 3,4 |
| GAPDH Mouse mAb | ABclonal | AC002 | Immunoblotting Protocol Step 3 |
| Gel electrophoresis apparatus | BIO-RAD | 1645070 | Immunoblotting Protocol Step 3 |
| GloMax Microplate Readers | Promega | GM3000 | luciferase activity measurement Protocol Step 4 |
| Goat anti-Mouse IgG (H+L) | Yeasen | P1126151 | Immunoblotting Protocol Step 3 |
| High speed microfreezing centrifuge | eppendorf | 5810 R | Cell culture Protocol Step 1 |
| Human IFN-γ ELISA Set | BD | 555142 | ELISA Protocol Step 5 Items: Recombinant Human IFN-γ Lyophilized Standard, Detection Antibody Biotin Anti-Human IFN-γ , Capture Antibody Purified Anti-Human IFN-γ, Enzyme Reagent Streptavidin-horseradish peroxidase conjugate (SAv-HRP) |
| Human IL-2 ELISA Set | BD | 555190 | ELISA Protocol Step 5 Items: Recombinant Human IL-2 Lyophilized Standard, Detection Antibody Biotin Anti-Human IL-2 , Capture Antibody Purified Anti-Human IL-2, Enzyme Reagent Streptavidin-horseradish peroxidase conjugate (SAv-HRP) |
| IL-15 | R&D systems | P40933 | T Cells culture Protocol Step 1 |
| IL-21 | Novoprotein | GMP-CC45 | T Cells culture Protocol Step 1 |
| IL-7 | R&D systems | P13232 | T Cells culture Protocol Step 1 |
| Inverted microscope | Olympus | CKX41 | Cell culture Protocol Step 1,3,4 |
| Jurkat | ATCC | TIB-152 | CAR-Jurkat construction Protocol Step 3 |
| LSRFortessa | BD | LSRFortessa | Flow cytometry Protocol Step 2 |
| Luciferase Assay System | Promega | E1501 | luciferase reporter assay Protocol Step 4 Items: Passive lysis buffer, firefly luciferase substrate |
| Microplate reader | BioTek | HTX | ELISA Protocol Step 5 |
| mobile CO2/O2/N2 Incubator Chamber | China Innovation Instrument Co., Ltd. | Smartor118 | Hypoxic condition Protocol Step 2, 3, 4 |
| Mouse Anti-Hexa Histidine tag | Sigma | SAB2702218 | Immunoblotting Protocol Step 3 |
| NcmBlot Rapid Transfer Buffer | NCM biotech | WB4600 | Immunoblotting |
| NcmECL Ultra | NCM biotech | P10300 | Immunoblotting Protocol Step 3 Items: NcmECL Ultra Luminol/Enhancer Reagent (A) ,NcmECL Ultra Stabilized Peroxide Reagent (B) |
| NovoNectin -coated 48-well flat plates | Novoprotein | GMP-CH38 | CAR-T cells construction Protocol Step 1 |
| OPD (o-phenylenediamine dihydrochloride) tablet set | Sigma | P9187 | Substrate Reagent Protocol Step 5 Items: OPD tablet (silver foil),urea hydrogen peroxide tablet (gold foil) |
| PE-conjugated anti-DYKDDDDK | Biolegend | 637310 | Flow cytometry Protocol Step 2 |
| Protamine sulfate | Sigma | P3369-1OG | Lentivirus infection Protocol Step 1 |
| Protein Marker 10 Kda-250 KDa | Epizyme | WJ102 | Immunoblotting Protocol Step 3 |
| Purifed NA/LE Mouse Anti-Human CD3 | BD | 566685 | T Cells culture Protocol Step 1 |
| Purified NA/LE Mouse Anti-Human CD28 | BD | 555725 | T Cells culture Protocol Step 1 |
| PVDF membrane | Millipore | 168627 | Immunoblotting Protocol Step 3 |
| RPMI 1640 | Corning | 10-040-CVRC | Cell culture Protocol Step 3 |
| Skim milk powder | Yeasen | S9129060 | Immunoblotting Protocol Step 3 |
| SKOV3-Luc | ATCC | HTB-77 | Cytotoxicity assay Protocol Step 4 |
| Trypsin-EDTA | NCM biotech | C125C1 | Cell culture Protocol Step 4 |
| Tween 20 | Sinopharm | 30189328 | Immunoblotting Protocol Step 3 |
| Water bath | keelrein | NB014467 | Heating Protocol Step 1 |
| X-VIVO 15 | LONZA | 04-418Q | Serum-free lymphocyte culture medium Protocol Step 1 |
References
- Boardman, A. P., Salles, G. CAR T-cell therapy in large B cell lymphoma. Hematol Oncol. 41 (S1), 112-118 (2023).
- Chen, Y. -J., Abila, B., Mostafa Kamel, Y. CAR-T: What is next. Cancers. 15 (3), 663(2023).
- Barsan, V., et al. Tisagenlecleucel utilisation and outcomes across refractory, first relapse and multiply relapsed B-cell acute lymphoblastic leukemia: A retrospective analysis of real-world patterns. eClinicalMedicine. 65, 102268(2023).
- Liu, Y., et al. Oncolytic herpes simplex virus delivery of dual CAR targets of CD19 and BCMA as well as immunomodulators to enhance therapeutic efficacy in solid tumors combined with CAR-T cell therapy. Front Oncol. 12, 1037934(2022).
- Liu, C., Qi, T., Milner, J. J., Lu, Y., Cao, Y. Speed and location both matter: Antigen stimulus dynamics controls CAR-T cell response. Front Immunol. 12, 748768(2021).
- Li, N., et al. Improving the anti-solid tumor efficacy of CAR-T cells by inhibiting adenosine signaling pathway. Oncoimmunology. 9 (1), 1824643(2020).
- Derenzo, C., Gottschalk, S. Genetic modification strategies to enhance CAR T cell persistence for patients with solid tumors. Front Immunol. 10, 218(2019).
- Fu, R., et al. Delivery techniques for enhancing CAR T cell therapy against solid tumors. Advanced Functional Materials. 31 (44), 2009489(2021).
- Johnson, A., Townsend, M., O'Neill, K. Tumor microenvironment immunosuppression: A roadblock to CAR T-cell advancement in solid tumors. Cells. 11 (22), 3626(2022).
- Liu, Z., et al. Immunosuppression in tumor immune microenvironment and its optimization from CAR-T cell therapy. Theranostics. 12 (14), 6273-6290 (2022).
- Luo, Z., et al. Modulating tumor physical microenvironment for fueling CAR-T cell therapy. Adv Drug Deliv Rev. 185, 114301(2022).
- Martinez, M., Moon, E. K. CAR T cells for solid tumors: New strategies for finding, infiltrating, and surviving in the tumor microenvironment. Front Immunol. 10, 128(2019).
- Zhang, X., et al. The immunosuppressive microenvironment and immunotherapy in human glioblastoma. Front Immunol. 13, 1003651(2022).
- Tie, Y., Tang, F., Wei, Y. Q., Wei, X. W. Immunosuppressive cells in cancer: Mechanisms and potential therapeutic targets. J Hematol Oncol. 15 (1), 61(2022).
- Wu, Y., et al. Engineering CAR T cells for enhanced efficacy and safety. APL Bioeng. 6 (1), 011502(2022).
- Al-Haideri, M., et al. cell combination therapy: The next revolution in cancer treatment. Cancer Cell Int. 22 (1), 365(2022).
- Fuca, G., Reppel, L., Landoni, E., Savoldo, B., Dotti, G. Enhancing chimeric antigen receptor T-cell efficacy in solid tumors. Clin Cancer Res. 26 (11), 2444-2451 (2020).
- Neelapu, S. S., et al. Chimeric antigen receptor T-cell therapy - assessment and management of toxicities. Nat Rev Clin Oncol. 15 (1), 47-62 (2018).
- Mi, J., Ye, Q., Min, Y. Advances in nanotechnology development to overcome current roadblocks in CAR-T therapy for solid tumors. Front Immunol. 13, 849759(2022).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: Current limitations and potential strategies. Blood Cancer J. 11 (4), 69(2021).
- Yu, S., Yi, M., Qin, S., Wu, K. Next generation chimeric antigen receptor T cells: Safety strategies to overcome toxicity. Mol Cancer. 18 (1), 125(2019).
- Dana, H., et al. CAR-T cells: Early successes in blood cancer and challenges in solid tumors. Acta Pharm Sin B. 11 (5), 1129-1147 (2021).
- Van Der Schans, J. J., Van De Donk, N., Mutis, T. Dual targeting to overcome current challenges in multiple myeloma CAR T-cell treatment. Front Oncol. 10, 1362(2020).
- Andrea, A. E., Chiron, A., Bessoles, S., Hacein-Bey-Abina, S. Engineering next-generation car-t cells for better toxicity management. Int J Mol Sci. 21 (22), 8620(2020).
- Flugel, C. L., et al. Overcoming on-target, off-tumour toxicity of CAR T cell therapy for solid tumours. Nat Rev Clin Oncol. 20 (1), 49-62 (2023).
- Rababah, F., et al. Chimeric antigen receptor T cells therapy in solid tumors. Clin Transl Oncol. 25 (8), 2279-2296 (2023).
- Masoud, G. N., Li, W. Hif-1alpha pathway: Role, regulation and intervention for cancer therapy. Acta Pharm Sin B. 5 (5), 378-389 (2015).
- Semenza, G. L. Targeting hif-1 for cancer therapy. Nat Rev Cancer. 3 (10), 721-732 (2003).
- Harris, A. L. Hypoxia--a key regulatory factor in tumour growth. Nat Rev Cancer. 2 (1), 38-47 (2002).
- Juillerat, A., et al. An oxygen sensitive self-decision making engineered CAR T-cell. Sci Rep. 7, 39833(2017).
- Liao, Q., et al. Engineering T cells with hypoxia-inducible chimeric antigen receptor (HiCAR) for selective tumor killing. Biomark Res. 8 (1), 56(2020).
- Ivan, M., et al. Hifα targeted for vhl-mediated destruction by proline hydroxylation: Implications for o2 sensing. Science. 292 (5516), 464-468 (2001).
- Wang, G. L., Semenza, G. L. Purification and characterization of hypoxia-inducible factor 1. J Biol Chem. 270 (3), 1230-1237 (1995).
- D'alonzo, R. A., et al. In vivo noninvasive preclinical tumor hypoxia imaging methods: A review. Int J Radiat Biol. 97 (5), 593-631 (2021).
- He, H., et al. Conditioned car-t cells by hypoxia-inducible transcription amplification (hita) system significantly enhances systemic safety and retains antitumor efficacy. J Immunother Cancer. 9 (10), e002755(2021).
- Barsoum, I. B., Smallwood, C. A., Siemens, D. R., Graham, C. H. A mechanism of hypoxia-mediated escape from adaptive immunity in cancer cells. Cancer Res. 74 (3), 665-674 (2014).
- Kroemer, G., Pouyssegur, J. Tumor cell metabolism: Cancer's achilles' heel. Cancer Cell. 13 (6), 472-482 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.