Method Article
Levedura de fissão como plataforma para triagens de drogas antibacterianas direcionadas a proteínas do citoesqueleto bacteriano
Neste Artigo
Resumo
A levedura de fissão é usada aqui como um hospedeiro heterólogo para expressar proteínas bacterianas do citoesqueleto, como FtsZ e MreB, como proteínas de fusão translacional com GFP para visualizar sua polimerização. Além disso, os compostos que afetam a polimerização são identificados por imagens usando um microscópio de fluorescência.
Resumo
Proteínas bacterianas do citoesqueleto, como FtsZ e MreB, desempenham funções essenciais, como divisão celular e manutenção da forma celular. Além disso, FtsZ e MreB surgiram como alvos importantes para novas descobertas de antimicrobianos. Vários ensaios foram desenvolvidos para identificar compostos direcionados à ligação de nucleotídeos e polimerização dessas proteínas do citoesqueleto, focados principalmente em FtsZ. Além disso, muitos dos ensaios são trabalhosos ou caros, e verificar se essas proteínas são o alvo celular da droga geralmente requer vários métodos. Finalmente, a toxicidade das drogas para as células eucarióticas também representa um problema. Aqui, descrevemos um ensaio baseado em células de etapa única para descobrir novas moléculas direcionadas ao citoesqueleto bacteriano e minimizar os golpes que podem ser potencialmente tóxicos para as células eucarióticas. A levedura de fissão é passível de peneiras de alto rendimento baseadas em microscopia, e uma peneira visual pode identificar facilmente qualquer molécula que altere a polimerização de FtsZ ou MreB. Nosso ensaio utiliza a placa padrão de 96 poços e depende da capacidade das proteínas bacterianas do citoesqueleto de polimerizar em uma célula eucariótica, como a levedura de fissão. Embora os protocolos descritos aqui sejam para levedura de fissão e utilizem FtsZ de Staphylococcus aureus e MreB de Escherichia coli, eles são facilmente adaptáveis a outras proteínas bacterianas do citoesqueleto que se montam prontamente em polímeros em qualquer hospedeiro de expressão eucariótica. O método aqui descrito deve ajudar a facilitar a descoberta de novos antimicrobianos direcionados às proteínas bacterianas do citoesqueleto.
Introdução
A resistência generalizada a quase todos os antibióticos atualmente empregados para combater infecções bacterianas criou uma necessidade imediata de novas categorias de antibióticos. Um relatório de 2019 indicou que as infecções resistentes a antibióticos resultaram na perda de 1,27 milhão de vidas, contribuindo para uma contagem geral de 4,95 milhões de mortes ao considerar complicações de infecções bacterianas resistentes1. Embora ainda seja eficaz na prática clínica, o arsenal atual de antibióticos visa predominantemente um espectro estreito de processos celulares, concentrando-se principalmente na parede celular, DNA e síntese de proteínas. Ao longo do último meio século, menos de 30 proteínas foram exploradas comercialmente como alvos para o desenvolvimento de novos antibacterianos 2,3. Essa gama limitada de alvos viáveis cria restrições significativas para a descoberta de novos antibióticos ou seus derivados para combater bactérias resistentes a antibióticos. Assim, para superar o problema emergente de resistência aos antibióticos, há a necessidade do desenvolvimento de novos antibióticos com novos alvos e mecanismos de ação.
Idealmente, um alvo antibacteriano deve ser um componente essencial do crescimento celular bacteriano, ser conservado em todas as espécies filogeneticamente diversas, mostrar menos homologia eucariótica e ser acessível a antibióticos4. Desde a descoberta das proteínas bacterianas do citoesqueleto envolvidas na divisão celular e na manutenção da forma celular, elas surgiram como um ponto focal promissor para o desenvolvimento de compostos antibacterianos5. Essas proteínas são essenciais para a viabilidade bacteriana e desempenham um papel fundamental na manutenção da forma celular (MreB, CreS), divisão (FtsZ, FtsA) e segregação de DNA (ParM, TubZ, PhuZ, AlfA), semelhante ao citoesqueleto em células eucarióticas. Notavelmente, FtsZ exibe um nível notavelmente alto de conservação em uma ampla gama de organismos procarióticos, enquanto MreB é encontrado em quase todas as bactérias em forma de bastonete. Essa ampla distribuição e relevância na viabilidade celular tornam essas proteínas um alvo fascinante na pesquisa de antibióticos 5,6,7.
É crucial adotar uma abordagem multifacetada que combine observações in vivo, interações in vitro e experimentos enzimáticos para validar completamente as proteínas do citoesqueleto bacteriano como o alvo primário de um inibidor potencial7. Procedimentos trabalhosos ou implicações substanciais de custo sobrecarregam muitos ensaios disponíveis para esse fim. Esses são obstáculos notáveis para sua utilização generalizada na triagem de compostos de chumbo que podem afetar o citoesqueleto bacteriano. Dentre estes, a microscopia se destaca como um método excepcionalmente eficiente e rápido para avaliar a eficácia dos compostos, examinando diretamente as mudanças na morfologia celular. No entanto, a heteroassociação da proteína-alvo com outros complexos do citoesqueleto, efeitos indiretos devido à ligação fora do alvo e alterações no potencial de membrana, dificuldade em penetrar na célula com eficiência e presença de bombas de efluxo, especialmente em bactérias Gram-negativas, tornam coletivamente complexo identificar a causa precisa da deformação celular bacteriana 8,9,10.
Schizosaccharomyces pombe, ou levedura de fissão, como é comumente conhecida, é um organismo eucariótico unicelular em forma de bastonete. A levedura de fissão é amplamente utilizada como organismo modelo em biologia celular e molecular devido à extraordinária conservação em processos celulares, como o ciclo e divisão celular, organização celular e replicação cromossômica com eucariotos superiores, incluindo humanos11,12. Além disso, Errington e colegas expressaram uma proteína citoesquelética bacteriana localizada em pólo DivIVA em levedura de fissão para demonstrar que DivIVA se acumulou em superfícies curvadas negativamente13. Mais uma vez, Balasubramanian e seu grupo estabeleceram pela primeira vez a levedura de fissão como um sistema de modelo celular para trazer novos insights sobre o mecanismo, montagem e dinamicidade da proteína do citoesqueleto de actina de E. coli, como MreB14 e homólogo de tubulina FtsZ15. Eles também demonstram a capacidade do A22 de impedir eficientemente a polimerização do MreB por meio de microscopia de epifluorescência quando expresso em levedura14. Depois disso, outros grupos também empregaram com sucesso leveduras de fissão para estudar as propriedades de montagem das proteínas FtsZ1 e FtsZ2 do cloroplasto16. Mais recentemente, estabelecemos uma prova de conceito da viabilidade do uso de levedura de fissão como uma plataforma celular para rastrear especificamente inibidores do citoesqueleto bacteriano, conduzindo uma avaliação abrangente do impacto de três inibidores de FtsZ conhecidos - proteínas sanguinarina, berberina e PC190723-on FtsZ derivadas de duas bactérias patogênicas, a saber, Staphylococcus aureus e Helicobacter pylori17. Além disso, este ensaio baseado em células de etapa única é fundamental para minimizar o risco de identificação de compostos que podem ser potencialmente tóxicos para células eucarióticas.
Neste relatório, utilizando o sistema de levedura de fissão, propomos um fluxo de trabalho sistemático usando a placa padrão de 96 poços para triagem semiautomatizada e quantificação do efeito de inibidores de pequenas moléculas direcionados a FtsZ de Staphylococcus aureus e MreB de Escherichia coli. Aqui, configuramos e otimizamos o fluxo de trabalho semiautomatizado usando os inibidores estabelecidos PC190723 e A22 que visam especificamente FtsZ e MreB, respectivamente. Este fluxo de trabalho usa um microscópio de epifluorescência equipado com uma platina motorizada de alta precisão e aquisição automatizada de imagens em uma placa padrão de 96 poços para melhorar a padronização atual. Portanto, ele pode ser aplicado a telas de médio e alto rendimento de bibliotecas químicas sintéticas e contorna alguns dos desafios listados acima.
Protocolo
1. Expressão de proteínas citoesqueléticas bacterianas marcadas com GFP em S. pombe
NOTA: Consulte a Tabela 1 para obter informações sobre todos os plasmídeos e cepas usados aqui. Consulte a Tabela 2 para todas as composições de mídia.
- Realize a clonagem de E. coli MreB com uma fusão GFP N-terminal (GFP-MreB) e S. aureus FtsZ carregando uma GFP C-terminal (SaFtsZ-GFP) no vetor de expressão de S. pombe, pREP42 com um promotor repressível de tiamina de força média, nmt4118,19 conforme descrito anteriormente14,15. Manter, amplificar e isolar os plasmídeos das estirpes de E. coli (DH10β) conforme descrito em20,21.
NOTA: Outras cepas de E. coli , como DH5α, XL1Blue, TOP10, etc. ou outras células competentes comercialmente disponíveis usadas rotineiramente para clonagem molecular também podem ser usadas. - Transformação dos plasmídeos pREP42-GFP-EcMreB e pREP42-SaFtsZ-GFP em S. pombe
- Transforme os plasmídeos pCCD3 (pREP42-GFP-EcMreB) e pCCD713 (pREP42-SaFtsZ-GFP) em cepa de S. pombe (h-leu1-32 ura4-D18) usando o método de acetato de lítio22, conforme mencionado nas etapas abaixo.
- Dia 1 - Cultura primária: Inocule um loop cheio de cultura de S. pombe recém-listrada em 3 mL de extrato de levedura autoclavado e caldo de suplementos (YES). Incubá-lo num agitador orbital a 30 °C durante a noite (O/N).
- Dia 2:
- Cultura secundária: Adicione cerca de 500 μL de cultura primária a 30 mL de caldo YES autoclavado. Incubar a 30 °C durante 3 - 4 h com agitação até que o OD600 atinja 0,4 - 0,6.
NOTA: Para cada transformação, 30 mL são usados. - Pellet a cultura de 30 mL a 2.500 x g por 6-8 min em temperatura ambiente. Rejeitar o sobrenadante e lavar as células com 50 ml de água destilada estéril (D/W). Derrube novamente e descarte o sobrenadante. Ressuspenda as células em 1 mL de D/W estéril e transfira-o para um tubo de centrífuga de 2 mL. Centrifugue como acima e descarte o sobrenadante.
- Adicione 1 mL de acetato de lítio 0,1 M, solução de Tris-EDTA (LiAc-TE) e centrifugue como acima. Rejeitar o sobrenadante e ressuspender em 1 ml de LiAc-TE 0,1 M. Centrifugue e descarte o sobrenadante, deixando 100 μL de solução para trás.
- Adicione 10 a 20 μg de DNA transportador (DNA de esperma de salmão; desnaturado e resfriado rapidamente em gelo) e 2 a 3 μg do DNA do plasmídeo, que precisa ser transformado. Misture delicadamente. Incubar à temperatura ambiente durante 10 min.
- Adicionar 260 μL de 40% de PEG/LiAc-TE; misture delicadamente. Incubar durante 60 min no shaker ou num termomixer a 30 °C com uma mistura suave. Adicione 43 μL de DMSO; misture delicadamente.
- Choque térmico a 42 °C por 10 min no termomisturador. Pellet a 2.500 x g por 6-8 min e descarte o sobrenadante. Lave o pellet 1x com 1 mL de D/W estéril.
- Pellet, descarte o sobrenadante e ressuspenda o pellet em 200 μL de D / W estéril. Placa 100 μL em placas de meio mínimo de Edimburgo (EMM) contendo 5 μg / mL de tiamina (para reprimir o promotor nmt41 ) e suplementos de aminoácidos adenina (0,225 mg / mL), histidina (0,225 mg / mL) e leucina (0,225 mg / mL), mas sem uracila (marcador de seleção para plasmídeo pREP42).
NOTA: Alternativamente, placa 70 μL e 130 μL em duas placas diferentes. Dois volumes diferentes (70 μL e 130 μL) são semeados para obter colônias isoladas em pelo menos uma das placas, dependendo das eficiências de transformação, que podem variar de experimento para experimento. - Incubar as placas a 30 °C durante 2-3 dias até que as colónias apareçam. Misture uma única colônia com 100 μL de D / W estéril e espalhe em uma placa EMM nova contendo tiamina, mas sem uracila, conforme descrito acima.
- Incubar a 30 °C durante 2-3 dias até aparecer um relvado completo. Raspe o gramado crescido de células usando uma alça inoculante e ressuspenda-o para 1 mL de meio YES contendo 30% de glicerol em um frasco criogênico.
- Congelar rapidamente o frasco criogênico em nitrogênio líquido e armazenar a -80 °C para preservar os estoques de levedura congelados.
- Cultura secundária: Adicione cerca de 500 μL de cultura primária a 30 mL de caldo YES autoclavado. Incubar a 30 °C durante 3 - 4 h com agitação até que o OD600 atinja 0,4 - 0,6.
- Expressão de proteínas do citoesqueleto bacteriano em levedura de fissão
- Listre assepticamente um adesivo do estoque de glicerol em uma placa específica de levedura fresca para obter cultura suficiente para novos experimentos.
NOTA: No caso do pREP42, usamos uma placa de ágar EMM (meio mínimo) contendo adenina, histidina e leucina (como usando a cepa de S. pombe (h- leu1-32 ura4-D18)) sem uracila (uracila presente no pREP42 como marcador de seleção). Adicionamos 15 a 20 μM de tiamina às placas de ágar (já que o pREP42 possui o promotor nmt41 repressível de tiamina) para reprimir a expressão do gene de interesse ao crescer na placa. - Inocule uma pequena alça do inóculo do adesivo listrado em 5 mL de meio EMM específico para levedura sem tiamina e incube-o por 10 a 12 h a 30 ° C.
NOTA: A expressão de FtsZ e MreB de diferentes espécies sob o promotor nmt41 no S. pombe pode variar, tipicamente de 16 a 30 h. O tempo ideal para a expressão proteica de GFP-EcMreB e SaFtsZ-GFP em S. pombe é de 20 a 24 h e 16 a 20 h a 30 °C, respectivamente, sem tiamina.
- Listre assepticamente um adesivo do estoque de glicerol em uma placa específica de levedura fresca para obter cultura suficiente para novos experimentos.
2. Tratamento de culturas de S. pombe expressando proteínas citoesqueléticas bacterianas marcadas com GFP
NOTA: Várias moléculas de medicamentos diferentes são testadas na cultura de levedura cultivada durante a noite em uma placa de 96 poços.
- Inocule uma cultura fresca transferindo 50 μL da cultura noturna para cada poço de uma placa de 96 poços contendo 150 μL de meio EMM de levedura fresca usando o instrumento de pipetagem multicanal semiautomatizado de 96 poços.
- Ao pipetar para dentro e para fora para uma mistura adequada usando uma pipeta multicanal semiautomatizada de 96 poços, introduza lentamente diferentes concentrações crescentes de medicamentos na cultura em crescimento, cada uma feita em triplicata, conforme representado no esquema da Figura 1.
- Como controle positivo, use os medicamentos já conhecidos, PC190723 para (S. aureus FtsZ) e A22 (para E. coli MreB) em duplicata.
NOTA: Como relatado anteriormente, PC190723 e A22 foram usados em uma concentração de 56,2 μM17 e 72,6 μM 14,17, respectivamente. Enquanto isso, o tratamento A22 de SaFtsZ e PC190723 tratamento de EcMreB serviram como controles negativos, respectivamente. - Use DMSO como controle de solvente em três concentrações diferentes de acordo com as concentrações mais baixas e mais altas de medicamentos.
NOTA: O solvente no qual os medicamentos são dissolvidos é usado como controle de solvente. - Incubar as culturas de controlo e tratadas a 30 °C durante 6-10 h (até que as células mostrem a expressão de proteínas fluorescentes bacterianas) e, em seguida, obter imagens utilizando microscopia de epifluorescência.
3. Visualização dos polímeros
- Aplicar uma camada de 20 μL de 1 mg/ml de concanavalina A em cada alvéolo da placa de fundo opticamente transparente de 96 poços (paredes pretas para imagens de fluorescência) e incubar durante 20 min à temperatura ambiente. Aspire o líquido e deixe secar ao ar por 10 min.
- Transferir 20 μL de células da placa de cultura para cada poço respectivo e deixar descansar por 10 min. Lave a célula 3x-4x com o meio EMM estéril.
- Com a lente objetiva a ser usada no lugar (consulte a etapa 3.6), use o modo de navegação no painel de aquisição do software de aquisição de imagem para alinhamento de placas de 96 poços e cobertura de poços. Alinhe as bordas do poço no navegador.
- Em seguida, selecione os parâmetros de cobertura do poço, que incluem uma seleção de várias posições da região de interesse no poço, e use o controle de foco automático adaptativo com o modo sob demanda para manter a amostra em foco durante a geração de imagens.
- Adquira imagens usando contraste de interferência diferencial (DIC) e fluorescência. Defina filtros de excitação e emissão de 475/28 nm e 525/48 nm, respectivamente, para obter imagens das proteínas bacterianas marcadas com GFP expressas em leveduras. Obtenha pilhas Z em um tamanho de passo de 0,2 μm através da espessura das células de levedura (5 μm).
- Capture imagens usando um microscópio de epifluorescência invertida equipado com uma objetiva de imersão em óleo de 1,4 NA de 100x e uma câmera CMOS de 2.000 x 2.000 sCMOS (tamanho de pixel de 6,5 μm x 6,5 μm). Use um sistema de iluminação LED para excitação do fluoróforo.
NOTA: Qualquer sistema de microscópio de epifluorescência que tenha uma platina motorizada para uma placa de 96 poços com posicionamento preciso de vários pontos deve ser adequado. Adquira todas as imagens celulares de controle e tratadas com drogas com um tempo de exposição semelhante (geralmente na faixa de 0,3 a 0,5 s) em um binning de 1 x 1 e iluminação de 15% a 20% para minimizar as variáveis do experimento e manter a consistência.
4. Quantificação das imagens usando ImageJ
- Processe imagens de células e meça o número de pontos por célula e a densidade de FtsZ17. No caso de MreB, meça a densidade e a anisotropia23 e compare entre as células controle e tratadas usando Fiji (v2.0.0-rc-69 / 1.52p) 24.
- Usando as imagens do canal DIC, primeiro contorne as células de levedura individuais usando a ferramenta de desenho à mão livre e salve como uma região de interesse (ROI) no gerenciador de ROI. Esta etapa ainda não é automatizada, mas ferramentas desenvolvidas recentemente usando aprendizado de máquina 25,26 podem ser tentadas e incorporadas em um futuro próximo.
- Mascarar a área externa da cela e preencher de preto conforme descrito em27.
- Use a macro de análise OPS threshold IJ1, um recurso integrado em Fiji, para contar o número de pontos24.
- Use o método otsu para limite automático e mascare as partículas segmentadas. Execute o plug-in analisar partículas usando uma macro.
- Para medir a densidade do polímero (quantidade de citoesqueleto por unidade de área em uma célula), processe as imagens conforme descrito, incluindo as etapas de mascaramento e esqueletização27,28. Use Lpx 2Dfilter no plug-in lpx para esqueletizar as imagens.
- Para obter detalhes, consulte esta publicação recente17. Realize a quantificação do polímero EcMreB conforme mencionado anteriormente em23, use anisotropia para quantificar a organização espacial usando FibrilTool29 conforme descrito anteriormente23.
NOTA: Esses métodos de análise podem ser usados para quantificar quaisquer outras proteínas do citoesqueleto bacteriano que são tratadas ou não tratadas pelos medicamentos.
Resultados
Instalação da placa de 96 poços para a triagem de drogas
O uso de S. pombe para expressar um S. aureus FtsZ marcado com GFP C- terminal de um vetor (pREP42) contendo o promotor repressível de tiamina de força média nmt41foi previamente estabelecido17 e, da mesma forma, o MreB de E. coli marcado com GFP N-terminal também foi expresso em S. pombe14. Também mostramos que PC190723, um inibidor específico de SaFtsZ e A22, um inibidor de MreB, podem exercer seus efeitos sobre as respectivas proteínas do citoesqueleto bacteriano de maneira específica quando expressas em leveduras14,17.
Aqui, propomos usar o sistema de expressão de levedura para desenvolver uma triagem de médio ou alto rendimento de drogas antibacterianas direcionadas às proteínas do citoesqueleto bacteriano. Um microscópio de epifluorescência com platina motorizada pode ser automatizado para obter imagens de uma placa de 96 poços, e bibliotecas comerciais de medicamentos também estão prontamente disponíveis em formatos de placa de 96 poços. Portanto, preferimos usar uma placa de 96 poços para a triagem proposta de medicamentos. As placas são ajustadas conforme mostrado na Figura 1. A primeira linha (Figura 1A) consiste em cultura de levedura que expressa SaFtsZ-GFP. A segunda linha (Figura 1B) consiste em culturas de leveduras que expressam GFP-EcMreB. As duas primeiras colunas das duas primeiras linhas (A1:B2) são definidas como mídia em branco. As seis colunas seguintes das duas primeiras linhas (A3:B12) são definidas como controle DMSO com três concentrações diferentes de acordo com as diluições do medicamento em duplicata. Em seguida, PC190723 (56,2 μM) e A22 (72,6 μM) são adicionados às células de levedura que expressam SaFtsZ-GFP ou GFP-EcMreB. PC190723 e A22 servem como controles positivos para FtsZ e MreB, respectivamente. Todos os outros poços (C1:F12) são utilizados para adicionar vários medicamentos (em três concentrações diferentes e em duplicata) usados na tela para identificar efetores das proteínas do citoesqueleto bacteriano, SaFtsZ ou EcMreB. Culturas de levedura que expressam o SaFtsZ ou MreB marcado com GFP são dispensadas nessas placas de 96 poços e cultivadas até que os efeitos dos medicamentos na montagem dos polímeros sejam visualizados.
Avaliação dos efeitos do crescimento em células de levedura
Depois de incubar as células subcultivadas contendo 96 poços a 30 ° C por 6 a 10 h, a densidade óptica (DO) da cultura de levedura é medida usando um leitor de microplacas. A medição da DO ajuda a avaliar qualquer efeito inibitório do crescimento das drogas contra as células de levedura eucarióticas e possivelmente efeitos deletérios nas células humanas. Assim, este ensaio pode ser usado para filtrar vários medicamentos com base em sua toxicidade no sistema de levedura. No entanto, nem PC190723 nem A22 exibem quaisquer efeitos de crescimento ou toxicidade para células de levedura, e OD600 das culturas que expressam SaFtsZ-GFP tratadas com DMSO, PC190723 ou A22 foram 0,38 ± 0,03, 0,44 ± 0,02 e 0,43 ± 0,06 (N ≥ 4), respectivamente. Da mesma forma, o OD600 das culturas expressando GFP-EcMreB e tratadas com DMSO, PC190723 ou A22 foram 0,38 ± 0,04, 0,44 ± 0,07 e 0,41 ± 0,08 (N ≥ 4), respectivamente.
Visualização do efeito dos fármacos sobre as estruturas poliméricas montadas por SaFtsZ e EcMreB expressas em S. pombe
A fim de avaliar o efeito dos fármacos na polimerização de SaFtsZ ou EcMreB, uma alíquota das células de levedura da placa de 96 poços acima mencionada contendo fármacos é transferida para outra placa de 96 poços com fundo de vidro opticamente transparente de 96 poços adequada para imagens de fluorescência. Esta placa de 96 poços também é revestida com concanavalina A para permitir a adesão das células de levedura que expressam o SaFtsZ ou EcMreB marcado com GFP. A placa de 96 poços é fotografada usando um microscópio de epifluorescência cobrindo todos os 96 poços da placa nas posições predeterminadas, conforme controlado pelo software de aquisição de imagem (Figura 2). Nos poços controle (tratados com DMSO), as células de levedura que expressam SaFtsZ-GFP apresentaram estruturas poliméricas na forma de manchas ou manchas distribuídas por todas as células, após 16 - 18 h de crescimento na ausência de tiamina. No entanto, 10 a 12 h após o crescimento na falta de tiamina, as células exibiram apenas fluorescência difusa ou poucas manchas, sugerindo que a expressão de FtsZ-GFP não atingiu a concentração crítica necessária para a polimerização (Figura 3A). Ao contrário, a droga estabilizadora FtsZ, PC190723, apresentou um aumento considerável nas estruturas poliméricas (manchas ou manchas) de SaFtsZ-GFP em comparação com o controle DMSO após 12 h de crescimento (Figura 3B), servindo como controle positivo. Em contraste, as células tratadas com A22 não mostraram diferença nas estruturas SaFtsZ-GFP montadas ( Figura 3C ). No entanto, ao contrário das culturas tratadas com PC190723, o SaFtsZ-GFP foi montado em manchas em culturas não tratadas apenas quando induzido por períodos mais longos, mostrando que o PC190723 agiu para reduzir a concentração crítica de polimerização de SaFtsZ (Figura 3D). Da mesma forma, GFP-EcMreB expresso em S. pombe formou matrizes lineares de filamentos longos ao longo do eixo longitudinal da levedura de fissão (Figura 4A). Embora PC190723 não tenha efeito na polimerização de EcMreB ( Figura 4B ), o tratamento de células com A22 resultou em fluorescência difusa em todo o citoplasma das células de levedura ( Figura 4C ). As imagens do restante das placas de 96 poços são inspecionadas visualmente quanto a qualquer estabilização ou efeitos inibitórios dos medicamentos no SaFtsZ ou EcMreB, conforme o caso.
O impacto dos medicamentos na montagem de proteínas bacterianas do citoesqueleto pode então ser quantificado usando ferramentas de análise de imagem e plug-ins em ImageJ ou Fiji, conforme relatado anteriormente para SaFtsZ17 e EcMreB21. A aquisição automatizada de imagens em formato de placa de 96 poços e a implementação de macros e scripts personalizados para processamento de imagens podem acelerar o tempo de imagem e a quantificação dos efeitos dos medicamentos. Assim, usando a levedura eucariótica unicelular, S. pombe, como sistema hospedeiro, propomos que uma triagem de médio ou alto rendimento para pequenas moléculas direcionadas às proteínas bacterianas do citoesqueleto pode ser realizada com sucesso, levando à descoberta de novos antibióticos.
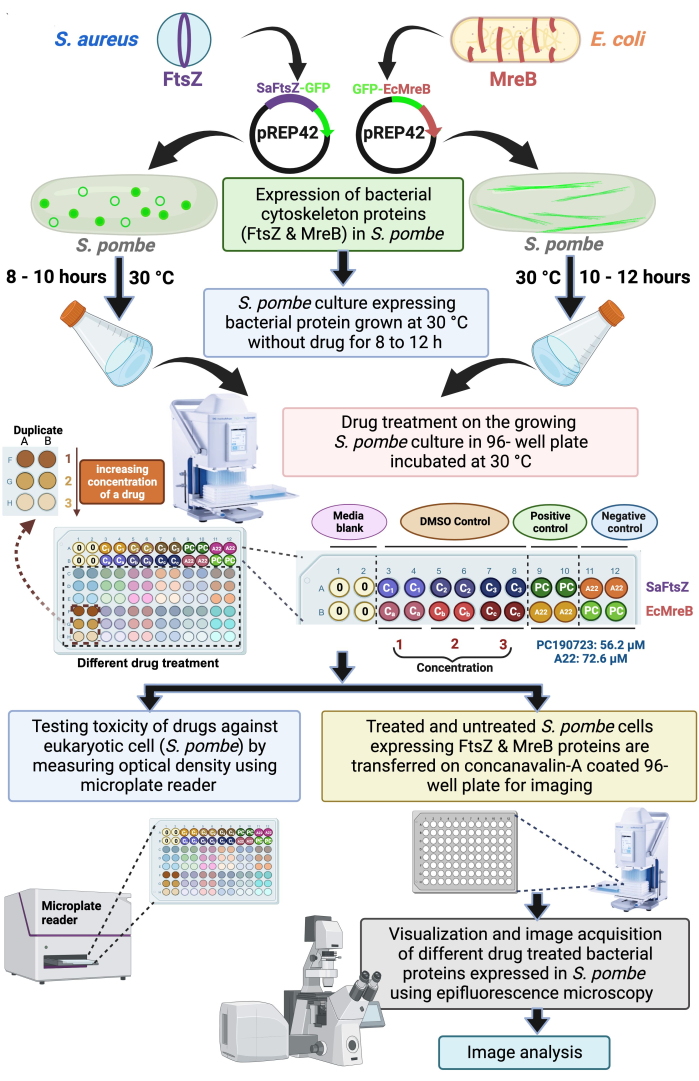
Figura 1: Esquema mostrando o uso de células de levedura de fissão para rastrear drogas direcionadas à montagem de proteínas bacterianas do citoesqueleto SaFtsZ ou EcMreB. FtsZ de S. aureus e MreB de E. coli foram clonados no vetor de expressão de levedura, pREP42 com marca GFP nos terminais C e N, respectivamente e transformados em S. pombe para o estudo fenotípico e de drogas. As culturas foram cultivadas por 8 - 12 h. Posteriormente, as culturas foram subcultivadas em placas de 96 poços com controles apropriados e os diferentes medicamentos sendo rastreados. Além disso, a placa foi incubada a 30 ° C por 6 a 8 h até que o OD600 atinja 0,5-0,6, e a densidade óptica é medida usando um leitor de microplacas para avaliar a toxicidade dos medicamentos para as células de levedura. Outra placa de 96 poços com fundo de vidro opticamente transparente foi pré-revestida com concanavalina A, para aderir às células de levedura. Esta placa de 96 poços foi usada para visualização e aquisição de imagens com um microscópio de epifluorescência. As imagens obtidas foram então analisadas. Clique aqui para ver uma versão maior desta figura.
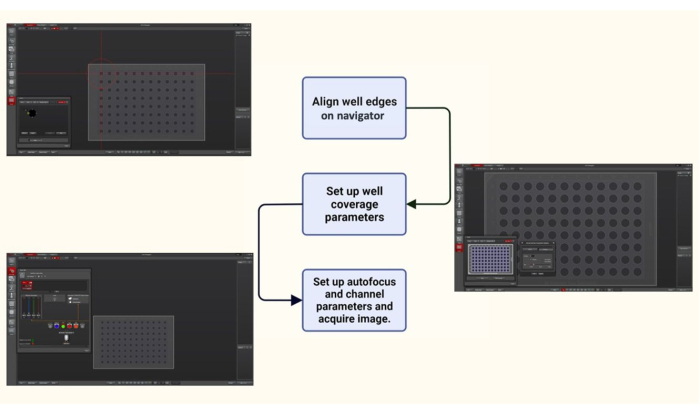
Figura 2: Esquema do software de aquisição de imagem para imagem automatizada de uma placa de 96 poços. Usando o navegador no software de aquisição de imagens, uma placa de 96 poços foi alinhada marcando as bordas. Parâmetros de cobertura do poço, como o número de imagens que precisam ser tiradas de cada poço e sua localização (aleatória ou do centro do poço), foram selecionados conforme desejado. Por fim, parâmetros de imagem como o conjunto de filtros a ser usado (DIC e FITC-filter; Ex 475/28 nm e Em 525/48 nm), foram definidos a porcentagem de intensidade da luz de iluminação, o foco automático e o tempo de exposição para captura de imagem. Clique aqui para ver uma versão maior desta figura.

Figura 3: Visualização do efeito dos medicamentos PC190723 e A22 no SaFtsZ-GFP expresso em S. pombe. A cultura de S. pombe expressando SaFtsZ-GFP foi cultivada na ausência de tiamina por 8 a 9 h a 30 ° C antes do DMSO e do tratamento medicamentoso. A cultura foi posteriormente cultivada em uma placa de 96 poços por 7 a 9 h a 30 ° C na presença ou ausência dos medicamentos. (A) No controle de DMSO, onde uma quantidade equivalente de DMSO foi adicionada, as células exibiram algumas estruturas poliméricas. (B) Na presença de PC190723 (56,2 μM), SaFtsZ expressa células de levedura mostrando um aumento considerável nas estruturas poliméricas do que o controle DMSO. (C) O inibidor de MreB, A22 (72,6 μM), não afetou as estruturas SaFtsZ-GFP. (D) Mais horas de expressão proteica foram necessárias para a montagem de SaFtsZ-GFP na ausência de PC190723 e, portanto, culturas de controle cultivadas a 30 ° C por 12 - 15 h após subcultivo em placa de 96 poços contendo DMSO também exibem polímeros FtsZ. A barra de escala é de 5 μm. Clique aqui para ver uma versão maior desta figura.
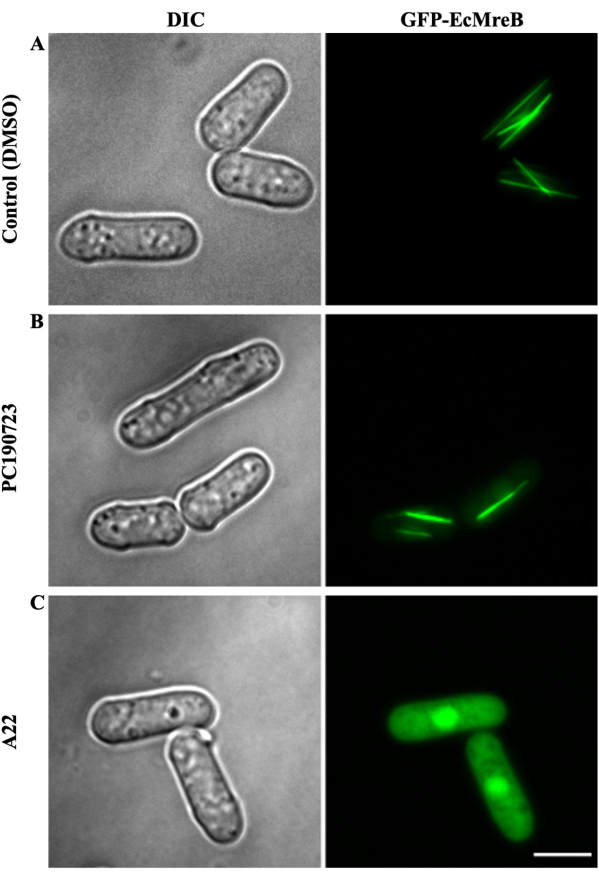
Figura 4: Visualização do efeito dos medicamentos PC190723 e A22 na GFP-EcMreB expressa em S. pombe. A cultura de S. pombe expressando GFP-EcMreB foi cultivada na ausência de tiamina por 9 a 11 h a 30 ° C antes da adição de DMSO ou dos medicamentos (A22 ou PC190723). A cultura foi posteriormente cultivada em uma placa de 96 poços por 8 a 10 h a 30 ° C com e sem drogas como controle. (A) Em culturas onde uma quantidade equivalente de DMSO foi adicionada como controle, as células exibiram filamentos lineares de EcMreB orientados ao longo do eixo longitudinal das células de levedura. (B) A montagem de GFP-EcMreB não foi afetada em culturas tratadas com PC190723 (56,2 μM). (C) A pequena molécula A22 (72,6 μM), um conhecido inibidor da polimerização de MreB, impediu a montagem de GFP-EcMreB em células de levedura de fissão. A barra de escala é de 5 μm. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Cepas e plasmídeos usados neste estudo. Clique aqui para baixar esta tabela.
Tabela 2: Composição dos meios e tampões utilizados neste estudo. Clique aqui para baixar esta tabela.
Discussão
A resistência antimicrobiana (RAM) é uma séria ameaça à saúde global e há uma necessidade urgente de novos antibióticos com novos alvos. O citoesqueleto bacteriano emergiu como um alvo atraente para o desenvolvimento de novos antibióticos, com inibidores de pequenas moléculas da proteína de divisão celular FtsZ, como TXA709, já em ensaios clínicos de FaseI 30. Vários métodos têm sido desenvolvidos para identificar inibidores da polimerização de FtsZ 7,31. Recentemente, usamos a levedura de fissão eucariótica em um ensaio baseado em células para mostrar que a droga estabilizadora FtsZ, PC190723, pode ter como alvo o HpFtsZ17. Além disso, também mostramos que, embora drogas como berberina e sanguinarina afetassem a polimerização de FtsZ, elas também afetavam a morfologia das células de levedura17. Motivados por esses estudos e observações, nos propusemos a desenvolver um ensaio baseado em células de etapa única para rastrear moduladores de pequenas moléculas do citoesqueleto bacteriano usando a plataforma de expressão de levedura de fissão. Como a tela depende da inibição da montagem de proteínas do citoesqueleto marcadas com GFP, pequenas moléculas que compartilham propriedades semelhantes de fluoróforo podem dar origem a falsos positivos. Evitar filtros passa-longa e escolher filtros passa-banda estreitos pode ajudar a reduzir esses falsos positivos decorrentes de pequenas moléculas fluorescentes. Aqui, mostramos as etapas envolvidas na configuração de uma tela de rendimento médio usando um microscópio de epifluorescência equipado com um suporte de platina de placa de 96 poços que pode ser usado para rastrear medicamentos direcionados a SaFtsZ ou EcMreB. O fluxo de trabalho envolve aquisição e análise de imagens semiautomatizadas, que podem ser facilmente dimensionadas para telas de alto rendimento no futuro usando sistemas robóticos de manuseio de líquidos e pipelines de processamento de imagens.
Além disso, a tela deve ser útil para outras proteínas bacterianas do citoesqueleto, como a proteína de manutenção do plasmídeo ParM32 contendo dobra de actina e contra qualquer proteína que se monte em estruturas poliméricas na levedura de fissão. No entanto, os níveis ideais de expressão para cada proteína de interesse precisarão ser padronizados antes do uso em qualquer triagem de drogas. Enquanto para FtsZs, descobrimos que o nmt41 é um promotor ideal, para outras proteínas de interesse, uma versão mais forte ou mais fraca do promotor nmt1 (Força do promotor (e vazamento): nmt1 > nmt41 > nmt81) ou outros promotores constitutivos, como a levedura adh1 ou act118,33 podem ser tentados para obter níveis ótimos de expressão e montagem de estruturas poliméricas. Além disso, ao usar plasmídeos epissómicos, as variações no número de cópias de célula para célula também representam problemas para a expressão gênica uniforme. Para contornar esses problemas, vários vetores que podem ser integrados ao genoma da levedura de fissão (SIVs para vetores de integração estáveis) carregando promotores de várias forças foram desenvolvidos recentemente34. O uso desses vetores pode oferecer resultados mais uniformes e quantitativos em comparação com os vetores epissómicos utilizados neste estudo. O uso de SIVs pode evitar a grande heterogeneidade nos níveis de expressão, visto como uma variação nas intensidades de fluorescência entre as células e deve ser mais adequado para telas de alto rendimento.
Além disso, drogas como PC190723 atuam para estabilizar os polímeros FtsZ, resultando na montagem precoce de filamentos FtsZ em comparação com células não tratadas. Embora a triagem seja adequada para a triagem de medicamentos que inibem a polimerização de proteínas bacterianas do citoesqueleto, devido à avaliação visual da fluorescência difusa no ponto final, a triagem de medicamentos estabilizadores de polímeros FtsZ requer otimização adicional dos níveis de expressão de proteínas e o tempo necessário para atingir o número máximo de células com polímeros. Portanto, é fundamental ter uma estimativa razoável do tempo necessário para a expressão da proteína atingir a concentração crítica necessária para a montagem e decidir o ponto final do ensaio de acordo. No caso de drogas que podem atuar para diminuir a concentração crítica necessária para a polimerização da proteína, a escolha do ponto final normalmente seria um momento em que uma população considerável de células não tratadas exibiria fluorescência difusa, mas as culturas tratadas com drogas exibiriam conjuntos de polímeros.
Uma das limitações, que também é uma etapa demorada do fluxo de trabalho, é a necessidade de identificar e segmentar células individuais para análise quantitativa de imagens. Atualmente, no esquema proposto, esta é uma etapa manual para identificar células de levedura individuais e atribuir a região de interesse (ROIs) para a quantificação do efeito dos medicamentos. No entanto, prevemos que os algoritmos de aprendizado de máquina recentemente desenvolvidos usando conjuntos de treinamento, como os implementáveis no ilastik35 , devem minimizar a necessidade de intervenção manual.
Embora nossa abordagem aqui usando a plataforma de levedura seja útil para identificar hits e pequenas moléculas potenciais direcionadas ao citoesqueleto bacteriano, eventualmente será necessário testar sua atividade antibacteriana usando os testes padrão de concentração inibitória mínima e eficácia em modelos animais. No entanto, o maior desafio para o aumento global da resistência antimicrobiana (AMR) ainda está na permeabilidade da membrana externa das bactérias Gram-negativas e nas numerosas bombas de efluxo em muitas espécies bacterianas patogênicas. Além disso, as bombas de efluxo na levedura de fissão também podem apresentar problemas semelhantes e concentrações mais altas de drogas podem ser necessárias para o processo de triagem. Alternativamente, cepas de levedura de fissão que são hipersensíveis a drogas (S. pombe MDR-supML), como resultado da deleção dos sete genes de resistência a múltiplas drogas, incluindo quatro genes transportadores e um fator de transcrição, podem ser usadas como hospedeiros para triagem32,33. Desenvolvimentos futuros em tecnologias que combinem a descoberta antibacteriana direcionada e abordem a resistência devido a fenômenos gerais, como a permeabilidade da membrana, serão necessários para enfrentar a crescente resistência antimicrobiana.
Divulgações
Todos os autores declaram não haver conflitos de interesse.
Agradecimentos
SMP, SR e AKS reconhecem as bolsas recebidas do Instituto Nacional de Educação e Pesquisa Científica, Departamento de Energia Atômica. O RS reconhece o apoio financeiro interno do Departamento de Energia Atômica, e este trabalho é apoiado por meio de uma bolsa de pesquisa para o RS (BT/PR42977/MED/29/1603/2022) do Departamento de Biotecnologia (DBT). Os autores também agradecem a V Badireenath Konkimalla por seus comentários, sugestões e discussões ao longo do desenvolvimento do protocolo.
Materiais
| Name | Company | Catalog Number | Comments |
| 96 Well CC2 Optical CVG Sterile, w/Lid. Black | Thermo Scientific™ | 160376 | |
| 96-well plate | Corning | CLS3370 | |
| A22 Hydrochloride | Sigma | SML0471 | Dissolved in DMSO |
| Adenine | FormediumTM | DOC0229 | 225 mg/L of media |
| Concanavalin A | Sigma | C5275-5MG | |
| DMSO | Sigma | 317275 | |
| Edinburg minimal medium (EMM Agar or EMM Broth) | FormediumTM | PMD0210 | See below for composition |
| EDTA | Sigma | EDS-500G | |
| epMotion® 96 with 2-position slider | Eppendorf | 5069000101 | |
| Histidine | FormediumTM | DOC0144 | 225 mg/L of media |
| Leica DMi8 inverted fluorescence microscope | Leica Microsystems | German company | |
| Leucine | FormediumTM | DOC0157 | 225 mg/L of media |
| Lithium acetate | Sigma | 517992-100G | |
| PC190723 | Merck | 344580 | Dissolved in DMSO |
| Polyethylene glycol (PEG) | Sigma | 202398 | |
| Thiamine | Sigma | T4625 | Filter sterilised |
| Tris-Hydrochloride | MP | 194855 | |
| Uracil | FormediumTM | DOC0214 | 225 mg/L of media, Store solution at 36°C |
| YES (Yeast extract + supplements) Agar | FormediumTM | PCM0410 | See below for composition |
| YES (Yeast extract + supplements) Broth | FormediumTM | PCM0310 | See below for composition |
| Yeast (S. pombe) media | |||
| Yeast extract + supplements (YES) | |||
| Composition | g/L | ||
| Yeast extract | 5 | ||
| Dextrose | 30 | ||
| Agar | 17 | ||
| Adenine | 0.05 | ||
| L-Histidine | 0.05 | ||
| L-Leucine | 0.05 | ||
| L-Lysine HCl | 0.05 | ||
| Uracil | 0.05 | ||
| Edinburg minimal medium (EMM) | |||
| Composition | g/L | concentration | |
| potassium hydrogen phthallate | 3 | 14.7mM | |
| Na2HPO4 | 2.2 | 15.5 mM | |
| NH4Cl | 5 | 93.5 mM | |
| glucose | 2% (w/v) or 20 g/L | 111 mM | |
| Salts (stock x 50) | 20 mL/L (v/v) | ||
| Vitamins (stock x 1000) | 1 mL/L (v/v) | ||
| Minerals (Stock x 10,000) | 0.1 mL/L (v/v) | ||
| Salts x 50 | 52.5 g/l MgCl2.6H20 (0.26 M) | 52.5 | 0.26 M |
| 0.735 mg/l CaCl2.2H20 (4.99 mM) | 0.000735 | 4.99 mM | |
| 50 g/l KCl (0.67 M) | 50 | 0.67 M | |
| 2 g/l Na2SO4 (14.l mM) | 2 | 14.1 mM | |
| Vitamins x 1000 | 1 g/l pantothenic acid | 1 | 4.20 mM |
| 10 g/l nicotinic acid | 10 | 81.2 mM | |
| 10 g/l inositol | 10 | 55.5 mM | |
| 10 mg/l biotin | 0.01 | 40.8 µM | |
| Minerals x 10,000 | boric acid | 5 | 80.9 mM |
| MnSO4 | 4 | 23.7 mM | |
| ZnSO4.7H2O | 4 | 13.9 mM | |
| FeCl2.6H2O | 2 | 7.40 mM | |
| molybdic acid | 0.4 | 2.47 mM | |
| KI | 1 | 6.02 mM | |
| CuSO4.5H2O | 0.4 | 1.60 mM | |
| citric acid | 10 | 47.6 mM | |
| Strains/ Plasmids | |||
| Strains | Description | Reference | |
| CCD190 | Escherichia coli DH10β | Invitrogen | |
| CCDY4 | MBY3532; CCDY346/pREP42- GFP-EcMreB | Srinivasan et al., 2007 | |
| CCDY340 | CCDY346/pREP42- SaFtsZ-GFP | Sharma et al., 2023 | |
| CCDY346 | MBY192; Schizosaccharomyces pombe [ura4-D18, leu1-32, h-] | Dr. Mithilesh Mishra (DBS, TIFR) | |
| Plasmids | |||
| pCCD3 | pREP42-GFP-EcMreB | Srinivasan et al., 2007 | |
| pCCD713 | pREP42-SaFtsZ-GFP | Sharma et al., 2023 |
Referências
- Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- Haselbeck, R., et al. Comprehensive essential gene identification as a platform for novel anti-infective drug discovery. Curr Pharma Des. 8 (13), 1155-1172 (2002).
- Wang, J., et al. Discovery of a small molecule that inhibits cell division by blocking FtsZ, a novel therapeutic target of antibiotics. J Biol Chem. 278 (45), 44424-44428 (2003).
- Sanchez, S., Demain, A. L. Antibiotics: current innovations and future trends. , Caister Academic Press. (2015).
- Vollmer, W. The prokaryotic cytoskeleton: a putative target for inhibitors and antibiotics. Appl Microbiol Biotechnol. 73 (1), 37-47 (2006).
- Vollmer, W. Targeting the bacterial Z-ring. Chem Biol. 15 (2), 93-94 (2008).
- Kusuma, K. D., Payne, M., Ung, A. T., Bottomley, A. L., Harry, E. J. FtsZ as an antibacterial target: status and guidelines for progressing this avenue. ACS Infect Dis. 5 (8), 1279-1294 (2019).
- Kaul, M., Zhang, Y., Parhi, A. K., Lavoie, E. J., Pilch, D. S. Inhibition of RND-type efflux pumps confers the FtsZ-directed prodrug TXY436 with activity against Gram-negative bacteria. Biochem Pharmacol. 89 (3), 321-328 (2014).
- Casiraghi, A., Suigo, L., Valoti, E., Straniero, V. Targeting bacterial cell division: A binding site-centered approach to the most promising inhibitors of the essential protein FtsZ. Antibiotics. 9 (2), 69(2020).
- Piddock, L. J. V. Multidrug-resistance efflux pumps - not just for resistance. Nat Rev. Microbiol. 4 (8), 629-636 (2006).
- Käufer, N. F., Simanis, V., Nurse, P. Fission yeast Schizosaccharomyces pombe correctly excises a mammalian RNA transcript intervening sequence. Nature. 318 (6041), 78-80 (1985).
- Vyas, A., Freitas, A. V., Ralston, Z. A., Tang, Z. Fission yeast Schizosaccharomyces pombe: A unicellular micromammal model organism. Curr Prot. 1 (6), e151(2021).
- Edwards, D. H., Thomaides, H. B., Errington, J. Promiscuous targeting of Bacillus subtilis cell division protein DivIVA to division sites in Escherichia coli and fission yeast. EMBO J. 19 (11), 2719-2727 (2000).
- Srinivasan, R., Mishra, M., Murata-Hori, M., Balasubramanian, M. K. Filament formation of the Escherichia coli actin-related protein, MreB, in fission yeast. Curr Biol. 17 (3), 266-272 (2007).
- Srinivasan, R., Mishra, M., Wu, L., Yin, Z., Balasubramanian, M. K. The bacterial cell division protein FtsZ assembles into cytoplasmic rings in fission yeast. Gene Dev. 22 (13), 1741-1746 (2008).
- TerBush, A. D., Osteryoung, K. W. Distinct functions of chloroplast FtsZ1 and FtsZ2 in Z-ring structure and remodeling. J Cell Biol. 199 (4), 623-637 (2012).
- Sharma, A. K., et al. A mechanism of salt bridge-mediated resistance to FtsZ inhibitor PC190723 revealed by a cell-based screen. Mol Biol Cell. 34 (3), ar16(2023).
- Basi, G., Schmid, E., Maundrell, K. TATA box mutations in the Schizosaccharomyces pombe nmt1 promoter affect transcription efficiency but not the transcription start point or thiamine repressibility. Gene. 123 (1), 131-136 (1993).
- Moreno, M. B., Durán, A., Carlos Ribas, J. A family of multifunctional thiamine-repressible expression vectors for fission yeast. Yeast. 16 (9), 861-872 (2000).
- Green, M. R., Sambrook, J. Caring for Escherichia coli. Cold Spring Harb Protoc. , (2018).
- Green, M. R., Sambrook, J. Isolation and quantification of DNA. Cold Spring Harb Protoc. , (2018).
- Bähler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Pande, V., Mitra, N., Bagde, S. R., Srinivasan, R., Gayathri, P. Filament organization of the bacterial actin MreB is dependent on the nucleotide state. J Cell Biol. 221 (5), e202106092(2022).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Meth. 9 (7), 676-682 (2012).
- Zhang, L. Machine learning for enumeration of cell colony forming units. Vis Comput Ind Biomed Art. 5 (1), 26(2022).
- Moen, E., et al. Deep learning for cellular image analysis. Nat Meth. 16 (12), 1233-1246 (2019).
- Higaki, T. Quantitative evaluation of cytoskeletal organizations by microscopic image analysis. Plant Morphol. 29 (1), 15-21 (2017).
- Henty-Ridilla, J. L., Li, J., Day, B., Staiger, C. J. ACTIN DEPOLYMERIZING FACTOR4 regulates actin dynamics during innate immune signaling in Arabidopsis. Plant Cell. 26 (1), 340-352 (2014).
- Boudaoud, A., et al. an ImageJ plug-in to quantify fibrillar structures in raw microscopy images. Nat Protoc. 9 (2), 457-463 (2014).
- Butler, M. S., Paterson, D. L. Antibiotics in the clinical pipeline in October 2019. J Antibio. 73 (6), 329-364 (2019).
- Andreu, J. M., Huecas, S., Araújo-Bazán, L., Vázquez-Villa, H., Martín-Fontecha, M. The search for antibacterial inhibitors targeting cell division protein ftsz at its nucleotide and allosteric binding sites. Biomedicines. 10 (8), 1825(2022).
- Vještica, A., et al. A toolbox of stable integration vectors in the fission yeast Schizosaccharomyces pombe. J Cell Sci. 133 (1), jcs240754(2020).
- Berg, S., et al. ilastik: interactive machine learning for (bio)image analysis. Nat Meth. 16 (12), 1226-1232 (2019).
- Shaevitz, J. W., Gitai, Z. The structure and function of bacterial actin homologs. Cold Spring Harb Pers Biol. 2 (9), a000364(2010).
- Hoffman, C. S., Wood, V., Fantes, P. A. An ancient yeast for young geneticists: A primer on the Schizosaccharomyces pombe model system. Genetics. 201 (2), 403-423 (2015).
- Aoi, Y., et al. Dissecting the first and the second meiotic divisions using a marker-less drug-hypersensitive fission yeast. Cell Cycle. 13 (8), 1327-1334 (2014).
- Zhang, J., et al. Improving drug sensitivity of HIV-1 protease inhibitors by restriction of cellular efflux system in a fission yeast model. Pathogens. 11 (7), 804(2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados