Method Article
خميرة الانشطار كمنصة لشاشات الأدوية المضادة للبكتيريا التي تستهدف بروتينات الهيكل الخلوي البكتيرية
In This Article
Summary
تستخدم خميرة الانشطار هنا كمضيف غير متجانس للتعبير عن البروتينات الهيكلية الخلوية البكتيرية مثل FtsZ و MreB كبروتينات اندماج متعدية مع GFP لتصور بلمرتها. أيضا ، يتم تحديد المركبات التي تؤثر على البلمرة عن طريق التصوير باستخدام المجهر الفلوري.
Abstract
تؤدي البروتينات الهيكلية الخلوية البكتيرية مثل FtsZ و MreB وظائف أساسية مثل انقسام الخلايا والحفاظ على شكل الخلية. علاوة على ذلك ، برزت FtsZ و MreB كأهداف مهمة لاكتشاف مضادات الميكروبات الجديدة. تم تطوير العديد من المقايسات لتحديد المركبات التي تستهدف ربط النوكليوتيدات وبلمرة هذه البروتينات الهيكلية الخلوية ، والتي تركز بشكل أساسي على FtsZ. علاوة على ذلك ، فإن العديد من الفحوصات إما شاقة أو كثيفة التكلفة ، والتأكد مما إذا كانت هذه البروتينات هي الهدف الخلوي للدواء غالبا ما يتطلب طرقا متعددة. أخيرا ، تشكل سمية الأدوية للخلايا حقيقية النواة مشكلة أيضا. هنا ، نصف مقايسة قائمة على الخلية من خطوة واحدة لاكتشاف جزيئات جديدة تستهدف الهيكل الخلوي البكتيري وتقليل الضربات التي قد تكون سامة للخلايا حقيقية النواة. خميرة الانشطار قابلة للشاشات عالية الإنتاجية القائمة على الفحص المجهري ، ويمكن للشاشة المرئية التعرف بسهولة على أي جزيء يغير بلمرة FtsZ أو MreB. يستخدم الفحص الخاص بنا الصفيحة القياسية المكونة من 96 بئرا ويعتمد على قدرة البروتينات الهيكلية الخلوية البكتيرية على البلمرة في خلية حقيقية النواة مثل خميرة الانشطار. في حين أن البروتوكولات الموصوفة هنا مخصصة لخميرة الانشطار وتستخدم FtsZ من المكورات العنقودية الذهبية و MreB من الإشريكية القولونية ، إلا أنها قابلة للتكيف بسهولة مع البروتينات الهيكلية الخلوية البكتيرية الأخرى التي تتجمع بسهولة في البوليمرات في أي مضيفات تعبير حقيقية النواة. يجب أن تساعد الطريقة الموصوفة هنا في تسهيل اكتشاف المزيد من مضادات الميكروبات الجديدة التي تستهدف البروتينات الهيكلية الخلوية البكتيرية.
Introduction
خلقت المقاومة الواسعة النطاق لجميع المضادات الحيوية المستخدمة حاليا لمكافحة الالتهابات البكتيرية ضرورة فورية لفئات جديدة من المضادات الحيوية. أشار تقرير صدر عام 2019 إلى أن العدوى المقاومة للمضادات الحيوية أدت إلى فقدان 1.27 مليون شخص ، مما ساهم في حصيلة إجمالية بلغت 4.95 مليون حالة وفاة عند النظر في مضاعفات العدوى البكتيرية المقاومة1. في حين أن الترسانة الحالية من المضادات الحيوية لا تزال فعالة في الممارسة السريرية ، إلا أنها تستهدف في الغالب طيفا ضيقا من العمليات الخلوية ، مع التركيز بشكل أساسي على جدار الخلية والحمض النووي وتخليق البروتين. على مدى نصف القرن الماضي ، تم استغلال أقل من 30 بروتينا تجاريا كأهداف لتطوير مضادات جديدة للبكتيريا 2,3. هذا النطاق المحدود من الأهداف القابلة للتطبيق يخلق قيودا كبيرة على اكتشاف مضادات حيوية جديدة أو مشتقاتها لمكافحة البكتيريا المقاومة للمضادات الحيوية. وبالتالي ، للتغلب على مشكلة مقاومة المضادات الحيوية الناشئة ، هناك حاجة لتطوير مضادات حيوية جديدة ذات أهداف وآليات عمل جديدة.
يجب أن يكون الهدف المضاد للبكتيريا بشكل مثالي مكونا أساسيا لنمو الخلايا البكتيرية ، وأن يتم حفظه في جميع أنحاء الأنواع المتنوعة من الناحية التطورية ، وأن يظهر أقل تماثل حقيقي النواة ، وأن يكون في متناول المضادات الحيوية4. منذ اكتشاف البروتينات الهيكلية الخلوية البكتيرية المشاركة في انقسام الخلايا والحفاظ على شكل الخلية ، ظهرت كنقطة محورية واعدة لتطوير المركبات المضادة للبكتيريا5. هذه البروتينات ضرورية لحيوية البكتيريا وتلعب دورا محوريا في الحفاظ على شكل الخلية (MreB ، CreS) ، والانقسام (FtsZ ، FtsA) ، وفصل الحمض النووي (ParM ، TubZ ، PhuZ ، AlfA) ، على غرار الهيكل الخلوي في الخلايا حقيقية النواة. والجدير بالذكر أن FtsZ يظهر مستوى عاليا بشكل ملحوظ من الحفظ عبر مجموعة واسعة من الكائنات بدائية النواة ، بينما يوجد MreB في جميع البكتيريا على شكل قضيب تقريبا. هذا التوزيع الواسع والأهمية في صلاحية الخلية يجعل هذه البروتينات هدفا رائعا في أبحاث المضادات الحيوية5،6،7.
من الأهمية بمكان اعتماد نهج متعدد الجوانب يجمع بين الملاحظات في الجسم الحي والتفاعلات في المختبر والتجارب الأنزيمية للتحقق بدقة من صحة بروتينات الهيكل الخلوي البكتيري كهدف أساسي لمثبط محتمل7. الإجراءات الشاقة أو الآثار المترتبة على التكلفة الكبيرة تثقل كاهل العديد من المقايسات المتاحة لهذا الغرض. هذه عقبات ملحوظة أمام استخدامها على نطاق واسع في فحص مركبات الرصاص التي يمكن أن تؤثر على الهيكل الخلوي البكتيري. من بين هذه ، يبرز الفحص المجهري كطريقة فعالة وسريعة بشكل استثنائي لتقييم فعالية المركبات من خلال الفحص المباشر للتغيرات في مورفولوجيا الخلية. ومع ذلك ، فإن الارتباط غير المتجانس للبروتين المستهدف مع مجمعات الهيكل الخلوي الأخرى ، والآثار غير المباشرة بسبب الارتباط خارج الهدف والتغيرات في إمكانات الغشاء ، وصعوبة اختراق الخلية بكفاءة ، ووجود مضخات التدفق ، خاصة في البكتيريا سالبة الجرام ، تجعل الأمر معقدا بشكل جماعي لتحديد السبب الدقيق لتشوه الخلايا البكتيرية8،9،10.
فطرية الفصام بومب، أو خميرة الانشطار كما هو معروف، كائن حقيقي النواة وحيد الخلية على شكل قضيب. تستخدم خميرة الانشطار على نطاق واسع ككائن نموذجي في البيولوجيا الخلوية والجزيئية بسبب الحفظ الاستثنائي في العمليات الخلوية مثل دورة الخلية والانقسام ، والتنظيم الخلوي ، وتكرار الكروموسوم مع حقيقيات النوى الأعلى ، بما في ذلك البشر11,12. علاوة على ذلك ، أعرب Errington وزملاؤه عن بروتين هيكلي خلوي بكتيري موضعي في القطب DivIVA في خميرة الانشطار لإثبات أن DivIVA تراكمت على الأسطح المنحنية سلبا13. مرة أخرى ، أنشأ Balasubramanian والمجموعة لأول مرة خميرة الانشطار كنظام نموذج خلوي لجلب رؤى جديدة حول آلية وتجميع وديناميكية بروتين الهيكل الخلوي E. coli actin مثل MreB14 و tubulin homolog FtsZ15. كما أنها توضح قدرة A22 على إعاقة بلمرة MreB بكفاءة من خلال الفحص المجهري epifluorescence عند التعبير عنها في الخميرة14. بعد ذلك ، نجحت مجموعات أخرى أيضا في استخدام خميرة الانشطار لدراسة خصائص تجميع بروتينات البلاستيدة الخضراء FtsZ1 و FtsZ216. في الآونة الأخيرة ، أنشأنا دليلا على مفهوم جدوى استخدام خميرة الانشطار كمنصة خلوية لفحص مثبطات الهيكل الخلوي البكتيري على وجه التحديد من خلال إجراء تقييم شامل لتأثير ثلاثة مثبطات FtsZ معروفة - سانجوينارين ، بربارين ، وبروتينات FtsZ PC190723 مشتقة من اثنين من البكتيريا المسببة للأمراض ، وهما المكورات العنقودية الذهبية وهيليكوباكتر بيلوري17. بالإضافة إلى ذلك ، يثبت هذا الفحص القائم على الخلية أحادي الخطوة أنه فعال في تقليل مخاطر تحديد المركبات التي قد تكون سامة للخلايا حقيقية النواة.
في هذا التقرير ، باستخدام نظام الخميرة الانشطارية ، نقترح سير عمل منهجي باستخدام لوحة 96 بئرا القياسية للفحص شبه الآلي والقياس الكمي لتأثير مثبطات الجزيئات الصغيرة التي تستهدف FtsZ من المكورات العنقودية الذهبية و MreB من الإشريكية القولونية. هنا ، قمنا بإعداد وتحسين سير العمل شبه الآلي باستخدام مثبطات PC190723 و A22 التي تستهدف على وجه التحديد FtsZ و MreB ، على التوالي. يستخدم سير العمل هذا مجهرا فوق فلوري مزودا بمرحلة عالية الدقة مزودة بمحرك والحصول الآلي على الصور في لوحة قياسية ذات 96 بئرا لتحسين التوحيد الحالي. وبالتالي ، يمكن تطبيقه على الشاشات المتوسطة والعالية الإنتاجية للمكتبات الكيميائية الاصطناعية والتحايل على بعض التحديات المذكورة أعلاه.
Protocol
1. التعبير عن بروتينات الهيكل الخلوي البكتيرية الموسومة ب GFP في S. pombe
ملاحظة: يرجى الاطلاع على الجدول 1 للحصول على معلومات حول جميع البلازميدات والسلالات المستخدمة هنا. يرجى الاطلاع على الجدول 2 للاطلاع على جميع التراكيب الإعلامية.
- إجراء استنساخ الإشريكية القولونية MreB مع اندماج GFP N-TERMINAL (GFP-MREB) و S. aureus FtsZ يحمل GFP (SaFtsZ-GFP) في ناقل تعبير S. pombe ، pREP42 مع محفز متوسط القوة قابل للقمع الثيامين ، nmt4118,19 كما هو موضح سابقا14,15. الحفاظ على البلازميدات وتضخيمها وعزلها من سلالات الإشريكية القولونية (DH10β) كما هو موضح في20،21.
ملاحظة: يمكن أيضا استخدام سلالات الإشريكية القولونية الأخرى مثل DH5α و XL1Blue و TOP10 وما إلى ذلك أو غيرها من الخلايا المختصة المتاحة تجاريا والتي تستخدم بشكل روتيني للاستنساخ الجزيئي. - تحويل البلازميدات pREP42-GFP-EcMreB و pREP42-SaFtsZ-GFP إلى S. pombe
- تحويل البلازميدات pCCD3 (pREP42-GFP-EcMreB) و pCCD713 (pREP42-SaFtsZ-GFP) إلى سلالة S. pombe (h-leu1-32 ura4-D18) باستخدام طريقة أسيتات الليثيوم22 ، كما هو مذكور في الخطوات التالية.
- اليوم 1 - الثقافة الأولية: قم بتلقيح حلقة من ثقافة S. pombe المخططة حديثا في 3 مل من مرق مستخلص الخميرة المعقم والمكملات الغذائية (YES). احتضانه في شاكر مداري عند 30 درجة مئوية طوال الليل (O / N).
- يوم 2:
- الثقافة الثانوية: أضف حوالي 500 ميكرولتر من المستزرع الأولي إلى 30 مل من مرق نعم المعقم. احتضان في 30 درجة مئوية لمدة 3-4 ساعات مع الهز حتى يصل OD600 إلى 0.4 - 0.6.
ملاحظة: لكل تحويل ، يتم استخدام 30 مل. - قم بتجميع 30 مل عند 2500 × جم لمدة 6-8 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية واغسل الخلايا ب 50 مل من الماء المقطر المعقم (D / W). بيليه لأسفل مرة أخرى وتجاهل طاف. أعد تعليق الخلايا في 1 مل من D / W المعقم وانقلها إلى أنبوب طرد مركزي سعة 2 مل. أجهزة الطرد المركزي على النحو الوارد أعلاه وتجاهل طاف.
- أضف 1 مل من أسيتات الليثيوم 0.1 متر ومحلول Tris-EDTA (LiAc-TE) وأجهزة الطرد المركزي على النحو الوارد أعلاه. تخلص من المادة الطافية وأعد تعليقها في 1 مل من 0.1 متر LiAc-TE. أجهزة الطرد المركزي والتخلص من المواد الطافية ، تاركة وراءها 100 ميكرولتر من المحلول.
- أضف 10 - 20 ميكروغرام من الحمض النووي الناقل (الحمض النووي للحيوانات المنوية من سمك السلمون ؛ مشوهة ومبرد على الجليد) و 2-3 ميكروغرام من الحمض النووي البلازميد ، والذي يحتاج إلى تحويل. تخلط بلطف. احتضان في درجة حرارة الغرفة لمدة 10 دقائق.
- أضف 260 ميكرولتر من 40٪ PEG / LiAc-TE ؛ تخلط بلطف. احتضانها لمدة 60 دقيقة في الخلاط أو خلاط حراري على حرارة 30 درجة مئوية مع خلط لطيف. إضافة 43 ميكرولتر من DMSO ؛ تخلط بلطف.
- صدمة حرارية عند 42 درجة مئوية لمدة 10 دقائق في الخلاط الحراري. حبيبات عند 2500 × جم لمدة 6-8 دقائق وتخلص من المادة الطافية. اغسل الحبيبات 1x ب 1 مل من D / W المعقم.
- بيليه ، تخلص من المادة الطافية وأعد تعليق الحبيبات في 200 ميكرولتر من D / W. لوحة معقمة 100 ميكرولتر على ألواح إدنبرة المتوسطة الدنيا (EMM) التي تحتوي على 5 ميكروغرام / مل من الثيامين (لقمع مروج nmt41 ) ومكملات الأحماض الأمينية الأدينين (0.225 مجم / مل) ، الهستيدين (0.225 مجم / مل) والليوسين (0.225 مجم / مل) ولكنها تفتقر إلى اليوراسيل (علامة اختيار لبلازميد pREP42).
ملاحظة: بالتناوب ، لوحة 70 ميكرولتر و 130 ميكرولتر في لوحين مختلفين. يتم طلاء حجمين مختلفين (70 ميكرولتر و 130 ميكرولتر) للحصول على مستعمرات معزولة على واحدة على الأقل من الألواح اعتمادا على كفاءات التحويل ، والتي يمكن أن تختلف من تجربة إلى أخرى. - احتضان الألواح على حرارة 30 درجة مئوية لمدة 2-3 أيام حتى تظهر المستعمرات. امزج مستعمرة واحدة مع 100 ميكرولتر من D / W المعقم وانتشر على لوحة EMM جديدة تحتوي على الثيامين ولكنها تفتقر إلى اليوراسيل كما هو موضح أعلاه.
- احتضان في 30 درجة مئوية لمدة 2-3 أيام حتى يظهر العشب الكامل. تخلص من العشب المزروع من الخلايا باستخدام حلقة تلقيح وأعد تعليقه إلى 1 مل من وسائط YES التي تحتوي على 30٪ من الجلسرين في قارورة بالتبريد.
- قم بتجميد قارورة التبريد في النيتروجين السائل وتخزينها في -80 درجة مئوية للحفاظ على مخزون الخميرة المجمدة.
- الثقافة الثانوية: أضف حوالي 500 ميكرولتر من المستزرع الأولي إلى 30 مل من مرق نعم المعقم. احتضان في 30 درجة مئوية لمدة 3-4 ساعات مع الهز حتى يصل OD600 إلى 0.4 - 0.6.
- التعبير عن بروتينات الهيكل الخلوي البكتيري في خميرة الانشطار
- قم بخط رقعة من مرق الجلسرين على طبق طازج خاص بالخميرة للحصول على ثقافة كافية لمزيد من التجارب.
ملاحظة: في حالة pREP42 ، استخدمنا لوحة أجار EMM (الحد الأدنى من الوسائط) التي تحتوي على الأدينين والهيستيدين والليوسين (كما هو الحال باستخدام سلالة S. pombe (h- leu1-32 ura4-D18)) بدون اليوراسيل (اليوراسيل موجود في pREP42 كعلامة اختيار). نضيف 15 - 20 ميكرومتر من الثيامين إلى ألواح الآجار (حيث يحتوي pREP42 على محفز nmt41 قابل للقمع من الثيامين) لقمع التعبير عن الجين محل الاهتمام عند النمو على اللوحة. - قم بتلقيح حلقة صغيرة من اللقاح من الرقعة المخططة إلى 5 مل من وسائط EMM الخاصة بالخميرة التي تفتقر إلى الثيامين واحتضانها لمدة 10-12 ساعة عند 30 درجة مئوية.
ملاحظة: يمكن أن يختلف تعبير FtsZ و MreB من أنواع مختلفة تحت مروج nmt41 في S. pombe ، عادة من 16 إلى 30 ساعة. الوقت الأمثل للتعبير البروتيني ل GFP-EcMreB و SaFtsZ-GFP في S. pombe هو 20 - 24 ساعة و 16 - 20 ساعة عند 30 درجة مئوية ، على التوالي ، بدون ثيامين.
- قم بخط رقعة من مرق الجلسرين على طبق طازج خاص بالخميرة للحصول على ثقافة كافية لمزيد من التجارب.
2. علاج مزارع S. pombe التي تعبر عن البروتينات الهيكلية الخلوية البكتيرية الموسومة ب GFP
ملاحظة: يتم اختبار عدد من جزيئات الأدوية المختلفة على مزرعة الخميرة المزروعة بين عشية وضحاها في لوحة 96 بئرا.
- قم بتلقيح مزرعة جديدة عن طريق نقل 50 ميكرولتر من الاستزراع الليلي إلى كل بئر من صفيحة 96 بئرا تحتوي على 150 ميكرولتر من وسائط EMM للخميرة الطازجة باستخدام أداة سحب السحب متعددة القنوات شبه الآلية ذات 96 بئرا.
- أثناء السحب للداخل والخارج للخلط المناسب باستخدام ماصة شبه آلية متعددة القنوات ذات 96 بئرا ، أدخل ببطء تركيزات متزايدة مختلفة من الأدوية في الثقافة المتنامية ، كل منها يتم في ثلاث نسخ كما هو موضح في الرسم التخطيطي في الشكل 1.
- كعنصر تحكم إيجابي ، استخدم الأدوية المعروفة بالفعل ، PC190723 ل (S. aureus FtsZ) و A22 (ل E. coli MreB) في نسختين.
ملاحظة: كما ذكر سابقا، استخدم PC190723 وA22 بتركيز 56.2 ميكرومتر17 و72.6 ميكرومتر14,17 على التوالي. وفي الوقت نفسه ، كان علاج A22 ل SaFtsZ والعلاج PC190723 ل EcMreB بمثابة ضوابط سلبية ، على التوالي. - استخدم DMSO كعنصر تحكم في المذيبات بثلاثة تركيزات مختلفة وفقا لأدنى وأعلى تركيزات الأدوية.
ملاحظة: يستخدم المذيب الذي تذوب فيه الأدوية كعنصر تحكم في المذيبات. - احتضان المزارع الضابطة والمعالجة عند 30 درجة مئوية لمدة 6-10 ساعات (حتى تظهر الخلايا تعبير البروتينات الفلورية البكتيرية) ثم قم بالتصوير باستخدام المجهر فوق الفلوري.
3. تصور البوليمرات
- ضع طبقة من 20 ميكرولتر من 1 مجم / مل كونكانافالين أ على كل بئر من الصفيحة السفلية ذات 96 بئرا الشفافة بصريا (ذات جدران سوداء للتصوير الفلوري) واحتضانها لمدة 20 دقيقة في درجة حرارة الغرفة. نضح السائل واتركه يجف في الهواء لمدة 10 دقائق.
- انقل 20 ميكرولتر من الخلايا من لوحة الاستزراع إلى كل بئر واتركها لمدة 10 دقائق. اغسل الخلية 3x-4x باستخدام وسائط EMM المعقمة.
- مع استخدام العدسة الشيئية في مكانها (انظر الخطوة 3.6) ، استخدم وضع المتصفح في لوحة الالتقاط الخاصة ببرنامج الحصول على الصور لمحاذاة لوحة 96 بئرا وتغطية البئر. قم بمحاذاة حواف البئر على الملاح.
- بعد ذلك ، حدد معلمات تغطية البئر ، والتي تتضمن اختيارا متعدد المواضع للمنطقة محل الاهتمام في البئر ، واستخدم التحكم في التركيز البؤري التلقائي التكيفي مع وضع عند الطلب للحفاظ على العينة في التركيز أثناء التصوير.
- التقط الصور باستخدام تباين التداخل التفاضلي (DIC) والتألق. اضبط مرشحات الإثارة والانبعاث 475/28 نانومتر و 525/48 نانومتر ، على التوالي لتصوير البروتينات البكتيرية الموسومة ب GFP المعبر عنها في الخميرة. احصل على مداخن Z بحجم خطوة 0.2 ميكرومتر من خلال سمك خلايا الخميرة (5 ميكرومتر).
- التقط الصور باستخدام مجهر فوق فلوري مقلوب مزود بهدف غمر الزيت 100x و 1.4-NA وكاميرا 2000 × 2000 sCMOS (حجم بكسل 6.5 ميكرومتر × 6.5 ميكرومتر). استخدم نظام إضاءة LED لإثارة الفلوروفور.
ملاحظة: يجب أن يكون أي نظام مجهر فوق فلوري يحتوي على مرحلة آلية للوحة 96 بئرا مع تحديد المواقع الدقيق متعدد النقاط مناسبا. الحصول على جميع صور الخلية للتحكم والمعالجة بالعقاقير مع وقت تعرض مماثل (عادة في حدود 0.3 - 0.5 ثانية) عند تجميع 1 × 1 والإضاءة بنسبة 15٪ - 20٪ لتقليل متغيرات التجربة والحفاظ على الاتساق.
4. القياس الكمي للصور باستخدام ImageJ
- معالجة صور الخلية وقياس عدد البقع لكل خلية وكثافتها ل FtsZ17. في حالة MreB ، قم بقياس الكثافة وتباين الخواص23 وقارن بين الخلايا الضابطة والمعالجة باستخدام فيجي (v2.0.0-rc-69 / 1.52p) 24.
- باستخدام الصور من قناة DIC ، حدد أولا خلايا الخميرة الفردية باستخدام أداة الرسم اليدوي واحفظها كمنطقة اهتمام (ROI) في مدير عائد الاستثمار. هذه الخطوة ليست مؤتمتة بعد ، ولكن الأدوات التي تم تطويرها مؤخرا باستخدام التعلم الآلي25,26 يمكن تجربتها ودمجها في المستقبل القريب.
- قم بإخفاء المنطقة الخارجية للخلية واملأها باللون الأسود كما هو موضح في27.
- استخدم ماكرو تحليل عتبة OPS IJ1 ، وهي ميزة مضمنة في فيجي ، لحساب عدد النقاط24.
- استخدم طريقة otsu للعتبة التلقائية وإخفاء الجسيمات المجزأة. قم بتشغيل جسيمات تحليل المكون الإضافي باستخدام ماكرو.
- لقياس كثافة البوليمر (كمية الهيكل الخلوي لكل وحدة مساحة في الخلية) ، قم بمعالجة الصور كما هو موضح ، بما في ذلك خطوات التقنيع والهيكل العظمي27,28. استخدم مرشح Lpx 2Dfilter في المكون الإضافي lpx لهيكلة الصور.
- لمزيد من التفاصيل ، تحقق من هذا المنشور الأخير17. قم بإجراء القياس الكمي للبوليمر EcMreB كما هو مذكور سابقا في23 ، استخدم تباين الخواص لتحديد التنظيم المكاني باستخدام FibrilTool29 كما هو موضح سابقا23.
ملاحظة: يمكن استخدام طرق التحليل هذه لتحديد أي بروتينات هيكلية خلوية بكتيرية أخرى يتم علاجها أو عدم معالجتها بواسطة الأدوية.
النتائج
إعداد لوحة 96 بئرا لفحص المخدرات
تم استخدام S. pombe للتعبير عن C- نهائيا GFP الموسوم S. aureus FtsZ من ناقل (pREP42) يحتوي على مروج الثيامين القابل للقمع متوسط القوة nmt41تم تحديده سابقا17 وبالمثل ، تم التعبير عن E. coli MreB الموسوم ب N- terminal GFP أيضا في S. pombe14. لقد أظهرنا أيضا أن PC190723 ، وهو مثبط محدد ل SaFtsZ و A22 ، مثبط MreB ، يمكن أن يمارس آثاره على البروتينات الهيكلية الخلوية البكتيرية المعنية بطريقة محددة عند التعبير عنها في الخميرة14,17.
هنا ، نقترح استخدام نظام تعبير الخميرة لتطوير فحص متوسط أو عالي الإنتاجية للأدوية المضادة للبكتيريا التي تستهدف بروتينات الهيكل الخلوي البكتيري. يمكن أتمتة مجهر التألق مع مرحلة آلية لتصوير لوحة 96 بئرا ، كما تتوفر مكتبات الأدوية التجارية بسهولة في تنسيقات لوحة 96 بئرا. لذلك ، نفضل استخدام لوحة 96 بئرا للفحص المقترح للأدوية. يتم تعيين اللوحات كما هو موضح في الشكل 1. يتكون الصف الأول (الشكل 1 أ) من SaFtsZ-GFP معبرا عن ثقافة الخميرة. يتكون الصف الثاني (الشكل 1B) من مزارع الخميرة التي تعبر عن GFP-EcMreB. يتم تعيين أول عمودين من الصفين الأولين (A1:B2) كوسائط فارغة. يتم تعيين الأعمدة الستة التالية من الصفين الأولين (A3: B12) كعنصر تحكم DMSO بثلاثة تركيزات مختلفة وفقا لتخفيفات الدواء في نسختين. بعد ذلك ، تتم إضافة PC190723 (56.2 ميكرومتر) و A22 (72.6 ميكرومتر) إلى خلايا الخميرة التي تعبر عن SaFtsZ-GFP أو GFP-EcMreB. تعمل PC190723 و A22 كعناصر تحكم إيجابية ل FtsZ و MreB ، على التوالي. تستخدم جميع الآبار الأخرى (C1: F12) لإضافة أدوية مختلفة (بثلاثة تركيزات مختلفة وفي نسختين) تستخدم في الشاشة لتحديد مستجيبات بروتينات الهيكل الخلوي البكتيري ، SaFtsZ أو EcMreB. يتم توزيع مزارع الخميرة التي تعبر عن SaFtsZ أو MreB الموسوم ب GFP في هذه الألواح المكونة من 96 بئرا وتنمو حتى يتم تصور تأثيرات الأدوية على تجميع البوليمرات.
تقييم آثار النمو على خلايا الخميرة
بعد احتضان الخلايا المستزرعة الفرعية المكونة من 96 بئرا عند 30 درجة مئوية لمدة 6 إلى 10 ساعات ، يتم قياس الكثافة البصرية (OD) لثقافة الخميرة باستخدام قارئ الصفيحة الدقيقة. يساعد قياس OD في تقييم أي تأثير مثبط للنمو للأدوية ضد خلايا الخميرة حقيقية النواة وربما الآثار الضارة على الخلايا البشرية. وبالتالي ، يمكن استخدام هذا الفحص لفحص أدوية متعددة بناء على سميتها في نظام الخميرة. ومع ذلك ، لا يظهر PC190723 ولا A22 أي آثار نمو أو سمية لخلايا الخميرة ، وكانOD 600 من الثقافات التي تعبر عن SaFtsZ-GFP المعالجة ب DMSO أو PC190723 أو A22 0.38 ± 0.03 و 0.44 ± 0.02 و 0.43 ± 0.06 (N ≥ 4) ، على التوالي. وبالمثل ، فإنOD 600 من الثقافات التي تعبر عن GFP-EcMreB وعولجت ب DMSO أو PC190723 أو A22 كانت 0.38 ± 0.04 و 0.44 ± 0.07 و 0.41 ± 0.08 (N ≥ 4) ، على التوالي.
تصور تأثير الأدوية على الهياكل البوليمرية التي تم تجميعها بواسطة SaFtsZ و EcMreB معبرا عنها في S. pombe
من أجل تقييم تأثير الأدوية على بلمرة SaFtsZ أو EcMreB ، يتم نقل حصة من خلايا الخميرة من الصفيحة المذكورة أعلاه المكونة من 96 بئرا والتي تحتوي على أدوية إلى صفيحة أخرى ذات 96 بئرا مع قاع زجاجي شفاف بصريا 96 بئر مناسب للتصوير الفلوري. هذه اللوحة المكونة من 96 بئرا مغلفة أيضا بكونكانافالين أ للسماح بالتصاق خلايا الخميرة التي تعبر عن SaFtsZ أو EcMreB الموسوم ب GFP. يتم تصوير الصفيحة المكونة من 96 بئرا باستخدام مجهر التألق الذي يغطي جميع آبار اللوحة البالغ عددها 96 بئرا في المواضع المحددة مسبقا كما يتحكم فيها برنامج الحصول على الصور (الشكل 2). في آبار التحكم (معالجة DMSO) ، أظهرت خلايا الخميرة التي تعبر عن SaFtsZ-GFP هياكل بوليمرية على شكل بقع أو بقع موزعة في جميع أنحاء الخلايا ، بعد 16 - 18 ساعة من النمو في غياب الثيامين. ومع ذلك ، في 10 - 12 ساعة بعد النمو في نقص الثيامين ، أظهرت الخلايا فقط مضان منتشر أو بقع قليلة ، مما يشير إلى أن تعبير FtsZ-GFP لم يصل إلى التركيز الحرج المطلوب للبلمرة (الشكل 3 أ). على العكس من ذلك ، أظهر عقار تثبيت FtsZ ، PC190723 ، زيادة كبيرة في الهياكل البوليمرية (البقع أو البقع) ل SaFtsZ-GFP مقارنة بالتحكم في DMSO بعد 12 ساعة من النمو (الشكل 3B) ، بمثابة عنصر تحكم إيجابي. في المقابل ، لم تظهر الخلايا المعالجة ب A22 أي اختلاف في هياكل SaFtsZ-GFP المجمعة (الشكل 3C). ومع ذلك ، على عكس الثقافات المعالجة PC190723 ، تم تجميع SaFtsZ-GFP في بقع في الثقافات غير المعالجة فقط عند تحفيزها لفترات أطول ، مما يدل على أن PC190723 عملت على تقليل التركيز الحرج لبلمرة SaFtsZ (الشكل 3D). وبالمثل ، شكل GFP-EcMreB المعبر عنه في S. pombe صفائف خطية من خيوط طويلة على طول المحور الطولي لخميرة الانشطار (الشكل 4A). بينما وجد أن PC190723 ليس له أي تأثير على بلمرة EcMreB (الشكل 4B) ، أدت معالجة الخلايا ب A22 إلى تألق منتشر في جميع أنحاء السيتوبلازم لخلايا الخميرة (الشكل 4C). يتم فحص الصور من بقية لوحات 96 بئرا بصريا بحثا عن أي استقرار أو تأثيرات مثبطة للأدوية على SaFtsZ أو EcMreB ، حسب الحالة.
يمكن بعد ذلك قياس تأثير الأدوية على تجميع البروتينات الهيكلية الخلوية البكتيرية باستخدام أدوات تحليل الصور والمكونات الإضافية في ImageJ أو Fiji ، كما تم الإبلاغ عنه سابقا ل SaFtsZ17 و EcMreB21. يمكن أن يؤدي الحصول الآلي على الصور بتنسيق لوحة 96 بئرا وتنفيذ وحدات ماكرو ونصوص مخصصة لمعالجة الصور إلى تسريع وقت التصوير والقياس الكمي لتأثيرات الأدوية. وهكذا ، باستخدام الخميرة حقيقية النواة وحيدة الخلية ، S. pombe ، كنظام مضيف ، نقترح أنه يمكن إجراء شاشة متوسطة أو عالية الإنتاجية للجزيئات الصغيرة التي تستهدف البروتينات الهيكلية الخلوية البكتيرية بنجاح ، مما يؤدي في النهاية إلى اكتشاف مضادات حيوية جديدة.
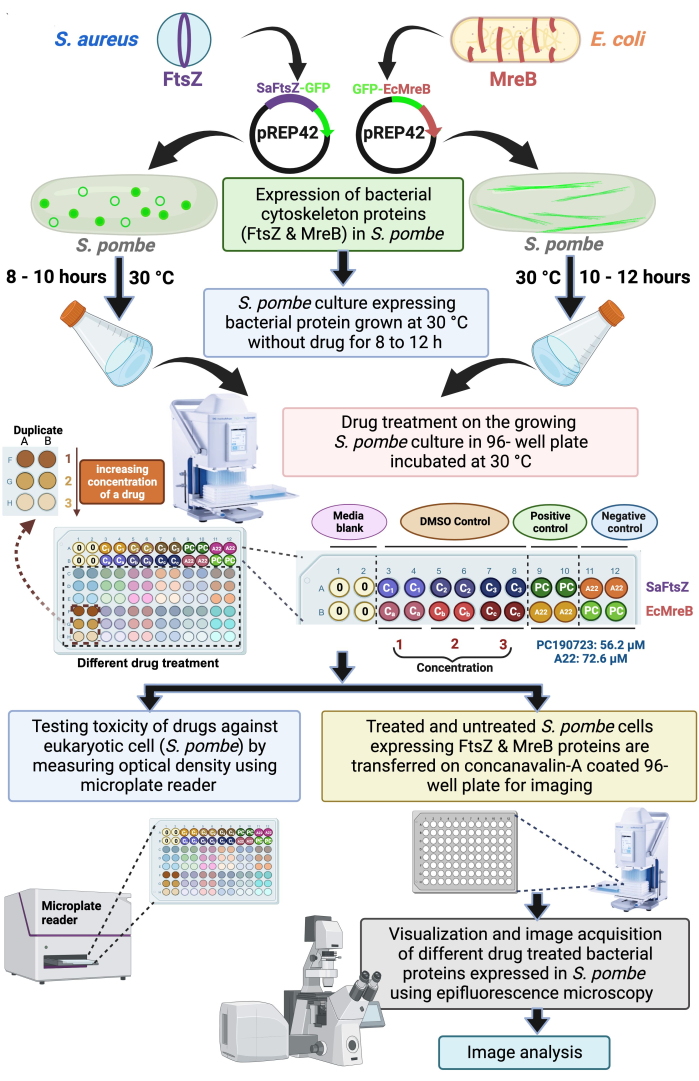
الشكل 1: رسم تخطيطي يوضح استخدام خلايا فطر الخميرة الانشطارية للكشف عن الأدوية التي تستهدف تجميع البروتينات الهيكلية الخلوية البكتيرية SaFtsZ أو EcMreB. تم استنساخ FtsZ من S. aureus و MreB من E. coli في ناقل تعبير الخميرة ، pREP42 وجود علامة GFP في C- و N- النهاية ، على التوالي وتحويلها إلى S. pombe لدراسة النمط الظاهري والمخدرات. نمت الثقافات لمدة 8 - 12 ساعة. بعد ذلك ، تم استزراع المزارع الفرعية في 96 لوحة بئر مع ضوابط مناسبة ويتم فحص الأدوية المختلفة. علاوة على ذلك ، تم تحضين الصفيحة عند 30 درجة مئوية لمدة 6 - 8 ساعات حتى يصل OD600 إلى 0.5-0.6 ، ويتم قياس الكثافة البصرية باستخدام قارئ الصفائح الدقيقة لتقييم سمية الأدوية تجاه خلايا الخميرة. تم طلاء لوحة زجاجية أخرى ذات 96 بئرا ذات قاع زجاجي شفاف بصريا مسبقا بكونكانافالين أ ، للالتصاق بخلايا الخميرة. تم استخدام هذه اللوحة المكونة من 96 بئرا للتصور والحصول على الصور باستخدام مجهر التألق. ثم تم تحليل الصور التي تم الحصول عليها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
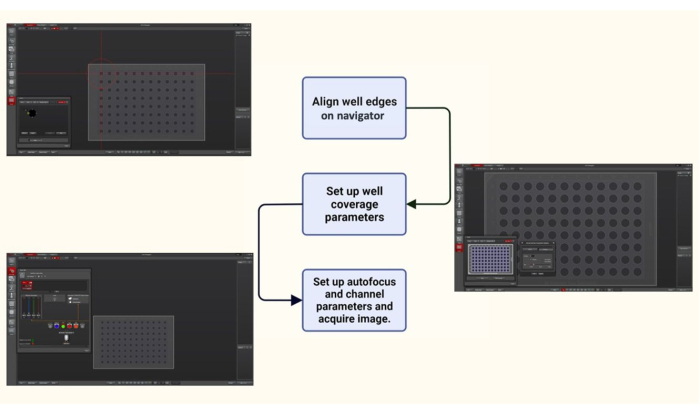
الشكل 2: رسم تخطيطي لبرنامج الحصول على الصور للتصوير الآلي للوحة 96 بئرا. باستخدام الملاح في برنامج الحصول على الصور ، تمت محاذاة لوحة 96 بئرا عن طريق وضع علامة على الحواف. تم اختيار معلمات تغطية جيدة مثل عدد الصور التي يجب التقاطها من كل بئر وموقعها (عشوائيا أو من مركز البئر) حسب الرغبة. أخيرا ، معلمات الصورة مثل مجموعة المرشح التي سيتم استخدامها (DIC و FITC-filter; Ex 475/28 نانومتر و Em 525/48 نانومتر) ، تم تعيين النسبة المئوية لشدة ضوء الإضاءة والتركيز التلقائي ووقت التعرض لالتقاط الصور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تصور تأثير أدوية PC190723 و A22 على SaFtsZ-GFP معبرا عنه في S. pombe. نمت ثقافة S. pombe التي تعبر عن SaFtsZ-GFP في غياب الثيامين لمدة 8-9 ساعات عند 30 درجة مئوية قبل DMSO والعلاج بالعقاقير. نمت الثقافة في صفيحة 96 بئرا لمدة 7 - 9 ساعات عند 30 درجة مئوية في وجود أو عدم وجود الأدوية. (أ) في مجموعة تحكم DMSO ، حيث تمت إضافة كمية مكافئة من DMSO ، أظهرت الخلايا بعض الهياكل البوليمرية. (ب) في وجود PC190723 (56.2 ميكرومتر) ، يعبر SaFtsZ عن خلايا الخميرة التي تظهر زيادة كبيرة في الهياكل البوليمرية مقارنة بعنصر التحكم DMSO. (ج) لم يؤثر مثبط MreB ، A22 (72.6 ميكرومتر) ، على هياكل SaFtsZ-GFP. (د) كانت ساعات أطول من التعبير البروتيني ضرورية لتجميع SaFtsZ-GFP في حالة عدم وجود PC190723 ، وبالتالي ، فإن مزارع التحكم التي نمت عند 30 درجة مئوية لمدة 12 - 15 ساعة بعد الاستزراع الفرعي في صفيحة 96 بئرا تحتوي على DMSO تظهر أيضا بوليمرات FtsZ. شريط المقياس هو 5 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
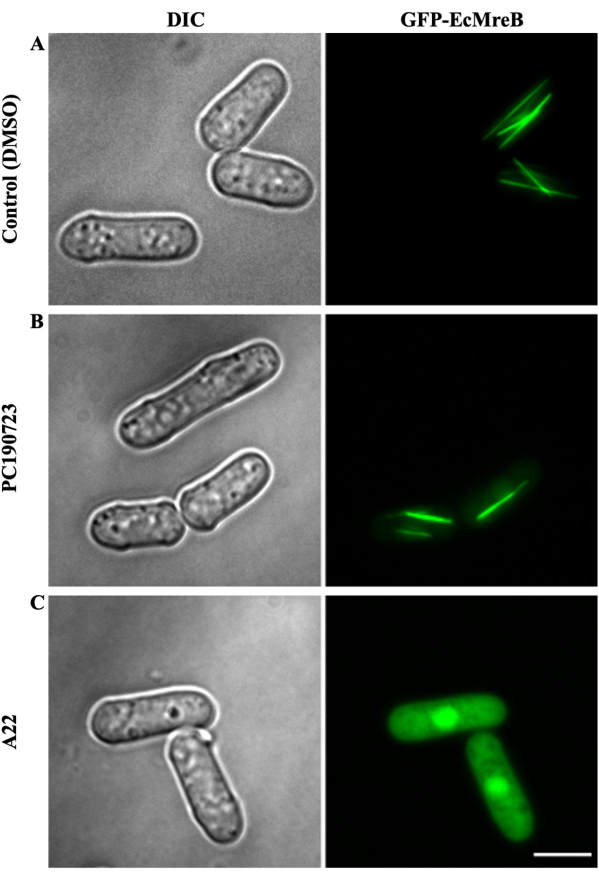
الشكل 4: تصور تأثير PC190723 و A22 المخدرات على GFP-EcMreB معبرا عنه في S. pombe. نمت ثقافة S. pombe التي تعبر عن GFP-EcMreB في غياب الثيامين لمدة 9-11 ساعة عند 30 درجة مئوية قبل إضافة DMSO أو الأدوية (A22 أو PC190723). نمت الثقافة أيضا في صفيحة من 96 بئرا لمدة 8-10 ساعات عند 30 درجة مئوية مع وبدون أدوية كعنصر تحكم. (أ) في المزارع التي أضيفت فيها كمية مكافئة من DMSO كعنصر تحكم ، أظهرت الخلايا خيوطا خطية من EcMreB موجهة على طول المحور الطولي لخلايا الخميرة. (ب) لم يتأثر تجميع GFP-EcMreB في المستنبتات المعالجة ب PC190723 (56.2 ميكرومتر). (ج) منع الجزيء الصغير A22 (72.6 ميكرومتر) ، وهو مثبط معروف لبلمرة MreB ، تجمع GFP-EcMreB في خلايا الخميرة الانشطارية. شريط المقياس هو 5 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: السلالات والبلازميدات المستخدمة في هذه الدراسة. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: تكوين الوسائط والمخازن المؤقتة المستخدمة في هذه الدراسة. الرجاء الضغط هنا لتنزيل هذا الجدول.
Discussion
تشكل مقاومة مضادات الميكروبات تهديدا صحيا عالميا خطيرا، وهناك حاجة ملحة إلى مضادات حيوية جديدة ذات أهداف جديدة. برز الهيكل الخلوي البكتيري كهدف جذاب لتطوير مضادات حيوية جديدة ، مع مثبطات جزيئية صغيرة لبروتين انقسام الخلايا FtsZ ، مثل TXA709 ، بالفعل في المرحلة الأولى من التجارب السريرية30. تم تطوير عدة طرق لتحديد مثبطات بلمرة FtsZ 7,31. لقد استخدمنا مؤخرا خميرة الانشطار حقيقية النواة في اختبار قائم على الخلايا لإظهار أن عقار تثبيت FtsZ ، PC190723 ، يمكن أن يستهدف HpFtsZ17. علاوة على ذلك ، أظهرنا أيضا أنه على الرغم من أن الأدوية مثل البربارين والسانغينارين أثرت على بلمرة FtsZ ، إلا أنها أثرت أيضا على مورفولوجيا خلايا الخميرة17. بدافع من هذه الدراسات والملاحظات ، شرعنا في تطوير اختبار قائم على الخلية من خطوة واحدة لفحص معدلات الجزيئات الصغيرة للهيكل الخلوي البكتيري باستخدام منصة تعبير الخميرة الانشطارية. نظرا لأن الشاشة تعتمد على تثبيط تجميع البروتينات الهيكلية الخلوية الموسومة ب GFP ، فإن الجزيئات الصغيرة التي تشترك في خصائص الفلوروفور المتشابهة قد تؤدي إلى نتائج إيجابية خاطئة. قد يساعد تجنب مرشحات التمرير الطويل واختيار مرشحات تمرير النطاق الضيق في تقليل هذه الإيجابيات الخاطئة الناشئة عن جزيئات الفلورسنت الصغيرة. هنا ، نعرض الخطوات المتبعة في إعداد شاشة متوسطة الإنتاجية باستخدام مجهر epifluorescence مجهز بحامل مرحلة صفيحة 96 بئرا يمكن استخدامه لفحص الأدوية التي تستهدف SaFtsZ أو EcMreB. يتضمن سير العمل الحصول على الصور وتحليلها شبه الآلي ، والتي يمكن بسهولة توسيع نطاقها إلى شاشات عالية الإنتاجية في المستقبل باستخدام أنظمة معالجة السوائل الروبوتية وخطوط أنابيب معالجة الصور.
علاوة على ذلك ، يجب أن تكون الشاشة مفيدة للبروتينات الهيكلية الخلوية البكتيرية الأخرى ، مثل طية الأكتين التي تحتوي على بروتين صيانة البلازميد ParM32 وضد أي بروتين يتجمع في الهياكل البوليمرية في خميرة الانشطار. ومع ذلك ، يجب توحيد مستويات التعبير المثلى لكل بروتين مهم قبل استخدامه في أي شاشات دوائية. بينما بالنسبة ل FtsZs ، وجدنا أن nmt41 هو المروج الأمثل ، بالنسبة للبروتينات الأخرى ذات الأهمية ، نسخة أقوى أو أضعف من مروج nmt1 (قوة المروج (والتسرب): nmt1 > nmt41 > nmt81) أو المروجين التأسيسيين الآخرين مثل الخميرة adh1 أو act118,33 يمكن محاولة الحصول على المستويات المثلى من التعبير وتجميع الهياكل البوليمرية. علاوة على ذلك ، أثناء استخدام البلازميدات العرضية ، فإن اختلافات عدد النسخ من خلية إلى أخرى تشكل أيضا مشاكل للتعبير الجيني الموحد. للتحايل على هذه القضايا ، تم مؤخرا تطوير العديد من النواقل التي يمكن دمجها في جينوم الخميرة الانشطارية (SIVs لنواقل التكامل المستقرة) التي تحمل محفزات ذات نقاط قوةمختلفة 34. قد يقدم استخدام هذه النواقل نتائج أكثر اتساقا وكمية مقارنة بالنواقل العرضية المستخدمة في هذه الدراسة هنا. يمكن أن يؤدي استخدام SIVs إلى تجنب عدم التجانس الكبير في مستويات التعبير ، والذي ينظر إليه على أنه اختلاف في شدة التألق عبر الخلايا ويجب أن يكون أكثر ملاءمة للشاشات عالية الإنتاجية.
علاوة على ذلك ، تعمل الأدوية مثل PC190723 على تثبيت بوليمرات FtsZ ، مما يؤدي إلى التجميع المبكر لخيوط FtsZ مقارنة بالخلايا غير المعالجة. في حين أن الشاشة مناسبة لفحص الأدوية التي تمنع بلمرة البروتينات الهيكلية الخلوية البكتيرية ، بسبب التقييم البصري للتألق المنتشر عند نقطة النهاية ، فإن فحص الأدوية التي تثبت بوليمرات FtsZ يتطلب مزيدا من التحسين لمستويات التعبير عن البروتين والوقت اللازم لتحقيق أقصى عدد من الخلايا التي تحتوي على بوليمرات. وبالتالي ، من الأهمية بمكان الحصول على تقدير معقول للوقت اللازم للتعبير عن البروتين لتحقيق التركيز الحرج المطلوب للتجميع وتحديد نقطة النهاية للفحص وفقا لذلك. في حالة الأدوية التي قد تعمل على تقليل التركيز الحرج المطلوب لبلمرة البروتين ، فإن اختيار نقطة النهاية عادة ما يكون وقتا ، حيث تظهر مجموعة كبيرة من الخلايا غير المعالجة مضان منتشر ، لكن الثقافات المعالجة بالأدوية ستعرض مجموعات البوليمر.
أحد القيود التي تعد أيضا خطوة تستغرق وقتا طويلا في سير العمل هو الحاجة إلى تحديد الخلايا الفردية وتقسيمها لتحليل الصور الكمي. حاليا ، في المخطط المقترح ، هذه خطوة يدوية لتحديد خلايا الخميرة الفردية وتعيين منطقة الاهتمام (ROIs) لتحديد تأثير الأدوية. ومع ذلك ، فإننا نتصور أن خوارزميات التعلم الآلي التي تم تطويرها مؤخرا باستخدام مجموعات التدريب مثل تلك القابلة للتنفيذ في ilastik35 يجب أن تقلل من الحاجة إلى التدخل اليدوي.
في حين أن نهجنا هنا باستخدام منصة الخميرة مفيد لتحديد الضربات والجزيئات الصغيرة المحتملة التي تستهدف الهيكل الخلوي البكتيري ، سيحتاج المرء في النهاية إلى اختبار نشاطها المضاد للبكتيريا باستخدام اختبارات الحد الأدنى من التركيز المثبط القياسية والفعالية في النماذج الحيوانية. ومع ذلك ، فإن التحدي الأكبر للزيادة العالمية في مقاومة مضادات الميكروبات (AMR) لا يزال يكمن في نفاذية الغشاء الخارجي للبكتيريا سالبة الجرام ومضخات التدفق العديدة في العديد من الأنواع البكتيرية المسببة للأمراض. علاوة على ذلك ، قد تشكل مضخات التدفق في خميرة الانشطار مشاكل مماثلة وقد تكون هناك حاجة إلى تركيزات أعلى من الأدوية لعملية الفحص. بالتناوب ، يمكن استخدام سلالات الخميرة الانشطارية شديدة الحساسية للأدوية (S. pombe MDR-supML) ، نتيجة لحذف الجينات السبعة المقاومة للأدوية المتعددة ، بما في ذلك أربعة جينات ناقلة وعامل نسخ ، كمضيفين لفحص32،33. ستكون التطورات المستقبلية في التقنيات التي تجمع بين الاكتشاف المستهدف للبكتيريا ومعالجة المقاومة بسبب الظواهر العامة مثل نفاذية الغشاء ضرورية لمعالجة المقاومة المتزايدة لمضادات الميكروبات.
Disclosures
يعلن جميع المؤلفين عدم وجود تضارب في المصالح.
Acknowledgements
تعترف SMP و SR و AKS بالزمالات التي تلقتها من المعهد الوطني لتعليم العلوم والبحوث ، قسم الطاقة الذرية. يقر قطاع الأبحاث بدعم التمويل الداخلي من وزارة الطاقة الذرية ، ويتم دعم هذا العمل من خلال منحة بحثية إلى RS (BT / PR42977 / MED/29/1603/2022) من قسم التكنولوجيا الحيوية (DBT). كما يعترف المؤلفون ب V Badireenath Konkimalla لتعليقاته واقتراحاته ومناقشاته طوال فترة تطوير البروتوكول.
Materials
| Name | Company | Catalog Number | Comments |
| 96 Well CC2 Optical CVG Sterile, w/Lid. Black | Thermo Scientific™ | 160376 | |
| 96-well plate | Corning | CLS3370 | |
| A22 Hydrochloride | Sigma | SML0471 | Dissolved in DMSO |
| Adenine | FormediumTM | DOC0229 | 225 mg/L of media |
| Concanavalin A | Sigma | C5275-5MG | |
| DMSO | Sigma | 317275 | |
| Edinburg minimal medium (EMM Agar or EMM Broth) | FormediumTM | PMD0210 | See below for composition |
| EDTA | Sigma | EDS-500G | |
| epMotion® 96 with 2-position slider | Eppendorf | 5069000101 | |
| Histidine | FormediumTM | DOC0144 | 225 mg/L of media |
| Leica DMi8 inverted fluorescence microscope | Leica Microsystems | German company | |
| Leucine | FormediumTM | DOC0157 | 225 mg/L of media |
| Lithium acetate | Sigma | 517992-100G | |
| PC190723 | Merck | 344580 | Dissolved in DMSO |
| Polyethylene glycol (PEG) | Sigma | 202398 | |
| Thiamine | Sigma | T4625 | Filter sterilised |
| Tris-Hydrochloride | MP | 194855 | |
| Uracil | FormediumTM | DOC0214 | 225 mg/L of media, Store solution at 36°C |
| YES (Yeast extract + supplements) Agar | FormediumTM | PCM0410 | See below for composition |
| YES (Yeast extract + supplements) Broth | FormediumTM | PCM0310 | See below for composition |
| Yeast (S. pombe) media | |||
| Yeast extract + supplements (YES) | |||
| Composition | g/L | ||
| Yeast extract | 5 | ||
| Dextrose | 30 | ||
| Agar | 17 | ||
| Adenine | 0.05 | ||
| L-Histidine | 0.05 | ||
| L-Leucine | 0.05 | ||
| L-Lysine HCl | 0.05 | ||
| Uracil | 0.05 | ||
| Edinburg minimal medium (EMM) | |||
| Composition | g/L | concentration | |
| potassium hydrogen phthallate | 3 | 14.7mM | |
| Na2HPO4 | 2.2 | 15.5 mM | |
| NH4Cl | 5 | 93.5 mM | |
| glucose | 2% (w/v) or 20 g/L | 111 mM | |
| Salts (stock x 50) | 20 mL/L (v/v) | ||
| Vitamins (stock x 1000) | 1 mL/L (v/v) | ||
| Minerals (Stock x 10,000) | 0.1 mL/L (v/v) | ||
| Salts x 50 | 52.5 g/l MgCl2.6H20 (0.26 M) | 52.5 | 0.26 M |
| 0.735 mg/l CaCl2.2H20 (4.99 mM) | 0.000735 | 4.99 mM | |
| 50 g/l KCl (0.67 M) | 50 | 0.67 M | |
| 2 g/l Na2SO4 (14.l mM) | 2 | 14.1 mM | |
| Vitamins x 1000 | 1 g/l pantothenic acid | 1 | 4.20 mM |
| 10 g/l nicotinic acid | 10 | 81.2 mM | |
| 10 g/l inositol | 10 | 55.5 mM | |
| 10 mg/l biotin | 0.01 | 40.8 µM | |
| Minerals x 10,000 | boric acid | 5 | 80.9 mM |
| MnSO4 | 4 | 23.7 mM | |
| ZnSO4.7H2O | 4 | 13.9 mM | |
| FeCl2.6H2O | 2 | 7.40 mM | |
| molybdic acid | 0.4 | 2.47 mM | |
| KI | 1 | 6.02 mM | |
| CuSO4.5H2O | 0.4 | 1.60 mM | |
| citric acid | 10 | 47.6 mM | |
| Strains/ Plasmids | |||
| Strains | Description | Reference | |
| CCD190 | Escherichia coli DH10β | Invitrogen | |
| CCDY4 | MBY3532; CCDY346/pREP42- GFP-EcMreB | Srinivasan et al., 2007 | |
| CCDY340 | CCDY346/pREP42- SaFtsZ-GFP | Sharma et al., 2023 | |
| CCDY346 | MBY192; Schizosaccharomyces pombe [ura4-D18, leu1-32, h-] | Dr. Mithilesh Mishra (DBS, TIFR) | |
| Plasmids | |||
| pCCD3 | pREP42-GFP-EcMreB | Srinivasan et al., 2007 | |
| pCCD713 | pREP42-SaFtsZ-GFP | Sharma et al., 2023 |
References
- Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- Haselbeck, R., et al. Comprehensive essential gene identification as a platform for novel anti-infective drug discovery. Curr Pharma Des. 8 (13), 1155-1172 (2002).
- Wang, J., et al. Discovery of a small molecule that inhibits cell division by blocking FtsZ, a novel therapeutic target of antibiotics. J Biol Chem. 278 (45), 44424-44428 (2003).
- Sanchez, S., Demain, A. L. Antibiotics: current innovations and future trends. , Caister Academic Press. (2015).
- Vollmer, W. The prokaryotic cytoskeleton: a putative target for inhibitors and antibiotics. Appl Microbiol Biotechnol. 73 (1), 37-47 (2006).
- Vollmer, W. Targeting the bacterial Z-ring. Chem Biol. 15 (2), 93-94 (2008).
- Kusuma, K. D., Payne, M., Ung, A. T., Bottomley, A. L., Harry, E. J. FtsZ as an antibacterial target: status and guidelines for progressing this avenue. ACS Infect Dis. 5 (8), 1279-1294 (2019).
- Kaul, M., Zhang, Y., Parhi, A. K., Lavoie, E. J., Pilch, D. S. Inhibition of RND-type efflux pumps confers the FtsZ-directed prodrug TXY436 with activity against Gram-negative bacteria. Biochem Pharmacol. 89 (3), 321-328 (2014).
- Casiraghi, A., Suigo, L., Valoti, E., Straniero, V. Targeting bacterial cell division: A binding site-centered approach to the most promising inhibitors of the essential protein FtsZ. Antibiotics. 9 (2), 69(2020).
- Piddock, L. J. V. Multidrug-resistance efflux pumps - not just for resistance. Nat Rev. Microbiol. 4 (8), 629-636 (2006).
- Käufer, N. F., Simanis, V., Nurse, P. Fission yeast Schizosaccharomyces pombe correctly excises a mammalian RNA transcript intervening sequence. Nature. 318 (6041), 78-80 (1985).
- Vyas, A., Freitas, A. V., Ralston, Z. A., Tang, Z. Fission yeast Schizosaccharomyces pombe: A unicellular micromammal model organism. Curr Prot. 1 (6), e151(2021).
- Edwards, D. H., Thomaides, H. B., Errington, J. Promiscuous targeting of Bacillus subtilis cell division protein DivIVA to division sites in Escherichia coli and fission yeast. EMBO J. 19 (11), 2719-2727 (2000).
- Srinivasan, R., Mishra, M., Murata-Hori, M., Balasubramanian, M. K. Filament formation of the Escherichia coli actin-related protein, MreB, in fission yeast. Curr Biol. 17 (3), 266-272 (2007).
- Srinivasan, R., Mishra, M., Wu, L., Yin, Z., Balasubramanian, M. K. The bacterial cell division protein FtsZ assembles into cytoplasmic rings in fission yeast. Gene Dev. 22 (13), 1741-1746 (2008).
- TerBush, A. D., Osteryoung, K. W. Distinct functions of chloroplast FtsZ1 and FtsZ2 in Z-ring structure and remodeling. J Cell Biol. 199 (4), 623-637 (2012).
- Sharma, A. K., et al. A mechanism of salt bridge-mediated resistance to FtsZ inhibitor PC190723 revealed by a cell-based screen. Mol Biol Cell. 34 (3), ar16(2023).
- Basi, G., Schmid, E., Maundrell, K. TATA box mutations in the Schizosaccharomyces pombe nmt1 promoter affect transcription efficiency but not the transcription start point or thiamine repressibility. Gene. 123 (1), 131-136 (1993).
- Moreno, M. B., Durán, A., Carlos Ribas, J. A family of multifunctional thiamine-repressible expression vectors for fission yeast. Yeast. 16 (9), 861-872 (2000).
- Green, M. R., Sambrook, J. Caring for Escherichia coli. Cold Spring Harb Protoc. , (2018).
- Green, M. R., Sambrook, J. Isolation and quantification of DNA. Cold Spring Harb Protoc. , (2018).
- Bähler, J., et al. Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast. 14 (10), 943-951 (1998).
- Pande, V., Mitra, N., Bagde, S. R., Srinivasan, R., Gayathri, P. Filament organization of the bacterial actin MreB is dependent on the nucleotide state. J Cell Biol. 221 (5), e202106092(2022).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Meth. 9 (7), 676-682 (2012).
- Zhang, L. Machine learning for enumeration of cell colony forming units. Vis Comput Ind Biomed Art. 5 (1), 26(2022).
- Moen, E., et al. Deep learning for cellular image analysis. Nat Meth. 16 (12), 1233-1246 (2019).
- Higaki, T. Quantitative evaluation of cytoskeletal organizations by microscopic image analysis. Plant Morphol. 29 (1), 15-21 (2017).
- Henty-Ridilla, J. L., Li, J., Day, B., Staiger, C. J. ACTIN DEPOLYMERIZING FACTOR4 regulates actin dynamics during innate immune signaling in Arabidopsis. Plant Cell. 26 (1), 340-352 (2014).
- Boudaoud, A., et al. an ImageJ plug-in to quantify fibrillar structures in raw microscopy images. Nat Protoc. 9 (2), 457-463 (2014).
- Butler, M. S., Paterson, D. L. Antibiotics in the clinical pipeline in October 2019. J Antibio. 73 (6), 329-364 (2019).
- Andreu, J. M., Huecas, S., Araújo-Bazán, L., Vázquez-Villa, H., Martín-Fontecha, M. The search for antibacterial inhibitors targeting cell division protein ftsz at its nucleotide and allosteric binding sites. Biomedicines. 10 (8), 1825(2022).
- Vještica, A., et al. A toolbox of stable integration vectors in the fission yeast Schizosaccharomyces pombe. J Cell Sci. 133 (1), jcs240754(2020).
- Berg, S., et al. ilastik: interactive machine learning for (bio)image analysis. Nat Meth. 16 (12), 1226-1232 (2019).
- Shaevitz, J. W., Gitai, Z. The structure and function of bacterial actin homologs. Cold Spring Harb Pers Biol. 2 (9), a000364(2010).
- Hoffman, C. S., Wood, V., Fantes, P. A. An ancient yeast for young geneticists: A primer on the Schizosaccharomyces pombe model system. Genetics. 201 (2), 403-423 (2015).
- Aoi, Y., et al. Dissecting the first and the second meiotic divisions using a marker-less drug-hypersensitive fission yeast. Cell Cycle. 13 (8), 1327-1334 (2014).
- Zhang, J., et al. Improving drug sensitivity of HIV-1 protease inhibitors by restriction of cellular efflux system in a fission yeast model. Pathogens. 11 (7), 804(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved