Method Article
Modelagem de microambientes vaginais saudáveis e disbióticos em uma vagina humana em um chip
Neste Artigo
Resumo
Este artigo descreve um protocolo para a criação de um dispositivo de cultura microfluídica vagina-on-a-chip (Vagina Chip) que permite o estudo das interações do hospedeiro humano com um microbioma vaginal vivo sob condições microaerofílicas. Este chip pode ser usado como uma ferramenta para investigar doenças vaginais, bem como para desenvolver e testar possíveis contramedidas terapêuticas.
Resumo
A saúde das mulheres, e particularmente as doenças do trato reprodutivo feminino (TRF), não receberam a atenção que merecem, embora um sistema reprodutivo insalubre possa levar a doenças com risco de vida, infertilidade ou resultados adversos durante a gravidez. Uma barreira no campo é que tem havido uma escassez de modelos experimentais pré-clínicos que imitam fielmente a fisiologia e a fisiopatologia do FRT. Os modelos in vitro e animais atuais não recapitulam totalmente as alterações hormonais, as condições microaeróbicas e as interações com o microbioma vaginal. O advento da tecnologia de cultura microfluídica Organ-on-a-Chip (Organ Chip) que pode imitar interfaces tecido-tecido, perfusão vascular, fluxos de fluido intersticial e o microambiente físico de uma subunidade importante de órgãos humanos pode potencialmente servir como uma solução para esse problema. Recentemente, foi desenvolvido um chip de vagina humana que suporta a co-cultura de consórcios microbianos vaginais humanos com epitélio vaginal humano primário que também tem interface com o estroma vaginal e experimenta fluxo dinâmico de fluido. Este chip replica as respostas fisiológicas da vagina humana a microbiomas saudáveis e disbióticos. Um protocolo detalhado para a criação de chips de vagina humana foi descrito neste artigo.
Introdução
Um microbioma vaginal dominado por Lactobacillus spp. que ajuda a manter um microambiente ácido desempenha um papel importante na manutenção da saúde reprodutiva feminina1. No entanto, às vezes pode haver uma mudança na composição das comunidades microbianas que compõem o microbioma, o que resulta em um aumento na diversidade de bactérias vaginais. Essas alterações disbióticas, que muitas vezes resultam em uma mudança de um estado dominado por Lactobacillus para um dominado por espécies bacterianas anaeróbias mais diversas (por exemplo, Gardnerella vaginalis), estão associadas a várias doenças do sistema reprodutivo, como vaginose bacteriana, vaginite atrófica, infecção do trato urinário, candidíase vulvovaginal, uretrite e corioamnionite 2,3,4,5 . Essas doenças, por sua vez, aumentam as chances de a mulher adquirir doenças sexualmente transmissíveis e doenças inflamatórias pélvicas 6,7,8,9. Eles também representam um risco maior de parto prematuro e abortos espontâneos em mulheres grávidas 10,11,12 e também têm sido implicados na infertilidade 13,14,15,16.
Embora esforços tenham sido feitos para modelar a disbiose vaginal usando células epiteliais vaginais cultivadas em sistemas de cultura estáticos bidimensionais (2D)17,18, eles não imitam efetivamente a fisiologia e a complexidade do microambiente vaginal19. Modelos animais também têm sido usados para estudar a disbiose vaginal; no entanto, suas fases menstruais e interações hospedeiro-microbioma diferem muito das dos humanos e, portanto, a relevância fisiológica dos resultados desses estudos permanece obscura 19,20,21. Para neutralizar esses problemas, organoides e modelos de inserção Transwell de tecido vaginal humano também têm sido usados para estudar as interações patógeno-hospedeiro no FRT 19,22,23,24. Mas, como são culturas estáticas, elas só podem suportar a co-cultura de células humanas com micróbios vivos por um curto período de tempo (<16-24 h) e carecem de muitas outras características físicas potencialmente importantes do microambiente vaginal humano, como produção de muco e fluxo de fluido22.
Os chips de órgãos são sistemas de cultura microfluídica tridimensional (3D) que contêm um ou mais microcanais ocos paralelos revestidos por células vivas cultivadas sob fluxo dinâmico de fluido. Os chips de dois canais permitem a recriação de interfaces tecido-tecido em nível de órgão, cultivando diferentes tipos de células (por exemplo, epitélio e fibroblastos estromais ou epitélio e endotélio vascular) em lados opostos de uma membrana porosa que separa os dois canais paralelos (Figura 1). Ambos os tecidos podem ser expostos independentemente ao fluxo de fluido e também podem experimentar condições microaeróbicas para permitir a co-cultura com um microbioma complexo 25,26,27,28. Essa abordagem foi recentemente aproveitada para desenvolver um chip de vagina humano revestido por epitélio vaginal primário sensível a hormônios, interligado com fibroblastos estromais subjacentes, que sustenta uma baixa concentração fisiológica de oxigênio no lúmen epitelial e permite a co-cultura com microbiomas saudáveis e disbióticos por pelo menos 3 dias in vitro29. Foi demonstrado que o Vagina Chip pode ser usado para estudar a colonização por consórcios ideais (saudáveis) de L. crispatus e detectar inflamação e lesão causada por consórcios contendo G. vaginalis não ideais (não saudáveis). Aqui, descrevemos em detalhes os métodos usados para criar o chip da vagina humana, bem como para estabelecer comunidades bacterianas saudáveis e disbióticas no chip.
Protocolo
Esta pesquisa foi realizada em conformidade com as diretrizes institucionais para o uso de células humanas. As células foram obtidas comercialmente (ver Tabela de Materiais). Todas as etapas devem ser realizadas assepticamente em um gabinete de biossegurança (BSC). Use apenas ponteiras de pipeta de filtro (ou barreira) para este protocolo.
1. Cultura de células epiteliais vaginais humanas
- Aqueça 50 mL de meio epitelial vaginal (VEM, consulte a Tabela de Materiais) a 37 °C.
- Alíquota de 9 mL de VEM para um tubo de 15 mL. Em seguida, descongele um frasco de células epiteliais vaginais humanas (HVECs) e adicione-o ao tubo contendo VEM.
- Centrifugue o tubo de 15 ml a 300 x g durante 5 min à temperatura ambiente (RT) e aspire o sobrenadante, deixando o pellet para trás.
- Ressuspenda suavemente o pellet em 2 ml de VEM e adicione 1 ml a cada um dos dois frascos T75 contendo 14 ml de VEM.
- Incubar os frascos a 37 °C com 5% de CO2. Troque o VEM a cada 2 dias até que os HVECs estejam aproximadamente 70% confluentes (cerca de 5 dias).
2. Cultura de células de fibroblastos uterinos humanos
- Preparar 10 ml de solução de poli-L-lisina (PLL) a 15 μg/ml em água bidestilada (ddH2O). Adicionar 5 ml de solução de PLL a cada um dos dois balões T75 e incubar a 37 °C durante 1 h.
- Aqueça 50 mL de meio de fibroblastos (FM, consulte a Tabela de Materiais) a 37 °C.
- Aspirar a solução de PLL e lavar cada balão com 5 ml de ddH2O.
- Alíquota de 9 mL de FM para um tubo de 15 mL e descongele um frasco de fibroblastos uterinos humanos (HUFs).
- Adicione os HUFs ao tubo de 15 mL contendo FM.
- Centrifugue o tubo de 15 ml a 300 x g durante 5 min à RT e aspire o sobrenadante, deixando o sedimento celular para trás.
- Ressuspenda suavemente o pellet em 2 mL de FM e adicione 1 mL a cada um dos dois frascos T75 contendo 14 mL de FM.
- Incubar frascos a 37 °C com 5% de CO2 até que as células estejam aproximadamente 70% confluentes, trocando o meio de 2 em 2 dias.
3. Ativação do chip e revestimento do canal
- Desgaseifique os cavacos (obtidos comercialmente, consulte a Tabela de Materiais) por 30 min em um dessecador a vácuo.
- Permita que o Reagente de Ativação 1 (AR-1) e o Reagente de Ativação 2 (AR-2) (consulte a Tabela de Materiais) se equilibrem em RT por 15 min sem remover sua embalagem.
- Enrole um tubo cônico de 15 mL em papel alumínio para protegê-lo da luz. Adicione lentamente 1 ml de solução de AR-2 às paredes do frasco para injetáveis de AR-1 e misture bem. Transfira a mistura para o tubo de 15 mL embrulhado em papel alumínio.
- Adicione repetidamente a solução de AR-2 ao frasco para injetáveis de AR-1 em incrementos de 1 ml até que o pó de AR-1 seja totalmente lavado do frasco para injetáveis.
- Complete a solução reconstituída AR-1 para 10 mL com solução AR-2.
- Adicione 200 μL desta solução à entrada do canal apical de cada chip durante a aspiração da saída (Figura 1A). Repita para o canal basal. Mantenha a pipeta perpendicular ao cavaco enquanto adiciona a solução para manter uma vedação hermética com fluxo desobstruído.
- Repita a etapa 3.6 para todos os chips.
- Verifique se há bolhas em todos os chips. Remova todas as bolhas adicionando mais solução ao(s) canal(is) afetado(s).
- Aspire todo o excesso de solução AR-1 da superfície do cavaco, evitando entradas e saídas de canal.
- Coloque os chips em uma placa de Petri de 150 mm e insira este prato descoberto em uma caixa de luz ultravioleta.
- Vire a caixa de luz UV para a parte de trás do BSC e deixe os chips sob luz UV constante por 30 min. A cor da solução nos chips mudará de rosa escuro para mogno.
- Lave cada canal adicionando 200 μL de solução AR-2 à entrada enquanto aspira simultaneamente da saída.
- Lave cada canal duas vezes adicionando 200 μL de DPBS frio (-/-) à entrada enquanto aspira simultaneamente da saída.
- Prepare o revestimento do canal apical (mistura de 200 μg/mL de colágeno I e 30 μg/mL de colágeno IV em DMEM) (consulte a Tabela de Materiais). Mantenha no gelo.
- Prepare o revestimento do canal basal (mistura de 15 μg/mL de PLL e 200 μg/mL de colágeno I em DMEM). Mantenha no gelo.
- Adicione 200 μL de revestimento do canal basal à entrada do canal basal. Conecte a tomada com uma ponta P200 quando a solução de revestimento aparecer na tomada. Dispense a solução até que os volumes da ponteira de entrada e saída sejam iguais e, em seguida, solte a ponteira da pipeta, deixando a ponteira na entrada.
- Da mesma forma, adicione 200 μL de revestimento do canal apical ao canal apical.
- Aspirar o excesso de solução da superfície da apara.
- Verifique se há bolhas em todos os chips. Remova todas as bolhas adicionando mais revestimento de canal ao(s) canal(is) afetado(s).
- Incubar as aparas durante a noite numa placa de Petri de 150 mm a 37 °C com 5% de CO2.
4. Semeando o canal basal do chip com HUFs
- Veja o crescimento de HUFs no frasco ao microscópio diariamente.
- Uma vez que as culturas de HUF estejam 70% -90% confluentes (~ 3 dias após o plaqueamento), aqueça 25 mL de FM, 5 mL de Dbs livre de Ca2+/Mg2+ (DPBS (-/-), 10 mL de tripsina/EDTA e 15 mL de solução neutralizante de tripsina (TNS, consulte a Tabela de Materiais) a 37 °C.
- Aspirar o meio dos frascos. Lave com 5 mL de DPBS (-/-) e aspire novamente.
- Adicione 4 ml de tripsina-EDTA a cada balão e incube a 37 °C durante 3-5 min até que as células se desprendam.
- Adicionar 6 ml de TNS a cada balão e transferir a suspensão celular para um tubo cónico de 15 ml.
- Misturar bem a suspensão com uma pipeta e tomar uma alíquota de 10 μL para a contagem das células. Misture 10 μL de suspensão celular com 10 μL de azul de tripano e conte usando um hemocitômetro.
- Centrifugar a suspensão da célula a 300 x g durante 5 min à RT. Aspirar o sobrenadante e ressuspender o sedimento em FM quente até uma concentração final de 7,5 x 105 células/ml.
- Lave o canal basal com 200 μL de FM.
- Aqueça 15 mL de VEM a 37 °C. Lavar o canal apical com 200 μL de VEM.
- Adicione 200 μL de VEM completo à entrada do canal apical enquanto obstrui a saída com uma ponta de pipeta. Dispense o meio até que os volumes da ponta de entrada e saída sejam iguais e, em seguida, solte a ponta da pipeta da pipeta, deixando a ponta na entrada. Mantenha o canal superior cheio e conectado na entrada e na saída.
- Pipete lentamente 50 μL de suspensão de células HUF na entrada do canal basal enquanto aspira simultaneamente da saída. Remova a ponta da pipeta da entrada quando ~ 2 μL da suspensão celular permanecerem na ponta da pipeta sem pressionar ou soltar o êmbolo da pipeta para evitar a formação de bolhas. Conecte a entrada e a saída com pontas de pipeta.
- Verifique se há bolhas sob um microscópio. Se estiverem presentes, lave o canal basal com FM e repita o passo 4.11.
- Vire os chips conectados de cabeça para baixo em um rack de tubo de 15 mL e incube a 37 ° C com 5% de CO2 por 1 h. Observe os chips após a incubação e verifique se há fixação da célula.
- Conecte a saída do canal basal com uma ponta de pipeta. Adicione 200 μL de FM à entrada do canal basal sem empurrar o êmbolo da pipeta para baixo. Solte a ponta da pipeta e deixe o meio fluir livremente através do canal até a ponta da pipeta de saída por fluxo gravitacional.
- Incubar lascas semeadas com HUF durante a noite a 37 °C com 5% de CO2.
5. Canal apical do chip de semeadura com células epiteliais vaginais
- Aqueça 50 mL de VEM a 37 °C.
- Prepare o revestimento do canal apical (200 μg / mL de colágeno I em DMEM). Mantenha no gelo.
- Conecte a saída do canal apical com uma ponta de pipeta.
- Adicione 200 μL de revestimento do canal apical à entrada do canal apical. Dispense a solução de revestimento apical até que os volumes da ponta de entrada e saída sejam iguais e, em seguida, solte a ponta da pipeta da pipeta, deixando a ponta na entrada.
- Aspire o excesso de solução da superfície do chip.
- Incube os cavacos a 37 °C com 5% de CO2 por 1 h.
- Após 1 h, lave o revestimento do canal apical adicionando 200 μL de VEM à entrada do canal apical enquanto aspira da saída.
- Verifique o crescimento HVEC sob um microscópio para ~ 70% -90% de confluência.
- Se as células forem 70% -90% confluentes, aqueça 6 mL de meio de células epiteliais vaginais completas e 4 mL de tripsina/EDTA por frasco, a 37 °C.
- Aspirar o meio do balão HVEC e lavar com 5 ml de DPBS (-/-) e, em seguida, aspirar.
- Adicione 4 ml de tripsina a cada frasco e incube a 37 °C com 5% de CO2 durante 3-5 min até que as células se desprendam.
- Adicionar 6 ml de VEM ao balão para inactivar a tripsina e transferir a suspensão celular para um tubo cónico de 15 ml.
- Misturar bem a suspensão com uma pipeta e tomar uma alíquota de 10 μL para a contagem das células. Misture 10 μL de suspensão celular com 10 μL de azul de tripano e conte usando um hemocitômetro.
- Centrifugar a suspensão da célula a 300 x g durante 5 min à RT. Aspirar o sobrenadante e ressuspender o sedimento em VEM até uma concentração final de 3,5-4 milhões de células/ml.
- Aqueça 25 mL de FM a 37 °C.
- Conecte a saída do canal apical com uma ponta de pipeta. Pipetar lentamente pelo menos 40 μL de suspensão de células HVEC na entrada do canal apical. Dispense a suspensão da célula até que os volumes da ponteira de entrada e saída sejam iguais e, em seguida, solte a ponteira da pipeta, deixando a ponteira na entrada. Mantenha o canal basal cheio de FM e conectado na entrada e na saída.
- Aspire cuidadosamente o excesso de meio na superfície dos chips e verifique se há bolhas ao microscópio. Se estiverem presentes, repita o passo 5.16.
- Coloque os cavacos em uma placa de Petri grande e incube a 37 ° C com 5% de CO2 durante a noite.
- No dia seguinte, observe os chips sob um microscópio para fixação celular.
- Remova as pontas da pipeta das entradas e saídas dos canais apicais e basais.
- Conecte a saída do canal basal com uma ponta de pipeta e adicione 200 μL de FM à entrada do canal basal sem empurrar o êmbolo da pipeta para baixo. Solte a ponta da pipeta da pipeta e deixe o meio fluir livremente através do canal até a ponta da pipeta de saída por fluxo gravitacional.
- Repita a etapa 5.21 para o canal apical usando VEM.
- Incubar as aparas duplamente semeadas a 37 °C com 5% de CO2 durante 24 h.
6. Conectando chips a vagens e diferenciando células epiteliais vaginais
- Alíquota de 50 mL de FM e VEM para separar tubos cônicos de 50 mL e aquecer a 37 °C.
- Desgaseifique os meios FM e VEM aquecidos a 37 °C sob vácuo estéril por 5 min.
- Desinfete e limpe as bandejas para o Dynamic Flow Module (DFM, consulte a Tabela de Materiais). Retire as cápsulas da embalagem e coloque-as nas bandejas.
- Adicionar 2 ml de VEM desgaseificado ao reservatório de entrada apical (reservatório superior direito; Figura 1B). Adicione meio ao longo das paredes do reservatório para evitar a formação de bolhas.
- Adicione 3 mL de FM desgaseificado ao reservatório de entrada basal (reservatório superior esquerdo, Figura 1B). Adicione meio ao longo das paredes do reservatório para evitar a formação de bolhas.
- Adicione 500 μL de VEM desgaseificado ao reservatório de saída apical (reservatório inferior direito, Figura 1B). Incline a cápsula de forma que o meio cubra toda a superfície inferior do reservatório.
- Adicione 500 μL de FM desgaseificado ao reservatório de saída basal (reservatório inferior esquerdo, Figura 1B). Incline a cápsula de forma que o meio cubra toda a superfície inferior do reservatório.
- Deslize as bandejas contendo pods para o DFM e execute o ciclo Prime duas vezes. Verifique se há gotículas saindo das portas na parte inferior de cada pod.
- Se uma gota não se formar após 4 ciclos "Prime", faça contato direto com a porta dentro do reservatório de saída da cápsula (Figura 1B) e pipete 200 μL do respectivo meio para permitir que o meio flua entre o reservatório e o canal. Isso é chamado de "preparação manual".
- Remova as pontas das pipetas dos chips e coloque uma gota do respectivo meio sobre todas as portas de cada chip.
- Deslize os chips nas vagens e coloque-os nas bandejas.
- Aspire qualquer mídia na superfície dos chips e deslize cada bandeja em um DFM.
- Defina os seguintes parâmetros no DFM como: Superior e Inferior - Líquido; Fluxo apical (canal superior) - 15 μL/h; Fluxo Basal (Canal Inferior) - 30 μL/h; Alongamento = 0%; Frequência = 0 Hz.
- Execute o ciclo Regular no DFM e permita o fluxo durante a noite.
- Após 24 h, altere as configurações de fluxo para 0 μL / h para o canal apical e mantenha o canal basal a uma taxa de fluxo de 30 μL / h por mais 24 h.
- Prepare 500 mL de meio de diferenciação (DM) adicionando 4 mM de L-glutamina, 20 mM de hidrocortisona, 1x ITES, 20 nM de triiodotironina, 100 μM de O-fosforil etanolamina, 180 μM de adenina, 3,2 mM de cloreto de cálcio, 2% de FBS inativado por calor, 1% de Pen-strep e 120 mL de meio F-12 de Ham ao DMEM de baixa glicose (consulte a Tabela de Materiais) e esterilize por filtro.
- Aqueça 50 mL de MS a 37 °C.
- Adicione 20 μL de estradiol 10 μM (consulte a Tabela de Materiais) aos 50 mL de MS, misture bem e desgaseifique sob vácuo estéril por 5 min.
- Aqueça 50 mL de VEM a 37 °C em banho-maria e desgaseifique sob vácuo estéril por 5 min.
- Retirar as bandejas do DFM, colocá-las em um BSC e aspirar os meios das cápsulas, evitando as portas nos reservatórios (Figura 1A). Em seguida, adicione 2 mL de VEM ao reservatório de entrada do canal apical e 3 mL de MS ao reservatório de entrada do canal basal.
- Retorne as bandejas para o DFM e defina o fluxo do canal apical para 15 μL / h e o fluxo do canal basal para 30 μL / h.
- Deixe o DFM fluir por 4-7 h. Em seguida, pare o fluxo do canal apical ajustando-o para 0 μL / h. Deixe o fluxo do canal basal continuar a 30 μL / h.
- Troque a mídia seguindo as etapas 6.16-6.19 a cada 48 h.
- Flua o meio intermitentemente no canal apical por 4-7 h todos os dias por 5 dias adicionais seguindo as etapas 6.20-6.21.
- Prepare a solução salina balanceada de Hanks com baixa capacidade tamponante com meio de glicose (HBSS (LB / + G)) adicionando 1.26 mM de cloreto de cálcio, 0.49 mM de cloreto de magnésio hexahidratado, 0.406 mM de sulfato de magnésio, 5.33 mM de cloreto de potássio, 137.93 mM de cloreto de sódio, 0.441 mM de fosfato de potássio monobásico e 5.55 mM de D-glicose a dd H2O (ver Tabela de Materiais); pH 4,8.
- Prepare 500 mL de DM sem Estreptococos de Caneta adicionando 4 mM de L-glutamina, 20 mM de hidrocortisona, 1x ITES, 20 nM de triiodotironina, 100 μM de O-fosforil etanolamina, 180 μM de adenina, 3,2 mM de cloreto de cálcio, 2% de FBS inativado por calor e 120 mL de meio F-12 de Ham ao DMEM de baixa glicose e esterilize por filtro.
- No dia 6, substitua o meio do canal apical por (HBSS (LB/+G)) e o meio do canal basal por DM sem estreptococos seguindo as etapas 6.16-6.19.
- Defina o fluxo no DFM para 15 μL / h para o canal apical e 30 μL / h para o canal basal por 24 h antes de prosseguir com a inoculação bacteriana.
7. Inoculação bacteriana de chips diferenciados
NOTA: Execute as etapas a seguir em um laboratório e BSC que estejam em conformidade com os regulamentos para lidar com micróbios.
- Calcular o UFC/ml de cada estirpe bacteriana a incluir no inóculo. Misture a quantidade necessária de cada cepa bacteriana para totalizar até ~ 5 x 106 UFC / mL.
- Centrifugue a mistura a 7.000 x g por 7 min a 4 °C e remova cuidadosamente o sobrenadante. Ressuspenda o chumbinho (HBSS (LB/+G)). Este será o inóculo bacteriano.
- Separe os chips das cápsulas. Conecte a saída do canal basal com uma ponta de pipeta e adicione 200 μL de DM sem estreptococos à entrada do canal basal sem empurrar o êmbolo da pipeta para baixo. Solte a ponta da pipeta da pipeta e permita que o meio flua livremente através do canal até a saída por fluxo gravitacional.
- Adicione 37 μL do inóculo bacteriano à entrada do canal apical, enquanto aspira da saída. Quando restarem cerca de 2 μL na ponta da pipeta, puxe a ponta para fora e tampe a entrada e saída do canal apical com as pontas da pipeta.
- Para os chips de controle (não inoculados), repita a etapa 7.4 com 37 μL de [HBSS (LB/+G)).
- Aspire qualquer mídia na superfície do chip. Colocar as aparas numa placa de Petri de 150 mm e incubar a 37 °C com 5% de CO2 durante 24 h.
- Coloque as vagens (sem lascas) nas bandejas e coloque-as na incubadora a 37 °C com 5% de CO2 por 24 h.
- Aqueça 50 mL de (HBSS (LB / + G)) e 50 mL de DM sem estreptococos a 37 ° C.
- Adicione 20 μL de 10 μM de Estradiol aos 50 mL de DM sem estreptococos Pen, misture bem e desgaseifique sob vácuo estéril por 5 min. Desgaseifique o (HBSS (LB / + G)) sob vácuo por 5 min.
- Aspire cuidadosamente o meio nas cápsulas, evitando as portas de entrada e saída do reservatório.
- Adicione 3 mL de desgaseificado [HBSS (LB / + G)) ao reservatório da cápsula de entrada apical e 500 μL de desgaseificado [HBSS (LB / + G)) ao reservatório da cápsula de saída apical.
- Adicione 3 mL de DM sem Pen-Strep desgaseificado ao reservatório da cápsula de entrada basal e 500 μL de DM livre de antibióticos desgaseificados ao reservatório da cápsula de saída basal.
- Deslize as bandejas com as cápsulas (sem os chips) no DFM e execute o ciclo Prime duas vezes. Verifique se há gotículas saindo de cada porta na parte inferior do pod.
NOTA: Se uma gota não se formar após 4 ciclos "Prime", faça contato direto com a porta dentro do reservatório de saída da cápsula (Figura 1B) e pipete 200 μL do respectivo meio para permitir que o meio flua entre o reservatório e o canal. - Remova as pontas da pipeta dos cavacos e coloque uma gota do respectivo meio sobre todas as entradas e saídas do canal.
- Deslize as batatas fritas nas cápsulas e coloque-as nas bandejas.
- Aspirar os meios nos reservatórios da cápsula de saída apical e basal e em qualquer meio na superfície das pastilhas. Em seguida, deslize as bandejas para dentro do DFM.
- Defina os seguintes parâmetros no DFM: Superior e Inferior - Líquido; Fluxo apical (superior) - 40 μL/h; Fluxo Basal (Inferior) - 40 μL/h; Alongamento - 0%; Frequência - 0 Hz. Execute o ciclo Regular .
- Pare o fluxo após 4 h e colete o efluente, ou seja, o meio nos reservatórios de saída apicais e basais.
- Meça e registre os volumes de efluentes.
- Coloque os cavacos de volta no DFM e ajuste a taxa de fluxo apical para 0 μL / h e o fluxo basal para 30 μL / h. Inicie o fluxo para ser executado durante a noite.
- Alíquota do efluente coletado para vários ensaios planejados e armazene-os em temperaturas apropriadas.
NOTA: Para medição de UFC, adicione glicerol a uma concentração final de 16% e armazene imediatamente a -80 °C. - Aspirar o meio apenas nos reservatórios de saída basal e definir caudais apicais e basais para 40 μL/h no DFM. Inicie o fluxo por 4 h e repita as etapas 7.18-7.21. Esta será a coleta de efluentes por 48 h.
- Repita a etapa 7.22 por 72 h ou até que o experimento termine.
- No ponto final do experimento, colete os efluentes seguindo as etapas 7.18-7.19.
- Prepare a solução de digestão adicionando 1 mg / mL de colagenase IV em TrypLE express. Aquecer 10 ml de solução de digestão a 37 °C.
- Conecte a porta de saída do canal basal com uma ponta de pipeta. Adicione 100 μL de solução de digestão ao canal basal. Misture bem e, usando uma pipeta, colete toda a solução do canal em um tubo rotulado como 'Tubo B'.
- Conecte a porta de saída do canal apical com uma ponta de pipeta. Adicione 100 μL de solução de digestão ao canal apical. Misture bem e, usando uma pipeta, colete toda a solução do canal em um tubo rotulado como 'Tubo A'.
- Adicione mais 100 μL da solução de digestão às entradas do canal apical e basal enquanto obstrui as saídas com ponteiras de pipeta. Incube os cavacos e os tubos A e B a 37 °C por 1-1.5 h.
- Misture bem o conteúdo da digestão dentro dos canais usando as pontas conectadas já colocadas nas entradas e saídas. Colete o conteúdo dos canais apicais e basais para os tubos A e B, respectivamente. Estes são os resumos apicais e basais do chip.
- Conte as células no Tubo A usando um hemocitômetro. Além disso, remova uma alíquota dos resumos de cavacos para medição de UFC seguindo a etapa 7.21.
8. Análise de efluentes e digestores de cavacos
- Para a enumeração de bactérias dos efluentes e digestos, diluir seriadamente os efluentes ou digestos em DPBS estéril (-/-) e placa em uma placa de mídia adequada, incubar a 37 ° C por 24-48 h e contar as colônias na placa.
- Para a medição do pH, recolher 10 μL do efluente de 72 h imediatamente após a recolha e utilizar uma faixa de pH para medir o pH do efluente.
- Para a análise das citocinas, utilizar os efluentes para detectar citocinas específicas utilizando ensaio baseado em Luminex, ELISA ou qualquer outra técnica aplicável29,30.
Resultados
A vagina humana é revestida por um epitélio estratificado que se sobrepõe a um estroma colágeno rico em fibroblastos. Para modelar isso, uma interface de tecido foi criada pela cultura de epitélio vaginal humano primário e fibroblastos em lados opostos de uma membrana porosa comum dentro de um dispositivo Organ Chip microfluídico de dois canais. A formação do epitélio vaginal é monitorada por meio de imagens microscópicas de campo claro, que revelam a formação de uma folha contínua de células que forma progressivamente múltiplas camadas de células (Figura 2A). Relatórios anteriores confirmaram que essa morfologia se correlaciona com o desenvolvimento de um epitélio totalmente estratificado quando visto em seção transversal29. No entanto, se a camada epitelial parecer irregular e descontínua (Figura 2B), o Chip da Vagina pode não ser adequado para uso em experimentos.
A Figura 3 mostra uma representação esquemática da geração do Chip da Vagina. Para validar a funcionalidade do Chip da Vagina, os chips foram inoculados com L. crispatus e G. vaginalis para modelar ambientes vaginais saudáveis e disbióticos, respectivamente. G. vaginalis é a bactéria envolvida principalmente na vaginose bacteriana. Para verificar se bactérias saudáveis e disbióticas são enxertadas nos chips da vagina, a carga bacteriana foi quantificada nos chips da vagina inoculados com as diferentes populações bacterianas por efluentes do canal de plaqueamento e camadas de células digeridas em meios de crescimento bacteriano seletivos (ágar De Man-Rogosa-Sharpe (MRS) para L. crispatus e ágar sangue Brucella (BBA) para G. vaginalis) (ver Tabela de Materiais) e comparando-os com culturas semelhantes usando o inóculo original. Colônias de L. crispatus e G. vaginalis foram detectadas dentro de 48 h após o plaqueamento (Figura 2C), confirmando que bactérias saudáveis e disbióticas foram enxertadas nos chips da vagina. No entanto, se forem observadas colônias bacterianas nas placas que contêm os inóculos, mas não observadas nas placas que contêm o efluente ou digerem após a incubação necessária, pode-se concluir que a bactéria não enxertou.
Um ambiente vaginal saudável é ácido e a disbiose resulta em um aumento do pH vaginal31. Portanto, o pH do efluente do canal epitelial apical do Chip da Vagina também foi analisado. O pH dos chips vaginais inoculados com L. crispatus foi semelhante ao dos chips de controle não inoculados e, quando co-cultivados com G. vaginalis , eles experimentaram um aumento significativo do pH (Figura 2D). Se o pH de um chip de vagina não infectado for observado alto, isso indica que há um problema e esses chips não devem ser usados para experimentos.
O estado inflamatório do tecido vaginal também é sensível à composição do microbioma vaginal, com um microbioma disbiótico estimulando a inflamação. Após a análise das citocinas pró-inflamatórias no canal apical do chip da vagina 3 dias após a inoculação com L. crispatus ou G. vaginalis, a resposta pró-inflamatória foi igualmente maior com G. vaginalis em comparação com chips não infectados e chips inoculados com L. crispatus ( Figura 2E). Em conjunto, esses resultados mostram que o Chip da Vagina imita de perto o microambiente vaginal humano em estados saudáveis e disbióticos.
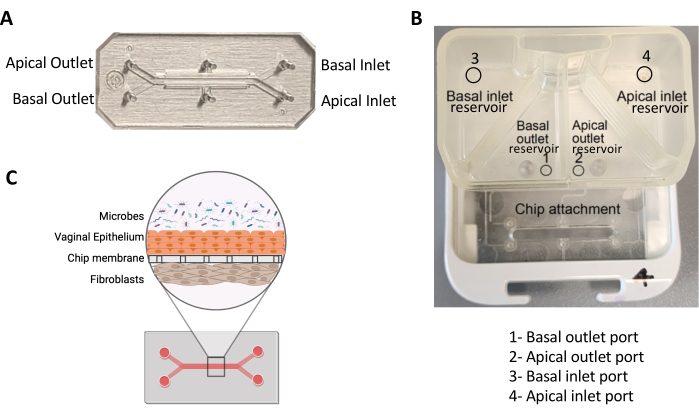
Figura 1: Um chip de dois canais e seu pod. (A) Imagem de um chip PDMS de dois canais representando seus canais e portas. (B) Imagem de uma cápsula representando os reservatórios e portas para canais apicais e basais. (C) Diagrama esquemático mostrando a vista transversal de um chip de vagina infectado com micróbios. Clique aqui para ver uma versão maior desta figura.

Figura 2: O chip da vagina imita microambientes vaginais humanos saudáveis e disbióticos. (A) Células epiteliais vaginais no canal apical de um chip de vagina robusto. A barra de escala representa 1 mm do chip na imagem superior e 500 μm na imagem inferior. (B) Células epiteliais vaginais no canal apical de um chip vaginal inadequado. A barra de escala representa 1 mm do chip na imagem superior e 500 μm na imagem inferior. (C) Enxerto de L. crispatus (LC) e G. vaginalis (GV) no chip da vagina. (D) pH dos chips vaginais após 72 h de incubação com L. crispatus (LC) e G. vaginalis (GV) em comparação com os chips vaginais não infectados (controle). (E) Resposta pró-inflamatória de chips de vagina a L. crispatus (LC) e G. vaginalis (GV) após 72 h de incubação, em comparação com chips de vagina não infectados (controle). (CE) Os gráficos mostram ± SD médio para 4-6 chips; * p < 0,05, ** p < 0,01, *** p < 0,001 em comparação com os chips vaginais de controle; Cada (●) representa dados de 1 chip. Clique aqui para ver uma versão maior desta figura.
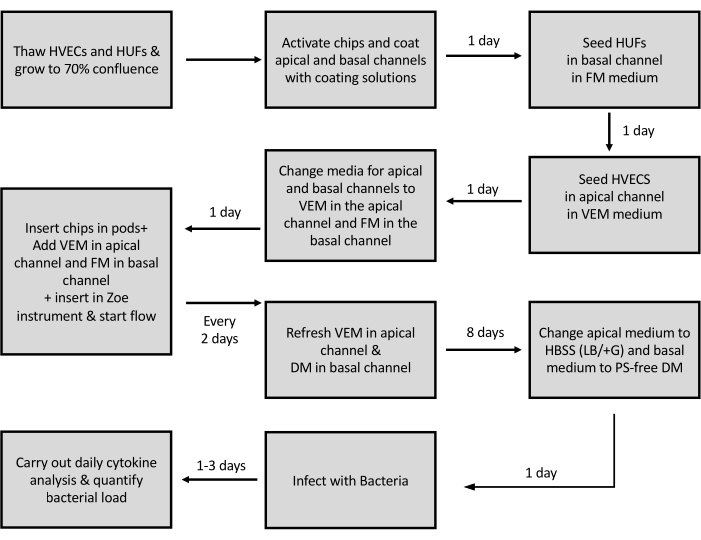
Figura 3: Representação esquemática do protocolo para a geração do Chip da Vagina. Representação esquemática das etapas envolvidas na semeadura de células e geração do Chip da Vagina. HVECs - Células epiteliais vaginais humanas; HUFs - Fibroblastos uterinos humanos; VEM - Meio epitelial vaginal; FM - Meios de fibroblastos; DM - Meio de diferenciação; PS - Penicilina estreptomicina. Clique aqui para ver uma versão maior desta figura.
Discussão
Modelos in vitro anteriores da vagina humana não replicam fielmente as estruturas do tecido vaginal, o fluxo de fluido e as interações hospedeiro-patógeno19,22. Os modelos animais também são limitados pela variação interespécies no microbioma e diferenças no ciclo estral ou menstrual19,22. Este manuscrito descreve um protocolo para criar um modelo de Chip de Órgão da vagina humana que pode efetivamente imitar as respostas humanas a comunidades microbianas saudáveis e disbióticas.
Este protocolo envolve a semeadura de células epiteliais vaginais e de fibroblastos em lados opostos de uma membrana porosa compartilhada que separa microcanais paralelos em um dispositivo Organ Chip de dois canais que está disponível comercialmente (consulte a Tabela de Materiais). A membrana porosa permite a migração de fatores de crescimento e outras formas de comunicação intercelular. No entanto, o revestimento de colágeno e a presença das monocamadas celulares impedem a mistura de meios entre os canais. Após a formação de uma monocamada de células epiteliais vaginais no canal apical, fatores de diferenciação são introduzidos no meio que flui no canal basal, que passa pelo espaço intersticial e, assim, promove a diferenciação das células epiteliais vaginais para formar um epitélio estratificado. A densidade das células epiteliais vaginais no momento da semeadura é um determinante crucial da saúde do chip da vagina no final da fase de diferenciação. Assim, a densidade das células epiteliais vaginais deve ser avaliada antes de iniciar a diferenciação, que não deve ser iniciada até que uma monocamada seja estabelecida. A exposição aos fatores de diferenciação pode ser continuada até que a densidade desejada das células epiteliais vaginais seja obtida e antes da inoculação bacteriana. Além disso, deve-se notar que a taxa de crescimento pode variar para células epiteliais vaginais primárias de diferentes doadores (ou fontes comerciais), o que pode afetar a qualidade do chip da vagina gerado. Em todos os estudos microfluídicos de chips de órgãos, é de extrema importância remover quaisquer bolhas que possam se formar nos canais ao longo da cultura de chips, pois elas interferem no fluxo do meio e acabarão resultando em redução da disponibilidade de nutrientes e perda de viabilidade celular.
Este protocolo também descreve como usar o chip da vagina para estabelecer comunidades bacterianas no chip que imitam o estado vaginal saudável ou a vaginose bacteriana. O Chip da Vagina também pode ser usado para estudar outras doenças ou distúrbios vaginais; No entanto, deve-se ter cuidado para entender as características de cada doença e os melhores meios para correlacionar os resultados com os achados clínicos ao realizar esses estudos. Em resumo, o chip da vagina humana abre novos caminhos para estudar uma infinidade de doenças e condições relacionadas à TRF e pode ser uma ferramenta valiosa para investigar possíveis terapêuticas.
Divulgações
Donald Ingber é fundador, membro do conselho, presidente do conselho consultivo científico e acionista da Emulate. Os outros autores declaram que não têm interesses conflitantes.
Agradecimentos
Esta pesquisa foi patrocinada com financiamento da Fundação Bill e Melinda Gates (INV-035977) e do Instituto Wyss de Engenharia Biologicamente Inspirada da Universidade de Harvard. Também agradecemos a Gwenn E. Merry, do Wyss Institute, por editar este manuscrito. O diagrama na Figura 1 foi criado com o BioRender.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm Steriflip | Millipore | SCGP00525 | To degas media |
| 2 channel chip | Emulate | BRK-S1-WER-24 | Part of the two-channel Chip kit |
| 200 μL barrier tips (or filter tips) | Thomas Scientific, SHARP | 1159M40 | Tips used for chip seeding |
| Activation Reagent 1 (or ER-1 powder) | Emulate | Chip S1 Basic Research kit-24PK | Part of the two-channel Chip kit; Storage temperature -20 °C |
| Activation Reagent 2 (or ER-2 solution) | Emulate | Chip S1 Basic Research kit-24PK | Part of the two-channel Chip kit; Storage temperature 4 °C |
| Adenine | Sigma Aldrich | A2786 | Component of the Differentiation media |
| Brucella blood agar plates | VWR International Inc. | 89405-032 | with Hemin and Vitamin K; For the enumeration of Gardnerella vaginalis |
| Ca2+ and Mg2+ free DPBS (DPBS (-/-) | ScienCell | 303 | For washing cells |
| Calcium Chloride | Sigma Aldrich | C5670 | Component of the Differentiation media |
| Calcium chloride (anhyd.) | Sigma Aldrich | 499609 | Component of HBSS (LB/+G) |
| Collagen I | Corning | 354236 | For the coating solution for HVEC |
| Collagen IV | Sigma Aldrich | C7521 | For the coating solution for HVEC |
| Collagenase IV | Gibco | 17104019 | For the dissociation of cells from the Vagina Chips |
| Complete fibroblast medium | ScienCell | 2301 | Media for the culture of HUF |
| Complete vaginal epithelium medium | Lifeline | LL-0068 | Media for the culture of HVEC |
| D-Glucose (dextrose) | Sigma Aldrich | 158968 | Component of HBSS (LB/+G) |
| DMEM (Low Glucose) | Thermofisher | 12320-032 | Component of the Differentiation media |
| Dynamic Flow Module (or Zoë) | Emulate | Zoë-CM1 | Regulates the flow rate of the chips |
| Ham's F12 | Thermofisher | 11765-054 | Component of the Differentiation media |
| Heat inactivated FBS | Thermofisher | 10438018 | Component of the Differentiation media |
| Human uterine fibroblasts | ScienCell | 7040 | HUF |
| Human vaginal epithelial cells | Lifeline | FC-0083 | HVEC |
| Hydrocortisone | Sigma Aldrich | H0396 | Component of the Differentiation media |
| ITES | Lonza | 17-839Z | Component of the Differentiation media |
| L-glutamine | Thermofisher | 25030081 | Component of the Differentiation media |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | Component of HBSS (LB/+G) |
| Magnesium sulfate heptahydrate | Sigma Aldrich | M1880 | Component of HBSS (LB/+G) |
| MRS agar plates | VWR International Inc. | 89407-214 | For enumeration of Lactobacillus |
| O-phosphorylethanolamine | Sigma Aldrich | P0503 | Component of the Differentiation media |
| Pen/Strep | Thermofisher | 15070063 | Component of the Differentiation media |
| pH strips | Fischer-Scientific | 13-640-520 | For measurement of pH |
| Pods (1/chip) | Emulate | BRK-S1-WER-24 | Part of the two-channel Chip kit |
| Poly-L-lysine | ScienCell | 403 | For the coating solution for HUFs |
| Potassium chloride | Sigma Aldrich | P3911 | Component of HBSS (LB/+G) |
| Potassium phosphate monobasic | Sigma Aldrich | P0662 | Component of HBSS (LB/+G) |
| Sterile 80% glycerol | MP Biomedicals | 113055034 | For freezing bacterial samples |
| Triiodothyronine | Sigma Aldrich | T6397 | Component of the Differentiation media |
| Trypan Blue Solution (0.4%) | Sigma Aldrich | T8154 | For counting live/dead cells |
| TrypLE Express | Thermofisher | 12605010 | For the dissociation of cells from the Vagina Chips |
| Trypsin Neutralizing Solution (TNS) | ScienCell | 113 | For neutralization of Trypsin |
| Trypsin/EDTA Solutiom (0.25%) | ScienCell | 103 | For cell dissociation |
| β-estradiol | Sigma Aldrich | E2257 | Hormone for differentiation media |
Referências
- Smith, S. B., Ravel, J. The vaginal microbiota, host defence and reproductive physiology. J Physiol. 595 (2), 451-463 (2017).
- Van De Wijgert, J., Jespers, V. The global health impact of vaginal dysbiosis. Res Microbiol. 168 (9-10), 859-864 (2017).
- Ralph, S. G., Rutherford, A. J., Wilson, J. D. Influence of bacterial vaginosis on conception and miscarriage in the first trimester: Cohort study. BMJ. 319 (7204), 220-223 (1999).
- Goldenberg, R. L., Hauth, J. C., Andrews, W. W. Intrauterine infection and preterm delivery. N Engl J Med. 342 (20), 1500-1507 (2000).
- Han, Y., Liu, Z., Chen, T. Role of vaginal microbiota dysbiosis in gynecological diseases and the potential interventions. Front Microbiol. 12, 643422 (2021).
- Leitich, H., Kiss, H. Asymptomatic bacterial vaginosis and intermediate flora as risk factors for adverse pregnancy outcome. Best Pract Res Clin Obstet Gynaecol. 21 (3), 375-390 (2007).
- Torcia, M. G. Interplay among vaginal microbiome, immune response and sexually transmitted viral infections. Int J Mol Sci. 20 (2), 266 (2019).
- Van Oostrum, N., De Sutter, P., Meys, J., Verstraelen, H. Risks associated with bacterial vaginosis in infertility patients: A systematic review and meta-analysis. Hum Reprod. 28 (7), 1809-1815 (2013).
- Lewis, F. M. T., Bernstein, K. T., Aral, S. O. Vaginal microbiome and its relationship to behavior, sexual health, and sexually transmitted diseases. Obstet Gynecol. 129 (4), 643-654 (2017).
- Hong, X., et al. The association between vaginal microbiota and female infertility: A systematic review and meta-analysis. Arch Gynecol Obstet. 302 (3), 569-578 (2020).
- Peelen, M. J., et al. The influence of the vaginal microbiota on preterm birth: A systematic review and recommendations for a minimum dataset for future research. Placenta. 79, 30-39 (2019).
- Smith, P. P., et al. Outcomes in prevention and management of miscarriage trials: A systematic review. BJOG. 126 (2), 176-189 (2019).
- Harp, D. F., Chowdhury, I. Trichomoniasis: Evaluation to execution. Eur J Obstet Gynecol Reprod Biol. 157 (1), 3-9 (2011).
- Pastorek, J. G., Cotch, M. F., Martin, D. H., Eschenbach, D. A. Clinical and microbiological correlates of vaginal trichomoniasis during pregnancy. The vaginal infections and prematurity study group. Clin Infect Dis. 23 (5), 1075-1080 (1996).
- Petrin, D., Delgaty, K., Bhatt, R., Garber, G. Clinical and microbiological aspects of trichomonas vaginalis. Clin Microbiol Rev. 11 (2), 300-317 (1998).
- Edwards, T., Burke, P., Smalley, H., Hobbs, G. Trichomonas vaginalis: Clinical relevance, pathogenicity and diagnosis. Crit Rev Microbiol. 42 (3), 406-417 (2016).
- Eade, C. R., et al. Identification and characterization of bacterial vaginosis-associated pathogens using a comprehensive cervical-vaginal epithelial coculture assay. PLoS One. 7 (11), e50106 (2012).
- Fichorova, R. N., Yamamoto, H. S., Delaney, M. L., Onderdonk, A. B., Doncel, G. F. Novel vaginal microflora colonization model providing new insight into microbicide mechanism of action. mBio. 2 (6), e00168 (2011).
- Herbst-Kralovetz, M. M., Pyles, R. B., Ratner, A. J., Sycuro, L. K., Mitchell, C. New systems for studying intercellular interactions in bacterial vaginosis. J Infect Dis. 214, S6-S13 (2016).
- Johnson, A. P., et al. A study of the susceptibility of three species of primate to vaginal colonization with gardnerella vaginalis. Br J Exp Pathol. 65 (3), 389-396 (1984).
- Yildirim, S., et al. Primate vaginal microbiomes exhibit species specificity without universal lactobacillus dominance. ISME J. 8 (12), 2431-2444 (2014).
- Edwards, V. L., et al. Three-dimensional models of the cervicovaginal epithelia to study host-microbiome interactions and sexually transmitted infections. Pathog Dis. 80 (1), 026 (2022).
- Zhu, Y., et al. Ex vivo 2D and 3D HSV-2 infection model using human normal vaginal epithelial cells. Oncotarget. 8 (9), 15267-15282 (2017).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infect Immun. 86 (11), e00282 (2018).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cell Mol Gastroenterol Hepatol. 5 (4), 659-668 (2018).
- Jalili-Firoozinezhad, S., et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nat Biomed Eng. 3 (7), 520-531 (2019).
- Valiei, A., Aminian-Dehkordi, J., Mofrad, M. R. K. Gut-on-a-chip models for dissecting the gut microbiology and physiology. APL Bioeng. 7 (1), 011502 (2023).
- Izadifar, Z., et al. Mucus production, host-microbiome interactions, hormone sensitivity, and innate immune responses modeled in human endo- and ecto-cervix chips. bioRxiv. , (2023).
- Mahajan, G., et al. Vaginal microbiome-host interactions modeled in a human vagina-on-a-chip. Microbiome. 10 (1), 201 (2022).
- Masson, L., et al. Inflammatory cytokine biomarkers to identify women with asymptomatic sexually transmitted infections and bacterial vaginosis who are at high risk of HIV infection. Sex Transm Infect. 92 (3), 186-193 (2016).
- Amsel, R., et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med. 74 (1), 14-22 (1983).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados