Method Article
نمذجة البيئات الدقيقة المهبلية الصحية وعسر التنشيط في مهبل بشري على رقاقة
In This Article
Summary
توضح هذه المقالة بروتوكولا لإنشاء جهاز زراعة مهبل على رقاقة (Vagina Chip) يمكن من دراسة تفاعلات المضيف البشري مع ميكروبيوم مهبلي حي في ظل ظروف microaerophilic. يمكن استخدام هذه الشريحة كأداة للتحقيق في الأمراض المهبلية وكذلك لتطوير واختبار التدابير المضادة العلاجية المحتملة.
Abstract
لم تحظ صحة المرأة ، وخاصة أمراض الجهاز التناسلي للأنثى (FRT) ، بالاهتمام الذي تستحقه ، على الرغم من أن الجهاز التناسلي غير الصحي قد يؤدي إلى أمراض تهدد الحياة أو العقم أو نتائج سلبية أثناء الحمل. أحد العوائق في هذا المجال هو أنه كان هناك ندرة في النماذج التجريبية قبل السريرية التي تحاكي بأمانة علم وظائف الأعضاء والفيزيولوجيا المرضية ل FRT. لا تلخص النماذج الحالية في المختبر بشكل كامل التغيرات الهرمونية والظروف الهوائية الدقيقة والتفاعلات مع الميكروبيوم المهبلي. إن ظهور تقنية زراعة الموائع الدقيقة Organ-on-a-Chip (Organ Chip) التي يمكن أن تحاكي واجهات الأنسجة والأنسجة ، والتروية الوعائية ، وتدفقات السوائل الخلالية ، والبيئة المكروية المادية لوحدة فرعية رئيسية من الأعضاء البشرية يمكن أن تكون بمثابة حل لهذه المشكلة. في الآونة الأخيرة ، تم تطوير رقاقة مهبلية بشرية تدعم الثقافة المشتركة للاتحادات الميكروبية المهبلية البشرية مع ظهارة مهبلية بشرية أولية مرتبطة أيضا بسدى مهبلي وتشهد تدفق سائل ديناميكي. تكرر هذه الشريحة الاستجابات الفسيولوجية للمهبل البشري للميكروبيوم الصحي وعسر الحيوي. تم وصف بروتوكول مفصل لإنشاء رقائق المهبل البشرية في هذه المقالة.
Introduction
يلعب الميكروبيوم المهبلي الذي يهيمن عليه Lactobacillus spp. الذي يساعد في الحفاظ على البيئة المكروية الحمضية دورا مهما في الحفاظ على الصحة الإنجابية للإناث1. ومع ذلك ، في بعض الأحيان يمكن أن يكون هناك تغيير في تكوين المجتمعات الميكروبية التي تشكل الميكروبيوم ، مما يؤدي إلى زيادة في تنوع البكتيريا المهبلية. ترتبط هذه التغيرات في خلل التخلق ، والتي غالبا ما تؤدي إلى التحول من حالة تهيمن عليها Lactobacillus إلى حالة تهيمن عليها أنواع بكتيرية لاهوائية أكثر تنوعا (على سبيل المثال ، Gardnerella vaginalis) ، بأمراض مختلفة في الجهاز التناسلي ، مثل التهاب المهبل الجرثومي ، التهاب المهبل الضموري ، عدوى المسالك البولية ، داء المبيضات الفرجي المهبلي ، التهاب الإحليل ، والتهاب المشيمية2،3،4،5. هذه الأمراض ، بدورها ، تزيد من فرص إصابة المرأة بالأمراض المنقولة جنسيا وأمراض التهاب الحوض6،7،8،9. كما أنها تشكل خطرا أكبر للولادة المبكرة والإجهاض لدى النساء الحوامل10،11،12 وقد تورطت أيضا في العقم13،14،15،16.
على الرغم من الجهود المبذولة لنمذجة dysbiosis المهبلي باستخدام الخلايا الظهارية المهبلية المزروعة في أنظمة الاستزراع الثابتة ثنائية الأبعاد (2D)17،18 ، إلا أنها لا تحاكي بشكل فعال فسيولوجيا وتعقيد البيئة المكروية المهبلية19. كما تم استخدام النماذج الحيوانية لدراسة dysbiosis المهبلي. ومع ذلك ، فإن مراحل الحيض وتفاعلات الميكروبيوم المضيف تختلف اختلافا كبيرا عن تلك الموجودة في البشر ، وبالتالي ، فإن الأهمية الفسيولوجية لنتائج هذه الدراسات لا تزال غير واضحة19،20،21. لمواجهة هذه المشكلات ، تم أيضا استخدام نماذج إدراج المواد العضوية و Transwell للأنسجة المهبلية البشرية لدراسة تفاعلات المضيف الممرض في FRT19،22،23،24. ولكن نظرا لأن هذه مزارع ثابتة ، فإنها لا يمكنها دعم الزراعة المشتركة للخلايا البشرية مع الميكروبات الحية إلا لفترة قصيرة من الزمن (<16-24 ساعة) ، وتفتقر إلى العديد من السمات الفيزيائية الأخرى المهمة المحتملة للبيئة المكروية المهبلية البشرية ، مثل إنتاج المخاط وتدفق السوائل22.
رقائق الجهاز هي أنظمة زراعة الموائع الدقيقة ثلاثية الأبعاد (3D) تحتوي على واحد أو أكثر من القنوات الدقيقة المجوفة المتوازية المبطنة بالخلايا الحية المزروعة تحت تدفق السوائل الديناميكي. تتيح الرقائق ثنائية القناة إعادة إنشاء واجهات الأنسجة على مستوى الأعضاء عن طريق زراعة أنواع مختلفة من الخلايا (على سبيل المثال ، الظهارة والخلايا الليفية اللحمية أو الظهارة والبطانة الوعائية) على جوانب متقابلة من الغشاء المسامي الذي يفصل بين القناتين المتوازيتين (الشكل 1). يمكن أن يتعرض كلا النسيجين بشكل مستقل لتدفق السوائل ، ويمكنهما أيضا تجربة الظروف الهوائية الدقيقة لتمكين الزراعة المشتركة مع ميكروبيوم معقد25،26،27،28. تم الاستفادة من هذا النهج مؤخرا لتطوير رقاقة مهبلية بشرية مبطنة بظهارة مهبلية أولية حساسة للهرمونات مرتبطة بالخلايا الليفية اللحمية الكامنة ، والتي تحافظ على تركيز أكسجين فسيولوجي منخفض في التجويف الظهاري وتمكن من الزراعة المشتركة مع الميكروبات الصحية وعسر الهضم لمدة 3 أيام على الأقل في المختبر29. وقد ثبت أنه يمكن استخدام رقاقة المهبل لدراسة الاستعمار من قبل اتحادات L. crispatus المثلى (الصحية) والكشف عن الالتهابات والإصابات الناجمة عن اتحادات تحتوي على G. vaginalis غير الأمثل (غير الصحي). هنا ، نصف بالتفصيل الطرق المستخدمة لإنشاء رقاقة المهبل البشرية وكذلك لإنشاء مجتمعات بكتيرية صحية وخلل حيوي على الرقاقة.
Protocol
تم إجراء هذا البحث وفقا للمبادئ التوجيهية المؤسسية لاستخدام الخلايا البشرية. تم الحصول على الخلايا تجاريا (انظر جدول المواد). يجب تنفيذ جميع الخطوات بشكل معقم في خزانة السلامة البيولوجية (BSC). استخدم فقط أطراف ماصة المرشح (أو الحاجز) لهذا البروتوكول.
1. زراعة الخلايا الظهارية المهبلية البشرية
- يسخن 50 مل من الوسط الظهاري المهبلي (VEM ، انظر جدول المواد) إلى 37 درجة مئوية.
- القسمة 9 مل من VEM إلى أنبوب 15 مل. ثم قم بإذابة قارورة من الخلايا الظهارية المهبلية البشرية (HVECs) ، وأضفها إلى الأنبوب الذي يحتوي على VEM.
- قم بطرد الأنبوب سعة 15 مل عند 300 × جم لمدة 5 دقائق في درجة حرارة الغرفة (RT) واستنشق المادة الطافية ، تاركا الحبيبات خلفك.
- أعد تعليق الحبيبات برفق في 2 مل من VEM وأضف 1 مل إلى كل من قارورتي T75 اللتين تحتويان على 14 مل من VEM.
- احتضان القوارير عند 37 درجة مئوية مع 5٪ CO2. قم بتغيير VEM كل 2 أيام حتى تكون HVECs متقاربة بنسبة 70٪ تقريبا (حوالي 5 أيام).
2. زراعة الخلايا الليفية الرحمية البشرية
- تحضير 10 مل من محلول Poly-L-lysine 15 ميكروغرام / مل (PLL) في ماء مقطر مزدوج (ddH2O). أضف 5 مل من محلول PLL إلى كل من قارورتي T75 واحتضانها عند 37 درجة مئوية لمدة 1 ساعة.
- 50 مل من وسط الخلايا الليفية الدافئ (FM ، انظر جدول المواد) إلى 37 درجة مئوية.
- نضح محلول PLL واغسل كل قارورة ب 5 مل من ddH2O.
- قسامة 9 مل من FM إلى أنبوب 15 مل وإذابة قارورة من الخلايا الليفية الرحمية البشرية (HUFs).
- أضف HUFs إلى أنبوب 15 مل الذي يحتوي على FM.
- قم بطرد مركزي أنبوب سعة 15 مل عند 300 × جم لمدة 5 دقائق في RT واستنشاق المادة الطافية ، تاركا حبيبات الخلية وراءها.
- أعد تعليق الحبيبات برفق في 2 مل من FM وأضف 1 مل إلى كل من قارورتي T75 اللتين تحتويان على 14 مل من FM.
- احتضان القوارير عند 37 درجة مئوية مع 5٪ CO2 حتى تتجمع الخلايا بنسبة 70٪ تقريبا أثناء تغيير الوسط كل يومين.
3. تفعيل رقاقة وطلاء القناة
- قم بإزالة الرقائق (التي تم الحصول عليها تجاريا ، انظر جدول المواد) لمدة 30 دقيقة في مجفف فراغ.
- اسمح لكاشف التنشيط 1 (AR-1) وكاشف التنشيط 2 (AR-2) (انظر جدول المواد) بالتوازن مع RT لمدة 15 دقيقة دون إزالة عبواتهما.
- لف أنبوبا مخروطيا سعة 15 مل بورق القصدير لحمايته من الضوء. أضف ببطء 1 مل من محلول AR-2 إلى جدران قارورة AR-1 واخلطها جيدا. انقل الخليط إلى أنبوب سعة 15 مل ملفوف بورق الألمنيوم.
- أضف محلول AR-2 بشكل متكرر إلى قارورة AR-1 بزيادات قدرها 1 مل حتى يتم غسل مسحوق AR-1 بالكامل من القارورة.
- قم بتعبئة محلول AR-1 المعاد تشكيله إلى 10 مل باستخدام محلول AR-2.
- أضف 200 ميكرولتر من هذا المحلول إلى مدخل القناة القمية لكل شريحة أثناء الشفط من المخرج (الشكل 1 أ). كرر للقناة القاعدية. حافظ على الماصة عموديا على الشريحة أثناء إضافة المحلول للحفاظ على ختم محكم مع تدفق دون عوائق.
- كرر الخطوة 3.6 لجميع الرقائق.
- تحقق من جميع الرقائق بحثا عن الفقاعات. قم بإزالة أي فقاعات عن طريق إضافة المزيد من المحلول إلى القناة (القنوات) المتأثرة.
- قم بشفط كل محلول AR-1 الزائد من سطح الرقاقة مع تجنب مداخل ومنافذ القناة.
- ضع رقائق البطاطس في طبق بتري 150 مم وأدخل هذا الطبق المكشوف في صندوق ضوء الأشعة فوق البنفسجية.
- واجه صندوق ضوء الأشعة فوق البنفسجية في الجزء الخلفي من BSC واترك الرقائق تحت ضوء الأشعة فوق البنفسجية الثابت لمدة 30 دقيقة. سيتغير لون المحلول في الرقائق من اللون الوردي الداكن إلى الماهوجني.
- اغسل كل قناة بإضافة 200 ميكرولتر من محلول AR-2 إلى المدخل مع شفط المخرج في نفس الوقت.
- اغسل كل قناة مرتين بإضافة 200 ميكرولتر من DPBS البارد (-/-) إلى المدخل مع شفط المخرج في نفس الوقت.
- تحضير طلاء القناة القمية (200 ميكروغرام / مل من خليط الكولاجين I و 30 ميكروغرام / مل من الكولاجين الوريدي في DMEM) (انظر جدول المواد). ابق على الجليد.
- تحضير طلاء القناة القاعدية (15 ميكروغرام / مل PLL و 200 ميكروغرام / مل خليط الكولاجين I في DMEM). ابق على الجليد.
- أضف 200 ميكرولتر من طلاء القناة القاعدية إلى مدخل القناة القاعدية. قم بتوصيل المخرج بطرف P200 عندما يظهر محلول الطلاء عند المخرج. قم بتوزيع المحلول حتى تتساوى أحجام طرف المدخل والمخرج ، ثم حرر طرف الماصة من الماصة ، تاركا الطرف في المدخل.
- وبالمثل ، أضف 200 ميكرولتر من طلاء القناة القمية إلى القناة القمية.
- نضح المحلول الزائد من سطح الرقاقة.
- تحقق من جميع الرقائق بحثا عن الفقاعات. قم بإزالة أي فقاعات عن طريق إضافة المزيد من طلاء القناة إلى القناة (القنوات) المتأثرة.
- احتضان الرقائق طوال الليل في طبق بتري 150 مم عند 37 درجة مئوية مع 5٪ CO2.
4. قناة البذر القاعدية رقاقة مع HUFs
- عرض نمو HUFs في القارورة تحت المجهر يوميا.
- بمجرد أن تكون مزارع HUF متقاربة بنسبة 70٪ -90٪ (~ 3 أيام بعد الطلاء) ، دافئة 25 مل من FM ، 5 مل من Ca2 + / Mg2+ DPBS مجانا (DPBS (-/-) ، 10 مل من التربسين / EDTA ، و 15 مل من محلول تحييد التربسين (TNS ، انظر جدول المواد) إلى 37 درجة مئوية.
- نضح الوسط من القوارير. يغسل مع 5 مل من DPBS (-/-) ، ثم نضح مرة أخرى.
- أضف 4 مل من التربسين-EDTA إلى كل دورق واحتضانه على حرارة 37 درجة مئوية لمدة 3-5 دقائق حتى تنفصل الخلايا.
- أضف 6 مل من TNS إلى كل دورق وانقل تعليق الخلية إلى أنبوب مخروطي سعة 15 مل.
- امزج التعليق جيدا مع ماصة وخذ حصة 10 ميكرولتر لعد الخلايا. امزج 10 ميكرولتر من تعليق الخلية مع 10 ميكرولتر من التريبان الأزرق وعد باستخدام مقياس الدم.
- تعليق خلية الطرد المركزي عند 300 × جم لمدة 5 دقائق في RT. نضح المادة الطافية وإعادة تعليق الحبيبات في FM الدافئ إلى تركيز نهائي يبلغ 7.5 × 105 خلايا / مل.
- اغسل القناة القاعدية ب 200 ميكرولتر من FM.
- يسخن 15 مل من VEM إلى 37 درجة مئوية. اغسل القناة القمية ب 200 ميكرولتر من VEM.
- أضف 200 ميكرولتر من VEM الكامل إلى مدخل القناة القمي أثناء توصيل المخرج بطرف ماصة. قم بتوزيع الوسط حتى تتساوى أحجام طرف المدخل والمخرج ، ثم حرر طرف الماصة من الماصة ، تاركا الطرف في المدخل. حافظ على القناة العلوية ممتلئة وموصولة عند كل من المدخل والمخرج.
- ماصة ببطء 50 ميكرولتر من تعليق خلية HUF في مدخل القناة القاعدية مع شفط المخرج في نفس الوقت. قم بإزالة طرف الماصة من المدخل عندما يظل ~ 2 ميكرولتر من تعليق الخلية في طرف الماصة دون الضغط على مكبس الماصة أو تحريره لتجنب تكوين الفقاعة. قم بتوصيل المدخل والمخرج بأطراف ماصة.
- تحقق من وجود فقاعات تحت المجهر. إذا كانت موجودة ، اغسل القناة القاعدية باستخدام FM وكرر الخطوة 4.11.
- اقلب الرقائق الموصولة رأسا على عقب على رف أنبوبي سعة 15 مل واحتضانها عند 37 درجة مئوية مع 5٪ CO2 لمدة 1 ساعة. راقب الرقائق بعد الحضانة وتحقق من ارتباط الخلية.
- قم بتوصيل مخرج القناة القاعدية بطرف ماصة. أضف 200 ميكرولتر من FM إلى مدخل القناة القاعدية دون الضغط لأسفل على مكبس الماصة. حرر الطرف من الماصة واترك الوسط يتدفق بحرية عبر القناة إلى طرف ماصة المخرج عن طريق تدفق الجاذبية.
- احتضان رقائق البذور HUF بين عشية وضحاها عند 37 درجة مئوية مع 5٪ CO2.
5. قناة قمي رقاقة البذر مع الخلايا الظهارية المهبلية
- يسخن 50 مل من VEM إلى 37 درجة مئوية.
- تحضير طلاء القناة القمية (200 ميكروغرام / مل من الكولاجين I في DMEM). ابق على الجليد.
- قم بتوصيل منفذ القناة القمي بطرف ماصة.
- أضف 200 ميكرولتر من طلاء القناة القمية إلى مدخل القناة القمية. قم بتوزيع محلول الطلاء القمي حتى تتساوى أحجام طرف المدخل والمخرج ، ثم حرر طرف الماصة من الماصة ، تاركا الطرف في المدخل.
- نضح الحل الزائد من سطح الشريحة.
- احتضان الرقائق عند 37 درجة مئوية مع 5٪ CO2 لمدة 1 ساعة.
- بعد 1 ساعة ، اغسل طلاء القناة القمية بإضافة 200 ميكرولتر من VEM إلى مدخل القناة القمية أثناء الشفط من المخرج.
- تحقق من نمو HVEC تحت المجهر لالتقاء ~ 70٪ -90٪.
- إذا كانت الخلايا متقاربة بنسبة 70٪ -90٪ ، قم بتسخين 6 مل من وسط الخلايا الظهارية المهبلية الكاملة و 4 مل من التربسين / EDTA لكل دورق ، إلى 37 درجة مئوية.
- نضح المتوسطة من قارورة HVEC واغسلها ب 5 مل من DPBS (-/-) ، ثم نضح.
- أضف 4 مل من التربسين إلى كل دورق واحتضانه عند 37 درجة مئوية مع 5٪ CO2 لمدة 3-5 دقائق حتى تنفصل الخلايا.
- أضف 6 مل من VEM إلى القارورة لتعطيل التربسين ونقل تعليق الخلية إلى أنبوب مخروطي سعة 15 مل.
- امزج التعليق جيدا مع ماصة وخذ حصة 10 ميكرولتر لعد الخلايا. امزج 10 ميكرولتر من تعليق الخلية مع 10 ميكرولتر من التريبان الأزرق وعد باستخدام مقياس الدم.
- تعليق خلية الطرد المركزي عند 300 × جم لمدة 5 دقائق في RT. نضح المادة الطافية وإعادة تعليق الحبيبات في VEM إلى تركيز نهائي يتراوح بين 3.5 و 4 ملايين خلية / مل.
- دافئ 25 مل من FM إلى 37 درجة مئوية.
- قم بتوصيل منفذ القناة القمي بطرف ماصة. ماصة ببطء ما لا يقل عن 40 ميكرولتر من تعليق خلية HVEC في مدخل القناة القمية. قم بتوزيع تعليق الخلية حتى تتساوى أحجام طرف المدخل والمخرج ، ثم حرر طرف الماصة من الماصة ، تاركا الطرف في المدخل. حافظ على القناة القاعدية مملوءة ب FM ومتصلة بكل من المدخل والمخرج.
- استنشاق الوسط الزائد بعناية على سطح الرقائق وتحقق من وجود فقاعات تحت المجهر. إذا كانت موجودة ، كرر الخطوة 5.16.
- توضع الرقائق في طبق بتري كبير وتحتضن على حرارة 37 درجة مئوية مع 5٪ CO2 طوال الليل.
- في اليوم التالي ، راقب الرقائق تحت المجهر لربط الخلية.
- قم بإزالة أطراف الماصة من مداخل ومنافذ كل من القنوات القمية والقاعدية.
- قم بتوصيل مخرج القناة القاعدية بطرف ماصة وأضف 200 ميكرولتر من FM إلى مدخل القناة القاعدية دون الضغط لأسفل على مكبس الماصة. حرر طرف الماصة من الماصة واترك الوسط يتدفق بحرية عبر القناة إلى طرف ماصة المخرج عن طريق تدفق الجاذبية.
- كرر الخطوة 5.21 للقناة القمية باستخدام VEM.
- احتضان رقائق البذور المزدوجة عند 37 درجة مئوية مع 5٪ CO2 لمدة 24 ساعة.
6. توصيل الرقائق بالقرون وتمييز الخلايا الظهارية المهبلية
- القسمة 50 مل من FM و VEM لفصل أنابيب مخروطية 50 مل ودافئة إلى 37 درجة مئوية.
- Degas تم تسخين وسائط FM و VEM إلى 37 درجة مئوية تحت فراغ معقم لمدة 5 دقائق.
- تطهير وتنظيف الصواني لوحدة التدفق الديناميكي (سوق دبي المالي، انظر جدول المواد). أخرج القرون من العبوة وضعها في الصواني.
- أضف 2 مل من VEM المفرغة إلى خزان المدخل القمي (أعلى الخزان الأيمن ؛ الشكل 1 ب). أضف وسيطا على طول جدران الخزان لتجنب تكوين الفقاعة.
- أضف 3 مل من FM المفرغة إلى خزان المدخل القاعدي (أعلى الخزان الأيسر ، الشكل 1 ب). أضف وسيطا على طول جدران الخزان لتجنب تكوين الفقاعة.
- أضف 500 ميكرولتر من VEM المفرغة إلى خزان المخرج القمي (الخزان الأيمن السفلي ، الشكل 1 ب). قم بإمالة الكبسولة بحيث يغطي الوسيط السطح السفلي للخزان بالكامل.
- أضف 500 ميكرولتر من FM المفرغة إلى خزان المخرج القاعدي (الخزان السفلي الأيسر ، الشكل 1 ب). قم بإمالة الكبسولة بحيث يغطي الوسيط السطح السفلي للخزان بالكامل.
- قم بتمرير الأدراج التي تحتوي على كبسولات في سوق دبي المالي وقم بتشغيل دورة Prime مرتين. تحقق من وجود قطرات تخرج من المنافذ على الجانب السفلي من كل جراب.
- إذا لم تتشكل قطرة بعد 4 دورات "Prime" ، فقم بإجراء اتصال مباشر مع المنفذ داخل خزان مخرج الكبسولة (الشكل 1B) وماصة 200 ميكرولتر من الوسط المعني للسماح للوسط بالتدفق بين الخزان والقناة. وهذا ما يسمى "فتيلة اليد".
- قم بإزالة أطراف الماصة من الرقائق وضع قطرة من الوسيط المعني على جميع المنافذ لكل شريحة.
- حرك الرقائق في الكبسولات وضع القرون على الصواني.
- قم بشفط أي وسائط على سطح الرقائق وحرك كل درج في سوق دبي المالي.
- قم بتعيين المعلمات التالية على سوق دبي المالي على النحو التالي: أعلى وأسفل - سائل. التدفق القمي (القناة العلوية) - 15 ميكرولتر / ساعة ؛ التدفق القاعدي (القناة السفلية) - 30 ميكرولتر / ساعة ؛ تمتد = 0٪ ؛ التردد = 0 هرتز.
- قم بتشغيل دورة التنظيم على سوق دبي المالي واسمح بالتدفق بين عشية وضحاها.
- بعد 24 ساعة ، قم بتغيير إعدادات التدفق إلى 0 μL / h للقناة القمية واحتفظ بالقناة القاعدية بمعدل تدفق 30 μL / h لمدة 24 ساعة أخرى.
- قم بإعداد 500 مل من وسط التمايز (DM) بإضافة 4 مللي مول L-glutamine ، 20 mM هيدروكورتيزون ، 1x ITES ، 20 نانومتر ثلاثي يودوثيرونين ، 100 ميكرومتر O-فوسفوريل إيثانولامين ، 180 ميكرومتر أدينين ، 3.2 مللي مول كلوريد الكالسيوم ، 2٪ FBS معطل حراريا ، 1٪ بكتيريا قلم ، و 120 مل من وسائط Ham's F-12 إلى DMEM منخفض الجلوكوز (انظر جدول المواد) ، وتعقيم المرشح.
- يسخن 50 مل من DM إلى 37 درجة مئوية.
- أضف 20 ميكرولتر من 10 ميكرومتر استراديول (انظر جدول المواد) إلى 50 مل من DM ، واخلطها جيدا ، وتخلص من الغازات تحت فراغ معقم لمدة 5 دقائق.
- يسخن 50 مل من VEM إلى 37 درجة مئوية في حمام مائي ويتخلص من الغازات تحت فراغ معقم لمدة 5 دقائق.
- قم بإزالة الصواني من سوق دبي المالي ، وضعها في BSC ، وشفط الوسائط من الكبسولات ، وتجنب المنافذ الموجودة في الخزانات (الشكل 1 أ). ثم أضف 2 مل من VEM إلى خزان مدخل القناة القمية و 3 مل من DM إلى خزان مدخل القناة القاعدية.
- أعد الصواني إلى DFM واضبط تدفق القناة القمية على 15 ميكرولتر / ساعة وتدفق القناة القاعدية على 30 ميكرولتر / ساعة.
- اسمح ل DFM بالتدفق لمدة 4-7 ساعات. ثم أوقف تدفق القناة القمية عن طريق ضبطه على 0 ميكرولتر / ساعة. دع تدفق القناة القاعدية يستمر عند 30 ميكرولتر / ساعة.
- قم بتغيير الوسائط باتباع الخطوات 6.16-6.19 كل 48 ساعة.
- تدفق الوسائط بشكل متقطع في القناة القمية لمدة 4-7 ساعات كل يوم لمدة 5 أيام إضافية باتباع الخطوات 6.20-6.21.
- تحضير محلول الملح المتوازن من هانكس مع سعة تخزين منخفضة مع وسائط الجلوكوز (HBSS (LB / + G)) عن طريق إضافة 1.26 mM كلوريد الكالسيوم ، 0.49 mM كلوريد المغنيسيوم سداسي هيدرات ، 0.406 mM كبريتات المغنيسيوم ، 5.33 mM كلوريد البوتاسيوم ، 137.93 mM كلوريد الصوديوم ، 0.441 mM فوسفات البوتاسيوم أحادي القاعدة ، و 5.55 mM D- الجلوكوز إلى dd H2O (انظر جدول المواد) ؛ درجة الحموضة 4.8.
- قم بإعداد 500 مل من DM الخالي من القلم عن طريق إضافة 4 ملليمتر L-glutamine ، 20 mM هيدروكورتيزون ، 1x ITES ، 20 نانومتر ثلاثي يودوثيرونين ، 100 ميكرومتر O-فوسفوريل إيثانولامين ، 180 ميكرومتر أدينين ، 3.2 مللي مول كلوريد الكالسيوم ، 2٪ FBS معطل حراريا ، و 120 مل من وسائط Ham's F-12 إلى DMEM منخفض الجلوكوز ، وتعقيم المرشح.
- في اليوم 6 ، استبدل وسط القناة القمي ب (HBSS (LB / + G)) ووسط القناة القاعدية ب DM الخالي من القلم باتباع الخطوات 6.16-6.19.
- اضبط التدفق على DFM على 15 ميكرولتر / ساعة للقناة القمية و 30 ميكرولتر / ساعة للقناة القاعدية لمدة 24 ساعة قبل الشروع في التلقيح البكتيري.
7. التلقيح البكتيري للرقائق المتمايزة
ملاحظة: قم بتنفيذ الخطوات التالية في المختبر و BSC التي تتوافق مع اللوائح الخاصة بالتعامل مع الميكروبات.
- احسب CFU / mL لكل سلالة بكتيرية ليتم تضمينها في اللقاح. امزج الكمية المطلوبة من كل سلالة بكتيرية ليصل مجموعها إلى ~ 5 × 106 CFU / mL.
- قم بطرد المزيج عند 7000 × جم لمدة 7 دقائق عند 4 درجات مئوية وقم بإزالة المادة الطافية بعناية. أعد تعليق الحبيبات في (HBSS (LB / + G)). سيكون هذا اللقاح البكتيري.
- افصل الرقائق عن القرون. قم بتوصيل مخرج القناة القاعدية بطرف ماصة وأضف 200 ميكرولتر من DM الخالي من Pen-Strep إلى مدخل القناة القاعدية دون الضغط لأسفل على مكبس الماصة. حرر طرف الماصة من الماصة واترك الوسط يتدفق بحرية عبر القناة إلى المخرج عن طريق تدفق الجاذبية.
- أضف 37 ميكرولتر من اللقاح البكتيري إلى مدخل القناة القمية ، أثناء الشفط من المخرج. عندما يتبقى حوالي 2 ميكرولتر في طرف الماصة ، اسحب الطرف للخارج وقم بتوصيل مدخل ومخرج القناة القمية بأطراف الماصة.
- بالنسبة لرقائق التحكم (غير الملقحة) ، كرر الخطوة 7.4 مع 37 ميكرولتر من (HBSS (LB / + G)).
- نضح أي وسائط على سطح الشريحة. ضع الرقائق في طبق بتري 150 مم واحتضانها على حرارة 37 درجة مئوية مع 5٪ CO2 لمدة 24 ساعة.
- ضع القرون (بدون رقائق) على الصواني وضعها في الحاضنة عند 37 درجة مئوية مع 5٪ CO2 لمدة 24 ساعة.
- دافئ 50 مل من (HBSS (LB / + G)) و 50 مل من DM الخالي من القلم إلى 37 درجة مئوية.
- أضف 20 ميكرولتر من 10 ميكرومتر استراديول إلى 50 مل من DM الخالي من Pen-Strep ، واخلطه جيدا ، وتخلص منه الغازات تحت فراغ معقم لمدة 5 دقائق. قم بإزالة غاز (HBSS (LB / + G)) تحت فراغ لمدة 5 دقائق.
- قم بشفط الوسائط الموجودة في الكبسولات بعناية مع تجنب منافذ مدخل ومخرج الخزان.
- أضف 3 مل من الغاز (HBSS (LB / + G)) إلى خزان جراب المدخل القمي و 500 ميكرولتر من التفريغ (HBSS (LB / + G)) إلى خزان جراب المخرج القمي.
- أضف 3 مل من DM الخالي من القلم المخفوق إلى خزان جراب المدخل القاعدي و 500 ميكرولتر من DM الخالي من المضادات الحيوية إلى خزان جراب المخرج القاعدي.
- قم بتمرير الصواني مع الكبسولات (بدون الرقائق) في سوق دبي المالي وقم بتشغيل دورة Prime مرتين. تحقق من وجود قطرات تخرج من كل منفذ على الجانب السفلي من الكبسولة.
ملاحظة: إذا لم تتشكل قطرة بعد 4 دورات "Prime" ، فقم بإجراء اتصال مباشر مع المنفذ داخل خزان مخرج الكبسولة (الشكل 1B) وماصة 200 ميكرولتر من الوسط المعني للسماح للوسط بالتدفق بين الخزان والقناة. - قم بإزالة أطراف الماصة من الرقائق وضع قطرة من الوسائط المعنية على جميع مداخل ومنافذ القناة.
- حرك الرقائق في القرون وضع القرون في الصواني.
- نضح الوسائط في خزانات جراب المخرج القمي والقاعدي وأي وسائط على سطح الرقائق. ثم حرك الأدراج في سوق دبي المالي.
- قم بتعيين المعلمات التالية على سوق دبي المالي: أعلى وأسفل - سائل ؛ التدفق القمي (العلوي) - 40 ميكرولتر / ساعة ؛ التدفق القاعدي (السفلي) - 40 ميكرولتر / ساعة ؛ تمتد - 0 ٪. التردد - 0 هرتز. قم بتشغيل دورة التنظيم .
- أوقف التدفق بعد 4 ساعات واجمع النفايات السائلة ، أي الوسائط في خزانات المخرج القمي والقاعدي.
- قياس وتسجيل أحجام النفايات السائلة.
- ضع الرقائق مرة أخرى في DFM واضبط معدل التدفق القمي على 0 ميكرولتر / ساعة والتدفق القاعدي على 30 ميكرولتر / ساعة. بدء التدفق لتشغيل بين عشية وضحاها.
- قسمة النفايات السائلة المجمعة لمختلف المقايسات المخطط لها وتخزينها في درجات حرارة مناسبة.
ملاحظة: لقياس CFU ، أضف الجلسرين إلى تركيز نهائي بنسبة 16٪ وقم بتخزينه على الفور عند -80 درجة مئوية. - استنشاق الوسط في خزانات المخرج القاعدي فقط وتعيين معدلات التدفق القمي والقاعدي إلى 40 ميكرولتر / ساعة في سوق دبي المالي. ابدأ التدفق لمدة 4 ساعات وكرر الخطوات 7.18-7.21. ستكون هذه هي مجموعة النفايات السائلة لمدة 48 ساعة.
- كرر الخطوة 7.22 لمدة 72 ساعة أو حتى تنتهي التجربة.
- في نهاية التجربة ، اجمع النفايات السائلة باتباع الخطوات 7.18-7.19.
- تحضير محلول الهضم عن طريق إضافة 1 ملغ / مل كولاجيناز IV في TrypLE اكسبرس. يسخن 10 مل من محلول الهضم إلى 37 درجة مئوية.
- قم بتوصيل منفذ مخرج القناة القاعدية بطرف ماصة. أضف 100 ميكرولتر من محلول الهضم إلى القناة القاعدية. امزج جيدا ، وباستخدام ماصة ، اجمع كل المحلول من القناة في أنبوب يسمى "الأنبوب B".
- قم بتوصيل منفذ مخرج القناة القمية بطرف ماصة. أضف 100 ميكرولتر من محلول الهضم إلى القناة القمية. امزج جيدا ، وباستخدام ماصة ، اجمع كل المحلول من القناة في أنبوب يسمى "الأنبوب أ".
- أضف 100 ميكرولتر أخرى من محلول الهضم إلى كل من مداخل القناة القمية والقاعدية أثناء توصيل المنافذ بأطراف الماصة. احتضان الرقائق والأنابيب A و B عند 37 درجة مئوية لمدة 1-1.5 ساعة.
- امزج محتويات الهضم جيدا داخل القنوات باستخدام الأطراف الموصلة الموضوعة بالفعل في المداخل والمنافذ. اجمع محتويات القنوات القمية والقاعدية للأنبوبين A و B ، على التوالي. هذه هي الهضم القمي والقاعدي رقاقة.
- عد الخلايا في الأنبوب A باستخدام مقياس الدم. أيضا ، قم بإزالة القسمة من ملخصات الشريحة لقياس CFU باتباع الخطوة 7.21.
8. تحليل النفايات السائلة للرقائق وهضمها
- لتعداد البكتيريا من النفايات السائلة والهضم ، قم بتخفيف النفايات السائلة أو الهضم في DPBS معقمة (-/-) ولوحة على لوحة وسائط مناسبة ، واحتضانها عند 37 درجة مئوية لمدة 24-48 ساعة ، وعد المستعمرات على اللوحة.
- لقياس الأس الهيدروجيني ، خذ 10 ميكرولتر من النفايات السائلة 72 ساعة مباشرة بعد التجميع واستخدم شريط الأس الهيدروجيني لقياس الرقم الهيدروجيني للنفايات السائلة.
- لتحليل السيتوكينات ، استخدم النفايات السائلة للكشف عن سيتوكينات معينة باستخدام الفحص القائم على Luminex أو ELISA أو أي تقنية أخرى قابلة للتطبيق29,30.
النتائج
المهبل البشري مبطن بظهارة طبقية تغطي سدى كولاجينوس غني بالخلايا الليفية. لنمذجة ذلك ، تم إنشاء واجهة نسيجية عن طريق زراعة ظهارة مهبلية بشرية أولية وخلايا ليفية على جوانب متقابلة من غشاء مسامي شائع داخل جهاز رقاقة جهاز الموائع الدقيقة ثنائي القناة. تتم مراقبة تكوين ظهارة المهبل باستخدام التصوير المجهري للمجال الساطع ، والذي يكشف عن تكوين ورقة مستمرة من الخلايا التي تشكل تدريجيا طبقات خلايا متعددة (الشكل 2 أ). أكدت التقارير السابقة أن هذا التشكل يرتبط بتطور ظهارة طبقية كاملة عند عرضها في المقطعالعرضي 29. ومع ذلك ، إذا بدت الطبقة الظهارية غير مكتملة ومتقطعة (الشكل 2 ب) ، فقد لا تكون رقاقة المهبل مناسبة للاستخدام في التجارب.
يوضح الشكل 3 تمثيلا تخطيطيا لتوليد شريحة المهبل. للتحقق من صحة وظائف رقاقة المهبل ، تم تلقيح الرقائق ب L. crispatus و G. vaginalis لنمذجة البيئات المهبلية الصحية وعسر الهضم ، على التوالي. G. vaginalis هي البكتيريا التي تشارك في المقام الأول في التهاب المهبل الجرثومي. للتحقق مما إذا كانت البكتيريا السليمة وعسر الهضم الحيوي تنقش على رقائق المهبل ، تم تحديد الحمل البكتيري في رقائق المهبل الملقحة بمجموعات بكتيرية مختلفة عن طريق طلاء النفايات السائلة للقناة وطبقات الخلايا المهضومة على وسائط نمو بكتيرية انتقائية (De Man-Rogosa-Sharpe (MRS) agar ل L. crispatus وأجار الدم البروسيلا (BBA) ل G. vaginalis) (انظر جدول المواد) ومقارنتها بالثقافات المماثلة باستخدام اللقاح الأصلي. تم الكشف عن مستعمرات L. crispatus و G. vaginalis في غضون 48 ساعة من الطلاء (الشكل 2C) ، مما يؤكد أن كلا من البكتيريا السليمة و dysbiotic محشورة في رقائق المهبل. ومع ذلك ، إذا لوحظت مستعمرات بكتيرية على الألواح التي تحتوي على اللقاحات ولكن لم يتم ملاحظتها على الألواح التي تحتوي على النفايات السائلة أو الهضم بعد الحضانة المطلوبة ، فيمكن استنتاج أن البكتيريا لم تطعم.
البيئة المهبلية الصحية حمضية ، ويؤدي dysbiosis إلى زيادة في درجة الحموضة المهبلية31. لذلك تم أيضا تحليل الرقم الهيدروجيني للنفايات السائلة للقناة الظهارية القمية لرقاقة المهبل. كان الرقم الهيدروجيني لرقائق المهبل الملقحة ب L. crispatus مشابها لرقائق التحكم غير الملقحة ، وعندما تمت زراعتها مع G. vaginalis ، فقد شهدت زيادة كبيرة في درجة الحموضة (الشكل 2D). إذا لوحظ أن الرقم الهيدروجيني لشريحة المهبل غير المصابة مرتفع ، فهذا يشير إلى وجود مشكلة ، ويجب عدم استخدام هذه الرقائق في التجارب.
الحالة الالتهابية للأنسجة المهبلية حساسة أيضا لتكوين الميكروبيوم المهبلي ، مع ميكروبيوم dysbiotic تحفيز الالتهاب. عند تحليل السيتوكينات المؤيدة للالتهابات في القناة القمية لرقاقة المهبل بعد 3 أيام من التلقيح إما ب L. crispatus أو G. vaginalis ، وجد أن الاستجابة المؤيدة للالتهابات تكون أعلى بالمثل مع G. vaginalis مقارنة بالرقائق غير المصابة والرقائق الملقحة ب L. crispatus (الشكل 2E). مجتمعة ، تظهر هذه النتائج أن رقاقة المهبل تحاكي عن كثب البيئة المكروية المهبلية البشرية في كل من الحالات الصحية و dysbiotic.
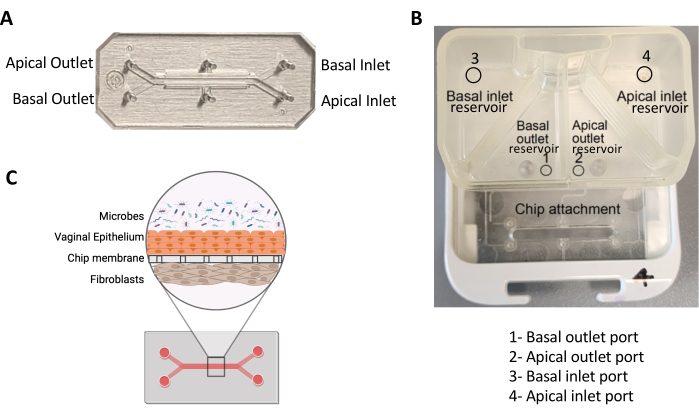
الشكل 1: شريحة ذات قناتين وجرابها. (أ) صورة لشريحة PDMS ثنائية القناة تصور قنواتها ومنافذها. (ب) صورة لجراب يصور الخزانات والموانئ للقنوات القمية والقاعدية. ج: شكل تخطيطي يوضح منظر المقطع العرضي لشريحة مهبلية مصابة بالميكروبات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحاكي رقاقة المهبل البيئات الدقيقة المهبلية البشرية السليمة والمصابة بخلل الحيوي. أ: الخلايا الطلائية المهبلية في القناة القمية لشريحة مهبلية قوية. يمثل شريط المقياس 1 مم من الشريحة في الصورة العلوية و 500 ميكرومتر في الصورة السفلية. ب: الخلايا الطلائية المهبلية في القناة القمية لرقاقة المهبل غير الكافية. يمثل شريط المقياس 1 مم من الشريحة في الصورة العلوية و 500 ميكرومتر في الصورة السفلية. (ج) تطعيم L. crispatus (LC) و G. vaginalis (GV) في رقاقة المهبل. (د) الرقم الهيدروجيني لرقائق المهبل بعد حضانة 72 ساعة مع L. crispatus (LC) و G. vaginalis (GV) مقارنة برقائق المهبل غير المصابة (السيطرة). (ه) الاستجابة المؤيدة للالتهابات لرقائق المهبل ل L. crispatus (LC) و G. vaginalis (GV) بعد حضانة 72 ساعة ، مقارنة برقائق المهبل غير المصابة (الضابطة). (جيم - ه) الرسوم البيانية تصور يعني ± SD ل 4-6 رقائق. * p < 0.05 ، ** p < 0.01 ، ***p < 0.001 مقارنة بالتحكم في رقائق المهبل ؛ يمثل كل (●) بيانات من شريحة 1. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
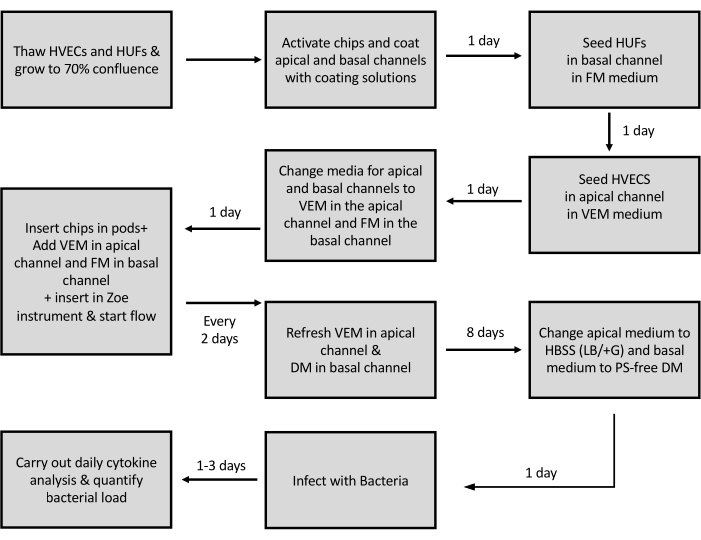
الشكل 3: تمثيل تخطيطي لبروتوكول توليد رقاقة المهبل. تمثيل تخطيطي للخطوات التي ينطوي عليها زرع الخلايا وتوليد رقاقة المهبل. HVECs - الخلايا الظهارية المهبلية البشرية. HUFs - الخلايا الليفية الرحمية البشرية. VEM - الوسط الظهاري المهبلي. FM - وسائل الإعلام الليفية. DM - وسيط التمايز ؛ PS - البنسلين الستربتومايسين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
النماذج السابقة في المختبر للمهبل البشري لا تكرر بأمانة هياكل الأنسجة المهبلية وتدفق السوائل والتفاعلات بين المضيفوالممرض 19,22. النماذج الحيوانية محدودة أيضا بسبب التباين بين الأنواع في الميكروبيوم والاختلافات في الدورة الشهريةأو الدورة الشهرية 19,22. تصف هذه المخطوطة بروتوكولا لإنشاء نموذج رقاقة الجهاز للمهبل البشري الذي يمكن أن يحاكي بشكل فعال الاستجابات البشرية للمجتمعات الميكروبية الصحية وخلل الهضم.
يتضمن هذا البروتوكول بذر الخلايا الظهارية والخلايا الليفية المهبلية على جوانب متقابلة من غشاء مسامي مشترك يفصل القنوات الدقيقة المتوازية في جهاز رقاقة الجهاز ثنائي القناة المتاح تجاريا (انظر جدول المواد). يسمح الغشاء المسامي بترحيل عوامل النمو وغيرها من أشكال الاتصال بين الخلايا. ومع ذلك ، فإن طلاء الكولاجين ووجود أحاديات الخلايا يمنع خلط الوسائط بين القنوات. عند تكوين طبقة أحادية الخلية الظهارية المهبلية في القناة القمية ، يتم إدخال عوامل التمايز في الوسط المتدفق في القناة القاعدية ، والتي تمر عبر الفراغ الخلالي وبالتالي تعزز تمايز الخلايا الظهارية المهبلية لتشكيل ظهارة طبقية. كثافة الخلايا الظهارية المهبلية في وقت البذر هي محدد حاسم لصحة رقاقة المهبل في نهاية مرحلة التمايز. وبالتالي ، يجب تقييم كثافة الخلايا الظهارية المهبلية قبل بدء التمايز ، والذي لا ينبغي أن يبدأ حتى يتم إنشاء طبقة أحادية. يمكن أن يستمر التعرض لعوامل التمايز حتى يتم الحصول على الكثافة المطلوبة للخلايا الظهارية المهبلية وقبل التلقيح البكتيري. علاوة على ذلك ، تجدر الإشارة إلى أن معدل النمو قد يختلف بالنسبة للخلايا الظهارية المهبلية الأولية من متبرعين مختلفين (أو مصادر تجارية) ، مما قد يؤثر على جودة رقاقة المهبل المتولدة. في جميع دراسات رقائق الأعضاء الدقيقة ، من الأهمية بمكان إزالة أي فقاعات قد تتشكل في القنوات في جميع أنحاء ثقافة الرقائق لأنها تتداخل مع التدفق المتوسط وستؤدي في النهاية إلى انخفاض توافر المغذيات وفقدان صلاحية الخلية.
يصف هذا البروتوكول أيضا كيفية استخدام شريحة المهبل لإنشاء مجتمعات بكتيرية على الرقاقة تحاكي إما الحالة المهبلية الصحية أو التهاب المهبل الجرثومي. يمكن أيضا استخدام رقاقة المهبل لدراسة الأمراض أو الاضطرابات المهبلية الأخرى. ومع ذلك ، ينبغي توخي الحذر لفهم خصائص كل مرض وأفضل وسيلة لربط النتائج بالنتائج السريرية عند إجراء هذه الدراسات. باختصار ، تفتح رقاقة المهبل البشرية طرقا جديدة لدراسة عدد كبير من الأمراض والحالات المتعلقة ب FRT ، ويمكن أن تكون أداة قيمة للتحقيق في العلاجات المحتملة.
Disclosures
دونالد إنجبر هو مؤسس وعضو مجلس إدارة ورئيس مجلس استشاري علمي وحامل أسهم في Emulate. يعلن المؤلفون الآخرون أنه ليس لديهم مصالح متنافسة.
Acknowledgements
تم رعاية هذا البحث بتمويل من مؤسسة بيل وميليندا غيتس (INV-035977) ومعهد ويس للهندسة المستوحاة بيولوجيا في جامعة هارفارد. كما نشكر غوين إي ميري ، معهد ويس ، على تحرير هذه المخطوطة. تم إنشاء الرسم البياني في الشكل 1 باستخدام BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm Steriflip | Millipore | SCGP00525 | To degas media |
| 2 channel chip | Emulate | BRK-S1-WER-24 | Part of the two-channel Chip kit |
| 200 μL barrier tips (or filter tips) | Thomas Scientific, SHARP | 1159M40 | Tips used for chip seeding |
| Activation Reagent 1 (or ER-1 powder) | Emulate | Chip S1 Basic Research kit-24PK | Part of the two-channel Chip kit; Storage temperature -20 °C |
| Activation Reagent 2 (or ER-2 solution) | Emulate | Chip S1 Basic Research kit-24PK | Part of the two-channel Chip kit; Storage temperature 4 °C |
| Adenine | Sigma Aldrich | A2786 | Component of the Differentiation media |
| Brucella blood agar plates | VWR International Inc. | 89405-032 | with Hemin and Vitamin K; For the enumeration of Gardnerella vaginalis |
| Ca2+ and Mg2+ free DPBS (DPBS (-/-) | ScienCell | 303 | For washing cells |
| Calcium Chloride | Sigma Aldrich | C5670 | Component of the Differentiation media |
| Calcium chloride (anhyd.) | Sigma Aldrich | 499609 | Component of HBSS (LB/+G) |
| Collagen I | Corning | 354236 | For the coating solution for HVEC |
| Collagen IV | Sigma Aldrich | C7521 | For the coating solution for HVEC |
| Collagenase IV | Gibco | 17104019 | For the dissociation of cells from the Vagina Chips |
| Complete fibroblast medium | ScienCell | 2301 | Media for the culture of HUF |
| Complete vaginal epithelium medium | Lifeline | LL-0068 | Media for the culture of HVEC |
| D-Glucose (dextrose) | Sigma Aldrich | 158968 | Component of HBSS (LB/+G) |
| DMEM (Low Glucose) | Thermofisher | 12320-032 | Component of the Differentiation media |
| Dynamic Flow Module (or Zoë) | Emulate | Zoë-CM1 | Regulates the flow rate of the chips |
| Ham's F12 | Thermofisher | 11765-054 | Component of the Differentiation media |
| Heat inactivated FBS | Thermofisher | 10438018 | Component of the Differentiation media |
| Human uterine fibroblasts | ScienCell | 7040 | HUF |
| Human vaginal epithelial cells | Lifeline | FC-0083 | HVEC |
| Hydrocortisone | Sigma Aldrich | H0396 | Component of the Differentiation media |
| ITES | Lonza | 17-839Z | Component of the Differentiation media |
| L-glutamine | Thermofisher | 25030081 | Component of the Differentiation media |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | Component of HBSS (LB/+G) |
| Magnesium sulfate heptahydrate | Sigma Aldrich | M1880 | Component of HBSS (LB/+G) |
| MRS agar plates | VWR International Inc. | 89407-214 | For enumeration of Lactobacillus |
| O-phosphorylethanolamine | Sigma Aldrich | P0503 | Component of the Differentiation media |
| Pen/Strep | Thermofisher | 15070063 | Component of the Differentiation media |
| pH strips | Fischer-Scientific | 13-640-520 | For measurement of pH |
| Pods (1/chip) | Emulate | BRK-S1-WER-24 | Part of the two-channel Chip kit |
| Poly-L-lysine | ScienCell | 403 | For the coating solution for HUFs |
| Potassium chloride | Sigma Aldrich | P3911 | Component of HBSS (LB/+G) |
| Potassium phosphate monobasic | Sigma Aldrich | P0662 | Component of HBSS (LB/+G) |
| Sterile 80% glycerol | MP Biomedicals | 113055034 | For freezing bacterial samples |
| Triiodothyronine | Sigma Aldrich | T6397 | Component of the Differentiation media |
| Trypan Blue Solution (0.4%) | Sigma Aldrich | T8154 | For counting live/dead cells |
| TrypLE Express | Thermofisher | 12605010 | For the dissociation of cells from the Vagina Chips |
| Trypsin Neutralizing Solution (TNS) | ScienCell | 113 | For neutralization of Trypsin |
| Trypsin/EDTA Solutiom (0.25%) | ScienCell | 103 | For cell dissociation |
| β-estradiol | Sigma Aldrich | E2257 | Hormone for differentiation media |
References
- Smith, S. B., Ravel, J. The vaginal microbiota, host defence and reproductive physiology. J Physiol. 595 (2), 451-463 (2017).
- Van De Wijgert, J., Jespers, V. The global health impact of vaginal dysbiosis. Res Microbiol. 168 (9-10), 859-864 (2017).
- Ralph, S. G., Rutherford, A. J., Wilson, J. D. Influence of bacterial vaginosis on conception and miscarriage in the first trimester: Cohort study. BMJ. 319 (7204), 220-223 (1999).
- Goldenberg, R. L., Hauth, J. C., Andrews, W. W. Intrauterine infection and preterm delivery. N Engl J Med. 342 (20), 1500-1507 (2000).
- Han, Y., Liu, Z., Chen, T. Role of vaginal microbiota dysbiosis in gynecological diseases and the potential interventions. Front Microbiol. 12, 643422 (2021).
- Leitich, H., Kiss, H. Asymptomatic bacterial vaginosis and intermediate flora as risk factors for adverse pregnancy outcome. Best Pract Res Clin Obstet Gynaecol. 21 (3), 375-390 (2007).
- Torcia, M. G. Interplay among vaginal microbiome, immune response and sexually transmitted viral infections. Int J Mol Sci. 20 (2), 266 (2019).
- Van Oostrum, N., De Sutter, P., Meys, J., Verstraelen, H. Risks associated with bacterial vaginosis in infertility patients: A systematic review and meta-analysis. Hum Reprod. 28 (7), 1809-1815 (2013).
- Lewis, F. M. T., Bernstein, K. T., Aral, S. O. Vaginal microbiome and its relationship to behavior, sexual health, and sexually transmitted diseases. Obstet Gynecol. 129 (4), 643-654 (2017).
- Hong, X., et al. The association between vaginal microbiota and female infertility: A systematic review and meta-analysis. Arch Gynecol Obstet. 302 (3), 569-578 (2020).
- Peelen, M. J., et al. The influence of the vaginal microbiota on preterm birth: A systematic review and recommendations for a minimum dataset for future research. Placenta. 79, 30-39 (2019).
- Smith, P. P., et al. Outcomes in prevention and management of miscarriage trials: A systematic review. BJOG. 126 (2), 176-189 (2019).
- Harp, D. F., Chowdhury, I. Trichomoniasis: Evaluation to execution. Eur J Obstet Gynecol Reprod Biol. 157 (1), 3-9 (2011).
- Pastorek, J. G., Cotch, M. F., Martin, D. H., Eschenbach, D. A. Clinical and microbiological correlates of vaginal trichomoniasis during pregnancy. The vaginal infections and prematurity study group. Clin Infect Dis. 23 (5), 1075-1080 (1996).
- Petrin, D., Delgaty, K., Bhatt, R., Garber, G. Clinical and microbiological aspects of trichomonas vaginalis. Clin Microbiol Rev. 11 (2), 300-317 (1998).
- Edwards, T., Burke, P., Smalley, H., Hobbs, G. Trichomonas vaginalis: Clinical relevance, pathogenicity and diagnosis. Crit Rev Microbiol. 42 (3), 406-417 (2016).
- Eade, C. R., et al. Identification and characterization of bacterial vaginosis-associated pathogens using a comprehensive cervical-vaginal epithelial coculture assay. PLoS One. 7 (11), e50106 (2012).
- Fichorova, R. N., Yamamoto, H. S., Delaney, M. L., Onderdonk, A. B., Doncel, G. F. Novel vaginal microflora colonization model providing new insight into microbicide mechanism of action. mBio. 2 (6), e00168 (2011).
- Herbst-Kralovetz, M. M., Pyles, R. B., Ratner, A. J., Sycuro, L. K., Mitchell, C. New systems for studying intercellular interactions in bacterial vaginosis. J Infect Dis. 214, S6-S13 (2016).
- Johnson, A. P., et al. A study of the susceptibility of three species of primate to vaginal colonization with gardnerella vaginalis. Br J Exp Pathol. 65 (3), 389-396 (1984).
- Yildirim, S., et al. Primate vaginal microbiomes exhibit species specificity without universal lactobacillus dominance. ISME J. 8 (12), 2431-2444 (2014).
- Edwards, V. L., et al. Three-dimensional models of the cervicovaginal epithelia to study host-microbiome interactions and sexually transmitted infections. Pathog Dis. 80 (1), 026 (2022).
- Zhu, Y., et al. Ex vivo 2D and 3D HSV-2 infection model using human normal vaginal epithelial cells. Oncotarget. 8 (9), 15267-15282 (2017).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infect Immun. 86 (11), e00282 (2018).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cell Mol Gastroenterol Hepatol. 5 (4), 659-668 (2018).
- Jalili-Firoozinezhad, S., et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nat Biomed Eng. 3 (7), 520-531 (2019).
- Valiei, A., Aminian-Dehkordi, J., Mofrad, M. R. K. Gut-on-a-chip models for dissecting the gut microbiology and physiology. APL Bioeng. 7 (1), 011502 (2023).
- Izadifar, Z., et al. Mucus production, host-microbiome interactions, hormone sensitivity, and innate immune responses modeled in human endo- and ecto-cervix chips. bioRxiv. , (2023).
- Mahajan, G., et al. Vaginal microbiome-host interactions modeled in a human vagina-on-a-chip. Microbiome. 10 (1), 201 (2022).
- Masson, L., et al. Inflammatory cytokine biomarkers to identify women with asymptomatic sexually transmitted infections and bacterial vaginosis who are at high risk of HIV infection. Sex Transm Infect. 92 (3), 186-193 (2016).
- Amsel, R., et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med. 74 (1), 14-22 (1983).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved