Method Article
Modellierung gesunder und dysbiotischer vaginaler Mikroumgebungen in einer menschlichen Vagina-on-a-Chip
In diesem Artikel
Zusammenfassung
In diesem Artikel wird ein Protokoll zur Erstellung eines mikrofluidischen Vagina-on-a-Chip-Kulturgeräts (Vagina Chip) beschrieben, das die Untersuchung der Interaktionen des menschlichen Wirts mit einem lebenden vaginalen Mikrobiom unter mikroaerophilen Bedingungen ermöglicht. Dieser Chip kann sowohl als Werkzeug zur Erforschung von Vaginalerkrankungen als auch zur Entwicklung und Erprobung möglicher therapeutischer Gegenmaßnahmen eingesetzt werden.
Zusammenfassung
Die Gesundheit von Frauen, und insbesondere Erkrankungen des weiblichen Fortpflanzungstrakts (FRT), haben nicht die Aufmerksamkeit erhalten, die sie verdienen, obwohl ein ungesundes Fortpflanzungssystem zu lebensbedrohlichen Krankheiten, Unfruchtbarkeit oder unerwünschten Folgen während der Schwangerschaft führen kann. Ein Hindernis auf diesem Gebiet besteht darin, dass es einen Mangel an präklinischen, experimentellen Modellen gibt, die die Physiologie und Pathophysiologie der FRT originalgetreu nachahmen. Aktuelle In-vitro - und Tiermodelle rekapitulieren die hormonellen Veränderungen, mikroaeroben Bedingungen und Wechselwirkungen mit dem vaginalen Mikrobiom nicht vollständig. Das Aufkommen der mikrofluidischen Kulturtechnologie Organ-on-a-Chip (Organ Chip), die Gewebe-Gewebe-Grenzflächen, die Gefäßperfusion, interstitielle Flüssigkeitsflüsse und die physikalische Mikroumgebung einer wichtigen Untereinheit menschlicher Organe nachahmen kann, kann möglicherweise als Lösung für dieses Problem dienen. Kürzlich wurde ein humaner Vagina-Chip entwickelt, der die Co-Kultur von menschlichen vaginalen mikrobiellen Konsortien mit primärem humanem Vaginalepithel unterstützt, das ebenfalls mit dem vaginalen Stroma verbunden ist und einen dynamischen Flüssigkeitsfluss erfährt. Dieser Chip repliziert die physiologischen Reaktionen der menschlichen Vagina auf gesunde und dysbiotische Mikrobiome. Ein detailliertes Protokoll zur Herstellung von menschlichen Vagina-Chips wurde in diesem Artikel beschrieben.
Einleitung
Ein vaginales Mikrobiom, das von Lactobacillus spp. dominiert wird und zur Aufrechterhaltung eines sauren Mikromilieus beiträgt, spielt eine wichtige Rolle bei der Aufrechterhaltung der weiblichen Fortpflanzungsgesundheit1. Manchmal kann es jedoch zu einer Veränderung in der Zusammensetzung der mikrobiellen Gemeinschaften kommen, aus denen das Mikrobiom besteht, was zu einer Zunahme der Vielfalt der Vaginalbakterien führt. Diese dysbiotischen Veränderungen, die oft zu einem Wechsel von einem Lactobacillus-dominierten Zustand zu einem Zustand führen, der von vielfältigeren anaeroben Bakterienarten (z. B. Gardnerella vaginalis) dominiert wird, sind mit verschiedenen Erkrankungen des Fortpflanzungssystems verbunden, wie z. B. bakterielle Vaginose, atrophische Vaginitis, Harnwegsinfektion, vulvovaginale Candidiasis, Urethritis und Chorioamnionitis 2,3,4,5 . Diese Krankheiten erhöhen wiederum die Chancen einer Frau, sexuell übertragbare Krankheiten und entzündliche Erkrankungen des Beckens zu erwerben 6,7,8,9. Sie stellen auch ein höheres Risiko für Frühgeburten und Fehlgeburten bei schwangeren Frauen dar 10,11,12 und wurden auch mit Unfruchtbarkeit in Verbindung gebracht 13,14,15,16.
Obwohl Anstrengungen unternommen wurden, die vaginale Dysbiose mit Hilfe von vaginalen Epithelzellen zu modellieren, die in statischen, zweidimensionalen (2D) Kultursystemen kultiviert wurden17,18, ahmen sie die Physiologie und Komplexität der vaginalen Mikroumgebung nicht effektiv nach19. Tiermodelle wurden auch verwendet, um vaginale Dysbiose zu untersuchen; Ihre Menstruationsphasen und Wirt-Mikrobiom-Interaktionen unterscheiden sich jedoch stark von denen beim Menschen, so dass die physiologische Relevanz der Ergebnisse dieser Studien unklar bleibt 19,20,21. Um diesen Problemen entgegenzuwirken, wurden Organoide und Transwell-Insert-Modelle von menschlichem Vaginalgewebe auch verwendet, um Wirt-Pathogen-Interaktionen in der FRT zu untersuchen 19,22,23,24. Da es sich jedoch um statische Kulturen handelt, können sie die Co-Kultur menschlicher Zellen mit lebenden Mikroben nur für einen kurzen Zeitraum (<16-24 h) unterstützen, und ihnen fehlen viele andere potenziell wichtige physikalische Merkmale der menschlichen vaginalen Mikroumgebung, wie z. B. die Schleimproduktion und der Flüssigkeitsfluss22.
Organchips sind dreidimensionale (3D) mikrofluidische Kultursysteme, die einen oder mehrere parallele hohle Mikrokanäle enthalten, die von lebenden Zellen ausgekleidet sind, die unter dynamischer Flüssigkeitsströmung kultiviert werden. Die Zweikanal-Chips ermöglichen die Nachbildung von Gewebe-Gewebe-Grenzflächen auf Organebene, indem verschiedene Zelltypen (z. B. Epithel und stromale Fibroblasten oder Epithel und vaskuläres Endothel) auf gegenüberliegenden Seiten einer porösen Membran kultiviert werden, die die beiden parallelen Kanäle trennt (Abbildung 1). Beide Gewebe können unabhängig voneinander einer Flüssigkeitsströmung ausgesetzt werden, und sie können auch mikroaerobe Bedingungen erfahren, um eine Co-Kultur mit einem komplexen Mikrobiom zu ermöglichen 25,26,27,28. Dieser Ansatz wurde kürzlich genutzt, um einen humanen Vagina-Chip zu entwickeln, der von hormonempfindlichem, primärem Vaginalepithel ausgekleidet ist, das mit den darunter liegenden stromalen Fibroblasten verbunden ist, eine niedrige physiologische Sauerstoffkonzentration im Epithellamen aufrechterhält und eine Co-Kultur mit gesunden und dysbiotischen Mikrobiomen für mindestens 3 Tage in vitro ermöglicht 29. Es wurde gezeigt, dass der Vagina-Chip verwendet werden kann, um die Besiedlung durch optimale (gesunde) L. crispatus-Konsortien zu untersuchen und Entzündungen und Verletzungen zu erkennen, die durch nicht-optimale (nicht gesunde) G. vaginalis-haltige Konsortien verursacht werden. Hier beschreiben wir detailliert die Methoden, die zur Herstellung des humanen Vagina-Chips sowie zur Etablierung gesunder und dysbiotischer Bakteriengemeinschaften auf dem Chip verwendet werden.
Protokoll
Diese Forschung wurde in Übereinstimmung mit den institutionellen Richtlinien für die Verwendung menschlicher Zellen durchgeführt. Die Zellen wurden kommerziell beschafft (siehe Materialtabelle). Alle Schritte sollten aseptisch in einer Biosicherheitswerkbank (BSC) durchgeführt werden. Verwenden Sie für dieses Protokoll nur Filter- (oder Barriere-) Pipettenspitzen.
1. Kultivierung menschlicher Vaginalepithelzellen
- 50 ml vaginales Epithelmedium (VEM, siehe Materialtabelle) auf 37 °C erwärmen.
- Aliquotieren Sie 9 mL VEM auf ein 15 mL Röhrchen. Tauen Sie dann ein Fläschchen mit humanen Vaginalepithelzellen (HVECs) auf und geben Sie es in das Röhrchen mit VEM.
- Das 15-ml-Röhrchen bei 300 x g für 5 min bei Raumtemperatur (RT) zentrifugieren und den Überstand ansaugen, wobei das Pellet zurückbleibt.
- Das Pellet wird vorsichtig in 2 mL VEM resuspendiert und je 1 mL in die beiden T75-Kolben mit 14 mL VEM gegeben.
- Die Kolben werden bei 37 °C mit 5 % CO2 inkubiert. Wechseln Sie VEM alle 2 Tage, bis die HVECs zu ca. 70 % konfluent sind (ca. 5 Tage).
2. Kultivierung menschlicher Uterusfibroblastenzellen
- 10 ml 15 μg/ml Poly-L-Lysinlösung (PLL) in doppelt destilliertem Wasser (ddH2O) zubereiten. 5 ml PLL-Lösung werden in jeden der beiden T75-Kolben gegeben und 1 h lang bei 37 °C inkubiert.
- 50 mL Fibroblastenmedium (FM, siehe Materialtabelle) auf 37 °C erwärmen.
- Die PLL-Lösung wird abgesaugt und jeder Kolben mit 5 mL ddH2O gewaschen.
- Aliquotieren Sie 9 ml FM in ein 15-ml-Röhrchen und tauen Sie ein Fläschchen mit humanen Uterusfibroblasten (HUFs) auf.
- Geben Sie die HUFs in das 15-ml-Röhrchen mit FM.
- Das 15-ml-Röhrchen bei 300 x g für 5 min bei RT zentrifugieren und den Überstand ansaugen, wobei das Zellpellet zurückgelassen wird.
- Das Pellet wird vorsichtig in 2 mL FM resuspendiert und je 1 mL in die beiden T75-Kolben mit 14 mL FM gegeben.
- Die Kolben werden bei 37 °C mit 5 % CO2 inkubiert, bis die Zellen zu etwa 70 % konfluent sind, wobei das Medium alle 2 Tage gewechselt wird.
3. Chipaktivierung und Kanalbeschichtung
- Entgasen Sie die Späne (kommerziell erhältlich, siehe Materialtabelle) für 30 min in einem Vakuumexsikkator.
- Lassen Sie das Aktivierungsreagenz 1 (AR-1) und das Aktivierungsreagenz 2 (AR-2) (siehe Materialtabelle) 15 Minuten lang zu RT äquilibrieren, ohne die Verpackung zu entfernen.
- Wickeln Sie ein konisches 15-ml-Röhrchen in Folie ein, um es vor Licht zu schützen. Geben Sie langsam 1 ml AR-2-Lösung an die Wände der Durchstechflasche AR-1 und mischen Sie sie gut. Übertragen Sie die Mischung in das mit Folie umwickelte 15-ml-Röhrchen.
- Geben Sie die AR-2-Lösung wiederholt in Schritten von 1 ml in die Durchstechflasche, bis das AR-1-Pulver vollständig aus der Durchstechflasche gewaschen ist.
- Füllen Sie die rekonstituierte AR-1-Lösung auf 10 mL mit AR-2-Lösung auf.
- Geben Sie 200 μl dieser Lösung in den apikalen Kanaleinlass jedes Chips, während Sie aus dem Auslass aspirieren (Abbildung 1A). Wiederholen Sie dies für den Basalkanal. Halten Sie die Pipette senkrecht zum Chip, während Sie die Lösung hinzufügen, um eine dichte Abdichtung mit ungehindertem Durchfluss zu gewährleisten.
- Wiederholen Sie Schritt 3.6 für alle Chips.
- Überprüfen Sie alle Chips auf Blasen. Entfernen Sie alle Blasen, indem Sie mehr Lösung in die betroffenen Kanäle geben.
- Saugen Sie die gesamte überschüssige AR-1-Lösung von der Chipoberfläche ab und vermeiden Sie dabei Kanalein- und -auslässe.
- Geben Sie die Chips in eine 150 mm Petrischale und setzen Sie diese unbedeckte Schale in eine UV-Lichtbox ein.
- Richten Sie die UV-Lichtbox auf die Rückseite des BSC und lassen Sie die Chips 30 Minuten lang unter konstantem UV-Licht. Die Farbe der Lösung in den Chips ändert sich von dunkelrosa zu mahagonifarben.
- Waschen Sie jeden Kanal, indem Sie 200 μl AR-2-Lösung in den Einlass geben, während Sie gleichzeitig aus dem Auslass aspirieren.
- Waschen Sie jeden Kanal zweimal, indem Sie 200 μl kaltes DPBS (-/-) in den Einlass geben, während Sie gleichzeitig aus dem Auslass ansaugen.
- Bereiten Sie die apikale Kanalbeschichtung vor (200 μg/mL Kollagen I und 30 μg/mL Kollagen IV Gemisch in DMEM) (siehe Materialtabelle). Bleiben Sie auf Eis.
- Bereiten Sie die Basalkanalbeschichtung vor (15 μg/mL PLL und 200 μg/mL Kollagen I Mischung in DMEM). Bleiben Sie auf Eis.
- Geben Sie 200 μl Basalkanalbeschichtung in den Basalkanaleinlass. Stecken Sie die Steckdose mit einer P200-Spitze ein, wenn die Beschichtungslösung am Auslass erscheint. Geben Sie die Lösung ab, bis das Volumen der Einlass- und Auslassspitze gleich ist, und lösen Sie dann die Pipettenspitze von der Pipette, wobei Sie die Spitze im Einlass belassen.
- Geben Sie auf ähnliche Weise 200 μl apikale Kanalbeschichtung in den apikalen Kanal.
- Überschüssige Lösung von der Chipoberfläche ansaugen.
- Überprüfen Sie alle Chips auf Blasen. Entfernen Sie alle Blasen, indem Sie den betroffenen Kanal oder die betroffenen Kanäle mit einer weiteren Kanalbeschichtung versehen.
- Die Chips werden über Nacht in einer 150 mm Petrischale bei 37 °C mit 5 % CO2 inkubiert.
4. Säen des Spanbasalkanals mit HUFs
- Betrachten Sie täglich das Wachstum der HUF im Kolben unter dem Mikroskop.
- Sobald HUF-Kulturen zu 70%-90% konfluent sind (~3 Tage nach dem Plattieren), erwärmen Sie 25 mL FM, 5 mL Ca2+/Mg2+ freies DPBS (DPBS (-/-), 10 mL Trypsin/EDTA und 15 mL Trypsin-Neutralisationslösung (TNS, siehe Materialtabelle) auf 37 °C.
- Das Medium wird aus den Kolben abgesaugt. Mit 5 mL DPBS (-/-) waschen, dann erneut aspirieren.
- 4 ml Trypsin-EDTA in jeden Kolben geben und 3-5 Minuten lang bei 37 °C inkubieren, bis sich die Zellen ablösen.
- 6 ml TNS werden in jeden Kolben gegeben und die Zellsuspension in ein konisches 15-ml-Röhrchen überführt.
- Die Suspension mit einer Pipette gut mischen und ein 10 μl Aliquot für die Zellzählung entnehmen. Mischen Sie 10 μl Zellsuspension mit 10 μl Trypanblau und zählen Sie mit einem Hämozytometer.
- Zentrifugieren Sie die Zellsuspension bei 300 x g für 5 min bei RT. Aspirieren Sie den Überstand und resuspendieren Sie das Pellet in warmem FM auf eine Endkonzentration von 7,5 x 105 Zellen/ml.
- Waschen Sie den Basalkanal mit 200 μl FM.
- 15 mL VEM auf 37 °C erwärmen. Waschen Sie den apikalen Kanal mit 200 μl VEM.
- Geben Sie 200 μl vollständiges VEM in den apikalen Kanaleinlass, während Sie den Auslass mit einer Pipettenspitze verstopfen. Geben Sie das Medium ab, bis das Volumen der Einlass- und Auslassspitze gleich ist, lösen Sie dann die Pipettenspitze von der Pipette und lassen Sie die Spitze im Einlass. Halten Sie den oberen Kanal sowohl am Einlass als auch am Auslass gefüllt und verstopft.
- 50 μl HUF-Zellsuspension langsam in den Einlass des Basalkanals pipettieren, während gleichzeitig aus dem Auslass aspiriert wird. Entfernen Sie die Pipettenspitze aus dem Einlass, wenn ~2 μl der Zellsuspension in der Pipettenspitze verbleiben, ohne den Pipettenkolben anzudrücken oder loszulassen, um Blasenbildung zu vermeiden. Stecken Sie den Ein- und Auslass mit Pipettenspitzen ein.
- Überprüfen Sie unter dem Mikroskop auf Blasen. Falls vorhanden, waschen Sie den Basalkanal mit FM und wiederholen Sie Schritt 4.11.
- Drehen Sie die eingesteckten Chips auf einem 15 mL Röhrchengestell um und inkubieren Sie sie bei 37 °C mit 5% CO2 für 1 h. Beobachten Sie die Chips nach der Inkubation und prüfen Sie, ob sie an den Zellen haften.
- Verstopfen Sie den Ausgang des Basalkanals mit einer Pipettenspitze. Geben Sie 200 μl FM in den Basalkanaleinlass, ohne den Pipettenkolben nach unten zu drücken. Lösen Sie die Spitze von der Pipette und lassen Sie das Medium durch die Schwerkraft frei durch den Kanal zur Auslasspipettenspitze fließen.
- Mit HUF gesäte Chips über Nacht bei 37 °C mit 5 % CO2 inkubieren.
5. Aussaat eines apikalen Chip-Kanals mit vaginalen Epithelzellen
- 50 mL VEM auf 37 °C erwärmen.
- Bereiten Sie eine apikale Kanalbeschichtung vor (200 μg/mL Kollagen I in DMEM). Bleiben Sie auf Eis.
- Stecken Sie den apikalen Kanalauslass mit einer Pipettenspitze ein.
- Geben Sie 200 μl apikale Kanalbeschichtung in den apikalen Kanaleinlass. Geben Sie die apikale Beschichtungslösung ab, bis das Volumen der Einlass- und Auslassspitze gleich ist, und lösen Sie dann die Pipettenspitze von der Pipette und lassen Sie die Spitze im Einlass.
- Überschüssige Lösung von der Oberfläche des Chips ansaugen.
- Chips bei 37 °C mit 5 % CO2 1 h inkubieren.
- Nach 1 h waschen Sie die apikale Kanalbeschichtung, indem Sie 200 μl VEM in den apikalen Kanaleinlass geben, während Sie aus dem Auslass aspirieren.
- Überprüfen Sie das HVEC-Wachstum unter einem Mikroskop auf ~70%-90% Konfluenz.
- Wenn die Zellen zu 70 % bis 90 % konfluent sind, erwärmen Sie 6 ml vollständiges vaginales Epithelzellmedium und 4 ml Trypsin/EDTA pro Kolben auf 37 °C.
- Das Medium aus dem HVEC-Kolben ansaugen und mit 5 mL DPBS (-/-) waschen, dann aspirieren.
- 4 ml Trypsin in jeden Kolben geben und bei 37 °C mit 5 % CO2 3-5 min inkubieren, bis sich die Zellen ablösen.
- 6 ml VEM werden in den Kolben gegeben, um Trypsin zu inaktivieren, und die Zellsuspension in ein konisches 15-ml-Röhrchen überführt.
- Die Suspension mit einer Pipette gut mischen und ein 10 μl Aliquot für die Zellzählung entnehmen. Mischen Sie 10 μl Zellsuspension mit 10 μl Trypanblau und zählen Sie mit einem Hämozytometer.
- Zentrifugieren Sie die Zellsuspension bei 300 x g für 5 min bei RT. Aspirieren Sie den Überstand und resuspendieren Sie das Pellet in VEM auf eine Endkonzentration von 3,5-4 Millionen Zellen/ml.
- Erwärmen Sie 25 mL FM auf 37 °C.
- Stecken Sie den apikalen Kanalauslass mit einer Pipettenspitze ein. Pipettieren Sie langsam mindestens 40 μl HVEC-Zellsuspension in den apikalen Kanaleinlass. Geben Sie die Zellsuspension ab, bis das Volumen der Einlass- und Auslassspitze gleich ist, lösen Sie dann die Pipettenspitze von der Pipette und lassen Sie die Spitze im Einlass. Halten Sie den Basalkanal mit FM gefüllt und sowohl am Einlass als auch am Ausgang angeschlossen.
- Saugen Sie überschüssiges Medium vorsichtig auf der Oberfläche der Späne auf und prüfen Sie unter dem Mikroskop auf Blasen. Falls vorhanden, wiederholen Sie Schritt 5.16.
- Die Chips in eine große Petrischale geben und bei 37 °C mit 5 % CO2 über Nacht inkubieren.
- Beobachten Sie am nächsten Tag die Chips unter dem Mikroskop auf Zellanhaftung.
- Entfernen Sie die Pipettenspitzen aus den Ein- und Auslässen sowohl des apikalen als auch des basalen Kanals.
- Stecken Sie den Basalkanalauslass mit einer Pipettenspitze ein und geben Sie 200 μl FM in den Basalkanaleinlass, ohne den Pipettenkolben nach unten zu drücken. Lösen Sie die Pipettenspitze von der Pipette und lassen Sie das Medium durch die Schwerkraft frei durch den Kanal zur Auslasspipettenspitze fließen.
- Wiederholen Sie Schritt 5.21 für den apikalen Kanal mit VEM.
- Die doppelt ausgesäten Chips bei 37 °C mit 5 % CO2 24 h inkubieren.
6. Verbinden von Chips mit Pods und Differenzieren von Vaginalepithelzellen
- 50 mL FM und VEM aliquotieren, um konische 50 mL-Röhrchen zu trennen und auf 37 °C zu erwärmen.
- Entgasen Sie die auf 37 ΰC erwärmten FM- und VEM-Medien unter einem sterilen Vakuum für 5 min.
- Desinfizieren und reinigen Sie die Tabletts für das Dynamic Flow Module (DFM, siehe Materialtabelle). Nehmen Sie die Pods aus der Verpackung und legen Sie sie in die Trays.
- Geben Sie 2 mL entgastes VEM in das apikale Einlassreservoir (oberes rechtes Reservoir; Abbildung 1B). Füge Medium entlang der Wände des Reservoirs hinzu, um Blasenbildung zu vermeiden.
- Geben Sie 3 mL entgastes FM in das basale Einlassreservoir (oberes linkes Reservoir, Abbildung 1B). Füge Medium entlang der Wände des Reservoirs hinzu, um Blasenbildung zu vermeiden.
- Geben Sie 500 μl entgastes VEM in das apikale Auslassreservoir (unteres rechtes Reservoir, Abbildung 1B). Kippen Sie den Pod so, dass das Medium die gesamte Unterseite des Behälters bedeckt.
- Geben Sie 500 μl entgastes FM in das basale Auslassreservoir (unteres linkes Reservoir, Abbildung 1B). Kippen Sie den Pod so, dass das Medium die gesamte Unterseite des Behälters bedeckt.
- Schieben Sie die Fächer mit den Pods in DFM und führen Sie den Prime-Zyklus zweimal aus. Überprüfen Sie, ob Tröpfchen aus den Anschlüssen an der Unterseite jedes Pods austreten.
- Wenn sich nach 4 "Prime"-Zyklen kein Tröpfchen bildet, stellen Sie direkten Kontakt mit dem Anschluss im Auslassbehälter des Pods her (Abbildung 1B) und pipettieren Sie 200 μl des jeweiligen Mediums, damit das Medium zwischen dem Reservoir und dem Kanal fließen kann. Dies wird als "Hand-Priming" bezeichnet.
- Entfernen Sie die Pipettenspitzen von den Chips und geben Sie ein Tröpfchen des entsprechenden Mediums auf alle Anschlüsse für jeden Chip.
- Schieben Sie die Chips in die Pods und legen Sie die Pods auf die Tabletts.
- Saugen Sie alle Medien auf der Oberfläche der Chips an und schieben Sie jedes Fach in ein DFM.
- Stellen Sie die folgenden Parameter am DFM wie folgt ein: Oben und Unten - Flüssigkeit; Apikale Strömung (oberer Kanal) - 15 μL/h; Basaler Durchfluss (unterer Kanal) - 30 μL/h; Dehnung = 0%; Frequenz = 0 Hz.
- Führen Sie den Regulationszyklus auf dem DFM aus und lassen Sie den Durchfluss über Nacht zu.
- Ändern Sie nach 24 h die Flusseinstellungen für den apikalen Kanal auf 0 μL/h und halten Sie den Basalkanal für weitere 24 Stunden bei einer Durchflussrate von 30 μL/h.
- Bereiten Sie 500 ml Differenzierungsmedium (TM) vor, indem Sie 4 mM L-Glutamin, 20 mM Hydrocortison, 1x ITES, 20 nM Trijodthyronin, 100 μM O-Phosphorylethanolamin, 180 μM Adenin, 3,2 mM Calciumchlorid, 2 % hitzeinaktiviertes FBS, 1 % Pen-Streptokokken und 120 ml F-12-Medium von Ham zu DMEM mit niedrigem Glukosegehalt (siehe Materialtabelle) hinzufügen und filtrieren.
- 50 mL TM auf 37 °C erwärmen.
- Geben Sie 20 μl 10 μM Estradiol (siehe Materialtabelle) zu den 50 mL TM, mischen Sie es gut und entgasen Sie es 5 Minuten lang unter einem sterilen Vakuum.
- 50 mL VEM im Wasserbad auf 37 °C erwärmen und unter sterilem Vakuum 5 min lang entgasen.
- Entfernen Sie die Fächer aus dem DFM, setzen Sie sie in einen BSC ein, und saugen Sie das Medium aus den Pods an, wobei Sie die Anschlüsse in den Behältern vermeiden (Abbildung 1A). Geben Sie dann 2 mL VEM in das apikale Kanaleinlassreservoir und 3 mL DM in das Basalkanaleinlassreservoir.
- Setzen Sie die Trays wieder in das DFM und stellen Sie den apikalen Kanalfluss auf 15 μl/h und den basalen Kanalfluss auf 30 μl/h ein.
- Lassen Sie das DFM 4-7 h lang fließen. Stoppen Sie dann den apikalen Kanalfluss, indem Sie ihn auf 0 μL/h einstellen. Lassen Sie den Basalkanalfluss mit 30 μL/h weiterfließen.
- Wechseln Sie das Medium gemäß den Schritten 6.16-6.19 alle 48 Stunden.
- Fließen Sie das Medium intermittierend für 4-7 Stunden pro Tag für weitere 5 Tage in den apikalen Kanal, indem Sie die Schritte 6.20-6.21 befolgen.
- Bereiten Sie Hanks' ausgewogene Salzlösung mit geringer Pufferkapazität mit Glukosemedien (HBSS (LB/+G)) vor, indem Sie 1,26 mM Calciumchlorid, 0,49 mM Magnesiumchloridhexahydrat, 0,406 mM Magnesiumsulfat, 5,33 mM Kaliumchlorid, 137,93 mM Natriumchlorid, 0,441 mM Kaliumphosphat monobasisch und 5,55 mM D-Glukose bis dd H2O (siehe Materialtabelle) hinzufügen; pH-Wert 4,8.
- Bereiten Sie 500 ml Pen-Streptokokkenfreies TM vor, indem Sie 4 mM L-Glutamin, 20 mM Hydrocortison, 1x ITES, 20 nM Trijodthyronin, 100 μM O-Phosphorylethanolamin, 180 μM Adenin, 3,2 mM Calciumchlorid, 2 % hitzeinaktiviertes FBS und 120 mL F-12-Medium von Ham zu DMEM mit niedrigem Glukosegehalt hinzufügen und filtrieren.
- Ersetzen Sie an Tag 6 das apikale Kanalmedium durch (HBSS (LB/+G)) und das Basalkanalmedium durch Pen-Strep-freies DM gemäß den Schritten 6.16-6.19.
- Stellen Sie den Durchfluss am DFM auf 15 μl/h für den apikalen Kanal und 30 μl/h für den basalen Kanal für 24 h ein, bevor Sie mit der bakteriellen Inokulation fortfahren.
7. Bakterielle Inokulation von differenzierten Chips
HINWEIS: Führen Sie die folgenden Schritte in einem Labor und BSC durch, die den Vorschriften für den Umgang mit Mikroben entsprechen.
- Berechnen Sie die KBE/ml jedes Bakterienstamms, der in das Inokulum aufgenommen werden soll. Mischen Sie die erforderliche Menge jedes Bakterienstamms auf insgesamt ~5 x 106 KBE/ml.
- Die Mischung bei 7.000 x g für 7 min bei 4 °C zentrifugieren und den Überstand vorsichtig entfernen. Resuspendieren Sie das Pellet in (HBSS (LB/+G)). Dies wird das bakterielle Inokulum sein.
- Chips von den Schoten lösen. Verschließen Sie den Ausgang des Basalkanals mit einer Pipettenspitze und geben Sie 200 μl Pen-Strep-freies DM in den Basalkanaleinlass, ohne den Pipettenkolben nach unten zu drücken. Lösen Sie die Pipettenspitze von der Pipette und lassen Sie das Medium durch die Schwerkraft frei durch den Kanal zum Auslass fließen.
- Geben Sie 37 μl des bakteriellen Inokulums in den apikalen Kanaleinlass, während Sie aus dem Auslass aspirieren. Wenn noch etwa 2 μl in der Pipettenspitze verbleiben, ziehen Sie die Spitze heraus und verschließen Sie den Einlass und Auslass des apikalen Kanals mit Pipettenspitzen.
- Für die Kontrollchips (ungeimpft) wiederholen Sie Schritt 7.4 mit 37 μl (HBSS (LB/+G)).
- Saugen Sie alle Medien auf der Oberfläche des Chips an. Die Chips in eine 150 mm Petrischale geben und bei 37 °C mit 5 % CO2 24 h inkubieren.
- Legen Sie die Pods (ohne Chips) auf die Tabletts und legen Sie sie für 24 h bei 37 °C mit 5% CO2 in den Inkubator.
- 50 mL (HBSS (LB/+G)) und 50 mL pen-Streptokokkenfreies TM auf 37 °C erwärmen.
- Geben Sie 20 μl 10 μM Estradiol zu den 50 mL Pen-Strepto-freies TM, mischen Sie es gut und entgasen Sie es 5 Minuten lang unter einem sterilen Vakuum. Entgasen Sie die (HBSS (LB/+G)) unter Vakuum für 5 min.
- Saugen Sie das Medium vorsichtig in den Pods an und vermeiden Sie dabei die Einlass- und Auslassöffnungen des Behälters.
- 3 mL entgastes (HBSS (LB/+G)) in das apikale Einlasskapselreservoir und 500 μl entgastes (HBSS (LB/+G)) in das apikale Auslasskapselreservoir geben.
- Geben Sie 3 mL entgastes Pen-Strep-freies TM in das Reservoir des Basaleinlassbehälters und 500 μl entgastes antibiotikafreies TM in das Reservoir des Basalauslassbehälters.
- Schieben Sie die Fächer mit den Pods (ohne die Chips) in das DFM und führen Sie den Prime-Zyklus zweimal aus. Überprüfen Sie, ob Tröpfchen aus jedem Anschluss an der Unterseite des Pods austreten.
HINWEIS: Wenn sich nach 4 "Prime"-Zyklen kein Tröpfchen bildet, stellen Sie direkten Kontakt mit dem Anschluss im Auslassbehälter des Pods her (Abbildung 1B) und pipettieren Sie 200 μl des jeweiligen Mediums, damit das Medium zwischen dem Reservoir und dem Kanal fließen kann. - Entfernen Sie die Pipettenspitzen von den Chips und geben Sie ein Tröpfchen des entsprechenden Mediums auf alle Kanalein- und -auslässe.
- Schieben Sie die Chips in die Pods und legen Sie die Pods in die Tabletts.
- Aspirieren Sie das Medium in den apikalen und basalen Auslassbehältern des Pods und alle Medien auf der Oberfläche der Chips. Schieben Sie dann die Fächer in das DFM.
- Stellen Sie die folgenden Parameter am DFM ein: Oben und Unten - Flüssigkeit; Apikaler (oberer) Fluss - 40 μL/h; Basale (untere) Strömung - 40 μL/h; Dehnung - 0%; Frequenz - 0 Hz. Führen Sie den Regulationszyklus aus.
- Stoppen Sie den Durchfluss nach 4 h und sammeln Sie das Abwasser, d. h. das Medium, in den apikalen und basalen Auslassbehältern.
- Messen und erfassen Sie die Abwassermengen.
- Setzen Sie die Chips wieder in das DFM ein und stellen Sie die apikale Flussrate auf 0 μL/h und den basalen Fluss auf 30 μL/h ein. Starten Sie den Flow, der über Nacht ausgeführt wird.
- Aliquotieren Sie das gesammelte Abwasser für verschiedene geplante Assays und lagern Sie sie bei geeigneten Temperaturen.
HINWEIS: Für die KBE-Messung Glycerin bis zu einer Endkonzentration von 16 % zugeben und sofort bei -80 °C lagern. - Saugen Sie das Medium nur in den basalen Auslassbehältern an und stellen Sie die apikalen und basalen Flussraten im DFM auf 40 μl/h ein. Starten Sie den Flow für 4 h und wiederholen Sie die Schritte 7.18-7.21. Dies wird die Abwassersammlung für 48 Stunden sein.
- Wiederholen Sie Schritt 7.22 für 72 h oder bis zum Ende des Experiments.
- Am Endpunkt des Versuchs werden die Abwässer gemäß den Schritten 7.18 bis 7.19 gesammelt.
- Bereiten Sie die Aufschlusslösung vor, indem Sie 1 mg/ml Kollagenase i.v. in TrypLE express hinzufügen. 10 ml Aufschlusslösung auf 37 °C erwärmen.
- Stecken Sie die Auslassöffnung des Basalkanals mit einer Pipettenspitze ein. Geben Sie 100 μl Aufschlusslösung in den Basalkanal. Mischen Sie gut und sammeln Sie mit einer Pipette die gesamte Lösung aus dem Kanal in einem Röhrchen mit der Aufschrift "Röhrchen B".
- Stecken Sie die Auslassöffnung des apikalen Kanals mit einer Pipettenspitze ein. 100 μl Aufschlusslösung in den apikalen Kanal geben. Mischen Sie gut und sammeln Sie mit einer Pipette die gesamte Lösung aus dem Kanal in einem Röhrchen mit der Aufschrift "Röhrchen A".
- Geben Sie weitere 100 μl der Aufschlusslösung sowohl in die apikalen als auch in die basalen Kanaleinlässe, während Sie die Auslässe mit Pipettenspitzen verschließen. Inkubieren Sie die Chips und Röhrchen A und B bei 37 °C für 1-1,5 h.
- Mischen Sie den Aufschlussinhalt gut in den Kanälen mit den verstopften Spitzen, die sich bereits in den Ein- und Auslässen befinden. Sammeln Sie den Inhalt des apikalen und des basalen Kanals zu den Röhren A bzw. B. Dabei handelt es sich um die apikalen und basalen Digests des Chips.
- Zählen Sie die Zellen in Röhrchen A mit einem Hämozytometer. Entfernen Sie außerdem ein Aliquot aus den Chip-Aufschlüssen für die KBE-Messung gemäß Schritt 7.21.
8. Analyse von Späneabwässern und -aufschlägen
- Für die Zählung der Bakterien aus den Abwässern und Aufschlüssen werden die Abwässer bzw. Aufschlüsse in sterilem DPBS (-/-) seriell verdünnt und auf eine geeignete Medienplatte aufgegossen, 24-48 h bei 37 °C inkubiert und die Kolonien auf der Platte gezählt.
- Für die Messung des pH-Werts nehmen Sie unmittelbar nach der Entnahme 10 μl des 72-Stunden-Abwassers und verwenden Sie einen pH-Streifen, um den pH-Wert des Abwassers zu messen.
- Für die Analyse der Zytokine sind die Abwässer zum Nachweis spezifischer Zytokine unter Verwendung eines Luminex-basierten Assays, ELISA oder einer anderen anwendbaren Technikzu verwenden 29,30.
Ergebnisse
Die menschliche Vagina ist von einem geschichteten Epithel ausgekleidet, das über einem fibroblastenreichen kollagenen Stroma liegt. Um dies zu modellieren, wurde eine Gewebeschnittstelle geschaffen, indem primäres humanes Vaginalepithel und Fibroblasten auf gegenüberliegenden Seiten einer gemeinsamen porösen Membran in einem zweikanaligen mikrofluidischen Organchip-Gerät kultiviert wurden. Die Bildung des vaginalen Epithels wird mit Hilfe der hellfeldmikroskopischen Bildgebung überwacht, die die Bildung einer kontinuierlichen Zellschicht zeigt, die nach und nach mehrere Zellschichten bildet (Abbildung 2A). Frühere Berichte bestätigten, dass diese Morphologie mit der Entwicklung eines vollständig geschichteten Epithels korreliert, wenn man sie in Querschnitt29 betrachtet. Wenn die Epithelschicht jedoch lückenhaft und diskontinuierlich erscheint (Abbildung 2B), ist der Vagina-Chip möglicherweise nicht für den Einsatz in Experimenten geeignet.
Abbildung 3 zeigt eine schematische Darstellung der Erzeugung des Vagina-Chips. Um die Funktionalität des Vagina-Chips zu validieren, wurden die Chips mit L. crispatus und G. vaginalis inokuliert, um ein gesundes bzw. dysbiotisches Vaginalmilieu zu modellieren. G. vaginalis ist das Bakterium, das hauptsächlich an der bakteriellen Vaginose beteiligt ist. Um zu überprüfen, ob sich gesunde und dysbiotische Bakterien auf den Vagina-Chips einnisten, wurde die Bakterienlast in den Vagina-Chips, die mit den verschiedenen Bakterienpopulationen geimpft wurden, quantifiziert, indem Kanalabwässer und verdaute Zellschichten auf selektiven bakteriellen Wachstumsmedien (De Man-Rogosa-Sharpe (MRS)-Agar für L. crispatus und Brucella-Blutagar (BBA) für G. vaginalis) (siehe Materialtabelle) und mit ähnlichen Kulturen unter Verwendung des Originalinokulums verglichen wurden. Kolonien von L. crispatus und G. vaginalis wurden innerhalb von 48 Stunden nach der Plattierung nachgewiesen (Abbildung 2C), was bestätigt, dass sowohl gesunde als auch dysbiotische Bakterien in die Vagina-Chips transplantiert wurden. Wenn jedoch Bakterienkolonien auf den Platten mit den Inokula beobachtet werden, aber nicht auf den Platten, die das Abwasser oder den Verdau nach der erforderlichen Inkubation enthalten, dann kann daraus geschlossen werden, dass sich die Bakterien nicht eingepflanzt haben.
Ein gesundes vaginales Milieu ist sauer, und eine Dysbiose führt zu einem Anstieg des vaginalen pH-Wertsvon 31. Dazu wurde auch der pH-Wert des Ablaufs des apikalen Epithelkanals des Vagina-Chips analysiert. Der pH-Wert von Vagina-Chips, die mit L. crispatus inokuliert wurden, war ähnlich wie der von nicht geimpften Kontrollchips, und wenn sie mit G. vaginalis co-kultiviert wurden, zeigten sie einen signifikant erhöhten pH-Wert (Abbildung 2D). Wenn festgestellt wird, dass der pH-Wert eines nicht infizierten Vagina-Chips hoch ist, deutet dies darauf hin, dass es ein Problem gibt und diese Chips nicht für Experimente verwendet werden sollten.
Der Entzündungszustand des Vaginalgewebes reagiert auch empfindlich auf die Zusammensetzung des vaginalen Mikrobioms, wobei ein dysbiotisches Mikrobiom die Entzündung stimuliert. Bei der Analyse der proinflammatorischen Zytokine im apikalen Kanal des Vagina-Chips 3 Tage nach der Inokulation mit L. crispatus oder G. vaginalis wurde in ähnlicher Weise festgestellt, dass die proinflammatorische Reaktion bei G. vaginalis höher war als bei nicht infizierten Chips und Chips, die mit L. crispatus geimpft wurden (Abbildung 2E). Zusammengenommen zeigen diese Ergebnisse, dass der Vagina-Chip die menschliche vaginale Mikroumgebung sowohl im gesunden als auch im dysbiotischen Zustand genau nachahmt.
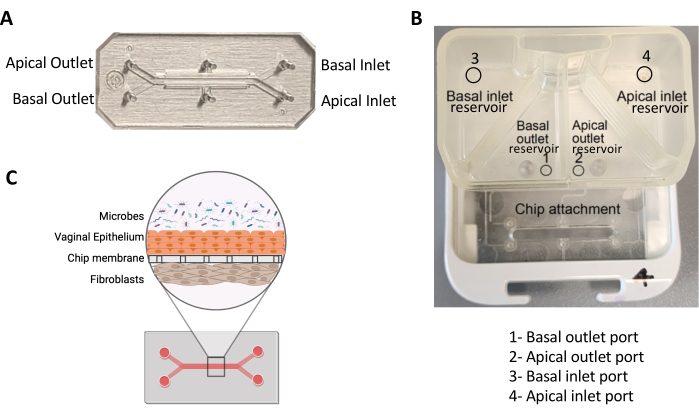
Abbildung 1: Ein Zweikanal-Chip und sein Pod. (A) Bild eines Zweikanal-PDMS-Chips, das seine Kanäle und Ports darstellt. (B) Bild einer Kapsel, die die Reservoirs und Öffnungen für apikale und basale Kanäle darstellt. (C) Schematische Darstellung des Querschnitts eines mit Mikroben infizierten Vagina-Chips. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Der Vagina Chip ahmt gesunde und dysbiotische menschliche vaginale Mikroumgebungen nach. (A) Vaginale Epithelzellen im apikalen Kanal eines robusten Vagina Chips. Die Maßstabsleiste stellt 1 mm des Chips im oberen Bild und 500 μm im unteren Bild dar. (B) Vaginalepithelzellen im apikalen Kanal eines unzureichenden Vagina-Chips. Die Maßstabsleiste stellt 1 mm des Chips im oberen Bild und 500 μm im unteren Bild dar. (C) Transplantation von L. crispatus (LC) und G. vaginalis (GV) in den Vagina-Chip. (D) pH-Wert von Vagina-Chips nach 72-stündiger Inkubation mit L. crispatus (LC) und G. vaginalis (GV) im Vergleich zu nicht infizierten (Kontroll-)Vagina-Chips. (E) Proinflammatorische Reaktion von Vagina-Chips auf L. crispatus (LC) und G. vaginalis (GV) nach 72-stündiger Inkubation im Vergleich zu nicht infizierten (Kontroll-)Vagina-Chips. (C-E) Die Diagramme zeigen den Mittelwert ± SD für 4-6 Chips; *p < 0,05, **p < 0,01, ***p < 0,001 im Vergleich zu Kontroll-Vagina-Chips; Jedes (●) steht für Daten von 1 Chip. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
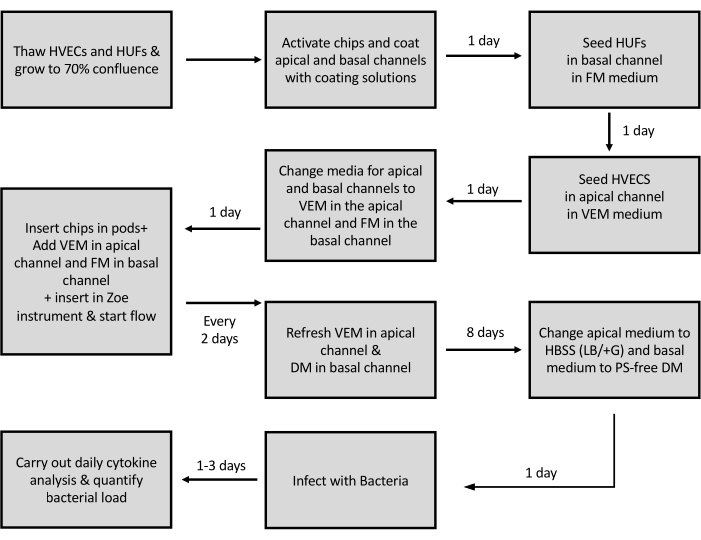
Abbildung 3: Schematische Darstellung des Protokolls zur Erzeugung des Vagina Chips. Schematische Darstellung der Schritte bei der Aussaat der Zellen und der Generierung des Vagina-Chips. HVECs - Menschliche vaginale Epithelzellen; HUFs - Humane Uterusfibroblasten; VEM - Vaginales Epithelmedium; FM - Fibroblasten-Medien; DM - Differenzierungsmedium; PS - Penicillin-Streptomycin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Bisherige In-vitro-Modelle der menschlichen Vagina replizieren die Strukturen des vaginalen Gewebes, den Flüssigkeitsfluss und die Wechselwirkungen zwischen Wirt und Krankheitserreger nicht originalgetreu 19,22. Tiermodelle sind auch durch die Variation des Mikrobioms zwischen den Arten und Unterschiede im Brunst- oder Menstruationszyklus begrenzt19,22. Dieses Manuskript beschreibt ein Protokoll zur Erstellung eines Organ-Chip-Modells der menschlichen Vagina, das die menschlichen Reaktionen auf gesunde und dysbiotische mikrobielle Gemeinschaften effektiv nachahmen kann.
Bei diesem Protokoll werden vaginale Epithel- und Fibroblastenzellen auf gegenüberliegenden Seiten einer gemeinsamen porösen Membran ausgesät, die parallele Mikrokanäle in einem im Handel erhältlichen Zweikanal-Organchip-Gerät trennt (siehe Materialtabelle). Die poröse Membran ermöglicht die Migration von Wachstumsfaktoren und anderen Formen der interzellulären Kommunikation. Die Kollagenbeschichtung und das Vorhandensein der Zellmonoschichten verhindern jedoch das Mischen von Medien zwischen den Kanälen. Bei der Bildung einer vaginalen Epithelzell-Monoschicht im apikalen Kanal werden Differenzierungsfaktoren in das im Basalkanal strömende Medium eingebracht, das den interstitiellen Raum durchläuft und dadurch die Differenzierung der vaginalen Epithelzellen zu einem geschichteten Epithel fördert. Die Dichte der vaginalen Epithelzellen zum Zeitpunkt der Aussaat ist eine entscheidende Determinante für die Gesundheit des Vagina Chips am Ende der Differenzierungsphase. Daher sollte die Dichte der vaginalen Epithelzellen vor Beginn der Differenzierung beurteilt werden, die erst eingeleitet werden sollte, wenn eine Monoschicht etabliert ist. Die Exposition gegenüber den Differenzierungsfaktoren kann so lange fortgesetzt werden, bis die gewünschte Dichte der vaginalen Epithelzellen erreicht ist und bevor die bakterielle Inokulation erfolgt. Des Weiteren ist zu beachten, dass die Wachstumsrate bei primären vaginalen Epithelzellen von verschiedenen Spendern (oder kommerziellen Quellen) variieren kann, was die Qualität des erzeugten Vagina-Chips beeinträchtigen kann. Bei allen mikrofluidischen Organchip-Studien ist es von größter Bedeutung, alle Blasen zu entfernen, die sich in den Kanälen in der Chipkultur bilden könnten, da sie den Medienfluss beeinträchtigen und schließlich zu einer verringerten Nährstoffverfügbarkeit und einem Verlust der Zelllebensfähigkeit führen.
Dieses Protokoll beschreibt auch, wie der Vagina-Chip verwendet wird, um bakterielle Gemeinschaften auf dem Chip zu etablieren, die entweder den gesunden vaginalen Zustand oder die bakterielle Vaginose nachahmen. Der Vagina-Chip kann auch zur Untersuchung anderer vaginaler Erkrankungen oder Störungen verwendet werden. Bei der Durchführung dieser Studien sollte jedoch darauf geachtet werden, die Merkmale der einzelnen Krankheiten zu verstehen und die besten Mittel zur Korrelation der Ergebnisse mit den klinischen Befunden zu ermitteln. Zusammenfassend lässt sich sagen, dass der menschliche Vagina-Chip neue Wege eröffnet, um eine Vielzahl von Krankheiten und Zuständen im Zusammenhang mit der FRT zu untersuchen, und er kann ein wertvolles Werkzeug für die Untersuchung potenzieller Therapeutika sein.
Offenlegungen
Donald Ingber ist Gründer, Vorstandsmitglied, Vorsitzender des wissenschaftlichen Beirats und Anteilseigner von Emulate. Die anderen Autoren erklären, dass sie keine konkurrierenden Interessen haben.
Danksagungen
Diese Forschung wurde von der Bill and Melinda Gates Foundation (INV-035977) und dem Wyss Institute for Biologically Inspired Engineering an der Harvard University finanziert. Wir danken auch Gwenn E. Merry, Wyss Institute, für die Redaktion dieses Manuskripts. Das Diagramm in Abbildung 1 wurde mit BioRender erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µm Steriflip | Millipore | SCGP00525 | To degas media |
| 2 channel chip | Emulate | BRK-S1-WER-24 | Part of the two-channel Chip kit |
| 200 μL barrier tips (or filter tips) | Thomas Scientific, SHARP | 1159M40 | Tips used for chip seeding |
| Activation Reagent 1 (or ER-1 powder) | Emulate | Chip S1 Basic Research kit-24PK | Part of the two-channel Chip kit; Storage temperature -20 °C |
| Activation Reagent 2 (or ER-2 solution) | Emulate | Chip S1 Basic Research kit-24PK | Part of the two-channel Chip kit; Storage temperature 4 °C |
| Adenine | Sigma Aldrich | A2786 | Component of the Differentiation media |
| Brucella blood agar plates | VWR International Inc. | 89405-032 | with Hemin and Vitamin K; For the enumeration of Gardnerella vaginalis |
| Ca2+ and Mg2+ free DPBS (DPBS (-/-) | ScienCell | 303 | For washing cells |
| Calcium Chloride | Sigma Aldrich | C5670 | Component of the Differentiation media |
| Calcium chloride (anhyd.) | Sigma Aldrich | 499609 | Component of HBSS (LB/+G) |
| Collagen I | Corning | 354236 | For the coating solution for HVEC |
| Collagen IV | Sigma Aldrich | C7521 | For the coating solution for HVEC |
| Collagenase IV | Gibco | 17104019 | For the dissociation of cells from the Vagina Chips |
| Complete fibroblast medium | ScienCell | 2301 | Media for the culture of HUF |
| Complete vaginal epithelium medium | Lifeline | LL-0068 | Media for the culture of HVEC |
| D-Glucose (dextrose) | Sigma Aldrich | 158968 | Component of HBSS (LB/+G) |
| DMEM (Low Glucose) | Thermofisher | 12320-032 | Component of the Differentiation media |
| Dynamic Flow Module (or Zoë) | Emulate | Zoë-CM1 | Regulates the flow rate of the chips |
| Ham's F12 | Thermofisher | 11765-054 | Component of the Differentiation media |
| Heat inactivated FBS | Thermofisher | 10438018 | Component of the Differentiation media |
| Human uterine fibroblasts | ScienCell | 7040 | HUF |
| Human vaginal epithelial cells | Lifeline | FC-0083 | HVEC |
| Hydrocortisone | Sigma Aldrich | H0396 | Component of the Differentiation media |
| ITES | Lonza | 17-839Z | Component of the Differentiation media |
| L-glutamine | Thermofisher | 25030081 | Component of the Differentiation media |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | Component of HBSS (LB/+G) |
| Magnesium sulfate heptahydrate | Sigma Aldrich | M1880 | Component of HBSS (LB/+G) |
| MRS agar plates | VWR International Inc. | 89407-214 | For enumeration of Lactobacillus |
| O-phosphorylethanolamine | Sigma Aldrich | P0503 | Component of the Differentiation media |
| Pen/Strep | Thermofisher | 15070063 | Component of the Differentiation media |
| pH strips | Fischer-Scientific | 13-640-520 | For measurement of pH |
| Pods (1/chip) | Emulate | BRK-S1-WER-24 | Part of the two-channel Chip kit |
| Poly-L-lysine | ScienCell | 403 | For the coating solution for HUFs |
| Potassium chloride | Sigma Aldrich | P3911 | Component of HBSS (LB/+G) |
| Potassium phosphate monobasic | Sigma Aldrich | P0662 | Component of HBSS (LB/+G) |
| Sterile 80% glycerol | MP Biomedicals | 113055034 | For freezing bacterial samples |
| Triiodothyronine | Sigma Aldrich | T6397 | Component of the Differentiation media |
| Trypan Blue Solution (0.4%) | Sigma Aldrich | T8154 | For counting live/dead cells |
| TrypLE Express | Thermofisher | 12605010 | For the dissociation of cells from the Vagina Chips |
| Trypsin Neutralizing Solution (TNS) | ScienCell | 113 | For neutralization of Trypsin |
| Trypsin/EDTA Solutiom (0.25%) | ScienCell | 103 | For cell dissociation |
| β-estradiol | Sigma Aldrich | E2257 | Hormone for differentiation media |
Referenzen
- Smith, S. B., Ravel, J. The vaginal microbiota, host defence and reproductive physiology. J Physiol. 595 (2), 451-463 (2017).
- Van De Wijgert, J., Jespers, V. The global health impact of vaginal dysbiosis. Res Microbiol. 168 (9-10), 859-864 (2017).
- Ralph, S. G., Rutherford, A. J., Wilson, J. D. Influence of bacterial vaginosis on conception and miscarriage in the first trimester: Cohort study. BMJ. 319 (7204), 220-223 (1999).
- Goldenberg, R. L., Hauth, J. C., Andrews, W. W. Intrauterine infection and preterm delivery. N Engl J Med. 342 (20), 1500-1507 (2000).
- Han, Y., Liu, Z., Chen, T. Role of vaginal microbiota dysbiosis in gynecological diseases and the potential interventions. Front Microbiol. 12, 643422 (2021).
- Leitich, H., Kiss, H. Asymptomatic bacterial vaginosis and intermediate flora as risk factors for adverse pregnancy outcome. Best Pract Res Clin Obstet Gynaecol. 21 (3), 375-390 (2007).
- Torcia, M. G. Interplay among vaginal microbiome, immune response and sexually transmitted viral infections. Int J Mol Sci. 20 (2), 266 (2019).
- Van Oostrum, N., De Sutter, P., Meys, J., Verstraelen, H. Risks associated with bacterial vaginosis in infertility patients: A systematic review and meta-analysis. Hum Reprod. 28 (7), 1809-1815 (2013).
- Lewis, F. M. T., Bernstein, K. T., Aral, S. O. Vaginal microbiome and its relationship to behavior, sexual health, and sexually transmitted diseases. Obstet Gynecol. 129 (4), 643-654 (2017).
- Hong, X., et al. The association between vaginal microbiota and female infertility: A systematic review and meta-analysis. Arch Gynecol Obstet. 302 (3), 569-578 (2020).
- Peelen, M. J., et al. The influence of the vaginal microbiota on preterm birth: A systematic review and recommendations for a minimum dataset for future research. Placenta. 79, 30-39 (2019).
- Smith, P. P., et al. Outcomes in prevention and management of miscarriage trials: A systematic review. BJOG. 126 (2), 176-189 (2019).
- Harp, D. F., Chowdhury, I. Trichomoniasis: Evaluation to execution. Eur J Obstet Gynecol Reprod Biol. 157 (1), 3-9 (2011).
- Pastorek, J. G., Cotch, M. F., Martin, D. H., Eschenbach, D. A. Clinical and microbiological correlates of vaginal trichomoniasis during pregnancy. The vaginal infections and prematurity study group. Clin Infect Dis. 23 (5), 1075-1080 (1996).
- Petrin, D., Delgaty, K., Bhatt, R., Garber, G. Clinical and microbiological aspects of trichomonas vaginalis. Clin Microbiol Rev. 11 (2), 300-317 (1998).
- Edwards, T., Burke, P., Smalley, H., Hobbs, G. Trichomonas vaginalis: Clinical relevance, pathogenicity and diagnosis. Crit Rev Microbiol. 42 (3), 406-417 (2016).
- Eade, C. R., et al. Identification and characterization of bacterial vaginosis-associated pathogens using a comprehensive cervical-vaginal epithelial coculture assay. PLoS One. 7 (11), e50106 (2012).
- Fichorova, R. N., Yamamoto, H. S., Delaney, M. L., Onderdonk, A. B., Doncel, G. F. Novel vaginal microflora colonization model providing new insight into microbicide mechanism of action. mBio. 2 (6), e00168 (2011).
- Herbst-Kralovetz, M. M., Pyles, R. B., Ratner, A. J., Sycuro, L. K., Mitchell, C. New systems for studying intercellular interactions in bacterial vaginosis. J Infect Dis. 214, S6-S13 (2016).
- Johnson, A. P., et al. A study of the susceptibility of three species of primate to vaginal colonization with gardnerella vaginalis. Br J Exp Pathol. 65 (3), 389-396 (1984).
- Yildirim, S., et al. Primate vaginal microbiomes exhibit species specificity without universal lactobacillus dominance. ISME J. 8 (12), 2431-2444 (2014).
- Edwards, V. L., et al. Three-dimensional models of the cervicovaginal epithelia to study host-microbiome interactions and sexually transmitted infections. Pathog Dis. 80 (1), 026 (2022).
- Zhu, Y., et al. Ex vivo 2D and 3D HSV-2 infection model using human normal vaginal epithelial cells. Oncotarget. 8 (9), 15267-15282 (2017).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infect Immun. 86 (11), e00282 (2018).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cell Mol Gastroenterol Hepatol. 5 (4), 659-668 (2018).
- Jalili-Firoozinezhad, S., et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nat Biomed Eng. 3 (7), 520-531 (2019).
- Valiei, A., Aminian-Dehkordi, J., Mofrad, M. R. K. Gut-on-a-chip models for dissecting the gut microbiology and physiology. APL Bioeng. 7 (1), 011502 (2023).
- Izadifar, Z., et al. Mucus production, host-microbiome interactions, hormone sensitivity, and innate immune responses modeled in human endo- and ecto-cervix chips. bioRxiv. , (2023).
- Mahajan, G., et al. Vaginal microbiome-host interactions modeled in a human vagina-on-a-chip. Microbiome. 10 (1), 201 (2022).
- Masson, L., et al. Inflammatory cytokine biomarkers to identify women with asymptomatic sexually transmitted infections and bacterial vaginosis who are at high risk of HIV infection. Sex Transm Infect. 92 (3), 186-193 (2016).
- Amsel, R., et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med. 74 (1), 14-22 (1983).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten