Method Article
Modélisation de microenvironnements vaginaux sains et dysbiotiques dans un vagin humain sur puce
Dans cet article
Résumé
Cet article décrit un protocole de création d’un dispositif de culture microfluidique de vagin sur puce (Vagina Chip) qui permet d’étudier les interactions de l’hôte humain avec un microbiome vaginal vivant dans des conditions microaérophiles. Cette puce peut être utilisée comme outil pour étudier les maladies vaginales ainsi que pour développer et tester des contre-mesures thérapeutiques potentielles.
Résumé
La santé des femmes, et en particulier les maladies de l’appareil reproducteur féminin, n’a pas reçu l’attention qu’elle mérite, même si un système reproducteur malsain peut entraîner des maladies potentiellement mortelles, l’infertilité ou des résultats défavorables pendant la grossesse. L’un des obstacles dans le domaine est qu’il y a eu une pénurie de modèles précliniques et expérimentaux qui imitent fidèlement la physiologie et la physiopathologie de la TRF. Les modèles in vitro et animaux actuels ne récapitulent pas entièrement les changements hormonaux, les conditions microaérobies et les interactions avec le microbiome vaginal. L’avènement de la technologie de culture microfluidique Organ-on-a-Chip (Organ Chip) qui peut imiter les interfaces tissu-tissu, la perfusion vasculaire, les flux de liquide interstitiel et le microenvironnement physique d’une sous-unité majeure d’organes humains peut potentiellement servir de solution à ce problème. Récemment, une puce vaginale humaine qui soutient la co-culture de consortiums microbiens vaginaux humains avec un épithélium vaginal humain primaire qui est également interfacé avec le stroma vaginal et connaît un flux de fluide dynamique a été développée. Cette puce reproduit les réponses physiologiques du vagin humain aux microbiomes sains et dysbiotiques. Un protocole détaillé pour la création de puces vaginales humaines a été décrit dans cet article.
Introduction
Un microbiome vaginal dominé par Lactobacillus spp. qui aide à maintenir un microenvironnement acide joue un rôle important dans le maintien de la santé reproductive féminine1. Cependant, il peut parfois y avoir un changement dans la composition des communautés microbiennes qui composent le microbiome, ce qui entraîne une augmentation de la diversité des bactéries vaginales. Ces changements dysbiotiques, qui entraînent souvent le passage d’un état dominé par les Lactobacillus à un état dominé par des espèces bactériennes anaérobies plus diversifiées (par exemple, Gardnerella vaginalis), sont associés à diverses maladies du système reproducteur, telles que la vaginose bactérienne, la vaginite atrophique, l’infection des voies urinaires, la candidose vulvovaginale, l’urétrite et la chorioamnionite 2,3,4,5 . Ces maladies, à leur tour, augmentent les chances d’une femme de contracter des maladies sexuellement transmissibles et des maladies inflammatoires pelviennes 6,7,8,9. Ils présentent également un risque plus élevé d’accouchement prématuré et de fausses couches chez les femmes enceintes 10,11,12 et ont également été impliqués dans l’infertilité 13,14,15,16.
Bien que des efforts aient été faits pour modéliser la dysbiose vaginale à l’aide de cellules épithéliales vaginales cultivées dans des systèmes de culture statiques et bidimensionnels (2D)17,18, elles n’imitent pas efficacement la physiologie et la complexité du microenvironnement vaginal19. Des modèles animaux ont également été utilisés pour étudier la dysbiose vaginale ; Cependant, leurs phases menstruelles et leurs interactions hôte-microbiome diffèrent considérablement de celles chez l’homme, et par conséquent, la pertinence physiologique des résultats de ces études reste incertaine 19,20,21. Pour contrer ces problèmes, des modèles d’organoïdes et d’inserts Transwell de tissu vaginal humain ont également été utilisés pour étudier les interactions hôte-pathogène dans le FRT 19,22,23,24. Mais parce qu’il s’agit de cultures statiques, elles ne peuvent soutenir la co-culture de cellules humaines avec des microbes vivants que pendant une courte période de temps (<16-24 h), et elles manquent de nombreuses autres caractéristiques physiques potentiellement importantes du microenvironnement vaginal humain, telles que la production de mucus et l’écoulement des fluides22.
Les puces d’organe sont des systèmes de culture microfluidique tridimensionnels (3D) qui contiennent un ou plusieurs microcanaux creux parallèles tapissés de cellules vivantes cultivées sous un écoulement de fluide dynamique. Les puces à deux canaux permettent de recréer des interfaces tissu-tissu au niveau des organes en cultivant différents types de cellules (par exemple, l’épithélium et les fibroblastes stromaux ou l’épithélium et l’endothélium vasculaire) sur les côtés opposés d’une membrane poreuse qui sépare les deux canaux parallèles (Figure 1). Les deux tissus peuvent être exposés indépendamment à l’écoulement des fluides, et ils peuvent également connaître des conditions microaérobies pour permettre la co-culture avec un microbiome complexe 25,26,27,28. Cette approche a récemment été mise à profit pour développer une puce vaginale humaine tapissée d’un épithélium vaginal primaire sensible aux hormones, interfacé avec des fibroblastes stromaux sous-jacents, qui maintient une faible concentration physiologique d’oxygène dans la lumière épithéliale et permet la co-culture avec des microbiomes sains et dysbiotiques pendant au moins 3 jours in vitro29. Il a été démontré que la puce vaginale pouvait être utilisée pour étudier la colonisation par des consortiums optimaux (sains) de L. crispatus et détecter l’inflammation et les lésions causées par des consortiums non optimaux (non sains) contenant G. vaginalis. Ici, nous décrivons en détail les méthodes utilisées pour créer la puce vaginale humaine ainsi que pour établir des communautés bactériennes saines et dysbiotiques sur la puce.
Protocole
Cette recherche a été réalisée dans le respect des directives institutionnelles pour l’utilisation de cellules humaines. Les cellules ont été obtenues commercialement (voir Tableau des matériaux). Toutes les étapes doivent être effectuées de manière aseptique dans une enceinte de biosécurité (ESB). Utilisez uniquement des pointes de pipette à filtre (ou à barrière) pour ce protocole.
1. Culture de cellules épithéliales vaginales humaines
- Chauffer 50 mL de milieu épithélial vaginal (VEM, voir le tableau des matières) à 37 °C.
- Aliquote de 9 mL de VEM dans un tube de 15 mL. Ensuite, décongelez un flacon de cellules épithéliales vaginales humaines (HVEC) et ajoutez-le dans le tube contenant le VEM.
- Centrifugez le tube de 15 mL à 300 x g pendant 5 min à température ambiante (RT) et aspirez le surnageant en laissant la pastille derrière.
- Remettez doucement la pastille en suspension dans 2 mL de VEM et ajoutez 1 mL dans chacun des deux flacons T75 contenant 14 mL de VEM.
- Incuber les ballons à 37 °C avec 5% de CO2. Changez VEM tous les 2 jours jusqu’à ce que les HVEC soient confluents à environ 70 % (environ 5 jours).
2. Culture de cellules de fibroblastes utérins humains
- Préparer 10 mL de solution de poly-L-lysine (LPL) de 15 μg/mL dans de l’eau distillée deux fois (jjH2O). Ajouter 5 mL de solution PLL dans chacun des deux flacons T75 et incuber à 37 °C pendant 1 h.
- Chauffer 50 mL de milieu fibroblastique (FM, voir le tableau des matériaux) à 37 °C.
- Aspirer la solution PLL et laver chaque flacon avec 5 mL de ddH2O.
- Aliquote de 9 mL de FM dans un tube de 15 mL et décongeler une fiole de fibroblastes utérins humains (HUF).
- Ajouter les HUF dans le tube de 15 mL contenant la FM.
- Centrifuger le tube de 15 mL à 300 x g pendant 5 min à RT et aspirer le surnageant en laissant la pastille cellulaire derrière lui.
- Remettez doucement la pastille en suspension dans 2 mL de FM et ajoutez 1 mL dans chacun des deux flacons T75 contenant 14 mL de FM.
- Incuber les flacons à 37 °C avec 5 % de CO2 jusqu’à ce que les cellules soient confluentes à environ 70 %, tout en changeant de milieu tous les 2 jours.
3. Activation de la puce et revêtement des canaux
- Dégazer les copeaux (obtenus dans le commerce, voir Tableau des matériaux) pendant 30 min dans un dessiccateur sous vide.
- Laissez le réactif d’activation 1 (AR-1) et le réactif d’activation 2 (AR-2) (voir le tableau des matériaux) s’équilibrer en RT pendant 15 minutes sans retirer leur emballage.
- Enveloppez un tube conique de 15 ml dans du papier d’aluminium pour le protéger de la lumière. Ajouter lentement 1 mL de solution AR-2 sur les parois du flacon AR-1 et bien mélanger. Transférer le mélange dans le tube de 15 ml enveloppé d’une feuille d’aluminium.
- Ajouter à plusieurs reprises la solution AR-2 dans le flacon AR-1 par incréments de 1 ml jusqu’à ce que la poudre AR-1 soit complètement lavée du flacon.
- Complétez la solution reconstituée d’AR-1 à 10 mL avec la solution AR-2.
- Ajouter 200 μL de cette solution à l’entrée du canal apical de chaque puce tout en aspirant à partir de la sortie (figure 1A). Répétez l’opération pour le canal basal. Gardez la pipette perpendiculaire à la puce tout en ajoutant la solution pour maintenir une étanchéité avec un écoulement non obstrué.
- Répétez l’étape 3.6 pour toutes les puces.
- Vérifiez tous les jetons pour les bulles. Éliminez toutes les bulles en ajoutant plus de solution au(x) canal(s) affecté(s).
- Aspirez tout excès de solution AR-1 de la surface de la puce tout en évitant les entrées et sorties de canaux.
- Placez les copeaux dans une boîte de Pétri de 150 mm et insérez cette parabole non couverte dans une boîte à lumière UV.
- Placez le caisson de lumière UV à l’arrière du BSC et laissez les copeaux sous une lumière UV constante pendant 30 min. La couleur de la solution dans les copeaux passera du rose foncé à l’acajou.
- Lavez chaque canal en ajoutant 200 μL de solution AR-2 à l’entrée tout en aspirant simultanément à partir de la sortie.
- Lavez chaque canal deux fois en ajoutant 200 μL de DPBS froid (-/-) à l’entrée tout en aspirant simultanément par la sortie.
- Préparez l’enrobage du canal apical (200 μg/mL de collagène I et 30 μg/mL de collagène IV dans du DMEM) (voir le tableau des matériaux). Restez sur la glace.
- Préparez l’enrobage du canal basal (15 μg/mL de PLL et 200 μg/mL de collagène I dans du DMEM). Restez sur la glace.
- Ajouter 200 μL de revêtement du canal basal à l’entrée du canal basal. Branchez la prise avec un embout P200 lorsque la solution de revêtement apparaît à la sortie. Distribuez la solution jusqu’à ce que les volumes des pointes d’entrée et de sortie soient égaux, puis relâchez la pointe de la pipette de la pipette, en laissant la pointe dans l’entrée.
- De même, ajoutez 200 μL de revêtement de canal apical au canal apical.
- Aspirez l’excès de solution de la surface de la puce.
- Vérifiez tous les jetons pour les bulles. Éliminez toutes les bulles en ajoutant plus de revêtement de canal au(x) canal(s) affecté(s).
- Incuber les copeaux pendant la nuit dans une boîte de Pétri de 150 mm à 37 °C avec 5 % de CO2.
4. Canal basal de puces d’ensemencement avec HUFs
- Observez quotidiennement la croissance des HUF dans le flacon au microscope.
- Une fois que les cultures HUF sont confluentes à 70 % à 90 % (~3 jours après le placage), réchauffez 25 mL de FM, 5 mL de Ca2+/Mg2+ de DPBS libre (DPBS (-/-), 10 mL de trypsine/EDTA et 15 mL de solution neutralisante de trypsine (TNS, voir le tableau des matériaux) à 37 °C.
- Aspirer le milieu des flacons. Laver avec 5 mL de DPBS (-/-), puis aspirer à nouveau.
- Ajouter 4 mL de trypsine-EDTA dans chaque fiole et incuber à 37 °C pendant 3 à 5 minutes jusqu’à ce que les cellules se détachent.
- Ajouter 6 mL de TNS dans chaque fiole et transférer la suspension cellulaire dans un tube conique de 15 mL.
- Bien mélanger la suspension à l’aide d’une pipette et prélever une aliquote de 10 μL pour le comptage des cellules. Mélangez 10 μL de suspension cellulaire avec 10 μL de bleu de trypan et comptez à l’aide d’un hémocytomètre.
- Suspension de cellule de centrifugation à 300 x g pendant 5 min à RT. Aspirer le surnageant et remettre en suspension la pastille dans de la FM chaude jusqu’à une concentration finale de 7,5 x 105 cellules/mL.
- Laver le canal basal avec 200 μL de FM.
- Chauffer 15 mL de VEM à 37 °C. Laver le canal apical avec 200 μL de VEM.
- Ajoutez 200 μL de VEM complet à l’entrée du canal apical tout en bouchant la sortie avec une pointe de pipette. Distribuez le fluide jusqu’à ce que les volumes des pointes d’entrée et de sortie soient égaux, puis libérez la pointe de la pipette de la pipette en laissant la pointe dans l’entrée. Gardez le canal supérieur rempli et bouché à l’entrée et à la sortie.
- Pipeter lentement 50 μL de suspension de cellules HUF dans l’entrée du canal basal tout en aspirant simultanément par la sortie. Retirez la pointe de la pipette de l’entrée lorsque ~2 μL de suspension cellulaire restent dans la pointe de la pipette sans appuyer sur le piston de la pipette ni le relâcher pour éviter la formation de bulles. Branchez l’entrée et la sortie avec des pointes de pipette.
- Vérifiez la présence de bulles au microscope. S’ils sont présents, lavez le canal basal avec FM et répétez l’étape 4.11.
- Retournez les copeaux bouchés sur un support tubulaire de 15 ml et incubez à 37 °C avec 5 % de CO2 pendant 1 h. Observez les puces après l’incubation et vérifiez qu’elles ne sont pas attachées.
- Bouchez la sortie du canal basal avec une pointe de pipette. Ajoutez 200 μL de FM à l’entrée du canal basal sans appuyer sur le piston de la pipette. Libérez la pointe de la pipette et laissez le fluide s’écouler librement à travers le canal jusqu’à la pointe de sortie de la pipette par écoulement gravitationnel.
- Incuber les copeaux ensemencés en HUF pendant la nuit à 37 °C avec 5 % de CO2.
5. Canal apical de puce d’ensemencement avec des cellules épithéliales vaginales
- Chauffer 50 mL de VEM à 37 °C.
- Préparer l’enrobage des canaux apicaux (200 μg/mL de collagène I dans du DMEM). Restez sur la glace.
- Bouchez la sortie du canal apical avec une pointe de pipette.
- Ajouter 200 μL de revêtement du canal apical à l’entrée du canal apical. Distribuez la solution de revêtement apical jusqu’à ce que les volumes des pointes d’entrée et de sortie soient égaux, puis relâchez la pointe de la pipette de la pipette, en laissant la pointe dans l’entrée.
- Aspirez l’excès de solution de la surface de la puce.
- Incuber les copeaux à 37 °C avec 5% de CO2 pendant 1 h.
- Après 1 h, laver le revêtement du canal apical en ajoutant 200 μL de VEM à l’entrée du canal apical tout en aspirant par la sortie.
- Vérifiez la croissance du HVEC au microscope pour une confluence de ~70 % à 90 %.
- Si les cellules sont confluentes de 70 à 90 %, réchauffez 6 mL de milieu cellulaire épithélial vaginal complet et 4 mL de trypsine/EDTA par flacon, à 37 °C.
- Aspirer le milieu de la fiole HVEC et laver avec 5 mL de DPBS (-/-), puis aspirer.
- Ajouter 4 mL de trypsine dans chaque fiole et incuber à 37 °C avec 5 % de CO2 pendant 3 à 5 minutes jusqu’à ce que les cellules se détachent.
- Ajouter 6 mL de VEM dans la fiole pour inactiver la trypsine et transférer la suspension cellulaire dans un tube conique de 15 mL.
- Bien mélanger la suspension à l’aide d’une pipette et prélever une aliquote de 10 μL pour le comptage des cellules. Mélangez 10 μL de suspension cellulaire avec 10 μL de bleu de trypan et comptez à l’aide d’un hémocytomètre.
- Suspension de cellule de centrifugation à 300 x g pendant 5 min à RT. Aspirer le surnageant et remettre en suspension la pastille dans VEM jusqu’à une concentration finale de 3,5 à 4 millions de cellules/mL.
- Chauffer 25 mL de FM à 37 °C.
- Bouchez la sortie du canal apical avec une pointe de pipette. Pipeter lentement au moins 40 μL de suspension de cellules HVEC dans l’entrée du canal apical. Distribuez la suspension cellulaire jusqu’à ce que les volumes des pointes d’entrée et de sortie soient égaux, puis libérez la pointe de la pipette de la pipette en laissant la pointe dans l’entrée. Gardez le canal basal rempli de FM et branché à l’entrée et à la sortie.
- Aspirez soigneusement l’excès de fluide à la surface des copeaux et vérifiez la présence de bulles au microscope. S’ils sont présents, répétez l’étape 5.16.
- Placez les copeaux dans une grande boîte de Pétri et incubez à 37 °C avec 5 % de CO2 pendant la nuit.
- Le lendemain, observez les puces au microscope pour la fixation des cellules.
- Retirez les pointes de pipette des entrées et des sorties des canaux apical et basal.
- Bouchez la sortie du canal basal à l’aide d’une pointe de pipette et ajoutez 200 μL de FM à l’entrée du canal basal sans appuyer sur le piston de la pipette. Libérez la pointe de la pipette de la pipette et laissez le fluide s’écouler librement à travers le canal jusqu’à la pointe de sortie de la pipette par écoulement gravitationnel.
- Répétez l’étape 5.21 pour le canal apical à l’aide de VEM.
- Incuber les copeaux ensemencés en deux à 37 °C avec 5% de CO2 pendant 24 h.
6. Connecter les puces aux pods et différencier les cellules épithéliales vaginales
- Aliquote 50 mL de FM et VEM pour séparer les tubes coniques de 50 mL et les réchauffer à 37 °C.
- Dégazer les milieux FM et VEM chauffés à 37 °C sous vide stérile pendant 5 min.
- Désinfectez et nettoyez les plateaux pour le module de débit dynamique (DFM, voir tableau des matériaux). Retirez les gousses de l’emballage et placez-les dans les plateaux.
- Ajouter 2 mL de VEM dégazé dans le réservoir d’entrée apical (réservoir en haut à droite ; Figure 1B). Ajoutez du fluide le long des parois du réservoir pour éviter la formation de bulles.
- Ajouter 3 mL de FM dégazé dans le réservoir d’entrée basal (réservoir en haut à gauche, figure 1B). Ajoutez du fluide le long des parois du réservoir pour éviter la formation de bulles.
- Ajouter 500 μL de VEM dégazé dans le réservoir de sortie apicale (réservoir en bas à droite, figure 1B). Inclinez le pod de manière à ce que le fluide recouvre toute la surface inférieure du réservoir.
- Ajouter 500 μL de FM dégazé dans le réservoir de sortie basale (réservoir inférieur gauche, figure 1B). Inclinez le pod de manière à ce que le fluide recouvre toute la surface inférieure du réservoir.
- Faites glisser les plateaux contenant les dosettes dans DFM et exécutez le cycle Prime deux fois. Vérifiez qu’il n’y a pas de gouttelettes qui sortent des orifices situés sous chaque dosette.
- Si aucune gouttelette ne se forme après 4 cycles « Amorcer », entrez en contact direct avec l’orifice situé à l’intérieur du réservoir de sortie de la dosette (Figure 1B) et pipetez 200 μL du fluide concerné pour permettre au fluide de s’écouler entre le réservoir et le canal. C’est ce qu’on appelle le « Hand-priming ».
- Retirez les pointes de pipette des puces et placez une gouttelette de fluide respective sur tous les ports de chaque puce.
- Glissez les copeaux dans les gousses et placez-les sur des plateaux.
- Aspirez tout support à la surface des puces et glissez chaque plateau dans un DFM.
- Réglez les paramètres suivants sur le DFM comme suit : Haut et Bas - Liquide ; Débit apical (canal supérieur) - 15 μL/h ; Débit basal (canal inférieur) - 30 μL/h ; Étirement = 0 % ; Fréquence = 0 Hz.
- Exécutez le cycle de régulation sur le DFM et laissez couler pendant la nuit.
- Après 24 h, modifiez les paramètres de débit à 0 μL/h pour le canal apical et maintenez le canal basal à un débit de 30 μL/h pendant 24 h supplémentaires.
- Préparez 500 ml de milieu de différenciation (MS) en ajoutant 4 mM de L-glutamine, 20 mM d’hydrocortisone, 1x ITES, 20 nM de triiodothyronine, 100 μM d’O-phosphoryléthanolamine, 180 μM d’adénine, 3,2 mM de chlorure de calcium, 2 % de FBS inactivé par la chaleur, 1 % de Pen-strep et 120 ml de milieu F-12 de Ham à du DMEM à faible teneur en glucose (voir le tableau des matériaux), et filtrez-stériliser.
- Réchauffer 50 mL de MS à 37 °C.
- Ajouter 20 μL d’œstradiol 10 μM (voir le tableau des matières) aux 50 mL de MS, bien mélanger et dégazer sous vide stérile pendant 5 min.
- Chauffer 50 mL de VEM à 37 °C dans un bain-marie et dégazer sous vide stérile pendant 5 min.
- Retirez les plateaux du DFM, placez-les dans un BSC et aspirez le média des gousses, en évitant les orifices dans les réservoirs (Figure 1A). Ensuite, ajoutez 2 mL de VEM dans le réservoir d’entrée du canal apical et 3 mL de MS dans le réservoir d’entrée du canal basal.
- Remettez les plateaux dans le DFM et réglez le débit du canal apical à 15 μL/h et le débit du canal basal à 30 μL/h.
- Laissez le DFM couler pendant 4 à 7 h. Ensuite, arrêtez l’écoulement du canal apical en le réglant à 0 μL/h. Laisser le débit du canal basal se poursuivre à 30 μL/h.
- Changez de support en suivant les étapes 6.16 à 6.19 toutes les 48 h.
- Écoulement intermittent du milieu dans le canal apical pendant 4 à 7 h chaque jour pendant 5 jours supplémentaires en suivant les étapes 6.20-6.21.
- Préparez une solution saline équilibrée de Hanks à faible pouvoir tampon avec du glucose (HBSS (LB/+G)) en ajoutant 1,26 mM de chlorure de calcium, 0,49 mM de chlorure de magnésium hexahydraté, 0,406 mM de sulfate de magnésium, 5,33 mM de chlorure de potassium, 137,93 mM de chlorure de sodium, 0,441 mM de phosphate de potassium monobasique et 5,55 mM de D-glucose à dd H2O (voir le tableau des matériaux) ; pH 4,8.
- Préparez 500 ml de DM sans Pen-Strep en ajoutant 4 mM de L-glutamine, 20 mM d’hydrocortisone, 1x ITES, 20 nM de triiodothyronine, 100 μM d’O-phosphoryléthanolamine, 180 μM d’adénine, 3,2 mM de chlorure de calcium, 2% de FBS inactivé par la chaleur et 120 ml de milieu F-12 de Ham à du DMEM à faible teneur en glucose, et filtrez-stériliser.
- Le jour 6, remplacez le milieu de canal apical par (HBSS (LB/+G)) et le milieu de canal basal par un DM sans Pen-Strep en suivant les étapes 6.16-6.19.
- Régler le débit sur le DFM à 15 μL/h pour le canal apical et à 30 μL/h pour le canal basal pendant 24 h avant de procéder à l’inoculation bactérienne.
7. Inoculation bactérienne de puces différenciées
REMARQUE : Effectuez les étapes suivantes dans un laboratoire et un ESB conformes à la réglementation sur la manipulation des microbes.
- Calculer l’UFC/mL de chaque souche bactérienne à inclure dans l’inoculum. Mélanger la quantité requise de chaque souche bactérienne pour obtenir un total de ~5 x 106 UFC/mL.
- Centrifuger le mélange à 7 000 x g pendant 7 min à 4 °C et retirer délicatement le surnageant. Remettre le granulé en suspension (HBSS (LB/+G)). Il s’agira de l’inoculum bactérien.
- Détachez les copeaux des gousses. Bouchez la sortie du canal basal à l’aide d’une pointe de pipette et ajoutez 200 μL de DM sans Pen-Strep à l’entrée du canal basal sans appuyer sur le piston de la pipette. Libérez la pointe de la pipette de la pipette et laissez le fluide s’écouler librement à travers le canal jusqu’à la sortie par écoulement gravitationnel.
- Ajouter 37 μL de l’inoculum bactérien à l’entrée du canal apical, tout en aspirant par la sortie. Lorsqu’il reste environ 2 μL dans la pointe de la pipette, tirez la pointe vers l’extérieur et bouchez l’entrée et la sortie du canal apical avec les pointes de la pipette.
- Pour les puces témoins (non inoculées), répéter l’étape 7.4 avec 37 μL de (HBSS (LB/+G)).
- Aspirez tout support à la surface de la puce. Placez les copeaux dans une boîte de Pétri de 150 mm et incubez à 37 °C avec 5% de CO2 pendant 24 h.
- Placez les gousses (sans copeaux) sur les plateaux et placez-les dans l’incubateur à 37 °C avec 5% de CO2 pendant 24 h.
- Chauffer 50 mL de (HBSS (LB/+G)) et 50 mL de MS sans pen-streptocoque à 37 °C.
- Ajouter 20 μL d’œstradiol 10 μM aux 50 mL de DM sans Pen-Strep, bien mélanger et dégazer sous vide stérile pendant 5 min. Dégazer le (HBSS (LB/+G)) sous vide pendant 5 min.
- Aspirez soigneusement le média dans les dosettes tout en évitant les orifices d’entrée et de sortie du réservoir.
- Ajouter 3 mL de dégazé (HBSS (LB/+G)) dans le réservoir de la gousse d’entrée apicale et 500 μL de dégazé (HBSS (LB/+G)) dans le réservoir de la gousse de sortie apicale.
- Ajouter 3 ml de DM dégazé sans Pen-Strep dans le réservoir de la capsule d’entrée basale et 500 μL de DM dégazé sans antibiotiques dans le réservoir de la capsule de sortie basale.
- Glissez les plateaux avec les dosettes (sans les puces) dans le DFM et exécutez le cycle Prime deux fois. Vérifiez qu’il n’y a pas de gouttelettes sortant de chaque port sur la face inférieure de la gousse.
REMARQUE : Si aucune gouttelette ne se forme après 4 cycles « Amorcer », entrez en contact direct avec l’orifice situé à l’intérieur du réservoir de sortie de la dosette (Figure 1B) et pipetez 200 μL du fluide concerné pour permettre au fluide de s’écouler entre le réservoir et le canal. - Retirez les pointes de pipette des puces et placez une gouttelette de support respectif sur toutes les entrées et sorties du canal.
- Glissez les copeaux dans les gousses et placez les gousses dans les plateaux.
- Aspirez les fluides dans les réservoirs des gousses de sortie apicale et basale et tout milieu à la surface des copeaux. Ensuite, glissez les plateaux dans le DFM.
- Réglez les paramètres suivants sur le DFM : Haut et Bas - Liquide ; Débit apical (supérieur) - 40 μL/h ; Débit basal (inférieur) - 40 μL/h ; Étirement - 0% ; Fréquence - 0 Hz. Exécutez le cycle Régulation .
- Arrêter l’écoulement au bout de 4 h et recueillir l’effluent, c’est-à-dire le milieu dans les réservoirs de sortie apicale et basale.
- Mesurer et consigner les volumes d’effluents.
- Remettez les copeaux dans le DFM et réglez le débit apical à 0 μL/h et le débit basal à 30 μL/h. Démarrez le flux pour qu’il s’exécute pendant la nuit.
- Aliquote l’effluent collecté pour divers essais planifiés et stockez-le à des températures appropriées.
REMARQUE : Pour la mesure des UFC, ajoutez du glycérol à une concentration finale de 16% et stockez-le immédiatement à -80 °C. - Aspirer le fluide uniquement dans les réservoirs de sortie basale et régler les débits apical et basal à 40 μL/h dans le DFM. Démarrez le flux pendant 4 h et répétez les étapes 7.18-7.21. Il s’agira de la collecte des effluents pendant 48 h.
- Répétez l’étape 7.22 pendant 72 h ou jusqu’à la fin de l’expérience.
- À la fin de l’expérience, prélever les effluents en suivant les étapes 7.18-7.19.
- Préparez la solution de digestion en ajoutant 1 mg/mL de collagénase IV dans TrypLE express. Réchauffer 10 mL de solution de digestion à 37 °C.
- Bouchez l’orifice de sortie du canal basal à l’aide d’une pointe de pipette. Ajouter 100 μL de solution de digestion dans le canal basal. Mélangez bien et, à l’aide d’une pipette, recueillez toute la solution du canal dans un tube étiqueté « Tube B ».
- Bouchez l’orifice de sortie du canal apical à l’aide d’une pointe de pipette. Ajouter 100 μL de solution de digestion dans le canal apical. Mélangez bien et, à l’aide d’une pipette, recueillez toute la solution du canal dans un tube étiqueté « Tube A ».
- Ajoutez encore 100 μL de la solution de digestion aux entrées des canaux apical et basal tout en bouchant les sorties avec des pointes de pipette. Incuber les copeaux et les tubes A et B à 37 °C pendant 1 à 1,5 h.
- Bien mélanger le contenu de la digestion à l’intérieur des canaux à l’aide des embouts bouchés déjà placés dans les entrées et les sorties. Recueillir le contenu des canaux apical et basal vers les tubes A et B, respectivement. Il s’agit des digestes apicales et basales de la puce.
- Comptez les cellules du tube A à l’aide d’un hémocytomètre. De plus, retirez une aliquote des digests de puce pour la mesure CFU en suivant l’étape 7.21.
8. Analyse des effluents et des digestats de copeaux
- Pour le dénombrement des bactéries dans les effluents et les digestes, diluer en série les effluents ou les digestes dans des DPBS stériles (-/-) et les déposer sur une plaque de milieu appropriée, incuber à 37 °C pendant 24 à 48 h et compter les colonies sur la plaque.
- Pour mesurer le pH, prélever 10 μL de l’effluent de 72 h immédiatement après le prélèvement et mesurer le pH de l’effluent à l’aide d’une bandelette de pH.
- Pour l’analyse des cytokines, utilisez les effluents pour détecter des cytokines spécifiques à l’aide d’un test basé sur Luminex, d’ELISA ou de toute autre technique applicable29,30.
Résultats
Le vagin humain est tapissé d’un épithélium stratifié qui recouvre un stroma collagène riche en fibroblastes. Pour modéliser cela, une interface tissulaire a été créée en cultivant de l’épithélium vaginal humain primaire et des fibroblastes sur les côtés opposés d’une membrane poreuse commune au sein d’un dispositif de puce d’organe microfluidique à deux canaux. La formation de l’épithélium vaginal est surveillée à l’aide d’une imagerie microscopique à champ clair, qui révèle la formation d’une feuille continue de cellules qui forme progressivement plusieurs couches cellulaires (Figure 2A). Des rapports antérieurs ont confirmé que cette morphologie est en corrélation avec le développement d’un épithélium entièrement stratifié lorsqu’on l’observe en coupe transversale29. Cependant, si la couche épithéliale semble inégale et discontinue (figure 2B), la puce vaginale peut ne pas être adaptée à une utilisation dans des expériences.
La figure 3 montre une représentation schématique de la génération de la puce vaginale. Pour valider la fonctionnalité de la puce vaginale, les puces ont été inoculées avec L. crispatus et G. vaginalis pour modéliser des environnements vaginaux sains et dysbiotiques, respectivement. G. vaginalis est la bactérie principalement impliquée dans la vaginose bactérienne. Pour vérifier si des bactéries saines et dysbiotiques se greffent sur les puces vaginales, la charge bactérienne a été quantifiée dans les puces vaginales inoculées avec les différentes populations bactériennes par des effluents de canaux de placage et des couches cellulaires digérées sur des milieux de croissance bactérienne sélectifs (gélose De Man-Rogosa-Sharpe (MRS) pour L. crispatus et gélose au sang Brucella (BBA) pour G. vaginalis) (voir la table des matériaux) et en les comparant à des cultures similaires en utilisant l’inoculum d’origine. Des colonies de L. crispatus et de G. vaginalis ont été détectées dans les 48 h suivant la mise en plaques (figure 2C), confirmant que des bactéries saines et dysbiotiques étaient greffées dans les puces vaginales. Cependant, si des colonies bactériennes sont observées sur les plaques contenant les inoculums, mais pas sur les plaques contenant l’effluent ou la digestion après l’incubation requise, on peut conclure que les bactéries ne se sont pas greffées.
Un environnement vaginal sain est acide et la dysbiose entraîne une augmentation du pH vaginalde 31. Par conséquent, le pH de l’effluent du canal épithélial apical de la puce vaginale a également été analysé. Le pH des puces vaginales inoculées avec L. crispatus était semblable à celui des puces témoins non inoculées, et lorsqu’elles ont été cultivées conjointement avec G. vaginalis , elles ont présenté une augmentation significative du pH (figure 2D). Si le pH d’une puce vaginale non infectée est élevé, cela indique qu’il y a un problème et que ces puces ne doivent pas être utilisées pour des expériences.
L’état inflammatoire du tissu vaginal est également sensible à la composition du microbiome vaginal, avec un microbiome dysbiotique stimulant l’inflammation. Lors de l’analyse des cytokines pro-inflammatoires dans le canal apical de la puce vaginale 3 jours après l’inoculation avec L. crispatus ou G. vaginalis, la réponse pro-inflammatoire s’est également avérée plus élevée avec G. vaginalis par rapport aux puces non infectées et aux puces inoculées avec L. crispatus (Figure 2E). Pris ensemble, ces résultats montrent que la puce vaginale imite étroitement le microenvironnement vaginal humain dans les états sains et dysbiotiques.
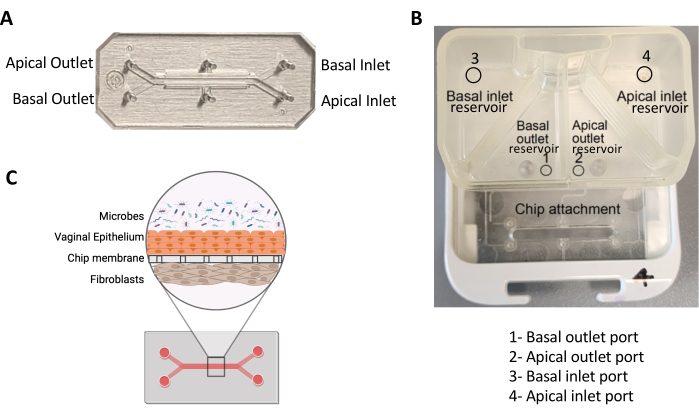
Figure 1 : Puce à deux canaux et son pod. (A) Image d’une puce PDMS à deux canaux illustrant ses canaux et ses ports. (B) Image d’un groupe illustrant les réservoirs et les orifices des canaux apical et basal. (C) Schéma montrant la vue en coupe transversale d’une puce vaginale infectée par des microbes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : La puce vaginale imite les microenvironnements vaginaux humains sains et dysbiotiques. (A) Cellules épithéliales vaginales dans le canal apical d’une puce vaginale robuste. La barre d’échelle représente 1 mm de la puce dans l’image du haut et 500 μm dans l’image du bas. (B) Cellules épithéliales vaginales dans le canal apical d’une puce vaginale inadéquate. La barre d’échelle représente 1 mm de la puce dans l’image du haut et 500 μm dans l’image du bas. (c) Greffe de L. crispatus (LC) et de G. vaginalis (GV) dans la puce vaginale. (D) pH des puces vaginales après 72 h d’incubation avec L. crispatus (LC) et G. vaginalis (GV) par rapport aux puces vaginales non infectées (témoins). (E) Réponse pro-inflammatoire des puces vaginales à L. crispatus (LC) et G. vaginalis (GV) après 72 h d’incubation, par rapport aux puces vaginales non infectées (témoins). (C-E) Les graphiques illustrent la moyenne ± SD pour 4 à 6 puces ; *p < 0,05, **p < 0,01, ***p < 0,001 par rapport aux puces vaginales de contrôle ; Chaque (●) représente les données d'1 puce. Veuillez cliquer ici pour voir une version agrandie de cette figure.
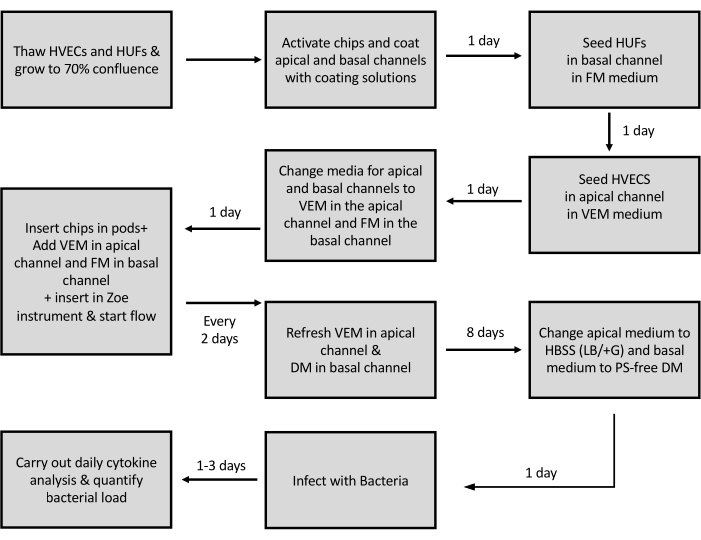
Figure 3 : Représentation schématique du protocole de génération de la puce vaginale. Représentation schématique des étapes impliquées dans l’ensemencement des cellules et la génération de la puce vaginale. HVEC - Cellules épithéliales vaginales humaines ; HUFs - Fibroblastes utérins humains ; VEM - Milieu épithélial vaginal ; FM - Média fibroblastique ; DM - Milieu de différenciation ; PS - Pénicilline Streptomycine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les modèles in vitro antérieurs du vagin humain ne reproduisent pas fidèlement les structures des tissus vaginaux, le flux de fluides et les interactions hôte-pathogène19,22. Les modèles animaux sont également limités par les variations inter-espèces du microbiome et les différences dans le cycle œstral ou menstruel19,22. Ce manuscrit décrit un protocole permettant de créer un modèle de puce d’organe du vagin humain capable d’imiter efficacement les réponses humaines aux communautés microbiennes saines et dysbiotiques.
Ce protocole consiste à ensemencer des cellules épithéliales vaginales et des fibroblastes sur les côtés opposés d’une membrane poreuse partagée qui sépare les microcanaux parallèles dans un dispositif de puce d’organe à deux canaux disponible dans le commerce (voir le tableau des matériaux). La membrane poreuse permet la migration des facteurs de croissance et d’autres formes de communication intercellulaire. Cependant, le revêtement de collagène et la présence de monocouches cellulaires empêchent le mélange des médias entre les canaux. Lors de la formation d’une monocouche de cellules épithéliales vaginales dans le canal apical, des facteurs de différenciation sont introduits dans le milieu circulant dans le canal basal, qui traverse l’espace interstitiel et favorise ainsi la différenciation des cellules épithéliales vaginales pour former un épithélium stratifié. La densité des cellules épithéliales vaginales au moment de l’ensemencement est un déterminant crucial de la santé de la puce vaginale à la fin de la phase de différenciation. Ainsi, la densité des cellules épithéliales vaginales doit être évaluée avant d’initier la différenciation, qui ne doit pas être initiée tant qu’une monocouche n’est pas établie. L’exposition aux facteurs de différenciation peut être poursuivie jusqu’à ce que la densité souhaitée des cellules épithéliales vaginales soit obtenue et avant l’inoculation bactérienne. De plus, il convient de noter que le taux de croissance peut varier pour les cellules épithéliales vaginales primaires provenant de différents donneurs (ou sources commerciales), ce qui pourrait affecter la qualité de la puce vaginale générée. Dans toutes les études microfluidiques sur les puces d’organes, il est de la plus haute importance d’éliminer toutes les bulles qui pourraient se former dans les canaux de la culture de puces, car elles interfèrent avec l’écoulement du milieu et finiront par entraîner une réduction de la disponibilité des nutriments et une perte de viabilité cellulaire.
Ce protocole décrit également comment utiliser la puce vaginale pour établir des communautés bactériennes sur puce qui imitent soit l’état vaginal sain, soit la vaginose bactérienne. La puce vaginale peut également être utilisée pour étudier d’autres maladies ou troubles vaginaux ; Cependant, il faut prendre soin de comprendre les caractéristiques de chaque maladie et les meilleurs moyens de corréler les résultats avec les signes cliniques lors de la réalisation de ces études. En résumé, la puce vaginale humaine ouvre de nouvelles voies pour étudier une pléthore de maladies et d’affections liées à la TRF, et elle peut être un outil précieux pour étudier des thérapies potentielles.
Déclarations de divulgation
Donald Ingber est fondateur, membre du conseil d’administration, président du conseil consultatif scientifique et actionnaire d’Emulate. Les autres auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Cette recherche a été financée par la Fondation Bill et Melinda Gates (INV-035977) et le Wyss Institute for Biologically Inspired Engineering de l’Université Harvard. Nous remercions également Gwenn E. Merry, de l’Institut Wyss, pour l’édition de ce manuscrit. Le diagramme de la figure 1 a été créé avec BioRender.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm Steriflip | Millipore | SCGP00525 | To degas media |
| 2 channel chip | Emulate | BRK-S1-WER-24 | Part of the two-channel Chip kit |
| 200 μL barrier tips (or filter tips) | Thomas Scientific, SHARP | 1159M40 | Tips used for chip seeding |
| Activation Reagent 1 (or ER-1 powder) | Emulate | Chip S1 Basic Research kit-24PK | Part of the two-channel Chip kit; Storage temperature -20 °C |
| Activation Reagent 2 (or ER-2 solution) | Emulate | Chip S1 Basic Research kit-24PK | Part of the two-channel Chip kit; Storage temperature 4 °C |
| Adenine | Sigma Aldrich | A2786 | Component of the Differentiation media |
| Brucella blood agar plates | VWR International Inc. | 89405-032 | with Hemin and Vitamin K; For the enumeration of Gardnerella vaginalis |
| Ca2+ and Mg2+ free DPBS (DPBS (-/-) | ScienCell | 303 | For washing cells |
| Calcium Chloride | Sigma Aldrich | C5670 | Component of the Differentiation media |
| Calcium chloride (anhyd.) | Sigma Aldrich | 499609 | Component of HBSS (LB/+G) |
| Collagen I | Corning | 354236 | For the coating solution for HVEC |
| Collagen IV | Sigma Aldrich | C7521 | For the coating solution for HVEC |
| Collagenase IV | Gibco | 17104019 | For the dissociation of cells from the Vagina Chips |
| Complete fibroblast medium | ScienCell | 2301 | Media for the culture of HUF |
| Complete vaginal epithelium medium | Lifeline | LL-0068 | Media for the culture of HVEC |
| D-Glucose (dextrose) | Sigma Aldrich | 158968 | Component of HBSS (LB/+G) |
| DMEM (Low Glucose) | Thermofisher | 12320-032 | Component of the Differentiation media |
| Dynamic Flow Module (or Zoë) | Emulate | Zoë-CM1 | Regulates the flow rate of the chips |
| Ham's F12 | Thermofisher | 11765-054 | Component of the Differentiation media |
| Heat inactivated FBS | Thermofisher | 10438018 | Component of the Differentiation media |
| Human uterine fibroblasts | ScienCell | 7040 | HUF |
| Human vaginal epithelial cells | Lifeline | FC-0083 | HVEC |
| Hydrocortisone | Sigma Aldrich | H0396 | Component of the Differentiation media |
| ITES | Lonza | 17-839Z | Component of the Differentiation media |
| L-glutamine | Thermofisher | 25030081 | Component of the Differentiation media |
| Magnesium chloride hexahydrate | Sigma Aldrich | M2393 | Component of HBSS (LB/+G) |
| Magnesium sulfate heptahydrate | Sigma Aldrich | M1880 | Component of HBSS (LB/+G) |
| MRS agar plates | VWR International Inc. | 89407-214 | For enumeration of Lactobacillus |
| O-phosphorylethanolamine | Sigma Aldrich | P0503 | Component of the Differentiation media |
| Pen/Strep | Thermofisher | 15070063 | Component of the Differentiation media |
| pH strips | Fischer-Scientific | 13-640-520 | For measurement of pH |
| Pods (1/chip) | Emulate | BRK-S1-WER-24 | Part of the two-channel Chip kit |
| Poly-L-lysine | ScienCell | 403 | For the coating solution for HUFs |
| Potassium chloride | Sigma Aldrich | P3911 | Component of HBSS (LB/+G) |
| Potassium phosphate monobasic | Sigma Aldrich | P0662 | Component of HBSS (LB/+G) |
| Sterile 80% glycerol | MP Biomedicals | 113055034 | For freezing bacterial samples |
| Triiodothyronine | Sigma Aldrich | T6397 | Component of the Differentiation media |
| Trypan Blue Solution (0.4%) | Sigma Aldrich | T8154 | For counting live/dead cells |
| TrypLE Express | Thermofisher | 12605010 | For the dissociation of cells from the Vagina Chips |
| Trypsin Neutralizing Solution (TNS) | ScienCell | 113 | For neutralization of Trypsin |
| Trypsin/EDTA Solutiom (0.25%) | ScienCell | 103 | For cell dissociation |
| β-estradiol | Sigma Aldrich | E2257 | Hormone for differentiation media |
Références
- Smith, S. B., Ravel, J. The vaginal microbiota, host defence and reproductive physiology. J Physiol. 595 (2), 451-463 (2017).
- Van De Wijgert, J., Jespers, V. The global health impact of vaginal dysbiosis. Res Microbiol. 168 (9-10), 859-864 (2017).
- Ralph, S. G., Rutherford, A. J., Wilson, J. D. Influence of bacterial vaginosis on conception and miscarriage in the first trimester: Cohort study. BMJ. 319 (7204), 220-223 (1999).
- Goldenberg, R. L., Hauth, J. C., Andrews, W. W. Intrauterine infection and preterm delivery. N Engl J Med. 342 (20), 1500-1507 (2000).
- Han, Y., Liu, Z., Chen, T. Role of vaginal microbiota dysbiosis in gynecological diseases and the potential interventions. Front Microbiol. 12, 643422 (2021).
- Leitich, H., Kiss, H. Asymptomatic bacterial vaginosis and intermediate flora as risk factors for adverse pregnancy outcome. Best Pract Res Clin Obstet Gynaecol. 21 (3), 375-390 (2007).
- Torcia, M. G. Interplay among vaginal microbiome, immune response and sexually transmitted viral infections. Int J Mol Sci. 20 (2), 266 (2019).
- Van Oostrum, N., De Sutter, P., Meys, J., Verstraelen, H. Risks associated with bacterial vaginosis in infertility patients: A systematic review and meta-analysis. Hum Reprod. 28 (7), 1809-1815 (2013).
- Lewis, F. M. T., Bernstein, K. T., Aral, S. O. Vaginal microbiome and its relationship to behavior, sexual health, and sexually transmitted diseases. Obstet Gynecol. 129 (4), 643-654 (2017).
- Hong, X., et al. The association between vaginal microbiota and female infertility: A systematic review and meta-analysis. Arch Gynecol Obstet. 302 (3), 569-578 (2020).
- Peelen, M. J., et al. The influence of the vaginal microbiota on preterm birth: A systematic review and recommendations for a minimum dataset for future research. Placenta. 79, 30-39 (2019).
- Smith, P. P., et al. Outcomes in prevention and management of miscarriage trials: A systematic review. BJOG. 126 (2), 176-189 (2019).
- Harp, D. F., Chowdhury, I. Trichomoniasis: Evaluation to execution. Eur J Obstet Gynecol Reprod Biol. 157 (1), 3-9 (2011).
- Pastorek, J. G., Cotch, M. F., Martin, D. H., Eschenbach, D. A. Clinical and microbiological correlates of vaginal trichomoniasis during pregnancy. The vaginal infections and prematurity study group. Clin Infect Dis. 23 (5), 1075-1080 (1996).
- Petrin, D., Delgaty, K., Bhatt, R., Garber, G. Clinical and microbiological aspects of trichomonas vaginalis. Clin Microbiol Rev. 11 (2), 300-317 (1998).
- Edwards, T., Burke, P., Smalley, H., Hobbs, G. Trichomonas vaginalis: Clinical relevance, pathogenicity and diagnosis. Crit Rev Microbiol. 42 (3), 406-417 (2016).
- Eade, C. R., et al. Identification and characterization of bacterial vaginosis-associated pathogens using a comprehensive cervical-vaginal epithelial coculture assay. PLoS One. 7 (11), e50106 (2012).
- Fichorova, R. N., Yamamoto, H. S., Delaney, M. L., Onderdonk, A. B., Doncel, G. F. Novel vaginal microflora colonization model providing new insight into microbicide mechanism of action. mBio. 2 (6), e00168 (2011).
- Herbst-Kralovetz, M. M., Pyles, R. B., Ratner, A. J., Sycuro, L. K., Mitchell, C. New systems for studying intercellular interactions in bacterial vaginosis. J Infect Dis. 214, S6-S13 (2016).
- Johnson, A. P., et al. A study of the susceptibility of three species of primate to vaginal colonization with gardnerella vaginalis. Br J Exp Pathol. 65 (3), 389-396 (1984).
- Yildirim, S., et al. Primate vaginal microbiomes exhibit species specificity without universal lactobacillus dominance. ISME J. 8 (12), 2431-2444 (2014).
- Edwards, V. L., et al. Three-dimensional models of the cervicovaginal epithelia to study host-microbiome interactions and sexually transmitted infections. Pathog Dis. 80 (1), 026 (2022).
- Zhu, Y., et al. Ex vivo 2D and 3D HSV-2 infection model using human normal vaginal epithelial cells. Oncotarget. 8 (9), 15267-15282 (2017).
- Barrila, J., et al. Modeling host-pathogen interactions in the context of the microenvironment: Three-dimensional cell culture comes of age. Infect Immun. 86 (11), e00282 (2018).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cell Mol Gastroenterol Hepatol. 5 (4), 659-668 (2018).
- Jalili-Firoozinezhad, S., et al. A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nat Biomed Eng. 3 (7), 520-531 (2019).
- Valiei, A., Aminian-Dehkordi, J., Mofrad, M. R. K. Gut-on-a-chip models for dissecting the gut microbiology and physiology. APL Bioeng. 7 (1), 011502 (2023).
- Izadifar, Z., et al. Mucus production, host-microbiome interactions, hormone sensitivity, and innate immune responses modeled in human endo- and ecto-cervix chips. bioRxiv. , (2023).
- Mahajan, G., et al. Vaginal microbiome-host interactions modeled in a human vagina-on-a-chip. Microbiome. 10 (1), 201 (2022).
- Masson, L., et al. Inflammatory cytokine biomarkers to identify women with asymptomatic sexually transmitted infections and bacterial vaginosis who are at high risk of HIV infection. Sex Transm Infect. 92 (3), 186-193 (2016).
- Amsel, R., et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med. 74 (1), 14-22 (1983).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon