Method Article
Um modelo para exposição experimental de humanos a larvas de carrapatos Ixodes scapularis
Neste Artigo
Resumo
Este artigo apresenta a metodologia para exposição humana a larvas de Ixodes scapularis para pesquisa clínica. A técnica é relativamente simples, tolerável pelos voluntários da pesquisa, podendo ser modificada de acordo com as necessidades experimentais. Essa pesquisa envolvendo seres humanos deve ser conduzida de acordo com protocolos de estudos clínicos aprovados pelas autoridades reguladoras apropriadas.
Resumo
As doenças transmitidas por carrapatos são um problema significativo de saúde pública nos Estados Unidos e no mundo. Os carrapatos são artrópodes que se alimentam de sangue obrigatórios; Um carrapato ixodídeo deve permanecer preso à pele do hospedeiro e completar seu processo de alimentação de vários dias para adquirir sua refeição de sangue. Expor animais a carrapatos é uma prática comum para estudar as respostas do hospedeiro a picadas de carrapatos e doenças transmitidas por carrapatos. Desenvolvemos o procedimento, conduzimos o primeiro estudo de pesquisa em humanos e publicamos as descobertas sobre a exposição de voluntários humanos a carrapatos larvais de Ixodes scapularis não infectados. Este artigo descreve a metodologia usada para construir o curativo de contenção, como aplicar e prender os carrapatos ao hospedeiro, como manter o curativo e como remover os carrapatos do hospedeiro. A exposição de voluntários a picadas de carrapatos é um procedimento experimental e deve ser realizado de acordo com um protocolo de pesquisa clínica aprovado pelas autoridades regulatórias apropriadas. Este método permite a pesquisa translacional para entender melhor a resposta humana às picadas de carrapatos e promover o desenvolvimento de diagnósticos, prevenção e terapias para doenças transmitidas por carrapatos.
Introdução
Os carrapatos duros (Ixodidae: Acari) são ectoparasitas que se alimentam de sangue obrigatório que ocorrem em todo o mundo e são capazes de transmitir uma ampla gama de patógenos, incluindo bactérias, vírus e parasitas, de grande importância médica e veterinária. Os carrapatos ixodídeos devem permanecer presos ao hospedeiro por dias para completar uma refeição de sangue e têm a capacidade de permanecer presos à pele, evitando o reconhecimento, impedindo a coagulação sanguínea local e facilitando a alimentação a longo prazo 1,2,3. Estudos em animais demonstraram que hospedeiros não permissivos adquirem resistência a picadas de carrapatos com exposições repetidas a carrapatos, o que pode levar a uma diminuição da capacidade de transmitir um patógeno, enquanto os carrapatos podem parasitar repetidamente hospedeiros permissivos. A resistência adquirida ao carrapato depende da natureza da resposta imune do hospedeiro 4,5,6,7.
As doenças transmitidas por carrapatos são uma ameaça crescente nos Estados Unidos (EUA), com o número de casos relatados mais do que dobrando entre 2004 e 2016 8,9. Devido às mudanças climáticas, as distribuições geográficas de diferentes carrapatos continuam a se expandir10,11. As principais doenças transmitidas por carrapatos nos EUA incluem doença de Lyme, anaplasmose, erliquiose, febre maculosa, rickettsiose, babesiose, tularemia e doença do vírus Powassan8. A doença de Lyme, causada pela infecção por Borrelia burgdorferi sensu lato, é a doença transmitida por carrapatos mais comum nos EUA e na Europa12. Com aproximadamente 476.000 indivíduos diagnosticados com doença de Lyme anualmente nos EUA, há um fardo econômico e de saúde pública para os indivíduos e para a sociedade 13,14,15.
Ixodes scapularis (o carrapato de patas pretas ou veado) é o principal vetor da doença de Lyme, bem como anaplasmose, babesiose, doença de Borrelia miyamotoi e doença do vírus Powassan nos EUA. Outras espécies de carrapatos medicamente importantes nos EUA incluem Amblyomma americanum (carrapato estrela solitária), Dermacentor variabilis (carrapato de cachorro americano), Ixodes pacificus (carrapato de patas pretas ocidental), Dermacentor andersoni (carrapato de madeira das Montanhas Rochosas), Ixodes cookei (carrapato da marmota), Dermacentor occidentalis (carrapato da costa do Pacífico), Rhipicephalus sanguineus (carrapato marrom do cão) e Amblyomma maculatum (carrapato da Costa do Golfo)16.
O desenvolvimento de um método para expor voluntários de pesquisa a picadas de carrapatos apoia estudos usando o vetor natural para buscar evidências de infecção, um procedimento conhecido como xenodiagnóstico 17,18,19,20,21, e para aprender mais sobre a imunidade induzida pela exposição a carrapatos, o que pode contribuir para a descoberta de uma vacina anti-carrapato 5,6,7. O procedimento aqui descrito foi desenvolvido e utilizado no primeiro estudo de pesquisa em humanos utilizando larvas de Ixodes scapularis criadas em laboratório para xenodiagnóstico de infecção por B. burgdorferi após antibioticoterapia (NCT01143558), publicado em 201419. O sistema foi usado com sucesso em um estudo de fase 2 que investigou se um xenodiagnóstico positivo se correlacionava com a persistência dos sintomas após o tratamento com antibióticos da doença de Lyme (NCT02446626) e em um estudo que explorou a resposta do hospedeiro a picadas de carrapatos (NCT05036707).
Este protocolo de procedimento descreve o processo de criação do curativo de contenção, o procedimento de colocação de carrapatos e o procedimento de remoção de carrapatos, bem como os cuidados no local necessários para manter o curativo de contenção. Os detalhes sobre a colônia de carrapatos I. scapularis livre de patógenos e os procedimentos de exposição a carrapatos usados para os estudos citados acima foram descritos anteriormente19,22. Esta metodologia oferece uma ferramenta de pesquisa flexível que pode ser adaptada para estudar diferentes aspectos da resposta do hospedeiro humano a picadas de carrapatos, a eficácia dos medicamentos de prevenção de carrapatos, bem como a doença de Lyme e outras doenças transmitidas por carrapatos.
Protocolo
A exposição de voluntários a picadas de carrapatos é um método experimental e deve ser conduzido de acordo com um protocolo de pesquisa clínica aprovado pelas autoridades reguladoras relevantes. Os estudos clínicos (NCT01143558, NCT02446626 e NCT05036707) foram aprovados pelos respectivos conselhos de revisão institucional, conduzidos sob isenções de dispositivos experimentais concedidas pela Food and Drug Administration dos EUA e realizados de acordo com as diretrizes de Boas Práticas Clínicas. Além disso, esses estudos foram registrados com ClinicalTrials.gov e o consentimento informado por escrito foi obtido de todos os participantes.
1. Preparação do curativo de contenção
- Para criar um modelo de medição, fotocopie o curativo de contenção hidrocolóide de 3" x 3" ao longo da lateral das linhas de medição (Figura 1A e Tabela de Materiais).
- Corte o modelo fotocopiado ao longo da linha de 1". Em seguida, corte ao longo da linha de 2", criando um círculo de 2" com um centro de 1" (Figura 1B).
- Usando este modelo, corte o curativo de espuma não adesiva para criar um círculo de 2" com um centro de 1" (Figura 2A, B e Tabela de Materiais).
- Usando o mesmo modelo, corte um círculo de 2" no centro do curativo hidrocolóide extrafino de 4" x 4" (Figura 2C,D).
- Corte a camada hidrocolóide do curativo de contenção de 3" x 3" na linha de 11/2".
- Puxe para trás o forro de papel da camada hidrocolóide do curativo de contenção para expor o adesivo. Coloque o curativo de espuma cortado dentro do círculo de 2" do adesivo (Figura 3A). Isso garantirá que o curativo de espuma se estenda além da abertura do curativo de contenção. Recoloque o forro de papel na camada hidrocolóide do curativo (Figura 3B).
NOTA: Essas medidas foram usadas para estudos envolvendo até 10 carrapatos larvais de I. scapularis . Para estudos envolvendo até 30 larvas de carrapatos I. scapularis , o gabarito para o centro de espuma foi cortado entre as marcações de 1" e 11/2" para permitir uma área maior para colocação. As medidas do curativo de contenção podem ser adaptadas de acordo com o desenho do estudo.
2. Colocação de ticks
- Armazenamento de carrapatos
- Armazene os carrapatos larvais de I. scapularis em uma geladeira de grau médico com a temperatura ajustada para 9-10 °C.
- Armazene os carrapatos em um frasco coberto com uma tampa de malha para permitir o fluxo de ar adequado. Embale o frasco de carrapatos em um saco plástico lacrado com uma esponja levemente umedecida para manter a umidade e evitar a dessecação.
- Colocando os carrapatos
- Remova os carrapatos da geladeira para permitir que aqueçam até a temperatura ambiente. Os carrapatos podem se tornar ativos em menos de 15 minutos fora da geladeira.
- Posicione uma folha branca ao redor da área de posicionamento para visualizar facilmente qualquer marca solta inadvertidamente.
- Umedeça uma gaze de 4 "x 4" com água limpa ou soro fisiológico e use-a para limpar a pele do local de colocação. A área deve ser seca ou deixada secar ao ar.
NOTA: Ao selecionar o local do corpo para a colocação do carrapato, considere áreas que não restrinjam as atividades diárias do voluntário e onde a integridade do curativo possa ser facilmente monitorada pelo participante. Não coloque os carrapatos em áreas onde possam ser esmagados devido à pressão direta (por exemplo, nas costas). Avalie os pelos corporais do participante e, se necessário, apare cuidadosamente os pelos excessivos do corpo com uma tesoura no local do adesivo, evitando danos à pele. Evite usar uma lâmina de barbear para depilação, pois pode aumentar o risco de lesões e infecções na pele. - Quando a pele estiver seca, remova o revestimento adesivo do lado hidrocolóide do curativo preparado e fixe-o firmemente na pele no local de colocação, garantindo que a camada de malha permaneça aberta.
- Quebre o cotonete de madeira (consulte a Tabela de Materiais) ao meio para expor as pontas irregulares.
- Abra cuidadosamente o frasco de carrapatos.
- Usando a extremidade irregular do cotonete de madeira, transfira os carrapatos ativos do frasco e coloque-os na pele dentro do curativo de contenção ( Figura 4A ). Peça a um membro adicional da equipe que monitore o local de colocação do carrapato para garantir que os carrapatos permaneçam dentro do curativo de contenção. Use fita adesiva para prender os carrapatos que escapam do frasco durante este processo.
NOTA: Quebrar um cotonete de madeira e usar a extremidade irregular é eficaz para manipulação e transferência de carrapatos sem causar danos aos carrapatos. Um pequeno pincel com cerdas macias em uma cor clara também funciona para transferir carrapatos do recipiente para o local da pele. - Uma vez colocado o número especificado de carrapatos para o estudo, remova o revestimento adesivo da camada de malha do curativo de contenção e feche-o sobre a abertura.
- Depois de garantir que o adesivo esteja bem preso, aplique o curativo hidrocolóide extrafino de 4" x 4" preparado sobre o curativo de contenção para segurança adicional (Figura 4B).
NOTA: Informações adicionais sobre a colônia de carrapatos I. scapularis livre de patógenos e a duração dos procedimentos de exposição ao carrapato usados nos estudos citados podem ser encontradas nas seções de métodos dos estudos publicados19,22.
3. Cuidados com o local
- Forneça uma cobertura de barreira de água e fita hipoalergênica de 2" (consulte a Tabela de Materiais) para o participante da pesquisa.
- Forneça instruções para cuidar do local de contenção de carrapatos.
- Verifique periodicamente o curativo e monitore as bordas para uma adesão segura à pele. Aplique fita adicional para reforçar as bordas do curativo conforme necessário.
- Não coce o local do curativo e evite abrir ou remover o curativo durante o período do estudo.
- Evite tomar banho ou mergulhar na água. Além disso, evite banhos quentes e limite a duração do banho. Antes de tomar banho, proteja o curativo de contenção com a tampa de barreira de água fornecida e remova-o após terminar o banho. Seque suavemente o curativo e inspecione-o para garantir que permaneça seguro.
- Evite atividades que possam causar transpiração intensa e comprometer a integridade do curativo (por exemplo, exercícios aeróbicos, caminhadas prolongadas).
4. Remoção de carrapatos
- Preparação de frascos de coleta
- Rotule os frascos de coleta de carrapatos com os identificadores desejados (por exemplo, código do estudo, data).
- Se for necessária a preservação de carrapatos vivos, faça furos na tampa dos frascos com uma agulha de 20 G. Use uma camada de malha de náilon ou poliéster junto com a tampa para selar o frasco. Coloque um pequeno pedaço de esponja úmida em um saco lacrado com o frasco de carrapatos para manter a umidade.
- Removendo os carrapatos
- Coloque lençóis brancos ao redor do local do curativo e certifique-se de que uma bacia de coleta esteja ao seu alcance.
- Usando lenços umedecidos com álcool, remova cuidadosamente o curativo da pele.
- Depois de totalmente removido, coloque o curativo na bacia de coleta e examine-o quanto à presença de carrapatos destacados.
- Avalie o local de colocação em busca de carrapatos anexados. Os carrapatos que se alimentaram até a repleção se desprenderão (Figura 5A). Para os carrapatos restantes anexados, use uma pinça de ponta fina para remoção (Figura 5B).
- Limpe a pele com lenços umedecidos com álcool ou água e sabão.
Resultados
O estudo demonstrou que o procedimento é seguro e bem tolerado, sendo o evento adverso primário prurido leve no local das picadas, observado em 58% dos procedimentos. Não houve eventos adversos graves relacionados ao procedimento quando se utilizou carrapatos larvais limpos de I. scapularis criados em laboratório19. Nos 43 procedimentos realizados, o percentual médio de recuperação dos carrapatos presos em relação aos carrapatos colocados foi de 45% ± 27% (DP), com percentual mediano de 40% (Figura 6).
A duração exata para os carrapatos larvais de I. scapularis se ligarem aos humanos permanece incerta, pois o tempo desde a colocação do carrapato até a fixação do carrapato não foi observado rotineiramente. Em um caso em que um voluntário de pesquisa foi observado por 2 horas e meia, nenhum dos carrapatos havia se fixado até o final do período. Leva de 4 a 5 dias desde a colocação para que as larvas de carrapatos I. scapularis se alimentem até a reposição19.

Figura 1: Medidas do curativo de contenção. (A) Uma fotocópia do curativo de contenção. (B) O modelo de medição do curativo de contenção criado cortando a fotocópia nas marcações desejadas. Clique aqui para ver uma versão maior desta figura.

Figura 2: Criação de curativos de reforço não adesivos e hidrocolóides. (A) Usando o gabarito de medição do curativo de contenção para cortar o curativo de espuma. (B) Um círculo de 2" com um curativo de espuma central de 1". (C) Usando o modelo de medição de curativo de contenção para cortar o curativo hidrocolóide. (D) Um curativo hidrocolóide de 4" x 4" com um centro de 2". Clique aqui para ver uma versão maior desta figura.

Figura 3: Curativo de contenção. (A) O curativo de espuma no lado adesivo da camada hidrocolóide do curativo de contenção. (B) Curativo de contenção usado para alimentação de carrapatos. Clique aqui para ver uma versão maior desta figura.
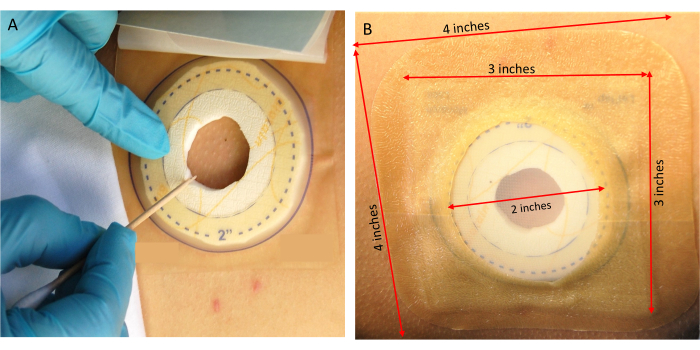
Figura 4: Colocação de carrapatos. (A) Transferência de carrapatos para o voluntário de pesquisa. (B) Fixação do curativo de contenção. Clique aqui para ver uma versão maior desta figura.
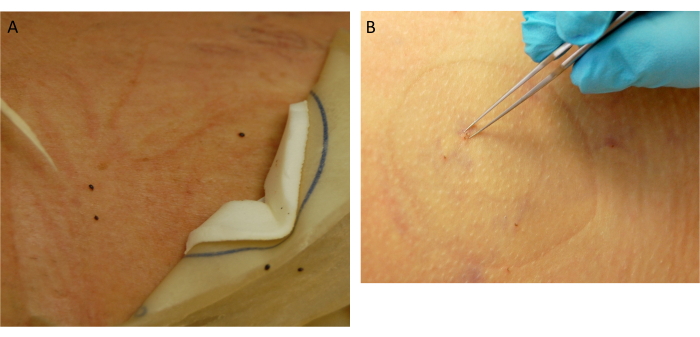
Figura 5: Coleção de ticks. (A) Ticks repletos destacados. (B) Remoção de carrapatos anexados. Clique aqui para ver uma versão maior desta figura.

Figura 6: Recuperação de carrapatos larvais ingurgitados de Ixodes scapularis . Cada ponto representa a porcentagem de carrapatos larvais de I. scapularis ingurgitados recuperados usando o protocolo descrito. A porcentagem média de carrapatos recuperados foi de 45 ± 27 (DP). Clique aqui para ver uma versão maior desta figura.
Discussão
Embora estudos em animais envolvendo exposições a carrapatos 4,5,6,7,21 tenham sido inestimáveis para aumentar nossa compreensão da resposta do hospedeiro a doenças transmitidas por carrapatos e picadas de carrapatos, esses modelos têm limitações em quão bem eles preveem a resposta do hospedeiro humano. Este modelo, que descreve a metodologia para expor humanos a picadas de carrapatos de maneira controlada, pode ser facilmente adaptado para responder a diferentes questões de pesquisa e expande a capacidade de realizar esses estudos necessários em humanos.
O estudo inicial exigiu o desenvolvimento de um novo sistema que permitisse que os carrapatos se alimentassem por dias, ao mesmo tempo em que fosse confortável e tolerável para os seres humanos. Depois de avaliar diferentes técnicas, o curativo de contenção descrito aqui foi o mais bem-sucedido. Durante os testes iniciais, os carrapatos vagaram até a borda do recorte circular do curativo de contenção e morreram no adesivo exposto antes que a fixação pudesse ocorrer. Para explicar esse comportamento do carrapato, um anel de espuma não adesivo foi adicionado sob o adesivo hidrocolóide do curativo de contenção. Isso forneceu uma borda escura não adesiva para os carrapatos migrarem e se fixarem na pele. Carrapatos soltos ressecaram e morreram no curativo. Se os carrapatos viajassem além da camada de espuma, eles ficavam presos no adesivo e morriam. Uma vez que os carrapatos se prenderam à pele, eles geralmente permaneceram embutidos até se alimentarem até a repleção. Os carrapatos que se alimentaram até a plenitude se soltarão; portanto, é importante examinar o curativo removido para coletar esses carrapatos destacados alimentados. Se o protocolo clínico não exigir que os carrapatos se alimentem até a repleção, use uma pinça de ponta fina para remover os carrapatos presos.
A duração da alimentação do carrapato dependerá da questão da pesquisa, do estágio de vida do carrapato e do protocolo clínico aprovado. Para os estudos usando esta colônia de larvas I. scapularis, levou de 4 a 5 dias para os carrapatos se alimentarem até a plenitude19. Os voluntários da pesquisa são solicitados a abster-se de atividades como exercícios e natação que possam comprometer o curativo de contenção. Para tomar banho, os voluntários recebem coberturas de barreira de água, como as usadas para cobrir cateteres intravenosos centrais e gessos. Além disso, eles são instruídos a evitar longos banhos quentes. Se for tomado cuidado para manter o curativo de contenção seco e reforçá-lo com fita adicional conforme necessário, ele permanecerá intacto.
Para o estudo inicial de pesquisa em humanos em humanos, as larvas de I. scapularis foram escolhidas para o procedimento. As razões para a escolha incluíram semelhança com o estudo em camundongos23 , bem como razões práticas. O uso de carrapatos larvais teve menos preocupações de segurança, pois esse estágio não recebeu uma refeição de sangue antes do uso em protocolos clínicos. Além disso, sua abundância relativa (em comparação com outros estágios) facilitou o teste e a produção de números maiores. O teste dessa colônia de larvas livres de patógenos I. scapularis é descrito em Marques et al.19. Novos estudos clínicos estão sendo realizados usando carrapatos ninfal, incluindo um estudo avaliando a eficácia de um medicamento para matar carrapatos (NCT05387083) e um estudo de desafio de carrapatos (NCT05965635).
Expor carrapatos a voluntários de pesquisa humana era um conceito novo e tem suas limitações. A colônia de carrapatos precisa ser criada com segurança e testada para patógenos conhecidos que podem ser transmitidos aos humanos antes de serem usados para pesquisas clínicas. Este processo requer conhecimentos e recursos adequados.
Muito esforço é implementado para educar potenciais voluntários de pesquisa sobre a segurança e tolerabilidade do procedimento, bem como o processo de manutenção dos carrapatos sob o curativo de contenção. Embora essa metodologia de exposição ao carrapato permita que os voluntários da pesquisa continuem a maioria de suas atividades diárias, os ajustes no estilo de vida necessários para manter o curativo de contenção e o compromisso de tempo podem ser impedimentos para a participação.
Apesar das limitações, o desenvolvimento de um modelo para exposição humana a larvas de carrapatos I. scapularis é uma importante ferramenta de pesquisa. O procedimento tem utilidade de pesquisa para promover investigações sobre carrapatos, picadas de carrapatos, a resposta humana a carrapatos e a prevenção de doenças transmitidas por carrapatos. A vantagem dessa metodologia é sua simplicidade e adaptabilidade. A metodologia pode ser usada para alimentar diferentes estágios de vida de carrapatos ixodídeos e é adequada para vários tipos de experimentos em que é necessária a exposição humana a carrapatos ixodídeos. Os procedimentos de pesquisa envolvendo seres humanos devem ser realizados em estudos clínicos aprovados pelas autoridades regulatórias apropriadas.
Divulgações
A Dra. Adriana Marques possui uma patente US 8.926.989 B2; e é um consultor científico não remunerado da Global Lyme Alliance e da American Lyme Disease Foundation. Siu Ping Turk e Aleah Eschman não têm uma associação que possa representar um conflito de interesses. O conteúdo desta publicação não reflete necessariamente as opiniões ou políticas do Departamento de Saúde e Serviços Humanos, nem a menção de nomes comerciais, produtos comerciais ou organizações implica endosso do governo dos EUA.
Agradecimentos
Esta pesquisa foi apoiada pelo Programa de Pesquisa Intramural do NIH, Instituto Nacional de Alergia e Doenças Infecciosas. Agradecemos a Linden T. Hu, Sam R. Telford III, Kenneth Dardick, Carla Williams, Erin Chung e Christina Brandeburg por sua participação no desenvolvimento dos procedimentos.
Materiais
| Name | Company | Catalog Number | Comments |
| 20 G needle | Any brand | For puncturing the vial cap. | |
| 3" x 3" containment dressing | Monarch Labs Names | LeFlap | https://www.monarchlabs.com/ordering |
| 4" x 4" extra-thin hydrocolloid dressing | ConvaTec | DuoDerm | https://www.convatec.com/products/advanced-wound-care/brand-names/pc-wound-duoderm-granluflex/duoderm-extra-thin-dressing/ |
| 4" x 4" gauze | Monarch Labs Names | For cleaning skin | |
| Clean water or saline | For cleaning skin | ||
| Moisture barrier (e.g. 7" x 7") | AquaGuard | TIDI | For showering, ttps://www.tidiproducts.com/product-listing/aquaguard-shower-cover-sheets |
| Non-adhesive foam dressing | Coloplast | Biatain | https://www.coloplast.us/biatain-non-adhesive-en-us.aspx |
| Roll of 2" hypoallergenic tape | Monarch Labs Names | Durapore | For reinforcing containment dressing. |
| Roll of adhesive tape | For trapping ticks | ||
| Vials for collection (e.g. cryovials) | Ependorf | ECC200 |
Referências
- Yeh, M. T., et al. Determining the duration of Ixodes scapularis (Acari: Ixodidae) attachment to tick-bite victims. J Med Entomol. 32 (6), 853-858 (1995).
- Piesman, J., Mather, T. N., Sinsky, R. J., Spielman, A. Duration of tick attachment and Borrelia burgdorferi transmission. J Clin Microbiol. 25 (3), 557-558 (1987).
- Vora, A., et al. Ticks elicit variable fibrinogenolytic activities upon feeding on hosts with different immune backgrounds. Sci Rep. 7, 44593(2017).
- Narasimhan, S., et al. Immunity against Ixodes scapularis salivary proteins expressed within 24 hours of attachment thwarts tick feeding and impairs Borrelia transmission. PLoS One. 2 (5), 451(2007).
- Nazario, S., et al. Prevention of Borrelia burgdorferi transmission in guinea pigs by tick immunity. Am J Trop Med Hyg. 58 (6), 780-785 (1998).
- Krause, P. J., et al. Dermatologic changes induced by repeated Ixodes scapularis bites and implications for prevention of tick-borne infection. Vector Borne Zoonotic Dis. 9 (6), 603-610 (2009).
- Anderson, J. M., et al. Ticks, Ixodes scapularis, feed repeatedly on white-footed mice despite strong inflammatory response: an expanding paradigm for understanding tick-host interactions. Front Immunol. 8, 1784(2017).
- Rosenberg, R., et al. Vital signs: trends in reported vectorborne disease cases - United States and Territories, 2004-2016. MMWR Morb Mortal Wkly Rep. 67 (17), 496-501 (2018).
- Paules, C. I., Marston, H. D., Bloom, M. E., Fauci, A. S. Tickborne diseases - confronting a growing threat. N Engl J Med. 379 (8), 701-703 (2018).
- Tardy, O., et al. Mechanistic movement models to predict geographic range expansions of ticks and tick-borne pathogens: Case studies with Ixodes scapularis and Amblyomma americanum in eastern North America. Ticks Tick Borne Dis. 14 (4), 102161(2023).
- Molaei, G., Eisen, L. M., Price, K. J., Eisen, R. J. Range expansion of native and invasive ticks: a looming public health threat. J Infect Dis. 226 (3), 370-373 (2022).
- Marques, A. R., Strle, F., Wormser, G. P. Comparison of Lyme disease in the United States and Europe. Emerg Infect Dis. 27 (8), 2017-2024 (2021).
- Kugeler, K. J., Schwartz, A. M., Delorey, M. J., Mead, P. S., Hinckley, A. F. Estimating the frequency of Lyme disease diagnoses, United States, 2010-2018. Emerg Infect Dis. 27 (2), 616-619 (2021).
- Schwartz, A. M., Kugeler, K. J., Nelson, C. A., Marx, G. E., Hinckley, A. F. use of commercial claims data for evaluating trends in lyme disease diagnoses, United States, 2010-2018. Emerg Infect Dis. 27 (2), 499-507 (2021).
- Hook, S. A., et al. Economic burden of reported Lyme disease in high-incidence areas, United States. Emerg Infect Dis. 28 (6), 1170-1179 (2022).
- Eisen, L. Tick species infesting humans in the United States. Ticks Tick Borne Dis. 13 (6), 102025(2022).
- Embers, M. E., et al. Variable manifestations, diverse seroreactivity and post-treatment persistence in non-human primates exposed to Borrelia burgdorferi by tick feeding. PLoS One. 12 (12), 0189071(2017).
- Hodzic, E., Imai, D., Feng, S., Barthold, S. W. Resurgence of persisting non-cultivable Borrelia burgdorferi following antibiotic treatment in mice. PLoS One. 9 (1), 86907(2014).
- Marques, A., et al. Xenodiagnosis to detect Borrelia burgdorferi infection: a first-in-human study. Clin Infect Dis. 58 (7), 937-945 (2014).
- Hodzic, E., Imai, D. M., Escobar, E. Generality of post-antimicrobial treatment persistence of Borrelia burgdorferi strains N40 and B31 in genetically susceptible and resistant mouse strains. Infect Immun. 87 (10), e00442(2019).
- Bockenstedt, L. K., Mao, J., Hodzic, E., Barthold, S. W., Fish, D. Detection of attenuated, noninfectious spirochetes in Borrelia burgdorferi-infected mice after antibiotic treatment. J Infect Dis. 186 (10), 1430-1437 (2002).
- Turk, S., Williams, C., Marques, A. in Borrelia burgdorferi: Methods in Molecular Biology. Pal, U., Buyuktanir, O. , Springer. New York. 337-346 (2018).
- Hodzic, E., Feng, S., Holden, K., Freet, K. J., Barthold, S. W. Persistence of Borrelia burgdorferi following antibiotic treatment in mice. Antimicrob Agents Chemother. 52 (5), 1728-1736 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados