Method Article
Un modèle d’exposition expérimentale des humains aux tiques larvaires Ixodes scapularis
Dans cet article
Résumé
Cet article présente la méthodologie d’exposition de l’homme à la larve d’Ixodes scapularis pour la recherche clinique. La technique est relativement simple, tolérable par les volontaires de la recherche, et peut être modifiée en fonction des besoins expérimentaux. De telles recherches impliquant des sujets humains doivent être menées selon des protocoles d’étude clinique approuvés par les autorités réglementaires compétentes.
Résumé
Les maladies transmises par les tiques sont un problème de santé publique important aux États-Unis et dans le monde. Les tiques sont des arthropodes hématophages obligatoires ; Une tique ixodide doit rester attachée à la peau de l’hôte et terminer son processus d’alimentation de plusieurs jours pour obtenir son repas de sang. L’exposition des animaux aux tiques est une pratique courante pour étudier les réactions de l’hôte aux morsures de tiques et aux maladies transmises par les tiques. Nous avons mis au point la procédure, mené la première étude de recherche sur l’homme et publié les résultats de l’exposition de volontaires humains à des larves de tiques Ixodes scapularis non infectées. Cet article décrit la méthodologie utilisée pour construire le pansement de confinement, comment appliquer et fixer les tiques à l’hôte, comment entretenir le pansement et comment retirer les tiques de l’hôte. L’exposition de volontaires à des morsures de tiques est une procédure expérimentale qui doit être réalisée dans le cadre d’un protocole de recherche clinique approuvé par les autorités réglementaires compétentes. Cette méthode permet la recherche translationnelle pour mieux comprendre la réponse humaine aux morsures de tiques et favoriser le développement de diagnostics, de prévention et de thérapies pour les maladies transmises par les tiques.
Introduction
Les tiques dures (Ixodidae : Acari) sont des ectoparasites hématophages obligatoires qui se produisent dans le monde entier et sont capables de transmettre un large éventail d’agents pathogènes, y compris des bactéries, des virus et des parasites, d’une importance médicale et vétérinaire majeure. Les tiques Ixodid doivent rester attachées à l’hôte pendant des jours pour compléter un repas de sang, et elles ont la capacité de rester attachées à la peau tout en évitant la reconnaissance, en empêchant la coagulation sanguine locale et en facilitant l’alimentation à long terme 1,2,3. Des études animales ont démontré que les hôtes non permissifs acquièrent une résistance aux piqûres de tiques lors d’expositions répétées aux tiques, ce qui peut entraîner une diminution de la capacité à transmettre un agent pathogène, tandis que les tiques peuvent parasiter à plusieurs reprises les hôtes permissifs. La résistance acquise des tiques dépend de la nature de la réponse immunitaire de l’hôte 4,5,6,7.
Les maladies transmises par les tiques constituent une menace croissante aux États-Unis, le nombre de cas signalés ayant plus que doublé entre 2004 et 2016 8,9. En raison du changement climatique, les aires de répartition géographique des différentes tiques continuent de s’étendre10,11. Les principales maladies transmises par les tiques aux États-Unis comprennent la maladie de Lyme, l’anaplasmose, l’ehrlichiose, la rickettsiose à fièvre pourprée, la babésiose, la tularémie et la maladie à virus Powassan8. La maladie de Lyme, causée par une infection à Borrelia burgdorferi sensu lato, est la maladie transmise par les tiques la plus courante aux États-Unis et en Europe12. Avec environ 476 000 personnes diagnostiquées avec la maladie de Lyme chaque année aux États-Unis, il y a un fardeau à la fois de santé publique et économique pour les individus et pour la société 13,14,15.
Ixodes scapularis (la tique à pattes noires ou tique du cerf) est le principal vecteur de la maladie de Lyme, ainsi que de l’anaplasmose, de la babésiose, de la maladie de Borrelia miyamotoi et de la maladie à virus Powassan aux États-Unis. Aux États-Unis, d’autres espèces de tiques importantes sur le plan médical comprennent Amblyomma americanum (tique solitaire), Dermacentor variabilis (tique américaine du chien), Ixodes pacificus (tique à pattes noires de l’Ouest), Dermacentor andersoni (tique des bois des montagnes Rocheuses), Ixodes cookei (tique de la marmotte), Dermacentor occidentalis (tique de la côte du Pacifique), Rhipicephalus sanguineus (tique brune du chien) et Amblyomma maculatum (tique de la côte du golfe)16.
La mise au point d’une méthode pour exposer des volontaires de recherche à des morsures de tiques soutient les études utilisant le vecteur naturel pour rechercher des signes d’infection, une procédure connue sous le nom de xénodiagnostic 17,18,19,20,21, et pour en savoir plus sur l’immunité induite par l’exposition aux tiques, ce qui peut contribuer à la découverte d’un vaccin anti-tiques 5,6,7. La procédure décrite ici a été développée et utilisée dans la première étude de recherche humaine utilisant des larves d’Ixodes scapularis élevées en laboratoire pour le xénodiagnostic de l’infection à B. burgdorferi après une antibiothérapie (NCT01143558), publiée en 201419. Le système a été utilisé avec succès dans une étude de phase 2 visant à déterminer si un xénodiagnostic positif était corrélé à la persistance des symptômes après un traitement antibiotique de la maladie de Lyme (NCT02446626) et dans une étude explorant la réponse de l’hôte aux morsures de tiques (NCT05036707).
Ce protocole de procédure décrit le processus de création du pansement de confinement, la procédure de mise en place des tiques et la procédure d’enlèvement des tiques, ainsi que les soins au site nécessaires pour entretenir le pansement de confinement. Les détails concernant les procédures d’exposition à la colonie de tiques I. scapularis exemptes d’agents pathogènes et aux tiques utilisées pour les études susmentionnées ont déjà été décrits19,22. Cette méthodologie offre un outil de recherche flexible qui peut être adapté à l’étude de différents aspects de la réponse de l’hôte humain aux morsures de tiques, de l’efficacité des médicaments de prévention des tiques, ainsi que de la maladie de Lyme et d’autres maladies transmises par les tiques.
Protocole
L’exposition de volontaires à des morsures de tiques est une méthode expérimentale qui doit être menée dans le cadre d’un protocole de recherche clinique approuvé par les autorités réglementaires compétentes. Les études cliniques (NCT01143558, NCT02446626 et NCT05036707) ont été approuvées par les comités d’examen institutionnels respectifs, menées dans le cadre d’exemptions de dispositifs expérimentaux accordées par la Food and Drug Administration des États-Unis et réalisées conformément aux directives de bonnes pratiques cliniques. De plus, ces études ont été enregistrées auprès de ClinicalTrials.gov et un consentement éclairé écrit a été obtenu de tous les participants.
1. Préparation du pansement de confinement
- Pour créer un gabarit de mesure, photocopiez le pansement de confinement hydrocolloïde de 3 po x 3 po le long des lignes de mesure (figure 1A et tableau des matériaux).
- Coupez le gabarit photocopié le long de la ligne de 1 po. Ensuite, coupez le long de la ligne de 2 po, en créant un cercle de 2 po avec un centre de 1 po (Figure 1B).
- À l’aide de ce gabarit, coupez le pansement en mousse non adhésif pour créer un cercle de 2 po avec un centre de 1 po (Figure 2A, B et tableau des matériaux).
- À l’aide du même gabarit, découpez un cercle de 2 po au centre du pansement hydrocolloïde extra-mince de 4 po x 4 po (Figure 2C, D).
- Coupez la couche hydrocolloïde du pansement de confinement de 3 po x 3 po au niveau de la ligne de 1 po.
- Tirez la doublure en papier de la couche hydrocolloïde du pansement de confinement pour exposer l’adhésif. Placez le pansement en mousse découpée dans le cercle de 2 po de l’adhésif (Figure 3A). Cela garantira que le pansement en mousse s’étend au-delà de l’ouverture du pansement de confinement. Replacez la doublure en papier sur la couche hydrocolloïde du pansement (figure 3B).
REMARQUE : Ces mesures ont été utilisées pour des études portant sur jusqu’à 10 larves de tiques I. scacularis . Pour les études portant sur jusqu’à 30 larves de tiques I. scacularis , le gabarit du centre de la mousse a été coupé entre les marques de 1 po et de 1 po pour permettre une plus grande zone de placement. Les dimensions du pansement de confinement peuvent être adaptées en fonction de la conception de l’étude.
2. Placement des tiques
- Stockage des tiques
- Conservez les larves de tiques I. scapularis dans un réfrigérateur de qualité médicale avec une température réglée à 9-10 °C.
- Conservez les tiques dans un flacon recouvert d’un capuchon en maille pour permettre une circulation d’air adéquate. Emballez le flacon de tiques dans un sac en plastique refermable avec une éponge légèrement humidifiée pour maintenir l’humidité et prévenir la dessiccation.
- Placer les tiques
- Sortez les tiques du réfrigérateur pour leur permettre de se réchauffer à température ambiante. Les tiques peuvent devenir actives en aussi peu que 15 minutes à l’extérieur du réfrigérateur.
- Placez une feuille blanche autour de la zone de placement pour visualiser facilement toute tique tombée par inadvertance.
- Humidifiez un tampon de gaze de 4 « x 4 » avec de l’eau propre ou une solution saline et utilisez-le pour nettoyer la peau du site de placement. La zone doit être séchée en tapotant ou laissée sécher à l’air.
REMARQUE : Lorsque vous choisissez l’emplacement du corps pour la pose des tiques, tenez compte des zones qui ne limitent pas les activités quotidiennes du bénévole et où l’intégrité du pansement peut être facilement surveillée par le participant. Ne placez pas les tiques dans des endroits où elles pourraient être écrasées en raison d’une pression directe (par exemple, le dos). Évaluez les poils du corps du participant et, si nécessaire, coupez soigneusement les poils excessifs à l’aide de ciseaux au site de l’adhésif, en évitant d’endommager la peau. Évitez d’utiliser un rasoir pour l’épilation, car cela peut augmenter le risque de blessure cutanée et d’infection. - Une fois que la peau est sèche, retirez la doublure adhésive du côté hydrocolloïde du pansement préparé et fixez-la fermement à la peau au site de mise en place, en veillant à ce que la couche de maille reste ouverte.
- Cassez l’écouvillon en bois (voir le tableau des matériaux) en deux pour exposer les extrémités dentelées.
- Ouvrez soigneusement la fiole de tiques.
- À l’aide de l’extrémité dentelée de l’écouvillon en bois, transférez les tiques actives de la fiole et placez-les sur la peau à l’intérieur du pansement de confinement (figure 4A). Demandez à un membre supplémentaire de l’équipe de surveiller le site de placement des tiques pour s’assurer qu’elles restent à l’intérieur du pansement de confinement. Utilisez du ruban adhésif pour piéger les tiques qui s’échappent du flacon pendant ce processus.
REMARQUE : Casser un écouvillon en bois et utiliser l’extrémité dentelée est efficace pour la manipulation et le transfert des tiques sans endommager les tiques. Une petite brosse à poils doux de couleur claire fonctionne également pour transférer les tiques du récipient au site de la peau. - Une fois que le nombre spécifié de tiques pour l’étude est placé, retirez la doublure adhésive de la couche de maille du pansement de confinement et fermez-la sur l’ouverture.
- Après s’être assuré que l’adhésif est bien fixé, appliquez le pansement hydrocolloïde extra-mince de 4 po x 4 po préparé sur le pansement de confinement pour plus de sécurité (figure 4B).
REMARQUE : Des renseignements supplémentaires concernant la colonie de tiques I. scapularis exempte d’agents pathogènes et la durée des procédures d’exposition aux tiques utilisées dans les études citées se trouvent dans les sections sur les méthodes des études publiées19,22.
3. Entretien du site
- Fournissez au participant à la recherche une housse de protection contre l’eau et du ruban adhésif hypoallergénique de 2 po (voir le tableau des matériaux).
- Fournir des instructions pour prendre soin du site de confinement des tiques.
- Vérifiez périodiquement le pansement et surveillez les bords pour une adhérence sûre à la peau. Appliquez du ruban adhésif supplémentaire pour renforcer les bords du pansement au besoin.
- Ne grattez pas l’endroit du pansement et évitez d’ouvrir ou de retirer le pansement pendant la période d’étude.
- Évitez de vous baigner ou de vous tremper dans l’eau. Évitez également les douches chaudes et limitez la durée de la douche. Avant de prendre une douche, protégez le pansement de confinement à l’aide de la housse étanche fournie et retirez-le après la fin de la douche. Séchez doucement le pansement et inspectez-le pour vous assurer qu’il reste bien en place.
- Évitez les activités qui peuvent entraîner une transpiration abondante et compromettre l’intégrité du pansement (par exemple, les exercices aérobiques, les randonnées prolongées).
4. Retrait des tiques
- Préparation des flacons de prélèvement
- Étiquetez les flacons de prélèvement de tiques avec les identificateurs souhaités (p. ex., code d’étude, date).
- S’il est nécessaire de conserver des tiques vivantes, percez des trous dans le capuchon des flacons avec une aiguille de 20 G. Utilisez une couche de maille en nylon ou en polyester avec le capuchon pour sceller le flacon. Placez un petit morceau d’éponge humide dans un sac refermable avec la fiole de tiques pour maintenir l’humidité.
- Retirer les tiques
- Placez des feuilles blanches autour du site du pansement et assurez-vous qu’un bassin de collecte est à portée de main.
- À l’aide de lingettes imbibées d’alcool, retirez délicatement le pansement de la peau.
- Une fois complètement retiré, placez le pansement dans le bassin de collecte et examinez-le pour détecter la présence de tiques détachées.
- Évaluez le site de placement des tiques attachées. Les tiques qui se sont nourries jusqu’à se rassasier se détachent (figure 5A). Pour les tiques restantes, utilisez une pince à pointe fine pour les retirer (figure 5B).
- Nettoyez la peau avec des lingettes imbibées d’alcool ou de l’eau et du savon.
Résultats
L’étude a démontré que la procédure est sûre et bien tolérée, le principal effet indésirable étant de légères démangeaisons au site des morsures, observées dans 58% des procédures. Il n’y a eu aucun effet indésirable grave lié à l’intervention lors de l’utilisation de larves de tiques I. scapularis 19 élevées en laboratoire. Dans les 43 procédures effectuées, le pourcentage moyen de récupération des tiques attachées par rapport aux tiques placées était de 45 % ± 27 % (écart-type), avec un pourcentage médian de 40 % (figure 6).
La durée exacte pendant laquelle les larves de tiques I. scapularis s’attachent aux humains n’est pas claire, car le temps écoulé entre le placement et la fixation des tiques n’a pas été observé régulièrement. Dans un cas où un volontaire de recherche a été observé pendant 2 heures, aucune des tiques ne s’était attachée à la fin de la période. Il faut 4 à 5 jours entre la mise en place des tiques I. scapularis et la réplétion19.

Figure 1 : Mesures du pansement de confinement. (A) Une photocopie du pansement de confinement. (B) Le gabarit de mesure de l’habillage de confinement créé en découpant la photocopie aux marques souhaitées. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Création de pansements de renfort non adhésifs et hydrocolloïdes. (A) Utilisation du gabarit de mesure du pansement de confinement pour couper le pansement en mousse. (B) Un cercle de 2 » avec un pansement en mousse central de 1 ». (C) Utiliser le gabarit de mesure du pansement de confinement pour couper le pansement hydrocolloïde. (D) Un pansement hydrocolloïde de 4 » x 4 » avec un centre de 2 ». Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Pansement de confinement. (A) Pansement en mousse sur le côté adhésif de la couche hydrocolloïde du pansement de confinement. (B) Pansement de confinement utilisé pour l’alimentation des tiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
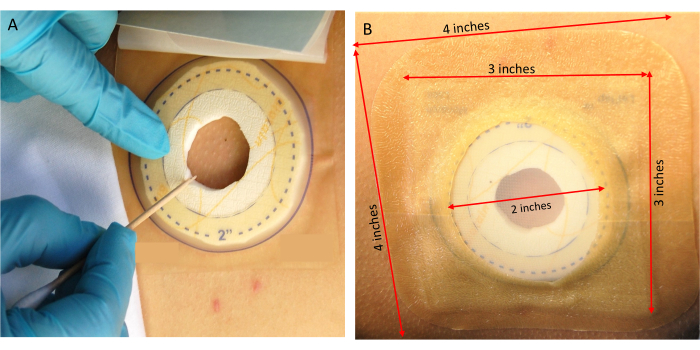
Figure 4 : Placement des tiques. (A) Transfert des tiques sur le volontaire de recherche. (B) Fixation du pansement de confinement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
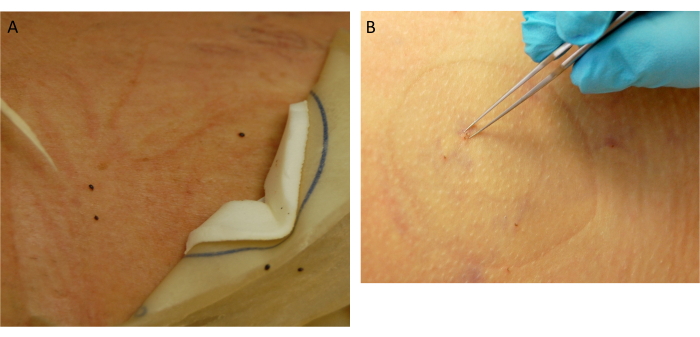
Figure 5 : Collection de tiques. (A) Tiques détachées et pleines. (B) Retrait des tiques attachées. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Récupération de tiques larvaires d’Ixodes scapularis engorgées. Chaque point représente le pourcentage de tiques larvaires d’I. scapularis engorgées récupérées à l’aide du protocole décrit. Le pourcentage moyen de tiques guéries était de 45 ± 27 (écart-type). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Bien que les études animales portant sur l’exposition aux tiques 4,5,6,7,21 aient été inestimables pour accroître notre compréhension de la réponse de l’hôte aux maladies transmises par les tiques et aux morsures de tiques, ces modèles ont des limites dans leur capacité à prédire la réponse de l’hôte humain. Ce modèle, qui décrit la méthodologie d’exposition contrôlée des humains aux morsures de tiques, peut être facilement adapté pour répondre à différentes questions de recherche et élargit la capacité de réaliser ces études nécessaires chez l’homme.
L’étude initiale a nécessité le développement d’un nouveau système qui permettrait aux tiques de se nourrir pendant des jours tout en étant confortable et tolérable pour les sujets humains. Après avoir évalué différentes techniques, le pansement de confinement décrit ici a finalement été le plus réussi. Au cours des premiers essais, les tiques se sont déplacées jusqu’au bord de la découpe circulaire du pansement de confinement et sont mortes sur l’adhésif exposé avant que la fixation ne puisse avoir lieu. Pour tenir compte de ce comportement des tiques, un anneau en mousse non adhésif a été ajouté sous l’adhésif hydrocolloïde du pansement de confinement. Cela a fourni un bord sombre non adhésif pour que les tiques migrent et se fixent à la peau. Les tiques non attachées se sont desséchées et sont mortes dans le pansement. Si les tiques dépassaient la couche de mousse, elles se coinçaient dans l’adhésif et mouraient. Une fois que les tiques se sont attachées à la peau, elles sont généralement restées incrustées jusqu’à ce qu’elles se nourrissent jusqu’à ce qu’elles se remplissent. Les tiques qui se sont nourries jusqu’à se rassasier se détacheront ; Par conséquent, il est important d’examiner le pansement retiré pour recueillir ces tiques détachées nourries. Si le protocole clinique n’exige pas que les tiques se nourrissent jusqu’à ce qu’elles soient rassasiées, utilisez des pinces à pointe fine pour retirer les tiques attachées.
La durée de l’alimentation des tiques dépendra de la question de recherche, de l’étape de vie de la tique et du protocole clinique approuvé. Pour les études utilisant cette colonie de larves d’I. scapularis, il a fallu 4 à 5 jours pour que les tiques se nourrissent jusqu’à ce qu’elles en rassasient19. Les volontaires de la recherche sont priés de s’abstenir d’activités telles que l’exercice et la natation qui peuvent compromettre le pansement de confinement. Pour prendre une douche, les volontaires reçoivent des couvercles de barrière d’eau tels que ceux utilisés pour couvrir les cathéters intraveineux centraux et les plâtres. De plus, ils ont pour consigne d’éviter les longues douches chaudes. Si l’on prend soin de garder le pansement de confinement sec et de le renforcer avec du ruban adhésif supplémentaire au besoin, il restera intact.
Pour l’étude de recherche initiale chez l’homme, des larves d’I. scapularis ont été choisies pour la procédure. Les raisons du choix comprenaient une similitude avec l’étude chez la souris23 ainsi que des raisons pratiques. L’utilisation de larves de tiques présentait moins de problèmes de sécurité, car ce stade n’a pas reçu de repas de sang avant l’utilisation dans les protocoles cliniques. De plus, leur abondance relative (par rapport à d’autres stades) a facilité les tests et la production de plus grands nombres. Les essais effectués sur cette colonie de larves exemptes d’agents pathogènes I. scapularis sont décrits dans Marques et al.19. De nouvelles études cliniques sont en cours sur des tiques nymphales, y compris une étude évaluant l’efficacité d’un médicament pour tuer les tiques (NCT05387083) et une étude de provocation sur les tiques (NCT05965635).
L’exposition des tiques à des volontaires humains était un concept nouveau qui a ses limites. La colonie de tiques doit être élevée en toute sécurité et testée pour détecter la présence d’agents pathogènes connus qui peuvent être transmis aux humains avant de pouvoir être utilisés pour la recherche clinique. Ce processus nécessite une expertise et des ressources adéquates.
Beaucoup d’efforts sont déployés pour éduquer les volontaires potentiels sur la sécurité et la tolérabilité de la procédure ainsi que sur le processus de maintien des tiques sous le pansement de confinement. Bien que cette méthodologie d’exposition aux tiques permette aux volontaires de poursuivre la plupart de leurs activités quotidiennes, les ajustements du mode de vie nécessaires pour maintenir le pansement de confinement et l’engagement de temps peuvent être dissuasifs à la participation.
Malgré les limites, la mise au point d’un modèle d’exposition des humains aux larves de tiques I. scapularis est un outil de recherche important. La procédure a une utilité pour la recherche afin de favoriser les enquêtes sur les tiques, les morsures de tiques, la réponse humaine aux tiques et la prévention des maladies transmises par les tiques. L’avantage de cette méthodologie est sa simplicité et son adaptabilité. La méthodologie peut être utilisée pour nourrir les tiques ixodides à différents stades de leur vie et convient à divers types d’expériences où il est nécessaire d’exposer les humains aux tiques ixodides. Les procédures de recherche impliquant des sujets humains doivent être effectuées dans le cadre d’études cliniques approuvées par les autorités réglementaires compétentes.
Déclarations de divulgation
Le Dr Adriana Marques est titulaire d’un brevet US 8,926,989 B2 ; et est conseillère scientifique non rémunérée auprès de la Global Lyme Alliance et de l’American Lyme Disease Foundation. Siu Ping Turk et Aleah Eschman n’ont pas d’association qui pourrait poser un conflit d’intérêts. Le contenu de cette publication ne reflète pas nécessairement les opinions ou les politiques du ministère de la Santé et des Services sociaux, et la mention de noms commerciaux, de produits commerciaux ou d’organisations n’implique pas l’approbation du gouvernement américain.
Remerciements
Cette recherche a été soutenue par le programme de recherche intra-muros du NIH, National Institute of Allergy and Infectious Diseases. Nous remercions Linden T. Hu, Sam R. Telford III, Kenneth Dardick, Carla Williams, Erin Chung et Christina Brandeburg pour leur participation à l’élaboration des procédures.
matériels
| Name | Company | Catalog Number | Comments |
| 20 G needle | Any brand | For puncturing the vial cap. | |
| 3" x 3" containment dressing | Monarch Labs Names | LeFlap | https://www.monarchlabs.com/ordering |
| 4" x 4" extra-thin hydrocolloid dressing | ConvaTec | DuoDerm | https://www.convatec.com/products/advanced-wound-care/brand-names/pc-wound-duoderm-granluflex/duoderm-extra-thin-dressing/ |
| 4" x 4" gauze | Monarch Labs Names | For cleaning skin | |
| Clean water or saline | For cleaning skin | ||
| Moisture barrier (e.g. 7" x 7") | AquaGuard | TIDI | For showering, ttps://www.tidiproducts.com/product-listing/aquaguard-shower-cover-sheets |
| Non-adhesive foam dressing | Coloplast | Biatain | https://www.coloplast.us/biatain-non-adhesive-en-us.aspx |
| Roll of 2" hypoallergenic tape | Monarch Labs Names | Durapore | For reinforcing containment dressing. |
| Roll of adhesive tape | For trapping ticks | ||
| Vials for collection (e.g. cryovials) | Ependorf | ECC200 |
Références
- Yeh, M. T., et al. Determining the duration of Ixodes scapularis (Acari: Ixodidae) attachment to tick-bite victims. J Med Entomol. 32 (6), 853-858 (1995).
- Piesman, J., Mather, T. N., Sinsky, R. J., Spielman, A. Duration of tick attachment and Borrelia burgdorferi transmission. J Clin Microbiol. 25 (3), 557-558 (1987).
- Vora, A., et al. Ticks elicit variable fibrinogenolytic activities upon feeding on hosts with different immune backgrounds. Sci Rep. 7, 44593(2017).
- Narasimhan, S., et al. Immunity against Ixodes scapularis salivary proteins expressed within 24 hours of attachment thwarts tick feeding and impairs Borrelia transmission. PLoS One. 2 (5), 451(2007).
- Nazario, S., et al. Prevention of Borrelia burgdorferi transmission in guinea pigs by tick immunity. Am J Trop Med Hyg. 58 (6), 780-785 (1998).
- Krause, P. J., et al. Dermatologic changes induced by repeated Ixodes scapularis bites and implications for prevention of tick-borne infection. Vector Borne Zoonotic Dis. 9 (6), 603-610 (2009).
- Anderson, J. M., et al. Ticks, Ixodes scapularis, feed repeatedly on white-footed mice despite strong inflammatory response: an expanding paradigm for understanding tick-host interactions. Front Immunol. 8, 1784(2017).
- Rosenberg, R., et al. Vital signs: trends in reported vectorborne disease cases - United States and Territories, 2004-2016. MMWR Morb Mortal Wkly Rep. 67 (17), 496-501 (2018).
- Paules, C. I., Marston, H. D., Bloom, M. E., Fauci, A. S. Tickborne diseases - confronting a growing threat. N Engl J Med. 379 (8), 701-703 (2018).
- Tardy, O., et al. Mechanistic movement models to predict geographic range expansions of ticks and tick-borne pathogens: Case studies with Ixodes scapularis and Amblyomma americanum in eastern North America. Ticks Tick Borne Dis. 14 (4), 102161(2023).
- Molaei, G., Eisen, L. M., Price, K. J., Eisen, R. J. Range expansion of native and invasive ticks: a looming public health threat. J Infect Dis. 226 (3), 370-373 (2022).
- Marques, A. R., Strle, F., Wormser, G. P. Comparison of Lyme disease in the United States and Europe. Emerg Infect Dis. 27 (8), 2017-2024 (2021).
- Kugeler, K. J., Schwartz, A. M., Delorey, M. J., Mead, P. S., Hinckley, A. F. Estimating the frequency of Lyme disease diagnoses, United States, 2010-2018. Emerg Infect Dis. 27 (2), 616-619 (2021).
- Schwartz, A. M., Kugeler, K. J., Nelson, C. A., Marx, G. E., Hinckley, A. F. use of commercial claims data for evaluating trends in lyme disease diagnoses, United States, 2010-2018. Emerg Infect Dis. 27 (2), 499-507 (2021).
- Hook, S. A., et al. Economic burden of reported Lyme disease in high-incidence areas, United States. Emerg Infect Dis. 28 (6), 1170-1179 (2022).
- Eisen, L. Tick species infesting humans in the United States. Ticks Tick Borne Dis. 13 (6), 102025(2022).
- Embers, M. E., et al. Variable manifestations, diverse seroreactivity and post-treatment persistence in non-human primates exposed to Borrelia burgdorferi by tick feeding. PLoS One. 12 (12), 0189071(2017).
- Hodzic, E., Imai, D., Feng, S., Barthold, S. W. Resurgence of persisting non-cultivable Borrelia burgdorferi following antibiotic treatment in mice. PLoS One. 9 (1), 86907(2014).
- Marques, A., et al. Xenodiagnosis to detect Borrelia burgdorferi infection: a first-in-human study. Clin Infect Dis. 58 (7), 937-945 (2014).
- Hodzic, E., Imai, D. M., Escobar, E. Generality of post-antimicrobial treatment persistence of Borrelia burgdorferi strains N40 and B31 in genetically susceptible and resistant mouse strains. Infect Immun. 87 (10), e00442(2019).
- Bockenstedt, L. K., Mao, J., Hodzic, E., Barthold, S. W., Fish, D. Detection of attenuated, noninfectious spirochetes in Borrelia burgdorferi-infected mice after antibiotic treatment. J Infect Dis. 186 (10), 1430-1437 (2002).
- Turk, S., Williams, C., Marques, A. in Borrelia burgdorferi: Methods in Molecular Biology. Pal, U., Buyuktanir, O. , Springer. New York. 337-346 (2018).
- Hodzic, E., Feng, S., Holden, K., Freet, K. J., Barthold, S. W. Persistence of Borrelia burgdorferi following antibiotic treatment in mice. Antimicrob Agents Chemother. 52 (5), 1728-1736 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon