Method Article
유충 Ixodes scapularis 진드기에 대한 인간의 실험적 노출을 위한 모델
요약
이 기사에서는 임상 연구를 위해 인간을 유충 Ixodes scapularis 에 노출시키는 방법을 제시합니다. 이 기술은 비교적 간단하고 연구 지원자가 견딜 수 있으며 실험적 필요에 따라 수정할 수 있습니다. 인간 피험자를 대상으로 하는 이러한 연구는 해당 규제 당국이 승인한 임상 연구 프로토콜에 따라 수행되어야 합니다.
초록
진드기 매개 질병은 미국과 전 세계적으로 중요한 공중 보건 문제입니다. 진드기는 피를 먹는 절지동물입니다. 익소디드 진드기는 숙주의 피부에 붙어 있어야 하며 혈액 식사를 얻기 위해 여러 날에 걸친 먹이 과정을 완료해야 합니다. 동물을 진드기에 노출시키는 것은 진드기에 물리는 것과 진드기 매개 질병에 대한 숙주의 반응을 연구하기 위한 일반적인 관행입니다. 우리는 이 절차를 개발하고, 최초의 인간 연구 연구를 수행했으며, 인간 지원자를 감염되지 않은 유충 Ixodes scapularis 진드기에 노출시키는 것에 대한 결과를 발표했습니다. 이 글에서는 봉쇄 드레싱을 구성하는 데 사용되는 방법론, 숙주에 진드기를 적용하고 고정하는 방법, 드레싱을 유지하는 방법, 숙주에서 진드기를 제거하는 방법에 대해 설명합니다. 지원자를 진드기에 물리는 것은 실험적인 절차이며 해당 규제 당국에서 승인한 임상 연구 프로토콜에 따라 수행해야 합니다. 이 방법을 통해 중개 연구를 통해 진드기에 물렸을 때 인간의 반응을 더 잘 이해하고 진드기 매개 질병에 대한 진단, 예방 및 치료법의 개발을 촉진할 수 있습니다.
서문
딱딱한 진드기(Ixodidae: Acari)는 전 세계적으로 발생하는 필수 혈액 순환 외부 기생충이며 주요 의학 및 수의학적으로 중요한 박테리아, 바이러스 및 기생충을 포함한 광범위한 병원체를 전염시킬 수 있습니다. 익소디드 진드기는 혈액 식사를 완료하기 위해 며칠 동안 숙주에 붙어 있어야 하며, 인식을 피하고 국소 혈액 응고를 방지하며 장기간 수유를 촉진하면서 피부에 붙어 있을 수 있는 능력이 있습니다 1,2,3. 동물 연구에 따르면 비관대적 숙주는 진드기에 반복적으로 노출되면 진드기에 물리는 것에 대한 저항력을 획득하여 병원체를 전달하는 능력이 감소할 수 있는 반면, 진드기는 방임적 숙주에 반복적으로 기생할 수 있습니다. 후천적 진드기 저항성은 숙주 면역 반응 4,5,6,7의 특성에 따라 달라집니다.
진드기 매개 질병은 2004년에서 2016년 사이에 보고된 사례 수가 두 배 이상 증가하면서 미국에서 점점 더 위협이 되고 있습니다 8,9. 기후 변화로 인해 다양한 진드기의 지리적 범위는 계속 확장되고 있습니다10,11. 미국의 주요 진드기 매개 질병으로는 라임병, 아나플라즈마증, 에를리히증, 반점열 리케치증, 바베시아증, 야토병, 포와산 바이러스 질환등이 있다 8. Borrelia burgdorferi sensu lato에 감염되어 발생하는 라임병은 미국과 유럽에서 가장 흔한 진드기 매개 질병입니다12. 미국에서 매년 약 476,000명이 라임병 진단을 받고 있으며, 이는 개인과 사회에 공중 보건 및 경제적 부담을 주고 있습니다 13,14,15.
Ixodes scapularis (검은다리 진드기 또는 사슴 진드기)는 라임병의 주요 매개체이며 미국에서 아나플라즈마증, 바베시아증, 보렐리아 미야모토이 병, 포와산 바이러스병입니다. 미국에서 의학적으로 중요한 다른 진드기 종으로는 Amblyomma americanum (론스타 진드기), Dermacentor variabilis (미국 개 진드기), Ixodes pacificus (서부 검은다리 진드기), Dermacentor andersoni (로키산맥 나무 진드기), Ixodes cookei (그라운드호그 진드기), Dermacentor occidentalis (태평양 연안 진드기), Rhipicephalus sanguineus (갈색 개 진드기) 및 Amblyomma maculatum (걸프 코스트 진드기)이 있습니다16.
연구 지원자를 진드기에 물리게 하는 방법을 개발하는 것은 감염의 증거를 찾기 위해 자연 벡터를 사용하는 연구를 지원하며, 이는 이종 진단 17,18,19,20,21 로 알려진 절차이며, 진드기에 노출되어 유도되는 면역에 대해 자세히 알아보고, 이는 항 진드기 백신의 발견에 기여할 수 있습니다 5,6,7. 여기에 설명된 절차는 2014년에 발표된 항생제 요법 후 B. burgdorferi 감염의 이종 진단을 위해 실험실에서 사육된 Ixodes scapularis 유충을 사용한 최초의 인간 연구 연구에서 개발 및사용되었습니다(NCT01143558). 이 시스템은 라임병의 항생제 치료 후 양성 이종 진단이 증상의 지속과 상관관계가 있는지 여부를 조사하는 2상 연구(NCT02446626)와 진드기 물림에 대한 숙주 반응을 조사하는 연구(NCT05036707)에서 성공적으로 사용되었습니다.
이 절차 프로토콜은 봉쇄 드레싱을 만드는 과정, 진드기 배치 절차, 진드기 제거 절차, 그리고 봉쇄 드레싱을 유지하는 데 필요한 현장 관리에 대해 설명합니다. 위에서 인용된 연구에 사용된 병원체가 없는 I. scapularis 진드기 군집 및 진드기 노출 절차에 대한 세부 사항은 이전에 설명되었습니다19,22. 이 방법론은 진드기에 물렸을 때 인간 숙주가 나타내는 반응의 다양한 측면, 진드기 예방 약물의 효과, 라임병 및 기타 진드기 매개 질병을 연구하는 데 적용할 수 있는 유연한 연구 도구를 제공합니다.
프로토콜
지원자를 진드기에 물리는 것은 실험적인 방법이며 관련 규제 당국에서 승인한 임상 연구 프로토콜에 따라 수행해야 합니다. 임상 연구(NCT01143558, NCT02446626 및 NCT05036707)는 해당 기관 검토 위원회의 승인을 받았으며, 미국 식품의약국(FDA)이 부여한 임상시험용 의료기기 면제에 따라 수행되었으며, Good Clinical Practice 지침에 따라 수행되었습니다. 또한 이러한 연구는 ClinicalTrials.gov 에 등록되었으며 모든 참가자로부터 서면 동의를 얻었습니다.
1. 봉쇄 드레싱 준비
- 측정 템플릿을 만들려면 측정 라인의 측면을 따라 3" x 3" 하이드로콜로이드 봉쇄 드레싱을 복사합니다(그림 1A 및 재료 표).
- 복사한 템플릿을 1" 선을 따라 자릅니다. 그런 다음 2" 선을 따라 절단하여 2" 중심이 있는 1" 원을 만듭니다(그림 1B).
- 이 템플릿을 사용하여 비접착 폼 드레싱을 절단하여 중앙이 1인치인 2인치 원을 만듭니다(그림 2A, B 및 재료 표).
- 동일한 템플릿을 사용하여 4" x 4" 초박형 하이드로콜로이드 드레싱의 중앙에 2" 원을 자릅니다(그림 2C,D).
- 3" x 3" 봉쇄 드레싱의 하이드로콜로이드 층을 11/2" 라인에서 자릅니다.
- 봉쇄 드레싱의 하이드로콜로이드 층의 종이 라이너를 뒤로 당겨 접착제를 노출시킵니다. 절단된 폼 드레싱을 접착제의 2인치 원 안에 놓습니다(그림 3A). 이렇게 하면 폼 드레싱이 격납 드레싱의 개구부를 넘어 확장됩니다. 종이 라이너를 드레싱의 하이드로콜로이드 층에 교체합니다(그림 3B).
참고: 이 측정은 최대 10개의 유충 I. scapularis 진드기와 관련된 연구에 사용되었습니다. 최대 30마리의 유충 I. scapularis 진드기와 관련된 연구의 경우, 폼 센터의 템플릿을 1"와 11/2" 표시 사이로 절단하여 더 넓은 배치 영역을 허용했습니다. 봉쇄 드레싱의 측정은 연구 설계에 따라 조정할 수 있습니다.
2. 눈금 배치
- 틱 스토리지
- I . scapularis 진드기 유충을 온도가 9-10 °C로 설정된 의료용 냉장고에 보관하십시오.
- 적절한 공기 흐름을 허용하기 위해 메쉬 캡으로 덮인 바이알에 진드기를 보관하십시오. 진드기 바이알을 밀봉 가능한 비닐 봉지에 담아 습도를 유지하고 건조를 방지하기 위해 살짝 적신 스폰지로 포장하십시오.
- 눈금 놓기
- 냉장고에서 진드기를 제거하여 실온으로 데우십시오. 진드기는 냉장고 밖에서 15분 이내에 활성화될 수 있습니다.
- 배치 영역 주변에 흰색 시트를 배치하여 실수로 떨어뜨린 눈금을 쉽게 시각화할 수 있습니다.
- 4"x 4" 거즈 패드를 깨끗한 물이나 식염수로 적시고 식립 부위의 피부를 청소하는 데 사용합니다. 해당 부위는 두드려 말리거나 자연 건조시켜야 합니다.
참고: 진드기 배치를 위한 신체 부위를 선택할 때 자원봉사자의 일상 활동을 제한하지 않고 참가자가 드레싱의 무결성을 쉽게 모니터링할 수 있는 영역을 고려하십시오. 직접적인 압력으로 인해 눌릴 수 있는 곳(예: 등)에 진드기를 두지 마십시오. 참가자의 체모를 평가하고 필요한 경우 접착제 부위를 가위로 사용하여 과도한 체모를 조심스럽게 다듬어 피부 손상을 방지합니다. 제모를 위해 면도기를 사용하면 피부 부상 및 감염의 위험이 증가할 수 있으므로 사용하지 마십시오. - 피부가 건조되면 준비된 드레싱의 하이드로 콜로이드 쪽에서 접착 라이너를 제거하고 배치 부위의 피부에 단단히 부착하여 메쉬 층이 열린 상태를 유지하도록합니다.
- 나무 면봉( 재료 표 참조)을 반으로 부어 들쭉날쭉한 끝을 노출시킵니다.
- 진드기가 있는 유리병을 조심스럽게 엽니다.
- 나무 면봉의 들쭉날쭉한 끝 부분을 사용하여 바이알에서 활성 진드기를 옮겨 격리 드레싱 내의 피부에 놓습니다(그림 4A). 추가 팀원이 진드기 배치 부위를 모니터링하여 진드기가 격리 드레싱 내부에 남아 있는지 확인하도록 합니다. 이 과정에서 바이알에서 빠져나가는 진드기를 잡기 위해 접착 테이프를 사용하십시오.
알림: 나무 면봉을 부수고 들쭉날쭉한 끝 부분을 사용하면 진드기에 손상을 주지 않고 진드기 조작 및 전달에 효과적입니다. 밝은 색상의 부드러운 칫솔모가 있는 작은 브러시도 용기에서 피부 부위로 진드기를 옮기는 데 효과가 있습니다. - 연구에 대해 지정된 수의 눈금이 배치되면 봉쇄 드레싱의 메쉬 층에서 접착 라이너를 제거하고 개구부를 닫습니다.
- 접착제가 단단히 부착되었는지 확인한 후 추가 보안을 위해 준비된 4" x 4" 초박형 하이드로콜로이드 드레싱을 격납 드레싱 위에 바릅니다(그림 4B).
참고: 병원체가 없는 I. scapularis 진드기 군집 및 인용된 연구에서 사용된 진드기 노출 절차의 기간에 대한 추가 정보는 발표된 연구19,22의 방법 섹션에서 찾을 수 있습니다.
3. 현장 관리
- 연구 참가자에게 물 차단 덮개와 2인치 저자극성 테이프( 재료 표 참조)를 제공합니다.
- 진드기 격리 장소를 관리하기 위한 지침을 제공하십시오.
- 주기적으로 드레싱을 점검하고 가장자리를 모니터링하여 피부에 단단히 밀착되도록 합니다. 필요에 따라 드레싱 가장자리를 강화하기 위해 추가 테이프를 붙입니다.
- 드레싱 부위를 긁지 말고, 공부 기간 동안 드레싱을 열거나 제거하지 마십시오.
- 목욕이나 물에 몸을 담그지 마십시오. 또한 뜨거운 샤워를 피하고 샤워 시간을 제한하십시오. 샤워하기 전에 제공된 물 차단 덮개로 봉쇄 드레싱을 보호하고 샤워가 끝난 후 제거하십시오. 드레싱을 부드럽게 두드려 말리고 단단히 고정되어 있는지 확인합니다.
- 땀을 많이 흘리고 드레싱의 무결성을 손상시킬 수 있는 활동(예: 유산소 운동, 장시간 하이킹)을 피하십시오.
4. 진드기 제거
- 수집 바이알 준비
- 진드기 수집 바이알에 원하는 식별자(예: 연구 코드, 날짜)로 라벨을 붙입니다.
- 살아있는 진드기의 보존이 필요한 경우 20G 바늘로 바이알 뚜껑에 구멍을 뚫습니다. 나일론 또는 폴리에스테르 메쉬 층을 캡과 함께 사용하여 바이알을 밀봉합니다. 촉촉한 스폰지의 작은 조각을 진드기 유리병과 함께 밀봉 가능한 가방에 넣어 습도를 유지합니다.
- 진드기 제거
- 붕대 부위 주변에 흰색 시트를 놓고 수집 대야가 손이 닿는 곳에 있는지 확인합니다.
- 알코올 물티슈를 사용하여 피부에서 붕대를 조심스럽게 제거합니다.
- 완전히 제거되면 붕대를 수집 대야에 넣고 분리된 진드기가 있는지 검사합니다.
- 부착된 진드기에 대한 배치 위치를 평가합니다. 영양을 충분히 섭취한 진드기는 분리됩니다(그림 5A). 나머지 부착된 진드기는 끝이 가는 집게를 사용하여 제거합니다(그림 5B).
- 알코올 물티슈나 비누와 물로 피부를 닦으십시오.
결과
이 연구는 시술이 안전하고 내약성이 우수하다는 것을 보여주었으며, 주요 부작용은 시술의 58%에서 관찰된 물린 부위의 경미한 가려움증이었습니다. 깨끗한 실험실에서 사육된 유충 I. scapularis 진드기를 사용했을 때 절차와 관련된 심각한 부작용은 없었다19. 수행된 43개의 절차에서 배치된 진드기에 비해 부착된 진드기의 평균 회수율은 45% ± 27%(SD)였으며 중앙값은 40%였습니다(그림 6).
유충 I. scapularis 진드기가 인간에게 부착하는 정확한 기간은 불분명한데, 이는 진드기 배치부터 진드기 부착까지의 시간이 일상적으로 관찰되지 않았기 때문입니다. 한 사례에서 연구 지원자를 2시간 반 동안 관찰한 결과, 기간이 끝날 때까지 진드기가 하나도 붙지 않았습니다. 유충 I. scapularis 진드기가 먹이를 먹기 위해서는 배치 후 4-5일이 소요됩니다19.

그림 1: 봉쇄 드레싱 측정. (A) 봉쇄 드레싱의 사본. (B) 원하는 표시에서 사본을 절단하여 만든 봉쇄 드레싱 측정 템플릿. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 비접착성 및 하이드로콜로이드 강화 드레싱의 생성. (A) 밀폐 드레싱 측정 템플릿을 사용하여 폼 드레싱을 절단합니다. (B) 1" 중앙 폼 드레싱이 있는 2" 원. (C) 봉쇄 드레싱 측정 템플릿을 사용하여 하이드로콜로이드 드레싱을 절단합니다. (D) 2" 센터가 있는 4" x 4" 하이드로콜로이드 드레싱. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 봉쇄 드레싱. (A) 봉쇄 드레싱의 하이드로콜로이드 층의 접착면에 있는 폼 드레싱. (B) 진드기 먹이에 사용되는 봉쇄 드레싱. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
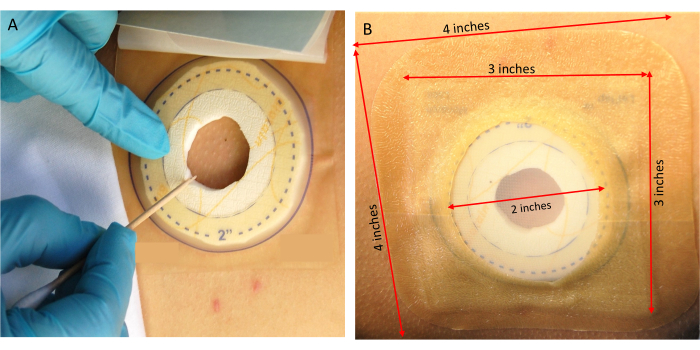
그림 4: 진드기 배치. (A) 연구 지원자에게 진드기를 전달합니다. (B) 봉쇄 드레싱을 고정합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
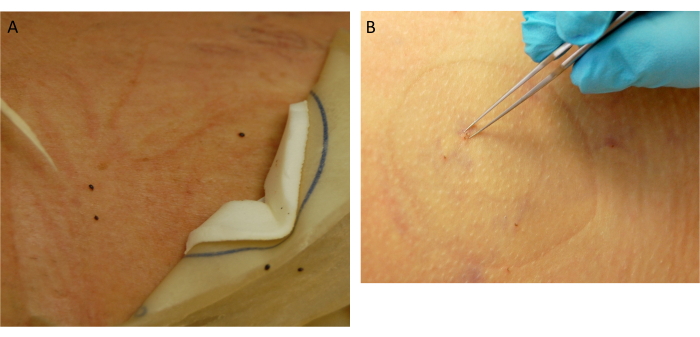
그림 5: 진드기 수집. (A) 분리된 완전한 진드기. (B) 부착된 진드기 제거. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 충혈된 Ixodes scapularis 유충 진드기의 회복. 각 점은 설명된 프로토콜을 사용하여 회수된 충혈된 I. scapularis 유충 진드기의 백분율을 나타냅니다. 회수된 진드기의 평균 비율은 45± 27(SD)이었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
진드기 4,5,6,7,21에 대한 노출과 관련된 동물 연구는 진드기 매개 질병 및 진드기 물림에 대한 숙주 반응에 대한 이해를 높이는 데 매우 중요하지만, 이러한 모델은 인간의 숙주 반응을 얼마나 잘 예측하는지에 한계가 있습니다. 통제된 방식으로 인간을 진드기에 물리는 방법을 설명하는 이 모델은 다양한 연구 질문에 답하기 위해 쉽게 적용할 수 있으며 인간에게 필요한 이러한 연구를 수행할 수 있는 능력을 확장할 수 있습니다.
초기 연구에서는 진드기가 며칠 동안 먹이를 먹으면서 인간 피험자가 편안하고 견딜 수 있도록 하는 새로운 시스템을 개발해야 했습니다. 다양한 기법을 평가한 결과, 여기에 설명된 격리 드레싱이 궁극적으로 가장 성공적이었다. 초기 실험에서, 진드기는 격리 드레싱의 원형 컷아웃 가장자리로 돌아다니다가 부착이 이루어지기 전에 노출된 접착제에 죽었습니다. 이러한 진드기 행동을 설명하기 위해, 비접착성 폼 링이 봉쇄 드레싱의 하이드로콜로이드 접착제 아래에 추가되었습니다. 이것은 진드기가 피부로 이동하여 부착할 수 있는 비접착성 어두운 가장자리를 제공했습니다. 부착되지 않은 진드기는 드레싱에서 건조되어 죽었습니다. 진드기가 거품 층을 넘어 이동하면 접착제에 걸려 죽었습니다. 일단 진드기가 피부에 붙으면, 일반적으로 영양이 풍부해질 때까지 박혀 있었습니다. 배불리 먹은 진드기는 분리됩니다. 따라서 이러한 먹이를 먹인 분리된 진드기를 수집하기 위해 제거된 드레싱을 검사하는 것이 중요합니다. 임상 프로토콜에 따라 진드기가 가득 찰 때까지 먹이를 줄 필요가 없는 경우, 끝이 가는 겸자를 사용하여 부착된 진드기를 제거합니다.
진드기 먹이 기간은 연구 질문, 진드기 수명 단계 및 승인된 임상 프로토콜에 따라 다릅니다. 이 유충 I. scapularis의 군집을 사용한 연구의 경우, 진드기가 먹이를 먹고 보충하는 데 4-5일이 걸렸다19. 연구 자원봉사자들은 운동과 수영과 같이 격리 드레싱을 손상시킬 수 있는 활동을 삼가야 한다. 샤워를 위해 자원봉사자에게는 중앙 정맥 카테터와 깁스를 덮는 데 사용되는 것과 같은 물 차단 덮개가 제공됩니다. 또한 길고 뜨거운 샤워를 피하라는 지시를 받았습니다. 격리 드레싱을 건조한 상태로 유지하고 필요에 따라 추가 테이프로 보강하는 데 주의를 기울인다면, 그것은 온전한 상태로 유지될 것이다.
인간을 대상으로 한 초기 인간 연구 연구를 위해 유충 I. scapularis 가 절차를 위해 선택되었습니다. 선정 이유에는 생쥐23 에 대한 연구와의 유사성과 실제적인 이유가 포함되었습니다. 유충 진드기의 사용은 임상 프로토콜에서 사용하기 전에 혈액 식사를 받지 않았기 때문에 안전성 문제가 적었습니다. 또한 (다른 단계에 비해) 상대적인 풍부도로 인해 더 많은 수를 테스트하고 생성하기가 더 쉬웠습니다. 이 병원체가 없는 유충 I. scapularis 의 콜로니에 대한 테스트는 Marques et al.19에 설명되어 있습니다. 진드기를 죽이는 약물의 효과를 평가하는 연구(NCT05387083)와 진드기 챌린지 연구(NCT05965635)를 포함하여 약충 진드기를 사용한 새로운 임상 연구가 수행되고 있습니다.
인간 연구 지원자에게 진드기를 노출시키는 것은 새로운 개념이었고 한계가 있었습니다. 진드기 군집은 임상 연구에 사용하기 전에 인간에게 전염될 수 있는 알려진 병원체에 대해 안전하게 사육하고 테스트해야 합니다. 이 프로세스에는 적절한 전문 지식과 리소스가 필요합니다.
잠재적인 연구 지원자에게 절차의 안전성과 내약성, 그리고 격리 드레싱 아래에서 진드기를 유지하는 과정에 대해 교육하기 위해 많은 노력이 기울여집니다. 이 진드기 노출 방법론을 통해 연구 지원자는 대부분의 일상 활동을 계속할 수 있지만, 격리 드레싱을 유지하는 데 필요한 생활 방식 조정과 시간 약속은 참여를 방해하는 요인이 될 수 있습니다.
이러한 한계에도 불구하고, 인간을 유충 I. scapularis 진드기에 노출시키기 위한 모델의 개발은 중요한 연구 도구입니다. 이 절차는 진드기, 진드기 물림, 진드기에 대한 인간의 반응 및 진드기 매개 질병 예방에 대한 연구를 촉진하는 연구 유용성을 가지고 있습니다. 이 방법론의 장점은 단순성과 적응성입니다. 이 방법론은 익소디드 진드기의 다양한 생활 단계에 영양을 공급하는 데 사용할 수 있으며 인간을 익소디드 진드기에 노출시켜야 하는 다양한 유형의 실험에 적합합니다. 인간 피험자와 관련된 연구 절차는 해당 규제 당국이 승인한 임상 연구에 따라 수행되어야 합니다.
공개
Dr. Adriana Marques는 US 8,926,989 B2의 특허를 보유하고 있습니다. 세계 라임 연맹(Global Lyme Alliance)과 미국 라임병 재단(American Lyme Disease Foundation)의 무급 과학 고문입니다. Siu Ping Turk와 Aleah Eschman은 이해 상충을 일으킬 수 있는 연관성이 없습니다. 이 간행물의 내용이 반드시 보건복지부(Department of Health and Human Services)의 견해나 정책을 반영하는 것은 아니며, 상표명, 상용 제품 또는 조직에 대한 언급이 미국 정부의 승인을 암시하는 것도 아닙니다.
감사의 말
이 연구는 미국 국립알레르기·전염병연구소(National Institute of Allergy and Infectious Diseases)의 교내 연구 프로그램(Intramural Research Program)의 지원을 받았다. 절차 개발에 참여해 주신 Linden T. Hu, Sam R. Telford III, Kenneth Dardick, Carla Williams, Erin Chung 및 Christina Brandeburg에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 20 G needle | Any brand | For puncturing the vial cap. | |
| 3" x 3" containment dressing | Monarch Labs Names | LeFlap | https://www.monarchlabs.com/ordering |
| 4" x 4" extra-thin hydrocolloid dressing | ConvaTec | DuoDerm | https://www.convatec.com/products/advanced-wound-care/brand-names/pc-wound-duoderm-granluflex/duoderm-extra-thin-dressing/ |
| 4" x 4" gauze | Monarch Labs Names | For cleaning skin | |
| Clean water or saline | For cleaning skin | ||
| Moisture barrier (e.g. 7" x 7") | AquaGuard | TIDI | For showering, ttps://www.tidiproducts.com/product-listing/aquaguard-shower-cover-sheets |
| Non-adhesive foam dressing | Coloplast | Biatain | https://www.coloplast.us/biatain-non-adhesive-en-us.aspx |
| Roll of 2" hypoallergenic tape | Monarch Labs Names | Durapore | For reinforcing containment dressing. |
| Roll of adhesive tape | For trapping ticks | ||
| Vials for collection (e.g. cryovials) | Ependorf | ECC200 |
참고문헌
- Yeh, M. T., et al. Determining the duration of Ixodes scapularis (Acari: Ixodidae) attachment to tick-bite victims. J Med Entomol. 32 (6), 853-858 (1995).
- Piesman, J., Mather, T. N., Sinsky, R. J., Spielman, A. Duration of tick attachment and Borrelia burgdorferi transmission. J Clin Microbiol. 25 (3), 557-558 (1987).
- Vora, A., et al. Ticks elicit variable fibrinogenolytic activities upon feeding on hosts with different immune backgrounds. Sci Rep. 7, 44593(2017).
- Narasimhan, S., et al. Immunity against Ixodes scapularis salivary proteins expressed within 24 hours of attachment thwarts tick feeding and impairs Borrelia transmission. PLoS One. 2 (5), 451(2007).
- Nazario, S., et al. Prevention of Borrelia burgdorferi transmission in guinea pigs by tick immunity. Am J Trop Med Hyg. 58 (6), 780-785 (1998).
- Krause, P. J., et al. Dermatologic changes induced by repeated Ixodes scapularis bites and implications for prevention of tick-borne infection. Vector Borne Zoonotic Dis. 9 (6), 603-610 (2009).
- Anderson, J. M., et al. Ticks, Ixodes scapularis, feed repeatedly on white-footed mice despite strong inflammatory response: an expanding paradigm for understanding tick-host interactions. Front Immunol. 8, 1784(2017).
- Rosenberg, R., et al. Vital signs: trends in reported vectorborne disease cases - United States and Territories, 2004-2016. MMWR Morb Mortal Wkly Rep. 67 (17), 496-501 (2018).
- Paules, C. I., Marston, H. D., Bloom, M. E., Fauci, A. S. Tickborne diseases - confronting a growing threat. N Engl J Med. 379 (8), 701-703 (2018).
- Tardy, O., et al. Mechanistic movement models to predict geographic range expansions of ticks and tick-borne pathogens: Case studies with Ixodes scapularis and Amblyomma americanum in eastern North America. Ticks Tick Borne Dis. 14 (4), 102161(2023).
- Molaei, G., Eisen, L. M., Price, K. J., Eisen, R. J. Range expansion of native and invasive ticks: a looming public health threat. J Infect Dis. 226 (3), 370-373 (2022).
- Marques, A. R., Strle, F., Wormser, G. P. Comparison of Lyme disease in the United States and Europe. Emerg Infect Dis. 27 (8), 2017-2024 (2021).
- Kugeler, K. J., Schwartz, A. M., Delorey, M. J., Mead, P. S., Hinckley, A. F. Estimating the frequency of Lyme disease diagnoses, United States, 2010-2018. Emerg Infect Dis. 27 (2), 616-619 (2021).
- Schwartz, A. M., Kugeler, K. J., Nelson, C. A., Marx, G. E., Hinckley, A. F. use of commercial claims data for evaluating trends in lyme disease diagnoses, United States, 2010-2018. Emerg Infect Dis. 27 (2), 499-507 (2021).
- Hook, S. A., et al. Economic burden of reported Lyme disease in high-incidence areas, United States. Emerg Infect Dis. 28 (6), 1170-1179 (2022).
- Eisen, L. Tick species infesting humans in the United States. Ticks Tick Borne Dis. 13 (6), 102025(2022).
- Embers, M. E., et al. Variable manifestations, diverse seroreactivity and post-treatment persistence in non-human primates exposed to Borrelia burgdorferi by tick feeding. PLoS One. 12 (12), 0189071(2017).
- Hodzic, E., Imai, D., Feng, S., Barthold, S. W. Resurgence of persisting non-cultivable Borrelia burgdorferi following antibiotic treatment in mice. PLoS One. 9 (1), 86907(2014).
- Marques, A., et al. Xenodiagnosis to detect Borrelia burgdorferi infection: a first-in-human study. Clin Infect Dis. 58 (7), 937-945 (2014).
- Hodzic, E., Imai, D. M., Escobar, E. Generality of post-antimicrobial treatment persistence of Borrelia burgdorferi strains N40 and B31 in genetically susceptible and resistant mouse strains. Infect Immun. 87 (10), e00442(2019).
- Bockenstedt, L. K., Mao, J., Hodzic, E., Barthold, S. W., Fish, D. Detection of attenuated, noninfectious spirochetes in Borrelia burgdorferi-infected mice after antibiotic treatment. J Infect Dis. 186 (10), 1430-1437 (2002).
- Turk, S., Williams, C., Marques, A. in Borrelia burgdorferi: Methods in Molecular Biology. Pal, U., Buyuktanir, O. , Springer. New York. 337-346 (2018).
- Hodzic, E., Feng, S., Holden, K., Freet, K. J., Barthold, S. W. Persistence of Borrelia burgdorferi following antibiotic treatment in mice. Antimicrob Agents Chemother. 52 (5), 1728-1736 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유