Method Article
Esferoides do fígado humano do sangue periférico para estudos de doença hepática
Neste Artigo
Resumo
Aqui apresentamos um método não genético para gerar esferoides hepáticos autólogos humanos usando células mononucleares isoladas do sangue periférico em estado estacionário.
Resumo
As células hepáticas humanas podem formar uma estrutura tridimensional (3D) capaz de crescer em cultura por algumas semanas, preservando sua capacidade funcional. Devido à sua natureza de se agrupar nos pratos de cultura com características adesivas baixas ou nenhumas, eles formam agregados de múltiplas células hepáticas que são chamadas de esferoides hepáticos humanos. A formação de esferoides hepáticos 3D depende da tendência natural das células hepáticas de se agregarem na ausência de um substrato adesivo. Essas estruturas 3D possuem melhores respostas fisiológicas do que as células, que estão mais próximas de um ambiente in vivo. O uso de culturas de hepatócitos 3D tem inúmeras vantagens quando comparado com culturas bidimensionais clássicas (2D), incluindo um microambiente mais biologicamente relevante, morfologia arquitetônica que remonta órgãos naturais, bem como uma melhor predição sobre o estado da doença e respostas in vivo a drogas. Várias fontes podem ser usadas para gerar esferoides, como tecido hepático primário ou linhas celulares imortalizadas. O tecido hepático 3D também pode ser modificado usando células-tronco embrionárias humanas (hESCs) ou células-tronco pluripotentes induzidas (hiPSCs) para derivar hepatócitos. Obtivemos esferoides hepáticos humanos usando células-tronco pluripotentes derivadas do sangue (BD-PSCs) geradas a partir de sangue periférico não manipulado pela ativação de proteínas ligadas à GPI ligadas à membrana humana e diferenciadas aos hepatócitos humanos. As células hepáticas humanas derivadas de BD-PSCs e os esferoides hepáticos humanos foram analisados por microscopia de luz e imunofenotipagem usando marcadores de hepatócitos humanos.
Introdução
Nos últimos anos, os sistemas de cultura esferoides tridimensionais (3D) tornaram-se uma ferramenta importante para estudar várias áreas de pesquisa sobre o câncer, descoberta de medicamentos e toxicologia. Tais culturas despertam grande interesse porque preenchem a lacuna entre as monocamadas de cultura celular bidimensional (2D) e os órgãos complexos1.
Na ausência de uma superfície adesiva, em comparação com a cultura de células 2D, a formação de esferoides é baseada na afinidade natural dessas células para se agruparem na forma 3D. Essas células se organizam em grupos que consistem em um ou mais tipos de células maduras. Livres de materiais estranhos, essas células interagem umas com as outras como em seu microambiente original. As células em cultura 3D são muito mais próximas e têm uma orientação adequada entre si, com maior produção de matriz extracelular do que as culturas 2D, e constituem um ambiente próximo ao natural 2.
Modelos animais têm sido utilizados há muito tempo para estudar a biologia humana e doenças3. A este respeito, existem diferenças intrínsecas entre humanos e animais, o que torna esses modelos não inteiramente adequados para estudos extrapolativos. Os esferoides e organoides de cultura 3D representam uma ferramenta promissora para estudar a arquitetura, a interação e o crosstalk semelhantes a tecidos entre diferentes tipos de células que ocorrem in vivo e podem contribuir para reduzir ou mesmo substituir modelos animais. Eles são de particular interesse para o estudo da patogênese das doenças hepáticas, bem como das plataformas de triagem de medicamentos4.
A cultura esferoide 3D é de particular importância para a pesquisa do câncer, pois pode eliminar a descontinuidade entre as células e seu ambiente, reduzindo a necessidade de tripsinização ou tratamento com colagenase necessário para preparar as monocamadas de células tumorais para culturas 2D. Os esferoides tumorais permitem o estudo de como as células normais versus malignas recebem e respondem aos sinais de seus arredores5 e são uma parte importante dos estudos de biologia tumoral.
Em comparação com a monocamada, as culturas 3D que consistem em vários tipos de células se assemelham a tecidos tumorais em suas propriedades estruturais e funcionais e, portanto, são adequadas para estudar metástases e invasão de células tumorais. É por isso que tais modelos esferoides estão contribuindo para acelerar a pesquisa sobre o câncer6.
Os esferoides também estão ajudando a desenvolver a tecnologia para criar organoides humanos, porque a biologia de tecidos e órgãos é muito difícil de estudar, particularmente em humanos. O progresso na cultura de células-tronco possibilita o desenvolvimento de culturas 3D como organoides constituídos por células-tronco e progenitores teciduais, bem como diferentes tipos de células maduras (teciduais) de um órgão com algumas características funcionais, como um órgão real, que pode ser usado para modelar o desenvolvimento de órgãos, doenças, mas também podem ser considerados úteis na medicina regenerativa7.
Os hepatócitos humanos primários são geralmente usados para estudar a biologia in vitro dos hepatócitos humanos, a função hepática e a toxicidade induzida por drogas. As culturas de hepatócitos humanos têm duas desvantagens principais, em primeiro lugar, a disponibilidade limitada de tecido primário, como os hepatócitos humanos, e, em segundo lugar, a tendência dos hepatócitos a se desdiferenciarem rapidamente em cultura 2D, perdendo assim sua função específica de hepatócitos8. As culturas hepáticas 3D são superiores a esse respeito e foram recentemente realizadas a partir de células-tronco embrionárias humanas diferenciadas (hESCs) ou células-tronco pluripotentes induzidas (hiPSCs)9. Os esferoides 3D hepáticos de bioengenharia são de particular interesse para estudar o desenvolvimento, a toxicidade, as doenças genéticas e infecciosas do fígado, bem como na descoberta de medicamentos para o tratamento de doenças hepáticas10. Por fim, também têm potencial para serem utilizados clinicamente, sabendo que as doenças hepáticas agudas têm uma taxa de mortalidade de quase 80%, os esferoides hepáticos e/ou hepáticos bioartificiais poderiam potencialmente resgatar esses pacientes, fornecendo função hepática parcial até que um doador adequado possa ser encontrado11.
Estabelecemos um protocolo para a geração de esferoides hepáticos humanos usando células-tronco pluripotentes derivadas do sangue (BD-PSCs) para preparar esferoides de tamanhos diferentes contendo 4000 a 1 x 106 células e analisá-los por meio de microscopia de luz e imunofluorescência. Também testamos a capacidade da função específica dos hepatócitos, avaliando a expressão das enzimas do citocromo P450 3A4 (CYP3A4) e 2E1 (CYP2E1) pertencentes à família do citocromo P450 que têm papéis importantes no metabolismo celular e de drogas através do processo de desintoxicação12.
Protocolo
Obteve-se aprovação ética (ACA CELL Biotech GmbH/25b-5482.2-64-1) para a realização desses experimentos e o termo de consentimento livre e esclarecido foi assinado por todos os doadores antes da extração do sangue, em conformidade com as diretrizes institucionais.
1. Preparação de células mononucleares (MNCs) a partir do sangue periférico humano (PB)
- Extraia 30 mL de sangue de doadores saudáveis com a ajuda de pessoal médico treinado de acordo com o protocolo padrão.
- Isolar PBMNCs utilizando meios de gradiente de densidade de acordo com o protocolo publicado por Becker-Kojić et al.13. Isolar, por pipetagem, a camada interfásica entre o plasma e os meios de gradiente de densidade e usar solução salina tampão fosfato estéril (PBS) para lavar as células isoladas.
- Use uma câmara de contagem e conte o número de células usando métodos padrão.
2. Desdiferenciação das multins após a ativação com glicoproteína humana ancorada no GPI
- Colocar 6 x 106 células mononucleares em PBS/1% de albumina sérica bovina (BSA) em tubo de poliestireno (15 mL) e incubar com o anticorpo específico por 30 min a 37 °C de acordo com Becker-Kojić et al.13.
- Centrifugar as células a 300 x g à temperatura ambiente e substituir PBS/BSA pelo meio Dulbecco modificado de Iscove suplementado com 10% de soro fetal bovino (FBS).
- Cultivar as células em tubos de poliestireno de 15 mL em incubadora de CO2 a 5% a 37 °C por 8-10 dias, conforme descrito em Becker-Kojić et al.13. No dia 5 (D5), adicione 1-2 mL de meio de Iscove suplementado com 10% de FBS a cada tubo de 15 mL.
3. Classificação de células desdiferenciadas recém-geradas
- Centrífuga de suspensão celular cultivada à temperatura ambiente por 10 min a 300 x g e aspirar com pipeta estéril o sobrenadante resultante de acordo com Becker-Kojić et al.13.
- Ressuspender o pellet obtido por centrifugação em 90 μL de tampão PBS frio (PBS pH 7,2, 0,5 % BSA e EDTA 2 mM) e adicionar 10 μL de esferas magnéticas de tamanho nanométrico CD45 positivo e incubar no gelo por 15 min.
- Lavar a suspensão celular com 2 ml de tampão PBS, centrifugar-a a 300 x g durante 10 minutos à temperatura ambiente e adicionar 500 μL de tampão PBS às células e ressuspender completamente.
- Pipetar 500 μL de tampão PBS pré-resfriado na coluna para lavá-lo e colocá-lo no campo magnético usando um suporte magnético.
- Lavar as células colocadas na coluna, duas vezes com 500 μL de tampão PBS e recolher o fluxo contendo células CD45 negativas no meio de Iscove suplementado com 10% de FBS.
- Use uma câmara de contagem para determinar o número de células reprogramadas.
4. Preparação de coberturas de vidro para a geração de hepatócitos humanos
- Separe as tampas de vidro (14 mm) e incube-as em detergente não iônico por 10 min. Lavar as lâminas de vidro em água deionizada até que não restem bolhas e incubá-las em HCl 1M por 30 min (adaptado de Marchenko et al.14).
- Lave as tampas de vidro com água deionizada pelo menos 3x e seque-as durante a noite à temperatura ambiente. Tampas de vidro secas em autoclave em um recipiente adequado.
5. Revestimento de placas de cultura celular com biolaminina para diferenciação hepática 2D de BD-PSCs
- Coloque as tampas de vidro autoclavadas com um par estéril de pinças em 4 placas de poço e acenda as luzes UV por 30 minutos para garantir condições estéreis.
- Descongele as alíquotas de biolaminina e adicione 120 μL de 5 μg/mL de biolaminina a cada folha de tampa de vidro. Deixar as tampas de vidro revestidas durante a noite a 4 °C.
- Remova o excesso de biolaminina e adicione 200 μL de meio de diferenciação de hepatócitos, conforme descrito abaixo.
6. Preparação dos meios de diferenciação dos hepatócitos
- Fazer 500 mL de meio de reposição sérica knockout de hepatoblasto (KSR)/dimetilsulfóxido (DMSO) consistindo de 76,4% de DMEM KNOCKOUT (KO-DMEM), 20% KSR, 0,5% L-glutamina, 1% de aminoácidos não essenciais (NEAA), 0,1% de β-mercaptoetanol, 1% de DMSO e 1% de penicilina-estreptomicina (Pen/Strepto).
- Preparar 500 mL de meio de maturação de hepatócitos contendo 1% de L-glutamina, 10 μM de sal de sódio de hidrocortisona 21-hemisuccinato (CHC) e 1% de Pen/Strep.
- Aliquotar o meio do estoque e adicionar fator de crescimento de hepatócitos frescos (HGF) e oncostatina M (OSM) em concentrações finais de 10 ng/mL e/ou 20 ng/mL para cada mudança de meio.
NOTA: A oncostatina M é uma citocina pertencente ao grupo de citocinas interleucina 6, importante para a hematopoiese, bem como para o desenvolvimento hepático.
7. Cultivo de células hepáticas diferenciadas de BD-PSCs
- Coloque 3 x 105 células BD-PSCS em cada poço de uma placa de 4 poços revestida com biolaminina.
- Colocar as placas de 4 poços na incubadora a 37 °C e a 5% de CO2. Cultive as células por 5 dias em meio hepatoblástico KSR/DMSO que suporta a diferenciação endodérmica e altere o meio a cada dois dias.
- Mudar para o meio de maturação dos hepatócitos no dia 5 e cultivar as células durante mais 7-10 dias na incubadora a 37 °C e 5% de CO2. Mude o meio a cada 48 h.
8.3D diferenciação hepática esferoide
- Conte células usando uma câmara de contagem.
- Centrífuga de suspensão de células desdiferenciadas BD a 300 x g durante 10 min à temperatura ambiente. Remova o sobrenadante e ressuspenda as células BD-desdiferenciadas em meio KSR/DMSO a 2 x 106 células/mL.
- Passe as células através de um filtro celular de 40 μm para garantir uma suspensão de célula única e remover quaisquer detritos adicionais.
- Conte as células usando uma câmara de contagem e prepare um volume suficiente para cada densidade de semeadura celular, a fim de dispensar o volume necessário por poço. Prepare um gradiente com semeadura superior de 1 x 106 células para uma baixa densidade de semeadura de 4000 células.
- Dispensar 100 μL de meio KSR/DMSO em 96 placas de fixação bem baixas e adicionar 100 μL de diluição de semeadura celular.
- Coloque a placa de fixação baixa na incubadora a 37 °C e 5% de CO2 e cultive-a por 5 dias.
- Altere 50% do meio dos dias 3-4 após a semeadura, quando os esferoides estiverem suficientemente compactos.
- No dia 5, mude o meio para o meio de maturação dos hepatócitos e cultive as células por mais 7-10 dias para uma maturação adicional. Mude o meio a cada dois dias.
9. Análise de imunofluorescência de culturas de células hepáticas 2D recém-geradas
- Cultive as células de acordo com o método de diferenciação descrito acima por 4, 8, 15 e 24 dias e remova os meios.
- Incubar células com fixador pré-aquecido constituído por paraformaldeído a 4% em PBS por 10 min. Descarte o fixador e lave as células 2x com PBS por 5 min cada. Adicione imediatamente a solução de tritão X-100 a 0,1% e permeabilize as células por 5 min. Lave 2x com PBS.
- Adicione a solução de bloqueio feita de PBS e BSA a 5% e coloque na placa do balancim por 1 h à temperatura ambiente.
- Diluir anticorpos primários em tampão de diluição 1% BSA/PBS da seguinte forma: albumina (ALB) 1:50, alfa-1 fetoproteína (AFP) 1:250, citoqueratina 18 (CK18) 1:50, fator nuclear de hepatócitos 4 alfa (HNF4α) 1:1000 e transtirretina (TTR) 1:50. Use 50 μL de diluição de anticorpos por poço.
- Incubar as células durante 1 h à temperatura ambiente. Em seguida, descarte a solução de anticorpos, lave as células por 5 minutos e repita a etapa de lavagem 3x.
- Prepare os seguintes anticorpos secundários em tampão de diluição: IgG anti-frango de coelho (vermelho Texas) 1:1000, IgG anti-rato de cabra (488) 1:1000 e anti-coelho de cabra (488) 1:500. Use 50 μL de diluição de anticorpos por poço e incube as células por 30 minutos à temperatura ambiente.
- Lave as células 3x com PBS por 5 min cada e monte as tampas com meios de montagem contendo DAPI para análise microscópica.
10. Coloração viva de esferoides hepáticos recém-formados
- Descarte cuidadosamente os meios de cultura sem tocar nos esferoides, adicione PBS recém-feito com solução de tritão X-100 a 0,1% e incube por 5 minutos para permeabilizar as células.
- Lave os esferoides com o meio pipetando lentamente por 5 min, repita 2x.
- Incubar os esferoides com os anticorpos primários ALB (1:50), AFP (1:250), CK18 (1:50), CYP2E1 (1:200) e CYP3A4 (1:200) preparados em PBS com 1% de BSA por 1 h em 5% de CO2 incubadora a 37 °C. Use 50 μL de diluição de anticorpos por poço.
- Remova cuidadosamente o excesso de solução de anticorpos e lave os esferoides com meio 3x.
- Preparar os anticorpos secundários correspondentes IgG anti-rato de cabra (Cy3), IgG de cabra anti-rato (488) e IgG de coelho anti-frango (Texas red) numa diluição de 1:1000 e 1:500 para cabra anti-coelho (488) em PBS em 1% de BSA. Utilizar 50 μL de diluição de anticorpos por alvéolo e incubar durante 20 min na incubadora a 37 °C e 5% de CO2.
- Lave cuidadosamente 3x com meio e deixe a placa por 30 min na incubadora a 37 °C e 5% de CO2 antes de realizar a microscopia de fluorescência.
11. Exame de esferoides usando um microscópio de fluorescência
- Ligue a fonte de luz de fluorescência 10 minutos antes do uso, ligue o computador e abra o software de imagem.
- Use um objetivo com ampliação de 4x, clique no botão 4x na barra de ferramentas para selecionar a barra de escala correta e, em seguida, coloque a placa de 96 poços na placa central do palco.
- Ligue a fonte de luz LED, use o filtro de campo brilhante e posicione a placa no poço de interesse usando o botão de ajuste de estágio do eixo x-y.
- Mude para o caminho da luz da câmera, clique no botão Viva no software de imagem para visualizar a imagem na tela e verifique se o esferoide está centralizado usando os botões do eixo x-y e o foco usando o botão de foco grosso/fino.
NOTA: A forma dos esferoides permanece constante após a aplicação de coloração ao vivo. - Escolha o método de Observação de campo brilhante na barra de ferramentas, coloque as configurações de exposição como automáticas e clique no botão Instantâneo no painel de controle da câmera para tirar uma foto. Em seguida, salve a imagem como arquivo .vsi usando o nome apropriado na pasta de interesse.
- Coloque a placa de proteção da luz ambiente para desligar a luz LED, mude para filtrar a excitação B, escolha o método de observação 488 na barra de ferramentas, abra o obturador, tire uma foto clicando no botão Instantâneo, feche o obturador e salve o arquivo conforme descrito acima.
- Repita isso com um filtro para excitação G usando o método de observação apropriado (vermelho Texas ou CY3). Em seguida, reitere todo o procedimento para cada poço de interesse.
- Devolver a placa à incubadora de CO2 a 5% a 37 °C e cultivá-la conforme descrito acima.
Resultados
Diferenciamos com sucesso as BD-PSCs humanas em células progenitoras endodérmicas/hepáticas e hepatócitos aplicando um protocolo de duas etapas. As alterações morfológicas durante o processo de diferenciação hepática são mostradas na Figura 1. Os BD-PSCs se diferenciam em hepatócitos que passam por três estágios diferentes. O primeiro estágio representa a diferenciação em células endodérmicas L4, o segundo, a diferenciação em células progenitoras hepáticas (hepatoblastos) L8, exibindo uma morfologia poligonal típica, e o terceiro, a maturação para hepatócitos L15-L24.
A análise de imunofluorescência foi realizada para confirmar a diferenciação hepática das BD-PSCs, conforme apresentado na Figura 2. Forte expressão de marcadores progenitores endodérmicos/hepáticos humanos, como a alfa-fetoproteína (AFP), uma importante proteína plasmática no soro fetal cuja concentração é muito baixa em organismos adultos e, portanto, é considerada como um marcador para o precursor dos hepatócitos15 e a transtirretina (TTR), uma importante proteína de ligação ao hormônio tireoide envolvida no transporte de tiroxina da corrente sanguínea para o cérebro16 são encontrados nas células no primeiro estágio do processo de diferenciação hepática em L4 a L8. No entanto, sua expressão diminui em L15, enquanto a expressão de albumina (ALB), a proteína plasmática mais abundante produzida principalmente pelo fígado e totalmente crítica para a diferenciação hepática, bem como o fator nuclear de hepatócitos 4 alfa (HNF-4α), um fator de transcrição de hepatócitos que está envolvido na expressão de genes específicos do fígado17 aparece primeiramente em L4, sobe ao longo do tempo de diferenciação L4-L15 atingindo uma expressão forte e estável durante o tempo de maturação L15-L24.
A citoqueratina 18 (CK18) é uma proteína citoesquelética, um dos principais componentes do filamento intermediário expresso no fígado18. Os resultados mostram que, como esperado, a expressão de CK18 se correlaciona com hepatócitos maduros (L15-L24), e não é expressa em células progenitoras de hepatócitos.
O protocolo bem definido para diferenciação de hepatócitos em culturas 2D permite a engenharia de culturas 3D hepáticas a partir de BD-PSCs.
Demonstramos aqui que a agregação espontânea dessas células em placas de baixa fixação contendo meio de indução/maturação de hepatócitos inicia a formação de esferoides. A trilha de crescimento foi seguida por células de imagem em L2, L4 e L7. (Figura 3A) Existe uma correlação consistente entre o volume esferoide e a variável número de células, conforme apresentado na Figura 3B.
O fígado é um órgão no qual a maioria das drogas no corpo humano são metabolizadas. O citocromo P450 é uma superfamília de enzimas (monooxigenases) que são de importância fundamental nos processos de metabolismo celular e de drogas, desintoxicação de xenobióticos e homeostase. Para avaliar a potencial atividade funcional de esferoides hepáticos derivados de BD-PSCs, analisamos a expressão de enzimas metabolizadoras de drogas como CYP3A4 e CYP2E1, membros das famílias CYP3 e CYP219.
A maioria das drogas que são usadas hoje, incluindo codeína, ciclosporina A, eritromicina, paracetamol e diazepam, bem como muitos esteroides e carcinógenos, são metabolizados devido à atividade da enzima CY3A420. O CYP2E1 está envolvido no metabolismo de substratos endógenos como etilenoglicol, benzeno, tetracloreto de carbono e, particularmente, o mais importante composto altamente mutagênico como a nitrosamina21.
Os esferoides que são formados e diferenciados de acordo com o protocolo em D14, vivos corados com anticorpos para essas duas enzimas, revelam a potencial atividade funcional hepática dos esferoides derivados de BD-PSCs (Figura 4).

Figura 1: Diferenciação de BD-PSCs para células hepáticas. Micrografias representativas de alterações morfológicas ao longo da diferenciação hepática de BD-PSCs mostrando morfologia endodérmica L4, ou forma poligonal L8 finalmente atingindo o estado de maturação em L15 a L24. Barras de escala: linha superior 50 μm, linha inferior 20 μm. Clique aqui para ver uma versão maior desta figura.
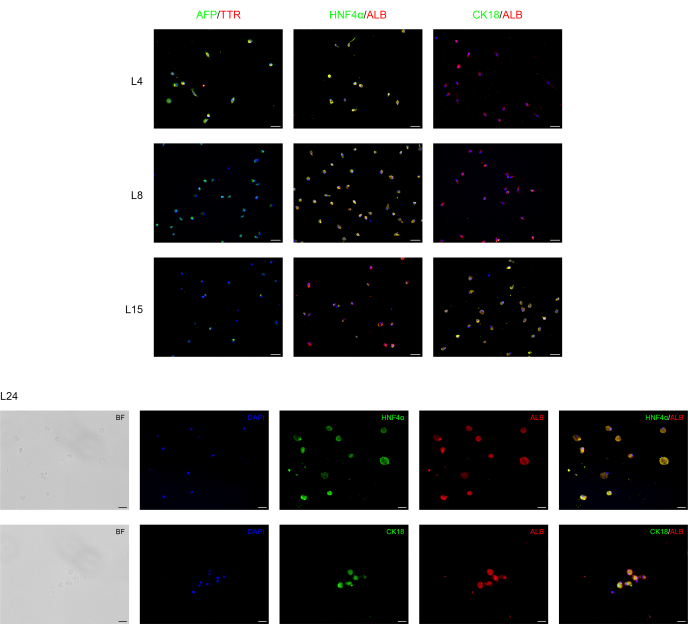
Figura 2: Análise de imunofluorescência da rediferenciação de BD-PSCs em direção às células hepáticas. Marcadores progenitores de endodermes/hepatócitos e específicos de hepatócitos são expressos durante a diferenciação hepática de BD-PSCs em culturas 2D. Nos dias de L4 a L8, as micrografias mostram diminuição da expressão do endoderme/progenitor hepático AFP e TTR, enquanto sua expressão desapareceu de L8-L24. A expressão dos marcadores ALB e HNFα dos hepatócitos surge em L4 e aumenta durante a maturação, enquanto a expressão de CK18 apareceu primeiro em L15, atingindo o máximo em L24. Barras de escala para gráficos L4-L15: 50 μm e para L24: 20 μm. O controle é apresentado na Figura 1 Suplementar. Por favor, clique aqui para ver uma versão maior desta figura.
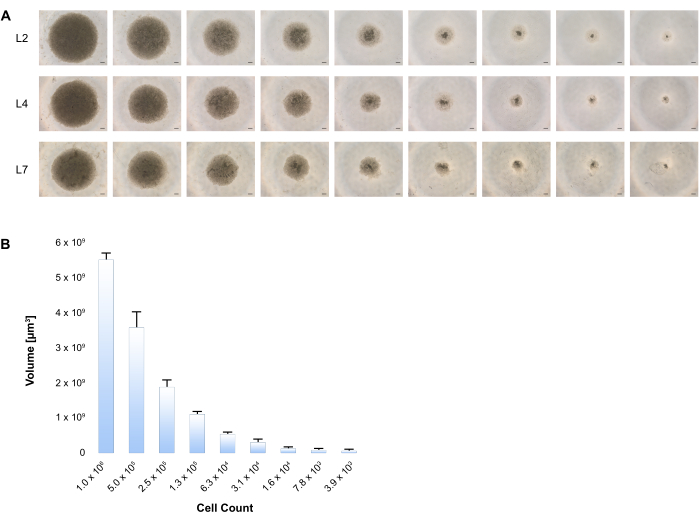
Figura 3: Formação de esferoides 3D após diferenciação hepática de BD-PSCs. (A) Números celulares variáveis de BD-PSCs começando com 1 x 106 a 4000 células foram semeadas em placas de baixa fixação, e a diferenciação foi realizada de acordo com o procedimento de dois estágios, conforme indicado no Protocolo. A geração de esferoides hepáticos humanos 3D foi fotografada em diferentes pontos de tempo, mostrando-se imagens representativas de contraste de fase em cada momento durante o período de cultura. Barra de escala: 200 μm. (B) Diâmetros de pelo menos 4 esferoides hepáticos para cada tamanho foram medidos em L4 usando software de imagem de microscópio e os volumes foram calculados. As barras de erro mostram o desvio padrão. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 4: Os marcadores funcionais dos hepatócitos são expressos em esferoides hepáticos derivados de BD-PSCs. As BD-PSCs foram diferenciadas em hepatócitos. A análise de imunofluorescência direta foi realizada em células vivas em L14 usando anticorpos para ALB, AFP, CK18 e CYP2E1 e CYP3A4, membros da família do citocromo P450. Barra de escala: 200 μm. Clique aqui para ver uma versão maior desta figura.
Figura 1 Suplementar: Controle negativo para análise de imunofluorescência da rediferenciação de BD-PSCs em direção às células hepáticas. Marcadores progenitores de endodermes/hepatócitos e específicos de hepatócitos são expressos durante a diferenciação hepática de BD-PSCs em culturas 2D. Barra de escala: 100 μm. Clique aqui para baixar este arquivo.
Discussão
O fígado é um órgão importante no corpo humano com muitas funções biológicas essenciais, como a desintoxicação de metabólitos. Devido a falhas hepáticas graves, como cirrose e / ou hepatite viral, há quase 2 milhões de mortes por ano em todo o mundo. Os transplantes hepáticos ocupam o segundo lugar em transplantes de órgãos sólidos em todo o mundo, mas apenas cerca de 10% da necessidade atual é atendida22.
Hepatócitos humanos primários (PHH) são frequentemente utilizados para estudar a toxicidade hepática. Essas células podem ser mantidas em cultura por um curto período de tempo mantendo suas funções específicas. Além disso, o número de células disponíveis de um único doador é limitado, além disso, essas células não podem ser expandidas na cultura, portanto, a escassez de PHH do doador continua sendo o principal obstáculo para os estudos de hepatotoxicidade. As PSCs representam uma fonte de renovação de tecidos humanos e podem ser utilizadas para a geração de culturas hepáticas 3D11.
Os sistemas de cultura 3D do fígado apresentam múltiplas vantagens quando comparados aos 2D. O menor tempo de diferenciação e a imitação precisa dos processos in vivo permitem estudos mais precisos sobre a toxicidade induzida por medicamentos, melhor predição da responsabilidade hepática e são mais custo-efetivos23. As culturas esferoides hepáticas devido à sua característica autóloga podem ser uma grande vantagem sobre os hepatócitos humanos primários (PHH), contornando as desvantagens relacionadas ao seu uso e podem se tornar um padrão-ouro para aplicação no teste de toxicidade de drogas e tem uma potencial aplicação futura na medicina regenerativa.
Demonstramos aqui que as BD-PSCs geradas a partir de sangue periférico em estado estacionário podem ser diferenciadas com sucesso em progenitores endodérmicos/hepatócitos/hepatócitos maduros com secreção constante de albumina e estabilidade fenotípica expressando marcadores de hepatócitos. Além disso, as culturas esferoides de hepatócitos humanos 3D modificadas demonstram a atividade funcional potencial expressando as enzimas que pertencem ao citocromo P450, como CYP3A4 e CYP2E1.
O passo mais importante no protocolo é obter boa qualidade e número de novas multinacionais humanas para o processo de reprogramação. O uso de multifuncionais congeladas resulta em um número reduzido de células reprogramadas.
Projetamos esferoides hepáticos humanos usando culturas de PBMNCs ativadas com e sem a aplicação de classificação imunomagnética que separa células reprogramadas de células sanguíneas maduras. A pequena diferença no uso desses dois métodos depende da maior densidade da estrutura 3D ao usar células reprogramadas purificadas. A expressão de marcadores de hepatócitos permanece consistente em ambas as preparações de cultura celular.
Devido à disponibilidade limitada de PHH, o método representa potencialmente a alternativa biologicamente relevante mais próxima aos hepatócitos frescos autólogos para estudar a função hepática in vitro , como metabolismos xenobióticos e toxicidade hepática, intervenção patogênica do hospedeiro e biologia celular em geral. A possibilidade de usar BD-PSCs em medicina regenerativa sendo autóloga e não teratogênica é objeto de novos estudos em nosso laboratório.
Divulgações
A autora correspondente declara que ela é uma detentora de patente relacionada à nova proteína humana ligada ao GPI. Ela co-fundou e trabalha com a ACA CELL Biotech GmbH. Os demais autores declaram não haver conflitos de interesse.
Agradecimentos
Os autores são especialmente gratos pela assistência técnica prestada por Oksana e John Greenacre. Este trabalho foi apoiado pela ACA CELL Biotech GmbH Heidelberg, Alemanha.
Materiais
| Name | Company | Catalog Number | Comments |
| Albumin antibody | Sigma-Aldrich | SAB3500217 | produced in chicken |
| Albumin Fraction V | Carl Roth GmbH+Co. KG | T8444.4 | |
| Alpha-1 Fetoprotein | Proteintech Germany GmbH | 14550-1-AP | rabbit polyclonal IgG |
| Biolaminin 111 LN | BioLamina | LN111-02 | human recombinant |
| CD45 MicroBeads | Miltenyi | 130-045-801 | nano-sized magnetic beads |
| Cell Strainer | pluriSelect | 43-10040-40 | |
| CellSens | Olympus | imaging software | |
| Centrifuge tubes 50 mL | Greiner Bio-One | 210270 | |
| CEROplate 96 well | OLS OMNI Life Science | 2800-109-96 | |
| CKX53 | Olympus | ||
| Commercially available detergent | Procter & Gamble | nonionic detergent | |
| CYP2E1-specific antibody | Proteintech Germany GmbH | 19937-1-AP | rabbit polyclonal antibody IgG |
| CYP3A4 | Proteintech Germany GmbH | 67110-1-lg | mouse monoclonal antibody IgG1 |
| Cytokeratin 18 | DakoCytomation | M7010 | mouse monoclonal antibody IgG1 |
| DMSO | Sigma-Aldrich | D8418-50ML | |
| DPBS | Thermo Fisher Scientific | 14040091 | |
| FBS | Merck Millipore | S0115/1030B | Discontinued. Available under: TMS-013-B |
| Glass cover slips 14 mm | R. Langenbrinck | 01-0014/1 | |
| GlutaMax 100x Gibco | Thermo Fisher Scientific | 35050038 | L-glutamine |
| Glutaraldehyde 25% | Sigma-Aldrich | G588.2-50ML | |
| Goat anti-mouse IgG Cy3 | Antibodies online | ABIN1673767 | polyclonal |
| Goat anti-mouse IgG DyLight 488 | Antibodies online | ABIN1889284 | polyclonal |
| Goat anti-rabbit IgG Alexa Fluor 488 | Life Technologies | A-11008 | |
| HCl | Sigma-Aldrich | 30721-1LGL | |
| HepatoZYME-SFM | Thermo Fisher Scientific | 17705021 | hepatocyte maturation medium |
| HGF | Thermo Fisher Scientific | PHG0324 | human recombinant |
| HNF4α antibody | Sigma-Aldrich | ZRB1457-25UL | clone 4C19 ZooMAb Rbmono |
| Hydrocortisone 21-hemisuccinate (sodium salt) | Biomol | Cay18226-100 | |
| Knock out Serum Replacement - Multi Species Gibco | Fisher Scientific | A3181501 | KSR |
| KnockOut DMEM/F-12 | Thermo Fisher Scientific | 12660012 | Discontinued. Available under Catalog No. 10-828-010 |
| MACS Buffer | Miltenyi | 130-091-221 | |
| MACS MultiStand | Miltenyi | 130-042-303 | magnetic stand |
| MEM NEAA 100x Gibco | Thermo Fisher Scientific | 11140035 | |
| Mercaptoethanol | Thermo Fisher Scientific | 31350010 | 50mM |
| MiniMACS columns | Miltenyi | 130-042-201 | |
| Nunclon Multidishes | Sigma-Aldrich | D6789 | 4 well plates |
| Oncostatin M | Thermo Fisher Scientific | PHC5015 | human recombinant |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PBS sterile | Carl Roth GmbH+Co. KG | 9143.2 | |
| Penicillin/Streptomycin | Biochrom GmbH | A2213 | 10000 U/ml |
| PS 15ml tubes sterile | Greiner Bio-One | 188171 | |
| Rabbit anti-chicken IgG Texas red | Antibodies online | ABIN637943 | |
| Roti Cell Iscoves MDM | Carl Roth GmbH+Co. KG | 9033.1 | |
| Roti Mount FluorCare DAPI | Carl Roth GmbH+Co. KG | HP20.1 | |
| Roti Sep 1077 human | Carl Roth GmbH+Co. KG | 0642.2 | |
| Transthyretin antibody | Sigma-Aldrich | SAB3500378 | produced in chicken |
| Triton X-100 | Thermo Fisher Scientific | HFH10 | 1% |
Referências
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Ryu, N. E., Lee, S. H., Park, H. Spheroid culture system methods and applications for mesenchymal stem cells. Cells. 8 (12), 1620(2019).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- Ingelman-Sundberg, M., Lauschke, V. M. 3D human liver spheroids for translational pharmacology and toxicology. Basic and Clinical Pharmacology and Toxicology. 130, Suppl 1 5-15 (2022).
- Nelson, C. M., Bissell, M. J. Of extracellular matrix, scaffolds, and signalling: tissue architecture regulates development, homeostasis, and cancer. Annual review of cell and developmental biology. 22, 287-309 (2006).
- Khanna, S., Chauhan, A., Bhatt, A. N., Dwarakanath, B. S. R. Multicellular tumor spheroids as in vitro models for studying tumor responses to anticancer therapies. Animal Biotechnology (Second Edition). , Academic Press. Chapter 13 251-268 (2020).
- Rossi, G., Manfrin, A., Lutolf, M. P. Progress and potential in organoid research. Nature Reviews Genetics. 19 (11), 671-687 (2018).
- Riede, J., Wollmann, B. M., Molden, E., Ingelman-Sundberg, M. Primary human hepatocyte spheroids as an in vitro tool for investigating drug compounds with low clearance. Drug metabolism and disposition: The Biological Fate of Chemicals. 49 (7), 501-508 (2021).
- Soto-Gutierrez, A., et al. Differentiating stem cells into liver. Biotechnology & Genetic Engineering Reviews. 25, 149-163 (2008).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964(2020).
- Chen, S., et al. Hepatic spheroids derived from human induced pluripotent stem cells in bio-artificial liver rescue porcine acute liver failure. Cell Research. 30 (1), 95-97 (2020).
- Zhao, M., et al. Cytochrome P450 enzymes and drug metabolism in humans. International Journal of Molecular Sciences. 22 (23), 12808(2021).
- Becker-Kojić, Z. A., Schott, A. K., Zipančić, I., Hernández-Rabaza, V. GM-Free generation of blood-derived neuronal cells. Journal of Visualized Experiments. (168), e61634(2021).
- Marchenko, S., Flanagan, L. Immunocytochemistry: Human neural stem cells. Journal of Visualized Experiments. (7), e267(2007).
- Crandall, B. F. Alpha-fetoprotein: a review. Critical Reviews in Clinical Laboratory Sciences. 15 (2), 127-185 (1981).
- Magalhães, J., Eira, J., Liz, M. A. The role of transthyretin in cell biology: impact on human pathophysiology. Cellular and Molecular Life Sciences 2021. 78 (17-18), 6105-6117 (2021).
- Huck, I., Gunewardena, S., Espanol-Suner, R., Willenbring, H., Apte, U. Hepatocyte nuclear factor 4 alpha activation is essential for termination of liver regeneration in mice. Hepatology. 70 (2), 666-681 (2019).
- Korver, S., et al. The application of cytokeratin-18 as a biomarker for drug-induced liver injury. Archives of Toxicology. 95 (11), 3435-3448 (2021).
- Klyushova, L. S., Perepechaeva, M. L., Grishanova, A. Y. The role of CYP3A in health and disease. Biomedicines. 10 (11), 2686(2022).
- Fujino, C., Sanoh, S., Katsura, T. Variation in expression of cytochrome P450 3A isoforms and toxicological effects: endo- and exogenous substances as regulatory factors and substrates. Biological & Pharmaceutical Bulletin. 44 (11), 1617-1634 (2021).
- Hutchinson, M. R., Menelaou, A., Foster, D. J., Coller, J. K., Somogyi, A. A. CYP2D6 and CYP3A4 involvement in the primary oxidative metabolism of hydrocodone by human liver microsomes. British Journal of Clinical Pharmacology. 57 (3), 287-297 (2004).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Kammerer, S. Three-dimensional liver culture systems to maintain primary hepatic properties for toxicological analysis in vitro. International Journal of Molecular Sciences. 22 (19), 10214(2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados