Method Article
Sphéroïdes hépatiques humains provenant du sang périphérique pour les études sur les maladies du foie
Dans cet article
Résumé
Nous présentons ici une méthode non génétique pour générer des sphéroïdes hépatiques autologues humains en utilisant des cellules mononucléaires isolées du sang périphérique à l’état d’équilibre.
Résumé
Les cellules hépatiques humaines peuvent former une structure tridimensionnelle (3D) capable de croître en culture pendant quelques semaines, préservant ainsi leur capacité fonctionnelle. En raison de leur nature à se regrouper dans les boîtes de culture avec des caractéristiques adhésives faibles ou nulles, ils forment des agrégats de plusieurs cellules hépatiques appelées sphéroïdes hépatiques humains. La formation de sphéroïdes hépatiques 3D repose sur la tendance naturelle des cellules hépatiques à s’agréger en l’absence d’un substrat adhésif. Ces structures 3D possèdent de meilleures réponses physiologiques que les cellules, qui sont plus proches d’un environnement in vivo . L’utilisation de cultures d’hépatocytes 3D présente de nombreux avantages par rapport aux cultures bidimensionnelles classiques (2D), notamment un microenvironnement biologiquement plus pertinent, une morphologie architecturale qui réassemble les organes naturels ainsi qu’une meilleure prédiction de l’état de la maladie et des réponses in vivo aux médicaments. Diverses sources peuvent être utilisées pour générer des sphéroïdes, comme le tissu hépatique primaire ou les lignées cellulaires immortalisées. Le tissu hépatique 3D peut également être modifié en utilisant des cellules souches embryonnaires humaines (CSEh) ou des cellules souches pluripotentes induites (CSPhi) pour obtenir des hépatocytes. Nous avons obtenu des sphéroïdes hépatiques humains en utilisant des cellules souches pluripotentes dérivées du sang (BD-PSC) générées à partir de sang périphérique non manipulé par activation de la protéine liée à la GPI liée à la membrane humaine et différenciée aux hépatocytes humains. Les cellules hépatiques humaines dérivées des BD-PSC et les sphéroïdes hépatiques humains ont été analysés par microscopie optique et immunophénotypage à l’aide de marqueurs hépatocytes humains.
Introduction
Au cours des dernières années, les systèmes de culture sphéroïde tridimensionnels (3D) sont devenus un outil important pour étudier divers domaines de la recherche sur le cancer, de la découverte de médicaments et de la toxicologie. De telles cultures suscitent un grand intérêt car elles comblent le fossé entre les monocouches de culture cellulaire bidimensionnelles (2D) et les organes complexes1.
En l’absence de surface adhésive, par rapport à la culture cellulaire 2D, la formation de sphéroïdes est basée sur l’affinité naturelle de ces cellules pour se regrouper sous forme 3D. Ces cellules s’organisent en groupes constitués d’un ou plusieurs types de cellules matures. Exemptes de corps étrangers, ces cellules interagissent les unes avec les autres comme dans leur microenvironnement d’origine. Les cellules en culture 3D sont beaucoup plus proches et ont une orientation appropriée les unes vers les autres, avec une production de matrice extracellulaire plus élevée que les cultures 2D, et constituent un environnement proche de la nature 2.
Les modèles animaux sont utilisés depuis longtemps pour étudier la biologie humaine et les maladies3. À cet égard, il existe des différences intrinsèques entre les humains et les animaux, ce qui rend ces modèles pas tout à fait adaptés aux études extrapolatives. Les sphéroïdes et les organoïdes de culture 3D représentent un outil prometteur pour étudier l’architecture, l’interaction et la diaphonie tissulaires entre différents types de cellules qui se produisent in vivo et peuvent contribuer à réduire, voire à remplacer, les modèles animaux. Ils présentent un intérêt particulier pour l’étude de la pathogenèse des maladies du foie ainsi que des plateformes de criblagede médicaments 4.
La culture sphéroïde 3D revêt une importance particulière pour la recherche sur le cancer, car elle peut éliminer la discontinuité entre les cellules et leur environnement en réduisant le besoin de trypsinisation ou de traitement par collagénase nécessaire à la préparation des monocouches de cellules tumorales pour les cultures 2D. Les sphéroïdes tumoraux permettent d’étudier comment les cellules normales par rapport aux cellules malignes reçoivent et répondent aux signaux de leur environnement5 et constituent une partie importante des études de biologie tumorale.
Par rapport à la monocouche, les cultures 3D composées de différents types de cellules ressemblent aux tissus tumoraux dans leurs propriétés structurelles et fonctionnelles et conviennent donc à l’étude des métastases et de l’invasion des cellules tumorales. C’est pourquoi de tels modèles sphéroïdes contribuent à accélérer la recherche sur le cancer6.
Les sphéroïdes aident également à développer la technologie pour créer des organoïdes humains parce que la biologie des tissus et des organes est très difficile à étudier, en particulier chez les humains. Les progrès de la culture de cellules souches permettent de développer des cultures 3D comme des organoïdes constitués de cellules souches et de progéniteurs tissulaires ainsi que différents types de cellules matures (tissulaires) à partir d’un organe présentant certaines caractéristiques fonctionnelles comme un organe réel qui peut être utilisé pour modéliser le développement des organes, les maladies, mais elles peuvent également être considérées comme utiles en médecine régénérative7.
Les hépatocytes humains primaires sont généralement utilisés pour étudier in vitro la biologie des hépatocytes humains, la fonction hépatique et la toxicité induite par les médicaments. Les cultures d’hépatocytes humains présentent deux inconvénients principaux, d’une part, la disponibilité limitée de tissus primaires comme les hépatocytes humains, et d’autre part, la tendance des hépatocytes à se dédifférencier rapidement en culture 2D, perdant ainsi leur fonction hépatocytes spécifique8. Les cultures hépatiques 3D sont supérieures à cet égard et ont récemment été fabriquées à partir de cellules souches embryonnaires humaines différenciées (CSEh) ou de cellules souches pluripotentes induites (CSPhi)9. Les sphéroïdes hépatiques 3D issus de la bio-ingénierie présentent un intérêt particulier pour étudier le développement, la toxicité, les maladies génétiques et infectieuses du foie, ainsi que la découverte de médicaments pour le traitement des maladies du foie10. Enfin, ils ont également le potentiel d’être utilisés cliniquement, sachant que les maladies hépatiques aiguës ont un taux de mortalité de près de 80%, le foie bio-artificiel et / ou les sphéroïdes hépatiques pourraient potentiellement sauver ces patients en fournissant une fonction hépatique partielle jusqu’à ce qu’un donneur approprié puisse être trouvé11.
Nous avons établi un protocole pour la génération de sphéroïdes hépatiques humains à l’aide de cellules souches pluripotentes dérivées du sang (BD-PSC) pour préparer des sphéroïdes de tailles différentes contenant 4000 à 1 x 106 cellules et les avons analysés au moyen de la microscopie optique et de l’immunofluorescence. Nous avons également testé la capacité de la fonction spécifique des hépatocytes, en évaluant l’expression des enzymes du cytochrome P450 3A4 (CYP3A4) et 2E1 (CYP2E1) appartenant à la famille du cytochrome P450 qui jouent un rôle important dans le métabolisme cellulaire et médicamenteux par le processus de désintoxication12.
Protocole
L’approbation éthique a été obtenue (ACA CELL Biotech GmbH/25b-5482.2-64-1) pour effectuer ces expériences et le consentement éclairé a été signé par tous les donneurs avant l’extraction de sang conformément aux directives institutionnelles.
1. Préparation de cellules mononucléées (MNC) à partir de sang périphérique humain (PB)
- Extraire 30 mL de sang de donneurs sains avec l’aide d’un personnel médical formé selon le protocole standard.
- Isoler les PBMNCs à l’aide de milieux à gradient de densité selon le protocole publié par Becker-Kojić et al.13. Isoler, par pipetage, la couche interphasique entre le plasma et le milieu de gradient de densité et utiliser une solution saline tampon phosphate stérile (PBS) pour laver les cellules isolées.
- Utilisez une chambre de comptage et comptez le nombre de cellules en utilisant des méthodes standard.
2. Dédifférenciation des multinationales lors de l’activation avec la glycoprotéine humaine ancrée dans le GPI
- Placer 6 x 106 cellules mononucléaires dans du PBS/albumine sérique bovine (BSA) à 1 % dans un tube en polystyrène (15 mL) et incuber avec l’anticorps spécifique pendant 30 min à 37 °C selon Becker-Kojić et coll.13.
- Centrifuger les cellules à 300 x g à température ambiante et remplacer PBS/BSA par le milieu Dulbecco modifié d’Iscove complété par 10% de sérum bovin fœtal (FBS).
- Faire pousser les cellules dans des tubes de polystyrène de 15 ml dans un incubateur à 5 % de CO2 à 37 °C pendant 8 à 10 jours, comme décrit dans Becker-Kojić et coll.13. Le jour 5 (J5), ajouter 1 à 2 mL du milieu d’Iscove complété par 10 % de FBS à chaque tube de 15 mL.
3. Tri des cellules dédifférenciées nouvellement générées
- Centrifuger la suspension cellulaire cultivée à température ambiante pendant 10 min à 300 x g et aspirer avec une pipette stérile le surnageant résultant selon Becker-Kojić et al.13.
- Resuspendre la pastille obtenue par centrifugation dans 90 μL de tampon PBS froid (PBS pH 7,2, 0,5 % BSA et 2 mM EDTA) et ajouter 10 μL de billes magnétiques de taille nanométrique CD45 positives et incuber sur glace pendant 15 min.
- Lavez la suspension cellulaire avec 2 mL de tampon PBS, centrifugez-la à 300 x g pendant 10 min à température ambiante et ajoutez 500 μL de tampon PBS aux cellules et remettez soigneusement en suspension.
- Pipeter 500 μL de tampon PBS prérefroidi dans la colonne pour le laver et le placer dans le champ magnétique à l’aide d’un support magnétique.
- Laver deux fois les cellules placées sur la colonne avec 500 μL de tampon PBS et recueillir les cellules CD45 négatives dans le milieu d’Iscove complétées par 10% de FBS.
- Utilisez une chambre de comptage pour déterminer le nombre de cellules reprogrammées.
4. Préparation de lamelles de verre pour la génération d’hépatocytes humains
- Séparer les lamelles de verre (14 mm) et les incuber dans un détergent non ionique pendant 10 min. Laver les lamelles de verre dans de l’eau désionisée jusqu’à ce qu’il ne reste plus de bulles et les incuber dans 1M HCl pendant 30 minutes (adapté de Marchenko et al.14).
- Lavez les lamelles de verre avec de l’eau désionisée au moins 3x et séchez-les pendant la nuit à température ambiante. Enveloppes en verre séché autoclave dans un récipient approprié.
5. Revêtement de plaques de culture cellulaire avec de la biolaminine pour la différenciation hépatique 2D des CSP-BD
- Placez les lamelles de verre autoclavées avec une pince à épiler stérile dans 4 plaques de puits et allumez les lampes UV pendant 30 minutes pour assurer des conditions stériles.
- Décongeler les aliquotes de biolaminine et ajouter 120 μL de biolaminine à 5 μg/mL à chaque glissement de couvercle en verre. Laisser les lamelles de verre couchées pendant la nuit à 4 °C.
- Enlever l’excès de biolaminine et ajouter 200 μL de milieu de différenciation des hépatocytes comme décrit ci-dessous.
6. Préparation des milieux de différenciation des hépatocytes
- Fabriquer 500 mL de milieu de remplacement du sérum knockout à l’hépatoblast (KSR)/diméthylsulfoxyde (DMSO) composé de 76,4 % de DMEM KNOCKOUT (KO-DMEM), 20 % de KSR, 0,5 % de L-glutamine, 1 % d’acides aminés non essentiels (NEAA), 0,1 % de β-mercaptoéthanol, 1 % de DMSO et 1 % de pénicilline-streptomycine (Pen/Strep).
- Préparer 500 mL de milieu de maturation hépatocytes contenant 1 % de L-glutamine, 10 μM d’hydrocortisone 21-hémisuccinate de sel de sodium (CHC) et 1 % de Pen/Strep.
- Aliquote du stock et ajouter le facteur de croissance des hépatocytes frais (HGF) et l’oncostatine M (OSM) à des concentrations finales de 10 ng/mL et/ou 20 ng/mL pour chaque changement de milieu.
NOTE: L’oncostatine M est une cytokine appartenant au groupe des cytokines interleukine 6, importante pour l’hématopoïèse ainsi que pour le développement du foie.
7. Culture de cellules hépatiques différenciées des CSP-BD
- Mettez 3 x 105 cellules BD-PSCS dans chaque puits d’une plaque de 4 puits recouverte de biolaminine.
- Placer les plaques à 4 puits dans l’incubateur à 37 °C et 5% de CO2. Culture des cellules pendant 5 jours dans un milieu hépatoblast KSR/DMSO qui soutient la différenciation endodermique et changer le milieu tous les deux jours.
- Passer au milieu de maturation des hépatocytes au jour 5 et cultiver les cellules pendant 7 à 10 jours supplémentaires dans l’incubateur à 37 °C et 5% de CO2. Changez le milieu toutes les 48 h.
8.3D Différenciation hépatique sphéroïde
- Comptez les cellules à l’aide d’une chambre de comptage.
- Centrifuger la suspension cellulaire dédifférenciée BD à 300 x g pendant 10 min à température ambiante. Retirer le surnageant et remettre en suspension les cellules dédifférenciées en BD dans un milieu KSR/DMSO à 2 x 106 cellules/mL.
- Passez les cellules dans une crépine cellulaire de 40 μm pour assurer une suspension unicellulaire et éliminer tout débris supplémentaire.
- Compter les cellules à l’aide d’une chambre de comptage et préparer un volume suffisant pour chaque densité d’ensemencement cellulaire afin de distribuer le volume requis par puits. Préparer un gradient avec un ensemencement supérieur de 1 x 106 cellules jusqu’à une faible densité d’ensemencement de 4000 cellules.
- Distribuer 100 μL de milieu KSR/DMSO dans 96 plaques de fixation bien basses et ajouter 100 μL de dilution d’ensemencement cellulaire.
- Placer la plaque de fixation basse dans l’incubateur à 37 °C et 5% de CO2 et les cultiver pendant 5 jours.
- Changez 50% du milieu à partir des jours 3-4 après l’ensemencement lorsque les sphéroïdes sont suffisamment compacts.
- Le jour 5, changez le milieu en milieu de maturation hépatocytes et cultivez les cellules pendant 7 à 10 jours supplémentaires pour une maturation ultérieure. Changez le support tous les deux jours.
9. Analyse d’immunofluorescence de cultures de cellules hépatiques 2D nouvellement générées
- Cultivez les cellules selon la méthode de différenciation décrite ci-dessus pendant 4, 8, 15 et 24 jours et retirez le milieu.
- Incuber les cellules avec un fixateur préchauffé composé de 4% de paraformaldéhyde dans du PBS pendant 10 min. Jeter le fixateur et laver les cellules 2x avec du PBS pendant 5 min chacune. Ajouter immédiatement la solution de triton X-100 à 0,1% et perméabiliser les cellules pendant 5 min. Lavez 2x avec PBS.
- Ajouter une solution de blocage à base de PBS et de BSA à 5% et placer sur la plaque à bascule pendant 1 h à température ambiante.
- Diluer les anticorps primaires dans le tampon de dilution 1% BSA/PBS comme suit : albumine (ALB) 1:50, alpha-1 fœtoprotéine (AFP) 1:250, cytokératine 18 (CK18) 1:50, facteur nucléaire hépatocytes 4 alpha (HNF4α) 1:1000 et transthyrétine (TTR) 1:50. Utiliser 50 μL de dilution d’anticorps par puits.
- Incuber les cellules pendant 1 h à température ambiante. Ensuite, jetez la solution d’anticorps, lavez les cellules pendant 5 minutes et répétez l’étape de lavage 3x.
- Préparer les anticorps secondaires suivants dans un tampon de dilution : IgG anti-poulet de lapin (rouge Texas) 1:1000, IgG anti-souris de chèvre (488) 1:1000 et anti-lapin de chèvre (488) 1:500. Utiliser 50 μL de dilution d’anticorps par puits et incuber les cellules pendant 30 min à température ambiante.
- Lavez les cellules 3x avec du PBS pendant 5 min chacune et montez les lamelles de couverture avec un support de montage contenant DAPI pour une analyse microscopique.
10. Coloration vivante des sphéroïdes hépatiques nouvellement formés
- Jetez soigneusement les milieux de culture sans toucher les sphéroïdes, ajoutez du PBS fraîchement préparé avec une solution de triton X-100 à 0,1% et incuber pendant 5 minutes pour perméabiliser les cellules.
- Laver les sphéroïdes avec le milieu en pipetant lentement pendant 5 min, répéter 2x.
- Incuber les sphéroïdes avec les anticorps primaires ALB (1:50), AFP (1:250), CK18 (1:50), CYP2E1 (1:200) et CYP3A4 (1:200) préparés dans du PBS avec 1% de BSA pendant 1 h dans un incubateur de CO2 à 5% à 37 °C. Utiliser 50 μL de dilution d’anticorps par puits.
- Retirez délicatement l’excès de solution d’anticorps et lavez les sphéroïdes avec un milieu 3x.
- Préparer les anticorps secondaires correspondants IgG anti-souris de chèvre (Cy3), d’IgG anti-souris de chèvre (488) et d’IgG anti-poulet de lapin (Texas rouge) à une dilution de 1:1000 et 1:500 pour les anti-lapins de chèvre (488) dans du PBS dans 1% BSA. Utiliser 50 μL de dilution d’anticorps par puits et incuber pendant 20 min dans l’incubateur à 37 °C et 5% de CO2.
- Laver soigneusement 3x avec du milieu et laisser la plaque pendant 30 min dans l’incubateur à 37 °C et 5% de CO2 avant d’effectuer la microscopie à fluorescence.
11. Examen des sphéroïdes au microscope à fluorescence
- Allumez la source lumineuse de fluorescence 10 min avant utilisation, allumez l’ordinateur et ouvrez le logiciel d’imagerie.
- Utilisez un objectif avec un grossissement 4x, cliquez sur le bouton 4x dans la barre d’outils pour sélectionner la barre d’échelle correcte, puis placez la plaque de 96 puits sur la plaque centrale de la scène.
- Allumez la source lumineuse LED, utilisez le filtre de fond clair et positionnez la plaque sur le puits d’intérêt à l’aide du bouton de réglage de la scène de l’axe x-y.
- Passez au trajet lumineux de la caméra, cliquez sur le bouton Live dans le logiciel d’imagerie pour visualiser l’image à l’écran et assurez-vous que le sphéroïde est centré à l’aide des boutons de l’axe x-y et faites la mise au point à l’aide du bouton de mise au point grossière/fine.
REMARQUE: La forme des sphéroïdes reste constante après l’application de coloration vivante. - Choisissez la méthode d’observation en fond clair dans la barre d’outils, définissez les paramètres d’exposition sur automatique, puis cliquez sur le bouton Snapshot dans le panneau de commande de l’appareil photo pour prendre une photo. Enregistrez ensuite l’image en tant que fichier .vsi en utilisant le nom approprié dans le dossier qui vous intéresse.
- Placez la plaque de protection contre la lumière ambiante pour éteindre la lumière LED, passez au filtre pour l’excitation B, choisissez la méthode d’observation 488 dans la barre d’outils, ouvrez l’obturateur, prenez une photo en cliquant sur le bouton Instantané, fermez l’obturateur, puis enregistrez le fichier comme décrit ci-dessus.
- Répétez cette opération avec un filtre pour l’excitation G en utilisant la méthode d’observation appropriée (Texas red ou CY3). Répétez ensuite toute la procédure pour chaque puits d’intérêt.
- Remettre la plaque dans l’incubateur à 5% de CO2 à 37 °C et la cultiver comme décrit ci-dessus.
Résultats
Nous avons réussi à différencier les CSD-BD humaines en cellules progénitrices endodermiques/hépatiques et en hépatocytes en appliquant un protocole en deux étapes. Les changements morphologiques au cours du processus de différenciation hépatique sont illustrés à la figure 1. Les CSP-BD se différencient en hépatocytes passant par trois étapes différentes. La première étape représente la différenciation en cellules endodermiques L4, la deuxième, la différenciation en cellules progénitrices hépatiques (hépatoblastes) L8, présentant une morphologie polygonale typique, et la troisième, la maturation en hépatocytes L15-L24.
Une analyse d’immunofluorescence a été effectuée pour confirmer la différenciation hépatique des CSP-BD, comme le montre la figure 2. Forte expression du marqueur progéniteur de l’endoderme/foie humain, comme l’alpha-fœtoprotéine (AFP), une protéine plasmatique majeure dans le sérum fœtal dont la concentration est très faible dans les organismes adultes et est donc considérée comme un marqueur du précurseur15 des hépatocytes et de la transthyrétine (TTR), une protéine majeure de liaison aux hormones thyroïdiennes impliquée dans le transport de la thyroxine de la circulation sanguine vers le cerveau16 se trouvent dans les cellules au premier stade du processus de différenciation hépatique à L4 à L8. Cependant, leur expression diminue à L15, tandis que l’expression de l’albumine (ALB), la protéine plasmatique la plus abondante produite principalement par le foie et tout à fait critique pour la différenciation hépatique, ainsi que du facteur nucléaire 4 alpha des hépatocytes (HNF-4α), un facteur de transcription des hépatocytes impliqué dans l’expression des gènes spécifiques du foie17 apparaît d’abord à L4, s’élève tout au long du temps de différenciation L4-L15 atteignant une expression forte et stable pendant le temps de maturation L15-L24.
La cytokératine 18 (CK18) est une protéine cytosquelettique, l’un des principaux composants du filament intermédiaire exprimé dans le foie18. Les résultats montrent que, comme prévu, l’expression de CK18 est en corrélation avec les hépatocytes matures (L15-L24) et qu’elle n’est pas exprimée dans les cellules progénitrices des hépatocytes.
Le protocole bien défini pour la différenciation des hépatocytes dans les cultures 2D permet l’ingénierie de cultures 3D hépatiques en commençant par les CSP-BD.
Nous démontrons ici que l’agrégation spontanée de ces cellules dans des plaques de fixation faibles contenant un milieu d’induction/maturation hépatocytes initie la formation de sphéroïdes. La piste de croissance a été suivie par l’imagerie des cellules à L2, L4 et L7. (Figure 3A) Il existe une corrélation constante entre le volume sphéroïde et le nombre variable de cellules, comme le montre la figure 3B.
Le foie est un organe dans lequel la plupart des médicaments dans le corps humain sont métabolisés. Le cytochrome P450 est une superfamille d’enzymes (monooxygénases) qui sont d’une importance cruciale dans les processus du métabolisme médicamenteux et cellulaire, de la désintoxication des xénobiotiques et de l’homéostasie. Pour évaluer l’activité fonctionnelle potentielle des sphéroïdes hépatiques dérivés des BD-PSC, nous avons analysé l’expression d’enzymes métabolisant les médicaments comme le CYP3A4 et le CYP2E1, membres des familles CYP3 et CYP219.
La plupart des médicaments utilisés aujourd’hui, y compris la codéine, la cyclosporine A, l’érythromycine, l’acétaminophène et le diazépam, ainsi que de nombreux stéroïdes et cancérogènes, sont métabolisés en raison de l’activité de l’enzyme20 CY3A4. Le CYP2E1 est impliqué dans le métabolisme des substrats endogènes comme l’éthylène glycol, le benzène, le tétrachlorure de carbone, et en particulier le composé hautement mutagène le plus important comme la nitrosamine21.
Les sphéroïdes qui se forment et se différencient selon le protocole à J14, vivants colorés avec des anticorps dirigés contre ces deux enzymes, révèlent l’activité fonctionnelle hépatique potentielle des sphéroïdes dérivés de BD-PSC (Figure 4).

Figure 1 : Différenciation des CSP-BD en cellules hépatiques. Micrographies représentatives des changements morphologiques tout au long de la différenciation hépatique des BD-PSC montrant une morphologie endodermique L4, ou forme polygonale L8 atteignant finalement l’état de maturation à L15 à L24. Barres d’échelle: rangée supérieure 50 μm, rangée inférieure 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
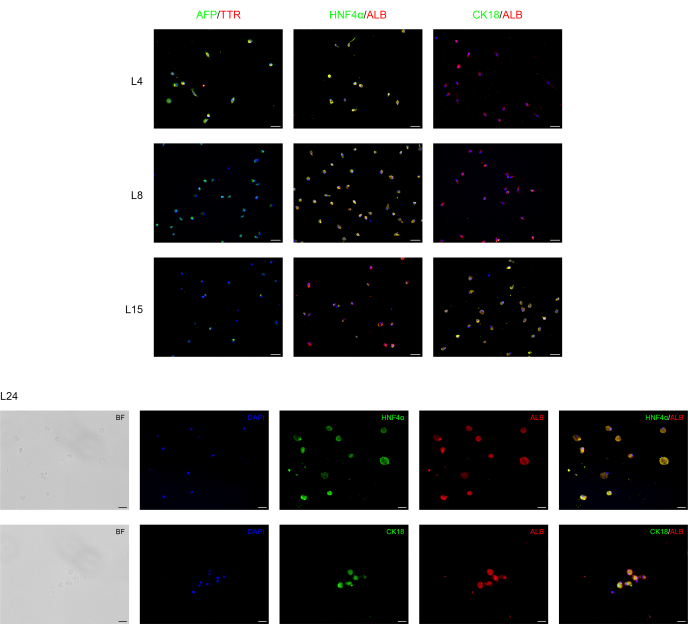
Figure 2 : Analyse par immunofluorescence de la redifférenciation des CSP-BD vers les cellules hépatiques. Les marqueurs spécifiques de l’endoderme/hépatocytes et des hépatocytes sont exprimés lors de la différenciation hépatique des CSP-BD dans des cultures 2D. Les jours L4 à L8, les micrographies montrent une diminution de l’expression de l’endoderme/progéniteur hépatique AFP et TTR alors que leur expression a disparu de L8-L24. L’expression des hépatocytes Les marqueurs ALB et HNFα apparaissent à L4 et augmentent au cours de la maturation, tandis que l’expression de CK18 est apparue d’abord à L15, atteignant le maximum à L24. Barres d’échelle pour les graphes L4-L15 : 50 μm et pour L24 : 20 μm. Le contrôle est présenté à la figure supplémentaire 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
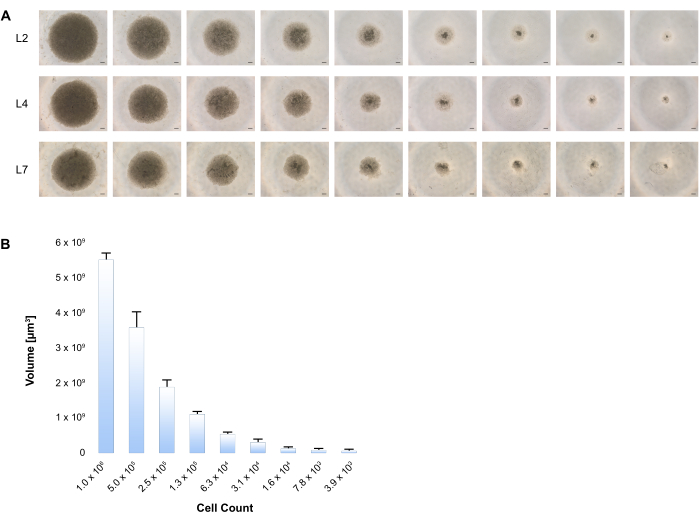
Figure 3 : Formation de sphéroïdes 3D lors de la différenciation hépatique des CSP-BD. (A) Un nombre variable de cellules de CSP-BD commençant par 1 x 106 à 4000 cellules a été ensemencé dans des plaques de fixation basses, et la différenciation a été effectuée selon la procédure en deux étapes décrite dans le Protocole. La génération de sphéroïdes hépatiques humains 3D a été imagée à différents moments, montrant des images représentatives du contraste de phase à chaque moment de la période de culture. Barre d’échelle: 200 μm. (B) Des diamètres d’au moins 4 sphéroïdes hépatiques pour chaque taille ont été mesurés à L4 à l’aide d’un logiciel d’imagerie au microscope et les volumes ont été calculés. Les barres d’erreur indiquent l’écart type. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Les marqueurs fonctionnels des hépatocytes sont exprimés dans les sphéroïdes hépatiques dérivés des BD-PSC. Les CSP-BD ont été différenciées en hépatocytes. Une analyse directe par immunofluorescence a été réalisée sur des cellules vivantes à L14 en utilisant des anticorps dirigés contre ALB, AFP, CK18 et CYP2E1 et CYP3A4, membres de la famille des cytochromes P450. Barre d’échelle: 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Contrôle négatif pour l’analyse par immunofluorescence de la redifférenciation des CSP-BD vers les cellules hépatiques. Les marqueurs spécifiques de l’endoderme/hépatocytes et des hépatocytes sont exprimés lors de la différenciation hépatique des CSP-BD dans des cultures 2D. Barre d’échelle: 100 μm. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le foie est un organe majeur du corps humain avec de nombreuses fonctions biologiques essentielles, telles que la désintoxication des métabolites. En raison d’insuffisances hépatiques graves comme la cirrhose et / ou l’hépatite virale, il y a près de 2 millions de décès par an dans le monde. Les transplantations hépatiques se classent au deuxième rang mondial des transplantations d’organes pleins, mais seulement environ 10% des besoins actuels sont satisfaits22.
Les hépatocytes humains primaires (PHH) sont souvent utilisés pour étudier la toxicité hépatique. Ces cellules peuvent être maintenues en culture pendant une courte période en conservant leurs fonctions spécifiques. En outre, le nombre de cellules disponibles à partir d’un seul donneur est limité, en outre, ces cellules ne peuvent pas être étendues dans la culture par conséquent, la pénurie de PHH de donneur reste le principal obstacle pour les études d’hépatotoxicité. Les CSP représentent une source de renouvellement des tissus humains et peuvent être utilisées pour la génération de cultures hépatiques 3D11.
Les systèmes de culture 3D hépatique présentent de multiples avantages par rapport à la 2D. Un temps de différenciation plus court et une imitation précise des processus in vivo permettent des études plus précises sur la toxicité induite par les médicaments, une meilleure prédiction de la responsabilité hépatique et sont plus rentables23. Les cultures sphéroïdes hépatiques en raison de leur caractéristique autologue pourraient être un grand avantage par rapport aux hépatocytes humains primaires (PHH) contournant les inconvénients liés à leur utilisation et peuvent devenir une référence pour l’application dans les tests de toxicité des médicaments et a une application future potentielle en médecine régénérative.
Nous avons démontré ici que les CSP-BD générées à partir du sang périphérique à l’état d’équilibre peuvent être différenciées avec succès en progéniteurs endodermiques / hépatocytes / hépatocytes matures avec une sécrétion régulière d’albumine et une stabilité phénotypique exprimant des marqueurs hépatocytes. De plus, les cultures de sphéroïdes hépatocytes humains 3D modifiées démontrent l’activité fonctionnelle potentielle en exprimant les enzymes qui appartiennent au cytochrome P450, comme le CYP3A4 et le CYP2E1.
L’étape la plus importante du protocole est d’obtenir une bonne qualité et un bon nombre de multinationales humaines fraîches pour le processus de reprogrammation. L’utilisation de multinationales congelées entraîne une réduction du nombre de cellules reprogrammées.
Nous avons conçu des sphéroïdes hépatiques humains en utilisant des cultures PBMNCs activées avec et sans application de tri immunomagnétique qui sépare les cellules reprogrammées des cellules sanguines matures. La légère différence dans l’utilisation de ces deux méthodes repose sur la densité plus élevée de la structure 3D lors de l’utilisation de cellules purifiées reprogrammées. L’expression des marqueurs hépatocytes reste constante dans les deux préparations de culture cellulaire.
En raison de la disponibilité limitée de PHH, la méthode représente potentiellement l’alternative biologiquement pertinente la plus proche des hépatocytes frais autologues pour étudier la fonction hépatique in vitro , comme les métabolismes xénobiotiques et la toxicité hépatique, l’intervention hôte-pathogène et la biologie cellulaire en général. La possibilité d’utiliser les CSP-BD en médecine régénérative tout en étant autologue et non tératogène fait l’objet d’études complémentaires dans notre laboratoire.
Déclarations de divulgation
L’auteur correspondant déclare qu’elle est titulaire d’un brevet lié à la nouvelle protéine humaine liée au GPI. Elle a cofondé et travaille avec ACA CELL Biotech GmbH. Les autres auteurs déclarent qu’il n’y a pas de conflits d’intérêts.
Remerciements
Les auteurs sont particulièrement reconnaissants de l’assistance technique fournie par Oksana et John Greenacre. Ce travail a été soutenu par ACA CELL Biotech GmbH Heidelberg, Allemagne.
matériels
| Name | Company | Catalog Number | Comments |
| Albumin antibody | Sigma-Aldrich | SAB3500217 | produced in chicken |
| Albumin Fraction V | Carl Roth GmbH+Co. KG | T8444.4 | |
| Alpha-1 Fetoprotein | Proteintech Germany GmbH | 14550-1-AP | rabbit polyclonal IgG |
| Biolaminin 111 LN | BioLamina | LN111-02 | human recombinant |
| CD45 MicroBeads | Miltenyi | 130-045-801 | nano-sized magnetic beads |
| Cell Strainer | pluriSelect | 43-10040-40 | |
| CellSens | Olympus | imaging software | |
| Centrifuge tubes 50 mL | Greiner Bio-One | 210270 | |
| CEROplate 96 well | OLS OMNI Life Science | 2800-109-96 | |
| CKX53 | Olympus | ||
| Commercially available detergent | Procter & Gamble | nonionic detergent | |
| CYP2E1-specific antibody | Proteintech Germany GmbH | 19937-1-AP | rabbit polyclonal antibody IgG |
| CYP3A4 | Proteintech Germany GmbH | 67110-1-lg | mouse monoclonal antibody IgG1 |
| Cytokeratin 18 | DakoCytomation | M7010 | mouse monoclonal antibody IgG1 |
| DMSO | Sigma-Aldrich | D8418-50ML | |
| DPBS | Thermo Fisher Scientific | 14040091 | |
| FBS | Merck Millipore | S0115/1030B | Discontinued. Available under: TMS-013-B |
| Glass cover slips 14 mm | R. Langenbrinck | 01-0014/1 | |
| GlutaMax 100x Gibco | Thermo Fisher Scientific | 35050038 | L-glutamine |
| Glutaraldehyde 25% | Sigma-Aldrich | G588.2-50ML | |
| Goat anti-mouse IgG Cy3 | Antibodies online | ABIN1673767 | polyclonal |
| Goat anti-mouse IgG DyLight 488 | Antibodies online | ABIN1889284 | polyclonal |
| Goat anti-rabbit IgG Alexa Fluor 488 | Life Technologies | A-11008 | |
| HCl | Sigma-Aldrich | 30721-1LGL | |
| HepatoZYME-SFM | Thermo Fisher Scientific | 17705021 | hepatocyte maturation medium |
| HGF | Thermo Fisher Scientific | PHG0324 | human recombinant |
| HNF4α antibody | Sigma-Aldrich | ZRB1457-25UL | clone 4C19 ZooMAb Rbmono |
| Hydrocortisone 21-hemisuccinate (sodium salt) | Biomol | Cay18226-100 | |
| Knock out Serum Replacement - Multi Species Gibco | Fisher Scientific | A3181501 | KSR |
| KnockOut DMEM/F-12 | Thermo Fisher Scientific | 12660012 | Discontinued. Available under Catalog No. 10-828-010 |
| MACS Buffer | Miltenyi | 130-091-221 | |
| MACS MultiStand | Miltenyi | 130-042-303 | magnetic stand |
| MEM NEAA 100x Gibco | Thermo Fisher Scientific | 11140035 | |
| Mercaptoethanol | Thermo Fisher Scientific | 31350010 | 50mM |
| MiniMACS columns | Miltenyi | 130-042-201 | |
| Nunclon Multidishes | Sigma-Aldrich | D6789 | 4 well plates |
| Oncostatin M | Thermo Fisher Scientific | PHC5015 | human recombinant |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PBS sterile | Carl Roth GmbH+Co. KG | 9143.2 | |
| Penicillin/Streptomycin | Biochrom GmbH | A2213 | 10000 U/ml |
| PS 15ml tubes sterile | Greiner Bio-One | 188171 | |
| Rabbit anti-chicken IgG Texas red | Antibodies online | ABIN637943 | |
| Roti Cell Iscoves MDM | Carl Roth GmbH+Co. KG | 9033.1 | |
| Roti Mount FluorCare DAPI | Carl Roth GmbH+Co. KG | HP20.1 | |
| Roti Sep 1077 human | Carl Roth GmbH+Co. KG | 0642.2 | |
| Transthyretin antibody | Sigma-Aldrich | SAB3500378 | produced in chicken |
| Triton X-100 | Thermo Fisher Scientific | HFH10 | 1% |
Références
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Ryu, N. E., Lee, S. H., Park, H. Spheroid culture system methods and applications for mesenchymal stem cells. Cells. 8 (12), 1620(2019).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- Ingelman-Sundberg, M., Lauschke, V. M. 3D human liver spheroids for translational pharmacology and toxicology. Basic and Clinical Pharmacology and Toxicology. 130, Suppl 1 5-15 (2022).
- Nelson, C. M., Bissell, M. J. Of extracellular matrix, scaffolds, and signalling: tissue architecture regulates development, homeostasis, and cancer. Annual review of cell and developmental biology. 22, 287-309 (2006).
- Khanna, S., Chauhan, A., Bhatt, A. N., Dwarakanath, B. S. R. Multicellular tumor spheroids as in vitro models for studying tumor responses to anticancer therapies. Animal Biotechnology (Second Edition). , Academic Press. Chapter 13 251-268 (2020).
- Rossi, G., Manfrin, A., Lutolf, M. P. Progress and potential in organoid research. Nature Reviews Genetics. 19 (11), 671-687 (2018).
- Riede, J., Wollmann, B. M., Molden, E., Ingelman-Sundberg, M. Primary human hepatocyte spheroids as an in vitro tool for investigating drug compounds with low clearance. Drug metabolism and disposition: The Biological Fate of Chemicals. 49 (7), 501-508 (2021).
- Soto-Gutierrez, A., et al. Differentiating stem cells into liver. Biotechnology & Genetic Engineering Reviews. 25, 149-163 (2008).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964(2020).
- Chen, S., et al. Hepatic spheroids derived from human induced pluripotent stem cells in bio-artificial liver rescue porcine acute liver failure. Cell Research. 30 (1), 95-97 (2020).
- Zhao, M., et al. Cytochrome P450 enzymes and drug metabolism in humans. International Journal of Molecular Sciences. 22 (23), 12808(2021).
- Becker-Kojić, Z. A., Schott, A. K., Zipančić, I., Hernández-Rabaza, V. GM-Free generation of blood-derived neuronal cells. Journal of Visualized Experiments. (168), e61634(2021).
- Marchenko, S., Flanagan, L. Immunocytochemistry: Human neural stem cells. Journal of Visualized Experiments. (7), e267(2007).
- Crandall, B. F. Alpha-fetoprotein: a review. Critical Reviews in Clinical Laboratory Sciences. 15 (2), 127-185 (1981).
- Magalhães, J., Eira, J., Liz, M. A. The role of transthyretin in cell biology: impact on human pathophysiology. Cellular and Molecular Life Sciences 2021. 78 (17-18), 6105-6117 (2021).
- Huck, I., Gunewardena, S., Espanol-Suner, R., Willenbring, H., Apte, U. Hepatocyte nuclear factor 4 alpha activation is essential for termination of liver regeneration in mice. Hepatology. 70 (2), 666-681 (2019).
- Korver, S., et al. The application of cytokeratin-18 as a biomarker for drug-induced liver injury. Archives of Toxicology. 95 (11), 3435-3448 (2021).
- Klyushova, L. S., Perepechaeva, M. L., Grishanova, A. Y. The role of CYP3A in health and disease. Biomedicines. 10 (11), 2686(2022).
- Fujino, C., Sanoh, S., Katsura, T. Variation in expression of cytochrome P450 3A isoforms and toxicological effects: endo- and exogenous substances as regulatory factors and substrates. Biological & Pharmaceutical Bulletin. 44 (11), 1617-1634 (2021).
- Hutchinson, M. R., Menelaou, A., Foster, D. J., Coller, J. K., Somogyi, A. A. CYP2D6 and CYP3A4 involvement in the primary oxidative metabolism of hydrocodone by human liver microsomes. British Journal of Clinical Pharmacology. 57 (3), 287-297 (2004).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Kammerer, S. Three-dimensional liver culture systems to maintain primary hepatic properties for toxicological analysis in vitro. International Journal of Molecular Sciences. 22 (19), 10214(2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon