Method Article
Esferoides hepáticos humanos de sangre periférica para estudios de enfermedad hepática
En este artículo
Resumen
Aquí presentamos un método no genético para generar esferoides hepáticos autólogos humanos utilizando células mononucleares aisladas de sangre periférica en estado estacionario.
Resumen
Las células hepáticas humanas pueden formar una estructura tridimensional (3D) capaz de crecer en cultivo durante algunas semanas, preservando su capacidad funcional. Debido a su naturaleza para agruparse en las placas de cultivo con características adhesivas bajas o nulas, forman agregados de múltiples células hepáticas que se denominan esferoides hepáticos humanos. La formación de esferoides hepáticos 3D se basa en la tendencia natural de las células hepáticas a agregarse en ausencia de un sustrato adhesivo. Estas estructuras 3D poseen mejores respuestas fisiológicas que las células, que están más cerca de un entorno in vivo . El uso de cultivos de hepatocitos 3D tiene numerosas ventajas en comparación con los cultivos bidimensionales clásicos (2D), incluido un microambiente biológicamente más relevante, morfología arquitectónica que reensambla órganos naturales, así como una mejor predicción sobre el estado de la enfermedad y las respuestas in vivo a los medicamentos. Se pueden utilizar varias fuentes para generar esferoides, como tejido hepático primario o líneas celulares inmortalizadas. El tejido hepático 3D también se puede diseñar mediante el uso de células madre embrionarias humanas (hESCs) o células madre pluripotentes inducidas (hiPSCs) para derivar hepatocitos. Hemos obtenido esferoides hepáticos humanos utilizando células madre pluripotentes derivadas de la sangre (BD-PSC) generadas a partir de sangre periférica no manipulada mediante la activación de proteínas ligadas a GPI unidas a la membrana humana y diferenciadas a hepatocitos humanos. Las células hepáticas humanas derivadas de BD-PSCs y los esferoides hepáticos humanos se analizaron mediante microscopía óptica e inmunofenotipado utilizando marcadores de hepatocitos humanos.
Introducción
En los últimos años, los sistemas de cultivo de esferoides tridimensionales (3D) se han convertido en una herramienta importante para estudiar diversas áreas de la investigación del cáncer, el descubrimiento de fármacos y la toxicología. Tales cultivos despiertan gran interés porque cierran la brecha entre las monocapas de cultivo celular bidimensionales (2D) y los órganos complejos1.
En ausencia de una superficie adhesiva, en comparación con el cultivo celular 2D, la formación de esferoides se basa en la afinidad natural de estas células para agruparse en forma 3D. Estas células se organizan en grupos que consisten en uno o más tipos de células maduras. Libre de materiales extraños, estas células interactúan entre sí como en su microambiente original. Las células en cultivo 3D están mucho más cerca y tienen una orientación adecuada entre sí, con mayor producción de matriz extracelular que los cultivos 2D, y constituyen un entorno cercano al natural 2.
Los modelos animales se han utilizado durante mucho tiempo para estudiar la biología humana y las enfermedades3. En este sentido, existen diferencias intrínsecas entre humanos y animales, lo que hace que estos modelos no sean del todo adecuados para estudios extrapolativos. Los esferoides y organoides de cultivo 3D representan una herramienta prometedora para estudiar la arquitectura, la interacción y la diafonía similares a los tejidos entre diferentes tipos de células que ocurren in vivo y pueden contribuir a reducir o incluso reemplazar los modelos animales. Son de particular interés para el estudio de la patogénesis de las enfermedades hepáticas, así como las plataformas de detección de drogas4.
El cultivo de esferoides 3D es de particular importancia para la investigación del cáncer, ya que puede eliminar la discontinuidad entre las células y su entorno al reducir la necesidad de tripsinización o tratamiento con colagenasa necesarios para preparar las monocapas de células tumorales para cultivos 2D. Los esferoides tumorales permiten el estudio de cómo las células normales versus malignas reciben y responden a las señales de su entorno5 y son una parte importante de los estudios de biología tumoral.
En comparación con la monocapa, los cultivos 3D que consisten en varios tipos de células se asemejan a los tejidos tumorales en sus propiedades estructurales y funcionales y, por lo tanto, son adecuados para estudiar la metástasis y la invasión de células tumorales. Es por eso que tales modelos esferoides están contribuyendo a acelerar la investigación del cáncer6.
Los esferoides también están ayudando a desarrollar la tecnología para crear organoides humanos porque la biología de tejidos y órganos es muy difícil de estudiar, particularmente en humanos. El progreso en el cultivo de células madre permite desarrollar cultivos 3D como organoides que consisten en células madre y progenitores tisulares, así como diferentes tipos de células maduras (tejidos) de un órgano con algunas características funcionales como un órgano real que puede usarse para modelar el desarrollo de órganos, enfermedades, pero también pueden considerarse útiles en medicina regenerativa7.
Los hepatocitos humanos primarios se utilizan generalmente para estudiar la biología in vitro de los hepatocitos humanos, la función hepática y la toxicidad inducida por fármacos. Los cultivos de hepatocitos humanos tienen dos inconvenientes principales, en primer lugar, la disponibilidad limitada de tejido primario como los hepatocitos humanos, y en segundo lugar, la tendencia de los hepatocitos a desdiferenciarse rápidamente en el cultivo 2D, perdiendo así su función hepatocitos específica8. Los cultivos hepáticos 3D son superiores en este sentido y recientemente se han realizado a partir de células madre embrionarias humanas diferenciadas (hESCs) o células madre pluripotentes inducidas (hiPSCs)9. Los esferoides 3D hepáticos de bioingeniería son de particular interés para estudiar el desarrollo, la toxicidad, las enfermedades genéticas e infecciosas del hígado, así como en el descubrimiento de fármacos para el tratamiento de enfermedades hepáticas10. Por último, también tienen el potencial de ser utilizados clínicamente, sabiendo que las enfermedades hepáticas agudas tienen una tasa de mortalidad de casi el 80%, los esferoides hepáticos y/o hepáticos bioartificiales podrían rescatar a estos pacientes al proporcionar una función hepática parcial hasta que se pueda encontrar un donante adecuado11.
Hemos establecido un protocolo para la generación de esferoides hepáticos humanos utilizando células madre pluripotentes derivadas de sangre (BD-PSCs) para preparar esferoides de diferentes tamaños que contienen 4000 a 1 x 106 células y analizarlos mediante microscopía óptica e inmunofluorescencia. También probamos la capacidad de la función específica de los hepatocitos, evaluando la expresión de las enzimas citocromo P450 3A4 (CYP3A4) y 2E1 (CYP2E1) que pertenecen a la familia del citocromo P450 que tienen papeles importantes en el metabolismo celular y farmacológico a través del proceso de desintoxicación12.
Protocolo
Se obtuvo la aprobación ética (ACA CELL Biotech GmbH/25b-5482.2-64-1) para realizar estos experimentos y todos los donantes firmaron el consentimiento informado antes de la extracción de sangre de acuerdo con las directrices institucionales.
1. Preparación de células mononucleares (EMN) a partir de sangre periférica humana (PB)
- Extraiga 30 ml de sangre de donantes sanos con la ayuda de personal médico capacitado de acuerdo con el protocolo estándar.
- Aislar PBMNCs utilizando medios de gradiente de densidad según el protocolo publicado por Becker-Kojić et al.13. Aísle, mediante pipeteo, la capa de interfase entre el plasma y los medios de gradiente de densidad y utilice solución salina tampón fosfato estéril (PBS) para lavar las células aisladas.
- Use una cámara de conteo y cuente el número de celdas usando métodos estándar.
2. Desdiferenciación de las MNC tras la activación con glicoproteína humana anclada a GPI
- Colocar 6 x 106 células mononucleares en PBS/albúmina sérica bovina (BSA) al 1% en un tubo de poliestireno (15 mL) e incubar con el anticuerpo específico durante 30 min a 37 °C según Becker-Kojić et al.13.
- Centrifugar las células a 300 x g a temperatura ambiente y reemplazar PBS / BSA con el medio de Dulbecco modificado de Iscove suplementado con 10% de suero bovino fetal (FBS).
- Cultivar las células en tubos de poliestireno de 15 ml en una incubadora deCO2 al 5% a 37 °C durante 8-10 días, como se describe en Becker-Kojić et al.13. El día 5 (D5), agregue 1-2 ml de medio de Iscove suplementado con 10% de FBS a cada tubo de 15 ml.
3. Clasificación de células desdiferenciadas recién generadas
- Centrifugar la suspensión de células cultivadas a temperatura ambiente durante 10 min a 300 x g y aspirar con una pipeta estéril el sobrenadante resultante según Becker-Kojić et al.13.
- Resuspender el pellet obtenido por centrifugación en 90 μL de tampón PBS frío (PBS pH 7.2, 0.5 % BSA y 2 mM EDTA) y agregar 10 μL de perlas magnéticas de tamaño nanométrico positivas CD45 e incubar en hielo durante 15 min.
- Lave la suspensión celular con 2 ml de tampón PBS, centrifugarla a 300 x g durante 10 minutos a temperatura ambiente y agregue 500 μL de tampón PBS a las celdas y vuelva a suspenderla completamente.
- Pipetear 500 μL de tampón PBS preenfriado en la columna para lavarlo y colocarlo en el campo magnético utilizando un soporte magnético.
- Lave las células colocadas en la columna, dos veces con 500 μL de tampón PBS y recoja el flujo que contiene células CD45 negativas en el medio de Iscove suplementado con 10% de FBS.
- Utilice una cámara de conteo para determinar el número de células reprogramadas.
4. Preparación de cubreobjetos de vidrio para la generación de hepatocitos humanos
- Separe los cubreobjetos de vidrio (14 mm) e incubarlos en detergente no iónico durante 10 min. Lave los cubreobjetos de vidrio en agua desionizada hasta que no queden burbujas e incubarlos en 1M HCl durante 30 min (adaptado de Marchenko et al.14).
- Lave los cubreobjetos de vidrio con agua desionizada al menos 3 veces y séquelos durante la noche a temperatura ambiente. Cubreobjetos de vidrio secado en autoclave en un recipiente adecuado.
5. Recubrimiento de placas de cultivo celular con biolaminina para la diferenciación hepática 2D de BD-PSCs
- Coloque los cubreobjetos de vidrio esterilizados en autoclave con un par de pinzas estériles en placas de 4 pocillos y encienda las luces UV durante 30 minutos para garantizar condiciones estériles.
- Descongele las alícuotas de biolaminina y añada 120 μL de 5 μg/ml de biolaminina a cada cubreobjetos de vidrio. Dejar los cubreobjetos de vidrio recubierto durante la noche a 4 °C.
- Eliminar el exceso de biolaminina y añadir 200 μL de medio de diferenciación de hepatocitos como se describe a continuación.
6. Preparación de medios de diferenciación de hepatocitos
- Hacer 500 ml de medio de reemplazo sérico knockout de hepatoblastos (KSR)/dimetilsulfóxido (DMSO) que consiste en 76.4% de DMEM KNOCKOUT (KO-DMEM), 20% KSR, 0.5% L-glutamina, 1% de aminoácidos no esenciales (NEAA), 0.1% β-mercaptoetanol, 1% de DMSO y 1% de penicilina-estreptomicina (Pen/Strep).
- Preparar 500 ml de medio de maduración de hepatocitos que contenga 1% de L-glutamina, 10 μM de hidrocortisona 21-hemisuccinato de sodio (HCC) y 1% de pluma/estreptococo.
- Medio alícuota de la cepa y añadir factor de crecimiento de hepatocitos (HGF) y oncostatina M (OSM) frescos a concentraciones finales de 10 ng/ml y/o 20 ng/ml para cada cambio medio.
NOTA: La oncostatina M es una citoquina perteneciente al grupo de citoquinas interleucina 6, importante para la hematopoyesis y para el desarrollo hepático.
7. Cultivo de células hepáticas diferenciadas de BD-PSCs
- Coloque 3 x 105 células BD-PSCS en cada pocillo de una placa de 4 pocillos recubierta con biolaminina.
- Colocar las placas de 4 pocillos en la incubadora a 37 °C y 5% deCO2. Cultive las células durante 5 días en medio de hepatoblastos KSR/DMSO que apoye la diferenciación endodérmica y cambie el medio cada dos días.
- Cambiar al medio de maduración de hepatocitos el día 5 y cultivar las células durante 7-10 días adicionales en la incubadora a 37 °C y 5% deCO2. Cambiar el medio cada 48 h.
8.3D diferenciación hepática esferoide
- Cuente las celdas usando una cámara de conteo.
- Suspensión de celda desdiferenciada BD centrífuga a 300 x g durante 10 min a temperatura ambiente. Eliminar el sobrenadante y resuspender las células desdiferenciadas de BD en medio KSR/DMSO a 2 x 106 células/ml.
- Pase las células a través de un filtro de células de 40 μm para garantizar una suspensión de una sola célula y eliminar cualquier residuo adicional.
- Cuente las células utilizando una cámara de conteo y prepare un volumen suficiente para cada densidad de siembra de células con el fin de dispensar el volumen requerido por pocillo. Prepare un gradiente con siembra superior de 1 x 106 celdas a una densidad de siembra baja de 4000 celdas.
- Dispensar 100 μL de medio KSR/DMSO en 96 placas de fijación bien baja y añadir 100 μL de dilución de siembra celular.
- Colocar la placa de fijación baja en la incubadora a 37 °C y 5% deCO2 y cultivarlas durante 5 días.
- Cambiar el 50% del medio a partir de los días 3-4 después de la siembra cuando los esferoides estén lo suficientemente compactos.
- El día 5, cambie el medio al medio de maduración de hepatocitos y cultive las células durante 7-10 días adicionales para una mayor maduración. Cambie el medio cada dos días.
9. Análisis de inmunofluorescencia de cultivos de células hepáticas 2D recién generados
- Cultive las células de acuerdo con el método de diferenciación descrito anteriormente durante 4, 8, 15 y 24 días y retire los medios.
- Incubar células con fijador precalentado que consiste en paraformaldehído al 4% en PBS durante 10 min. Deseche el fijador y lave las células 2 veces con PBS durante 5 minutos cada una. Agregue inmediatamente una solución de tritón X-100 al 0,1% y permeabilice las células durante 5 minutos. Lavar 2x con PBS.
- Agregue una solución de bloqueo hecha de PBS y BSA al 5% y colóquela en la placa basculante durante 1 h a temperatura ambiente.
- Anticuerpos primarios diluidos en tampón de dilución 1% BSA/PBS de la siguiente manera: albúmina (ALB) 1:50, alfa-1 fetoproteína (AFP) 1:250, citoqueratina 18 (CK18) 1:50, factor nuclear de hepatocitos 4 alfa (HNF4α) 1:1000 y transtiretina (TTR) 1:50. Use 50 μL de dilución de anticuerpos por pocillo.
- Incubar las celdas durante 1 h a temperatura ambiente. Luego deseche la solución de anticuerpos, lave las células durante 5 minutos y repita el paso de lavado 3x.
- Prepare los siguientes anticuerpos secundarios en tampón de dilución: conejo anti-pollo IgG (rojo de Texas) 1:1000, cabra anti-ratón IgG (488) 1:1000 y cabra anti-conejo (488) 1:500. Use 50 μL de dilución de anticuerpos por pocillo e incube las células durante 30 minutos a temperatura ambiente.
- Lave las celdas 3 veces con PBS durante 5 minutos cada una y monte los cubreobjetos con medios de montaje que contengan DAPI para análisis microscópico.
10. Tinción viva de esferoides hepáticos recién formados
- Deseche cuidadosamente los medios de cultivo sin tocar los esferoides, agregue PBS recién hecho con solución de tritón X-100 al 0,1% e incube durante 5 minutos para permeabilizar las células.
- Lave los esferoides con el medio pipeteando lentamente durante 5 minutos, repita 2x.
- Incubar los esferoides con los anticuerpos primarios ALB (1:50), AFP (1:250), CK18 (1:50), CYP2E1 (1:200) y CYP3A4 (1:200) preparados en PBS con BSA al 1% durante 1 h en una incubadora deCO2 al 5% a 37 °C. Use 50 μL de dilución de anticuerpos por pocillo.
- Retire con cuidado el exceso de solución de anticuerpos y lave los esferoides con medio 3x.
- Preparar los anticuerpos secundarios correspondientes cabra anti-ratón IgG (Cy3), cabra anti-ratón IgG (488) y conejo anti-pollo IgG (Texas rojo) en una dilución de 1:1000 y 1:500 para cabra anti-conejo (488) en PBS en 1% BSA. Utilizar 50 μL de dilución de anticuerpos por pocillo e incubar durante 20 min en la incubadora a 37 °C y 5% deCO2.
- Lavar cuidadosamente 3x con medio y dejar la placa durante 30 min en la incubadora a 37 °C y 5% deCO2 antes de realizar la microscopía de fluorescencia.
11. Examen de esferoides utilizando un microscopio de fluorescencia
- Encienda la fuente de luz de fluorescencia 10 minutos antes de usar, encienda la computadora y abra el software de imágenes.
- Use un objetivo con un aumento de 4x, haga clic en el botón 4x en la barra de herramientas para seleccionar la barra de escala correcta, luego coloque la placa de 96 pocillos en la placa central del escenario.
- Encienda la fuente de luz LED, use el filtro de campo claro y coloque la placa en el pozo de interés utilizando la perilla de ajuste de la etapa del eje x.
- Cambie a la trayectoria de la luz de la cámara, haga clic en el botón Live in imaging software para visualizar la imagen en la pantalla y asegúrese de que el esferoide esté centrado usando las perillas del eje x y enfoque usando la perilla de enfoque grueso / fino.
NOTA: La forma de los esferoides permanece constante después de aplicar tinción viva. - Elija el método Brightfield Observation en la barra de herramientas, ponga la configuración de exposición en automático y haga clic en el botón Instantánea en el panel de control de la cámara para tomar una foto. A continuación, guarde la imagen como archivo .vsi utilizando el nombre apropiado en la carpeta de interés.
- Coloque la placa de protección de luz ambiental para apagar la luz LED, cambie al filtro para la excitación B, elija el método de observación 488 en la barra de herramientas, abra el obturador, tome una foto haciendo clic en el botón Instantánea, cierre el obturador y luego guarde el archivo como se describe anteriormente.
- Repita esto con un filtro para la excitación G utilizando el método de observación apropiado (rojo de Texas o CY3). Luego reitere todo el procedimiento para cada pozo de interés.
- Devolver la placa a la incubadora deCO2 al 5% a 37 °C y cultivarla como se ha descrito anteriormente.
Resultados
Diferenciamos con éxito las BD-PSC humanas en células progenitoras endodermas / hepáticas y hepatocitos mediante la aplicación de un protocolo de dos pasos. Los cambios morfológicos durante el proceso de diferenciación hepática se muestran en la Figura 1. Las BD-PSC se diferencian en hepatocitos que pasan por tres etapas diferentes. La primera etapa representa la diferenciación en células endodérmicas L4, la segunda, la diferenciación a células progenitoras hepáticas (hepatoblastos) L8, exhibiendo una morfología poligonal típica, y la tercera, la maduración a hepatocitos L15-L24.
Se realizó un análisis de inmunofluorescencia para confirmar la diferenciación hepática de BD-PSCs como se presenta en la Figura 2. Fuerte expresión del marcador progenitor endodermo/hígado humano, como la alfafetoproteína (AFP), una proteína plasmática importante en el suero fetal cuya concentración es muy baja en organismos adultos y, por lo tanto, se considera un marcador para el precursor15 de los hepatocitos y la transtiretina (TTR), una importante proteína de unión a la hormona tiroidea involucrada en el transporte de tiroxina desde el torrente sanguíneo hasta el cerebro16 se encuentran en las células en la primera etapa del proceso de diferenciación hepática en L4 a L8. Sin embargo, su expresión disminuye en L15, mientras que la expresión de albúmina (ALB), la proteína plasmática más abundante producida principalmente por el hígado y totalmente crítica para la diferenciación hepática, así como el factor nuclear de hepatocitos 4 alfa (HNF-4α), un factor de transcripción de hepatocitos que está involucrado en la expresión de genes específicos del hígado17 aparece en primer lugar en L4, aumenta a lo largo del tiempo de diferenciación L4-L15 alcanzando una expresión fuerte y estable durante el tiempo de maduración L15-L24.
La citoqueratina 18 (CK18) es una proteína citoesquelética, uno de los principales componentes del filamento intermedio expresado en el hígado18. Los resultados muestran que, como era de esperar, la expresión de CK18 se correlaciona con hepatocitos maduros (L15-L24), y no se expresa en células progenitoras de hepatocitos.
El protocolo bien definido para la diferenciación de hepatocitos en cultivos 2D permite la ingeniería de cultivos 3D hepáticos a partir de BD-PSC.
Demostramos aquí que la agregación espontánea de estas células en placas de baja unión que contienen medio de inducción/maduración de hepatocitos inicia la formación de esferoides. La trayectoria de crecimiento fue seguida por imágenes de células en L2, L4 y L7. (Figura 3A) Existe una correlación consistente entre el volumen esferoide y el número variable de células, como se presenta en la Figura 3B.
El hígado es un órgano en el que la mayoría de los medicamentos en el cuerpo humano se metabolizan. El citocromo P450 es una superfamilia de enzimas (monooxigenasas) que son de importancia fundamental en los procesos de metabolismo celular y de fármacos, desintoxicación de xenobióticos y homeostasis. Para evaluar la actividad funcional potencial de los esferoides hepáticos derivados de BD-PSCs, analizamos la expresión de enzimas metabolizadoras de fármacos como CYP3A4 y CYP2E1, miembros de las familias CYP3 y CYP219.
La mayoría de los medicamentos que se usan hoy en día, incluyendo codeína, ciclosporina A, eritromicina, paracetamol y diazepam, así como muchos esteroides y carcinógenos, se metabolizan debido a la actividad de la enzima CY3A420. CYP2E1 está involucrado en el metabolismo de sustratos endógenos como etilenglicol, benceno, tetracloruro de carbono, y particularmente el compuesto altamente mutagénico más importante como la nitrosamina21.
Los esferoides que se forman y diferencian según el protocolo de D14, vivos teñidos con anticuerpos contra estas dos enzimas, revelan la potencial actividad funcional hepática de los esferoides derivados de BD-PSCs (Figura 4).

Figura 1: Diferenciación de BD-PSCs a células de tipo hepático. Micrografías representativas de cambios morfológicos a lo largo de la diferenciación hepática de BD-PSCs que muestran una morfología endodérmica L4, o de forma poligonal L8 que finalmente alcanza el estado de maduración en L15 a L24. Barras de escala: fila superior 50 μm, fila inferior 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
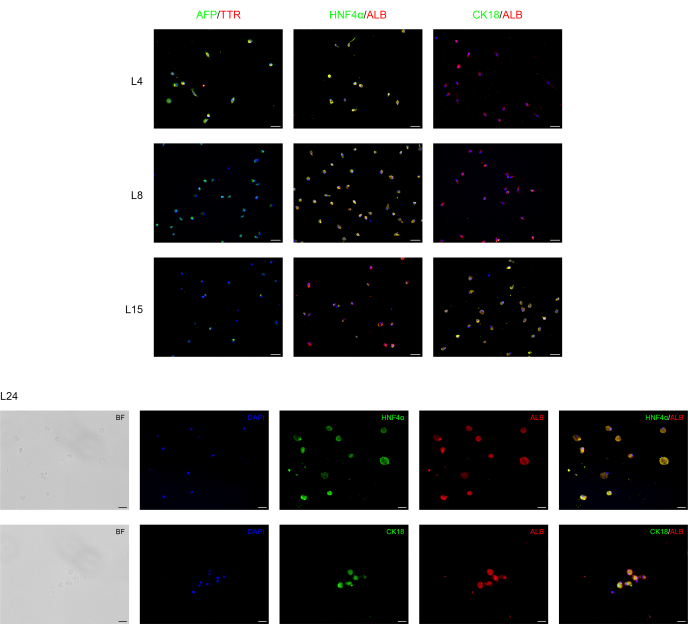
Figura 2: Análisis de inmunofluorescencia de la rediferenciación de BD-PSCs hacia células hepáticas. Los marcadores progenitores de endodermo/hepatocitos y hepatocitos específicos se expresan durante la diferenciación hepática de BD-PSCs en cultivos 2D. En los días L4 a L8, las micrografías muestran una disminución de la expresión del endodermo/progenitor hepático AFP y TTR, mientras que su expresión desapareció de L8-L24. La expresión de los marcadores ALB y HNFα de los hepatocitos surge en L4 y aumenta durante la maduración, mientras que la expresión de CK18 apareció primero en L15, alcanzando el máximo en L24. Barras de escala para los gráficos L4-L15: 50 μm y para L24: 20 μm. El control se presenta en la Figura suplementaria 1. Haga clic aquí para ver una versión más grande de esta figura.
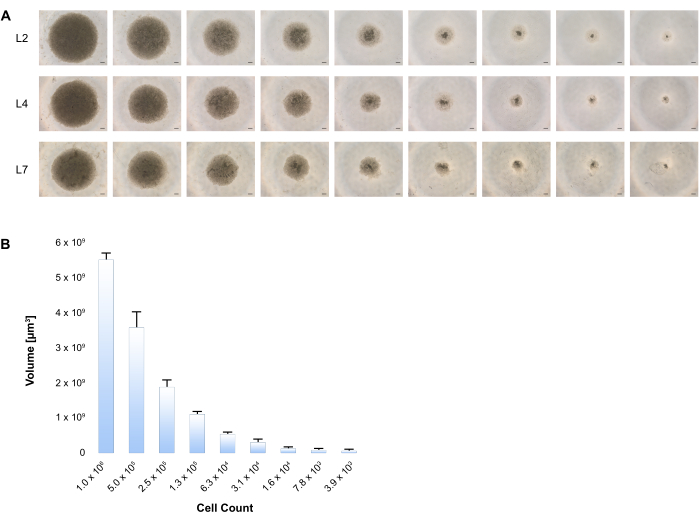
Figura 3: Formación de esferoides 3D tras la diferenciación hepática de BD-PSCs. (A) El número variable de células de BD-PSC comenzando con 1 x 106 a 4000 células se sembraron en placas de unión baja, y la diferenciación se realizó de acuerdo con el procedimiento de dos etapas como se establece en el Protocolo. La generación de esferoides hepáticos humanos en 3D se visualizó en diferentes puntos de tiempo, se muestran imágenes representativas de contraste de fase en cada momento durante el período de cultivo. Barra de escala: 200 μm. (B) Se midieron diámetros de al menos 4 esferoides hepáticos para cada tamaño en L4 utilizando un software de imágenes de microscopio y se calcularon los volúmenes. Las barras de error muestran la desviación estándar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Los marcadores funcionales de hepatocitos se expresan en esferoides hepáticos derivados de BD-PSCs. Las BD-PSC se diferenciaron en hepatocitos. El análisis de inmunofluorescencia directa se realizó en células vivas en L14 utilizando anticuerpos contra ALB, AFP, CK18 y CYP2E1 y CYP3A4, miembros de la familia del citocromo P450. Barra de escala: 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Control negativo para el análisis de inmunofluorescencia de la rediferenciación de BD-PSCs hacia células hepáticas. Los marcadores progenitores de endodermo/hepatocitos y hepatocitos específicos se expresan durante la diferenciación hepática de BD-PSCs en cultivos 2D. Barra de escala: 100 μm. Haga clic aquí para descargar este archivo.
Discusión
El hígado es un órgano importante en el cuerpo humano con muchas funciones biológicas esenciales, como la desintoxicación de metabolitos. Debido a fallas hepáticas graves como cirrosis y / o hepatitis viral, hay casi 2 millones de muertes por año en todo el mundo. Los trasplantes de hígado ocupan el segundo lugar en trasplantes de órganos sólidos en todo el mundo, pero solo alrededor del 10% de la necesidad actual se satisface22.
Los hepatocitos humanos primarios (PHH) se utilizan a menudo para estudiar la toxicidad hepática. Estas células se pueden mantener en cultivo por un corto tiempo conservando sus funciones específicas. Además, el número de células disponibles de un solo donante es limitado, además, estas células no se pueden expandir en el cultivo por lo tanto, la escasez de PHH del donante sigue siendo el principal obstáculo para los estudios de hepatotoxicidad. Las PSCs representan una fuente de renovación de tejidos humanos y pueden ser utilizadas para la generación de cultivos hepáticos 3D11.
Los sistemas de cultivo 3D de hígado muestran múltiples ventajas en comparación con 2D. El tiempo de diferenciación más corto y la imitación precisa de los procesos in vivo permiten estudios más precisos sobre la toxicidad inducida por fármacos, una mejor predicción de la responsabilidad hepática y son más rentables23. Los cultivos de esferoides hepáticos debido a su característica autóloga podrían ser una gran ventaja sobre los hepatocitos humanos primarios (PHH) eludiendo las desventajas relacionadas con su uso y pueden convertirse en un estándar de oro para su aplicación en pruebas de toxicidad de medicamentos y tiene una posible aplicación futura en medicina regenerativa.
Hemos demostrado aquí que las BD-PSC generadas a partir de sangre periférica en estado estacionario se pueden diferenciar con éxito en progenitores endodérmicos / hepatocitos / hepatocitos maduros con secreción constante de albúmina y estabilidad fenotípica que expresa marcadores de hepatocitos. Además, los cultivos de esferoides de hepatocitos humanos 3D diseñados demuestran la actividad funcional potencial al expresar las enzimas que pertenecen al citocromo P450, como CYP3A4 y CYP2E1.
El paso más importante en el protocolo es obtener buena calidad y número de nuevas multinacionales humanas para el proceso de reprogramación. El uso de multinacionales congeladas da como resultado un número reducido de células reprogramadas.
Hemos diseñado esferoides hepáticos humanos utilizando cultivos de PBMNCs activados con y sin aplicar clasificación inmunomagnética que separa las células reprogramadas de las células sanguíneas maduras. La ligera diferencia en el uso de estos dos métodos se basa en la mayor densidad de la estructura 3D cuando se utilizan células reprogramadas purificadas. La expresión de marcadores de hepatocitos permanece consistente en ambas preparaciones de cultivo celular.
Debido a la disponibilidad limitada de PHH, el método representa potencialmente la alternativa biológicamente relevante más cercana a los hepatocitos frescos autólogos para estudiar la función hepática in vitro , como los metabolismos xenobióticos y la toxicidad hepática, la intervención huésped-patógeno y la biología celular en general. La posibilidad de utilizar BD-PSCs en medicina regenerativa siendo autólogo y no teratogénico es objeto de estudios adicionales en nuestro laboratorio.
Divulgaciones
La autora correspondiente declara que es titular de una patente relacionada con la nueva proteína humana ligada a GPI. Es cofundadora y trabaja con ACA CELL Biotech GmbH. Los otros autores declaran que no hay conflictos de intereses.
Agradecimientos
Los autores están especialmente agradecidos por la asistencia técnica proporcionada por Oksana y John Greenacre. Este trabajo fue apoyado por ACA CELL Biotech GmbH Heidelberg, Alemania.
Materiales
| Name | Company | Catalog Number | Comments |
| Albumin antibody | Sigma-Aldrich | SAB3500217 | produced in chicken |
| Albumin Fraction V | Carl Roth GmbH+Co. KG | T8444.4 | |
| Alpha-1 Fetoprotein | Proteintech Germany GmbH | 14550-1-AP | rabbit polyclonal IgG |
| Biolaminin 111 LN | BioLamina | LN111-02 | human recombinant |
| CD45 MicroBeads | Miltenyi | 130-045-801 | nano-sized magnetic beads |
| Cell Strainer | pluriSelect | 43-10040-40 | |
| CellSens | Olympus | imaging software | |
| Centrifuge tubes 50 mL | Greiner Bio-One | 210270 | |
| CEROplate 96 well | OLS OMNI Life Science | 2800-109-96 | |
| CKX53 | Olympus | ||
| Commercially available detergent | Procter & Gamble | nonionic detergent | |
| CYP2E1-specific antibody | Proteintech Germany GmbH | 19937-1-AP | rabbit polyclonal antibody IgG |
| CYP3A4 | Proteintech Germany GmbH | 67110-1-lg | mouse monoclonal antibody IgG1 |
| Cytokeratin 18 | DakoCytomation | M7010 | mouse monoclonal antibody IgG1 |
| DMSO | Sigma-Aldrich | D8418-50ML | |
| DPBS | Thermo Fisher Scientific | 14040091 | |
| FBS | Merck Millipore | S0115/1030B | Discontinued. Available under: TMS-013-B |
| Glass cover slips 14 mm | R. Langenbrinck | 01-0014/1 | |
| GlutaMax 100x Gibco | Thermo Fisher Scientific | 35050038 | L-glutamine |
| Glutaraldehyde 25% | Sigma-Aldrich | G588.2-50ML | |
| Goat anti-mouse IgG Cy3 | Antibodies online | ABIN1673767 | polyclonal |
| Goat anti-mouse IgG DyLight 488 | Antibodies online | ABIN1889284 | polyclonal |
| Goat anti-rabbit IgG Alexa Fluor 488 | Life Technologies | A-11008 | |
| HCl | Sigma-Aldrich | 30721-1LGL | |
| HepatoZYME-SFM | Thermo Fisher Scientific | 17705021 | hepatocyte maturation medium |
| HGF | Thermo Fisher Scientific | PHG0324 | human recombinant |
| HNF4α antibody | Sigma-Aldrich | ZRB1457-25UL | clone 4C19 ZooMAb Rbmono |
| Hydrocortisone 21-hemisuccinate (sodium salt) | Biomol | Cay18226-100 | |
| Knock out Serum Replacement - Multi Species Gibco | Fisher Scientific | A3181501 | KSR |
| KnockOut DMEM/F-12 | Thermo Fisher Scientific | 12660012 | Discontinued. Available under Catalog No. 10-828-010 |
| MACS Buffer | Miltenyi | 130-091-221 | |
| MACS MultiStand | Miltenyi | 130-042-303 | magnetic stand |
| MEM NEAA 100x Gibco | Thermo Fisher Scientific | 11140035 | |
| Mercaptoethanol | Thermo Fisher Scientific | 31350010 | 50mM |
| MiniMACS columns | Miltenyi | 130-042-201 | |
| Nunclon Multidishes | Sigma-Aldrich | D6789 | 4 well plates |
| Oncostatin M | Thermo Fisher Scientific | PHC5015 | human recombinant |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PBS sterile | Carl Roth GmbH+Co. KG | 9143.2 | |
| Penicillin/Streptomycin | Biochrom GmbH | A2213 | 10000 U/ml |
| PS 15ml tubes sterile | Greiner Bio-One | 188171 | |
| Rabbit anti-chicken IgG Texas red | Antibodies online | ABIN637943 | |
| Roti Cell Iscoves MDM | Carl Roth GmbH+Co. KG | 9033.1 | |
| Roti Mount FluorCare DAPI | Carl Roth GmbH+Co. KG | HP20.1 | |
| Roti Sep 1077 human | Carl Roth GmbH+Co. KG | 0642.2 | |
| Transthyretin antibody | Sigma-Aldrich | SAB3500378 | produced in chicken |
| Triton X-100 | Thermo Fisher Scientific | HFH10 | 1% |
Referencias
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Ryu, N. E., Lee, S. H., Park, H. Spheroid culture system methods and applications for mesenchymal stem cells. Cells. 8 (12), 1620 (2019).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- Ingelman-Sundberg, M., Lauschke, V. M. 3D human liver spheroids for translational pharmacology and toxicology. Basic and Clinical Pharmacology and Toxicology. 130, 5-15 (2022).
- Nelson, C. M., Bissell, M. J. Of extracellular matrix, scaffolds, and signalling: tissue architecture regulates development, homeostasis, and cancer. Annual review of cell and developmental biology. 22, 287-309 (2006).
- Khanna, S., Chauhan, A., Bhatt, A. N., Dwarakanath, B. S. R. Multicellular tumor spheroids as in vitro models for studying tumor responses to anticancer therapies. Animal Biotechnology (Second Edition). , 251-268 (2020).
- Rossi, G., Manfrin, A., Lutolf, M. P. Progress and potential in organoid research. Nature Reviews Genetics. 19 (11), 671-687 (2018).
- Riede, J., Wollmann, B. M., Molden, E., Ingelman-Sundberg, M. Primary human hepatocyte spheroids as an in vitro tool for investigating drug compounds with low clearance. Drug metabolism and disposition: The Biological Fate of Chemicals. 49 (7), 501-508 (2021).
- Soto-Gutierrez, A., et al. Differentiating stem cells into liver. Biotechnology & Genetic Engineering Reviews. 25, 149-163 (2008).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964 (2020).
- Chen, S., et al. Hepatic spheroids derived from human induced pluripotent stem cells in bio-artificial liver rescue porcine acute liver failure. Cell Research. 30 (1), 95-97 (2020).
- Zhao, M., et al. Cytochrome P450 enzymes and drug metabolism in humans. International Journal of Molecular Sciences. 22 (23), 12808 (2021).
- Becker-Kojić, Z. A., Schott, A. K., Zipančić, I., Hernández-Rabaza, V. GM-Free generation of blood-derived neuronal cells. Journal of Visualized Experiments. (168), e61634 (2021).
- Marchenko, S., Flanagan, L. Immunocytochemistry: Human neural stem cells. Journal of Visualized Experiments. (7), e267 (2007).
- Crandall, B. F. Alpha-fetoprotein: a review. Critical Reviews in Clinical Laboratory Sciences. 15 (2), 127-185 (1981).
- Magalhães, J., Eira, J., Liz, M. A. The role of transthyretin in cell biology: impact on human pathophysiology. Cellular and Molecular Life Sciences 2021. 78 (17-18), 6105-6117 (2021).
- Huck, I., Gunewardena, S., Espanol-Suner, R., Willenbring, H., Apte, U. Hepatocyte nuclear factor 4 alpha activation is essential for termination of liver regeneration in mice. Hepatology. 70 (2), 666-681 (2019).
- Korver, S., et al. The application of cytokeratin-18 as a biomarker for drug-induced liver injury. Archives of Toxicology. 95 (11), 3435-3448 (2021).
- Klyushova, L. S., Perepechaeva, M. L., Grishanova, A. Y. The role of CYP3A in health and disease. Biomedicines. 10 (11), 2686 (2022).
- Fujino, C., Sanoh, S., Katsura, T. Variation in expression of cytochrome P450 3A isoforms and toxicological effects: endo- and exogenous substances as regulatory factors and substrates. Biological & Pharmaceutical Bulletin. 44 (11), 1617-1634 (2021).
- Hutchinson, M. R., Menelaou, A., Foster, D. J., Coller, J. K., Somogyi, A. A. CYP2D6 and CYP3A4 involvement in the primary oxidative metabolism of hydrocodone by human liver microsomes. British Journal of Clinical Pharmacology. 57 (3), 287-297 (2004).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Kammerer, S. Three-dimensional liver culture systems to maintain primary hepatic properties for toxicological analysis in vitro. International Journal of Molecular Sciences. 22 (19), 10214 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados