Method Article
Sferoidi epatici umani da sangue periferico per studi sulle malattie del fegato
In questo articolo
Riepilogo
Qui presentiamo un metodo non genetico per generare sferoidi epatici autologhi umani usando cellule mononucleate isolate dal sangue periferico allo stato stazionario.
Abstract
Le cellule epatiche umane possono formare una struttura tridimensionale (3D) in grado di crescere in coltura per alcune settimane, preservando la loro capacità funzionale. A causa della loro natura di raggrupparsi nei piatti di coltura con caratteristiche adesive basse o assenti, formano aggregati di più cellule epatiche che sono chiamate sferoidi epatici umani. La formazione di sferoidi epatici 3D si basa sulla naturale tendenza delle cellule epatiche ad aggregarsi in assenza di un substrato adesivo. Queste strutture 3D possiedono risposte fisiologiche migliori rispetto alle cellule, che sono più vicine a un ambiente in vivo . L'utilizzo di colture di epatociti 3D presenta numerosi vantaggi rispetto alle classiche colture bidimensionali (2D), tra cui un microambiente biologicamente più rilevante, una morfologia architettonica che riassembla gli organi naturali e una migliore previsione dello stato della malattia e delle risposte simili in vivo ai farmaci. Varie fonti possono essere utilizzate per generare sferoidi, come tessuto epatico primario o linee cellulari immortalizzate. Il tessuto epatico 3D può anche essere ingegnerizzato utilizzando cellule staminali embrionali umane (hESC) o cellule staminali pluripotenti indotte (hiPSC) per derivare gli epatociti. Abbiamo ottenuto sferoidi epatici umani utilizzando cellule staminali pluripotenti derivate dal sangue (BD-PSC) generate da sangue periferico non manipolato mediante attivazione di proteine GPI legate alla membrana umana e differenziate in epatociti umani. Le cellule epatiche umane derivate da BD-PSCs e gli sferoidi epatici umani sono stati analizzati mediante microscopia ottica e immunofenotipizzazione utilizzando marcatori di epatociti umani.
Introduzione
Negli ultimi anni i sistemi di coltura sferoidale tridimensionale (3D) sono diventati uno strumento importante per studiare varie aree della ricerca sul cancro, della scoperta di farmaci e della tossicologia. Tali colture suscitano grande interesse perché colmano il divario tra monostrati di colture cellulari bidimensionali (2D) e organi complessi1.
In assenza di una superficie adesiva, rispetto alla coltura cellulare 2D, la formazione di sferoidi si basa sulla naturale affinità di queste cellule a raggrupparsi in forma 3D. Queste cellule si organizzano in gruppi costituiti da uno o più tipi di cellule mature. Prive di materiali estranei, queste cellule interagiscono tra loro come nel loro microambiente originale. Le cellule nella coltura 3D sono molto più vicine e hanno un corretto orientamento l'una verso l'altra, con una maggiore produzione di matrice extracellulare rispetto alle colture 2D, e costituiscono un ambiente vicino al naturale 2.
I modelli animali sono stati utilizzati per lungo tempo per studiare la biologia umana e le malattie3. A questo proposito, ci sono differenze intrinseche tra esseri umani e animali, il che rende questi modelli non del tutto adatti per studi estrapolativi. Gli sferoidi e gli organoidi di coltura 3D rappresentano uno strumento promettente per studiare l'architettura simile ai tessuti, l'interazione e la diafonia tra diversi tipi di cellule che si verificano in vivo e possono contribuire a ridurre o addirittura sostituire i modelli animali. Sono di particolare interesse per lo studio della patogenesi delle malattie del fegato e delle piattaforme di screening dei farmaci4.
La coltura sferoidale 3D è di particolare importanza per la ricerca sul cancro in quanto può eliminare la discontinuità tra le cellule e il loro ambiente riducendo la necessità di tripsinizzazione o trattamento con collagenasi necessario per preparare i monostrati delle cellule tumorali per colture 2D. Gli sferoidi tumorali consentono lo studio di come le cellule normali rispetto a quelle maligne ricevono e rispondono ai segnali provenienti dall'ambiente circostante5 e sono una parte importante degli studi di biologia tumorale.
Rispetto al monostrato, le colture 3D costituite da vari tipi di cellule assomigliano ai tessuti tumorali nelle loro proprietà strutturali e funzionali e quindi sono adatte per studiare le metastasi e l'invasione delle cellule tumorali. Ecco perché tali modelli sferoidi stanno contribuendo ad accelerare la ricerca sul cancro6.
Gli sferoidi stanno anche aiutando a sviluppare la tecnologia per creare organoidi umani perché la biologia dei tessuti e degli organi è molto difficile da studiare, in particolare negli esseri umani. I progressi nella coltura di cellule staminali consentono di sviluppare colture 3D come organoidi costituiti da cellule staminali e progenitori tissutali, nonché diversi tipi di cellule mature (tissutali) da un organo con alcune caratteristiche funzionali come un organo reale che può essere utilizzato per modellare lo sviluppo di organi, malattie, ma possono anche essere considerati utili nella medicina rigenerativa7.
Gli epatociti umani primari sono solitamente utilizzati per studiare la biologia in vitro degli epatociti umani, la funzionalità epatica e la tossicità indotta da farmaci. Le colture di epatociti umani presentano due principali inconvenienti, in primo luogo, la limitata disponibilità di tessuto primario come gli epatociti umani e, in secondo luogo, la tendenza degli epatociti a dedifferenziarsi rapidamente nella coltura 2D, perdendo così la loro funzione specifica degli epatociti8. Le colture epatiche 3D sono superiori in questo senso e sono state recentemente prodotte da cellule staminali embrionali umane differenziate (hESC) o cellule staminali pluripotenti indotte (hiPSCs)9. Gli sferoidi 3D epatici bioingegnerizzati sono di particolare interesse per lo studio dello sviluppo, della tossicità, delle malattie genetiche e infettive del fegato, nonché nella scoperta di farmaci per il trattamento delle malattie del fegato10. Infine, hanno anche il potenziale per essere utilizzati clinicamente, sapendo che le malattie epatiche acute hanno un tasso di mortalità di quasi l'80%, il fegato bio-artificiale e / o gli sferoidi epatici potrebbero potenzialmente salvare questi pazienti fornendo una funzionalità epatica parziale fino a quando non si trova un donatore adatto11.
Abbiamo stabilito un protocollo per la generazione di sferoidi epatici umani utilizzando cellule staminali pluripotenti derivate dal sangue (BD-PSCs) per preparare sferoidi di dimensioni diverse contenenti da 4000 a 1 x 106 cellule e analizzarli mediante microscopia ottica e immunofluorescenza. Abbiamo anche testato la capacità della funzione specifica degli epatociti, valutando l'espressione degli enzimi del citocromo P450 3A4 (CYP3A4) e 2E1 (CYP2E1) che appartengono alla famiglia del citocromo P450 che hanno ruoli importanti nel metabolismo cellulare e dei farmaci attraverso il processo di disintossicazione12.
Protocollo
È stata ottenuta l'approvazione etica (ACA CELL Biotech GmbH/25b-5482.2-64-1) per l'esecuzione di questi esperimenti e il consenso informato è stato firmato da tutti i donatori prima dell'estrazione del sangue in conformità con le linee guida istituzionali.
1. Preparazione di cellule mononucleate (MNC) dal sangue periferico umano (PB)
- Estrarre 30 ml di sangue da donatori sani con l'aiuto di personale medico addestrato secondo il protocollo standard.
- Isolare i PBMNC utilizzando mezzi a gradiente di densità secondo il protocollo pubblicato da Becker-Kojić et al.13. Isolare mediante pipettaggio lo strato di interfase tra plasma e mezzi a gradiente di densità e utilizzare tampone fosfato sterile soluzione salina (PBS) per lavare le cellule isolate.
- Utilizzare una camera di conteggio e contare il numero di celle utilizzando metodi standard.
2. Dedifferenziazione delle multinazionali dopo attivazione con glicoproteina umana ancorata al GPI
- Porre 6 x 106 cellule mononucleate in PBS/1% albumina sierica bovina (BSA) in una provetta di polistirene (15 ml) e incubare con l'anticorpo specifico per 30 minuti a 37 °C secondo Becker-Kojić et al.13.
- Centrifugare le cellule a 300 x g a temperatura ambiente e sostituire PBS/BSA con il mezzo di Dulbecco modificato di Iscove integrato con siero bovino fetale (FBS) al 10%.
- Far crescere le cellule in tubi di polistirene da 15 ml in un incubatore al 5% di CO2 a 37 °C per 8-10 giorni come descritto in Becker-Kojić et al.13. Il giorno 5 (D5), aggiungere 1-2 ml di terreno di Iscove integrato con FBS al 10% a ciascun tubo da 15 ml.
3. Ordinamento delle cellule dedifferenziate di nuova generazione
- Centrifugare la sospensione cellulare in coltura a temperatura ambiente per 10 minuti a 300 x g e aspirare con una pipetta sterile il surnatante risultante secondo Becker-Kojić et al.13.
- Risospendere il pellet ottenuto per centrifugazione in 90 μL di tampone PBS freddo (PBS pH 7,2, 0,5% BSA e 2 mM EDTA) e aggiungere 10 μL di sfere magnetiche nanometriche CD45 positive e incubare su ghiaccio per 15 minuti.
- Lavare la sospensione cellulare con 2 mL di tampone PBS, centrifugarla a 300 x g per 10 minuti a temperatura ambiente e aggiungere 500 μL di tampone PBS alle cellule e risospendere accuratamente.
- Pipettare 500 μL di tampone PBS pre-raffreddato nella colonna per lavarlo e posizionarlo nel campo magnetico utilizzando un supporto magnetico.
- Lavare le cellule posizionate sulla colonna, due volte con 500 μL di tampone PBS e raccogliere il flusso attraverso contenente cellule CD45 negative nel mezzo di Iscove integrato con il 10% di FBS.
- Utilizzare una camera di conteggio per determinare il numero di celle riprogrammate.
4. Preparazione di vetrini per la generazione di epatociti umani
- Separare i vetrini (14 mm) e incubarli in detergente non ionico per 10 minuti. Lavare i coperchi di vetro in acqua deionizzata fino a quando non rimangono bolle e incubarli in 1M HCl per 30 minuti (adattato da Marchenko et al.14).
- Lavare i vetrini con acqua deionizzata almeno 3 volte e asciugarli per una notte a temperatura ambiente. Vetrini essiccati in autoclave in un contenitore adatto.
5. Rivestimento di piastre di coltura cellulare con biolaminina per la differenziazione epatica 2D di BD-PSCs
- Posizionare i vetrini in vetro autoclavato con un paio di pinzette sterili in 4 piastre a pozzetto e accendere le luci UV per 30 minuti per garantire condizioni sterili.
- Scongelare aliquote di biolaminina e aggiungere 120 μL di 5 μg/mL di biolaminina ad ogni vetrino. Lasciare i vetrini rivestiti per una notte a 4 °C.
- Rimuovere l'eccesso di biolaminina e aggiungere 200 μL di terreno di differenziazione degli epatociti come descritto di seguito.
6. Preparazione dei mezzi di differenziazione degli epatociti
- Produrre 500 ml di mezzo di sostituzione sierica knockout epatoblasta (KSR)/dimetil solfossido (DMSO) costituito da 76,4% knockout DMEM (KO-DMEM), 20% KSR, 0,5% L-glutammina, 1% aminoacidi non essenziali (NEAA), 0,1% β-mercaptoetanolo, 1% DMSO e 1% penicillina-streptomicina (Pen / Strep).
- Preparare 500 ml di terreno di maturazione degli epatociti contenente 1% L-glutammina, 10 μM di idrocortisone 21-emisuccinato sale sodico (HCC) e 1% Pen/Strep.
- Aliquot dal materiale madre e aggiungere il fattore di crescita fresco degli epatociti (HGF) e l'oncostatina M (OSM) alle concentrazioni finali di 10 ng/ml e/o 20 ng/ml per ogni variazione del terreno.
NOTA: L'oncostatina M è una citochina appartenente al gruppo delle citochine dell'interleuchina 6, importante per l'ematopoiesi e per lo sviluppo del fegato.
7. Coltura di cellule epatiche differenziate da BD-PSCs
- Inserire 3 x 105 cellule BD-PSCS in ciascun pozzetto di una piastra a 4 pozzetti rivestita di biolaminina.
- Posizionare le piastre a 4 pozzetti nell'incubatore a 37 °C e 5% di CO2. Coltura delle cellule per 5 giorni in mezzo di epatoblasto KSR / DMSO che supporta la differenziazione endodermica e cambia il terreno ogni due giorni.
- Passare al terreno di maturazione degli epatociti il giorno 5 e coltivare le cellule per altri 7-10 giorni nell'incubatore a 37 °C e al 5% di CO2. Cambia il mezzo ogni 48 ore.
8.3D differenziazione epatica sferoide
- Contare le celle utilizzando una camera di conteggio.
- Centrifugare la sospensione cellulare dedifferenziata BD a 300 x g per 10 minuti a temperatura ambiente. Rimuovere le cellule surnatanti e risospendere BD-dedifferenziate in mezzo KSR/DMSO a 2 x 106 cellule/ml.
- Far passare le cellule attraverso un filtro cellulare da 40 μm per garantire una sospensione a cella singola e rimuovere eventuali detriti aggiuntivi.
- Contare le celle utilizzando una camera di conteggio e preparare un volume sufficiente per ogni densità di semina cellulare al fine di erogare il volume richiesto per pozzetto. Preparare un gradiente con semina superiore di 1 x 106 celle a una bassa densità di semina di 4000 celle.
- Erogare 100 μL di terreno KSR/DMSO in 96 piastre di fissaggio ben basse e aggiungere 100 μL di diluizione della semina cellulare.
- Posizionare la piastra di fissaggio bassa nell'incubatore a 37 °C e al 5% di CO2 e coltivarla per 5 giorni.
- Cambiare il 50% del terreno dai giorni 3-4 dopo la semina quando gli sferoidi sono sufficientemente compatti.
- Il giorno 5, cambiare il terreno di maturazione in mezzo di maturazione degli epatociti e coltivare le cellule per altri 7-10 giorni per un'ulteriore maturazione. Cambia il mezzo ogni due giorni.
9. Analisi di immunofluorescenza di colture di cellule epatiche 2D di nuova generazione
- Coltivare le cellule secondo il metodo di differenziazione sopra descritto per 4, 8, 15 e 24 giorni e rimuovere i terreni.
- Incubare le cellule con fissativo preriscaldato costituito da paraformaldeide al 4% in PBS per 10 minuti. Scartare il fissativo e lavare le celle 2x con PBS per 5 minuti ciascuna. Aggiungere immediatamente la soluzione di tritone X-100 allo 0,1% e permeabilizzare le cellule per 5 minuti. Lavare 2x con PBS.
- Aggiungere la soluzione di blocco a base di PBS e BSA al 5% e posizionare sulla piastra del bilanciere per 1 ora a temperatura ambiente.
- Diluire gli anticorpi primari nel tampone di diluizione 1% BSA/PBS come segue: albumina (ALB) 1:50, alfa-1 fetoproteina (AFP) 1:250, citocheratina 18 (CK18) 1:50, fattore nucleare degli epatociti 4 alfa (HNF4α) 1:1000 e transtiretina (TTR) 1:50. Utilizzare 50 μL di diluizione anticorpale per pozzetto.
- Incubare le cellule per 1 ora a temperatura ambiente. Quindi scartare la soluzione anticorpale, lavare le cellule per 5 minuti e ripetere il passaggio di lavaggio 3x.
- Preparare i seguenti anticorpi secondari nel tampone di diluizione: coniglio anti-pollo IgG (Texas rosso) 1:1000, capra anti-topo IgG (488) 1:1000 e capra anti-coniglio (488) 1:500. Utilizzare 50 μL di diluizione anticorpale per pozzetto e incubare le cellule per 30 minuti a temperatura ambiente.
- Lavare le celle 3 volte con PBS per 5 minuti ciascuna e montare i vetrini con supporti di montaggio contenenti DAPI per l'analisi microscopica.
10. Colorazione viva di sferoidi epatici di nuova formazione
- Scartare con attenzione i terreni di coltura senza toccare gli sferoidi, aggiungere PBS appena fatto con soluzione di tritone X-100 allo 0,1% e incubare per 5 minuti per permeabilizzare le cellule.
- Lavare gli sferoidi con il mezzo pipettando lentamente per 5 minuti, ripetere 2x.
- Incubare gli sferoidi con gli anticorpi primari ALB (1:50), AFP (1:250), CK18 (1:50), CYP2E1 (1:200) e CYP3A4 (1:200) preparati in PBS con 1% BSA per 1 ora in incubatore al 5% di CO2 a 37 °C. Utilizzare 50 μL di diluizione anticorpale per pozzetto.
- Rimuovere con cura la soluzione anticorpale in eccesso e lavare gli sferoidi con mezzo 3x.
- Preparare i corrispondenti anticorpi secondari IgG anti-topo di capra (Cy3), IgG anti-topo di capra (488) e IgG anti-pollo di coniglio (rosso Texas) ad una diluizione di 1:1000 e 1:500 per capra anti-coniglio (488) in PBS in BSA all'1%. Utilizzare 50 μL di diluizione anticorpale per pozzetto e incubare per 20 minuti nell'incubatore a 37 °C e 5% di CO2.
- Lavare accuratamente 3 volte con terreno e lasciare la piastra per 30 minuti nell'incubatore a 37 °C e 5% CO2 prima di eseguire la microscopia a fluorescenza.
11. Esame degli sferoidi mediante microscopio a fluorescenza
- Accendere la sorgente luminosa a fluorescenza 10 minuti prima dell'uso, accendere il computer e aprire il software di imaging.
- Utilizzare un obiettivo con ingrandimento 4x, fare clic sul pulsante 4x nella barra degli strumenti per selezionare la barra della scala corretta, quindi posizionare la piastra a 96 pozzetti sulla piastra centrale del palco.
- Accendere la sorgente luminosa a LED, utilizzare il filtro a campo luminoso e posizionare la piastra sul pozzetto di interesse utilizzando la manopola di regolazione dello stadio dell'asse x-y.
- Passare al percorso della luce della fotocamera, fare clic sul pulsante Live nel software di imaging per visualizzare l'immagine sullo schermo e assicurarsi che lo sferoide sia centrato utilizzando le manopole dell'asse x-y e la messa a fuoco utilizzando la manopola di messa a fuoco grossolana/fine.
NOTA: La forma degli sferoidi rimane costante dopo l'applicazione della colorazione viva. - Scegli il metodo di osservazione Brightfield nella barra degli strumenti, imposta le impostazioni di esposizione su automatico e fai clic sul pulsante Istantanea nel pannello di controllo della fotocamera per scattare una foto. Quindi salvare l'immagine come file .vsi utilizzando il nome appropriato nella cartella di interesse.
- Posizionare la piastra di schermatura della luce ambientale per spegnere la luce LED, passare al filtro per l'eccitazione B, scegliere il metodo di osservazione 488 nella barra degli strumenti, aprire l'otturatore, scattare una foto facendo clic sul pulsante Istantanea, chiudere l'otturatore, quindi salvare il file come descritto sopra.
- Ripetere questa operazione con un filtro per l'eccitazione G utilizzando il metodo di osservazione appropriato (rosso Texas o CY3). Quindi ripetere l'intera procedura per ogni pozzo di interesse.
- Riportare la piastra nell'incubatore al 5% di CO2 a 37 °C e coltivarla come descritto sopra.
Risultati
Abbiamo differenziato con successo le BD-PSC umane in cellule progenitrici endodermiche/epatiche ed epatociti applicando un protocollo in due fasi. I cambiamenti morfologici durante il processo di differenziazione epatica sono mostrati nella Figura 1. Le BD-PSC si differenziano in epatociti che attraversano tre diverse fasi. Il primo stadio rappresenta la differenziazione in cellule endodermiche L4, il secondo, la differenziazione in cellule progenitrici epatiche (epatoblasto) L8, che mostrano una tipica morfologia poligonale, e il terzo, la maturazione in epatociti L15-L24.
L'analisi di immunofluorescenza è stata eseguita per confermare la differenziazione epatica delle BD-PSC come presentato nella Figura 2. Forte espressione del marcatore progenitore endodermico/epatico umano, come l'alfa-fetoproteina (AFP), una delle principali proteine plasmatiche nel siero fetale la cui concentrazione è molto bassa negli organismi adulti ed è quindi considerata un marker per il precursore15 degli epatociti e la transtiretina (TTR), una delle principali proteine leganti l'ormone tiroideo coinvolte nel trasporto della tiroxina dal flusso sanguigno al cervello16 si trovano nelle cellule nella prima fase del processo di differenziazione epatica da L4 a L8. Tuttavia, la loro espressione diminuisce a L15, mentre l'espressione di albumina (ALB), la proteina plasmatica più abbondante prodotta principalmente dal fegato e assolutamente critica per la differenziazione epatica, così come il fattore nucleare 4 alfa degli epatociti (HNF-4α), un fattore di trascrizione degli epatociti che è coinvolto nell'espressione di geni specifici del fegato17 appare prima a L4, sale per tutto il tempo di differenziamento L4-L15 raggiungendo un'espressione forte e stabile durante il tempo di maturazione L15-L24.
La citocheratina 18 (CK18) è una proteina citoscheletrica, uno dei principali componenti del filamento intermedio espresso nel fegato18. I risultati mostrano che, come previsto, l'espressione di CK18 è correlata agli epatociti maturi (L15-L24) e non è espressa nelle cellule progenitrici degli epatociti.
Il protocollo ben definito per la differenziazione degli epatociti nelle colture 2D consente l'ingegnerizzazione di colture 3D epatiche a partire da BD-PSC.
Dimostriamo qui che l'aggregazione spontanea di queste cellule in piastre a basso attacco contenenti terreno di induzione/maturazione degli epatociti avvia la formazione di sferoidi. La traccia di crescita è stata seguita dalle cellule di imaging a L2, L4 e L7. (Figura 3A) Esiste una correlazione coerente tra il volume sferoidale e il numero variabile di cellule, come presentato nella Figura 3B.
Il fegato è un organo in cui la maggior parte dei farmaci nel corpo umano vengono metabolizzati. Il citocromo P450 è una superfamiglia di enzimi (monoossigenasi) che sono di fondamentale importanza nei processi del metabolismo farmacologico e cellulare, nella disintossicazione degli xenobiotici e nell'omeostasi. Per valutare la potenziale attività funzionale degli sferoidi epatici derivati da BD-PSC, abbiamo analizzato l'espressione di enzimi che metabolizzano farmaci come CYP3A4 e CYP2E1, membri delle famiglie CYP3 e CYP219.
La maggior parte dei farmaci che vengono utilizzati oggi tra cui codeina, ciclosporina A, eritromicina, paracetamolo e diazepam, nonché molti steroidi e agenti cancerogeni, sono metabolizzati a causa dell'attività dell'enzima CY3A420. Il CYP2E1 è coinvolto nel metabolismo di substrati endogeni come glicole etilenico, benzene, tetracloruro di carbonio e in particolare il più importante composto altamente mutageno come la nitrosammina21.
Gli sferoidi che si formano e si differenziano secondo il protocollo a D14, vivi colorati con anticorpi contro questi due enzimi, rivelano la potenziale attività funzionale epatica degli sferoidi derivati da BD-PSCs (Figura 4).

Figura 1: Differenziazione delle BD-PSC in cellule epatiche. Micrografie rappresentative dei cambiamenti morfologici durante il differenziamento epatico delle BD-PSC che mostrano la morfologia endodermica L4, o di forma poligonale L8 che raggiunge infine lo stato di maturazione da L15 a L24. Barre della scala: fila superiore 50 μm, fila inferiore 20 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
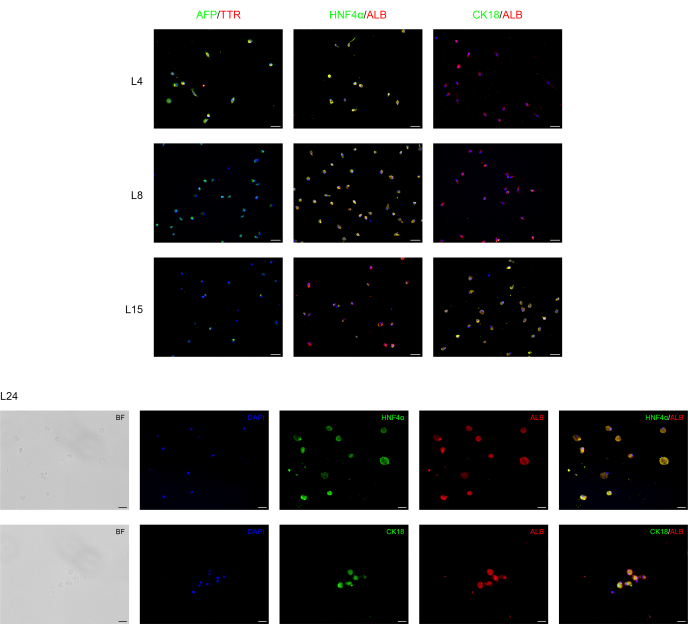
Figura 2: Analisi di immunofluorescenza del ridifferenziamento delle BD-PSCs verso cellule epatiche. I marcatori progenitori dell'endoderma/epatociti e specifici degli epatociti sono espressi durante la differenziazione epatica delle BD-PSC in colture 2D. Nei giorni da L4 a L8, le micrografie mostrano una diminuzione dell'espressione del progenitore endodermico/epatico AFP e TTR mentre la loro espressione è scomparsa da L8-L24. L'espressione dei marcatori degli epatociti ALB e HNFα insorge a L4 e aumenta durante la maturazione, mentre l'espressione di CK18 è apparsa prima a L15, raggiungendo il massimo a L24. Barre di scala per i grafici L4-L15: 50 μm e per L24: 20 μm. Il controllo è presentato nella figura supplementare 1. Fare clic qui per visualizzare una versione ingrandita di questa figura.
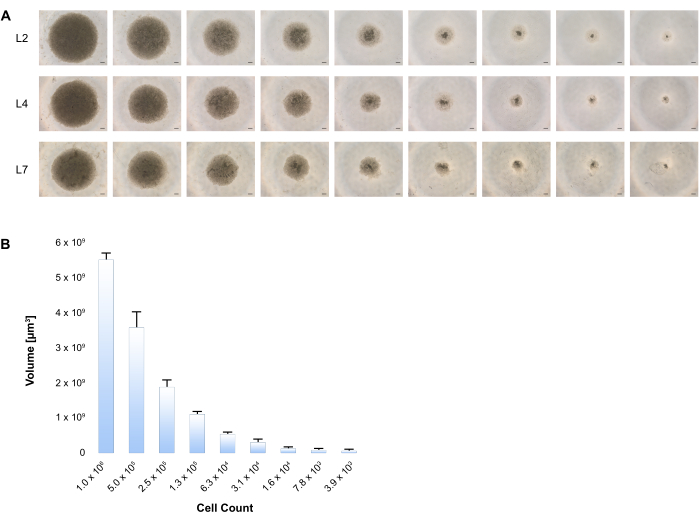
Figura 3: Formazione di sferoidi 3D su differenziazione epatica di BD-PSC. (A) Un numero variabile di cellule di BD-PSC a partire da 1 x 10da 6 a 4000 cellule è stato seminato in piastre a basso attacco e la differenziazione è stata eseguita secondo la procedura a due stadi come indicato nel protocollo. La generazione di sferoidi epatici umani 3D è stata ripresa in diversi punti temporali, mostrati come immagini rappresentative di contrasto di fase in ogni momento durante il periodo di tempo della coltura. Barra della scala: 200 μm. (B) I diametri di almeno 4 sferoidi epatici per ogni dimensione sono stati misurati a L4 utilizzando un software di imaging per microscopio e sono stati calcolati i volumi. Le barre di errore mostrano una deviazione standard. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: I marcatori funzionali degli epatociti sono espressi negli sferoidi epatici derivati da BD-PSCs. Le BD-PSC sono state differenziate in epatociti. L'analisi diretta di immunofluorescenza è stata eseguita su cellule vive a L14 utilizzando anticorpi contro ALB, AFP, CK18 e CYP2E1 e CYP3A4, membri della famiglia del citocromo P450. Barra scala: 200 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Controllo negativo per l'analisi di immunofluorescenza della ridifferenziazione delle BD-PSCs verso cellule epatiche. I marcatori progenitori dell'endoderma/epatociti e specifici degli epatociti sono espressi durante la differenziazione epatica delle BD-PSC in colture 2D. Barra scala: 100 μm. Clicca qui per scaricare questo file.
Discussione
Il fegato è un organo importante nel corpo umano con molte funzioni biologiche essenziali, come la disintossicazione dei metaboliti. A causa di gravi insufficienza epatica come la cirrosi e / o l'epatite virale, ci sono quasi 2 milioni di morti all'anno in tutto il mondo. I trapianti di fegato sono al secondo posto nei trapianti di organi solidi in tutto il mondo, ma solo circa il 10% del fabbisogno attuale è soddisfatto22.
Gli epatociti umani primari (PHH) sono spesso usati per studiare la tossicità epatica. Queste cellule possono essere mantenute in coltura per un breve periodo mantenendo le loro funzioni specifiche. Inoltre, il numero di cellule disponibili da un singolo donatore è limitato, inoltre, queste cellule non possono essere espanse nella coltura, pertanto la carenza di PHH del donatore rimane il principale ostacolo per gli studi di epatotossicità. Le PSC rappresentano una fonte di rinnovamento dei tessuti umani e possono essere utilizzate per la generazione di colture epatiche 3D11.
I sistemi di coltura 3D del fegato mostrano molteplici vantaggi rispetto al 2D. Un tempo di differenziazione più breve e un'accurata imitazione dei processi in vivo consentono studi più precisi sulla tossicità indotta da farmaci, una migliore previsione della responsabilità epatica e sono più convenienti23. Le colture sferoidi epatiche a causa della loro caratteristica autologa potrebbero essere un grande vantaggio rispetto agli epatociti umani primari (PHH) aggirando gli svantaggi legati al loro uso e potrebbero diventare un gold standard per l'applicazione nei test di tossicità dei farmaci e hanno una potenziale applicazione futura nella medicina rigenerativa.
Abbiamo dimostrato qui che le BD-PSC generate dal sangue periferico allo stato stazionario possono essere differenziate con successo in progenitori endodermici / epatociti maturi con secrezione costante di albumina e stabilità fenotipica che esprime marcatori epatocitari. Inoltre, le colture 3D di sferociti epatociti umani ingegnerizzate dimostrano la potenziale attività funzionale esprimendo gli enzimi che appartengono al citocromo P450, come CYP3A4 e CYP2E1.
Il passo più importante nel protocollo è ottenere una buona qualità e numero di multinazionali umane fresche per il processo di riprogrammazione. L'uso di multinazionali congelate si traduce in un numero ridotto di cellule riprogrammate.
Abbiamo ingegnerizzato sferoidi epatici umani utilizzando colture PBMNCs attivate con e senza applicare la selezione immunomagnetica che separa le cellule riprogrammate dalle cellule del sangue mature. La leggera differenza nell'utilizzo di questi due metodi si basa sulla maggiore densità della struttura 3D quando si utilizzano celle riprogrammate purificate. L'espressione dei marcatori degli epatociti rimane coerente in entrambe le preparazioni di colture cellulari.
A causa della limitata disponibilità di PHH, il metodo rappresenta potenzialmente l'alternativa biologicamente rilevante più vicina agli epatociti freschi autologhi per studiare la funzionalità epatica in vitro , come il metabolismo xenobiotico e la tossicità epatica, l'intervento ospite-patogeno e la biologia cellulare in generale. La possibilità di utilizzare le BD-PSC nella medicina rigenerativa pur essendo autologhe e non teratogene è oggetto di ulteriori studi nel nostro laboratorio.
Divulgazioni
L'autore corrispondente dichiara di essere titolare di un brevetto relativo alla nuova proteina umana legata al GPI. Ha co-fondato e lavora con ACA CELL Biotech GmbH. Gli altri autori dichiarano che non ci sono conflitti di interesse.
Riconoscimenti
Gli autori sono particolarmente grati per l'assistenza tecnica fornita da Oksana e John Greenacre. Questo lavoro è stato sostenuto da ACA CELL Biotech GmbH Heidelberg, Germania.
Materiali
| Name | Company | Catalog Number | Comments |
| Albumin antibody | Sigma-Aldrich | SAB3500217 | produced in chicken |
| Albumin Fraction V | Carl Roth GmbH+Co. KG | T8444.4 | |
| Alpha-1 Fetoprotein | Proteintech Germany GmbH | 14550-1-AP | rabbit polyclonal IgG |
| Biolaminin 111 LN | BioLamina | LN111-02 | human recombinant |
| CD45 MicroBeads | Miltenyi | 130-045-801 | nano-sized magnetic beads |
| Cell Strainer | pluriSelect | 43-10040-40 | |
| CellSens | Olympus | imaging software | |
| Centrifuge tubes 50 mL | Greiner Bio-One | 210270 | |
| CEROplate 96 well | OLS OMNI Life Science | 2800-109-96 | |
| CKX53 | Olympus | ||
| Commercially available detergent | Procter & Gamble | nonionic detergent | |
| CYP2E1-specific antibody | Proteintech Germany GmbH | 19937-1-AP | rabbit polyclonal antibody IgG |
| CYP3A4 | Proteintech Germany GmbH | 67110-1-lg | mouse monoclonal antibody IgG1 |
| Cytokeratin 18 | DakoCytomation | M7010 | mouse monoclonal antibody IgG1 |
| DMSO | Sigma-Aldrich | D8418-50ML | |
| DPBS | Thermo Fisher Scientific | 14040091 | |
| FBS | Merck Millipore | S0115/1030B | Discontinued. Available under: TMS-013-B |
| Glass cover slips 14 mm | R. Langenbrinck | 01-0014/1 | |
| GlutaMax 100x Gibco | Thermo Fisher Scientific | 35050038 | L-glutamine |
| Glutaraldehyde 25% | Sigma-Aldrich | G588.2-50ML | |
| Goat anti-mouse IgG Cy3 | Antibodies online | ABIN1673767 | polyclonal |
| Goat anti-mouse IgG DyLight 488 | Antibodies online | ABIN1889284 | polyclonal |
| Goat anti-rabbit IgG Alexa Fluor 488 | Life Technologies | A-11008 | |
| HCl | Sigma-Aldrich | 30721-1LGL | |
| HepatoZYME-SFM | Thermo Fisher Scientific | 17705021 | hepatocyte maturation medium |
| HGF | Thermo Fisher Scientific | PHG0324 | human recombinant |
| HNF4α antibody | Sigma-Aldrich | ZRB1457-25UL | clone 4C19 ZooMAb Rbmono |
| Hydrocortisone 21-hemisuccinate (sodium salt) | Biomol | Cay18226-100 | |
| Knock out Serum Replacement - Multi Species Gibco | Fisher Scientific | A3181501 | KSR |
| KnockOut DMEM/F-12 | Thermo Fisher Scientific | 12660012 | Discontinued. Available under Catalog No. 10-828-010 |
| MACS Buffer | Miltenyi | 130-091-221 | |
| MACS MultiStand | Miltenyi | 130-042-303 | magnetic stand |
| MEM NEAA 100x Gibco | Thermo Fisher Scientific | 11140035 | |
| Mercaptoethanol | Thermo Fisher Scientific | 31350010 | 50mM |
| MiniMACS columns | Miltenyi | 130-042-201 | |
| Nunclon Multidishes | Sigma-Aldrich | D6789 | 4 well plates |
| Oncostatin M | Thermo Fisher Scientific | PHC5015 | human recombinant |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PBS sterile | Carl Roth GmbH+Co. KG | 9143.2 | |
| Penicillin/Streptomycin | Biochrom GmbH | A2213 | 10000 U/ml |
| PS 15ml tubes sterile | Greiner Bio-One | 188171 | |
| Rabbit anti-chicken IgG Texas red | Antibodies online | ABIN637943 | |
| Roti Cell Iscoves MDM | Carl Roth GmbH+Co. KG | 9033.1 | |
| Roti Mount FluorCare DAPI | Carl Roth GmbH+Co. KG | HP20.1 | |
| Roti Sep 1077 human | Carl Roth GmbH+Co. KG | 0642.2 | |
| Transthyretin antibody | Sigma-Aldrich | SAB3500378 | produced in chicken |
| Triton X-100 | Thermo Fisher Scientific | HFH10 | 1% |
Riferimenti
- Fennema, E., Rivron, N., Rouwkema, J., van Blitterswijk, C., de Boer, J. Spheroid culture as a tool for creating 3D complex tissues. Trends in Biotechnology. 31 (2), 108-115 (2013).
- Ryu, N. E., Lee, S. H., Park, H. Spheroid culture system methods and applications for mesenchymal stem cells. Cells. 8 (12), 1620 (2019).
- Nevzorova, Y. A., Boyer-Diaz, Z., Cubero, F. J., Gracia-Sancho, J. Animal models for liver disease - A practical approach for translational research. Journal of Hepatology. 73 (2), 423-440 (2020).
- Ingelman-Sundberg, M., Lauschke, V. M. 3D human liver spheroids for translational pharmacology and toxicology. Basic and Clinical Pharmacology and Toxicology. 130, 5-15 (2022).
- Nelson, C. M., Bissell, M. J. Of extracellular matrix, scaffolds, and signalling: tissue architecture regulates development, homeostasis, and cancer. Annual review of cell and developmental biology. 22, 287-309 (2006).
- Khanna, S., Chauhan, A., Bhatt, A. N., Dwarakanath, B. S. R. Multicellular tumor spheroids as in vitro models for studying tumor responses to anticancer therapies. Animal Biotechnology (Second Edition). , 251-268 (2020).
- Rossi, G., Manfrin, A., Lutolf, M. P. Progress and potential in organoid research. Nature Reviews Genetics. 19 (11), 671-687 (2018).
- Riede, J., Wollmann, B. M., Molden, E., Ingelman-Sundberg, M. Primary human hepatocyte spheroids as an in vitro tool for investigating drug compounds with low clearance. Drug metabolism and disposition: The Biological Fate of Chemicals. 49 (7), 501-508 (2021).
- Soto-Gutierrez, A., et al. Differentiating stem cells into liver. Biotechnology & Genetic Engineering Reviews. 25, 149-163 (2008).
- Hurrell, T., et al. Human liver spheroids as a model to study aetiology and treatment of hepatic fibrosis. Cells. 9 (4), 964 (2020).
- Chen, S., et al. Hepatic spheroids derived from human induced pluripotent stem cells in bio-artificial liver rescue porcine acute liver failure. Cell Research. 30 (1), 95-97 (2020).
- Zhao, M., et al. Cytochrome P450 enzymes and drug metabolism in humans. International Journal of Molecular Sciences. 22 (23), 12808 (2021).
- Becker-Kojić, Z. A., Schott, A. K., Zipančić, I., Hernández-Rabaza, V. GM-Free generation of blood-derived neuronal cells. Journal of Visualized Experiments. (168), e61634 (2021).
- Marchenko, S., Flanagan, L. Immunocytochemistry: Human neural stem cells. Journal of Visualized Experiments. (7), e267 (2007).
- Crandall, B. F. Alpha-fetoprotein: a review. Critical Reviews in Clinical Laboratory Sciences. 15 (2), 127-185 (1981).
- Magalhães, J., Eira, J., Liz, M. A. The role of transthyretin in cell biology: impact on human pathophysiology. Cellular and Molecular Life Sciences 2021. 78 (17-18), 6105-6117 (2021).
- Huck, I., Gunewardena, S., Espanol-Suner, R., Willenbring, H., Apte, U. Hepatocyte nuclear factor 4 alpha activation is essential for termination of liver regeneration in mice. Hepatology. 70 (2), 666-681 (2019).
- Korver, S., et al. The application of cytokeratin-18 as a biomarker for drug-induced liver injury. Archives of Toxicology. 95 (11), 3435-3448 (2021).
- Klyushova, L. S., Perepechaeva, M. L., Grishanova, A. Y. The role of CYP3A in health and disease. Biomedicines. 10 (11), 2686 (2022).
- Fujino, C., Sanoh, S., Katsura, T. Variation in expression of cytochrome P450 3A isoforms and toxicological effects: endo- and exogenous substances as regulatory factors and substrates. Biological & Pharmaceutical Bulletin. 44 (11), 1617-1634 (2021).
- Hutchinson, M. R., Menelaou, A., Foster, D. J., Coller, J. K., Somogyi, A. A. CYP2D6 and CYP3A4 involvement in the primary oxidative metabolism of hydrocodone by human liver microsomes. British Journal of Clinical Pharmacology. 57 (3), 287-297 (2004).
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Kammerer, S. Three-dimensional liver culture systems to maintain primary hepatic properties for toxicological analysis in vitro. International Journal of Molecular Sciences. 22 (19), 10214 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon