Method Article
Determinação da eficiência de acasalamento de haploides em Saccharomyces cerevisiae
Neste Artigo
Resumo
Neste trabalho, um método robusto para a quantificação da eficiência reprodutiva da levedura Saccharomyces cerevisiae é descrito. Este método é particularmente útil para a quantificação de barreiras pré-zigóticas em estudos de especiação.
Resumo
Saccharomyces cerevisiae é um organismo modelo amplamente utilizado em genética, evolução e biologia molecular. Nos últimos anos, tornou-se também um organismo modelo popular para estudar problemas relacionados à especiação. O ciclo de vida da levedura envolve as fases reprodutiva assexuada e sexuada. A facilidade de realizar experimentos evolutivos e o curto tempo de geração do organismo permitem o estudo da evolução das barreiras reprodutivas. A eficiência com que os dois tipos de acasalamento (a e α) se acasalam para formar o diploide a/α é referida como a eficiência de acasalamento. Qualquer diminuição na eficiência de acasalamento entre os haploides indica uma barreira pré-zigótica. Assim, para quantificar a extensão do isolamento reprodutivo entre dois haploides, um método robusto para quantificar a eficiência reprodutiva é necessário. Para tanto, um protocolo simples e altamente reprodutível é apresentado aqui. O protocolo envolve quatro etapas principais, que incluem remendar os haploides em uma placa YPD, misturar os haploides em números iguais, diluir e plaquear para colônias únicas e, finalmente, calcular a eficiência com base no número de colônias em uma placa de drop-out. Marcadores auxotróficos são empregados para fazer claramente a distinção entre haploides e diploides.
Introdução
Saccharomyces cerevisiae, comumente chamada de levedura brotante, é um eucariota unicelular. Tem dois tipos de acasalamento, a e α, e exibe ciclos reprodutivos assexuados e sexuados. Os tipos de acasalamento a e α são haploides e podem se dividir mitoticamente na ausência do outro tipo de acasalamento no ambiente circundante, que representa o ciclo assexuado das leveduras. Quando os dois tipos de acasalamento estão próximos, eles param de se dividir mitoticamente e se fundem para formar uma célula diploide. A levedura diploide pode se dividir mitoticamente quando os nutrientes estão presentes ou sofrer meiose sob condições de carência de nitrogênio na presença de uma fonte pobre de carbono não fermentável, como o acetato1. Isso resulta na formação de esporos, que permanecem dormentes até que haja condições favoráveis de crescimento. O ciclo de vida se completa quando esses esporos germinam e os dois tipos haploides são liberados de volta ao pool haploide 2,3 (Figura 1).
O acasalamento de células leveduriformes inclui várias etapas, como aglutinação, formação de uma projeção de acasalamento ou "shmoo", seguida de fusão celular e nuclear 4,5. Os dois tipos de acasalamento a e α produzem um fator a e um fator α, respectivamente, para iniciar o acasalamento. Esses fatores são feromônios polipeptídicos que se ligam aos receptores (Ste2 e Ste3) presentes na superfície celular do tipo oposto de acasalamento5. A ligação dos feromônios aos receptores inicia a via de resposta aos feromônios, a via de transdução do sinal da proteína quinase ativada por mitógeno (MAPK) 6,7,8. Isso resulta na parada do ciclo celular na fase G1, levando a uma fase estacionária metabolicamente ativa9. As células então param de se dividir mitoticamente, e as proteínas necessárias para o acasalamento são sintetizadas. Como as células haploides não podem se mover umas em direção às outras, uma projeção de acasalamento ou "shmoo" é direcionada para o parceiro de acasalamento. Quando as células entram em contato, a parede celular é degradada e o conteúdo citoplasmático se funde, resultando no acasalamento para formar uma célula diploide10,11. A eficiência de acasalamento entre haploides tem sido utilizada como medida de especiação em linhagens evoluídas em laboratório, bem como entre espécies existentes12.
Sendo um simples organismo eucariótico, a levedura é o modelo de escolha para um grande número de questões de pesquisa associadas a organismos eucarióticos complexos. Uma dessas questões está associada à especiação e à evolução das barreiras reprodutivas13,14. Para organismos sexualmente reprodutores, uma espécie é definida pelo conceito biológico de espécie (BSC) proposto por Ernst Mayr15. De acordo com esse conceito, dois indivíduos de uma população pertencem a duas espécies diferentes se não puderem cruzar e forem isolados reprodutivamente. A quebra do ciclo reprodutivo sexual (que envolve a fusão de gametas para formar um zigoto, o desenvolvimento do zigoto em uma progênie e a obtenção da maturidade sexual na progênie) leva ao isolamento reprodutivo. Como mostrado na Figura 1, o ciclo de vida de S. cerevisiae é comparável ao ciclo reprodutivo sexual: a) a fusão dos dois tipos de acasalamento a e α é semelhante à fusão de gametas em organismos sexualmente reprodutores; b) a capacidade do diploide de sofrer divisão mitótica é equivalente ao zigoto que se desenvolve em progênie; e c) o diploide submetido à esporulação é comparável ao processo de gametogênese14.
O isolamento pré-zigótico ocorre quando se observa acasalamento assortativo. Dada a mesma oportunidade de acasalar com dois tipos geneticamente diferentes, um tipo α acasala preferencialmente com um em detrimento do outro ou vice-versa14. No caso de experimentos evolutivos em que haploides foram evoluídos em diferentes ambientes, a presença de uma barreira pré-acasalamento pode ser determinada através da realização de um ensaio de acasalamento. Uma diminuição na eficiência de acasalamento quando comparada ao ancestral indica a evolução de uma barreira pré-acasalamento. O isolamento pós-zigótico pode surgir devido à incapacidade do diploide de sofrer divisão mitótica efetiva e/ou esporulação para formar esporos haploides14. Estes podem ser quantificados medindo-se a taxa de crescimento dos diploides e calculando-se a eficiência de esporulação, respectivamente. Assim, para estudar a evolução das barreiras reprodutivas, são necessários métodos robustos para quantificar (a) a eficiência de acasalamento, (b) o crescimento mitótico do diploide e (c) a eficiência de esporulação do diploide. Neste trabalho, um método robusto para quantificar a eficiência reprodutiva de linhagens de leveduras é relatado.
Em experimentos de laboratório, uma das formas pelas quais a ocorrência de acasalamento pode ser detectada é por meio do uso de marcadores auxotróficos que complementam as necessidades nutricionais. Quando os dois tipos de acasalamento são auxotróficos para dois aminoácidos diferentes, apenas a célula diploide formada pela fusão dos dois tipos de acasalamento pode crescer em um meio deficiente em ambos os aminoácidos. Assim, marcadores auxotróficos são úteis para detectar acasalamentos qualitativa e quantitativamente. Um teste qualitativo será suficiente para identificar o tipo de acasalamento de uma cepa após a meiose16. Testes quantitativos são essenciais quando se está interessado em identificar uma redução no acasalamento enquanto se estudam os genes envolvidos na via de acasalamento17,18. Além disso, com leveduras sendo cada vez mais utilizadas em estudos de especiação, um ensaio de acasalamento conveniente e reprodutível é necessário, uma vez que a quantificação da eficiência reprodutiva é uma medida da barreira pré-zigótica.
A eficiência reprodutiva entre os dois tipos de acasalamento de leveduras foi quantificada previamente16,19,20. A maioria dos métodos utilizados anteriormente são semelhantes em seu desenho, com algumas variações 16,21,22,23,24,25. Alguns deles usam culturas de fase log inicial, enquanto alguns outros usam culturas de fase média de log de cepas haploides. Há variações nas proporções em que os dois tipos de acasalamento são misturados. Quase todos os protocolos utilizam membrana de nitrocelulose. Suspensões de ambos os tipos de acasalamento retiradas de culturas previamente cultivadas são misturadas e filtradas em uma membrana de nitrocelulose colocada em uma placa YPD. Em uma das variações do protocolo, a suspensão haploide é diretamente remendada em uma placa YPD21. Em experimentos que tratam dos genes envolvidos na produção de feromônios dos dois tipos de acasalamento, os feromônios são adicionados externamente durante a confecção das suspensões dos dois tipos de acasalamento24.
Após a incubação por algumas horas (tipicamente em torno de 5 h) após a mistura dos haploides, as células são lavadas da membrana, diluídas e plaqueadas em meios seletivos. Em um dos métodos anteriores relatados em 1973, a eficiência da formação de zigoto ou acasalamento foi calculada pela contagem do número de células brotadas, células não brotadas e pares de acasalamento sob um microscópio usando um hemocitômetro26. No entanto, a maioria dos métodos relatados posteriormente usa marcadores auxotróficos para distinguir haploides e diploides. A eficiência de acasalamento é calculada como a porcentagem de células diploides em relação ao número de células diploides e haploides no pool celular 16,21,23.
No entanto, apesar de vários relatos usando leveduras como um organismo modelo para estudar a especiação, não há nenhum protocolo padronizado relatado na literatura até o momento para calcular a eficiência do acasalamento. Células na fase logarítmica podem não ser ideais para a quantificação da eficiência de acasalamento. Durante o acasalamento, o ciclo celular dos dois haploides é interrompido e, portanto, as células durante o acasalamento não estão se dividindo9. Como o ciclo celular também é conhecido por ser igualmente preso em células na fase estacionária27, o uso dessas células pode tornar o protocolo mais reprodutível. As células de fase estacionária podem ser misturadas e dispostas em placas YPD (ou seja, um ambiente nutricionalmente rico) para o acasalamento. Os procedimentos convencionais também exigem uma membrana de nitrocelulose e lavagem das células, tornando o processo complicado e passível de erros de manuseio. Além disso, os protocolos utilizados até o momento quantificam a eficiência de acasalamento em termos de um haploide. No entanto, ao medir o isolamento reprodutivo, a eficiência de acasalamento é quantificada para uma combinação particular de haploides em vez de um único haploide.
Para resolver essas questões, aqui relatamos um método robusto para a quantificação da eficiência de acasalamento em leveduras que é altamente reprodutível e fácil de usar. Além disso, este método e as linhagens de leveduras empregadas aqui também podem ser usados em estudos que examinam o efeito do fluxo gênico na evolução das barreiras de acasalamento.
Duas cepas diferentes de S. cerevisiae foram utilizadas neste estudo. Uma das cepas é derivada do fundo SK1; isso foi modificado em nosso laboratório pela adição dos marcadores auxotróficos próximos ao locus MAT. Os genótipos resultantes dos haploides, estão apresentados na Tabela 128,29,30. Na cepa SK1, o haploide a teve o gene TRP1 inserido próximo ao locus MAT, e o haploide α teve o gene LEU2 inserido próximo ao locus MAT. Na cepa ScAM, os genes TRP1 e URA3 foram inseridos nos haploides a e α, respectivamente. O local de inserção foi na região ARS do cromossomo III (Chr III: 197378..197609). Para o protocolo aqui relatado, marcadores auxotróficos em qualquer lugar do genoma seriam suficientes. No entanto, ter os marcadores auxotróficos próximos ao locus MAT significa que essas cepas também podem ser usadas para estudos que examinam o efeito do fluxo gênico na especiação31,32. Os marcadores foram adicionados próximos ao locus MAT para evitar o remanejamento dos marcadores devido à recombinação. Assim, este protocolo pode ser utilizado para quantificar a eficiência reprodutiva em estudos envolvendo especiação e também para identificar a alteração da eficiência reprodutiva ao estudar as proteínas envolvidas na via de acasalamento.
Protocolo
NOTA: O protocolo envolve amplamente as seguintes etapas: (1) remendar os haploides nas grades de eficiência de acasalamento em uma placa YPD, (2) misturar os haploides em números iguais após 24 h de incubação e dar aos haploides mistos algumas horas para acasalar (7 h neste estudo), (3) plaquear as células mistas em YPD para isolar colônias únicas após 7 h a 30 °C, e, finalmente, (4) determinação do número de diploides formados pelos marcadores auxotróficos. Essas etapas são discutidas em detalhes a seguir (consulte também a Figura 2).
1. Aplicação de patches de haploides nas grades de eficiência de acasalamento
- Reviva os haploides a e α dos estoques congelados por meio de uma placa de ágar YPD (2% ágar, 2% dextrose, 1% peptona, 0,5% extrato de levedura) e deixe-os crescer por 48 h a 30 °C para obter colônias únicas isoladas.
- Inocular colônias únicas da placa YPD em 5 mL de meio YPD (dextrose a 2%, peptona a 1%, extrato de levedura a 0,5%) e incubar a 30 °C por 48 h com agitação a 250 rpm. As células encontram-se na fase estacionária de crescimento após este período de incubação.
- Desenhe uma grade de eficiência de acasalamento em uma placa YPD fresca. Desenhe a grade como um retângulo de 1 cm x 1,5 cm dividido em três caixas de modo que cada uma tenha uma dimensão de 1 cm x 0,5 cm, como mostra a Figura 2A.
- Patch 5 μL da cultura YPD dos dois tipos de acasalamento nos retângulos mais à esquerda e mais à direita (Figura 2B). Este volume corresponde a aproximadamente 5 x10 5 células haploides dispostas em cada seção. Incubar as placas durante 24 h a 30 °C.
NOTA: O objetivo da grade é tornar as medidas experimentais precisas (como o número de células no experimento). O tamanho da grade é pequeno o suficiente para que seja experimentalmente tratável, mas grande o suficiente para que possa ser facilmente manipulado (como levantar células de uma grade) e não suscetível a eventos de deriva ou casuais.
2. Mistura de haploides e acasalamento
NOTA: Após 24 h (Figura 2C), um número igual de células dos dois tipos haploides é raspado das duas grades, misturado e colocado no retângulo central (Figura 2D).
- Para misturar um número igual de células, remova cerca de 1/3 do adesivo que foi colocado nas caixas externas usando um palito estéril e ressuspenda em 20 μL de água em um frasco estéril de 1,5 mL para cada um dos haploides.
- Diluir 5 μL desta suspensão em 2 ml de água. Medir o DO desta suspensão diluída utilizando um espectrofotómetro a 600 nm. Misturar um número igual de células das duas cepas, com base no valor de OD e no número de células/mL em 1 OD para essa cepa específica. Calcular o volume necessário para ser misturado e aspirar a partir dos 15 μL restantes da suspensão haploide individual.
Observação : O número de células corrigidas no retângulo central é tal que as células formam uma monocamada. Considerando a célula de levedura como uma esfera com raio de 2,58 μm33, uma caixa retangular de 1 cm x 0,5 cm necessitaria de aproximadamente 1,7 x 106 células para formar uma monocamada. Deve-se tomar cuidado para garantir que não haja toque físico entre as células remendadas para o acasalamento e as duas grades celulares haploides. Uma vez que números iguais de cada tipo de células haploides têm de ser misturados, 8,5 x 105 células são adicionadas de cada estirpe. O número de células é calculado com base em medidas de DO, considerando 1 DO a 600 nm como sendo aproximadamente equivalente a 1 x 107 células34. Por exemplo, se o OD600 da suspensão haploide a é 0,17 e o da suspensão haploide α é 0,11, o número de células em 5 μL de cada suspensão haploide pode ser calculado. Para garantir 8,5 x 105 células de cada tipo haploide, 1,25 μL do haploide a e 1,93 μL do α as suspensões haploides são misturadas. - Adicione os volumes necessários de ambos os haploides num frasco para injetáveis fresco e estéril de 1,5 ml e misture bem utilizando uma pipeta. O volume final desta suspensão é geralmente em torno de 6-8 μL. Patch esta suspensão na grade central. Incubar a placa a 30 °C por 7 h, permitindo que os haploides tenham tempo suficiente para acasalar (Figura 2E).
3. Chapeamento de células mistas em ágar YPD
- Após o período de incubação de 7 h, raspar as células do retângulo central usando um palito ou uma ponta de pipeta e diluir em 2 mL de água estéril. Em seguida, espalhe a suspensão celular em ágar YPD para obter colônias únicas. Para determinar o fator de diluição necessário para obter colônias únicas, medir o DO do primeiro tubo no qual as células raspadas são adicionadas. É necessário determinar factores de diluição específicos para cada tipo de célula/estirpe utilizada.
NOTA: Por exemplo, um OD600 de 0,15 corresponde a 3 x 106 células em uma suspensão de 2 mL (considerando 1 OD = 1 x 107 células/mL). Para obter algumas centenas de colônias na placa YPD, a suspensão celular é diluída em série a 1:20 duas vezes e, em seguida, 100 μL da diluição final é usada para espalhamento. - Após o plaqueamento, incubar as placas de YPD a 30 °C por 36–48 h até que haja colônias únicas. Garantir que algumas centenas de colônias individuais sejam obtidas de cada experimento de acasalamento para triagem, de modo a garantir que a significância estatística possa ser detectada nos dados (Figura 2F).
4. Triagem de diploides utilizando marcadores auxotróficos
- Determinar qual fração das colônias obtidas é diploide. Para identificar as colônias diploides na placa, transfira as colônias individuais para uma placa de duplo drop-out (2% de glicose, 0,66% de base de nitrogênio, 0,05% de mistura de aminoácidos de drop-out duplo e 2% de ágar) sem os aminoácidos para os quais as cepas são auxotróficas, como mostrado na Figura 2G. Incubar as placas a 30 °C durante 48 horas.
NOTA: As colônias também podem ser transferidas para a placa de gotejamento duplo usando revestimento de réplica. Neste estudo, o meio de abandono de triptofano e leucina (trp− leu−) foi usado para quantificar a eficiência de acasalamento das cepas SK1AM, e o meio de abandono de triptofano e uracilo (trp− ura−) foi usado para as cepas de ScAM. Apenas as colônias diploides crescem na placa de duplo drop-out, pois possuem ambos os marcadores auxotróficos: os genes TRP1 e LEU2 nas cepas SK1AM e os genes TRP1 e URA3 nas cepas ScAM. - Além disso, estriar ou replicar plaqueia as colônias em um único meio de gotejamento (trp− ou leu− ou ura−) para quantificar a frequência de cada um dos dois tipos de haploide na população.
- Calcule a eficiência de acasalamento, η, da seguinte forma:
 Qe (1)
Qe (1)
onde o número de haploides acasalados, é simplesmente igual ao dobro do número de diploides identificados na placa de gotejamento duplo (uma vez que cada diploide resultou do acasalamento de dois haploides). O número total de haploides é igual à soma do número de haploides estriados mais o dobro do número de diploides estriados.
NOTA: Por exemplo, se apenas 60 colônias crescem após o estilhaço/revestimento de 100 colônias em um meio de gotejamento duplo, a eficiência de acasalamento pode ser quantificada como 75% (como 60 x 2 haploides acasalaram para formar os 60 diploides, e 40 haploides não acasalaram).
Resultados
Quantificação da eficiência reprodutiva dos dois tipos de acasalamento
O protocolo aqui descrito foi utilizado para quantificar a eficiência reprodutiva entre duas linhagens de leveduras - entre SK1AM a e SK1AM α e entre ScAMa eScAM α (Figura 3A). Nesses experimentos, o acasalamento entre os dois haploides foi repetido pelo menos 12 vezes. Em cada uma das repetições do experimento, pelo menos 100 colônias foram listradas em meio de duplo drop-out. A robustez do protocolo permitiu fácil diferenciação da eficiência reprodutiva entre as duas linhagens, SK1AM e ScAM. Enquanto as cepas SK1 acasalaram com uma eficiência muito alta, as cepas ScAM acasalaram com uma eficiência relativamente menor (Figura 3A). Isso talvez não seja surpreendente, uma vez que as cepas ScAM originaram-se do acasalamento híbrido entre as cepas S. cerevisiae e S. carlsbergensis 35.
Além de distinguir a eficiência de acasalamento entre as linhagens, este método também pode ser usado para quantificar as diferenças na eficiência de acasalamento das cepas em diferentes ambientes. Como mostrado na Figura 3B, a eficiência de acasalamento das cepas ScAM caiu significativamente quando o ambiente não continha glicose como fonte primária de carbono. O acasalamento é um processo energeticamente caro, e o crescimento em fontes alternativas de carbono reduz qualitativamente a eficiência do acasalamento.
Dinâmica da eficiência de acasalamento
A alta repetibilidade do método também permite acompanhar a dinâmica da eficiência de acasalamento. Quando permitido acasalar por diferentes períodos de tempo (Figura 3C), nenhum acasalamento foi observado nas primeiras 4-5 h; Os primeiros diploides apareceram somente após essa duração. Presumivelmente, este é o tempo necessário para que o processo de acasalamento seja concluído no ambiente dado. A partir daí, a eficiência de acasalamento aumentou rapidamente. No entanto, após 7 h, os cálculos de eficiência de acasalamento são influenciados pelo fato de que o crescimento mitótico começa a acontecer na placa. A identificação e seleção de diploides precoces ou tardios desta forma pode permitir o planejamento de experimentos que visam evoluir acasalamentos rápidos ou tardios entre haploides. O momento exato em que a eficiência de acasalamento atinge o pico é variável para cada cepa. Por exemplo, usando cinética de crescimento, determinamos experimentalmente que a linhagem ScAM exibe uma taxa de crescimento menor do que a de outras linhagens de S. cerevisiae (como SK1), e isso provavelmente também influencia a dinâmica do acasalamento.

Figura 1: Ciclo de vida de Saccharomyces cerevisiae. S. cerevisiae possui dois tipos de acasalamento, a e α, e apresenta fases reprodutivas assexuadas e sexuadas. Os dois tipos de acasalamento, na ausência do outro, dividem-se mitoticamente. No entanto, quando estão presentes nas proximidades um do outro, eles param de se dividir mitoticamente, e o conteúdo celular e nuclear se fundem para formar um diploide. A célula diploide pode se dividir mitoticamente. No entanto, na presença de condições desfavoráveis (fome), sofre meiose para produzir esporos contendo quatro haploides. Esses esporos germinam sob condições favoráveis para liberar dois haploides de cada tipo, completando assim o ciclo de vida. A eficácia com que os dois haploides a e α se acasalam é referida como a eficiência de acasalamento. Qualquer diminuição nesta eficiência de acasalamento indica uma barreira pré-zigótica ao acasalamento. Clique aqui para ver uma versão maior desta figura.
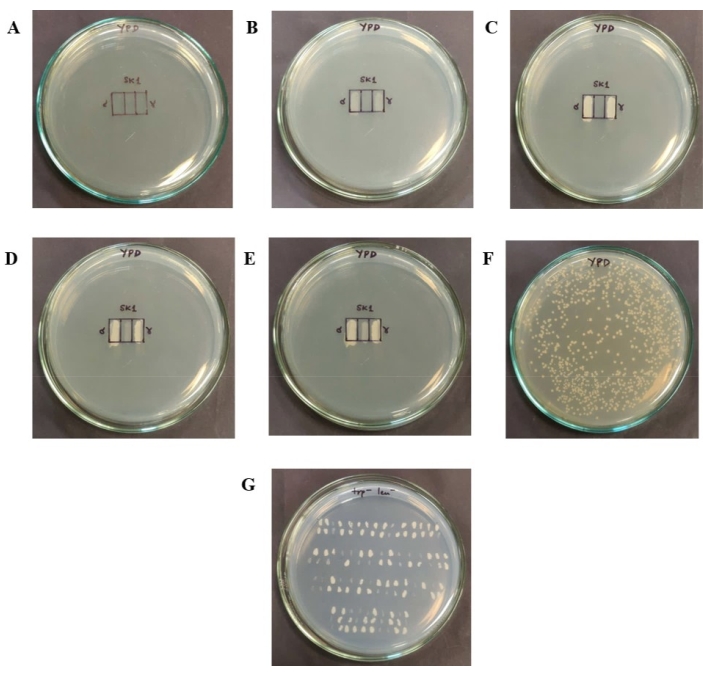
Figura 2: Etapas envolvidas no ensaio de eficiência de acasalamento. (A) Uma grade de eficiência de acasalamento de 1 cm x 1,5 cm, que é dividida em caixas de 1 cm x 0,5 cm cada, é desenhada em uma placa YPD. (B) As células haploides são remendadas nas caixas extremas. (C) O crescimento de células haploides após 24 h a 30 °C. (D) Um terço das manchas haploides são removidas usando um palito, misturadas em números iguais de células (com base em OD600) e corrigidas na grade central. (E) O crescimento das células remendadas na grade central após 7 h a 30 °C. Este contém os novos diploides formados e os haploides que não acasalaram. (F) Colônias isoladas obtidas em uma placa YPD após a diluição e plaqueamento das células raspadas da grade central. Essa placa foi incubada a 30 °C por 36-48 h. (G) Para identificar o número de diploides presentes na placa YPD, as colônias são transferidas para uma placa de duplo drop-out sem triptofano e leucina. Apenas diploides podem crescer nesta placa. Clique aqui para ver uma versão maior desta figura.
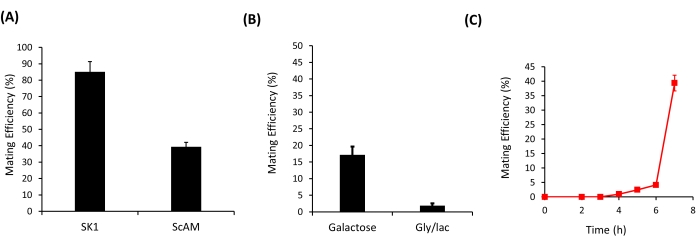
Figura 3: Eficiência de acasalamento das linhagens de leveduras. (A) A eficiência de acasalamento dos dois haploides a e α das cepas SK1 e ScAM em uma placa YPD. (B) A eficiência de acasalamento dos dois haploides a e α da cepa ScAM em placas de YP contendo 2% de galactose e em placas de glicerol/lactato. (C) A dinâmica do acasalamento na linhagem ScAM em ambiente de glicose. Os resultados são apresentados como média ± DP a partir de 12 repetições independentes. Clique aqui para ver uma versão maior desta figura.
| Cepas | Genótipo | Comentário | Referência |
| SK1AMa | ars314::TRP1, MATa, ho::LYS2, lys2, ura3, leu2::hisG, his3::hisG, trp1::hisG | Esta estirpe tem o gene TRP1 e pode, portanto, crescer na ausência de triptofano no meio. | |
| SK1AMα | ars314::LEU2, MATalpha, ho::LYS2, lys2, ura3, leu2::hisG, his3::hisG, trp1::hisG | Esta estirpe tem o gene LEU2 e pode, portanto, crescer na ausência de leucina no meio. | |
| ScAMum | ars314::TRP1, MATa, ho, MEL1, ade1, ile, trp1-HIII ura3‐52 | Esta estirpe tem o gene TRP1 e pode, portanto, crescer na ausência de triptofano no meio. | Derivado de ScPJB644a na referência 28 |
| ScAMα | ars314::URA3, MATalpha, ho, MEL1, ade1, ile, trp1-HIII, ura3‐52 | Esta estirpe tem o gene URA3 e pode, portanto, crescer na ausência de uracilo nos meios. | Derivado de ScPJB644α na referência 28 |
Tabela 1: Genótipos das cepas de S. cerevisiae utilizadas neste estudo.
Discussão
A quantificação da eficiência reprodutiva em S. cerevisiae é essencial para a realização de estudos relacionados aos genes envolvidos nas vias de acasalamento ou para o estudo da influência do ambiente externo no comportamento reprodutivo. Nas últimas duas décadas, S. cerevisiae também se tornou um modelo popular para abordar questões relacionadas à especiação14,36,37,38. A presença de dois tipos de acasalamento e a facilidade de manipulação e manutenção genética em ambientes de laboratório o tornaram um organismo apto para estudar a evolução das barreiras reprodutivas em tempo real. A quantificação da eficiência reprodutiva é essencial, pois fornece uma medida da barreira reprodutiva pré-zigótica. Assim, é necessário um protocolo conveniente e de alta reprodutibilidade.
Usando o protocolo acima, a eficiência reprodutiva de duas linhagens diferentes que apresentam comportamento reprodutivo completamente diferente foi quantificada. Assim, o protocolo pode ser aplicado a qualquer cepa, pois a maioria das linhagens de leveduras de laboratório carrega auxotrofias que podem ser usadas para seleção39. No entanto, existem algumas considerações importantes durante o uso desse protocolo. A duração de tempo necessária para que as culturas iniciais de DPP atinjam a fase estacionária é dependente da deformação. Uma estirpe de crescimento lento pode necessitar de mais de 48 h de incubação a 30 °C. O volume de haploide a ser misturado é calculado com base em medições de DO em espectrofotômetro. O valor relatado na literatura é da ordem de 107 células/mL para 1 OD34; no entanto, é melhor caracterizar esse valor para uma determinada cepa usando um gráfico de DO versus o número de células. O volume necessário para garantir a mistura de igual número de células pode ser calculado com base no valor de DO e no número de células/mL em 1 DO, que são obtidos a partir da caracterização da cepa. Deve-se garantir que as células que estão sendo remendadas na grade central depois de misturar os haploides formem aproximadamente uma monocamada que não seja muito espessa. Também é preciso ter certeza de que o volume que está sendo misturado é de aproximadamente 6-8 μL. Um volume maior pode levar à sobreposição com as manchas haploides que estão em ambos os lados da grade central.
Este método também pode ser usado para estudar barreiras reprodutivas pré-zigóticas entre isolados ecológicos de leveduras. No entanto, para esses casos, o gene da endonuclease HO deve ser removido primeiramente do genoma do organismo, pois as cepas portadoras da endonuclease HO formam diploides automaticamente devido à sua atividade de comutação do tipo acasalamento40. Os haploides isolados do diploide esporulado podem ser identificados como um ou α identificando a sequência presente no locus MAT usando os primers específicos mencionados anteriormente41. O marcador HO pode ser substituído por dois genes diferentes de resistência a antibióticos como marcadores para distinguir entre os dois tipos de acasalamento haploide. Esse detalhe depende da construção da deformação utilizada no estudo em particular.
Uma das limitações desse método é que o uso de marcadores auxotróficos requer a transferência das colônias da placa YPD para as placas de drop-out. O uso de marcadores de fluorescência para distinguir entre células haploides e diploides pode ajudar a reduzir o tempo experimental. Entretanto, o uso de marcadores de fluorescência pode afetar a dinâmica de crescimento das células, pois há um custo adicional envolvido na produção das proteínas fluorescentes, o que, portanto, pode alterar o estado metabólico e fisiológico de umacélula42. Alternativamente, os marcadores auxotróficos para identificar os dois haploides podem ser substituídos por marcadores antibióticos.
Alguns dos métodos anteriores utilizados para a caracterização da eficiência reprodutiva relatam a utilização de um excesso de um dos tipos de acasalamento na proporção de 10:1 16,21,24. Pela experiência, o uso de uma razão enviesada dos dois haploides resulta em crescimento mitótico do haploide em excesso. Portanto, o método atual usa uma mistura 1:1 dos dois haploides.
Como os marcadores auxotróficos das linhagens utilizadas neste estudo estão inseridos próximos ao locus MAT , a recombinação durante a meiose não quebra a associação entre o marcador auxotrófico e o tipo de acasalamento. Como resultado, a auxotrofia e o tipo de acasalamento de um determinado haploide não mudam mesmo se as cepas forem submetidas à meiose. Isso permite responder a questões relacionadas ao impacto do fluxo gênico como variável na adaptação e especiação43. Assim, de modo geral, este protocolo apresenta um método simples e robusto para quantificar as eficiências de acasalamento entre diferentes linhagens de leveduras.
Divulgações
Os autores declaram não ter interesses concorrentes neste trabalho. Os autores estão felizes em compartilhar as cepas derivadas do SK1 para todo uso sem fins lucrativos.
Agradecimentos
Este trabalho foi financiado por uma bolsa DBT/Wellcome Trust (India Alliance) (IA/S/19/2/504632) para S.S. P.N. é um Research Fellow apoiado por uma bolsa DBT/Wellcome Trust (India Alliance) (IA/S/19/2/504632). A.M. é apoiado pelo Conselho de Pesquisa Científica e Industrial (CSIR), Governo da Índia, como Senior Research Fellow (09/087(0873)/2017-EMR-I). Os autores agradecem a Paike Jayadeva Bhat pelas discussões.
Materiais
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma Life Science | A8626 | |
| Agar Powder regular grade for bacteriology | SRL | 19661 (0140186) | |
| Ammonium Sulphate, Hi-AR | HiMedia | GRM1273 | |
| D-(+)-glucose | Sigma Life Science | G8270 | |
| Glass Petri plates | HiMedia | PW008 | 90 mm x 15 mm dimension |
| L-Arginine | Sigma Life Science | A8094 | |
| L-Aspartic acid | Sigma Life Science | A7219 | |
| L-Histidine monochloride monohydrate | Sigma Life Science | H5659 | |
| L-Isoleucine | Sigma Aldrich | I2752 | |
| L-Leucine | Sigma Life Science | L8912 | |
| L-Lysine | Aldrich | 62840 | |
| L-Methionine | Sigma Life Science | M5308 | |
| L-Phenylalanine | Sigma Life Science | P5482 | |
| L-Threonine | Sigma Aldrich | T8625 | |
| L-Tyrosine | Sigma Life Science | T8566 | |
| L-Valine | Sigma Life Science | V0513 | |
| Mating efficiency grid | 1 cm x 1.5 cm rectangular grid drawn on the Petri plate | ||
| Microcentrifuge tubes | Tarsons | 500010 | |
| Peptone | HiMedia | RM001 | |
| Uracil | Sigma Life Science | U0750 | |
| Yeast Extract Powder | HiMedia | RM027 | |
| Yeast Nitrogen Base w/o Amino acids and Ammonium Sulphate | BD Difco | 233520 |
Referências
- Neiman, A. M. Sporulation in the budding yeast Saccharomyces cerevisiae. Genetics. 189 (3), 737-765 (2011).
- Duina, A. A., Miller, M. E., Keeney, J. B. Budding yeast for budding geneticists: A primer on the Saccharomyces cerevisiae model system. Genetics. 197 (1), 33-48 (2014).
- Herskowitz, I. Life cycle of the budding yeast Saccharomyces cerevisiae. Microbiological Reviews. 52 (4), 536-553 (1988).
- Erdman, S., Lin, L., Malczynski, M., Snyder, M. Pheromone-regulated genes required for yeast mating differentiation. Journal of Cell Biology. 140 (3), 461-483 (1998).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: How yeast cells do it. Open Biology. 3 (3), 130008 (2013).
- Gustin, M. C., Albertyn, J., Alexander, M., Davenport, K. MAP kinase pathways in the yeast Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 62 (4), 1264-1300 (1998).
- Bardwell, L. A walk-through of the yeast mating pheromone response pathway. Peptides. 26 (2), 339-350 (2005).
- Reid, B. J., Hartwell, L. H. Regulation of mating in the cell cycle of Saccharomyces cerevisiae. Journal of Cell Biology. 75, 355-365 (1977).
- Williams, T. C., Peng, B., Vickers, C. E., Nielsen, L. K. The Saccharomyces cerevisiae pheromone-response is a metabolically active stationary phase for bio-production. Metabolic Engineering Communications. 3, 142-152 (2016).
- Bagnat, M., Simons, K. Cell surface polarization during yeast mating. Proceedings of the National Academy of Sciences of the United States of America. 99 (22), 14183-14188 (2002).
- Trueheart, J., Boeke, J. D., Fink, G. R. Two genes required for cell fusion during yeast conjugation: Evidence for a pheromone-induced surface protein. Molecular and Cellular Biology. 7 (7), 2316-2328 (1987).
- Sniegowski, P. D., Dombrowski, P. G., Fingerman, E. Saccharomyces cerevisiae and Saccharomyces paradoxus coexist in a natural woodland site in North America and display different levels of reproductive isolation from European conspecifics. FEMS Yeast Research. 1 (4), 299-306 (2002).
- Replansky, T., Koufopanou, V., Greig, D., Bell, G. Saccharomyces sensu stricto as a model system for evolution and ecology. Trends in Ecology and Evolution. 23 (9), 494-501 (2008).
- Greig, D. Reproductive isolation in Saccharomyces. Heredity. 102 (1), 39-44 (2009).
- Mayr, E. . Systematics and the Origin of Species, from the Viewpoint of a Zoologist. , (1999).
- Sprague, G. F. Assay of yeast mating reaction. Methods in Enzymology. 194, 77-93 (1991).
- McCaffrey, G., Clay, F. J., Kelsay, K., Sprague, G. F. Identification and regulation of a gene required for cell fusion during mating of the yeast Saccharomyces cerevisiae. Molecular and Cellular Biology. 7 (8), 2680-2690 (1987).
- Valtz, N., Peter, M., Herskowitz, I. FAR1 is required for oriented polarization of yeast cells in response to mating pheromones. Journal of Cell Biology. 131 (4), 863-873 (1995).
- Maclean, C. J., Greig, D. Prezygotic reproductive isolation between Saccharomyces cerevisiae and Saccharomyces paradoxus. BMC Evolutionary Biology. 8, 1 (2008).
- Murphy, H. A., Kuehne, H. A., Francis, C. A., Sniegowski, P. D. Mate choice assays and mating propensity differences in natural yeast populations. Biology Letters. 2 (4), 553-556 (2006).
- Leu, J. Y., Murray, A. W. Experimental evolution of mating discrimination in budding yeast. Current Biology. 16 (3), 280-286 (2006).
- Kim, J., Hirsch, J. P. A nucleolar protein that affects mating efficiency in Saccharomyces cerevisiae by altering the morphological response to pheromone. Genetics. 149 (2), 795-805 (1998).
- Jin, M., et al. Yeast dynamically modify their environment to achieve better mating efficiency. Science Signaling. 4 (186), (2011).
- Rogers, D. W., Denton, J. A., McConnell, E., Greig, D. Experimental evolution of species recognition. Current Biology. 25 (13), 1753-1758 (2015).
- McClure, A. W., Jacobs, K. C., Zyla, T. R., Lew, D. J. Mating in wild yeast: Delayed interest in sex after spore germination. Molecular Biology of the Cell. 29 (26), 3119-3127 (2018).
- Sena, E. P., Radin, D. N., Fogel, S. Synchronous mating in yeast. Proceedings of the National Academy of Sciences of the United States of America. 70 (5), 1373-1377 (1973).
- Werner-Washburne, M., Braun, E., Johnston, G. C., Singer, R. A. Stationary phase in the yeast Saccharomyces cerevisiae. Microbiology Reviews. 57 (2), 383-401 (1993).
- Johnston, S. A., Hopper, J. E. Isolation of the yeast regulatory gene GAL4 and analysis of its dosage effects on the galactose/melibiose regulon. Proceedings of the National Academy of Sciences of the United States of America. 79 (22), 6971-6975 (1982).
- Mahilkar, A. . Study of metabolic specialization leading to speciation, using yeast as a model system. , (2021).
- Blank, T. E., Woods, M. P., Lebo, C. M., Xin, P., Hopper, J. E. Novel Gal3 proteins showing altered Gal80p binding cause constitutive transcription of Gal4p-activated genes in Saccharomyces cerevisiae. Molecular and Cellular Biology. 17 (5), 2566-2575 (1997).
- Rice, W. R., Hostert, E. E. Laboratory experiments on speciation: What have we learned in 40 years. Evolution. 47 (6), 1637-1653 (1993).
- White, N. J., Snook, R. R., Eyres, I. The past and future of experimental speciation. Trends in Ecology and Evolution. 35 (1), 10-21 (2020).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--The database of key numbers in molecular and cell biology. Nucleic Acids Research. 38, 750-753 (2010).
- Domitrovic, T., et al. Structural and functional study of YER067W, a new protein involved in yeast metabolism control and drug resistance. PLoS One. 5 (6), 11163 (2010).
- Lindegren, C. C., Spiegelman, S., Lindegren, G. Mendelian inheritance of adaptive enzymes. Proceedings of the National Academy of Sciences of the United States of America. 30 (11), 346-352 (1944).
- Dettman, J. R., Sirjusingh, C., Kohn, L. M., Anderson, J. B. Incipient speciation by divergent adaptation and antagonistic epistasis in yeast. Nature. 447 (7144), 585-588 (2007).
- Jhuang, H. Y., Lee, H. Y., Leu, J. Y. Mitochondrial-nuclear co-evolution leads to hybrid incompatibility through pentatricopeptide repeat proteins. EMBO Reports. 18 (1), 87-101 (2017).
- Lee, H. Y., et al. Incompatibility of nuclear and mitochondrial genomes causes hybrid sterility between two yeast species. Cell. 135 (6), 1065-1073 (2008).
- Pronk, J. T. Auxotrophic yeast strains in fundamental and applied research. Applied and Environmental Microbiology. 68 (5), 2095-2100 (2002).
- Madhani, H. D. . From a to α: Yeast as a Model for Cellular Differentiation. , (2007).
- Huxley, C., Green, E. D., Dunham, I. Rapid assessment of S. cerevisiae mating type by PCR. Trends in Genetics. 6 (8), 236 (1990).
- Rang, C., Galen, J. E., Kaper, J. B., Chao, L. Fitness cost of the green fluorescent protein in gastrointestinal bacteria. Canadian Journal of Microbiology. 49 (9), 531-537 (2003).
- Tusso, S., Nieuwenhuis, B. P. S., Weissensteiner, B., Immler, S., Wolf, J. B. W. Experimental evolution of adaptive divergence under varying degrees of gene flow. Nature Ecology and Evolution. 5 (3), 338-349 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados