Method Article
Détermination de l’efficacité d’accouplement des haploïdes chez Saccharomyces cerevisiae
Dans cet article
Résumé
Dans ce travail, une méthode robuste pour la quantification de l’efficacité de l’accouplement chez la levure Saccharomyces cerevisiae est décrite. Cette méthode est particulièrement utile pour la quantification des barrières pré-zygotiques dans les études de spéciation.
Résumé
Saccharomyces cerevisiae est un organisme modèle largement utilisé en génétique, en évolution et en biologie moléculaire. Ces dernières années, il est également devenu un organisme modèle populaire pour étudier les problèmes liés à la spéciation. Le cycle de vie de la levure implique à la fois des phases de reproduction asexuée et sexuée. La facilité d’effectuer des expériences d’évolution et le court temps de génération de l’organisme permettent d’étudier l’évolution des barrières reproductives. L’efficacité avec laquelle les deux types d’accouplement (a et α) s’accouplent pour former le diploïde a/α est appelée efficacité d’accouplement. Toute diminution de l’efficacité de l’accouplement entre haploïdes indique une barrière pré-zygote. Ainsi, pour quantifier l’étendue de l’isolement reproductif entre deux haploïdes, une méthode robuste pour quantifier l’efficacité de l’accouplement est nécessaire. À cette fin, un protocole simple et hautement reproductible est présenté ici. Le protocole comprend quatre étapes principales, qui comprennent le rapiéçage des haploïdes sur une plaque YPD, le mélange des haploïdes en nombre égal, la dilution et le placage pour les colonies individuelles, et enfin, le calcul de l’efficacité en fonction du nombre de colonies sur une plaque de chute. Des marqueurs auxotrophes sont utilisés pour faire clairement la distinction entre les haploïdes et les diploïdes.
Introduction
Saccharomyces cerevisiae, communément appelée levure bourgeonnante, est un eucaryote unicellulaire. Il a deux types d’accouplement, a et α, et présente à la fois des cycles de reproduction asexuée et sexuée. Les types d’accouplement a et α sont haploïdes et peuvent se diviser mitotiquement en l’absence de l’autre type d’accouplement dans le milieu environnant, qui représente le cycle asexué de la levure. Lorsque les deux types d’accouplement sont à proximité, ils cessent de se diviser mitotiquement et fusionnent pour former une cellule diploïde. La levure diploïde peut soit se diviser mitotiquement lorsque des nutriments sont présents, soit subir une méiose dans des conditions de privation d’azote en présence d’une source de carbone pauvre et non fermentescible, telle que l’acétate1. Il en résulte la formation de spores, qui restent dormantes jusqu’à ce que les conditions de croissance soient favorables. Le cycle de vie est terminé lorsque ces spores germent et que les deux types haploïdes sont relâchés dans le pool haploïde 2,3 (Figure 1).
L’accouplement des cellules de levure comprend plusieurs étapes, telles que l’agglutination, la formation d’une projection d’accouplement ou « shmoo », suivie de la fusion cellulaire et nucléaire 4,5. Les deux types d’accouplement a et α produisent respectivement un facteur a et un facteur α pour initier l’accouplement. Ces facteurs sont des phéromones polypeptidiques qui se lient aux récepteurs (Ste2 et Ste3) présents à la surface cellulaire de l’accouplement opposé de type5. La liaison des phéromones aux récepteurs initie la voie de réponse des phéromones, la voie de transduction du signalde la protéine kinase activée par les mitogènes (MAPK) 6,7,8. Il en résulte l’arrêt du cycle cellulaire dans la phase G1, conduisant à une phase stationnairemétaboliquement active 9. Les cellules cessent alors de se diviser mitotiquement, et les protéines nécessaires à l’accouplement sont synthétisées. Comme les cellules haploïdes ne peuvent pas se déplacer les unes vers les autres, une projection d’accouplement ou « shmoo » est dirigée vers le partenaire d’accouplement. Lorsque les cellules entrent en contact, la paroi cellulaire est dégradée et le contenu cytoplasmique fusionne, ce qui entraîne l’accouplement pour former une cellule diploïde10,11. L’efficacité d’accouplement entre haploïdes a été utilisée comme mesure de la spéciation dans les souches développées en laboratoire, ainsi qu’entre les espèces existantes12.
Étant un organisme eucaryote simple, la levure est le modèle de choix pour un grand nombre de questions de recherche associées aux organismes eucaryotes complexes. L’une de ces questions est associée à la spéciation et à l’évolution des barrières de reproduction13,14. Pour les organismes à reproduction sexuée, une espèce est définie par le concept d’espèce biologique (BSC) proposé par Ernst Mayr15. Selon ce concept, deux individus d’une population sont dits appartenir à deux espèces différentes s’ils ne peuvent pas se croiser et sont isolés sur le plan de la reproduction. La rupture du cycle de reproduction sexuée (qui implique la fusion des gamètes pour former un zygote, le développement du zygote en une progéniture et l’atteinte de la maturité sexuelle dans la progéniture) conduit à l’isolement reproductif. Comme le montre la figure 1, le cycle de vie de S. cerevisiae est comparable au cycle de reproduction sexuée : a) la fusion des deux types d’accouplement a et α est similaire à la fusion des gamètes dans les organismes à reproduction sexuée; b) la capacité du diploïde à subir une division mitotique équivaut au développement du zygote en descendance; et c) le diploïde subissant une sporulation est comparable au processus de gamétogenèse14.
L’isolement pré-zygotique se produit lorsque l’accouplement assortatif est observé. Avec une chance égale de s’accoupler avec deux types A génétiquement différents, un type α s’accouple préférentiellement avec l’un plutôt qu’avec l’autre ou vice versa14. Dans le cas d’expériences d’évolution dans lesquelles les haploïdes ont évolué dans différents environnements, la présence d’une barrière de pré-accouplement peut être déterminée en effectuant un test d’accouplement. Une diminution de l’efficacité de l’accouplement par rapport à l’ancêtre indique l’évolution d’une barrière pré-accouplement. L’isolement post-zygotique peut survenir en raison de l’incapacité du diploïde à subir une division mitotique efficace et/ou une sporulation pour former des spores haploïdes14. Ceux-ci peuvent être quantifiés en mesurant le taux de croissance des diploïdes et en calculant l’efficacité de la sporulation, respectivement. Par conséquent, pour étudier l’évolution des barrières de reproduction, des méthodes robustes pour quantifier (a) l’efficacité de l’accouplement, (b) la croissance mitotique du diploïde et (c) l’efficacité de sporulation du diploïde sont nécessaires. Dans ce travail, une méthode robuste pour quantifier l’efficacité d’accouplement des souches de levure est rapportée.
Dans les expériences de laboratoire, l’un des moyens de détecter l’accouplement consiste à utiliser des marqueurs auxotrophes qui complètent les besoins nutritionnels. Lorsque les deux types d’accouplement sont auxotrophes pour deux acides aminés différents, seule la cellule diploïde formée par la fusion des deux types d’accouplement peut se développer sur un milieu déficient en deux acides aminés. Ainsi, les marqueurs auxotrophes sont utiles pour détecter l’accouplement à la fois qualitativement et quantitativement. Un test qualitatif suffira pour identifier le type d’accouplement d’une souche après la méiose16. Les tests quantitatifs sont essentiels lorsque l’on s’intéresse à l’identification d’une réduction de l’accouplement tout en étudiant les gènes impliqués dans la voie d’accouplement17,18. En outre, la levure étant de plus en plus utilisée dans les études de spéciation, un essai d’accouplement pratique et reproductible est nécessaire, car la quantification de l’efficacité de l’accouplement est une mesure de la barrière pré-zygotique.
L’efficacité d’accouplement entre les deux types d’accouplement de levure a été quantifiée précédemment16,19,20. La plupart des méthodes utilisées précédemment sont similaires dans leur conception avec quelques variations 16,21,22,23,24,25. Certains d’entre eux utilisent des cultures en phase logarithmique précoce, tandis que quelques autres utilisent des cultures en phase logarithmique de souches haploïdes. Il existe des variations dans les rapports dans lesquels les deux types d’accouplement sont mélangés. Presque tous les protocoles utilisent une membrane de nitrocellulose. Les suspensions des deux types d’accouplement prélevées sur des cultures antérieures sont mélangées et filtrées sur une membrane de nitrocellulose placée sur une plaque YPD. Dans l’une des variantes du protocole, la suspension haploïde est directement rapiécée sur une plaque YPD21. Dans les expériences portant sur les gènes impliqués dans la production de phéromones des deux types d’accouplement, les phéromones sont ajoutées à l’extérieur tout en rendant les suspensions des deux types d’accouplement24.
Après une incubation de quelques heures (généralement environ 5 h) après le mélange des haploïdes, les cellules sont lavées de la membrane, diluées et plaquées sur des milieux sélectifs. Dans l’une des méthodes antérieures rapportées en 1973, l’efficacité de la formation ou de l’accouplement de zygotes a été calculée en comptant le nombre de cellules bourgeonnées, de cellules non bourgeonnées et de paires d’accouplement au microscope à l’aide d’un hémocytomètre26. Cependant, la plupart des méthodes rapportées plus tard utilisent des marqueurs auxotrophes pour distinguer les haploïdes et les diploïdes. L’efficacité d’accouplement est calculée comme le pourcentage de cellules diploïdes par rapport au nombre de cellules diploïdes et haploïdes dans le pool cellulaire 16,21,23.
Cependant, malgré un certain nombre de rapports utilisant la levure comme organisme modèle pour étudier la spéciation, il n’existe pas de protocole normalisé rapporté dans la littérature jusqu’à présent pour calculer l’efficacité de l’accouplement. Les cellules en phase logarithmique peuvent ne pas être idéales pour la quantification de l’efficacité de l’accouplement. Pendant l’accouplement, le cycle cellulaire des deux haploïdes est arrêté et, par conséquent, les cellules pendant l’accouplement ne se divisent pas9. Comme le cycle cellulaire est également connu pour être arrêté de la même manière dans les cellules dans la phase stationnaire27, l’utilisation de telles cellules peut rendre le protocole plus reproductible. Les cellules en phase stationnaire peuvent être mélangées et disposées sur des plaques YPD (c.-à-d. un environnement riche sur le plan nutritionnel) pour l’accouplement. Les procédures conventionnelles nécessitent également une membrane de nitrocellulose et le lavage des cellules, ce qui rend le processus lourd et susceptible d’entraîner des erreurs de manipulation. De plus, les protocoles utilisés à ce jour quantifient l’efficacité de l’accouplement en termes d’un haploïde. Cependant, lors de la mesure de l’isolement reproductif, l’efficacité de l’accouplement est quantifiée pour une combinaison particulière d’haploïdes plutôt que pour un seul haploïde.
Pour résoudre ces problèmes, nous rapportons ici une méthode robuste pour la quantification de l’efficacité d’accouplement chez la levure qui est hautement reproductible et facile à utiliser. De plus, cette méthode et les souches de levure employées ici peuvent également être utilisées dans des études examinant l’effet du flux génétique sur l’évolution des barrières d’accouplement.
Deux souches différentes de S. cerevisiae ont été utilisées dans cette étude. L’une des souches est dérivée du fond SK1; cela a été modifié dans notre laboratoire en ajoutant les marqueurs auxotrophes près du locus MAT. Les génotypes résultants des haploïdes sont fournis dans le tableau 128,29,30. Dans la souche SK1, le gène TRP1 a été inséré près du locus MAT et l’haploïde α a inséré le gène LEU2 près du locus MAT. Dans la souche ScAM, les gènes TRP1 et URA3 ont été insérés dans les haploïdes a et α, respectivement. L’emplacement de l’insertion était dans la région ARS du chromosome III (Chr III: 197378..197609). Pour le protocole rapporté ici, des marqueurs auxotrophes n’importe où sur le génome suffiraient. Cependant, le fait d’avoir les marqueurs auxotrophes près du locus MAT signifie que ces souches peuvent également être utilisées pour des études examinant l’effet du flux génétique sur la spéciation31,32. Les marqueurs ont été ajoutés près du locus MAT pour empêcher le remaniement des marqueurs dû à la recombinaison. Par conséquent, ce protocole peut être utilisé pour quantifier l’efficacité de l’accouplement dans les études impliquant la spéciation et également pour identifier l’altération de l’efficacité de l’accouplement lors de l’étude des protéines impliquées dans la voie d’accouplement.
Protocole
NOTE: Le protocole comprend globalement les étapes suivantes: (1) patcher les haploïdes dans les grilles d’efficacité d’accouplement sur une plaque YPD, (2) mélanger les haploïdes en nombre égal après 24 heures d’incubation et donner aux haploïdes mixtes quelques heures pour s’accoupler (7 h dans cette étude), (3) placage des cellules mélangées sur YPD pour isoler les colonies individuelles après 7 h à 30 ° C, et enfin, (4) déterminer le nombre de diploïdes formés à l’aide des marqueurs auxotrophes. Ces étapes sont décrites en détail ci-dessous (voir également la figure 2).
1. Patching des haploïdes dans les grilles d’efficacité d’accouplement
- Faire revivre les haploïdes a et α des stocks congélateurs en les striant sur une plaque de gélose YPD (2 % d’agar, 2 % de dextrose, 1 % de peptone, 0,5 % d’extrait de levure), et laissez-les pousser pendant 48 h à 30 °C pour obtenir des colonies isolées.
- Inoculer les colonies individuelles de la plaque YPD dans 5 mL de milieu YPD (2 % de dextrose, 1 % de peptone, 0,5 % d’extrait de levure) et incuber à 30 °C pendant 48 h en agitant 250 rpm. Les cellules sont dans la phase stationnaire de croissance après cette période d’incubation.
- Dessinez une grille d’efficacité d’accouplement sur une nouvelle assiette YPD. Dessinez la grille sous la forme d’un rectangle de 1 cm x 1,5 cm divisé en trois cases de telle sorte que chacune ait une dimension de 1 cm x 0,5 cm, comme illustré à la figure 2A.
- Patch 5 μL de la culture YPD des deux types d’accouplement sur les rectangles les plus à gauche et à droite (figure 2B). Ce volume correspond à environ 5 x 105 cellules haploïdes disposées dans chaque section. Incuber les plaques pendant 24 h à 30 °C.
REMARQUE: Le but de la grille est de rendre les mesures expérimentales précises (telles que le nombre de cellules dans l’expérience). La taille de la grille est suffisamment petite pour qu’elle soit expérimentalement traitable, mais suffisamment grande pour pouvoir être facilement manipulée (comme soulever des cellules d’une grille) et ne pas être sensible à la dérive ou aux événements fortuits.
2. Mélange des haploïdes et accouplement
NOTE: Après 24 h (Figure 2C), un nombre égal de cellules des deux types haploïdes sont grattées des deux grilles, mélangées et posées dans le rectangle central (Figure 2D).
- Afin de mélanger un nombre égal de cellules, retirer environ 1/3 du timbre qui a été déposé dans les boîtes extérieures à l’aide d’un cure-dent stérile et remettre en suspension dans 20 μL d’eau dans un flacon stérile de 1,5 mL pour chacun des haploïdes.
- Diluer 5 μL de cette suspension dans 2 mL d’eau. Mesurer la DO de cette suspension diluée à l’aide d’un spectrophotomètre à 600 nm. Mélanger un nombre égal de cellules des deux souches, en fonction de la valeur de DO et du nombre de cellules/ml dans 1 DO pour cette souche particulière. Calculez le volume à mélanger et aspirez-le à partir des 15 μL restants de la suspension haploïde individuelle.
Remarque : Le nombre de cellules patchées dans le rectangle central est tel que les cellules forment une monocouche. En considérant la cellule de levure comme une sphère d’un rayon de 2,58 μm33, une boîte rectangulaire de 1 cm x 0,5 cm aurait besoin d’environ 1,7 x 106 cellules pour former une monocouche. Il faut veiller à ce qu’il n’y ait pas de contact physique entre les cellules patchées pour l’accouplement et les deux grilles cellulaires haploïdes. Étant donné qu’un nombre égal de chaque type de cellules haploïdes doit être mélangé, 8,5 x 105 cellules sont ajoutées de chaque souche. Le nombre de cellules est calculé sur la base des mesures de XO, considérant que 1 DO à 600 nm équivaut approximativement à 1 x 107 cellules34. Par exemple, si le OD600 de la suspension haploïde est de 0,17 et celui de l’haploïde α est de 0,11, le nombre de cellules dans 5 μL de chaque suspension haploïde peut être calculé. Pour assurer 8,5 x 105 cellules de chaque type d’haploïde, 1,25 μL de l’haploïde a et 1,93 μL des suspensions haploïdes α sont mélangés. - Ajouter les volumes requis des deux haploïdes dans un flacon frais et stérile de 1,5 mL et bien mélanger à l’aide d’une pipette. Le volume final de cette suspension est généralement d’environ 6 à 8 μL. Patchez cette suspension dans la grille centrale. Incuber la plaque à 30 °C pendant 7 h, en laissant aux haploïdes suffisamment de temps pour s’accoupler (Figure 2E).
3. Placage de cellules mixtes sur gélose YPD
- Après la période d’incubation de 7 h, gratter les cellules du rectangle central à l’aide d’un cure-dent ou d’un embout de pipette et diluer dans 2 mL d’eau stérile. Ensuite, étaler la suspension cellulaire sur gélose YPD pour obtenir des colonies uniques. Pour déterminer le facteur de dilution nécessaire pour obtenir des colonies individuelles, mesurer la DO du premier tube dans lequel les cellules raclées sont ajoutées. Des facteurs de dilution spécifiques doivent être déterminés pour chaque type de cellule/souche utilisée.
REMARQUE : Par exemple, un OD600 de 0,15 correspond à 3 x 106 cellules dans une suspension de 2 mL (en considérant 1 DO = 1 x 107 cellules/mL). Pour obtenir quelques centaines de colonies sur la plaque YPD, la suspension cellulaire est diluée en série à 1:20 deux fois, puis 100 μL de la dilution finale sont utilisés pour l’épandage. - Après le placage, incuber les plaques YPD à 30 °C pendant 36–48 h jusqu’à ce qu’il y ait des colonies uniques. S’assurer que quelques centaines de colonies individuelles sont obtenues à partir de chaque expérience d’accouplement pour le dépistage afin de s’assurer que la signification statistique peut être détectée dans les données (Figure 2F).
4. Dépistage des diploïdes à l’aide de marqueurs auxotrophes
- Déterminer quelle fraction des colonies obtenues est diploïde. Pour identifier les colonies diploïdes sur la plaque, transférer les colonies simples en les striant individuellement sur une plaque à double goutte (2% de glucose, 0,66% d’azote base, 0,05% de mélange d’acides aminés double goutte et 2% d’agar) dépourvues des acides aminés pour lesquels les souches sont auxotrophes, comme le montre la figure 2G. Incuber les plaques à 30 °C pendant 48 h.
REMARQUE: Les colonies peuvent également être transférées sur la plaque à double goutte à l’aide d’un placage de réplique. Dans cette étude, le milieu de chute du tryptophane et de la leucine (trp− leu−) a été utilisé pour quantifier l’efficacité d’accouplement des souches SK1AM, et le milieu de chute du tryptophane et de l’uracile (trp− ura−) a été utilisé pour les souches ScAM. Seules les colonies diploïdes se développent sur la plaque de double goutte car elles ont à la fois les marqueurs auxotrophes: gènes TRP1 et LEU2 dans les souches SK1AM et gènes TRP1 et URA3 dans les souches ScAM. - De plus, strier ou répliquer les colonies sur un seul milieu de goutte (trp− ou leu− ou ura−) pour quantifier la fréquence de chacun des deux types d’haploïdes dans la population.
- Calculez l’efficacité d’accouplement, η, comme suit:
 Égaliseur (1)
Égaliseur (1)
où le nombre d’haploïdes accouplés est simplement égal à deux fois le nombre de diploïdes identifiés sur la plaque de double décrochage (puisque chaque diploïde résulte de l’accouplement de deux haploïdes). Le nombre total d’haploïdes est égal à la somme du nombre d’haploïdes striés plus deux fois le nombre de diploïdes striés.
REMARQUE : Par exemple, si seulement 60 colonies se développent après avoir strié ou plaqué 100 colonies sur un milieu à double goutte, l’efficacité d’accouplement peut être quantifiée à 75 % (60 haploïdes x 2 se sont accouplés pour former les 60 diploïdes et 40 haploïdes ne se sont pas accouplés).
Résultats
Quantification de l’efficacité d’accouplement des deux types d’accouplement
Le protocole décrit ici a été utilisé pour quantifier l’efficacité d’accouplement entre deux souches de levure - entre SK1AM a et SK1AM α et entre ScAMa et ScAM α (Figure 3A). Dans ces expériences, l’accouplement entre les deux haploïdes a été répété au moins 12 fois. Dans chacune des répétitions de l’expérience, au moins 100 colonies ont été striées sur des milieux à double goutte. La robustesse du protocole a permis de différencier facilement l’efficacité d’accouplement entre les deux souches, SK1AM et ScAM. Alors que les souches SK1 se sont accouplées avec un rendement très élevé, les déformations ScAM se sont accouplées avec une efficacité relativement inférieure (figure 3A). Ce n’est peut-être pas surprenant, car les souches ScAM proviennent de l’accouplement hybride entre les souches35 de S. cerevisiae et de S. carlsbergensis.
En plus de distinguer l’efficacité d’accouplement entre les déformations, cette méthode peut également être utilisée pour quantifier les différences dans l’efficacité d’accouplement des souches dans différents environnements. Comme le montre la figure 3B, l’efficacité d’accouplement des souches ScAM a chuté de manière significative lorsque l’environnement ne contenait pas de glucose comme source primaire de carbone. L’accouplement est un processus coûteux sur le plan énergétique, et la croissance sur d’autres sources de carbone réduit qualitativement l’efficacité de l’accouplement.
Dynamique de l’efficacité de l’accouplement
La répétabilité élevée de la méthode permet également de suivre la dynamique de l’efficacité de l’accouplement. Lorsqu’on a laissé s’accoupler pendant différentes périodes (figure 3C), aucun accouplement n’a été observé pendant les 4-5 premières heures; Les premiers diploïdes ne sont apparus qu’après cette durée. Vraisemblablement, c’est le temps nécessaire pour que le processus d’accouplement soit terminé dans l’environnement donné. Par la suite, l’efficacité de l’accouplement a augmenté rapidement. Cependant, au-delà de 7 h, les calculs d’efficacité d’accouplement sont influencés par le fait que la croissance mitotique commence à se produire dans la plaque. L’identification et la sélection de diploïdes précoces ou tardifs de cette manière peuvent permettre la conception d’expériences visant à faire évoluer l’accouplement rapide ou retardé entre haploïdes. Le moment précis auquel l’efficacité d’accouplement culmine est variable pour chaque déformation. Par exemple, en utilisant la cinétique de croissance, nous avons déterminé expérimentalement que la souche ScAM présente un taux de croissance inférieur à celui des autres souches de S. cerevisiae (comme SK1), ce qui influence probablement aussi la dynamique de l’accouplement.

Figure 1 : Cycle de vie de Saccharomyces cerevisiae. S. cerevisiae a deux types d’accouplement, a et α, et présente des phases de reproduction asexuée et sexuée. Les deux types d’accouplement, en l’absence de l’autre, se divisent mitotiquement. Cependant, lorsqu’ils sont présents à proximité l’un de l’autre, ils cessent de se diviser mitotiquement, et le contenu cellulaire et nucléaire fusionne pour former un diploïde. La cellule diploïde peut se diviser davantage mitotiquement. Cependant, en présence de conditions défavorables (famine), il subit une méiose pour produire des spores contenant quatre haploïdes. Ces spores germent dans des conditions favorables pour libérer deux haploïdes de chaque espèce, complétant ainsi le cycle de vie. L’efficacité avec laquelle les deux haploïdes a et α s’accouplent est appelée efficacité d’accouplement. Toute diminution de cette efficacité d’accouplement indique une barrière pré-zygotique à l’accouplement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
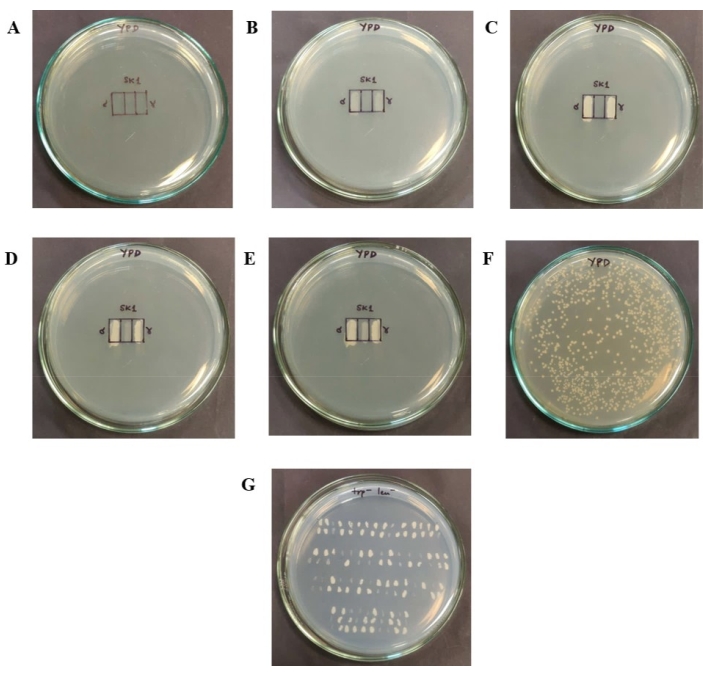
Figure 2 : Étapes impliquées dans le test d’efficacité de l’accouplement. (A) Une grille d’efficacité d’accouplement de 1 cm x 1,5 cm, qui est ensuite divisée en boîtes de 1 cm x 0,5 cm chacune, est dessinée sur une plaque YPD. (B) Les cellules haploïdes sont patchées sur les boîtes extrêmes. (C) La croissance des cellules haploïdes après 24 h à 30 °C. (D) Un tiers des patchs haploïdes sont enlevés à l’aide d’un cure-dent, mélangés en nombre égal de cellules (sur la base de OD600) et rapiécés dans la grille centrale. E) La croissance des cellules rapiécées dans la grille centrale après 7 h à 30 °C. Celui-ci contient les nouveaux diploïdes formés et les haploïdes qui ne se sont pas accouplés. (F) Colonies isolées isolées obtenues sur une plaque YPD après dilution et placage des cellules grattées de la grille centrale. Cette plaque a été incubée à 30 °C pendant 36-48 h. (G) Pour identifier le nombre de diploïdes présents sur la plaque YPD, les colonies sont transférées dans une plaque à double goutte dépourvue de tryptophane et de leucine. Seuls les diploïdes peuvent se développer sur cette plaque. Veuillez cliquer ici pour voir une version agrandie de cette figure.
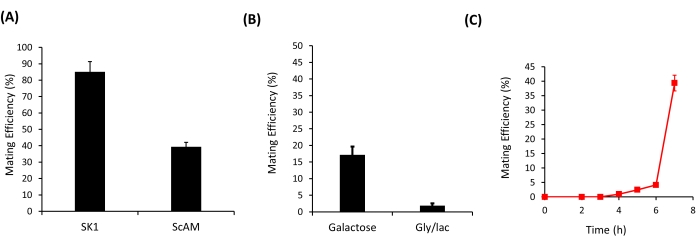
Figure 3 : Efficacité d’accouplement des souches de levure. (A) L’efficacité d’accouplement des deux haploïdes a et α des souches SK1 et ScAM sur une plaque YPD. (B) L’efficacité d’accouplement des deux haploïdes a et α de la souche ScAM sur des plaques YP contenant 2 % de galactose et sur des plaques de glycérol/lactate. (C) La dynamique de l’accouplement dans la souche ScAM dans un environnement de glucose. Les résultats sont présentés sous forme de moyenne ± écart-type de 12 répétitions indépendantes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Souches | Génotype | Commentaire | Référence |
| SK1AMa | ars314::TRP1, MATa, ho::LYS2, lys2, ura3, leu2::hisG, his3::hisG, trp1::hisG | Cette souche a le gène TRP1 et peut donc se développer en l’absence de tryptophane dans les milieux. | |
| SK1AMα | ars314::LEU2, MATalpha, ho::LYS2, lys2, ura3, leu2::hisG, his3::hisG, trp1::hisG | Cette souche possède le gène LEU2 et peut donc se développer en l’absence de leucine dans les milieux. | |
| Arnaquea | ars314::TRP1, MATa, ho, MEL1, ade1, ile, trp1-HIII ura3‐52 | Cette souche a le gène TRP1 et peut donc se développer en l’absence de tryptophane dans les milieux. | Dérivé de ScPJB644a dans la référence 28 |
| Escroquerieα | ars314::URA3, MATalpha, ho, MEL1, ade1, ile, trp1-HIII, ura3‐52 | Cette souche possède le gène URA3 et peut donc se développer en l’absence d’uracile dans le milieu. | Dérivé de ScPJB644α dans la référence 28 |
Tableau 1 : Génotypes des souches de S. cerevisiae utilisées dans cette étude.
Discussion
La quantification de l’efficacité de l’accouplement chez S. cerevisiae est essentielle pour réaliser des études liées aux gènes impliqués dans les voies d’accouplement ou étudier l’influence de l’environnement externe sur le comportement d’accouplement. Au cours des deux dernières décennies, S. cerevisiae est également devenu un modèle populaire pour répondre aux questions liées à la spéciation 14,36,37,38. La présence de deux types d’accouplement et la facilité de manipulation génétique et de maintenance dans les environnements de laboratoire en ont fait un organisme approprié pour étudier l’évolution des barrières de reproduction en temps réel. La quantification de l’efficacité de l’accouplement est essentielle car elle donne une mesure de la barrière de reproduction pré-zygotique. Par conséquent, un protocole pratique avec une reproductibilité élevée est nécessaire.
En utilisant le protocole ci-dessus, l’efficacité d’accouplement de deux souches différentes qui présentent un comportement d’accouplement complètement différent a été quantifiée. Par conséquent, le protocole peut être appliqué à n’importe quelle souche, car la plupart des souches de levure de laboratoire portent des auxotrophies qui peuvent être utilisées pour la sélection39. Cependant, il y a quelques considérations importantes lors de l’utilisation de ce protocole. Le temps nécessaire pour que les cultures initiales de la DPJ atteignent la phase stationnaire dépend de la déformation. Une souche à croissance lente peut nécessiter plus de 48 heures d’incubation à 30 °C. Le volume d’haploïdes à mélanger est calculé sur la base des mesures de DO dans un spectrophotomètre. La valeur rapportée dans la littérature est de l’ordre de 107 cellules/mL pour 1 DO34; cependant, il est préférable de caractériser cette valeur pour une souche particulière à l’aide d’un graphique de DO en fonction du nombre de cellules. Le volume requis pour assurer le mélange d’un nombre égal de cellules peut être calculé en fonction de la valeur de la DO et du nombre de cellules/ml dans 1 OD, qui sont obtenus à partir de la caractérisation de la souche. Il faut s’assurer que les cellules patchées dans la grille centrale après avoir mélangé les haploïdes forment grossièrement une monocouche qui n’est pas très épaisse. Il faut également s’assurer que le volume à mélanger est d’environ 6-8 μL. Un volume plus élevé peut entraîner un chevauchement avec les taches haploïdes qui se trouvent de chaque côté de la grille centrale.
Cette méthode peut également être utilisée pour étudier les barrières de reproduction pré-zygotes entre les isolats écologiques de levure. Cependant, dans de tels cas, le gène de l’endonucléase HO doit d’abord être retiré du génome de l’organisme, car les souches porteuses de l’endonucléase HO forment automatiquement des diploïdes en raison de son activité de commutation de type accouplement40. Les haploïdes isolés du diploïde sporulé peuvent être identifiés comme un ou α en identifiant la séquence présente au locus MAT à l’aide des amorces spécifiques mentionnées précédemment41. Le marqueur HO peut être remplacé par deux gènes de résistance aux antibiotiques différents comme marqueurs permettant de distinguer les deux types d’accouplement haploïde. Ce détail dépend de la construction de la souche utilisée dans l’étude particulière.
L’une des limites de cette méthode est que l’utilisation de marqueurs auxotrophes nécessite le transfert des colonies de la plaque YPD aux plaques de tombante. L’utilisation de marqueurs de fluorescence pour distinguer les cellules haploïdes des cellules diploïdes peut aider à réduire le temps expérimental. Cependant, l’utilisation de marqueurs de fluorescence peut affecter la dynamique de croissance des cellules car il y a un coût supplémentaire impliqué dans la production des protéines fluorescentes, qui, ainsi, peuvent modifier l’état métabolique et physiologique d’une cellule42. Alternativement, les marqueurs auxotrophes pour identifier les deux haploïdes peuvent être remplacés par des marqueurs antibiotiques.
Certaines des méthodes précédentes utilisées pour la caractérisation de l’efficacité de l’accouplement rapportent l’utilisation d’un excès de l’un des types d’accouplement dans un rapport de 10:1 16,21,24. Par expérience, l’utilisation d’un rapport biaisé des deux haploïdes entraîne une croissance mitotique de l’haploïde en excès. Par conséquent, la méthode actuelle utilise un mélange 1:1 des deux haploïdes.
Étant donné que les marqueurs auxotrophes dans les souches utilisées dans cette étude sont insérés près du locus MAT , la recombinaison pendant la méiose ne rompt pas l’association entre le marqueur auxotrophe et le type d’accouplement. En conséquence, l’auxotrophie et le type d’accouplement d’un haploïde particulier ne changent pas même si les souches sont autorisées à subir une méiose. Cela permet de répondre à des questions liées à l’impact du flux génétique en tant que variable sur l’adaptation et la spéciation43. Ainsi, dans l’ensemble, ce protocole présente une méthode simple et robuste pour quantifier l’efficacité de l’accouplement entre différentes souches de levure.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrents dans ce travail. Les auteurs sont heureux de partager les souches dérivées de SK1 pour toute utilisation à but non lucratif.
Remerciements
Ce travail a été financé par une subvention DBT/Wellcome Trust (India Alliance) (IA/S/19/2/504632) à S.S. P.N. est un chercheur soutenu par une subvention DBT/Wellcome Trust (India Alliance) (IA/S/19/2/504632). A.M. est soutenu par le Conseil de la recherche scientifique et industrielle (CSIR), gouvernement de l’Inde, en tant que chercheur principal (09/087(0873)/2017-EMR-I). Les auteurs remercient Paike Jayadeva Bhat pour les discussions.
matériels
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma Life Science | A8626 | |
| Agar Powder regular grade for bacteriology | SRL | 19661 (0140186) | |
| Ammonium Sulphate, Hi-AR | HiMedia | GRM1273 | |
| D-(+)-glucose | Sigma Life Science | G8270 | |
| Glass Petri plates | HiMedia | PW008 | 90 mm x 15 mm dimension |
| L-Arginine | Sigma Life Science | A8094 | |
| L-Aspartic acid | Sigma Life Science | A7219 | |
| L-Histidine monochloride monohydrate | Sigma Life Science | H5659 | |
| L-Isoleucine | Sigma Aldrich | I2752 | |
| L-Leucine | Sigma Life Science | L8912 | |
| L-Lysine | Aldrich | 62840 | |
| L-Methionine | Sigma Life Science | M5308 | |
| L-Phenylalanine | Sigma Life Science | P5482 | |
| L-Threonine | Sigma Aldrich | T8625 | |
| L-Tyrosine | Sigma Life Science | T8566 | |
| L-Valine | Sigma Life Science | V0513 | |
| Mating efficiency grid | 1 cm x 1.5 cm rectangular grid drawn on the Petri plate | ||
| Microcentrifuge tubes | Tarsons | 500010 | |
| Peptone | HiMedia | RM001 | |
| Uracil | Sigma Life Science | U0750 | |
| Yeast Extract Powder | HiMedia | RM027 | |
| Yeast Nitrogen Base w/o Amino acids and Ammonium Sulphate | BD Difco | 233520 |
Références
- Neiman, A. M. Sporulation in the budding yeast Saccharomyces cerevisiae. Genetics. 189 (3), 737-765 (2011).
- Duina, A. A., Miller, M. E., Keeney, J. B. Budding yeast for budding geneticists: A primer on the Saccharomyces cerevisiae model system. Genetics. 197 (1), 33-48 (2014).
- Herskowitz, I. Life cycle of the budding yeast Saccharomyces cerevisiae. Microbiological Reviews. 52 (4), 536-553 (1988).
- Erdman, S., Lin, L., Malczynski, M., Snyder, M. Pheromone-regulated genes required for yeast mating differentiation. Journal of Cell Biology. 140 (3), 461-483 (1998).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: How yeast cells do it. Open Biology. 3 (3), 130008 (2013).
- Gustin, M. C., Albertyn, J., Alexander, M., Davenport, K. MAP kinase pathways in the yeast Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 62 (4), 1264-1300 (1998).
- Bardwell, L. A walk-through of the yeast mating pheromone response pathway. Peptides. 26 (2), 339-350 (2005).
- Reid, B. J., Hartwell, L. H. Regulation of mating in the cell cycle of Saccharomyces cerevisiae. Journal of Cell Biology. 75, 355-365 (1977).
- Williams, T. C., Peng, B., Vickers, C. E., Nielsen, L. K. The Saccharomyces cerevisiae pheromone-response is a metabolically active stationary phase for bio-production. Metabolic Engineering Communications. 3, 142-152 (2016).
- Bagnat, M., Simons, K. Cell surface polarization during yeast mating. Proceedings of the National Academy of Sciences of the United States of America. 99 (22), 14183-14188 (2002).
- Trueheart, J., Boeke, J. D., Fink, G. R. Two genes required for cell fusion during yeast conjugation: Evidence for a pheromone-induced surface protein. Molecular and Cellular Biology. 7 (7), 2316-2328 (1987).
- Sniegowski, P. D., Dombrowski, P. G., Fingerman, E. Saccharomyces cerevisiae and Saccharomyces paradoxus coexist in a natural woodland site in North America and display different levels of reproductive isolation from European conspecifics. FEMS Yeast Research. 1 (4), 299-306 (2002).
- Replansky, T., Koufopanou, V., Greig, D., Bell, G. Saccharomyces sensu stricto as a model system for evolution and ecology. Trends in Ecology and Evolution. 23 (9), 494-501 (2008).
- Greig, D. Reproductive isolation in Saccharomyces. Heredity. 102 (1), 39-44 (2009).
- Mayr, E. . Systematics and the Origin of Species, from the Viewpoint of a Zoologist. , (1999).
- Sprague, G. F. Assay of yeast mating reaction. Methods in Enzymology. 194, 77-93 (1991).
- McCaffrey, G., Clay, F. J., Kelsay, K., Sprague, G. F. Identification and regulation of a gene required for cell fusion during mating of the yeast Saccharomyces cerevisiae. Molecular and Cellular Biology. 7 (8), 2680-2690 (1987).
- Valtz, N., Peter, M., Herskowitz, I. FAR1 is required for oriented polarization of yeast cells in response to mating pheromones. Journal of Cell Biology. 131 (4), 863-873 (1995).
- Maclean, C. J., Greig, D. Prezygotic reproductive isolation between Saccharomyces cerevisiae and Saccharomyces paradoxus. BMC Evolutionary Biology. 8, 1 (2008).
- Murphy, H. A., Kuehne, H. A., Francis, C. A., Sniegowski, P. D. Mate choice assays and mating propensity differences in natural yeast populations. Biology Letters. 2 (4), 553-556 (2006).
- Leu, J. Y., Murray, A. W. Experimental evolution of mating discrimination in budding yeast. Current Biology. 16 (3), 280-286 (2006).
- Kim, J., Hirsch, J. P. A nucleolar protein that affects mating efficiency in Saccharomyces cerevisiae by altering the morphological response to pheromone. Genetics. 149 (2), 795-805 (1998).
- Jin, M., et al. Yeast dynamically modify their environment to achieve better mating efficiency. Science Signaling. 4 (186), (2011).
- Rogers, D. W., Denton, J. A., McConnell, E., Greig, D. Experimental evolution of species recognition. Current Biology. 25 (13), 1753-1758 (2015).
- McClure, A. W., Jacobs, K. C., Zyla, T. R., Lew, D. J. Mating in wild yeast: Delayed interest in sex after spore germination. Molecular Biology of the Cell. 29 (26), 3119-3127 (2018).
- Sena, E. P., Radin, D. N., Fogel, S. Synchronous mating in yeast. Proceedings of the National Academy of Sciences of the United States of America. 70 (5), 1373-1377 (1973).
- Werner-Washburne, M., Braun, E., Johnston, G. C., Singer, R. A. Stationary phase in the yeast Saccharomyces cerevisiae. Microbiology Reviews. 57 (2), 383-401 (1993).
- Johnston, S. A., Hopper, J. E. Isolation of the yeast regulatory gene GAL4 and analysis of its dosage effects on the galactose/melibiose regulon. Proceedings of the National Academy of Sciences of the United States of America. 79 (22), 6971-6975 (1982).
- Mahilkar, A. . Study of metabolic specialization leading to speciation, using yeast as a model system. , (2021).
- Blank, T. E., Woods, M. P., Lebo, C. M., Xin, P., Hopper, J. E. Novel Gal3 proteins showing altered Gal80p binding cause constitutive transcription of Gal4p-activated genes in Saccharomyces cerevisiae. Molecular and Cellular Biology. 17 (5), 2566-2575 (1997).
- Rice, W. R., Hostert, E. E. Laboratory experiments on speciation: What have we learned in 40 years. Evolution. 47 (6), 1637-1653 (1993).
- White, N. J., Snook, R. R., Eyres, I. The past and future of experimental speciation. Trends in Ecology and Evolution. 35 (1), 10-21 (2020).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--The database of key numbers in molecular and cell biology. Nucleic Acids Research. 38, 750-753 (2010).
- Domitrovic, T., et al. Structural and functional study of YER067W, a new protein involved in yeast metabolism control and drug resistance. PLoS One. 5 (6), 11163 (2010).
- Lindegren, C. C., Spiegelman, S., Lindegren, G. Mendelian inheritance of adaptive enzymes. Proceedings of the National Academy of Sciences of the United States of America. 30 (11), 346-352 (1944).
- Dettman, J. R., Sirjusingh, C., Kohn, L. M., Anderson, J. B. Incipient speciation by divergent adaptation and antagonistic epistasis in yeast. Nature. 447 (7144), 585-588 (2007).
- Jhuang, H. Y., Lee, H. Y., Leu, J. Y. Mitochondrial-nuclear co-evolution leads to hybrid incompatibility through pentatricopeptide repeat proteins. EMBO Reports. 18 (1), 87-101 (2017).
- Lee, H. Y., et al. Incompatibility of nuclear and mitochondrial genomes causes hybrid sterility between two yeast species. Cell. 135 (6), 1065-1073 (2008).
- Pronk, J. T. Auxotrophic yeast strains in fundamental and applied research. Applied and Environmental Microbiology. 68 (5), 2095-2100 (2002).
- Madhani, H. D. . From a to α: Yeast as a Model for Cellular Differentiation. , (2007).
- Huxley, C., Green, E. D., Dunham, I. Rapid assessment of S. cerevisiae mating type by PCR. Trends in Genetics. 6 (8), 236 (1990).
- Rang, C., Galen, J. E., Kaper, J. B., Chao, L. Fitness cost of the green fluorescent protein in gastrointestinal bacteria. Canadian Journal of Microbiology. 49 (9), 531-537 (2003).
- Tusso, S., Nieuwenhuis, B. P. S., Weissensteiner, B., Immler, S., Wolf, J. B. W. Experimental evolution of adaptive divergence under varying degrees of gene flow. Nature Ecology and Evolution. 5 (3), 338-349 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon