Method Article
تحديد كفاءة التزاوج من أحادي الصيغة الصبغية في Saccharomyces cerevisiae
In This Article
Summary
في هذا العمل ، تم وصف طريقة قوية لقياس كفاءة التزاوج في الخميرة Saccharomyces cerevisiae . هذه الطريقة مفيدة بشكل خاص للقياس الكمي للحواجز ما قبل الزيجوت في دراسات الانتواع.
Abstract
Saccharomyces cerevisiae هو كائن نموذجي يستخدم على نطاق واسع في علم الوراثة والتطور والبيولوجيا الجزيئية. في السنوات الأخيرة ، أصبح أيضا كائنا نموذجيا شائعا لدراسة المشكلات المتعلقة بالانتواع. تتضمن دورة حياة فطر الخميرة مرحلتي التكاثر اللاجنسي والجنسي. تسمح سهولة إجراء تجارب التطور ووقت التوليد القصير للكائن الحي بدراسة تطور الحواجز التناسلية. يشار إلى الكفاءة التي يتزاوج بها نوعان من التزاوج (a و α) لتشكيل ثنائي الصيغة الصبغية a / α باسم كفاءة التزاوج. أي انخفاض في كفاءة التزاوج بين أحاديات الصيغة الصبغية يشير إلى حاجز ما قبل الزيجوت. وبالتالي ، لتحديد مدى العزلة التناسلية بين اثنين من أحادي الصيغة الصبغية ، يلزم وجود طريقة قوية لتحديد كفاءة التزاوج. تحقيقا لهذه الغاية ، يتم تقديم بروتوكول بسيط وقابل للتكرار للغاية هنا. يتضمن البروتوكول أربع خطوات رئيسية ، والتي تشمل ترقيع الصبغيات على لوحة YPD ، وخلط الأحادي الصيغة الصبغية بأعداد متساوية ، والتمييع والطلاء للمستعمرات الفردية ، وأخيرا ، حساب الكفاءة بناء على عدد المستعمرات على لوحة التسرب. يتم استخدام علامات Auxotrophic للتمييز بوضوح بين أحاديات الصيغة الصبغية وثنائيات الصبغيات.
Introduction
Saccharomyces cerevisiae ، المعروف باسم الخميرة الناشئة ، هو حقيقيات النواة وحيدة الخلية. يحتوي على نوعين من التزاوج ، A و α ، ويظهر دورات التكاثر اللاجنسي والجنسي. النوعان A و α من التزاوج أحادي الصيغة الصبغية ويمكن أن ينقسما ميتوتيا في حالة عدم وجود نوع التزاوج الآخر في البيئة المحيطة ، والذي يمثل الدورة اللاجنسية للخميرة. عندما يكون نوعا التزاوج على مقربة ، يتوقفان عن الانقسام الميتوتي ويندمجان لتكوين خلية ثنائية الصيغة الصبغية. يمكن أن تنقسم الخميرة ثنائية الصيغة الصبغية إما انقساما عند وجود العناصر الغذائية أو تخضع للانقسام الاختزالي في ظل ظروف تجويع النيتروجين في وجود مصدر كربون فقير غير قابل للتخمير ، مثل الأسيتات1. ينتج عن هذا تكوين جراثيم تظل نائمة حتى تكون هناك ظروف نمو مواتية. تكتمل دورة الحياة عندما تنبت هذه الجراثيم ويتم إطلاق النوعين الأحاديين الصيغة الصبغية مرة أخرى إلى البركة أحادية الصيغة الصبغية 2,3 (الشكل 1).
يتضمن تزاوج خلايا الخميرة عدة خطوات ، مثل التراص ، وتشكيل إسقاط التزاوج أو "shmoo" ، تليها الخلية والاندماج النووي 4,5. ينتج نوعان من التزاوج a و α عامل a وعامل α ، على التوالي ، لبدء التزاوج. هذه العوامل هي الفيرومونات عديد الببتيد التي ترتبط بالمستقبلات (Ste2 و Ste3) الموجودة على سطح الخلية من نوع التزاوج المعاكس5. يؤدي ارتباط الفيرومونات بالمستقبلات إلى بدء مسار استجابة الفرمون ، مسار نقل إشارة بروتين كيناز المنشط للميتوجين (MAPK)6،7،8. ينتج عن هذا توقف دورة الخلية في المرحلة G1 ، مما يؤدي إلى مرحلة ثابتة نشطة أيضيا9. ثم تتوقف الخلايا عن الانقسام الميتوتي ، ويتم تصنيع البروتينات اللازمة للتزاوج. وبما أن الخلايا الأحادية الصيغة الصبغية لا يمكنها التحرك بعضها نحو بعض، فإن إسقاط التزاوج أو «shmoo» موجه نحو شريك التزاوج. عندما تتلامس الخلايا ، يتحلل جدار الخلية ، وتندمج محتويات السيتوبلازم ، مما يؤدي إلى التزاوج لتشكيل خلية ثنائية الصيغة الصبغية10,11. تم استخدام كفاءة التزاوج بين الصبغيات الفردية كمقياس للانتواع في السلالات المتطورة مختبريا ، وكذلك بين الأنواع الموجودة12.
كونها كائنا حقيقيا النواة بسيطا ، فإن الخميرة هي النموذج المفضل لعدد كبير من الأسئلة البحثية المرتبطة بالكائنات الحقيقية النواة المعقدة. يرتبط أحد هذه الأسئلة بالانتواع وتطور الحواجز الإنجابية13,14. بالنسبة للكائنات الحية التي تتكاثر جنسيا ، يتم تعريف النوع من خلال مفهوم الأنواع البيولوجية (BSC) الذي اقترحه إرنست ماير15. وفقا لهذا المفهوم ، يقال إن فردين من السكان ينتميان إلى نوعين مختلفين إذا لم يتمكنوا من التزاوج ومعزولين تناسليا. يؤدي انهيار الدورة التناسلية الجنسية (التي تتضمن اندماج الأمشاج لتكوين زيجوت ، وتطور الزيجوت إلى ذرية ، وتحقيق النضج الجنسي في النسل) إلى العزلة التناسلية. كما هو موضح في الشكل 1 ، فإن دورة حياة S. cerevisiae مماثلة لدورة التكاثر الجنسي: أ) اندماج نوعي التزاوج a و α مشابه لاندماج الأمشاج في الكائنات الحية التي تتكاثر جنسيا. ب) قدرة ثنائي الصيغة الصبغية على الخضوع للانقسام الانقسامي تعادل تطور الزيجوت إلى ذرية ؛ ج) ثنائي الصيغة الصبغية الذي يخضع للتبويض يمكن مقارنته بعملية تكوين الأمشاج14.
يحدث عزل ما قبل الزيجوت عند ملاحظة التزاوج المتنوع. بالنظر إلى فرصة متساوية للتزاوج مع نوعين مختلفين وراثيا ، فإن النوع α يتزاوج بشكل تفضيلي مع أحدهما على الآخر أو العكس14. في حالة تجارب التطور التي تطورت فيها الصبغيات الفردية في بيئات مختلفة ، يمكن تحديد وجود حاجز ما قبل التزاوج عن طريق إجراء فحص التزاوج. يشير انخفاض كفاءة التزاوج عند مقارنته بالسلف إلى تطور حاجز ما قبل التزاوج. يمكن أن تنشأ عزلة ما بعد الزيجوت بسبب عدم قدرة ثنائي الصيغة الصبغية على الخضوع للانقسام الانقسامي الفعال و / أو الأبواغ لتشكيل جراثيم أحادية الصيغة الصبغية14. يمكن قياسها كميا عن طريق قياس معدل نمو ثنائيات الصيغة الصبغية وحساب كفاءة التبويض ، على التوالي. ومن ثم ، لدراسة تطور الحواجز التناسلية ، يلزم وجود طرق قوية لتحديد (أ) كفاءة التزاوج ، (ب) النمو الانقسامي للثنائي الصيغة الصبغية ، و (ج) كفاءة التبويض لثنائي الصيغة الصبغية. في هذا العمل ، تم الإبلاغ عن طريقة قوية لتحديد كفاءة التزاوج لسلالات الخميرة.
في التجارب المعملية ، تتمثل إحدى الطرق التي يمكن من خلالها اكتشاف حدوث التزاوج في استخدام علامات التغذية الخارجية التي تكمل المتطلبات الغذائية. عندما يكون نوعا التزاوج ذاتي التغذية لحمضين أمينيين مختلفين، فإن الخلية الثنائية الصيغة الصبغية التي تتكون من اندماج نوعي التزاوج هي وحدها التي يمكن أن تنمو على وسط ناقص في كلا الأحماض الأمينية. وبالتالي ، فإن العلامات الذاتية مفيدة للكشف عن التزاوج نوعيا وكميا. يكفي الاختبار النوعي لتحديد نوع التزاوج للسلالة بعد الانقسام الاختزالي16. الاختبارات الكمية ضرورية عندما يهتم المرء بتحديد انخفاض في التزاوج أثناء دراسة الجينات المشاركة في مسار التزاوج17,18. بالإضافة إلى ذلك ، مع استخدام الخميرة بشكل متزايد في دراسات الانتواع ، من الضروري إجراء فحص تزاوج مناسب وقابل للتكرار ، حيث أن القياس الكمي لكفاءة التزاوج هو مقياس للحاجز قبل الزيجوت.
تم تحديد كفاءة التزاوج بين نوعي تزاوج الخميرة سابقا16،19،20. معظم الطرق المستخدمة سابقا متشابهة في تصميمها مع بعض الاختلافات16،21،22،23،24،25. يستخدم بعضها ثقافات مرحلة اللوغاريتم المبكرة ، بينما يستخدم البعض الآخر ثقافات مرحلة منتصف اللوغاريتم للسلالات أحادية الصيغة الصبغية. هناك اختلافات في النسب التي يتم فيها خلط نوعي التزاوج. تستخدم جميع البروتوكولات تقريبا غشاء النيتروسليلوز. يتم خلط معلقات كلا النوعين من التزاوج المأخوذة من الثقافات المزروعة سابقا وتصفيتها على غشاء نيتروسليلوز يوضع على صفيحة YPD. في أحد أشكال البروتوكول ، يتم تصحيح التعليق أحادي الصيغة الصبغية مباشرة على لوحة YPD21. في التجارب التي تتناول الجينات المشاركة في إنتاج الفرمون لنوعي التزاوج ، تتم إضافة الفيرومونات خارجيا مع جعل معلقات نوعي التزاوج24.
بعد الحضانة لبضع ساعات (عادة حوالي 5 ساعات) بعد خلط الأحاديات الصبغية ، يتم غسل الخلايا من الغشاء وتخفيفها وطلائها على وسائط انتقائية. في إحدى الطرق السابقة التي تم الإبلاغ عنها في عام 1973 ، تم حساب كفاءة تكوين الزيجوت أو التزاوج عن طريق حساب عدد الخلايا الناشئة والخلايا غير المهدة وأزواج التزاوج تحت المجهر باستخدام مقياس الدم26. ومع ذلك ، فإن معظم الطرق التي تم الإبلاغ عنها لاحقا تستخدم علامات التغذية الذاتية للتمييز بين أحاديات الصيغة الصبغية وثنائيات الصبغيات. يتم حساب كفاءة التزاوج على أنها النسبة المئوية للخلايا ثنائية الصيغة الصبغية بالنسبة إلى عدد الخلايا ثنائية الصيغة الصبغية والأحادية الصيغة الصبغية في التجمع الخلوي16،21،23.
ومع ذلك ، على الرغم من عدد من التقارير التي تستخدم الخميرة ككائن نموذجي لدراسة الانتواع ، لا يوجد بروتوكول موحد تم الإبلاغ عنه في الأدبيات حتى الآن لحساب كفاءة التزاوج. قد لا تكون الخلايا في مرحلة السجل مثالية لقياس كفاءة التزاوج. أثناء التزاوج ، يتم القبض على دورة الخلية من اثنين من الصبغيات ، وبالتالي ، فإن الخلايا أثناء التزاوج لا تنقسم9. وبما أنه من المعروف أيضا أن دورة الخلية يتم إيقافها بالمثل في الخلايا في المرحلةالثابتة 27 ، فإن استخدام مثل هذه الخلايا يمكن أن يجعل البروتوكول أكثر قابلية للتكرار. يمكن خلط خلايا الطور الثابت ووضعها على ألواح YPD (أي بيئة غنية بالتغذية) للتزاوج. تتطلب الإجراءات التقليدية أيضا غشاء نيتروسليلوز وغسل الخلايا ، مما يجعل العملية مرهقة وعرضة للتعامل مع الأخطاء. بالإضافة إلى ذلك ، تحدد البروتوكولات المستخدمة حتى الآن كفاءة التزاوج من حيث واحد أحادي الصيغة الصبغية. ومع ذلك ، عند قياس العزلة التناسلية ، يتم تحديد كفاءة التزاوج لمجموعة معينة من أحاديات الصيغة الصبغية بدلا من أحادية الصيغة الصبغية واحدة.
لمعالجة هذه المشكلات ، هنا ، نبلغ عن طريقة قوية لقياس كفاءة التزاوج في الخميرة قابلة للتكرار بدرجة كبيرة وسهلة الاستخدام. علاوة على ذلك ، يمكن أيضا استخدام هذه الطريقة وسلالات الخميرة المستخدمة هنا في الدراسات التي تدرس تأثير تدفق الجينات على تطور حواجز التزاوج.
تم استخدام سلالتين مختلفتين من S. cerevisiae في هذه الدراسة. إحدى السلالات مشتقة من خلفية SK1. تم تعديل هذا في مختبرنا عن طريق إضافة علامات التغذية الخارجية بالقرب من موضع MAT. يتم توفير الأنماط الجينية الناتجة من أحاديات الصيغة الصبغية في الجدول 128،29،30. في سلالة SK1 ، تم إدخال جين TRP1 أحادي الصيغة الصبغية بالقرب من موضع MAT ، وتم إدخال جين LEU2 أحادي الصيغة الصبغية α بالقرب من موضع MAT. في سلالة ScAM ، تم إدخال جينات TRP1 و URA3 في الصبغيات A و α ، على التوالي. كان موقع الإدخال في منطقة ARS للكروموسوم الثالث (Chr III: 197378..197609). بالنسبة للبروتوكول المذكور هنا ، تكفي علامات التغذية الخارجية في أي مكان على الجينوم. ومع ذلك ، فإن وجود علامات التغذية الذاتية بالقرب من موضع MAT يعني أنه يمكن أيضا استخدام هذه السلالات للدراسات التي تدرس تأثير تدفق الجينات على الانتواع31,32. تمت إضافة العلامات بالقرب من موضع MAT لمنع إعادة خلط العلامات بسبب إعادة التركيب. ومن ثم ، يمكن استخدام هذا البروتوكول لتحديد كفاءة التزاوج في الدراسات التي تنطوي على الانتواع وأيضا لتحديد تغيير كفاءة التزاوج عند دراسة البروتينات المشاركة في مسار التزاوج.
Protocol
ملاحظة: يتضمن البروتوكول بشكل عام الخطوات التالية: (1) ترقيع الأحاديات الصيغة الصبغية في شبكات كفاءة التزاوج على لوحة YPD ، (2) خلط الأحاديات الصيغة الصبغية بأعداد متساوية بعد حضانة 24 ساعة وإعطاء الأحاديات الفردية المختلطة بضع ساعات للتزاوج (7 ساعات في هذه الدراسة) ، (3) طلاء الخلايا المختلطة على YPD لعزل المستعمرات الفردية بعد 7 ساعات عند 30 درجة مئوية ، وأخيرا، (4) تحديد عدد الثنائيات الصيغة الصبغية المتكونة باستخدام الواسمات الذاتية التغذية. تتم مناقشة هذه الخطوات بالتفصيل أدناه (انظر أيضا الشكل 2).
1. ترقيع الصبغيات الفردية في شبكات كفاءة التزاوج
- قم بإحياء الصبغيات الفردية A و α من مخزون المجمد عن طريق وضع صفيحة أجار YPD (2٪ أجار ، 2٪ سكر العنب ، 1٪ ببتون ، 0.5٪ مستخلص خميرة) ، والسماح لها بالنمو لمدة 48 ساعة عند 30 درجة مئوية للحصول على مستعمرات مفردة معزولة.
- قم بتلقيح المستعمرات المفردة من صفيحة YPD في 5 مل من وسط YPD (2٪ سكر العنب ، 1٪ ببتون ، 0.5٪ مستخلص الخميرة) ، واحتضانها عند 30 درجة مئوية لمدة 48 ساعة مع اهتزاز 250 دورة في الدقيقة. الخلايا في مرحلة ثابتة من النمو بعد فترة الحضانة هذه.
- ارسم شبكة كفاءة التزاوج على لوحة YPD جديدة. ارسم الشبكة على شكل مستطيل 1 سم × 1.5 سم مقسم إلى ثلاثة مربعات بحيث يكون لكل منها بعد 1 سم × 0.5 سم ، كما هو موضح في الشكل 2 أ.
- رقعة 5 ميكرولتر من ثقافة YPD لنوعي التزاوج على المستطيلات الموجودة في أقصى اليسار وأقصى اليمين (الشكل 2B). يتوافق هذا الحجم مع ما يقرب من 5 × 105 خلايا أحادية الصيغة الصبغية موضوعة في كل قسم. احتضان الألواح لمدة 24 ساعة عند 30 درجة مئوية.
ملاحظة: الغرض من الشبكة هو جعل المقاييس التجريبية دقيقة (مثل عدد الخلايا في التجربة). حجم الشبكة صغير بما يكفي بحيث يكون قابلا للسحب تجريبيا ولكنه كبير بما يكفي بحيث يمكن التلاعب به بسهولة (مثل رفع الخلايا من الشبكة) وليس عرضة للانجراف أو أحداث الصدفة.
2. خلط الصبغيات والتزاوج
ملاحظة: بعد 24 ساعة (الشكل 2C) ، يتم كشط عدد متساو من الخلايا من النوعين الأحاديين الصيغة الصبغية من الشبكتين ، وخلطها ، ووضعها في المستطيل المركزي (الشكل 2D).
- من أجل خلط عدد متساو من الخلايا ، قم بإزالة حوالي 1/3 من الرقعة التي تم وضعها في الصناديق الخارجية باستخدام عود أسنان معقم ، وأعد تعليقها في 20 ميكرولتر من الماء في قارورة معقمة سعة 1.5 مل لكل من الصبغيات.
- تمييع 5 ميكرولتر من هذا التعليق في 2 مل من الماء. قم بقياس OD لهذا التعليق المخفف باستخدام مقياس الطيف الضوئي عند 600 نانومتر. امزج عددا متساويا من الخلايا من السلالتين ، بناء على قيمة OD وعدد الخلايا / مل في 1 OD لتلك السلالة المعينة. احسب الحجم المطلوب خلطه ، واستنشقه من 15 ميكرولتر المتبقية من التعليق الفردي أحادي الصيغة الصبغية.
ملاحظة: عدد الخلايا المصححة في المستطيل الأوسط بحيث تشكل الخلايا طبقة أحادية. بالنظر إلى أن خلية فطر الخميرة كرة نصف قطرها 2.58 ميكرومتر33 ، فإن الصندوق المستطيل الذي يبلغ طوله 1 سم × 0.5 سم سيحتاج إلى حوالي 1.7 × 106 خلايا لتكوين طبقة أحادية. يجب توخي الحذر لضمان عدم وجود لمس مادي بين الخلايا المصححة للتزاوج وشبكتي الخلايا الأحادية الصيغة الصبغية. نظرا لأنه يجب خلط أعداد متساوية من كل نوع من الخلايا الأحادية الصيغة الصبغية ، تتم إضافة 8.5 × 105 خلايا من كل سلالة. يتم حساب رقم الخلية بناء على قياسات OD ، مع الأخذ في الاعتبار أن 1 OD عند 600 نانومتر يعادل تقريبا 1 × 107 خلايا34. على سبيل المثال ، إذا كان OD600 للتعليق أحادي الصيغة الصبغية هو 0.17 و α أحادي الصيغة الصبغية هو 0.11 ، فيمكن حساب عدد الخلايا في 5 ميكرولتر من كل تعليق أحادي الصيغة الصبغية. لضمان 8.5 × 105 خلايا من كل نوع أحادي الصيغة الصبغية ، يتم خلط 1.25 ميكرولتر من أحادي الصيغة الصبغية و 1.93 ميكرولتر من α معلقات أحادية الصيغة الصبغية. - أضف الأحجام المطلوبة من كل من الأحاديات الصيغة الصبغية في قارورة طازجة ومعقمة سعة 1.5 مل ، واخلطها جيدا باستخدام ماصة. الحجم النهائي لهذا التعليق بشكل عام حوالي 6-8 ميكرولتر. تصحيح هذا التعليق في الشبكة المركزية. احتضان اللوحة عند 30 درجة مئوية لمدة 7 ساعات ، مما يتيح للأحاديات الفردية وقتا كافيا للتزاوج (الشكل 2E).
3. طلاء الخلايا المختلطة على أجار YPD
- بعد فترة الحضانة البالغة 7 ساعات ، كشط الخلايا من المستطيل المركزي باستخدام مسواك أو طرف ماصة ، وخفف في 2 مل من الماء المعقم. ثم انشر تعليق الخلية على أجار YPD للحصول على مستعمرات واحدة. لتحديد عامل التخفيف اللازم للحصول على مستعمرات مفردة ، قم بقياس OD للأنبوب الأول الذي تضاف إليه الخلايا المكشطة. يجب تحديد عوامل تخفيف محددة لكل نوع / سلالة يتم استخدامها.
ملاحظة: على سبيل المثال ، يتوافق OD600 البالغ 0.15 مع 3 × 106 خلية في تعليق 2 مل (مع الأخذ في الاعتبار 1 OD = 1 × 107 خلية / مل). للحصول على بضع مئات من المستعمرات على لوحة YPD ، يتم تخفيف تعليق الخلية بشكل متسلسل عند 1:20 مرتين ، ثم يتم استخدام 100 ميكرولتر من التخفيف النهائي للانتشار. - بعد الطلاء ، احتضان ألواح YPD عند 30 درجة مئوية لمدة 36-48 ساعة حتى تكون هناك مستعمرات مفردة. تأكد من الحصول على بضع مئات من المستعمرات الفردية من كل تجربة تزاوج للفحص لضمان إمكانية اكتشاف الأهمية الإحصائية في البيانات (الشكل 2F).
4. فحص ثنائيات الصبغيات باستخدام علامات التغذية الذاتية
- تحديد أي جزء من المستعمرات التي تم الحصول عليها هي ثنائية الصيغة الصبغية. لتحديد المستعمرات ثنائية الصيغة الصبغية على اللوحة ، انقل المستعمرات المفردة عن طريق وضعها بشكل فردي على صفيحة مزدوجة التسرب (2٪ جلوكوز ، 0.66٪ قاعدة نيتروجين ، 0.05٪ خليط حمض أميني مزدوج التسرب ، و 2٪ أجار) تفتقر إلى الأحماض الأمينية التي تكون السلالات ذاتية التغذية لها ، كما هو موضح في الشكل 2G. احتضان الألواح عند 30 درجة مئوية لمدة 48 ساعة.
ملاحظة: يمكن أيضا نقل المستعمرات إلى لوحة التسرب المزدوجة باستخدام طلاء طبق النسخة. في هذه الدراسة ، تم استخدام وسط تسرب التربتوفان والليوسين (trp − leu −) عند تحديد كفاءة التزاوج لسلالات SK1AM ، وتم استخدام وسط تسرب التربتوفان واليوراسيل (trp − ura−) لسلالات ScAM. تنمو المستعمرات ثنائية الصيغة الصبغية فقط على صفيحة التسرب المزدوجة لأنها تحتوي على كل من العلامات الذاتية التغذية: جينات TRP1 و LEU2 في سلالات SK1AM وجينات TRP1 و URA3 في سلالات ScAM. - بالإضافة إلى ذلك ، قم بخط أو نسخة طبق الأصل من لوحة المستعمرات على وسائط تسرب واحدة (trp− أو leu− أو ura−) لتحديد تواتر كل نوع من نوعي أحادي الصيغة الصبغية في السكان.
- احسب كفاءة التزاوج ، η ، على النحو التالي:
 مكافئ (1)
مكافئ (1)
حيث يكون عدد التزاوج أحادي الصيغة الصبغية يساوي ببساطة ضعف عدد ثنائيات الصيغة الصبغية المحددة على لوحة التسرب المزدوجة (نظرا لأن كل ثنائي الصيغة الصبغية ناتج عن تزاوج اثنين من أحادي الصيغة الصبغية). إجمالي عدد الأحاديات الصيغة الصبغية يساوي مجموع عدد الأحاديات الصيغة الصبغية المخططة زائد ضعف عدد ثنائيات الصيغة الصبغية المخططة.
ملاحظة: على سبيل المثال ، إذا نمت 60 مستعمرة فقط بعد طلاء 100 مستعمرة على وسائط تسرب مزدوجة / نسخة طبق الأصل ، فيمكن قياس كفاءة التزاوج على أنها 75٪ (حيث تزاوج 60 × 2 أحادي الصيغة الصبغية لتشكيل 60 ثنائي الصيغة الصبغية ، ولم يتزاوج 40 أحادي الصيغة الصبغية).
النتائج
القياس الكمي لكفاءة التزاوج لنوعي التزاوج
تم استخدام البروتوكول الموصوف هنا لتحديد كفاءة التزاوج بين سلالتين من الخميرة - بين SK1AMa و SK1AM α وبين ScAMa و ScAMα (الشكل 3A). في هذه التجارب ، تكرر التزاوج بين اثنين من أحادي الصيغة الصبغية 12 مرة على الأقل. في كل من تكرار التجربة ، تم تخطيط ما لا يقل عن 100 مستعمرة على وسائط التسرب المزدوجة. مكنت متانة البروتوكول من التمييز السهل بين كفاءة التزاوج بين السلالتين ، SK1AM و ScAM. بينما تتزاوج سلالات SK1 بكفاءة عالية جدا ، تتزاوج سلالات ScAM بكفاءة أقل نسبيا (الشكل 3 أ). ربما لا يكون هذا مفاجئا ، حيث نشأت سلالات ScAM من التزاوج الهجين بين سلالات S. cerevisiae و S. carlsbergensis 35.
بالإضافة إلى التمييز بين كفاءة التزاوج بين السلالات ، يمكن أيضا استخدام هذه الطريقة لتحديد الاختلافات في كفاءة التزاوج للسلالات عبر بيئات مختلفة. كما هو موضح في الشكل 3 ب ، انخفضت كفاءة التزاوج لسلالات ScAM بشكل ملحوظ عندما لا تحتوي البيئة على الجلوكوز كمصدر أساسي للكربون. التزاوج عملية مكلفة للغاية ، والنمو على مصادر الكربون البديلة يقلل نوعيا من كفاءة التزاوج.
ديناميات كفاءة التزاوج
تسمح قابلية التكرار العالية للطريقة أيضا بتتبع ديناميكيات كفاءة التزاوج. عندما سمح للتزاوج لفترات زمنية مختلفة (الشكل 3C) ، لم يلاحظ أي تزاوج لأول 4-5 ساعات ؛ ظهرت ثنائيات الصبغيات الأولى فقط بعد هذه المدة. من المفترض أن هذا هو الوقت اللازم لإكمال عملية التزاوج في بيئة معينة. بعد ذلك ، زادت كفاءة التزاوج بسرعة. ومع ذلك ، بعد 7 ساعات ، تتأثر حسابات كفاءة التزاوج بحقيقة أن النمو الانقسامي يبدأ في الحدوث على اللوحة. يمكن أن يسمح تحديد واختيار ثنائيات الصيغة الصبغية المبكرة أو المتأخرة بهذه الطريقة بتصميم تجارب تهدف إلى تطوير التزاوج السريع أو المتأخر بين أحاديات الصيغة الصبغية. الوقت الدقيق الذي تصل فيه كفاءة التزاوج إلى ذروتها متغير لكل سلالة. على سبيل المثال ، باستخدام حركية النمو ، قررنا تجريبيا أن سلالة ScAM تظهر معدل نمو أقل من سلالات S. cerevisiae الأخرى (مثل SK1) ، وربما يؤثر هذا أيضا على ديناميكيات التزاوج.

الشكل 1: دورة حياة الفطريات السكرية المخيفية. S. cerevisiae له نوعان من التزاوج ، A و α ، ويظهر كل من مراحل الإنجاب اللاجنسي والجنسي. ينقسم نوعان من التزاوج ، في غياب الآخر ، انقساما. ومع ذلك ، عندما تكون موجودة بالقرب من بعضها البعض ، فإنها تتوقف عن الانقسام الانقسامي ، وتندمج المحتويات الخلوية والنووية لتشكيل ثنائي الصيغة الصبغية. يمكن للخلية الثنائية الصيغة الصبغية أن تنقسم انقساما انقساميا. ومع ذلك ، في ظل وجود ظروف غير مواتية (الجوع) ، فإنه يخضع للانقسام الاختزالي لإنتاج جراثيم تحتوي على أربعة أحاديات الصيغة الصبغية. تنبت هذه الجراثيم في ظل ظروف مواتية لإطلاق اثنين من الصبغيات الفردية من كل نوع ، وبالتالي إكمال دورة الحياة. يشار إلى الفعالية التي يشار بها إلى اثنين من الصبغيات الفردية a و α باسم كفاءة التزاوج. أي انخفاض في كفاءة التزاوج هذه يشير إلى حاجز ما قبل الزيجوت للتزاوج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
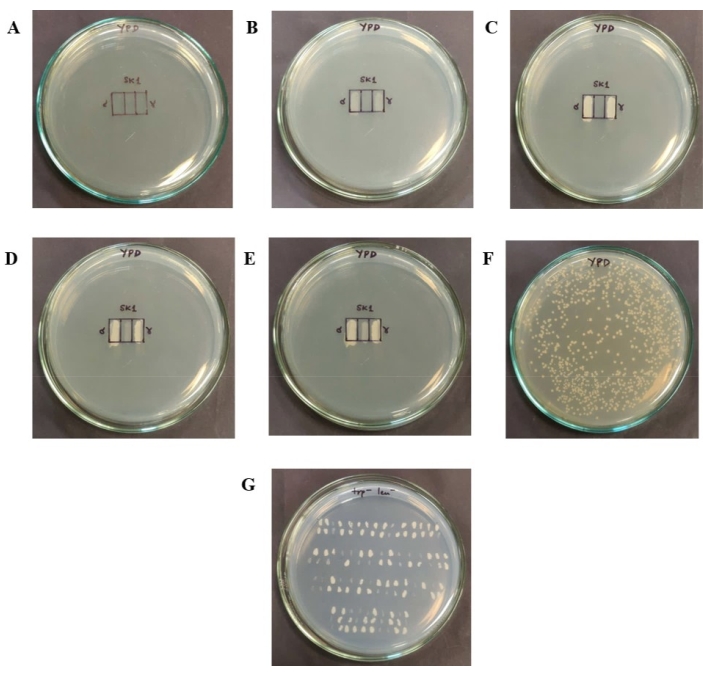
الشكل 2: الخطوات المتبعة في فحص كفاءة التزاوج . (أ) شبكة كفاءة التزاوج 1 سم × 1.5 سم ، والتي تنقسم أيضا إلى صناديق كل منها 1 سم × 0.5 سم ، مرسومة على لوحة YPD. (ب) الخلايا الأحادية الصيغة الصبغية مرقعة على المربعات المتطرفة. ج: نمو الخلايا الأحادية الصيغة الصبغية بعد 24 ساعة عند 30 درجة مئوية. (د) تتم إزالة ثلث الرقع الأحادية الصيغة الصبغية باستخدام عود أسنان، وتخلط بأعداد متساوية من الخلايا (بناء على OD600)، وتوضع في الشبكة المركزية. ه: نمو الخلايا المرقعة في الشبكة المركزية بعد 7 ساعات عند 30 درجة مئوية. يحتوي هذا على ثنائيات الصيغة الصبغية الجديدة المتكونة وأحاديات الصيغة الصبغية التي لم تتزاوج. (F) مستعمرات مفردة معزولة تم الحصول عليها على صفيحة YPD بعد تخفيف وطلاء الخلايا الكشط من الشبكة المركزية. تم تحضين هذه الصفيحة عند 30 درجة مئوية لمدة 36-48 ساعة. (ز) لتحديد عدد ثنائيات الصيغة الصبغية الموجودة على لوحة YPD ، يتم نقل المستعمرات إلى صفيحة مزدوجة التسرب تفتقر إلى التربتوفان والليوسين. فقط ثنائيات الصبغيات يمكن أن تنمو على هذه اللوحة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
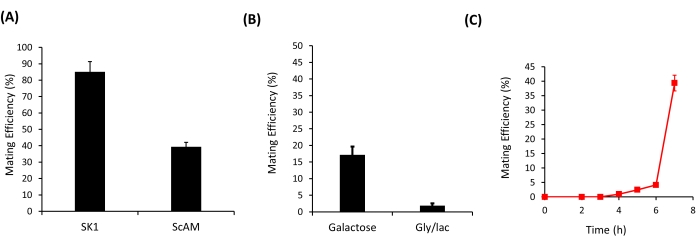
الشكل 3: كفاءة تزاوج سلالات الخميرة . (أ) كفاءة التزاوج للسلالتين الأحاديتين الصبغيتين a و α من سلالتي SK1 و ScAM على صفيحة YPD. (ب) كفاءة التزاوج للاثنين من أحادي الصيغة الصبغية A و α من سلالة ScAM على ألواح YP التي تحتوي على 2٪ جالاكتوز وعلى ألواح الجلسرين / اللاكتات. (ج) ديناميات التزاوج في سلالة ScAM في بيئة الجلوكوز. تظهر النتائج كمتوسط ± SD من 12 تكرارا مستقلا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| سلالات | الجيني | التعليق | مرجع |
| SK1AMa | ars314 :: TRP1 ، MATa ، ho :: LYS2 ، lys2 ، ura3 ، leu2 :: hisG ، his3 :: hisG ، trp1 :: hisG | تحتوي هذه السلالة على جين TRP1 وبالتالي يمكن أن تنمو في غياب التربتوفان في الوسائط. | |
| SK1AMα | ars314 :: LEU2 ، ماتألفا ، هو :: LYS2 ، lys2 ، ura3 ، leu2 :: hisG ، his3 :: hisG ، trp1 :: hisG | تحتوي هذه السلالة على جين LEU2 وبالتالي يمكن أن تنمو في غياب الليوسين في الوسائط. | |
| SCAMأ | ars314 :: TRP1 ، ماتا ، هو ، MEL1 ، ade1 ، إيل ، TRP1-HIII ura3‐52 | تحتوي هذه السلالة على جين TRP1 وبالتالي يمكن أن تنمو في غياب التربتوفان في الوسائط. | مشتق من ScPJB644a في المرجع 28 |
| α SCAM | ars314::URA3, ماتألفا, هو, MEL1, ade1, ile, TRP1-HIII, URA3‐52 | تحتوي هذه السلالة على جين URA3 وبالتالي يمكن أن تنمو في غياب اليوراسيل في الوسائط. | مشتق من ScPJB644α في المرجع 28 |
الجدول 1: الأنماط الجينية لسلالات S. cerevisiae المستخدمة في هذه الدراسة.
Discussion
يعد القياس الكمي لكفاءة التزاوج في S. cerevisiae ضروريا لإجراء الدراسات المتعلقة بالجينات المشاركة في مسارات التزاوج أو دراسة تأثير البيئة الخارجية على سلوك التزاوج. في العقدين الماضيين ، أصبحت S. cerevisiae أيضا نموذجا شائعا لمعالجة الأسئلة المتعلقة بالانتواع14،36،37،38. إن وجود نوعين من التزاوج وسهولة التلاعب الجيني والصيانة في البيئات المختبرية جعله كائنا مناسبا لدراسة تطور الحواجز التناسلية في الوقت الفعلي. يعد القياس الكمي لكفاءة التزاوج أمرا ضروريا لأنه يعطي مقياسا للحاجز التناسلي قبل الزيجوت. وبالتالي ، يلزم وجود بروتوكول مناسب مع قابلية عالية للتكرار.
باستخدام البروتوكول أعلاه ، تم تحديد كفاءة التزاوج لسلالتين مختلفتين تظهران سلوك تزاوج مختلف تماما. ومن ثم، يمكن تطبيق البروتوكول على أي سلالة؛ لأن معظم سلالات خميرة المختبر تحمل التغذية الأوكسوجينية التي يمكن استخدامها للاختيار39. ومع ذلك ، هناك بعض الاعتبارات المهمة أثناء استخدام هذا البروتوكول. تعتمد المدة الزمنية اللازمة لثقافات YPD الأولية للوصول إلى المرحلة الثابتة على الإجهاد. قد تحتاج السلالة بطيئة النمو إلى حضانة تزيد عن 48 ساعة عند 30 درجة مئوية. يتم حساب حجم الأحاديات الصيغة الصبغية المراد خلطها بناء على قياسات OD في مقياس الطيف الضوئي. القيمة المبلغ عنها في الأدبيات هي في حدود 107 خلية / مل ل 1 OD34 ؛ ومع ذلك ، من الأفضل وصف هذه القيمة لسلالة معينة باستخدام مخطط OD مقابل عدد الخلايا. يمكن حساب الحجم المطلوب لضمان خلط أعداد متساوية من الخلايا بناء على قيمة OD وعدد الخلايا / مل في 1 OD ، والتي يتم الحصول عليها من توصيف السلالة. يجب على المرء التأكد من أن الخلايا التي يتم ترقيعها في الشبكة المركزية بعد خلط الأحاديات الصيغة الصبغية تشكل تقريبا طبقة أحادية ليست سميكة جدا. يحتاج المرء أيضا إلى التأكد من أن الحجم الذي يتم خلطه هو حوالي 6-8 ميكرولتر. يمكن أن يؤدي الحجم الأكبر إلى التداخل مع البقع أحادية الصيغة الصبغية الموجودة على جانبي الشبكة المركزية.
يمكن أيضا استخدام هذه الطريقة لدراسة الحواجز التناسلية قبل الزيجوت بين العزلات البيئية للخميرة. ومع ذلك ، في مثل هذه الحالات ، يجب أولا إزالة جين HO endonuclease من جينوم الكائن الحي ، حيث أن السلالات التي تحمل HO endonuclease تشكل ثنائيات الصبغيات تلقائيا بسبب نشاط التبديل من نوع التزاوج40. يمكن تحديد الأحاديات الصيغة الصبغية المعزولة من ثنائي الصيغة الصبغية المبوغ على أنها أو α عن طريق تحديد التسلسل الموجود في موضع MAT باستخدام البادئات المحددة المذكورة سابقا41. يمكن استبدال علامة HO بجينين مختلفين لمقاومة المضادات الحيوية كعلامات للتمييز بين نوعي التزاوج أحادي الصيغة الصبغية. تعتمد هذه التفاصيل على بناء الإجهاد المستخدم في دراسة معينة.
أحد قيود هذه الطريقة هو أن استخدام علامات التغذية الخارجية يتطلب نقل المستعمرات من لوحة YPD إلى لوحات التسرب. يمكن أن يساعد استخدام علامات مضان للتمييز بين الخلايا الأحادية الصيغة الصبغية والخلايا الثنائية الصيغة الصبغية في تقليل الوقت التجريبي. ومع ذلك ، يمكن أن يؤثر استخدام علامات التألق على ديناميكيات نمو الخلايا حيث توجد تكلفة إضافية ينطوي عليها إنتاج البروتينات الفلورية ، والتي ، بالتالي ، يمكن أن تغير الحالة الأيضية والفسيولوجية للخلية42. بدلا من ذلك ، يمكن استبدال علامات التغذية الذاتية لتحديد اثنين من الصبغيات الفردية بعلامات المضادات الحيوية.
تشير بعض الطرق السابقة المستخدمة لتوصيف كفاءة التزاوج إلى استخدام فائض من أحد أنواع التزاوج بنسبة 10: 116،21،24. من التجربة ، يؤدي استخدام نسبة متحيزة من اثنين من أحادي الصيغة الصبغية إلى نمو انقسامي للأحادي الصيغة الصبغية الزائدة. لذلك ، تستخدم الطريقة الحالية مزيجا 1: 1 من اثنين من أحادي الصيغة الصبغية.
نظرا لأن علامات التغذية الذاتية في السلالات المستخدمة في هذه الدراسة يتم إدخالها بالقرب من موضع MAT ، فإن إعادة التركيب أثناء الانقسام الاختزالي لا يكسر الارتباط بين علامة التغذية الذاتية ونوع التزاوج. نتيجة لذلك ، لا يتغير التغذية الذاتية ونوع التزاوج لواحد فردي معين حتى لو سمح للسلالات بالخضوع للانقسام الاختزالي. هذا يسمح بالإجابة على الأسئلة المتعلقة بتأثير تدفق الجينات كمتغير على التكيف والانتواع43. وبالتالي ، بشكل عام ، يقدم هذا البروتوكول طريقة بسيطة وقوية لتحديد كفاءات التزاوج بين سلالات الخميرة المختلفة.
Disclosures
يعلن المؤلفون أنه ليس لديهم مصالح متنافسة في هذا العمل. يسعد المؤلفون بمشاركة السلالات المشتقة من SK1 لجميع الاستخدامات غير الربحية.
Acknowledgements
تم تمويل هذا العمل من خلال منحة DBT / Wellcome Trust (تحالف الهند) (IA / S / 19/2/504632) إلى S.S. P.N. هو زميل باحث مدعوم بمنحة DBT / Wellcome Trust (تحالف الهند) (IA / S / 19/2/504632). يتم دعم A.M. من قبل مجلس البحوث العلمية والصناعية (CSIR) ، حكومة الهند ، كزميل باحث أول (09/087 (0873) / 2017-EMR-I). يشكر المؤلفون بايكي جاياديفا بهات على المناقشات.
Materials
| Name | Company | Catalog Number | Comments |
| Adenine | Sigma Life Science | A8626 | |
| Agar Powder regular grade for bacteriology | SRL | 19661 (0140186) | |
| Ammonium Sulphate, Hi-AR | HiMedia | GRM1273 | |
| D-(+)-glucose | Sigma Life Science | G8270 | |
| Glass Petri plates | HiMedia | PW008 | 90 mm x 15 mm dimension |
| L-Arginine | Sigma Life Science | A8094 | |
| L-Aspartic acid | Sigma Life Science | A7219 | |
| L-Histidine monochloride monohydrate | Sigma Life Science | H5659 | |
| L-Isoleucine | Sigma Aldrich | I2752 | |
| L-Leucine | Sigma Life Science | L8912 | |
| L-Lysine | Aldrich | 62840 | |
| L-Methionine | Sigma Life Science | M5308 | |
| L-Phenylalanine | Sigma Life Science | P5482 | |
| L-Threonine | Sigma Aldrich | T8625 | |
| L-Tyrosine | Sigma Life Science | T8566 | |
| L-Valine | Sigma Life Science | V0513 | |
| Mating efficiency grid | 1 cm x 1.5 cm rectangular grid drawn on the Petri plate | ||
| Microcentrifuge tubes | Tarsons | 500010 | |
| Peptone | HiMedia | RM001 | |
| Uracil | Sigma Life Science | U0750 | |
| Yeast Extract Powder | HiMedia | RM027 | |
| Yeast Nitrogen Base w/o Amino acids and Ammonium Sulphate | BD Difco | 233520 |
References
- Neiman, A. M. Sporulation in the budding yeast Saccharomyces cerevisiae. Genetics. 189 (3), 737-765 (2011).
- Duina, A. A., Miller, M. E., Keeney, J. B. Budding yeast for budding geneticists: A primer on the Saccharomyces cerevisiae model system. Genetics. 197 (1), 33-48 (2014).
- Herskowitz, I. Life cycle of the budding yeast Saccharomyces cerevisiae. Microbiological Reviews. 52 (4), 536-553 (1988).
- Erdman, S., Lin, L., Malczynski, M., Snyder, M. Pheromone-regulated genes required for yeast mating differentiation. Journal of Cell Biology. 140 (3), 461-483 (1998).
- Merlini, L., Dudin, O., Martin, S. G. Mate and fuse: How yeast cells do it. Open Biology. 3 (3), 130008 (2013).
- Gustin, M. C., Albertyn, J., Alexander, M., Davenport, K. MAP kinase pathways in the yeast Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 62 (4), 1264-1300 (1998).
- Bardwell, L. A walk-through of the yeast mating pheromone response pathway. Peptides. 26 (2), 339-350 (2005).
- Reid, B. J., Hartwell, L. H. Regulation of mating in the cell cycle of Saccharomyces cerevisiae. Journal of Cell Biology. 75, 355-365 (1977).
- Williams, T. C., Peng, B., Vickers, C. E., Nielsen, L. K. The Saccharomyces cerevisiae pheromone-response is a metabolically active stationary phase for bio-production. Metabolic Engineering Communications. 3, 142-152 (2016).
- Bagnat, M., Simons, K. Cell surface polarization during yeast mating. Proceedings of the National Academy of Sciences of the United States of America. 99 (22), 14183-14188 (2002).
- Trueheart, J., Boeke, J. D., Fink, G. R. Two genes required for cell fusion during yeast conjugation: Evidence for a pheromone-induced surface protein. Molecular and Cellular Biology. 7 (7), 2316-2328 (1987).
- Sniegowski, P. D., Dombrowski, P. G., Fingerman, E. Saccharomyces cerevisiae and Saccharomyces paradoxus coexist in a natural woodland site in North America and display different levels of reproductive isolation from European conspecifics. FEMS Yeast Research. 1 (4), 299-306 (2002).
- Replansky, T., Koufopanou, V., Greig, D., Bell, G. Saccharomyces sensu stricto as a model system for evolution and ecology. Trends in Ecology and Evolution. 23 (9), 494-501 (2008).
- Greig, D. Reproductive isolation in Saccharomyces. Heredity. 102 (1), 39-44 (2009).
- Mayr, E. . Systematics and the Origin of Species, from the Viewpoint of a Zoologist. , (1999).
- Sprague, G. F. Assay of yeast mating reaction. Methods in Enzymology. 194, 77-93 (1991).
- McCaffrey, G., Clay, F. J., Kelsay, K., Sprague, G. F. Identification and regulation of a gene required for cell fusion during mating of the yeast Saccharomyces cerevisiae. Molecular and Cellular Biology. 7 (8), 2680-2690 (1987).
- Valtz, N., Peter, M., Herskowitz, I. FAR1 is required for oriented polarization of yeast cells in response to mating pheromones. Journal of Cell Biology. 131 (4), 863-873 (1995).
- Maclean, C. J., Greig, D. Prezygotic reproductive isolation between Saccharomyces cerevisiae and Saccharomyces paradoxus. BMC Evolutionary Biology. 8, 1 (2008).
- Murphy, H. A., Kuehne, H. A., Francis, C. A., Sniegowski, P. D. Mate choice assays and mating propensity differences in natural yeast populations. Biology Letters. 2 (4), 553-556 (2006).
- Leu, J. Y., Murray, A. W. Experimental evolution of mating discrimination in budding yeast. Current Biology. 16 (3), 280-286 (2006).
- Kim, J., Hirsch, J. P. A nucleolar protein that affects mating efficiency in Saccharomyces cerevisiae by altering the morphological response to pheromone. Genetics. 149 (2), 795-805 (1998).
- Jin, M., et al. Yeast dynamically modify their environment to achieve better mating efficiency. Science Signaling. 4 (186), (2011).
- Rogers, D. W., Denton, J. A., McConnell, E., Greig, D. Experimental evolution of species recognition. Current Biology. 25 (13), 1753-1758 (2015).
- McClure, A. W., Jacobs, K. C., Zyla, T. R., Lew, D. J. Mating in wild yeast: Delayed interest in sex after spore germination. Molecular Biology of the Cell. 29 (26), 3119-3127 (2018).
- Sena, E. P., Radin, D. N., Fogel, S. Synchronous mating in yeast. Proceedings of the National Academy of Sciences of the United States of America. 70 (5), 1373-1377 (1973).
- Werner-Washburne, M., Braun, E., Johnston, G. C., Singer, R. A. Stationary phase in the yeast Saccharomyces cerevisiae. Microbiology Reviews. 57 (2), 383-401 (1993).
- Johnston, S. A., Hopper, J. E. Isolation of the yeast regulatory gene GAL4 and analysis of its dosage effects on the galactose/melibiose regulon. Proceedings of the National Academy of Sciences of the United States of America. 79 (22), 6971-6975 (1982).
- Mahilkar, A. . Study of metabolic specialization leading to speciation, using yeast as a model system. , (2021).
- Blank, T. E., Woods, M. P., Lebo, C. M., Xin, P., Hopper, J. E. Novel Gal3 proteins showing altered Gal80p binding cause constitutive transcription of Gal4p-activated genes in Saccharomyces cerevisiae. Molecular and Cellular Biology. 17 (5), 2566-2575 (1997).
- Rice, W. R., Hostert, E. E. Laboratory experiments on speciation: What have we learned in 40 years. Evolution. 47 (6), 1637-1653 (1993).
- White, N. J., Snook, R. R., Eyres, I. The past and future of experimental speciation. Trends in Ecology and Evolution. 35 (1), 10-21 (2020).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--The database of key numbers in molecular and cell biology. Nucleic Acids Research. 38, 750-753 (2010).
- Domitrovic, T., et al. Structural and functional study of YER067W, a new protein involved in yeast metabolism control and drug resistance. PLoS One. 5 (6), 11163 (2010).
- Lindegren, C. C., Spiegelman, S., Lindegren, G. Mendelian inheritance of adaptive enzymes. Proceedings of the National Academy of Sciences of the United States of America. 30 (11), 346-352 (1944).
- Dettman, J. R., Sirjusingh, C., Kohn, L. M., Anderson, J. B. Incipient speciation by divergent adaptation and antagonistic epistasis in yeast. Nature. 447 (7144), 585-588 (2007).
- Jhuang, H. Y., Lee, H. Y., Leu, J. Y. Mitochondrial-nuclear co-evolution leads to hybrid incompatibility through pentatricopeptide repeat proteins. EMBO Reports. 18 (1), 87-101 (2017).
- Lee, H. Y., et al. Incompatibility of nuclear and mitochondrial genomes causes hybrid sterility between two yeast species. Cell. 135 (6), 1065-1073 (2008).
- Pronk, J. T. Auxotrophic yeast strains in fundamental and applied research. Applied and Environmental Microbiology. 68 (5), 2095-2100 (2002).
- Madhani, H. D. . From a to α: Yeast as a Model for Cellular Differentiation. , (2007).
- Huxley, C., Green, E. D., Dunham, I. Rapid assessment of S. cerevisiae mating type by PCR. Trends in Genetics. 6 (8), 236 (1990).
- Rang, C., Galen, J. E., Kaper, J. B., Chao, L. Fitness cost of the green fluorescent protein in gastrointestinal bacteria. Canadian Journal of Microbiology. 49 (9), 531-537 (2003).
- Tusso, S., Nieuwenhuis, B. P. S., Weissensteiner, B., Immler, S., Wolf, J. B. W. Experimental evolution of adaptive divergence under varying degrees of gene flow. Nature Ecology and Evolution. 5 (3), 338-349 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved