Method Article
Dosagem Múltipla em Bolus Intravenoso e Avaliação Hemodinâmica Invasiva em Modelo de Hipertensão Arterial Pulmonar em Camundongos Induzida por Hipóxia
Neste Artigo
Resumo
Este protocolo fornece um procedimento passo-a-passo para a execução da administração de múltiplas doses intravenosas em bolus e monitorização hemodinâmica invasiva em camundongos. Os investigadores podem usar esse protocolo para futura triagem terapêutica de compostos para hipertensão arterial pulmonar.
Resumo
A hipertensão arterial pulmonar (HAP) é uma doença progressiva com risco de vida, afetando principalmente pequenas arteríolas pulmonares do pulmão. Atualmente, não há cura para a HAP. É importante descobrir novos compostos que possam ser usados para tratar a HAP. O modelo de HAP induzida por hipóxia em camundongos é um modelo amplamente utilizado para pesquisa de HAP. Esse modelo recapitula as manifestações clínicas humanas da doença do grupo 3 da HAP e é uma importante ferramenta de pesquisa para avaliar a eficácia de novas terapias experimentais para HAP. A pesquisa usando este modelo muitas vezes requer a administração de compostos em camundongos. Para um composto que precisa ser administrado diretamente na corrente sanguínea, otimizar a administração intravenosa (IV) é uma parte fundamental dos procedimentos experimentais. Idealmente, o sistema de injeção IV deve permitir múltiplas injeções ao longo de um determinado curso de tempo. Embora o modelo de HAP induzida por hipóxia em camundongos seja muito popular em muitos laboratórios, é tecnicamente desafiador realizar múltiplas doses IV em bolus e avaliação hemodinâmica invasiva nesse modelo. Neste protocolo, apresentamos instruções passo a passo sobre como realizar múltiplas doses IV em bolus via veia jugular de camundongo e realizar cateterismo arterial e ventrículo direito para avaliação hemodinâmica em modelo de HAP induzida por hipóxia em camundongos.
Introdução
A hipertensão arterial pulmonar (HAP) é definida pela pressão sistólica média da artéria pulmonar maior que 20 mmHg em repouso 1,2. É uma doença progressiva e fatal, caracterizada por elevação sustentada da pressão arterial pulmonar, levando à sobrecarga do ventrículo direito e, finalmente, à morte por falência ventriculardireita1. Atualmente, não há cura para a HAP.
O uso de modelos animais de hipertensão pulmonar é importante para testar a eficácia de terapias experimentais de HAP. Entre esses modelos, o modelo de HAP induzida por hipóxia em camundongos forneceu informações importantes sobre o desenvolvimento da doença do grupo 3 de HAP humana 3,4. A pesquisa usando este modelo muitas vezes requer a administração de compostos em camundongos para avaliar a eficácia e segurança do novo composto. Portanto, os investigadores precisam de um procedimento experimental detalhado para dosagem de compostos e medidas hemodinâmicas para garantir a consistência da injeção e a reprodutibilidade da medida da pressão arterial do início ao fim.
Métodos para injeção intravenosa (IV) e medida da pressão arterial têm sido relatados na literatura 5,6. No entanto, a metodologia carece de ilustração visual e descrição detalhada. Aqui ilustramos os principais passos para uma injeção intravenosa em bolus bem-sucedida e a medição e registro precisos da pressão arterial sistêmica e do ventrículo direito. Os procedimentos aqui apresentados são um importante recurso para pesquisadores interessados na via IV da plataforma de administração de compostos desenvolverem um tratamento para HAP.
Protocolo
Todos os procedimentos com animais foram realizados de acordo com protocolos aprovados pelos Comitês Institucionais de Cuidados e Uso de Animais da Universidade de Yale.
1. Preparo dos animais, ferramentas, equipamentos de medição da pressão arterial e câmara de hipóxia
- Aclimatação animal.
NOTA: Os animais experimentais utilizados para este estudo foram camundongos machos C57BL/6 com 8 semanas de idade, pesando 25-27 g. Vários fatores devem ser considerados ao estimar o número de animais necessários para o experimento, incluindo mortalidade associada à cirurgia, complicações cirúrgicas inesperadas e morte súbita inesperada. Use pelo menos 10 camundongos por grupo para alcançar o poder estatístico e evitar estudos com baixo poder de potência.- Após a recepção, alojar os animais em gaiolas de roedores ventiladas (grupos de cinco animais por gaiola) providas de cama apropriada, ração para roedores e água. Deixar os animais aclimatarem-se ao novo ambiente (ciclo claro-escuro de 12 h a 18-20 °C) por pelo menos 3 dias.
- Atribua-os aleatoriamente aos seguintes grupos: Normóxia (Grupo 1), hipóxia (Grupo 2) e hipóxia + 7C1/let-7 miRNA (Grupo 3).
- Preparo de ferramentas cirúrgicas e equipamentos de medição de pressão arterial.
- Esterilizar todos os instrumentos cirúrgicos por autoclave (Figura 1A).
- Preparar uma plataforma de injeção improvisada com um cone nasal de anestesia caseiro (Figura 1B), compressas de sutura (Figura 1C) e equipamentos para o procedimento de HAP (Figura 1D-F).
- Cenário experimental para indução de hipertensão arterial pulmonar (HAP).
- Ajuste o tanque N2 , o sensor de oxigênio e a câmara de hipóxia semiselável (Figura 2A).
- Estabelecer um ponto de ajuste de 10% O2 no sensor de oxigênio e deixar o sistema atingir o estado estacionário (Figura 2B, C).
- Manter hipóxia (Grupo 2) e hipóxia + 7C1/let-7 miRNA (Grupo 3) em hipóxia (10% O2) por 3 semanas. Após 3 semanas de hipóxia, colocar os animais em condições normóxicas por 1 semana (Figura 2D). O grupo normóxico (Grupo 1) permanece em normóxia por 4 semanas.
NOTA: (1) 3 semanas de hipóxia seguidas de 1 semana de normóxia é um método bem estabelecido para o desenvolvimento de HAP e insuficiência cardíaca do ventrículo direito7. O sensor de oxigênio detecta a concentração de O2 dentro da câmara de hipóxia semiselável e a corrige infundindo gás N2 através do tubo de infusão de gás. - Inspecionar os animais diariamente durante toda a duração do experimento (3 semanas). Consulte um veterinário se os animais apresentarem sinais de angústia, como perda de peso dramática e dificuldade para respirar. Se a eutanásia for necessária para os animais em sofrimento grave, exclua o animal do estudo.
NOTA: A exposição à hipóxia causa perda de peso corporal de camundongos. Uma perda de 10% do peso corporal é normalmente usada como uma indicação confiável do desenvolvimento de HAP. - Evite a abertura extensa da câmara de hipóxia. Para limpeza de gaiolas, reposição de alimentos, troca de garrafas de água e administração de compostos, abra as câmaras por no máximo 1 hora por semana.
2. Injeção intravenosa em bolus pela veia jugular
- Preparo e anestesia de camundongos.
- Retire a hipóxia (Grupo 2) e a hipóxia + 7C1/let-7 miRNA (Grupo 3) das gaiolas de camundongos da câmara de hipóxia e remova suavemente o animal da gaiola.
NOTA: O regime posológico para 7C1/let-7 miRNA (1,5 mg/kg IV/dose) é de duas vezes por semana durante 4 semanas de tratamento. Recomenda-se que os investigadores retirem as gaiolas de hipóxia e hipóxia + tratamento composto da câmara de hipóxia durante a injeção IV para garantir que todos os animais recebam a mesma magnitude de exposição à hipóxia por intervalo de tempo. - Pesar o mouse usando uma balança de precisão e registrar seu peso (Figura 3A).
- Coloque o mouse em uma câmara de indução anestésica conectada ao vaporizador do anestésico e feche-o (Figura 3B). Fornecer suporte térmico e aplicar lubrificante ocular em ambos os olhos para evitar o ressecamento durante a anestesia. Expor o camundongo ao isoflurano a 3% até ficar inconsciente (Figura 3C-D).
- Retire o rato da câmara e raspe o pelo da mandíbula cranialmente até o meio do esterno caudalmente. Raspar lateralmente os pelos dos ângulos da mandíbula, pelas laterais do pescoço e em direção aos ombros (Figura 3E).
- Coloque o camundongo anestesiado com isoflurano em posição supina (barriga virada para cima) em uma plataforma de injeção sob um microscópio de dissecção. Manter a anestesia através de um cone nasal com isoflurano a 1,5% e segurar suavemente as quatro pernas com fita adesiva para imobilizar o corpo (Figura 3F).
- Aplique um estímulo nocivo (ou seja, pinça dos dedos) com pinça reta para garantir um nível adequado de anestesia. O camundongo anestesiado não deve responder à estimulação antes e durante todo o procedimento cirúrgico.
- Retire a hipóxia (Grupo 2) e a hipóxia + 7C1/let-7 miRNA (Grupo 3) das gaiolas de camundongos da câmara de hipóxia e remova suavemente o animal da gaiola.
- Preparação do agente injetor.
- Preparar um composto de injeção de dose única na dose de 1,5 mg/kg em condições estéreis.
NOTA: Aqueça o composto de injeção à temperatura ambiente (RT), uma vez que a injeção de substâncias frias pode causar desconforto e uma queda na temperatura corporal do rato (se isso não danificar o composto). A dose e a duração ideais do composto 7C1/let-7 miRNA utilizado neste estudo são baseadas em publicações anteriores 8,9. - Coloque a seringa estéril de uso único com o volume a ser injetado. Segure a seringa na vertical e avance o êmbolo para expelir o ar da seringa. Não reutilize a seringa.
- Limitar o volume de injeção a 200 μL num rato de 25 g para reduzir a incidência de hemodiluição e efeitos cardíacos anormais nos animais. Se for necessário um volume maior, divida o composto de injeção em duas injeções com um intervalo de 10 minutos.
- Preparar um composto de injeção de dose única na dose de 1,5 mg/kg em condições estéreis.
- Prepare o rato para injeção intravenosa.
- Esfregar suavemente a área cirúrgica três vezes com três rodadas alternadas de solução de iodopovidona e etanol a 70%. Administrar buprenorfina (0,05 mg/kg, SQ) 30 minutos antes do procedimento cirúrgico.
- Realizar um corte longitudinal de 0,5 cm levemente à direita da linha média do pescoço com lâmina de bisturi (Figura 3G).
- Utilizar pinça para separar o músculo e o tecido adiposo para localizar a veia jugular externa direita (Figura 3H).
NOTA: Gire os locais de injeção cada vez para evitar a formação de cicatriz. - Utilizar objetiva de alta potência para facilitar a visualização da área de injeção (Figura 3I).
- Injeção intravenosa
- Inserir uma agulha estéril 28 G na veia jugular com o bisel da agulha voltado para cima (Figura 3J, K).
NOTA: A injeção da veia caudal é uma alternativa à injeção da veia jugular. No entanto, esta técnica é difícil de realizar doses repetidas devido à variabilidade na profundidade da veia, cor da pele da cauda de camundongos e dureza da pele. - Pressione lentamente o êmbolo da seringa para injetar o composto na veia. Permitir que a agulha permaneça dentro da veia por mais 10 s para evitar o refluxo do injetante (Figura 3L).
NOTA: O corante azulado permite fácil visualização da injeção. Não inclua o corante ao injetar materiais de teste. Uma injeção imprecisa resultará no acúmulo de corante azulado ao redor do local da injeção intravenosa. - Retire a agulha e use um cotonete para pressionar o local da injeção para evitar sangramento (Figura 3M).
- Sutura da pele com fio 5-0 (Figura 3N). Após a cirurgia, mover o animal para uma área quente, limpa e seca e fornecer Meloxicam (1 mg/kg, SQ, q24h). Coloque o animal em uma gaiola de recuperação limpa, sem roupa de cama, mas o fundo coberto por um papel toalha.
NOTA: O rato deve estar acordado da anestesia e recuperar a consciência dentro de 5 minutos uma vez de volta à gaiola de recuperação. Monitore o mouse em busca de sinais de angústia. - Devolva os animais à sua gaiola de origem e coloque a gaiola do rato de volta na câmara de hipóxia.
NOTA: Todo o procedimento, desde anestesiar um camundongo até terminar a injeção da veia jugular, leva cerca de 10-15 minutos por um único experimentador. Para encurtar a exposição à normóxia em camundongos, recomenda-se que pelo menos dois pesquisadores colaborem para realizar um procedimento de injeção da veia jugular.
- Inserir uma agulha estéril 28 G na veia jugular com o bisel da agulha voltado para cima (Figura 3J, K).
3. Medida da pressão arterial
- Preparar instrumentos para medição da pressão arterial.
- Mergulhar a ponta do cateter 1.0 F em PBS pré-aquecido a 37 °C pelo menos 30 minutos antes da medida hemodinâmica (Figura 4A).
- Meça a distância do local de inserção do cateter até o local desejado na ponta do cateter. Por exemplo, a distância entre a aorta ascendente do camundongo até o meio do pescoço é de aproximadamente 1-1,2 cm. A distância entre o ventrículo direito do coração até o meio do pescoço é de aproximadamente 2,3-2,8 cm.
- Marque duas marcações de distância do cateter para fornecer uma indicação visual da profundidade de inserção (Figura 4B).
- Conecte o cateter ao transdutor de pressão, conecte o transdutor de pressão ao canal de entrada 1 do dispositivo de aquisição de dados, ligue a unidade de controle de pressão-volume e inicie o software de análise da pressão arterial de aquisição de dados. Crie um novo documento de análise da pressão arterial e defina o canal 1 para a pressão.
- Realizar uma calibração de pressão de acordo com o protocolo do fabricante. Deixe todo o setup estabilizar por pelo menos 5 min (Figura 4C).
- No software de análise de pressão arterial, selecione Conversão de unidades no menu suspenso Canal 1 (Figura 4D, seta vermelha).
- Defina os valores de conversão de unidades padrão (Figura 4E).
NOTA: A pressão arterial é representada como milímetros de mercúrio (mmHg). A saída de pressão padronizada da Unidade de Controle de Pressão é de 1 V por 100 mmHg. 25 mmHg corresponde a 0,25 V de saída e 100 mm Hg corresponde a 1 V de saída.
- Prepare o mouse para o procedimento de medição da pressão arterial.
- Anestesiar o camundongo com inalação de isoflurano a 3% através de um cone nasal.
- Aplique a pomada veterinária diretamente na superfície ocular dos olhos do rato para evitar o ressecamento, uma vez que o rato não pode fechar os olhos sob anestesia. Raspe o pelo do pescoço do rato enquanto estiver sob anestesia.
- Esfregar a região raspada com três rodadas alternadas de solução de iodopovidona e swab de etanol 70%. Coloque o camundongo anestesiado em decúbito dorsal em uma plataforma de injeção sob um microscópio de dissecção. Coloque o nariz do camundongo no cone nasal para manter a anestesia (isoflurano a 1,5%) durante todo o procedimento cirúrgico.
- Testar a resposta motora do camundongo anestesiado ao estímulo nocivo. O camundongo anestesiado não deve responder a um estímulo nocivo antes e durante a cirurgia.
NOTA: Anestésicos inaláveis (isoflurano) e injetáveis (cetamina/xilazina) podem diminuir a pressão arterial. Em geral, a anestesia inalatória com isoflurano tem um pequeno efeito na redução da pressão arterial do que a cetamina/xilazina. Portanto, o isoflurano é o anestésico inalatório preferido em relação à cetamina/xilazina. Alcançar a profundidade adequada da anestesia é fundamental para medidas hemodinâmicas precisas e reprodutíveis. O investigador precisa manter a profundidade da anestesia constante para cada camundongo.
- Cateterismo da aorta ascendente
- Aplique um estímulo nocivo (ou seja, pinça dos dedos) com pinça reta para garantir um nível adequado de anestesia. Fazer uma incisão mediana da pele desde a mandíbula até o esterno (Figura 5A).
- Separe as glândulas salivares e exponha a traqueia (Figura 5B).
- Utilizar pinça para desobstrução de partes moles ao longo dos vasos para exposição da artéria carótida direita e veia jugular externa direita (Figura 5C).
- Coloque 0,5 mL de PBS na cavidade para retardar o desenvolvimento de vasoespasmo ao manipular a artéria carótida.
- Isole cuidadosamente uma secção de 5 mm da artéria carótida direita. Coloque um pedaço de papel branco estéril sob o vaso como fundo para tornar a artéria mais visível (Figura 5D).
NOTA: Separe cuidadosamente o nervo vago (branco) da artéria e certifique-se de não cortar ou danificar o nervo ou a artéria. - Usando um 8-0 a sutura amarra um nó permanente para fechar a extremidade cranial do vaso (Figura 5E).
- Amarre um primeiro nó solto para ocluir temporariamente o fluxo sanguíneo da aorta. Em seguida, amarre um segundo nó solto entre as duas primeiras suturas (Figura 5F). O segundo nó solto será usado para fixar rapidamente o cateter após a colocação.
- Com agulha 25G, faça um orifício pequeno, grande o suficiente para passar o cateter, em linha com o vaso entre as ligaduras #3 e #1 (Figura 5G).
NOTA: As artérias carótidas transportam sangue oxigenado do coração e têm pressão muito alta. Se a artéria carótida for cortada, essa pressão fará com que o sangue jorre para fora (Figura 5H). - Segure o cateter a 1,5 centímetros da ponta e insira suavemente a ponta do cateter através do orifício da artéria (marca X). Apertar o nó de sutura média ao redor do cateter e do vaso que ainda permite a passagem do cateter (Figura 5I-J).
Observação : esta etapa requer prática. As complicações potenciais com esta etapa incluem sangramento no local de inserção do cateter e vasoespasmo. Quando ocorre sangramento, a perda de sangue da artéria sangrante reduz o volume sanguíneo, levando a uma queda grave da pressão arterial sistêmica. Devido à gravidade, o animal atingiu um desfecho humano e deve ser sacrificado. Para vasoespasmo induzido mecanicamente, geralmente ocorre durante a inserção do cateter causada por uma contração persistente dos vasos sanguíneos. Isso faz com que a abertura do vaso sanguíneo seja menor e impede o avanço do cateter para a artéria carótida. Não use força excessiva contra resistência para avançar o cateter. Quando a resistência ao vasoespasmo moderada ou grave for encontrada, tente novamente daqui a pouco ou use um cateter menor (por exemplo, 1,0 F). Microcirurgiões experientes podem atingir 100% de sucesso na cateterização da aorta ascendente. - Após o cateter passar o primeiro nó solto com a ponta do sensor, aperte o segundo nó solto com mais força para fixar o cateter e solte suavemente o primeiro nó solto (Figura 5K, L).
- Continuar a inserir o cateter em direção à aorta ascendente de acordo com a marcação no cateter (Figura 4B) até que a análise da pressão mostre um perfil de pressão arterial (Figura 5M). Registrar os dados de pressão arterial sistêmica (PAS) utilizando o sistema de aquisição de dados e o software.
- Soltar o nó de sutura média para permitir que o cateter seja arrancado (Figura 5N).
- Amarrar o nó de sutura média ao redor do vaso antes de retirar o cateter da artéria carótida (Figura 5O-P).
- Coloque o cateter em PBS.
- Cateterismo cardíaco direito.
- Isolar cuidadosamente a veia jugular externa direita do tecido conjuntivo circundante e ligar todos os pequenos ramos com 8-0 sutura (pontas de setas azuis) (Figura 6A).
NOTA: Para cateterismo cardíaco direito, o coração é comumente acessado através da veia jugular direita. - Usando um 8-0 suturar, amarrar um nó permanente para fechar a extremidade cranial do vaso (Figura 6B). Em seguida, amarre um nó solto na extremidade caudal do vaso (Figura 6C).
- Utilizar agulha 25G para fazer um pequeno orifício proximal ao nó permanente (Figura 6D).
NOTA: As veias jugulares transportam sangue desoxigenado para o coração e têm pressão baixa. Se a veia jugular for cortada, o sangue não jorrará (Figura 6D, E). - Segure o cateter e insira o cateter no corte da veia (marca X) (Figura 6E) e aperte o nó caudal ao redor do cateter e do vaso (Figura 6F).
- Empurre lenta e suavemente o cateter para o coração direito. Monitorar a profundidade da ponta do cateter com base na marca do cateter (Figura 4B).
NOTA: A avaliação da pressão sistólica do ventrículo direito (PSVD) em camundongos fechados de tórax é um desafio devido à complexa anatomia e estrutura do VD. Esta etapa requer um alto nível de especialização e muita prática. Nas mãos de um microcirurgião experiente, a taxa de sucesso do cateterismo do ventrículo direito pode se aproximar de 90%. - Avaliar a posição da ponta do cateter de acordo com o traçado de onda de pressão no software. Quando a ponta do cateter estiver no ventrículo direito, o monitor mostrará um traçado típico de PSVD (Figura 6G, H).
NOTA: Quando a forma das curvas de pressão pulmonar parece atípica (por exemplo, curvas espinhosas), isso implica o posicionamento incorreto do cateter. Ajuste a posição do cateter puxando suavemente o cateter um pouco para trás e, em seguida, avançando lentamente o cateter para uma posição mais central dentro do ventrículo direito. Para evitar a geração de artefatos nos dados da pesquisa, o investigador deve evitar tentativas prolongadas (não mais de 1 min) ou repetidas (não mais de duas tentativas) de cateterismo do ventrículo direito. - Mantenha o cateter imóvel e colete os dados por 5 min.
- Após o término do registro, retirar cuidadosamente o cateter e amarrar o nó caudal ao redor do vaso (Figura 6I). Coloque o cateter novamente em solução PBS.
NOTA: Após a conclusão do experimento, limpar o cateter com solução de enzimas digestivas a 1% de acordo com as instruções do fabricante. Além de avaliar o estado hemodinâmico, os investigadores podem colher os corações e os pulmões para o exame histopatológico da HAP. Para garantir a eficácia da dosagem múltipla em bolus IV, os investigadores podem isolar as células endoteliais pulmonares e medir os níveis de miRNA let-7.
- Isolar cuidadosamente a veia jugular externa direita do tecido conjuntivo circundante e ligar todos os pequenos ramos com 8-0 sutura (pontas de setas azuis) (Figura 6A).
4. Análise dos dados de pressão arterial
- Examine o registro da pressão arterial.
- Abra o arquivo de dados do software de análise de pressão arterial (PAH JOVE.adicht).
- No canal 1, selecione uma área que represente o sinal de pressão e coloque o Cursor da Forma de Onda no Pico (marca X) para medir a amplitude da pressão (Figura 7A).
- Determine a amplitude máxima da onda de pressão. Esta representa a pressão sistólica (Figura 7A, seta vermelha).
- Extraia a região de interesse (área cinza da Figura 7B ) da imagem pressionando Shift + Command + 3 (para Mac) ou Windows + Shift + S (para PC com Windows) e cole-a em um arquivo gráfico.
- Análise estatística dos dados de pressão arterial.
- Insira os dados individuais da pressão arterial do mouse no software de análise estatística.
- Realizar um teste t de Student não pareado para análise estatística de dois grupos de estudo (normóxia vs. hipóxia; hipóxia vs. hipóxia + 7C1/let-7 miRNA). Considere-se que as diferenças nos valores médios sejam tão significativas quanto p < 0,05.
Resultados
A anestesia muitas vezes reduz a pressão arterial. Portanto, uma dose mínima de anestesia foi utilizada para abolir os movimentos em resposta a um estímulo nocivo. O sucesso do acesso à câmara ventricular direita pode ser visualizado como as alterações da forma de onda hemodinâmica em diferentes regiões dos sistemas venosos (Figura 8).
Neste estudo, os camundongos foram aleatoriamente designados para o grupo normóxico (21% O2) (n = 10), grupo hipóxia (10% O2) ou grupo de tratamento hipóxia + 7C1/let-7 (n = 10). Para examinar o efeito do miRNA let-7 na supressão do desenvolvimento de HAP induzida por hipóxia, o miRNA 7C1/let-7 formulado foi administrado aos camundongos C57BL/6 por via intravenosa na dose de 1,5 mg/kg duas vezes por semana durante 4 semanas (Figura 2D).
4 semanas após a exposição à hipóxia ou normóxia, a PAS e a PSVD foram medidas em camundongos com tórax fechado. A Figura 9A mostra a curva representativa da pressão arterial dos grupos de tratamento com miRNA normóxico, hipóxia ou hipóxia + 7C1/let-7. Em comparação com os do grupo controle normóxia, a PSVD estava significativamente aumentada no grupo hipóxia. Além disso, em comparação com o grupo hipóxia, o tratamento com o composto 7C1/let-7 miRNA em camundongos resultou em redução significativa da PSVD (Figura 9B). A PAS não se alterou em nenhum dos grupos, o que está de acordo com relatos anteriores7. O miRNA 7C1/let-7 tem como alvo as células endoteliais e diminui a cascata de sinalização do TGFβ8. Os dados mostram que 7C1/let-7 miRNA 1,5 mg/kg é altamente eficaz na redução da pressão arterial no ventrículo direito, demonstrando a eficácia da dose múltipla IV em bolus.

Figura 1: Instrumentos cirúrgicos e equipamentos de medida da pressão arterial necessários para procedimentos de hipertensão arterial pulmonar. (A) Ferramentas cirúrgicas utilizadas para o procedimento de HAP. (B) Uma plataforma de injeção improvisada feita de uma almofada absorvente enrolada em torno de um rack de isopor de uma embalagem cônica de 50 mL. Fixação de um tubo de anestesia de 10 cm de comprimento à plataforma de injeção como cone nasal com tipo. (C) Bolsas de sutura. sutura 5-0 para fechamento da incisão e 8-0 sutura para ligadura. (D-F) Equipamento de medida da pressão arterial utilizado para o procedimento de HAP. Clique aqui para ver uma versão maior desta figura.

Figura 2: Cenário experimental para indução de HAP. (A) Fotografia da montagem do sistema hipóxico BioSpherix. Diferentes partes do sistema de indução são indicadas. (B-C) Sensor de oxigênio monitorando a concentração de O2 da câmara de hipóxia. (D) Cronograma experimental para tratamento com compostos de 7C1/let-7 miRNA e exposição ao nível de oxigênio para todos os grupos de animais durante a indução de HAP. Clique aqui para ver uma versão maior desta figura.
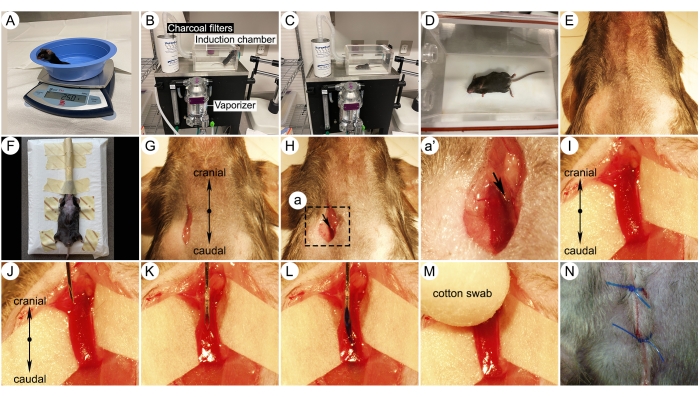
Figura 3: Fotografias dos principais passos cirúrgicos para injeção da veia jugular. (A) Rato em balança de peso. (B) Instalação do sistema de indução anestésica com roedores. Diferentes partes do sistema de indução são indicadas. (C-D) Fotos de um camundongo anestesiado com isoflurano em uma câmara de indução. (E) Pelo removido zona cirúrgica. (F) Um camundongo colocado em uma plataforma de injeção e respirou isoflurano a 1,5% através de um cone nasal de um vaporizador. (G) Incisão na pele para abordagem da veia jugular. (H) Dissecção cirúrgica da veia jugular externa direita. (I) Magnificação maior mostrando veia jugular direita isolada. Observe um papel branco embaixo do vaso, tornando a veia mais visível. (J-K) Inserção da agulha da veia jugular direita com o bisel para cima. (L) Injeção de um composto com corante azulado na veia jugular. (M) Aplicar pressão no local da injeção com um cotonete após a retirada da agulha. (N) Sutura da ferida com sutura 5-0. Clique aqui para ver uma versão maior desta figura.
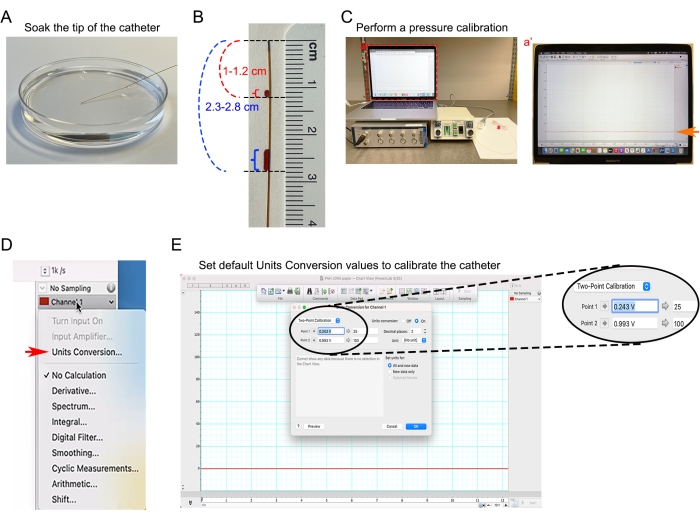
Figura 4: Calibração do cateter . (A) Embeber a ponta do cateter 1.0 F em PBS pré-aquecido a 37 °C. (B) Marcação de distância no cateter para ajudar a estimar a profundidade de inserção do cateter na aorta ascendente e ventrículo direito. (C) Equipamento de medida de pressão arterial submetido a calibração basal zero. (Ca') Captura de tela da análise de linha de base do cateter baseado em software de análise de pressão arterial. (D) No menu suspenso Canal 1 , selecione a caixa de diálogo Conversão de unidades no software de análise de pressão arterial. (E) Definir os valores padrão de Conversão de Unidades para converter o sinal de tensão de entrada em unidade mmHg. Clique aqui para ver uma versão maior desta figura.
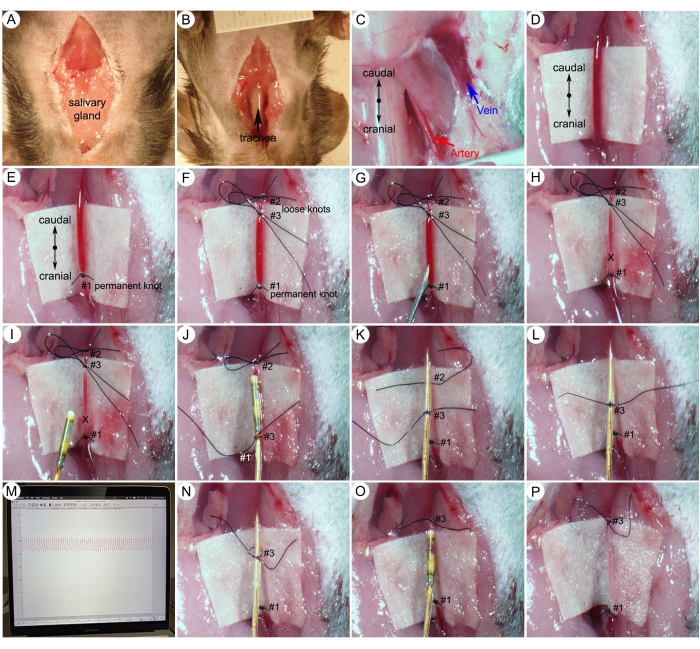
Figura 5: Procedimentos cirúrgicos para medidas da pressão arterial sistêmica (PAS). (A) Incisão mediana da mandíbula ao esterno sobre a pele do pescoço. (B) Separação da glândula salivar para exposição da traqueia. (C) Artéria carótida direita exposta e veia jugular externa direita após dissecção tecidual. (D) Secção isolada de 5 mm da artéria carótida. (E,F) Sutura de nó permanente na extremidade cranial e dois nós soltos na extremidade caudal. (G,H) Fazer um pequeno orifício (marca X) na artéria carótida apenas caudal ao nó permanente . (I) Inserção do cateter na artéria carótida. (J) Fixação do cateter com nó de sutura média . (K,L) Solte suavemente o primeiro nó solto . (M) Ondas representativas da pressão arterial. (N) Soltura do nó médio da sutura 4. (O,P) Apertar o nó de sutura média ao redor do vaso. Clique aqui para ver uma versão maior desta figura.
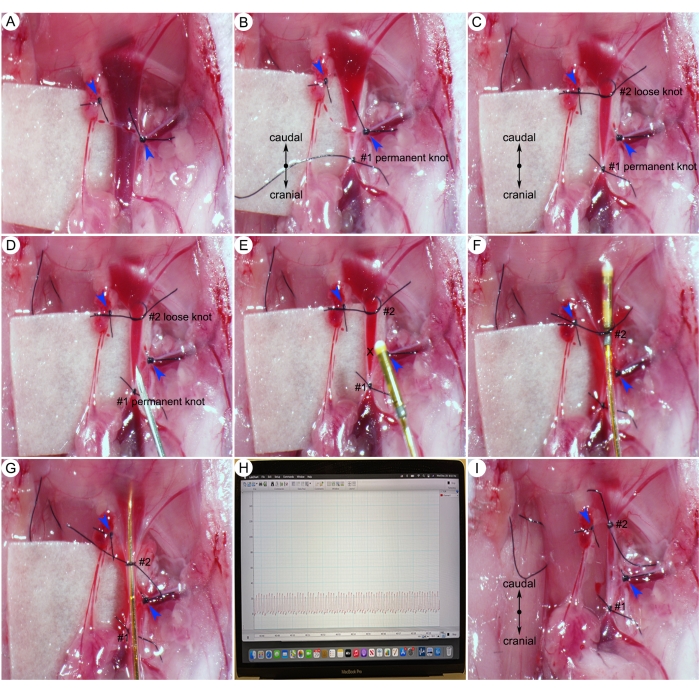
Figura 6: Procedimentos cirúrgicos para medidas da pressão sistólica do ventrículo direito (PSVD). (A) Ligadura dos pequenos ramos da veia jugular direita (cabeças de setas azuis). (B) Um nó permanente na extremidade cranial da veia jugular. (C) Um nó frouxo na extremidade caudal da veia jugular. (D) Confecção de um pequeno orifício na veia jugular direita caudal ao nó permanente . (E) Inserção de cateter na veia jugular através de pequeno orifício (marca X). (F) Apertar o nó caudal ao redor do cateter e do vaso. (G) Empurrar o cateter para o ventrículo direito do coração. (H) Representante RVSP. (I) Apertar o nó caudal ao redor do vaso. Clique aqui para ver uma versão maior desta figura.

Figura 7: Análise dos dados do software de análise da pressão arterial após o registro. (A) Usando o Cursor de Forma de Onda para medir a amplitude da pressão a partir dos dados brutos do software de análise da pressão arterial no Canal 1. (B) Extrair a região de interesse da imagem dos dados brutos do software de análise da pressão arterial. Clique aqui para ver uma versão maior desta figura.
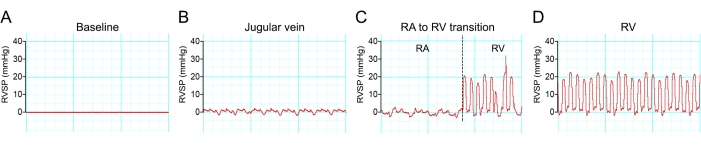
Figura 8: Transição da onda hemodinâmica durante o cateterismo do ventrículo direito. (A-D) Traços representativos de mudanças de pressão durante a cateterização do ventrículo direito de camundongo C57BL/6. Clique aqui para ver uma versão maior desta figura.

Figura 9: Representação da pressão arterial, figuras e análise dos dados. (A) Curvas representativas de PAS e RVSP em camundongos tratados com normóxia, hipóxia e hipóxia + 7C1/let-7 miRNA. (B) Gráficos resumo de PAS e RVSP em camundongos tratados com normóxia, hipóxia e hipóxia + 7C1/let-7 miRNA (NS: não significativo; **p < 0,01; ***p < 0,001; teste t bicaudal não pareado). N = 10 por grupo. Clique aqui para ver uma versão maior desta figura.
Discussão
Vários modelos animais de hipertensão pulmonar foram estabelecidos para mimetizar os eventos de resistência vascular pulmonar elevada em seres humanos. Dentre eles, o modelo de HAP induzida por hipóxia em camundongos tem sido amplamente utilizado para avaliar a eficácia de novas terapias experimentais para HAP. A pesquisa usando este modelo muitas vezes requer a administração de compostos para os ratos. Em comparação com outros protocolos publicados de injeção intravenosa (IV) e avaliação hemodinâmica invasiva, este método fornece ilustração visual e descrição detalhada.
Existem três etapas críticas para a execução bem-sucedida do procedimento e para a obtenção de medidas precisas e reprodutíveis da pressão arterial. Primeiro, verifique se a agulha da seringa está posicionada corretamente na veia jugular. A injeção incorreta da veia jugular pode resultar em injeção subcutânea. Em segundo lugar, garantir a profundidade suficiente da anestesia. A profundidade anestésica consistente em cada camundongo é importante para a geração de dados comparáveis entre os grupos. A anestesia muito profunda pode causar uma diminuição significativa nos níveis de pressão arterial. Além da anestesia inalatória com isoflurano, a injeção intraperitoneal de cetamina/xilazina é outro método anestésico amplamente utilizado para cirurgia em camundongos. Ambos os métodos têm vantagens e desvantagens. A anestesia inalatória com isoflurano tem várias vantagens sobre a cetamina/xilazina injetável, incluindo início rápido, ausência de drogas controladas, recuperação rápida e é muito mais fácil de controlar a profundidade da anestesia. As desvantagens são o custo do equipamento, o cheiro desagradável e a exposição humana aos gases anestésicos residuais. Terceiro, verifique se o cateter está dentro do ventrículo direito do coração. Tentativas prolongadas ou múltiplas tentativas fracassadas de cateterismo do ventrículo direito podem causar falsas leituras da pressão arterial.
A injeção IV em camundongos é predominantemente administrada através das veias laterais da cauda. Embora esta via seja de fácil acesso com agulhas, esta técnica é por vezes difícil de realizar múltiplas doses IV em bolus. Os dois maiores desafios na realização dessa técnica são a variabilidade na profundidade da veia e a dificuldade de visualização da agulha devido à cor da pele da cauda e dureza da pele de camundongos. Mais importante, não há nenhuma maneira de confirmar se todo o conteúdo da injeção entrou com sucesso na corrente sanguínea e não nos tecidos circundantes. A veia jugular é o local de acesso preferencial porque (1) é clinicamente relevante, (2) fornece confirmação visual da liberação de injetado na veia, (3) permite múltiplas injeções de um grupo de animais durante o curso do experimento e (4) essa técnica de injeção é segura e o procedimento não causa efeitos colaterais.
Existem três maneiras de registrar a pressão arterial em camundongos: (1) Pletismografia não invasiva do manguito de cauda10. Os sistemas permitem medições repetidas ao longo de um estudo longitudinal. (2) Radiotelemetria11. Os sistemas permitem o monitoramento da pressão arterial em tempo real em animais de laboratório acordados e em movimento livre. (3) Cateteres intra-arteriais invasivos12. Os sistemas permitem a mensuração aguda da PAS e da PSVD. Nesse protocolo, optou-se por um cateter de pressão para medidas sistêmicas de alta fidelidade e pressões do ventrículo direito. No entanto, esse método apresenta algumas limitações. Primeiro, o cateter de pressão e o equipamento de medida da pressão arterial são caros (Figura 1E-F). Segundo, é preciso anestesiar os animais, isso causa diminuição da pressão arterial. Terceiro, o cateterismo cardíaco direito é um procedimento terminal que não permite medidas seriadas. Quarto, o procedimento não é fácil de aprender mesmo por um microcirurgião bem treinado.
Uma vez registrada a pressão arterial, o pesquisador pode isolar os corações e os pulmões dos animais para caracterização histológica da HAP. Por exemplo, medidas da espessura da parede do ventrículo direito para hipertrofia ventricular direita e análise do vaso distal pulmonar muscularizado para remodelamento muscular da artéria pulmonar. Os dados mostram que o 7C1/let-7 miRNA é altamente eficaz na redução da pressão arterial pulmonar, demonstrando a eficácia de nossa dose múltipla IV em bolus. Além disso, os investigadores podem isolar as células endoteliais pulmonares do pulmão inteiro recém-isolado para avaliar a eficácia dos materiais injetados.
Em resumo, este protocolo fornece um procedimento passo-a-passo para a execução de múltiplas doses IV em bolus e monitorização hemodinâmica invasiva em um modelo de HAP induzida por hipóxia em camundongos. Os investigadores podem usar a injeção da veia jugular e as técnicas de cateterismo arterial/ventrículo direito descritas aqui para uma ampla variedade de modelos de roedores que requerem injeção intravenosa e monitorização hemodinâmica.
Divulgações
K Zsebo, M Simons e P-Y Chen são fundadores científicos e acionistas da VasoRx, Inc. Os demais autores declaram não haver interesses conflitantes.
Agradecimentos
Este trabalho foi apoiado, em parte, por um Microgrant Joint Biology Consortium fornecido sob NIH grant P30AR070253 (PYC), Cardiovascular Medical Research Education Fund (PYC), VasoRx, Inc HL152197 HL135582.
Materiais
| Name | Company | Catalog Number | Comments |
| 5-0 prolene suture pack | Ethicon | 8698G | for incision closure |
| 8-0 nylon suture pack | AROSurgical Instruments | T06A08N14-13 | for ligation |
| Anesthesia induction chamber | VETEQUIP | #941444 | Holds the animal during anesthesia exposure |
| Catheter Interface Cable PEC-4D | Millar | for connecting Millar Mikro-Tip catheter to PCU-2000 | |
| Charcoal canister filters | VETEQUIP | #931401 | to help remove waste anesthetic gases |
| Cotton swabs | McKesson | 24-106 | for applying pressure to the injection site to prevent bleeding |
| Fine scissors | Fine Science Tools | 14059-11 | Surgical tools |
| Insulin syringe 28 G | EXEL | 26027 | for jugular vein IV injection |
| Isoflurane | COVETRUS | #029405 | for mouse anesthesia |
| LabChart 8 Software | ADInstruments | for data analysis | |
| Mikro-Tip Pressure Catheter SPR-1000 (1.0 F) | Millar | for invasive blood pressure measurement | |
| Needle-25 G | BD | 305124 | for making a samll hole in a vessel |
| Oxygen controller ProOx Oxygen Sensor | BioSpherix | E702 | for oxygen concentration monitoring |
| PCU-2000 Pressure Control Unit | Millar | for connecting Millar Mikro-Tip catheter to PowerLab 4/35 | |
| PowerLab 4/35 | ADInstruments | for Data Acquisition. Investigator needs to connect the PowerLab 4/35 to a personal laptop containing LabChart 8 software for operation. | |
| Prism 8 | GraphPad | for statistics and scientific graphing | |
| Semisealable hypoxia chamber | BioSpherix | an artificial environment that simulates high-altitude conditions for animals | |
| Spring Scissors | Fine Science Tools | 15021-15 | Surgical tools |
| Tweezer Style 4 | Electron Microscopy Sciences | 0302-4-PO | Surgical tools |
| VasoRx compound 7C1/let-7 miRNA | VasoRx, Inc. | Lot# B2-L-16Apr | IV injection compound |
| VIP 3000 Veterinary Vaporizer | COLONIAL MEDICAL SUPPLY CO., INC. | for accurate anesthesia delivery |
Referências
- McLaughlin, V. V., McGoon, M. D. Pulmonary arterial hypertension. Circulation. 114 (1), 1417-1431 (2006).
- Hoeper, M. M., Humbert, M. The new haemodynamic definition of pulmonary hypertension: evidence prevails, finally. European Respiratory Journal. 53 (3), 1900038(2019).
- Chen, Y., et al. A novel rat model of pulmonary hypertension induced by mono treatment with SU5416. Hypertension Research. 43 (8), 754-764 (2020).
- Xiong, M., et al. Mouse model of experimental pulmonary hypertension: Lung angiogram and right heart catheterization. Pulmonary Circulation. 11 (4), 20458940211041512(2021).
- Kmiotek, E. K., Baimel, C., Gill, K. J. Methods for intravenous self administration in a mouse model. Journal of Visualized Experiments. (70), e3739(2012).
- Potus, F., Martin, A. Y., Snetsinger, B., Archer, S. L. Biventricular assessment of cardiac function and pressure-volume loops by closed-chest catheterization in mice. Journal of Visualized Experiments. (160), e61088(2020).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/hypoxia mouse model of pulmonary arterial hypertension. Experimental Models of Cardiovascular Diseases. 1816, 243-252 (2018).
- Chen, P. Y., et al. FGF regulates TGF-beta signaling and endothelial-to-mesenchymal transition via control of let-7 miRNA expression. Cell Reports. 2 (6), 1684-1696 (2012).
- Chen, P. Y., et al. Endothelial TGF-beta signalling drives vascular inflammation and atherosclerosis. Nature Metabolism. 1 (9), 912-926 (2019).
- Daugherty, A., Rateri, D., Hong, L., Balakrishnan, A. Measuring blood pressure in mice using volume pressure recording, a tail-cuff method. Journal of Visualized Experiments. (27), e1291(2009).
- Alam, M. A., Parks, C., Mancarella, S. Long-term blood pressure measurement in freely moving mice using telemetry. Journal of Visualized Experiments. (111), e53991(2016).
- Luo, F., et al. Invasive hemodynamic assessment for the right ventricular system and hypoxia-induced pulmonary arterial hypertension in mice. Journal of Visualized Experiments. (152), e60090(2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados