Method Article
Multiple intravenöse Bolusdosierung und invasive hämodynamische Beurteilung in einem Hypoxie-induzierten Mausmodell für pulmonalarterielle Hypertonie
In diesem Artikel
Zusammenfassung
Dieses Protokoll bietet ein schrittweises Verfahren zur Durchführung der mehrfachen intravenösen Bolusdosisverabreichung und invasiven hämodynamischen Überwachung bei Mäusen. Forscher können dieses Protokoll für zukünftiges therapeutisches Wirkstoff-Screening auf pulmonalarterielle Hypertonie verwenden.
Zusammenfassung
Die pulmonale arterielle Hypertonie (PAH) ist eine fortschreitende lebensbedrohliche Erkrankung, die hauptsächlich kleine Lungenarteriolen der Lunge betrifft. Derzeit gibt es keine Heilung für PAH. Es ist wichtig, neue Verbindungen zu entdecken, die zur Behandlung von PAK eingesetzt werden können. Das Maus-Hypoxie-induzierte PAH-Modell ist ein weit verbreitetes Modell für die PAH-Forschung. Dieses Modell rekapituliert die klinischen Manifestationen der PAH-Gruppe 3 beim Menschen und ist ein wichtiges Forschungsinstrument, um die Wirksamkeit neuer experimenteller Therapien für PAH zu bewerten. Die Forschung mit diesem Modell erfordert häufig die Verabreichung von Verbindungen an Mäuse. Bei einer Verbindung, die direkt in den Blutkreislauf verabreicht werden muss, ist die Optimierung der intravenösen (IV) Verabreichung ein wichtiger Bestandteil der experimentellen Verfahren. Idealerweise sollte das IV-Injektionssystem mehrere Injektionen über einen festgelegten Zeitraum ermöglichen. Obwohl das Maus-Hypoxie-induzierte PAH-Modell in vielen Labors sehr beliebt ist, ist es technisch schwierig, in diesem Modell eine mehrfache IV-Bolusdosierung und eine invasive hämodynamische Beurteilung durchzuführen. In diesem Protokoll präsentieren wir Schritt-für-Schritt-Anleitungen zur Durchführung einer mehrfachen IV-Bolusdosierung über die Halsvene der Maus und zur Durchführung einer arteriellen und rechten Ventrikelkatheterisierung zur hämodynamischen Beurteilung im Maus-Hypoxie-induzierten PAH-Modell.
Einleitung
Die pulmonalarterielle Hypertonie (PAH) ist definiert durch einen mittleren systolischen Druck der Pulmonalarterie von mehr als 20 mmHg im Ruhezustand 1,2. Es handelt sich um eine fortschreitende und tödliche Krankheit, die durch eine anhaltende Erhöhung des pulmonalarteriellen Drucks gekennzeichnet ist, die zu einer Überlastung des rechten Ventrikels und schließlich zum Tod aufgrund eines rechtsventrikulären Versagens führt1. Derzeit gibt es keine Heilung für PAH.
Die Verwendung von Tiermodellen der pulmonalen Hypertonie ist wichtig, um die Wirksamkeit experimenteller PAH-Therapien zu testen. Unter diesen Modellen hat das Maus-Hypoxie-induzierte PAH-Modell wichtige Einblicke in die Entwicklung der menschlichen PAH-Gruppe 3 geliefert 3,4. Die Forschung mit diesem Modell erfordert häufig die Verabreichung von Verbindungen an Mäuse, um die Wirksamkeit und Sicherheit der neuartigen Verbindung zu bewerten. Daher benötigen die Forscher ein detailliertes experimentelles Verfahren für die Dosierung von Verbindungen und hämodynamische Messungen, um die Konsistenz der Injektion und die Reproduzierbarkeit der Blutdruckmessung von Anfang bis Ende sicherzustellen.
In der Literatur wurde über Methoden zur intravenösen (IV) Injektion und Blutdruckmessung berichtet 5,6. Der Methodik fehlt es jedoch an visueller Illustration und detaillierter Beschreibung. Hier veranschaulichen wir die wichtigsten Schritte für eine erfolgreiche intravenöse Bolusinjektion und eine genaue Messung und Aufzeichnung des systemischen Blutdrucks und des Blutdrucks des rechten Ventrikels. Die hier vorgestellten Verfahren sind eine wichtige Ressource für Forscher, die sich für den intravenösen Weg der Verabreichungsplattform interessieren, um eine Behandlung für PAH zu entwickeln.
Protokoll
Alle Tierverfahren wurden nach Protokollen durchgeführt, die von den Institutional Animal Care and Use Committees der Yale University genehmigt wurden.
1. Vorbereitung von Tieren, Werkzeugen, Blutdruckmessgeräten und Hypoxiekammer
- Gewöhnung der Tiere.
HINWEIS: Die für diese Studie verwendeten Versuchstiere waren männliche, 8 Wochen alte C57BL/6-Mäuse mit einem Gewicht von 25-27 g. Bei der Schätzung der Anzahl der für das Experiment erforderlichen Tiere sollten mehrere Faktoren berücksichtigt werden, darunter operationsbedingte Mortalität, unerwartete chirurgische Komplikationen und plötzlicher unerwarteter Tod. Verwenden Sie mindestens 10 Mäuse pro Gruppe, um statistische Aussagekraft zu erreichen und leistungsschwache Studien zu vermeiden.- Halten Sie die Tiere nach Erhalt in belüfteten Nagetierkäfigen (Gruppen von fünf Tieren pro Käfig) unter, die mit geeigneter Einstreu, Nagetierfutter und Wasser ausgestattet sind. Lassen Sie die Tiere mindestens 3 Tage lang an die neue Umgebung (12 h Hell-Dunkel-Zyklus bei 18-20 °C) gewöhnen.
- Ordnen Sie sie nach dem Zufallsprinzip den folgenden Gruppen zu: Normoxie (Gruppe 1), Hypoxie (Gruppe 2) und Hypoxie + 7C1/let-7 miRNA (Gruppe 3).
- Vorbereitung von chirurgischen Instrumenten und Blutdruckmessgeräten.
- Sterilisieren Sie alle chirurgischen Instrumente durch Autoklavieren (Abbildung 1A).
- Bereiten Sie eine provisorische Injektionsplattform mit einem hausgemachten Anästhesie-Nasenkonus (Abbildung 1B), Nahtpackungen (Abbildung 1C) und Ausrüstung für das PAH-Verfahren vor (Abbildung 1D-F).
- Versuchsaufbau für die Induktion der pulmonalarteriellen Hypertonie (PAH).
- Stellen Sie den N2-Tank , den Sauerstoffsensor und die halbverschließbare Hypoxiekammer ein (Abbildung 2A).
- Stellen Sie einen Sollwert von 10 % O2 im Sauerstoffsensor ein und lassen Sie das System den stationären Zustand erreichen (Abbildung 2B, C).
- Hypoxie (Gruppe 2) und Hypoxie + 7C1/let-7 miRNA (Gruppe 3) Tiere 3 Wochen lang in Hypoxie (10% O2) halten. Nach 3 Wochen Hypoxie werden die Tiere 1 Woche lang normoxischen Bedingungen ausgesetzt (Abbildung 2D). Die normoxische Gruppe (Gruppe 1) bleibt 4 Wochen in Normoxie.
HINWEIS: (1) 3 Wochen Hypoxie, gefolgt von 1 Woche Normoxie, ist eine etablierte Methode zur Entwicklung von PAH und Herzinsuffizienz des rechten Ventrikels7. Der Sauerstoffsensor erkennt die O2 -Konzentration in der halbverschließbaren Hypoxiekammer und korrigiert sie, indem er N2 - Gas durch den Gasinfusionsschlauch infundiert. - Untersuchen Sie die Tiere täglich während der gesamten Dauer des Versuchs (3 Wochen). Konsultieren Sie einen Tierarzt, wenn die Tiere Anzeichen von Stress wie dramatischen Gewichtsverlust und Atembeschwerden aufweisen. Wenn Euthanasie für die Tiere in schwerer Not erforderlich ist, schließen Sie das Tier von der Studie aus.
HINWEIS: Hypoxie-Exposition führt zu Gewichtsverlust des Mauskörpers. Ein Verlust von 10 % Körpergewicht wird typischerweise als zuverlässiger Hinweis auf die Entwicklung von PAH verwendet. - Vermeiden Sie ein weites Öffnen der Hypoxiekammer. Öffnen Sie die Kammern für die Käfigreinigung, das Auffüllen von Futter, das Wechseln von Wasserflaschen und die Verabreichung von Verbindungen nicht länger als 1 Stunde pro Woche.
2. Intravenöse Bolusinjektion über die Halsvene
- Mausvorbereitung und Anästhesie.
- Nehmen Sie Hypoxie (Gruppe 2) und Hypoxie + 7C1/let-7 miRNA (Gruppe 3) Mauskäfige aus der Hypoxiekammer und entfernen Sie das Tier vorsichtig aus dem Käfig.
HINWEIS: Das Dosierungsschema für 7C1/let-7 miRNA (1,5 mg/kg IV/Dosis) beträgt zweimal pro Woche für 4 Wochen Behandlung. Es wird empfohlen, dass die Forscher während der IV-Injektion sowohl Hypoxie- als auch Hypoxie-+-Compound-Behandlungskäfige aus der Hypoxiekammer nehmen, um sicherzustellen, dass alle Tiere pro Zeitintervall die gleiche Hypoxie-Exposition erhalten. - Wiegen Sie die Maus mit einer Präzisionswaage und notieren Sie ihr Gewicht (Abbildung 3A).
- Legen Sie die Maus in eine Anästhesie-Induktionskammer, die mit dem Anästhesieverdampfer verbunden ist, und schließen Sie sie (Abbildung 3B). Bieten Sie thermische Unterstützung und tragen Sie Augengleitmittel auf beide Augen auf, um ein Austrocknen während der Betäubung zu verhindern. Setzen Sie die Maus 3% Isofluran aus, bis sie bewusstlos wird (Abbildung 3C-D).
- Nehmen Sie die Maus aus der Kammer und rasieren Sie das Fell vom Kiefer kranial bis zur Mitte des Brustbeins kaudal. Rasieren Sie das Fell seitlich von den Kieferwinkeln über die Seiten des Halses bis hin zu den Schultern (Abbildung 3E).
- Legen Sie die mit Isofluran betäubte Maus in Rückenlage (Bauchseite nach oben) auf eine Injektionsplattform unter einem Präpariermikroskop. Halten Sie die Anästhesie über einen Nasenkonus mit 1,5% Isofluran aufrecht und halten Sie die vier Beine vorsichtig mit Klebeband fest, um den Körper ruhigzustellen (Abbildung 3F).
- Wenden Sie einen schädlichen Reiz (z. B. Zehenkneifen) mit einer geraden Pinzette an, um ein angemessenes Maß an Anästhesie zu gewährleisten. Die anästhesierte Maus sollte vor und während des chirurgischen Eingriffs nicht auf die Stimulation ansprechen.
- Nehmen Sie Hypoxie (Gruppe 2) und Hypoxie + 7C1/let-7 miRNA (Gruppe 3) Mauskäfige aus der Hypoxiekammer und entfernen Sie das Tier vorsichtig aus dem Käfig.
- Vorbereitung des Injektionsmittels.
- Bereiten Sie eine Einzeldosis-Injektionsverbindung in einer Dosis von 1,5 mg/kg unter sterilen Bedingungen vor.
Anmerkungen: Erwärmen Sie die Injektionsmasse auf Raumtemperatur (RT), da die Injektion kalter Substanzen zu Beschwerden und einem Abfall der Körpertemperatur der Maus führen kann (wenn dies die Verbindung nicht beschädigt). Die optimale Dosis und Dauer der in dieser Studie verwendeten Verbindung 7C1/let-7 miRNA basieren auf früheren Veröffentlichungen 8,9. - Laden Sie die sterile Einmalspritze mit dem zu injizierenden Volumen. Halten Sie die Spritze aufrecht und schieben Sie den Kolben vor, um die Luft aus der Spritze auszustoßen. Verwenden Sie die Spritze nicht wieder.
- Begrenzen Sie das Injektionsvolumen auf 200 μl in einer 25-g-Maus, um das Auftreten von Hämodilution und abnormalen kardialen Auswirkungen auf die Tiere zu reduzieren. Wenn ein größeres Volumen benötigt wird, teilen Sie die Injektionsmasse im Abstand von 10 min in zwei Injektionen auf.
- Bereiten Sie eine Einzeldosis-Injektionsverbindung in einer Dosis von 1,5 mg/kg unter sterilen Bedingungen vor.
- Bereiten Sie die Maus für die IV-Injektion vor.
- Schrubben Sie den Operationsbereich dreimal sanft mit drei abwechselnden Runden Povidon-Jod-Lösung und 70% Ethanol. Verabreichen Sie Buprenorphin (0,05 mg/kg, SQ) 30 Minuten vor dem chirurgischen Eingriff.
- Machen Sie mit einer Skalpellklinge einen 0,5 cm langen Längsschnitt leicht rechts von der Mittellinie des Halses (Abbildung 3G).
- Verwenden Sie eine Pinzette, um den Muskel und das Fettgewebe zu trennen, um die rechte äußere Halsvene zu lokalisieren (Abbildung 3H).
HINWEIS: Drehen Sie die Injektionsstellen jedes Mal, um Narbenbildung zu vermeiden. - Verwenden Sie eine Hochleistungsobjektivlinse, um eine einfache Visualisierung des Injektionsbereichs zu ermöglichen (Abbildung 3I).
- IV-Injektion
- Führen Sie eine sterile 28-G-Nadel mit der Nadelschräge nach oben in die Halsvene ein (Abbildung 3J, K).
HINWEIS: Die Schwanzveneninjektion ist eine Alternative zur Jugularveneninjektion. Diese Technik ist jedoch aufgrund der Variabilität in der Venentiefe, der Hautfarbe des Mäuseschwanzes und der Hauthärte schwierig durchzuführen. - Drücken Sie langsam auf den Spritzenkolben, um die Verbindung in die Vene zu injizieren. Lassen Sie die Nadel weitere 10 s in der Vene, um einen Rückfluss des Injektors zu verhindern (Abbildung 3L).
HINWEIS: Der bläuliche Farbstoff ermöglicht eine einfache Visualisierung der Injektion. Fügen Sie den Farbstoff beim Einspritzen von Testmaterialien nicht hinzu. Eine ungenaue Injektion führt zur Ansammlung von bläulichem Farbstoff um die IV-Injektionsstelle. - Entfernen Sie die Nadel und üben Sie mit einem Wattestäbchen Druck auf die Injektionsstelle aus, um Blutungen zu vermeiden (Abbildung 3M).
- Vernähen Sie die Haut mit einer 5-0-Naht (Abbildung 3N). Nach der Operation bringen Sie das Tier an einen warmen, sauberen und trockenen Ort und geben Sie Meloxicam (1 mg/kg, SQ, alle 24 Stunden). Setzen Sie das Tier in einen sauberen Auffangkäfig ohne Einstreu, aber mit einem Papiertuch bedeckt.
HINWEIS: Die Maus sollte aus der Narkose wach sein und innerhalb von 5 Minuten das Bewusstsein wiedererlangen, sobald sie wieder in den Aufwachkäfig zurückkehrt. Überwachen Sie die Maus auf Anzeichen von Not. - Bringen Sie die Tiere in ihren Heimatkäfig zurück und stellen Sie den Mäusekäfig wieder in die Hypoxiekammer.
HINWEIS: Das gesamte Verfahren, von der Betäubung einer Maus bis zur Beendigung der Injektion der Halsvene, dauert etwa 10-15 Minuten durch einen einzelnen Experimentator. Um die Normoxie-Exposition bei Mäusen zu verkürzen, wird empfohlen, dass mindestens zwei Forscher zusammenarbeiten, um ein Injektionsverfahren in die Halsvene durchzuführen.
- Führen Sie eine sterile 28-G-Nadel mit der Nadelschräge nach oben in die Halsvene ein (Abbildung 3J, K).
3. Blutdruckmessung
- Bereiten Sie Instrumente für die Blutdruckmessung vor.
- Weichen Sie die Spitze des 1,0 F-Katheters mindestens 30 Minuten vor der hämodynamischen Messung in 37 °C vorgewärmtem PBS ein (Abbildung 4A).
- Messen Sie den Abstand von der Kathetereinführstelle zur gewünschten Position der Katheterspitze. Zum Beispiel beträgt der Abstand zwischen der aufsteigenden Aorta der Maus und der Mitte des Halses etwa 1-1,2 cm. Der Abstand zwischen dem rechten Ventrikel des Herzens und der Mitte des Halses beträgt ungefähr 2,3-2,8 cm.
- Markieren Sie zwei Katheterabstandsmarkierungen, um eine visuelle Anzeige der Einführtiefe zu erhalten (Abbildung 4B).
- Schließen Sie den Katheter an den Druckwandler an, schließen Sie den Druckaufnehmer an den Eingangskanal 1 des Datenerfassungsgeräts an, schalten Sie die Druck-Volumen-Steuereinheit ein und starten Sie die Datenerfassungs-Blutdruckanalysesoftware. Erstellen Sie ein neues Blutdruckanalysedokument und stellen Sie Kanal 1 für den Druck ein.
- Führen Sie eine Druckkalibrierung gemäß dem Protokoll des Herstellers durch. Lassen Sie das gesamte Setup mindestens 5 Minuten lang stabilisieren (Abbildung 4C).
- Wählen Sie in der Blutdruckanalysesoftware die Option Einheitenumrechnung aus dem Dropdown-Menü Kanal 1 (Abbildung 4D, roter Pfeil).
- Legen Sie die Standardwerte für die Umrechnung von Einheiten fest (Abbildung 4E).
HINWEIS: Der Blutdruck wird als Millimeter Quecksilbersäule (mmHg) dargestellt. Der standardisierte Druckausgang der Druckregeleinheit beträgt 1 V pro 100 mmHg. 25 mmHg entsprechen 0,25 V Ausgang und 100 mm Hg entsprechen 1 V Ausgang.
- Bereiten Sie die Maus auf das Blutdruckmessverfahren vor.
- Betäuben Sie die Maus mit 3% Isofluran-Inhalation durch einen Nasenkegel.
- Tragen Sie die Veterinärsalbe direkt auf die Augenoberfläche der Mausaugen auf, um Trockenheit zu vermeiden, da die Maus ihre Augen unter Narkose nicht schließen kann. Rasieren Sie das Fell vom Hals der Maus, während Sie unter Narkose stehen.
- Schrubben Sie den rasierten Bereich mit drei abwechselnden Runden Povidon-Jod-Lösung und 70%igem Ethanoltupfer. Legen Sie die betäubte Maus in Rückenlage auf eine Injektionsplattform unter einem Seziermikroskop. Setzen Sie die Nase der Maus in den Nasenkonus ein, um die Anästhesie (1,5 % Isofluran) während des gesamten chirurgischen Eingriffs aufrechtzuerhalten.
- Testen Sie die motorische Reaktion der betäubten Maus auf den schädlichen Reiz. Die betäubte Maus sollte vor und während der Operation nicht auf einen schädlichen Reiz reagieren.
HINWEIS: Inhalierbare (Isofluran) und injizierbare (Ketamin/Xylazin) Anästhetika können den Blutdruck senken. Im Allgemeinen hat die Isofluran-Inhalationsanästhesie einen leichten Einfluss auf die Senkung des Blutdrucks als Ketamin/Xylazin. Daher ist Isofluran das bevorzugte Inhalationsanästhetikum gegenüber Ketamin/Xylazin. Das Erreichen der geeigneten Anästhesietiefe ist entscheidend für genaue und reproduzierbare hämodynamische Messungen. Der Untersucher muss die Narkosetiefe für jede Maus konstant halten.
- Aufsteigende Aortenkatheterisierung
- Wenden Sie einen schädlichen Reiz (z. B. Zehenkneifen) mit einer geraden Pinzette an, um ein angemessenes Maß an Anästhesie zu gewährleisten. Machen Sie einen Mittellinienschnitt der Haut vom Unterkiefer bis zum Brustbein (Abbildung 5A).
- Trennen Sie die Speicheldrüsen und legen Sie die Luftröhre frei (Abbildung 5B).
- Verwenden Sie eine Pinzette, um das Weichgewebe entlang der Gefäße zu reinigen, um die rechte Halsschlagader und die rechte äußere Halsvene freizulegen (Abbildung 5C).
- Geben Sie 0,5 ml PBS in die Kavität, um die Entwicklung von Vasospasmus zu verlangsamen und gleichzeitig die Halsschlagader zu manipulieren.
- Isolieren Sie vorsichtig einen 5 mm langen Abschnitt der rechten Halsschlagader. Legen Sie ein Stück steriles weißes Papier als Hintergrund unter das Gefäß, um die Arterie besser sichtbar zu machen (Abbildung 5D).
HINWEIS: Trennen Sie den Vagusnerv (weiß) vorsichtig von der Arterie und stellen Sie sicher, dass der Nerv oder die Arterie nicht durchtrennt oder beschädigt wird. - Mit einem 8-0 Nahtbinden Sie einen dauerhaften Knoten (#1), um das kraniale Ende des Gefäßes zu verschließen (Abbildung 5E).
- Binden Sie einen ersten losen Knoten (#2), um den Blutfluss aus der Aorta vorübergehend zu verschließen. Binden Sie dann einen zweiten losen Knoten (#3) zwischen den ersten beiden Nähten (Abbildung 5F). Der zweite lose Knoten (#3) wird verwendet, um den Katheter nach dem Platzieren schnell zu sichern.
- Machen Sie mit einer 25-g-Nadel ein kleines Loch, das groß genug ist, um den Katheter zu passieren, in einer Linie mit dem Gefäß zwischen den Ligaturen #3 und #1 (Abbildung 5G).
HINWEIS: Die Halsschlagadern transportieren sauerstoffreiches Blut aus dem Herzen und haben einen sehr hohen Druck. Wenn die Halsschlagader durchtrennt wird, führt dieser Druck dazu, dass das Blut herausspritzt (Abbildung 5H). - Halten Sie den Katheter 1,5 Zoll von der Spitze entfernt und führen Sie die Spitze des Katheters vorsichtig durch das Loch der Arterie (X-Markierung) ein. Ziehen Sie den mittleren Nahtknoten (#3) um den Katheter und das Gefäß fest, das noch die Passage des Katheters ermöglicht (Abbildung 5I-J).
HINWEIS: Dieser Schritt erfordert Übung. Zu den möglichen Komplikationen bei diesem Schritt gehören Blutungen an der Kathetereinführstelle und Vasospasmus. Wenn Blutungen auftreten, verringert der Blutverlust aus der blutenden Arterie das Blutvolumen, was zu einem starken Abfall des systemischen Blutdrucks führt. Aufgrund der Schwere hat das Tier einen humanen Endpunkt erreicht und muss eingeschläfert werden. Beim mechanisch induzierten Vasospasmus tritt er in der Regel beim Einführen des Katheters auf, der durch eine anhaltende Kontraktion der Blutgefäße verursacht wird. Dadurch wird die Blutgefäßöffnung kleiner und ein Vorschieben des Katheters in die Halsschlagader verhindert. Wenden Sie keine übermäßige Kraft gegen Widerstand an, um den Katheter vorzuschieben. Wenn eine mittelschwere oder schwere Vasospasmusresistenz auftritt, versuchen Sie es nach kurzer Zeit erneut oder verwenden Sie einen kleineren Katheter (z. B. 1,0 F). Erfahrene Mikrochirurgen können 100%ige Erfolgsquoten bei der aufsteigenden Aortenkatheterisierung erzielen. - Nachdem der Katheter den ersten losen Knoten (#2) mit der Sensorspitze passiert hat, befestigen Sie den zweiten losen Knoten (#3) fester, um den Katheter zu sichern, und lösen Sie vorsichtig den ersten losen Knoten (#2) (Abbildung 5K, L).
- Führen Sie den Katheter gemäß der Markierung auf dem Katheter weiter in Richtung der aufsteigenden Aorta ein (Abbildung 4B), bis die Druckanalyse ein arterielles Blutdruckprofil zeigt (Abbildung 5M). Zeichnen Sie systemische Blutdruckdaten (SBP) mit dem Datenerfassungssystem und der Software auf.
- Lösen Sie den mittleren Nahtknoten (#3), damit der Katheter herausgezogen werden kann (Abbildung 5N).
- Binden Sie den mittleren Nahtknoten (#3) um das Gefäß, bevor Sie den Katheter aus der Halsschlagader ziehen (Abbildung 5O-P).
- Legen Sie den Katheter in PBS.
- Rechtsherzkatheterisierung.
- Isolieren Sie die rechte äußere Halsvene vorsichtig vom umgebenden Bindegewebe und ligieren Sie alle kleinen Äste mit 8-0 Naht (blaue Pfeilspitzen) (Abbildung 6A).
HINWEIS: Bei der Rechtsherzkatheteruntersuchung wird das Herz üblicherweise über die rechte Halsvene erreicht. - Mit einem 8-0 Nähten Sie einen dauerhaften Knoten (#1), um das kraniale Ende des Gefäßes zu verschließen (Abbildung 6B). Binden Sie dann einen losen Knoten (#2) am kaudalen Ende des Gefäßes (Abbildung 6C).
- Verwenden Sie eine 25-g-Nadel, um ein kleines Loch proximal zum permanenten Knoten (#1) zu bohren (Abbildung 6D).
HINWEIS: Jugularvenen transportieren sauerstoffarmes Blut zum Herzen und haben einen niedrigen Druck. Wenn die Halsvene durchtrennt wird, spritzt das Blut nicht heraus (Abbildung 6D, E). - Halten Sie den Katheter fest und führen Sie den Katheter in den Venenschnitt (X-Markierung) ein (Abbildung 6E) und ziehen Sie den kaudalen Knoten (#2) um den Katheter und das Gefäß fest (Abbildung 6F).
- Schieben Sie den Katheter langsam und sanft in das rechte Herz. Überwachen Sie die Tiefe der Katheterspitze anhand der Kathetermarkierung (Abbildung 4B).
HINWEIS: Die Beurteilung des rechtsventrikulären systolischen Drucks (RVSP) bei Mäusen mit geschlossenem Brustkorb ist aufgrund der komplexen Anatomie und Struktur des RV eine Herausforderung. Dieser Schritt erfordert ein hohes Maß an Fachwissen und viel Übung. In den Händen eines erfahrenen Mikrochirurgen kann die Erfolgsrate für die Katheterisierung des rechten Ventrikels bei 90 % liegen. - Beurteilen Sie die Position der Katheterspitze anhand der Druckwellenverfolgung in der Software. Wenn sich die Spitze des Katheters im rechten Ventrikel befindet, zeigt der Monitor eine typische RVSP-Verfolgung an (Abbildung 6G, H).
HINWEIS: Wenn die Form von Lungendruckkurven untypisch aussieht (z. B. stachelige Kurven), deutet dies auf eine falsche Positionierung des Katheters hin. Passen Sie die Katheterposition an, indem Sie den Katheter vorsichtig ein wenig nach hinten ziehen und dann den Katheter langsam in eine zentralere Position im rechten Ventrikel bringen. Um die Erzeugung von Artefakten in Forschungsdaten zu vermeiden, sollte der Prüfarzt längere (nicht mehr als 1 Minute) oder wiederholte Versuche (nicht mehr als zwei Versuche) bei der Katheterisierung des rechten Ventrikels vermeiden. - Halten Sie den Katheter unbeweglich und sammeln Sie die Daten 5 Minuten lang.
- Ziehen Sie nach Abschluss der Aufnahme den Katheter vorsichtig heraus und binden Sie den kaudalen Knoten (#2) um das Gefäß (Abbildung 6I). Legen Sie den Katheter wieder in die PBS-Lösung.
Anmerkungen: Reinigen Sie den Katheter nach Abschluss des Experiments mit 1% iger Verdauungsenzymlösung gemäß den Anweisungen des Herstellers. Zusätzlich zur Beurteilung des hämodynamischen Status können die Forscher die Herzen und die Lunge für die histopathologische PAH-Untersuchung entnehmen. Um die Wirksamkeit der mehrfachen IV-Bolusdosierung sicherzustellen, können die Forscher Lungenendothelzellen isolieren und let-7-miRNA-Spiegel messen.
- Isolieren Sie die rechte äußere Halsvene vorsichtig vom umgebenden Bindegewebe und ligieren Sie alle kleinen Äste mit 8-0 Naht (blaue Pfeilspitzen) (Abbildung 6A).
4. Analyse von Blutdruckdaten
- Untersuchen Sie die Blutdruckaufzeichnung.
- Öffnen Sie die Datendatei der Blutdruckanalysesoftware (PAH JOVE.adicht).
- Wählen Sie in Kanal 1 einen Bereich aus, der das Drucksignal darstellt, und platzieren Sie den Wellenformcursor auf dem Peak (X-Markierung), um die Druckamplitude zu messen (Abbildung 7A).
- Bestimmen Sie die maximale Amplitude der Druckwelle. Dies stellt den systolischen Druck dar (Abbildung 7A, roter Pfeil).
- Extrahieren Sie den interessierenden Bereich (Abbildung 7B grauer Bereich) aus dem Bild, indem Sie Umschalt + Befehl + 3 (für Mac) oder Windows + Umschalt + S (für Windows-PC) drücken und in eine Grafikdatei einfügen.
- Statistische Analyse von Blutdruckdaten.
- Geben Sie die einzelnen Blutdruckdaten der Maus in eine statistische Analysesoftware ein.
- Führen Sie einen ungepaarten Student's t-Test zur statistischen Analyse von zwei Studiengruppen durch (Normoxie vs. Hypoxie; Hypoxie vs. Hypoxie + 7C1/let-7 miRNA). Betrachten Sie die Unterschiede in den Mittelwerten als so signifikant wie p < 0,05.
Ergebnisse
Anästhesie senkt oft den Blutdruck. Daher wurde eine minimale Dosis Anästhesie verwendet, um die Bewegungen als Reaktion auf einen schädlichen Reiz aufzuheben. Ein erfolgreicher rechtsventrikulärer Kammerzugang kann visualisiert werden, wenn sich die hämodynamische Wellenform in verschiedenen Regionen des Venensystems ändert (Abbildung 8).
In dieser Studie wurden die Mäuse nach dem Zufallsprinzip der normoxischen (21% O2) Gruppe (n = 10), der Hypoxiegruppe (10% O2) (n = 10) oder der Hypoxie + 7C1/let-7-Behandlungsgruppe (n = 10) zugeordnet. Um die Wirkung von let-7 miRNA bei der Unterdrückung der Hypoxie-induzierten PAH-Entwicklung zu untersuchen, wurde den C57BL/6-Mäusen die formulierte 7C1/let-7 miRNA 4 Wochen lang intravenös in einer Dosis von 1,5 mg/kg zweimal pro Woche verabreicht (Abbildung 2D).
4 Wochen nach Exposition gegenüber Hypoxie oder Normoxie wurden SBP und RVSP bei einer Maus mit geschlossenem Brustkorb gemessen. Abbildung 9A zeigt die repräsentative Blutdruckkurve aus den Behandlungsgruppen Normoxie, Hypoxie oder Hypoxie + 7C1/let-7 miRNA. Im Vergleich zu denen in der Normoxie-Kontrollgruppe war RVSP in der Hypoxie-Gruppe signifikant erhöht. Darüber hinaus führte die Behandlung mit 7C1/let-7 miRNA-Verbindung bei Mäusen im Vergleich zur Hypoxie-Gruppe zu einer signifikant verringerten RVSP (Abbildung 9B). SBP hat sich in keiner Gruppe verändert, was mit den vorherigen Berichten übereinstimmt7. 7C1/let-7 miRNA zielt auf Endothelzellen ab und verringert die TGFβ-Signalkaskade8. Die Daten zeigen, dass 7C1/let-7 miRNA 1,5 mg/kg hochwirksam bei der Senkung des Blutdrucks im rechten Ventrikel ist, was die Wirksamkeit der mehrfachen IV-Bolusdosierung demonstriert.

Abbildung 1: Chirurgische Instrumente und Blutdruckmessgeräte, die für Verfahren zur pulmonalarteriellen Hypertonie erforderlich sind. (A) Chirurgische Instrumente, die für das PAH-Verfahren verwendet werden. (B) Eine behelfsmäßige Injektionsplattform aus einem absorbierenden Pad, das um ein Styroporgestell aus einer konischen 50-ml-Packung gewickelt ist. Anbringen eines 10 cm langen Anästhesieschlauchs an der Injektionsplattform als Nasenkonus mit Typ. (C) Nahtpackungen. 5-0 Naht für Inzisionsverschluss und 8-0 Naht für die Ligatur. (D-F) Blutdruckmessgeräte, die für das PAH-Verfahren verwendet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Versuchsaufbau für die PAK-Induktion. (A) Foto des Aufbaus des hypoxischen BioSpherix-Systems. Verschiedene Teile des Induktionssystems sind angezeigt. (B-C) Sauerstoffsensor zur Überwachung der HypoxiekammerO 2 -Konzentration. (D) Experimenteller Zeitplan für die Behandlung mit 7C1/let-7 miRNA-Verbindungen und die Sauerstoffgehaltsexposition für alle Tiergruppen während der PAK-Induktion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
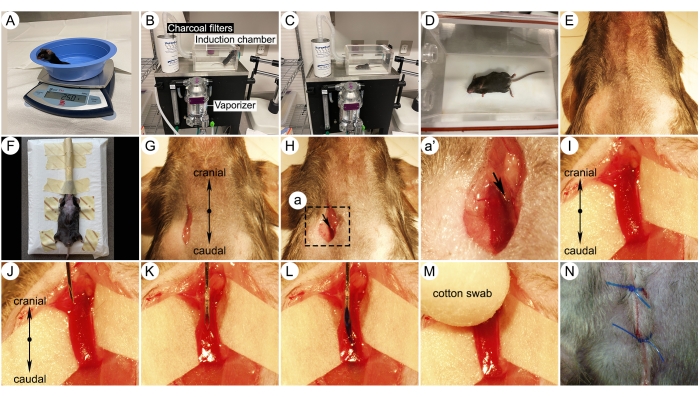
Abbildung 3: Fotos der wichtigsten chirurgischen Schritte für die Injektion von Halsvenen. (A) Maus auf einer Waage. (B) Einrichtung des Anästhesie-Induktionssystems für Nagetiere. Verschiedene Teile des Induktionssystems sind angezeigt. (C-D) Bilder einer Isofluran-betäubten Maus in einer Induktionskammer. (E) Fell entfernt Operationszone. (F) Eine Maus, die auf eine Injektionsplattform gelegt wurde und 1,5% Isofluran durch einen Nasenkegel aus einem Vaporizer einatmete. (G) Hautschnitt für den Zugang zur Halsvene. (H) Chirurgische Dissektion der rechten Vena jugularis externa. (I) Bildgebung mit höherer Vergrößerung, die die isolierte rechte Halsvene zeigt. Beachten Sie ein weißes Papier unter dem Gefäß, das die Vene besser sichtbar macht. (J-K) Nadeleinführung der rechten Halsvene mit der Abschrägung nach oben. (L) Injektion einer Verbindung mit bläulichem Farbstoff in die Halsvene. (M) Ausüben von Druck auf die Injektionsstelle mit einem Wattestäbchen nach dem Zurückziehen der Nadel. (N) Vernähen der Wunde mit einer 5-0-Naht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
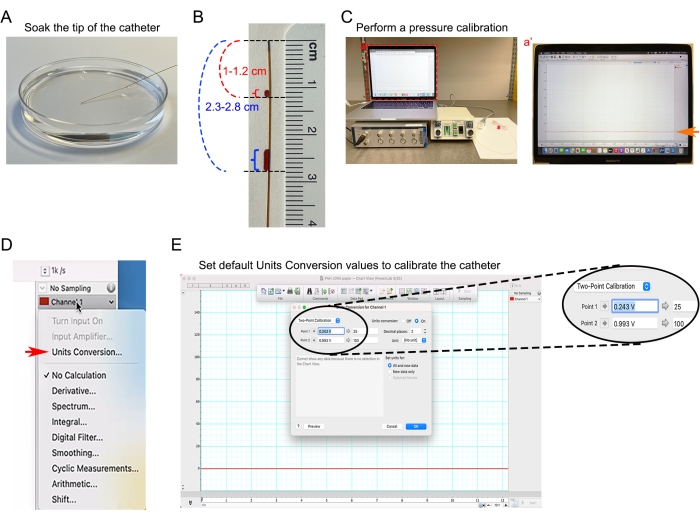
Abbildung 4: Katheterkalibrierung. (A) Einweichen der 1,0 F Katheterspitze in 37 °C vorgewärmtem PBS. (B) Abstandsmarkierungen auf dem Katheter zur Abschätzung der Einführtiefe des Katheters in die aufsteigende Aorta und den rechten Ventrikel. (C) Blutdruckmessgeräte, die einer Null-Basiskalibrierung unterzogen werden. (Ca') Screenshot der auf Blutdruckanalysesoftware basierenden Katheter-Baseline-Analyse. (D) Wählen Sie im Dropdown-Menü Kanal 1 das Dialogfeld Einheitenumrechnung in der Blutdruckanalysesoftware. (E) Festlegen der Standardwerte für die Einheitenkonvertierung zur Umwandlung des Eingangsspannungssignals in mmHg-Einheiten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
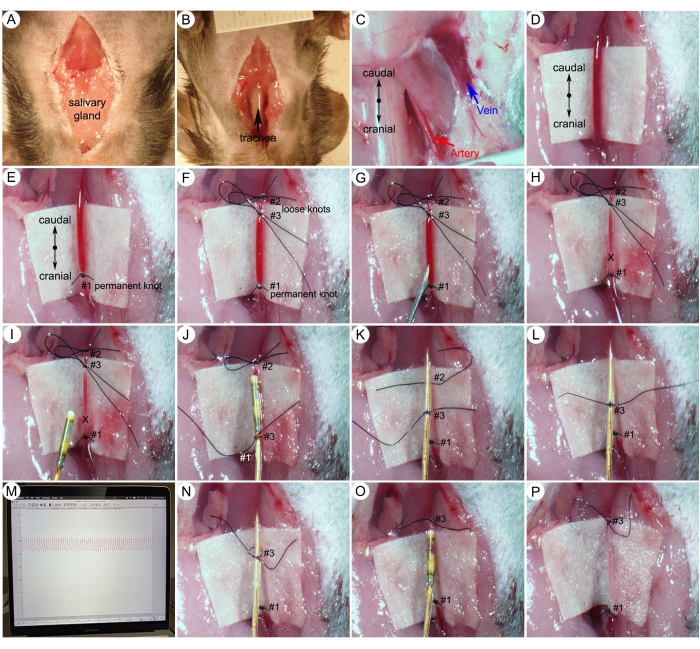
Abbildung 5: Chirurgische Verfahren zur Messung des systemischen Blutdrucks (SBP). (A) Ein Mittellinienschnitt vom Unterkiefer bis zum Brustbein auf der Haut des Halses. (B) Abtrennung der Speicheldrüse zur Freilegung der Luftröhre. (C) Freiliegende rechte Halsschlagader und rechte äußere Halsvene nach Gewebedissektion. (D) Ein isolierter 5-mm-Abschnitt der Halsschlagader. (E,F) Nahtknoten an der kranialen Extremität und zwei lose Knoten an der kaudalen Extremität. (G,H) Ein kleines Loch (X-Markierung) an der Halsschlagader direkt kaudal des permanenten Knotens (#1) machen. (I) Einführung des Katheters in die Halsschlagader. (J) Sicherung des Katheters mit einem mittleren Nahtknoten (#3). (K,L) Lösen Sie vorsichtig den ersten losen Knoten (#2). (M) Repräsentative arterielle Druckwellen. (N) Lösen des mittleren Nahtknotens (#3). (O,P) Ziehen Sie den mittleren Nahtknoten (#3) um das Gefäß fest. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
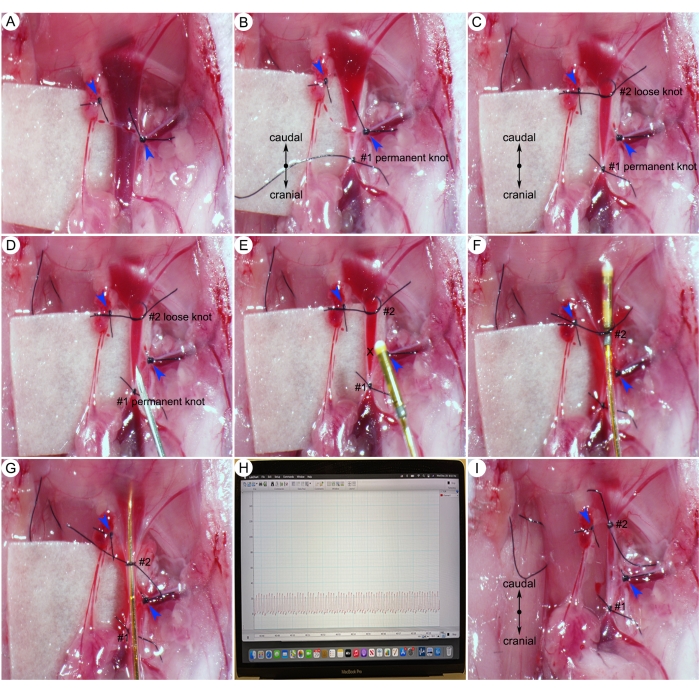
Abbildung 6: Chirurgische Verfahren zur Messung des systolischen Drucks des rechten Ventrikels (RVSP). (A) Ligatur der kleinen Äste der rechten Jugularvene (blaue Pfeilspitzen). (B) Ein dauerhafter Knoten (#1) am kranialen Ende der Halsvene. (C) Ein lockerer Knoten (#2) am kaudalen Ende der Halsvene. (D) Machen eines kleinen Lochs in der rechten Halsvene kaudal zum dauerhaften Knoten (#1). (E) Einführung eines Katheters in die Halsvene durch ein kleines Loch (X-Markierung). (F) Festziehen des kaudalen Knotens (#2) um den Katheter und das Gefäß. (G) Schieben des Katheters in den rechten Ventrikel des Herzens. (H) Vertreter RVSP. (I) Straffung des Schwanzknotens (#2) um das Gefäß. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Datenanalyse der Blutdruckanalysesoftware nach der Aufzeichnung. (A) Verwenden des Wellenformcursors zur Messung der Druckamplitude aus den Rohdaten der Blutdruckanalysesoftware in Kanal 1. (B) Extrahieren der interessierenden Region aus dem Rohdatenbild der Blutdruckanalysesoftware. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
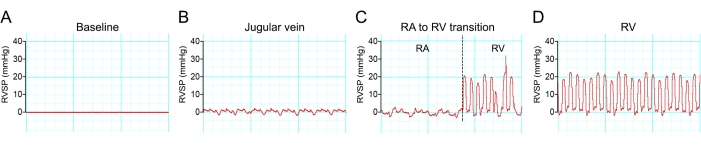
Abbildung 8: Hämodynamischer Wellenformübergang während der Katheterisierung des rechten Ventrikels. (A-D) Repräsentative Spuren von Druckänderungen während der Katheterisierung des rechten Ventrikels der Maus einer C57BL/6-Maus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 9: Darstellungszahlen der Blutdruckanalyse und Datenanalyse. (A) Repräsentative SBP- und RVSP-Kurven bei Normoxie, Hypoxie und Hypoxie + 7C1/let-7 miRNA-behandelten Mäusen. (B) Zusammenfassende Diagramme von SBP und RVSP in Normoxie, Hypoxie und Hypoxie + 7C1/let-7 miRNA-behandelten Mäusen (NS: nicht signifikant; **p < 0,01; ***p < 0,001; ungepaarter zweiseitiger Student's t-Test). N = 10 pro Gruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Es wurden mehrere Tiermodelle für pulmonale Hypertonie etabliert, um die erhöhten pulmonalen Gefäßresistenzereignisse bei menschlichen Probanden nachzuahmen. Unter ihnen wurde das Maus-Hypoxie-induzierte PAH-Modell häufig zur Bewertung der Wirksamkeit neuer experimenteller Therapien für PAH verwendet. Die Forschung mit diesem Modell erfordert häufig die Verabreichung von Verbindungen an die Mäuse. Im Vergleich zu anderen veröffentlichten intravenösen (IV) Injektions- und invasiven hämodynamischen Bewertungsprotokollen bietet diese Methode sowohl eine visuelle Darstellung als auch eine detaillierte Beschreibung.
Es gibt drei entscheidende Schritte für die erfolgreiche Durchführung des Verfahrens und für die Erzielung genauer und reproduzierbarer Blutdruckmessungen. Stellen Sie zunächst sicher, dass die Spritzennadel richtig in der Halsvene positioniert ist. Eine falsche Injektion der Halsvene kann zu einer subkutanen Injektion führen. Stellen Sie zweitens die ausreichende Anästhesietiefe sicher. Eine konsistente Anästhesietiefe in jeder Maus ist wichtig für die Generierung von Daten, die zwischen den Gruppen vergleichbar sind. Eine zu tiefe Anästhesie kann zu einem signifikanten Blutdruckabfall führen. Neben der Isofluran-Inhalationsanästhesie ist die intraperitoneale Injektion von Ketamin/Xylazin eine weitere weit verbreitete Anästhesiemethode für die Mauschirurgie. Beide Methoden haben Vor- und Nachteile. Die Isofluran-Inhalationsanästhesie hat mehrere Vorteile gegenüber injizierbarem Ketamin/Xylazin, einschließlich eines schnellen Wirkungsbeginns, keiner kontrollierten Medikamente, einer schnellen Genesung und einer viel einfacheren Kontrolle der Anästhesietiefe. Die Nachteile sind die Kosten für die Ausrüstung, unangenehmer Geruch und die Exposition des Menschen gegenüber Anästhesiegasen. Drittens stellen Sie sicher, dass sich der Katheter im rechten Ventrikel des Herzens befindet. Längere oder mehrere fehlgeschlagene Versuche einer Katheterisierung des rechten Ventrikels können zu falschen Blutdruckwerten führen.
Die IV-Injektion bei Mäusen erfolgt überwiegend über die seitlichen Schwanzvenen. Während dieser Weg mit Nadeln leicht zu erreichen ist, ist es bei dieser Technik manchmal schwierig, mehrere IV-Bolusdosierungen durchzuführen. Die beiden größten Herausforderungen bei der Durchführung dieser Technik sind die Variabilität der Venentiefe und die Schwierigkeit der Nadelvisualisierung aufgrund der Hautfarbe und Hauthärte des Mäuseschwanzes. Noch wichtiger ist, dass es keine Möglichkeit gibt zu bestätigen, ob der gesamte Inhalt der Injektion erfolgreich in den Blutkreislauf gelangt ist und nicht in das umgebende Gewebe. Die Halsvene ist eine bevorzugte Zugangsstelle, weil (1) sie klinisch relevant ist, (2) sie eine visuelle Bestätigung der Abgabe von Injekt an die Vene liefert, (3) sie mehrere Injektionen einer Gruppe von Tieren im Verlauf des Experiments ermöglicht und (4) diese Injektionstechnik sicher ist und das Verfahren keine Nebenwirkungen verursacht.
Es gibt drei Möglichkeiten, den Blutdruck bei Mäusen aufzuzeichnen: (1) Nicht-invasive Schwanzmanschettenplethysmographie10. Die Systeme ermöglichen wiederholte Messungen im Rahmen einer Längsschnittstudie. (2) Funktelemetrie11. Die Systeme ermöglichen die Echtzeit-Überwachung des Blutdrucks bei wachen und sich frei bewegenden Versuchstieren. (3) Invasive intraarterielle Katheter12. Die Systeme ermöglichen akute SBP- und RVSP-Messungen. In diesem Protokoll wählten wir einen Druckkatheter für systemische und rechtsventrikuläre High-Fidelity-Druckmessungen. Diese Methode hat jedoch einige Einschränkungen. Erstens sind der Druckkatheter und die Blutdruckmessgeräte teuer (Abbildung 1E-F). Zweitens müssen die Tiere betäubt werden, was zu einem Blutdruckabfall führt. Drittens ist die Rechtsherzkatheterisierung ein terminales Verfahren, das keine seriellen Messungen zulässt. Viertens ist das Verfahren selbst für einen gut ausgebildeten Mikrochirurgen nicht leicht zu erlernen.
Sobald der Blutdruck aufgezeichnet ist, kann der Untersucher die Herzen und die Lunge der Tiere für die histologische PAH-Charakterisierung isolieren. Zum Beispiel rechtsventrikuläre Wanddickenmessungen für rechtsventrikuläre Hypertrophie und muskularisierte pulmonale distale Gefäßanalyse für den Umbau der muskulären Lungenarterie. Die Daten zeigen, dass 7C1/let-7 miRNA hochwirksam bei der Senkung des Lungenblutdrucks ist, was die Wirksamkeit unserer mehrfachen IV-Bolusdosierung zeigt. Darüber hinaus können Forscher Lungenendothelzellen aus der frisch isolierten ganzen Lunge isolieren, um die Wirksamkeit von injizierten Materialien zu bewerten.
Zusammenfassend bietet dieses Protokoll ein schrittweises Verfahren zur Durchführung der mehrfachen IV-Bolusdosierung und der invasiven hämodynamischen Überwachung in einem Maus-Hypoxie-induzierten PAH-Modell. Die Forscher können die hier beschriebenen Techniken zur Injektion von Halsvenen und arteriellen/rechten Ventrikelkathetertechniken für eine Vielzahl von Nagetiermodellen anwenden, die eine IV-Injektion und hämodynamische Überwachung erfordern.
Offenlegungen
K Zsebo, M Simons und P-Y Chen sind wissenschaftliche Gründer und Aktionäre von VasoRx, Inc. M Simons ist Mitglied des wissenschaftlichen Beirats von VasoRx, Inc. HJ Duckers ist ein Mitarbeiter und Aktionär von VasoRx. Die anderen Autoren erklären, dass keine konkurrierenden Interessen bestehen.
Danksagungen
Diese Arbeit wurde teilweise durch einen Joint Biology Consortium Microgrant unterstützt, der im Rahmen von NIH Grant P30AR070253 (PYC), Cardiovascular Medical Research Education Fund (PYC), VasoRx, Inc. Fund (MS) und NIH Grants HL135582 (MS), HL152197 (MS) bereitgestellt wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| 5-0 prolene suture pack | Ethicon | 8698G | for incision closure |
| 8-0 nylon suture pack | AROSurgical Instruments | T06A08N14-13 | for ligation |
| Anesthesia induction chamber | VETEQUIP | #941444 | Holds the animal during anesthesia exposure |
| Catheter Interface Cable PEC-4D | Millar | for connecting Millar Mikro-Tip catheter to PCU-2000 | |
| Charcoal canister filters | VETEQUIP | #931401 | to help remove waste anesthetic gases |
| Cotton swabs | McKesson | 24-106 | for applying pressure to the injection site to prevent bleeding |
| Fine scissors | Fine Science Tools | 14059-11 | Surgical tools |
| Insulin syringe 28 G | EXEL | 26027 | for jugular vein IV injection |
| Isoflurane | COVETRUS | #029405 | for mouse anesthesia |
| LabChart 8 Software | ADInstruments | for data analysis | |
| Mikro-Tip Pressure Catheter SPR-1000 (1.0 F) | Millar | for invasive blood pressure measurement | |
| Needle-25 G | BD | 305124 | for making a samll hole in a vessel |
| Oxygen controller ProOx Oxygen Sensor | BioSpherix | E702 | for oxygen concentration monitoring |
| PCU-2000 Pressure Control Unit | Millar | for connecting Millar Mikro-Tip catheter to PowerLab 4/35 | |
| PowerLab 4/35 | ADInstruments | for Data Acquisition. Investigator needs to connect the PowerLab 4/35 to a personal laptop containing LabChart 8 software for operation. | |
| Prism 8 | GraphPad | for statistics and scientific graphing | |
| Semisealable hypoxia chamber | BioSpherix | an artificial environment that simulates high-altitude conditions for animals | |
| Spring Scissors | Fine Science Tools | 15021-15 | Surgical tools |
| Tweezer Style 4 | Electron Microscopy Sciences | 0302-4-PO | Surgical tools |
| VasoRx compound 7C1/let-7 miRNA | VasoRx, Inc. | Lot# B2-L-16Apr | IV injection compound |
| VIP 3000 Veterinary Vaporizer | COLONIAL MEDICAL SUPPLY CO., INC. | for accurate anesthesia delivery |
Referenzen
- McLaughlin, V. V., McGoon, M. D. Pulmonary arterial hypertension. Circulation. 114 (1), 1417-1431 (2006).
- Hoeper, M. M., Humbert, M. The new haemodynamic definition of pulmonary hypertension: evidence prevails, finally. European Respiratory Journal. 53 (3), 1900038(2019).
- Chen, Y., et al. A novel rat model of pulmonary hypertension induced by mono treatment with SU5416. Hypertension Research. 43 (8), 754-764 (2020).
- Xiong, M., et al. Mouse model of experimental pulmonary hypertension: Lung angiogram and right heart catheterization. Pulmonary Circulation. 11 (4), 20458940211041512(2021).
- Kmiotek, E. K., Baimel, C., Gill, K. J. Methods for intravenous self administration in a mouse model. Journal of Visualized Experiments. (70), e3739(2012).
- Potus, F., Martin, A. Y., Snetsinger, B., Archer, S. L. Biventricular assessment of cardiac function and pressure-volume loops by closed-chest catheterization in mice. Journal of Visualized Experiments. (160), e61088(2020).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/hypoxia mouse model of pulmonary arterial hypertension. Experimental Models of Cardiovascular Diseases. 1816, 243-252 (2018).
- Chen, P. Y., et al. FGF regulates TGF-beta signaling and endothelial-to-mesenchymal transition via control of let-7 miRNA expression. Cell Reports. 2 (6), 1684-1696 (2012).
- Chen, P. Y., et al. Endothelial TGF-beta signalling drives vascular inflammation and atherosclerosis. Nature Metabolism. 1 (9), 912-926 (2019).
- Daugherty, A., Rateri, D., Hong, L., Balakrishnan, A. Measuring blood pressure in mice using volume pressure recording, a tail-cuff method. Journal of Visualized Experiments. (27), e1291(2009).
- Alam, M. A., Parks, C., Mancarella, S. Long-term blood pressure measurement in freely moving mice using telemetry. Journal of Visualized Experiments. (111), e53991(2016).
- Luo, F., et al. Invasive hemodynamic assessment for the right ventricular system and hypoxia-induced pulmonary arterial hypertension in mice. Journal of Visualized Experiments. (152), e60090(2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten