Method Article
Dosaggio multiplo in bolo endovenoso e valutazione emodinamica invasiva in un modello murino di ipertensione arteriosa polmonare indotta da ipossia
In questo articolo
Riepilogo
Questo protocollo fornisce una procedura passo-passo per l'esecuzione della somministrazione di dosi multiple in bolo endovenoso e il monitoraggio emodinamico invasivo nei topi. I ricercatori possono utilizzare questo protocollo per il futuro screening dei composti terapeutici per l'ipertensione arteriosa polmonare.
Abstract
L'ipertensione arteriosa polmonare (PAH) è una malattia progressiva potenzialmente letale, che colpisce principalmente le piccole arteriole polmonari del polmone. Attualmente, non esiste una cura per la PAH. È importante scoprire nuovi composti che possono essere utilizzati per trattare la PAH. Il modello di PAH indotto dall'ipossia murina è un modello ampiamente utilizzato per la ricerca sulla PAH. Questo modello riassume le manifestazioni cliniche umane della malattia PAH di gruppo 3 ed è un importante strumento di ricerca per valutare l'efficacia di nuove terapie sperimentali per la PAH. La ricerca che utilizza questo modello richiede spesso la somministrazione di composti nei topi. Per un composto che deve essere somministrato direttamente nel flusso sanguigno, l'ottimizzazione della somministrazione endovenosa (IV) è una parte fondamentale delle procedure sperimentali. Idealmente, il sistema di iniezione endovenosa dovrebbe consentire più iniezioni in un determinato periodo di tempo. Sebbene il modello di PAH indotto dall'ipossia murina sia molto popolare in molti laboratori, è tecnicamente difficile eseguire il dosaggio di più boli endovenosi e la valutazione emodinamica invasiva in questo modello. In questo protocollo, presentiamo istruzioni passo-passo su come eseguire il dosaggio di boli endovenosi multipli attraverso la vena giugulare di topo ed eseguire il cateterismo arterioso e del ventricolo destro per la valutazione emodinamica nel modello di PAH indotto dall'ipossia del topo.
Introduzione
L'ipertensione arteriosa polmonare (PAH) è definita da una pressione sistolica media dell'arteria polmonare superiore a 20 mmHg a riposo 1,2. Si tratta di una malattia progressiva e fatale, caratterizzata da un aumento prolungato della pressione arteriosa polmonare, che porta al sovraccarico del ventricolo destro e, infine, alla morte per insufficienza ventricolare destra1. Attualmente, non esiste una cura per la PAH.
L'uso di modelli animali di ipertensione polmonare è importante per testare l'efficacia delle terapie sperimentali per la PAH. Tra questi modelli, il modello di PAH indotto dall'ipossia del topo ha fornito informazioni chiave sullo sviluppo della malattia PAH umana di gruppo 3 3,4. La ricerca che utilizza questo modello spesso richiede la somministrazione di composti nei topi per valutare l'efficacia e la sicurezza del nuovo composto. Pertanto, i ricercatori hanno bisogno di una procedura sperimentale dettagliata per il dosaggio dei composti e le misurazioni emodinamiche per garantire la coerenza dell'iniezione e la riproducibilità della misurazione della pressione sanguigna dall'inizio alla fine.
I metodi per l'iniezione endovenosa (IV) e la misurazione della pressione arteriosa sono stati riportati in letteratura 5,6. Tuttavia, la metodologia manca di un'illustrazione visiva e di una descrizione dettagliata. Qui illustriamo i passaggi chiave per un'iniezione endovenosa in bolo e per una misurazione e registrazione accurata della pressione arteriosa sistemica e del ventricolo destro. Le procedure qui presentate sono una risorsa importante per i ricercatori interessati alla piattaforma di somministrazione di composti per via endovenosa per sviluppare un trattamento per la PAH.
Protocollo
Tutte le procedure sugli animali sono state eseguite secondo i protocolli approvati dai Comitati Istituzionali per la Cura e l'Uso degli Animali dell'Università di Yale.
1. Preparazione di animali, strumenti, apparecchiature per la misurazione della pressione sanguigna e camera di ipossia
- Acclimatazione degli animali.
NOTA: Gli animali da esperimento utilizzati per questo studio erano topi maschi C57BL/6 di 8 settimane del peso di 25-27 g. Diversi fattori devono essere considerati quando si stima il numero di animali necessari per l'esperimento, tra cui la mortalità associata all'intervento chirurgico, le complicanze chirurgiche inaspettate e la morte improvvisa inaspettata. Utilizzare almeno 10 topi per gruppo per raggiungere la potenza statistica ed evitare studi sottodimensionati.- Al momento dell'accoglienza, alloggiare gli animali in gabbie per roditori ventilate (gruppi di cinque animali per gabbia) dotate di lettiera adeguata, cibo per roditori e acqua. Lasciare che gli animali si acclimatino al nuovo ambiente (ciclo luce-buio di 12 ore a 18-20 °C) per almeno 3 giorni.
- Assegnali in modo casuale ai seguenti gruppi: Normossia (Gruppo 1), ipossia (Gruppo 2) e ipossia + miRNA 7C1/let-7 (Gruppo 3).
- Preparazione di strumenti chirurgici e strumenti per la misurazione della pressione arteriosa.
- Sterilizzare tutti gli strumenti chirurgici in autoclave (Figura 1A).
- Preparare una piattaforma di iniezione improvvisata con un cono nasale per anestesia fatto in casa (Figura 1B), pacchetti di sutura (Figura 1C) e attrezzature per la procedura PAH (Figura 1D-F).
- Impostazione sperimentale per l'induzione dell'ipertensione arteriosa polmonare (PAH).
- Impostare il serbatoio N2 , il sensore di ossigeno e la camera di ipossia semisigillabile (Figura 2A).
- Stabilire un set point del 10% di O2 nel sensore di ossigeno e lasciare che il sistema raggiunga lo stato stazionario (Figura 2B, C).
- Mantenere in ipossia (10% O 2) gli animali con ipossia (Gruppo 2) e ipossia + miRNA 7C1/let-7 (Gruppo3) per 3 settimane. Dopo 3 settimane di ipossia, porre gli animali in condizioni normossiche per 1 settimana (Figura 2D). Il gruppo normossico (Gruppo 1) rimane in normossia per 4 settimane.
NOTA: (1) 3 settimane di ipossia seguite da 1 settimana di normossia sono un metodo consolidato per lo sviluppo di PAH e insufficienza cardiaca del ventricolo destro7. Il sensore di ossigeno rileva la concentrazione di O2 all'interno della camera di ipossia semisigillabile e la corregge infondendo gas N2 attraverso il tubo di infusione del gas. - Ispezionare gli animali ogni giorno per tutta la durata dell'esperimento (3 settimane). Consultare un veterinario se gli animali mostrano segni di sofferenza come una drammatica perdita di peso e difficoltà respiratorie. Se l'eutanasia è necessaria per gli animali in grave difficoltà, escludere l'animale dallo studio.
NOTA: L'esposizione all'ipossia provoca la perdita di peso corporeo del topo. Una perdita del 10% del peso corporeo è tipicamente utilizzata come indicazione affidabile dello sviluppo di IPA. - Evitare l'apertura prolungata della camera di ipossia. Per la pulizia delle gabbie, il rifornimento di cibo, il cambio delle bottiglie d'acqua e la somministrazione del composto, aprire le camere per non più di 1 ora alla settimana.
2. Iniezione endovenosa in bolo attraverso la vena giugulare
- Preparazione del topo e anestesia.
- Rimuovere le gabbie per topi ipossia (Gruppo 2) e ipossia + miRNA 7C1/let-7 (Gruppo 3) dalla camera di ipossia e rimuovere delicatamente l'animale dalla gabbia.
NOTA: Il regime posologico per il miRNA 7C1/let-7 (1,5 mg/kg EV/dose) è di due volte a settimana per 4 settimane di trattamento. Si raccomanda che gli sperimentatori tolgano sia l'ipossia che l'ipossia + gabbie di trattamento composto dalla camera di ipossia durante l'iniezione endovenosa per assicurarsi che tutti gli animali ricevano la stessa entità di esposizione all'ipossia per intervallo di tempo. - Pesate il mouse utilizzando una bilancia di precisione e annotatene il peso (Figura 3A).
- Collocare il mouse in una camera di induzione per anestesia collegata al vaporizzatore per anestesia e chiuderla (Figura 3B). Fornire supporto termico e applicare lubrificante per gli occhi su entrambi gli occhi per evitare la secchezza durante l'anestesia. Esporre il topo all'isoflurano al 3% fino a quando non perde conoscenza (Figura 3C-D).
- Rimuovere il topo dalla camera e radere il pelo dalla mascella cranialmente fino al centro dello sterno caudalmente. Lateralmente, radere il pelo dagli angoli della mascella, attraverso i lati del collo e verso le spalle (Figura 3E).
- Posizionare il topo anestetizzato con isoflurano in posizione supina (pancia rivolta verso l'alto) su una piattaforma di iniezione sotto un microscopio da dissezione. Mantenere l'anestesia tramite un cono nasale con isoflurano all'1,5% e trattenere delicatamente le quattro gambe con nastro adesivo per immobilizzare il corpo (Figura 3F).
- Applicare uno stimolo nocivo (ad esempio, pizzicare le dita dei piedi) con una pinza diritta per garantire un adeguato livello di anestesia. Il topo anestetizzato non deve rispondere alla stimolazione prima e durante la procedura chirurgica.
- Rimuovere le gabbie per topi ipossia (Gruppo 2) e ipossia + miRNA 7C1/let-7 (Gruppo 3) dalla camera di ipossia e rimuovere delicatamente l'animale dalla gabbia.
- Preparazione dell'agente iniettabile.
- Preparare un composto per iniezione monodose alla dose di 1,5 mg/kg in condizioni sterili.
NOTA: Riscaldare il composto per iniezione a temperatura ambiente (RT) poiché l'iniezione di sostanze fredde può causare disagio e un calo della temperatura corporea del topo (se questo non danneggia il composto). La dose ottimale e la durata del composto 7C1/let-7 miRNA utilizzato in questo studio si basano su precedenti pubblicazioni 8,9. - Caricare la siringa sterile monouso con il volume da iniettare. Tenere la siringa in posizione verticale e far avanzare lo stantuffo per espellere l'aria dalla siringa. Non riutilizzare la siringa.
- Limitare il volume di iniezione a 200 μL in un topo da 25 g per ridurre l'incidenza di emodiluizione e gli effetti cardiaci anomali sugli animali. Se è necessario un volume maggiore, dividere il composto da iniezione in due iniezioni con un intervallo di 10 minuti.
- Preparare un composto per iniezione monodose alla dose di 1,5 mg/kg in condizioni sterili.
- Preparare il topo per l'iniezione endovenosa.
- Strofinare delicatamente l'area chirurgica tre volte con tre cicli alternati di soluzione di iodio povidone ed etanolo al 70%. Somministrare buprenorfina (0,05 mg/kg, SQ) 30 minuti prima della procedura chirurgica.
- Eseguire un taglio longitudinale di 0,5 cm leggermente a destra della linea mediana del collo utilizzando una lama per bisturi (Figura 3G).
- Utilizzare le pinze per separare il muscolo e i tessuti adiposi per individuare la vena giugulare esterna destra (Figura 3H).
NOTA: Ruotare ogni volta i siti di iniezione per evitare la formazione di cicatrici. - Utilizzare una lente dell'obiettivo ad alta potenza per consentire una facile visualizzazione dell'area di iniezione (Figura 3I).
- Iniezione endovenosa
- Inserire un ago sterile da 28 G nella vena giugulare con lo smusso dell'ago rivolto verso l'alto (Figura 3J, K).
NOTA: L'iniezione della vena caudale è un'alternativa all'iniezione della vena giugulare. Tuttavia, questa tecnica è difficile da eseguire a dosi ripetute a causa della variabilità della profondità della vena, del colore della pelle della coda dei topi e della durezza della pelle. - Premere lentamente lo stantuffo della siringa per iniettare il composto nella vena. Lasciare che l'ago rimanga all'interno della vena per altri 10 secondi per evitare il riflusso dell'iniettore (Figura 3L).
NOTA: Il colorante bluastro consente una facile visualizzazione dell'iniezione. Non includere il colorante durante l'iniezione di materiali di prova. Un'iniezione imprecisa provocherà l'accumulo di colorante bluastro intorno al sito di iniezione endovenosa. - Rimuovere l'ago e utilizzare un batuffolo di cotone per esercitare pressione sul sito di iniezione per prevenire il sanguinamento (Figura 3M).
- Suturare la pelle con una sutura 5-0 (Figura 3N). Dopo l'intervento, spostare l'animale in un'area calda, pulita e asciutta e somministrare Meloxicam (1 mg/kg, SQ, ogni 24 ore). Metti l'animale in una gabbia di recupero pulita, senza lettiera ma con il fondo coperto da un tovagliolo di carta.
NOTA: Il topo dovrebbe essere sveglio dall'anestesia e riprendere conoscenza entro 5 minuti una volta tornato nella gabbia di recupero. Monitora il mouse per segni di angoscia. - Rimetti gli animali nella loro gabbia di casa e rimetti la gabbia per topi nella camera di ipossia.
NOTA: L'intera procedura, dall'anestesia di un topo al completamento dell'iniezione della vena giugulare, richiede circa 10-15 minuti da parte di un singolo sperimentatore. Per ridurre l'esposizione alla normossia nei topi, si raccomanda che almeno due ricercatori collaborino per eseguire una procedura di iniezione della vena giugulare.
- Inserire un ago sterile da 28 G nella vena giugulare con lo smusso dell'ago rivolto verso l'alto (Figura 3J, K).
3. Misurazione della pressione arteriosa
- Preparare gli strumenti per la misurazione della pressione arteriosa.
- Immergere la punta del catetere da 1,0 F in PBS preriscaldato a 37 °C almeno 30 minuti prima della misurazione emodinamica (Figura 4A).
- Misurare la distanza tra il sito di inserimento del catetere e la posizione desiderata della punta del catetere. Ad esempio, la distanza tra l'aorta ascendente del topo e la metà del collo è di circa 1-1,2 cm. La distanza tra il ventricolo destro del cuore e la metà del collo è di circa 2,3-2,8 cm.
- Contrassegnare due contrassegni di distanza del catetere per fornire un'indicazione visiva della profondità di inserimento (Figura 4B).
- Collegare il catetere al trasduttore di pressione, collegare il trasduttore di pressione al canale di ingresso 1 sul dispositivo di acquisizione dati, accendere l'unità di controllo pressione-volume e avviare il software di analisi della pressione sanguigna di acquisizione dati. Creare un nuovo documento di analisi della pressione arteriosa e impostare il canale 1 per la pressione.
- Eseguire una calibrazione della pressione secondo il protocollo del produttore. Lasciare che l'intera configurazione si stabilizzi per almeno 5 minuti (Figura 4C).
- Nel software di analisi della pressione arteriosa, selezionare Conversione unità dal menu a discesa Canale 1 (Figura 4D, freccia rossa).
- Impostare i valori di conversione delle unità predefiniti (Figura 4E).
NOTA: La pressione sanguigna è rappresentata in millimetri di mercurio (mmHg). La pressione standardizzata in uscita dall'unità di controllo della pressione è di 1 V per 100 mmHg. 25 mmHg corrispondono a 0,25 V in uscita e 100 mm Hg corrispondono a 1 V in uscita.
- Preparare il topo per la procedura di misurazione della pressione sanguigna.
- Anestetizzare il topo con l'inalazione di isoflurano al 3% attraverso un cono nasale.
- Applicare l'unguento veterinario direttamente sulla superficie oculare degli occhi del topo per prevenire la secchezza, poiché il topo non può chiudere gli occhi sotto anestesia. Radere il pelo dal collo del topo durante l'anestesia.
- Strofinare la regione rasata con tre cicli alternati di soluzione di iodio povidone e tampone di etanolo al 70%. Posizionare il topo anestetizzato in posizione supina su una piattaforma di iniezione sotto un microscopio da dissezione. Posizionare il naso del topo nell'ogno nasale per mantenere l'anestesia (isoflurano all'1,5%) durante la procedura chirurgica.
- Testare la risposta motoria del topo anestetizzato allo stimolo nocivo. Il topo anestetizzato non deve rispondere a uno stimolo nocivo prima e durante l'intervento.
NOTA: Gli anestetici inalabili (isoflurano) e iniettabili (ketamina/xilazina) possono ridurre la pressione sanguigna. In generale, l'anestesia per inalazione di isoflurano ha un leggero effetto sull'abbassamento della pressione sanguigna rispetto alla ketamina/xilazina. Pertanto, l'isoflurano è l'anestetico inalante preferito rispetto alla ketamina/xilazina. Raggiungere la profondità appropriata dell'anestesia è fondamentale per misurazioni emodinamiche accurate e riproducibili. Lo sperimentatore deve mantenere costante la profondità dell'anestesia per ogni topo.
- Cateterismo dell'aorta ascendente
- Applicare uno stimolo nocivo (ad esempio, pizzicare le dita dei piedi) con una pinza diritta per garantire un adeguato livello di anestesia. Praticare un'incisione sulla linea mediana della pelle dalla mandibola allo sterno (Figura 5A).
- Separare le ghiandole salivari ed esporre la trachea (Figura 5B).
- Utilizzare le pinze per liberare i tessuti molli lungo i vasi sanguigni per esporre l'arteria carotide destra e la vena giugulare esterna destra (Figura 5C).
- Mettere 0,5 ml di PBS nella cavità per rallentare lo sviluppo del vasospasmo mentre si manipola l'arteria carotide.
- Isolare con cura una sezione di 5 mm dell'arteria carotide destra. Posizionare un pezzo di carta bianca sterile sotto il vaso come sfondo per rendere l'arteria più visibile (Figura 5D).
NOTA: Separare con cura il nervo vago (bianco) dall'arteria e assicurarsi di non tagliare o danneggiare il nervo o l'arteria. - Usando un 8-0 la sutura annoda un nodo permanente (#1) per chiudere l'estremità cranica del vaso (Figura 5E).
- Annodare un primo nodo sciolto (#2) per occludere temporaneamente il flusso sanguigno dall'aorta. Quindi, fare un secondo nodo sciolto (#3) tra le prime due suture (Figura 5F). Il secondo nodo sciolto (#3) verrà utilizzato per fissare rapidamente il catetere dopo il posizionamento.
- Usando un ago da 25 G, praticare un piccolo foro, abbastanza grande da far passare il catetere, in linea con il vaso tra le legature #3 e #1 (Figura 5G).
NOTA: Le arterie carotidi trasportano sangue ossigenato dal cuore e hanno una pressione molto alta. Se l'arteria carotide viene tagliata, quella pressione farà fuoriuscire il sangue (Figura 5H). - Tenere il catetere a 1,5 pollici dalla punta e inserire delicatamente la punta del catetere attraverso il foro dell'arteria (segno X). Stringere il nodo di sutura centrale (# 3) attorno al catetere e al vaso che consente ancora il passaggio del catetere (Figura 5I-J).
NOTA: Questo passaggio richiede pratica. Le potenziali complicanze di questo passaggio includono sanguinamento nel sito di inserimento del catetere e vasospasmo. Quando si verifica un'emorragia, la perdita di sangue dall'arteria sanguinante riduce il volume del sangue, portando a un grave calo della pressione sanguigna sistemica. A causa della gravità, l'animale ha raggiunto un endpoint umano e deve essere soppresso. Per il vasospasmo indotto meccanicamente, di solito si verifica durante l'inserimento del catetere a causa di una contrazione persistente dei vasi sanguigni. Ciò riduce l'apertura del vaso sanguigno e impedisce l'avanzamento del catetere verso l'arteria carotide. Non esercitare una forza eccessiva contro la resistenza per far avanzare il catetere. Quando si riscontra una resistenza al vasospasmo moderata o grave, riprovare dopo un po' o utilizzare un catetere più piccolo (ad es. 1,0 F). I microchirurghi esperti possono raggiungere percentuali di successo del 100% per il cateterismo dell'aorta ascendente. - Dopo che il catetere ha superato il primo nodo allentato (#2) con la punta del sensore, fissare il secondo nodo allentato (#2) più saldamente per fissare il catetere e rilasciare delicatamente il primo nodo allentato (#2) (Figura 5K, L).
- Continuare a inserire il catetere verso l'aorta ascendente in base al segno sul catetere (Figura 4B) fino a quando l'analisi della pressione non mostra un profilo della pressione arteriosa (Figura 5M). Registra i dati della pressione arteriosa sistemica (SBP) utilizzando il sistema di acquisizione dati e il software.
- Allentare il nodo di sutura centrale (#3) per consentire l'estrazione del catetere (Figura 5N).
- Legare il nodo di sutura medio (# 3) attorno al vaso prima di estrarre il catetere dall'arteria carotide (Figura 5O-P).
- Posizionare il catetere nel PBS.
- Cateterismo cardiaco destro.
- Isolare accuratamente la vena giugulare esterna destra dal tessuto connettivo circostante e legare tutti i piccoli rami con 8-0 sutura (punte di freccia blu) (Figura 6A).
NOTA: Per il cateterismo cardiaco destro, l'accesso al cuore avviene comunemente attraverso la vena giugulare destra. - Usando un 8-0 sutura, fare un nodo permanente (#1) per chiudere l'estremità cranica del vaso (Figura 6B). Quindi, fare un nodo sciolto (#2) sull'estremità caudale del vaso (Figura 6C).
- Utilizzare un ago da 25 G per praticare un piccolo foro prossimale al nodo permanente (#1) (Figura 6D).
NOTA: Le vene giugulari trasportano il sangue deossigenato al cuore e hanno una bassa pressione. Se la vena giugulare viene tagliata, il sangue non sgorgherà (Figura 6D, E). - Afferrare il catetere e inserirlo nel taglio della vena (segno X) (Figura 6E) e stringere il nodo caudale (#2) attorno al catetere e al vaso (Figura 6F).
- Spingere lentamente e delicatamente il catetere nel cuore destro. Monitorare la profondità della punta del catetere in base al segno del catetere (Figura 4B).
NOTA: La valutazione della pressione sistolica ventricolare destra (RVSP) nei topi a torace chiuso è una sfida a causa della complessa anatomia e struttura del ventricolo destro. Questo passaggio richiede un alto livello di competenza e molta pratica. Nelle mani di un microchirurgo esperto, il tasso di successo per il cateterismo del ventricolo destro può avvicinarsi al 90%. - Valutare la posizione della punta del catetere in base al tracciamento dell'onda di pressione nel software. Quando la punta del catetere si trova nel ventricolo destro, il monitor mostrerà un tipico tracciato RVSP (Figura 6G, H).
NOTA: Quando la forma delle curve di pressione polmonare appare atipica (ad es. curve appuntite), ciò implica un posizionamento errato del catetere. Regolare la posizione del catetere tirando delicatamente il catetere leggermente all'indietro, quindi facendo avanzare lentamente il catetere in una posizione più centrale all'interno del ventricolo destro. Per evitare la generazione di artefatti nei dati di ricerca, lo sperimentatore deve evitare tentativi prolungati (non più di 1 minuto) o ripetuti (non più di due tentativi) di cateterismo del ventricolo destro. - Tenere il catetere immobile e raccogliere i dati per 5 minuti.
- Al termine della registrazione, estrarre con cautela il catetere e legare il nodo caudale (#2) attorno al vaso (Figura 6I). Riposizionare il catetere nella soluzione PBS.
NOTA: Al termine dell'esperimento, pulire il catetere con una soluzione di enzimi digestivi all'1% secondo le istruzioni del produttore. Oltre a valutare lo stato emodinamico, gli investigatori possono prelevare i cuori e i polmoni per l'esame istopatologico della PAH. Per garantire l'efficacia del dosaggio di più boli endovenosi, i ricercatori possono isolare le cellule endoteliali polmonari e misurare i livelli di miRNA let-7.
- Isolare accuratamente la vena giugulare esterna destra dal tessuto connettivo circostante e legare tutti i piccoli rami con 8-0 sutura (punte di freccia blu) (Figura 6A).
4. Analisi dei dati della pressione sanguigna
- Esaminare la registrazione della pressione sanguigna.
- Aprire il file di dati del software per l'analisi della pressione arteriosa (PAH JOVE.adicht).
- Nel canale 1, selezionare un'area che rappresenti il segnale di pressione e posizionare il cursore della forma d'onda sul picco (segno X) per misurare l'ampiezza della pressione (Figura 7A).
- Determinare l'ampiezza massima dell'onda di pressione. Rappresenta la pressione sistolica (Figura 7A, freccia rossa).
- Estrarre l'area di interesse (area grigia della Figura 7B ) dall'immagine premendo Maiusc + Comando + 3 (per Mac) o Windows + Maiusc + S (per PC Windows) e incollarla in un file grafico.
- Analisi statistica dei dati della pressione arteriosa.
- Inserire i dati della pressione sanguigna del singolo topo nel software di analisi statistica.
- Eseguire un test t di Student spaiato per l'analisi statistica di due gruppi di studio (normossia vs. ipossia; ipossia vs. ipossia + miRNA 7C1/let-7). Si considerino le differenze nei valori medi significative quanto p < 0,05.
Risultati
L'anestesia spesso riduce la pressione sanguigna. Pertanto, è stata utilizzata una dose minima di anestesia per abolire i movimenti in risposta a uno stimolo nocivo. L'accesso riuscito alla camera ventricolare destra può essere visualizzato mentre la forma d'onda emodinamica cambia in diverse regioni dei sistemi venosi (Figura 8).
In questo studio, i topi sono stati assegnati in modo casuale al gruppo normossico (21% O2 ) (n = 10), al gruppo ipossia (10% O2 ) (n = 10) o al gruppo di trattamento ipossia + 7C1/let-7 (n = 10). Per esaminare l'effetto del miRNA let-7 nella soppressione dello sviluppo di PAH indotto dall'ipossia, il miRNA 7C1/let-7 formulato è stato somministrato ai topi C57BL/6 per via endovenosa alla dose di 1,5 mg/kg due volte a settimana per 4 settimane (Figura 2D).
4 settimane dopo l'esposizione all'ipossia o alla normossia, SBP e RVSP sono stati misurati in un topo a torace chiuso. La Figura 9A mostra la curva rappresentativa della pressione arteriosa dei gruppi di trattamento con miRNA normossico, ipossia o ipossia + 7C1/let-7. Rispetto a quelli del gruppo di controllo normoxia, RVSP è stato significativamente aumentato nel gruppo ipossia. Inoltre, rispetto al gruppo ipossia, il trattamento con il composto miRNA 7C1/let-7 nei topi ha determinato una significativa riduzione della RVSP (Figura 9B). L'SBP non è cambiato in nessun gruppo, il che è coerente con le precedenti relazioni7. Il miRNA 7C1/let-7 prende di mira le cellule endoteliali e diminuisce la cascata di segnalazione del TGFβ8. I dati mostrano che il miRNA 7C1/let-7 1,5 mg/kg è altamente efficace nell'abbassare la pressione sanguigna nel ventricolo destro, dimostrando l'efficacia del dosaggio multiplo in bolo endovenoso.

Figura 1: Strumenti chirurgici e apparecchiature per la misurazione della pressione arteriosa necessari per le procedure di ipertensione arteriosa polmonare. (A) Strumenti chirurgici utilizzati per la procedura PAH. (B) Una piattaforma di iniezione improvvisata costituita da un tampone assorbente avvolto attorno a un rack di polistirolo da una confezione conica da 50 ml. Collegamento di un tubo per anestesia di 10 cm di lunghezza alla piattaforma di iniezione come cono nasale con tipo. (C) Pacchetti di sutura. Sutura 5-0 per la chiusura dell'incisione e 8-0 sutura per la legatura. (D-F) Apparecchiatura per la misurazione della pressione arteriosa utilizzata per la procedura IPA. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Impostazione sperimentale per l'induzione di IPA. (A) Fotografia dell'installazione del sistema ipossico BioSpherix. Sono indicate le diverse parti del sistema di induzione. (B-C) Sensore di ossigeno che monitora la concentrazione di O2 nella camera di ipossia. (D) Cronologia sperimentale per il trattamento con composti di miRNA 7C1/let-7 e l'esposizione al livello di ossigeno per tutti i gruppi animali durante l'induzione di IPA. Fare clic qui per visualizzare una versione più grande di questa figura.
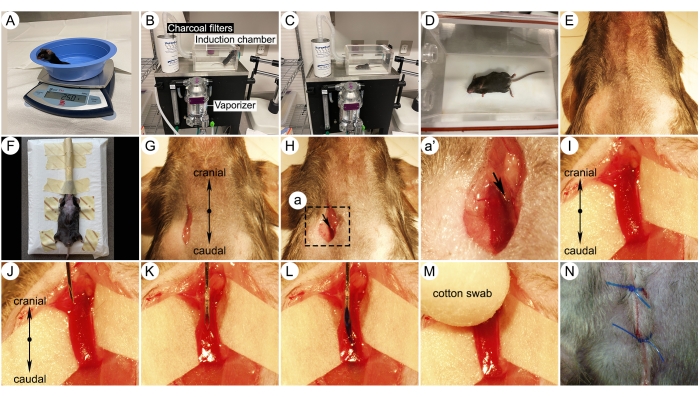
Figura 3: Fotografie delle fasi chirurgiche chiave per l'iniezione della vena giugulare. (A) Topo su una bilancia. (B) Configurazione del sistema di induzione dell'anestesia per roditori. Sono indicate le diverse parti del sistema di induzione. (C-D) Immagini di un topo anestetizzato con isoflurano in una camera di induzione. (E) Zona chirurgica rimossa dal pelo. (F) Un topo posto su una piattaforma di iniezione e respirato isoflurano all'1,5% attraverso un cono nasale da un vaporizzatore. (G) Incisione cutanea per l'approccio alla vena giugulare. (H) Dissezione chirurgica della vena giugulare esterna destra. (I) Imaging a maggiore ingrandimento che mostra la vena giugulare destra isolata. Nota un foglio bianco sotto il vaso, che rende la vena più visibile. (J-K) Inserimento dell'ago della vena giugulare destra con lo smusso verso l'alto. (L) Iniezione di un composto con colorante bluastro nella vena giugulare. (M) Esercitare pressione sul sito di iniezione utilizzando un batuffolo di cotone dopo aver ritirato l'ago. (N) Suturare la ferita con una sutura 5-0. Fare clic qui per visualizzare una versione più grande di questa figura.
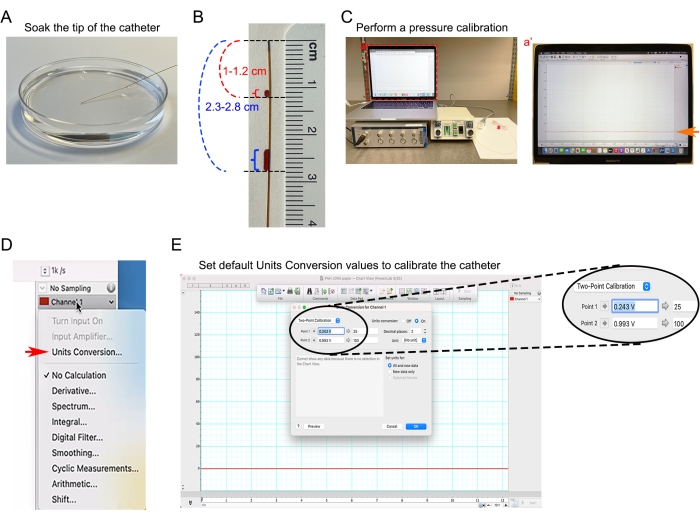
Figura 4: Calibrazione del catetere. (A) Immergere la punta del catetere da 1,0 F in PBS preriscaldato a 37 °C. (B) Segni di distanza sul catetere per aiutare a stimare la profondità di inserimento del catetere nell'aorta ascendente e nel ventricolo destro. (C) Apparecchiature per la misurazione della pressione arteriosa sottoposte a calibrazione di base zero. (Ca') Screenshot dell'analisi della linea di base del catetere basata su software per l'analisi della pressione arteriosa. (D) Nel menu a discesa Canale 1 , selezionare la finestra di dialogo Conversione unità nel software di analisi della pressione sanguigna. (E) Impostazione dei valori predefiniti di conversione delle unità per convertire il segnale di tensione di ingresso in unità mmHg. Fare clic qui per visualizzare una versione più grande di questa figura.
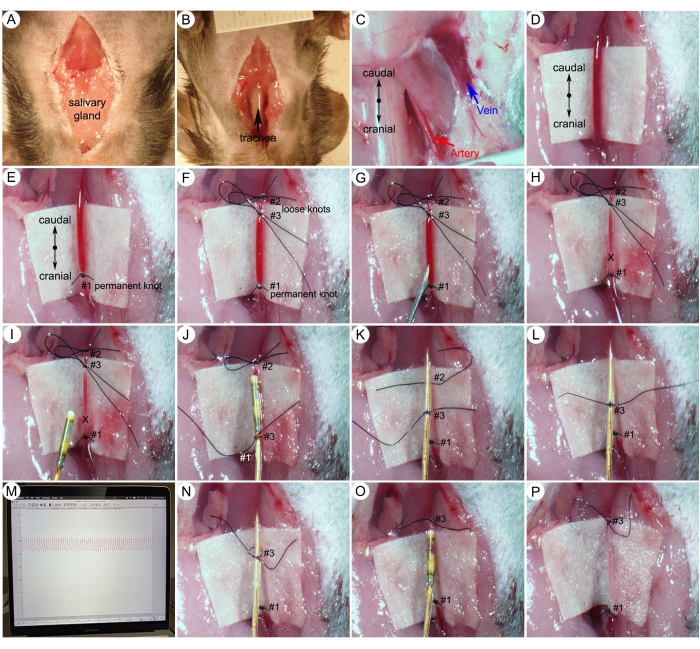
Figura 5: Procedure chirurgiche per la misurazione della pressione arteriosa sistemica (SBP). (A) Un'incisione della linea mediana dalla mandibola allo sterno sulla pelle del collo. (B) Separazione della ghiandola salivare per esporre la trachea. (C) Arteria carotide destra esposta e vena giugulare esterna destra dopo dissezione tissutale. (D) Una sezione isolata di 5 mm dell'arteria carotide. (E,F) Nodo permanente di sutura all'estremità cranica e due nodi sciolti all'estremità caudale. (G,H) Fare un piccolo foro (X-mark) sull'arteria carotide appena caudale al nodo permanente (#1). (I) Inserimento del catetere nell'arteria carotide. (J) Fissare il catetere con un nodo di sutura centrale (# 3). (K,L) Sciogliendo delicatamente il primo nodo sciolto (#2). (M) Onde di pressione arteriosa rappresentative. (N) Allentamento del nodo di sutura centrale (#3). (O,P) Stringere il nodo di sutura centrale (# 3) attorno al vaso. Fare clic qui per visualizzare una versione più grande di questa figura.
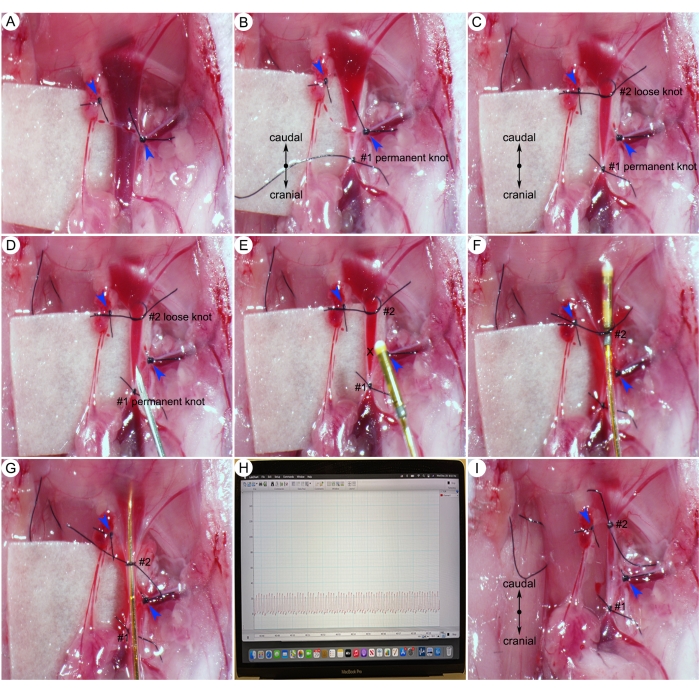
Figura 6: Procedure chirurgiche per la misurazione della pressione sistolica del ventricolo destro (RVSP). (A) Legatura dei piccoli rami della vena giugulare destra (punte di freccia blu). (B) Un nodo permanente (#1) sull'estremità cranica della vena giugulare. (C) Un nodo sciolto (#2) sull'estremità caudale della vena giugulare. (D) Fare un piccolo foro sulla vena giugulare destra caudale al nodo permanente (#1). (E) Inserimento di un catetere nella vena giugulare attraverso un piccolo foro (X-mark). (F) Stringere il nodo caudale (#2) attorno al catetere e al vaso. (G) Spingere il catetere nel ventricolo destro del cuore. (H) Rappresentante RVSP. (I) Serraggio del nodo caudale (#2) attorno al recipiente. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Analisi dei dati del software di analisi della pressione sanguigna dopo la registrazione. (A) Utilizzo del cursore della forma d'onda per misurare l'ampiezza della pressione dai dati grezzi del software di analisi della pressione sanguigna nel canale 1. (B) Estrazione della regione di interesse dall'immagine dei dati grezzi del software di analisi della pressione sanguigna. Fare clic qui per visualizzare una versione più grande di questa figura.
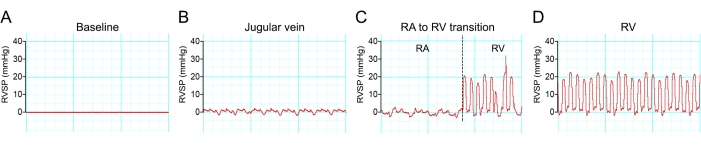
Figura 8: Transizione della forma d'onda emodinamica durante il cateterismo del ventricolo destro. (A-D) Tracce rappresentative delle variazioni di pressione durante il cateterismo del ventricolo destro del topo di un topo C57BL/6. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 9: Rappresentazione dell'analisi della pressione arteriosa Figure e analisi dei dati. (A) Curve rappresentative di SBP e RVSP in topi trattati con normossia, ipossia e ipossia + miRNA 7C1/let-7. (B) Grafici riassuntivi di SBP e RVSP in topi trattati con normossia, ipossia e ipossia + miRNA 7C1/let-7 (NS: non significativo; **p < 0,01; ***p < 0,001; t-test di Student a due code non accoppiato). N = 10 per gruppo. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Diversi modelli animali di ipertensione polmonare sono stati stabiliti per imitare gli eventi di elevata resistenza vascolare polmonare nei soggetti umani. Tra questi, il modello di PAH indotto dall'ipossia del topo è stato ampiamente utilizzato per valutare l'efficacia di nuove terapie sperimentali per la PAH. La ricerca che utilizza questo modello richiede spesso la somministrazione di composti ai topi. Rispetto ad altri protocolli pubblicati per l'iniezione endovenosa (IV) e la valutazione emodinamica invasiva, questo metodo fornisce sia un'illustrazione visiva che una descrizione dettagliata.
Ci sono tre passaggi critici per la corretta esecuzione della procedura e per ottenere misurazioni accurate e riproducibili della pressione arteriosa. Innanzitutto, assicurarsi che l'ago della siringa sia posizionato correttamente nella vena giugulare. Un'iniezione errata della vena giugulare può provocare un'iniezione sottocutanea. In secondo luogo, garantire una profondità sufficiente dell'anestesia. Una profondità di anestetico costante in ciascun topo è importante per la generazione di dati comparabili tra i gruppi. Un'anestesia troppo profonda può causare una significativa diminuzione dei livelli di pressione sanguigna. Oltre all'anestesia per inalazione di isoflurano, l'iniezione intraperitoneale di ketamina/xilazina è un altro metodo anestetico ampiamente utilizzato per la chirurgia del topo. Entrambi i metodi presentano vantaggi e svantaggi. L'anestesia per inalazione di isoflurano presenta diversi vantaggi rispetto alla ketamina / xilazina iniettabile, tra cui l'insorgenza rapida, l'assenza di farmaci controllati, il recupero rapido ed è molto più facile controllare la profondità dell'anestesia. Gli svantaggi sono il costo dell'apparecchiatura, l'odore sgradevole e l'esposizione umana ai gas anestetici di scarto. In terzo luogo, assicurarsi che il catetere si trovi all'interno del ventricolo destro del cuore. Tentativi prolungati o multipli falliti di cateterismo del ventricolo destro possono causare false letture della pressione sanguigna.
L'iniezione endovenosa nei topi viene somministrata prevalentemente attraverso le vene caudali laterali. Mentre questo percorso è facile da raggiungere con gli aghi, questa tecnica a volte è difficile da eseguire il dosaggio di più boli endovenosi. Le due principali sfide nell'esecuzione di questa tecnica sono la variabilità della profondità della vena e la difficoltà di visualizzazione dell'ago a causa del colore della pelle della coda dei topi e della durezza della pelle. Ancora più importante, non c'è modo di confermare se l'intero contenuto dell'iniezione è entrato con successo nel flusso sanguigno e non nei tessuti circostanti. La vena giugulare è un sito di accesso preferenziale perché (1) è clinicamente rilevante, (2) fornisce una conferma visiva della somministrazione dell'iniettato in vena, (3) consente iniezioni multiple di un gruppo di animali durante il corso dell'esperimento e (4) questa tecnica di iniezione è sicura e la procedura non causa effetti collaterali.
Esistono tre modi per registrare la pressione sanguigna nei topi: (1) Pletismografia non invasiva del polsino della coda10. I sistemi consentono misurazioni ripetute nel corso di uno studio longitudinale. (2) Radiotelemetria11. I sistemi consentono il monitoraggio della pressione sanguigna in tempo reale in animali da laboratorio svegli e in movimento libero. (3) Cateteri intraarteriosi invasivi12. I sistemi consentono misure acute di SBP e RVSP. In questo protocollo, abbiamo scelto un catetere a pressione per misurazioni ad alta fedeltà della pressione sistemica e del ventricolo destro. Tuttavia, questo metodo presenta alcune limitazioni. Innanzitutto, il catetere per la pressione e l'apparecchiatura per la misurazione della pressione sanguigna sono costosi (Figura 1E-F). In secondo luogo, richiede l'anestesia degli animali, questo provoca una diminuzione della pressione sanguigna. In terzo luogo, il cateterismo cardiaco destro è una procedura terminale che non consente misurazioni seriali. In quarto luogo, la procedura non è facile da imparare nemmeno da un microchirurgo ben addestrato.
Una volta registrata la pressione arteriosa, lo sperimentatore può isolare i cuori e i polmoni dagli animali per la caratterizzazione istologica della PAH. Ad esempio, misurazioni dello spessore della parete ventricolare destra per l'ipertrofia ventricolare destra e analisi dei vasi distali polmonari muscolozzati per il rimodellamento dell'arteria polmonare muscolare. I dati mostrano che il miRNA 7C1/let-7 è altamente efficace nell'abbassare la pressione sanguigna polmonare, dimostrando l'efficacia del nostro dosaggio multiplo in bolo endovenoso. Inoltre, i ricercatori possono isolare le cellule endoteliali polmonari dal polmone intero appena isolato per valutare l'efficacia dei materiali iniettati.
In sintesi, questo protocollo fornisce una procedura passo-passo per l'esecuzione di dosi multiple di boli endovenosi e monitoraggio emodinamico invasivo in un modello murino di PAH indotto da ipossia. I ricercatori possono utilizzare l'iniezione della vena giugulare e le tecniche di cateterismo arterioso/ventricolo destro qui descritte per un'ampia varietà di modelli di roditori che richiedono l'iniezione endovenosa e il monitoraggio emodinamico.
Divulgazioni
K Zsebo, M Simons e P-Y Chen sono fondatori scientifici e azionisti di VasoRx, Inc. M Simons è membro del comitato consultivo scientifico di VasoRx, Inc. HJ Duckers è un dipendente e azionista di VasoRx. Gli altri autori dichiarano di non avere interessi contrastanti.
Riconoscimenti
Questo lavoro è stato sostenuto, in parte, da un Joint Biology Consortium Microgrant fornito nell'ambito della sovvenzione NIH P30AR070253 (PYC), del Fondo per l'educazione alla ricerca medica cardiovascolare (PYC), del VasoRx, Inc. Fund (MS) e delle sovvenzioni NIH HL135582 (MS), HL152197 (MS).
Materiali
| Name | Company | Catalog Number | Comments |
| 5-0 prolene suture pack | Ethicon | 8698G | for incision closure |
| 8-0 nylon suture pack | AROSurgical Instruments | T06A08N14-13 | for ligation |
| Anesthesia induction chamber | VETEQUIP | #941444 | Holds the animal during anesthesia exposure |
| Catheter Interface Cable PEC-4D | Millar | for connecting Millar Mikro-Tip catheter to PCU-2000 | |
| Charcoal canister filters | VETEQUIP | #931401 | to help remove waste anesthetic gases |
| Cotton swabs | McKesson | 24-106 | for applying pressure to the injection site to prevent bleeding |
| Fine scissors | Fine Science Tools | 14059-11 | Surgical tools |
| Insulin syringe 28 G | EXEL | 26027 | for jugular vein IV injection |
| Isoflurane | COVETRUS | #029405 | for mouse anesthesia |
| LabChart 8 Software | ADInstruments | for data analysis | |
| Mikro-Tip Pressure Catheter SPR-1000 (1.0 F) | Millar | for invasive blood pressure measurement | |
| Needle-25 G | BD | 305124 | for making a samll hole in a vessel |
| Oxygen controller ProOx Oxygen Sensor | BioSpherix | E702 | for oxygen concentration monitoring |
| PCU-2000 Pressure Control Unit | Millar | for connecting Millar Mikro-Tip catheter to PowerLab 4/35 | |
| PowerLab 4/35 | ADInstruments | for Data Acquisition. Investigator needs to connect the PowerLab 4/35 to a personal laptop containing LabChart 8 software for operation. | |
| Prism 8 | GraphPad | for statistics and scientific graphing | |
| Semisealable hypoxia chamber | BioSpherix | an artificial environment that simulates high-altitude conditions for animals | |
| Spring Scissors | Fine Science Tools | 15021-15 | Surgical tools |
| Tweezer Style 4 | Electron Microscopy Sciences | 0302-4-PO | Surgical tools |
| VasoRx compound 7C1/let-7 miRNA | VasoRx, Inc. | Lot# B2-L-16Apr | IV injection compound |
| VIP 3000 Veterinary Vaporizer | COLONIAL MEDICAL SUPPLY CO., INC. | for accurate anesthesia delivery |
Riferimenti
- McLaughlin, V. V., McGoon, M. D. Pulmonary arterial hypertension. Circulation. 114 (1), 1417-1431 (2006).
- Hoeper, M. M., Humbert, M. The new haemodynamic definition of pulmonary hypertension: evidence prevails, finally. European Respiratory Journal. 53 (3), 1900038(2019).
- Chen, Y., et al. A novel rat model of pulmonary hypertension induced by mono treatment with SU5416. Hypertension Research. 43 (8), 754-764 (2020).
- Xiong, M., et al. Mouse model of experimental pulmonary hypertension: Lung angiogram and right heart catheterization. Pulmonary Circulation. 11 (4), 20458940211041512(2021).
- Kmiotek, E. K., Baimel, C., Gill, K. J. Methods for intravenous self administration in a mouse model. Journal of Visualized Experiments. (70), e3739(2012).
- Potus, F., Martin, A. Y., Snetsinger, B., Archer, S. L. Biventricular assessment of cardiac function and pressure-volume loops by closed-chest catheterization in mice. Journal of Visualized Experiments. (160), e61088(2020).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/hypoxia mouse model of pulmonary arterial hypertension. Experimental Models of Cardiovascular Diseases. 1816, 243-252 (2018).
- Chen, P. Y., et al. FGF regulates TGF-beta signaling and endothelial-to-mesenchymal transition via control of let-7 miRNA expression. Cell Reports. 2 (6), 1684-1696 (2012).
- Chen, P. Y., et al. Endothelial TGF-beta signalling drives vascular inflammation and atherosclerosis. Nature Metabolism. 1 (9), 912-926 (2019).
- Daugherty, A., Rateri, D., Hong, L., Balakrishnan, A. Measuring blood pressure in mice using volume pressure recording, a tail-cuff method. Journal of Visualized Experiments. (27), e1291(2009).
- Alam, M. A., Parks, C., Mancarella, S. Long-term blood pressure measurement in freely moving mice using telemetry. Journal of Visualized Experiments. (111), e53991(2016).
- Luo, F., et al. Invasive hemodynamic assessment for the right ventricular system and hypoxia-induced pulmonary arterial hypertension in mice. Journal of Visualized Experiments. (152), e60090(2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon