Method Article
Modelo Cirúrgico de Insuficiência Cardíaca com Fração de Ejeção Preservada em Miniporcos Tibetanos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo descreve um procedimento passo a passo para estabelecer um modelo miniporco de insuficiência cardíaca com fração de ejeção preservada usando constrição da aorta descendente. Os métodos para avaliação da morfologia, histologia e função cardíaca desse modelo de doença também são apresentados.
Resumo
Mais da metade dos casos de insuficiência cardíaca (IC) são classificados como insuficiência cardíaca com fração de ejeção preservada (ICFEP) em todo o mundo. Modelos animais de grande porte são limitados para investigar os mecanismos fundamentais da ICFEP e identificar potenciais alvos terapêuticos. Este trabalho fornece uma descrição detalhada do procedimento cirúrgico de constrição da aorta descendente (DAC) em miniporcos tibetanos para estabelecer um modelo animal de grande porte de ICFEP. Esse modelo utilizou uma constrição precisamente controlada da aorta descendente para induzir sobrecarga pressórica crônica no ventrículo esquerdo. O ecocardiograma foi utilizado para avaliar as alterações morfológicas e funcionais do coração. Após 12 semanas de estresse na DAC, o septo ventricular estava hipertrófico, mas a espessura da parede posterior estava significativamente reduzida, acompanhada de dilatação do ventrículo esquerdo. Entretanto, a fração de ejeção do VE dos corações modelo foi mantida em >50% durante o período de 12 semanas. Além disso, o modelo DAC exibiu dano cardíaco, incluindo fibrose, inflamação e hipertrofia de cardiomiócitos. Os marcadores de insuficiência cardíaca estavam significativamente elevados no grupo DAC. Esta ICFEP induzida por DAC em miniporcos é uma ferramenta poderosa para investigar mecanismos moleculares desta doença e para testes pré-clínicos.
Introdução
A insuficiência cardíaca com fração de ejeção preservada (ICFEP) é responsável por mais da metade dos casos de insuficiência cardíaca e tornou-se um problema de saúde pública mundial1. Observações clínicas indicaram várias características críticas da ICFEP: (1) disfunção diastólica ventricular, acompanhada de aumento da rigidez sistólica, (2) fração de ejeção normal em repouso com prejuízo no desempenho do exercício e (3) remodelação cardíaca2. Os mecanismos propostos incluem desregulação hormonal, inflamação microvascular sistêmica, distúrbios metabólicos e anormalidades nas proteínas do sarcomérico e da matriz extracelular3. Entretanto, estudos experimentais têm demonstrado que a insuficiência cardíaca com fração de ejeção reduzida (ICDS) causa essas alterações. Estudos clínicos têm explorado os efeitos terapêuticos dos inibidores dos receptores da angiotensina e de fármacos no tratamento da ICDS na ICFEP 4,5. No entanto, abordagens terapêuticas únicas para ICFEP são necessárias. Em comparação com a compreensão dos sintomas clínicos, as alterações na patologia, bioquímica e biologia molecular da ICFEP permanecem pouco definidas.
Modelos animais de ICFEP têm sido desenvolvidos para explorar mecanismos, marcadores diagnósticos e abordagens terapêuticas. Animais de laboratório, incluindo porcos, cães, ratos e camundongos, podem desenvolver ICFEP, e diversos fatores de risco, incluindo hipertensão, diabetes mellitus e envelhecimento, foram selecionados como fatores de indução 6,7. Por exemplo, acetato de deoxicorticosterona, isolado ou combinado com dieta rica em gordura/açúcar, induz ICFEP em suínos 8,9. A sobrecarga de pressão ventricular é outra técnica utilizada para o desenvolvimento da ICFEP em modelos de animais de grande e pequeno porte10. Além disso, valores de corte específicos de FE para definir ICFEP têm sido adotados em todos os continentes nos últimos anos, como visto nas diretrizes da Sociedade Europeia de Cardiologia, American College of Cardiology Foundation/American Heart Association11, Japanese Circulation Society/Japanese Heart Failure Society12. Assim, muitos modelos previamente estabelecidos podem se tornar apropriados para estudos de ICFEP se os critérios clínicos forem adotados. Por exemplo, Youselfi et al., afirmaram que uma linhagem de camundongos geneticamente modificada, Col4a3-/-, era um modelo eficaz de HFpEF. Essa cepa desenvolveu sintomas cardíacos típicos da ICFEP, como disfunção diastólica, disfunção mitocondrial e remodelamento cardíaco13. Um estudo anterior utilizou uma dieta de alta energia para induzir remodelação cardíaca com uma faixa média de FE em macacos idosos14, caracterizada por distúrbio metabólico, fibrose e redução da actomiosina MgATPase no miocárdio. A constrição aórtica transversa (TAC) de camundongos é um dos modelos mais utilizados para mimetizar a cardiomiopatia ventricular induzida por hipertensão. O ventrículo esquerdo evolui de hipertrofia concêntrica com aumento da FE para remodelamento dilatado com redução da FE15,16. Os fenótipos transicionais entre esses dois estágios típicos sugerem que a técnica de constrição aórtica pode ser usada para estudar a ICFEP.
As características patológicas, a sinalização celular e os perfis de RNAm de um modelo suíno de ICFEP foram previamente publicados17. Aqui, um protocolo passo-a-passo é apresentado para estabelecer esse modelo e as abordagens para avaliar os fenótipos desse modelo. O procedimento está ilustrado na Figura 1. Resumidamente, o plano cirúrgico foi feito em conjunto pelo pesquisador principal, cirurgiões, técnicos de laboratório e equipe de cuidados com os animais. Os miniporcos foram submetidos a exames de saúde, incluindo exames bioquímicos e ecocardiografia. Após a cirurgia, foram realizados procedimentos anti-inflamatórios e analgésicos. Ecocardiografia, exame histológico e biomarcadores foram utilizados para avaliar os fenótipos.
Protocolo
Todos os estudos em animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Instituto de Monitoramento de Animais de Laboratório de Guangdong (aprovação nº. IACUC2017009). Todos os experimentos com animais foram realizados seguindo o Guide for the Care and Use of Laboratory Animals (8th Ed., 2011, The National Academies, EUA). Os animais foram alojados em uma instalação credenciada pela AAALAC no Instituto de Monitoramento de Animais de Laboratório de Guangdong (licença nº. SYXK (YUE) 2016-0122, China). Seis miniporcos tibetanos machos (n = 3 cada para o grupo sham e grupo DAC, 25-30 kg de peso) foram usados para desenvolver o modelo de HFpEF.
1. Preparação de animais e instrumentos
- Aclimatar os animais ao local por 14 dias antes da cirurgia.
- Realizar exames de saúde, incluindo exames bioquímicos e ecocardiografia, antes da cirurgia. Excluir os animais com anormalidades cardíacas na estrutura (dilatação ou hipertrofia ventricular) e função (FE <50%) de acordo com o T/CALAS85-2020 Animais de laboratório - Diretrizes para a avaliação da saúde dos principais órgãos, como coração, fígado, rim e cérebro de grandes animais de laboratório (Associação Chinesa de Ciências Animais de Laboratório, China).
- Jejuar os animais por mais de 12 h antes da anestesia, não se alimentando no dia da cirurgia.
- Preparar a sala cirúrgica e os dispositivos (Figura 2). Verifique a estação de ventilação de anestesia, monitores veterinários e de pacientes, sistema de ultrassom veterinário, aspirador e outros dispositivos cirúrgicos. Autoclave a tesoura, pinça, afastadores, cabos de bisturi, cabeça do aspirador, agulhas cirúrgicas, etc. (ver Tabela de Materiais).
2. Sedação, intubação traqueal e canulação venosa
- Pesar os animais e calcular os fármacos anestésicos. Sedar os miniporcos com 1 mg/kg de injeção de zoletil (tiletamina e zolazepam injetáveis) e 0,5 mg/kg de injeção de cloridrato de xilazina (ver Tabela de Materiais).
- Conter e colocar os miniporcos na posição lateral direita sobre a mesa cirúrgica. Ligue o sistema de aquecimento para manter a temperatura corporal dos animais.
- Realizar o ecocardiograma (passo 5) e coletar 2 mL de amostras de sangue.
- Intubar os miniporcos com um tubo endotraqueal conectado a uma estação de ventilação de anestesia veterinária (Figura 3A) (ver Tabela de Materiais).
- Iniciar a ventilação a 8 mL/kg de volume corrente e 30 ciclos/min. Manter os animais com 1,5%-2,5% de isoflurano durante o procedimento cirúrgico.
- Estabelecer canulação intravenosa usando um cateter intravenoso periférico (26 G) (ver Tabela de Materiais) a partir de uma veia da orelha (geralmente a veia marginal da orelha, Figura 3B).
- Conecte o animal a um monitor veterinário.
3. Procedimento cirúrgico
- Faça a barba na região torácica esquerda. Aplicar 0,7% de iodo e álcool a 75% para preparar assepticamente a pele da escápula ao diafragma (Figura 3C).
- Coloque campos estéreis sobre a área cirúrgica.
- Administrar propofol (5 mg/kg) (ver Tabela de Materiais) por injeção intravenosa para manter a anestesia geral.
- Marque a incisão (~15 cm de comprimento) ao longo do 4º espaço intercostal antes da incisão da pele com eletrocautério.
- Abra o tórax usando uma combinação de cautério e dissecção romba do músculo e do tecido conjuntivo. Use um aspirador para remover o sangue durante a operação.
- Use um afastador de costelas para espalhar as costelas (Figura 3D).
- Localizar o segmento da aorta descendente torácica e determinar o local da constrição (Figura 3E). Utilizar duas suturas cirúrgicas 3-0 para contornar o segmento duas vezes (Figura 3F). Coloque três camadas de gaze médica entre a sutura e a aorta para evitar danos teciduais por suturas.
- Configure unidades de medida de pressão para determinar o grau de constrição (Figura 3F-H).
NOTA: A unidade inclui um cateter que punciona a parede do vaso, tubo de conexão, transdutor de pressão e um monitor do paciente. - Apertar a sutura cirúrgica ao redor do segmento da aorta descendente gradualmente para atingir o grau de constrição desejado. Deixe as leituras de pressão estabilizarem por 20 min e aperte permanentemente os nós cirúrgicos.
- Use um dreno torácico de drenagem para evacuar o ar e o excesso de líquidos na cavidade torácica.
- Fechar a parede torácica em planos, reaproximar as costelas e dividir os músculos com pontos absorvíveis.
- Verifique se há algum sangramento e garanta uma boa hemostasia.
- Aplicar um frasco de benzilpenicilina (800.000 unidades) (ver Tabela de Materiais) na área de operação pós-cirurgia.
- Monitorar a presença de piscar os olhos e o movimento dos membros do animal. Desconecte o ventilador, mas deixe o tubo endotraqueal. Monitorar a presença de respiração espontânea.
- Devolva o animal ao seu alojamento e deixe-o acordar automaticamente.
4. Cuidados pós-cirúrgicos
- Aplicar benzilpenicilina diariamente por 1 semana (20.000 U/kg).
- Aplicar 1 mg/kg de flunixina meglumina (ver Tabela de Materiais) diariamente durante 1 semana.
NOTA: Analgésicos opioides e AINEs devem ser administrados no intra e pós-operatório.
5. Ecocardiografia transtorácica
- Sedar o animal com 1 mg/kg de zoletil.
- Coloque o animal em uma unidade de retenção móvel com uma tampa de lona.
NOTA: A unidade de retenção móvel (ver Tabela de Materiais) tem quatro aberturas projetadas para estender os membros anteriores e posteriores do animal. - Faça a barba no peito esquerdo do animal.
- Coloque os dedos no centro esquerdo do tórax para sentir o pulso apical. Aplique o gel ultra-sônico na área circundante.
- Coloque o transdutor phased array do sistema de ultrassom (3-8 Hz) no terceiro espaço intercostal. Mova o transdutor para uma direção anterior ou posterior e ajuste o ângulo da incisura.
- Identificar os átrios, ventrículos e aorta. Grave as imagens paraesternais de eixo longo dos modos B e M.
NOTA: A imagem modo-B representa a secção transversal do ventrículo esquerdo ao nível do músculo papilar, e a imagem modo-M mostra o movimento do ventrículo esquerdo ao longo do tempo. - Gire a cabeça do transdutor 90° no sentido horário para obter a visão paraesternal de eixo curto. Identificar o ventrículo esquerdo, o ventrículo direito e o músculo papilar. Grave as imagens dos modos B e M.
- Use a estação de trabalho fornecida pelo fabricante do sistema de ultrassom para avaliar a estrutura e a função cardíaca.
Resultados
Ecocardiografia
A estrutura e a função cardíaca foram avaliadas nas semanas 0, 2, 4, 6, 8, 10 e 12. Os registros em modo B e modo M da visão paraesternal de eixo curto são exibidos na Figura 4A. A medida ecocardiográfica incluiu espessura do septo ventricular (VST), espessura da parede posterior (PWT) e dimensão interna do ventrículo esquerdo (LVID). O TEV no final da diástole aumentou nos corações DAC, enquanto o PWT no final da diástole aumentou e depois diminuiu durante o período de observação, sugerindo que o remodelamento hipertrófico estava presente no ventrículo esquerdo dos miniporcos DAC (Figura 4B,C). O LVID no final da diástole diminuiu nas semanas 4 e 6 e aumentou gradualmente após a semana 8, sugerindo que os ventrículos sofreram hipertrofia concêntrica antes da dilatação (Figura 4D). A FEVE dos corações modelo foi mantida em >50% durante o período de 12 semanas (Figura 4E).
Morfologia e marcador de insuficiência cardíaca
Após a 12ª semana, os corações foram colhidos conforme descrito anteriormente17. Comparados com os corações simulados, observou-se aumento dos corações DAC (Figura 5A). A concentração sérica de troponina I cardíaca (cTnI) foi determinada usando um kit de ensaio imunoenzimático nas semanas 0, 4, 8 e 12, seguindo as instruções do fabricante (ver Tabela de Materiais). A densidade óptica foi medida a 450 nm usando um leitor de microplacas. O marcador de insuficiência cardíaca cTnI foi significativamente maior nas semanas 4, 8 e 12 no grupo DAC do que no grupo sham nos momentos correspondentes (Figura 5B).
Exame histológico
Tecidos das paredes livres dos ventrículos esquerdo e direito, septo ventricular, átrio esquerdo e direito, valva mitral e aorta foram coletados e fixados com paraformaldeído a 4%. Os tecidos foram incluídos em blocos, cortados e corados com solução de hematoxilina e eosina (H &E), seguindo o relato anterior17. Cardiomiócitos hipertróficos, fibrose, células inflamatórias, núcleos picnóticos e outras estruturas foram identificados com microscópio de luz. Os cardiomiócitos nos átrios, septo ventricular e ventrículos apresentavam hipertrofia com picnose (Figura 6A). As camadas musculares estavam reduzidas na valva mitral (Figura 6B) e a hiperplasia endotelial vascular na aorta (Figura 6C). Além disso, a DAC induziu extensa fibrose no miocárdio dos miniporcos (Figura 7A), acompanhada de infiltração de células inflamatórias nos ventrículos esquerdos, átrio direito e paredes da aorta (Figura 7B).

Figura 1: Delineamento experimental. O plano experimental foi feito de forma colaborativa pelo pesquisador principal, cirurgiões, técnicos de laboratório e equipe de cuidados com os animais. Os miniporcos foram submetidos a exames de saúde, incluindo exames bioquímicos e ecocardiografia. Após a cirurgia, foram realizados procedimentos anti-inflamatórios e analgésicos. Ecocardiografia, exame histológico e teste de biomarcadores avaliaram fenótipos de insuficiência cardíaca. O número de animais, n = 3 cada, foi para os grupos sham e DAC. Clique aqui para ver uma versão maior desta figura.

Gráfico 2. Dispositivos cirúrgicos. Os dispositivos necessários (A) para a cirurgia de DAC incluíram aspirador (a), mesa cirúrgica (b), monitor veterinário (c), luzes cirúrgicas de LED (d) e estação de ventilação mecânica de anestesia (e). Um sistema de ultrassom veterinário foi utilizado para avaliar a estrutura e função dos corações dos animais antes e após a cirurgia (B). As ferramentas cirúrgicas incluíam laringoscópio (C) e pinças diversas, cabos de bisturi e tesoura (D). Clique aqui para ver uma versão maior desta figura.

Figura 3: Procedimento cirúrgico. Após a sedação, o animal foi intubado com tubo endotraqueal (A), e a canulação intravenosa foi estabelecida através de uma veia auricular (B). O sítio cirúrgico foi no tórax esquerdo do animal (C). Após a exposição da aorta descendente (D,E), determinou-se o local de constrição (SB) e os locais invasivos para monitorização da pressão (SA, SC) (F,G), e a pressão aórtica foi medida com monitor do paciente (H). Um desenho animado exibe a visão geral da estratégia de constrição (I). Clique aqui para ver uma versão maior desta figura.
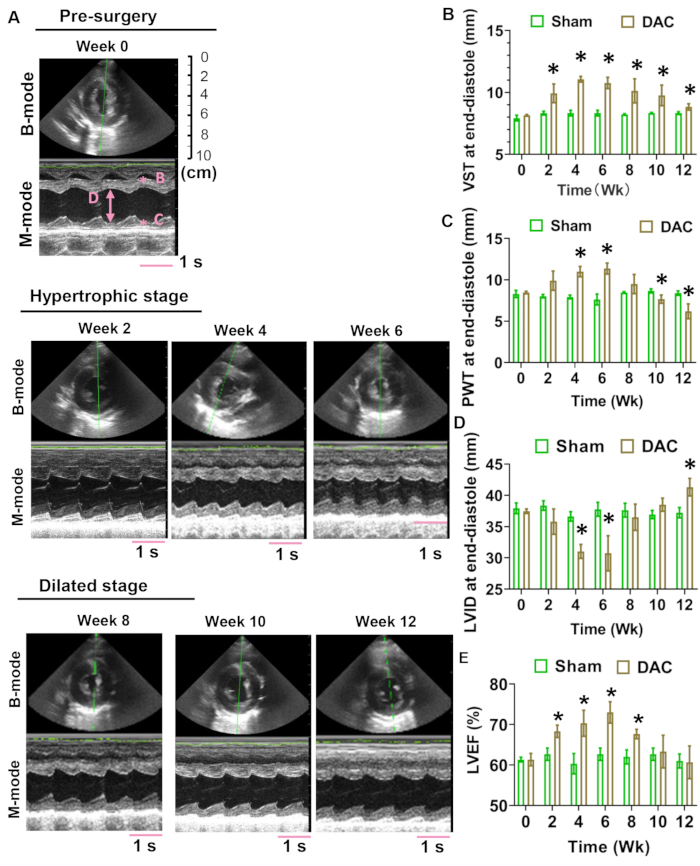
Figura 4: Avaliação ecocardiográfica transtorácica. As imagens representativas dos modos B e M dos corações de sobrecarga de pressão da semana 0 à semana 12 são exibidas em (A). As imagens do modo M gravadas por 4 s são mostradas. A barra rosa da escala indica o comprimento do registro de 1 s.A espessura do septo ventricular (VST) no final da diástole aumentou nos corações DAC (B). Em contraste, a espessura da parede posterior (PWT) no final da diástole aumentou e diminuiu gradualmente durante o período de observação (C). A dimensão interna do ventrículo esquerdo (LVID) no final da diástole diminuiu na semana 4 e na semana 6 e aumentou gradualmente após a semana 8 (D). A FEVE dos corações modelo foi mantida em >50% durante o período de 12 semanas (E). O número de animais, n = 3 cada, foi para os grupos sham e DAC. Testes t não pareados foram utilizados para determinar as diferenças entre os grupos. *P < 0,05 vs. o grupo de simulação. Clique aqui para ver uma versão maior desta figura.

Figura 5: Morfologia cardíaca e cTnI sérica. O tamanho do coração parecia aumentar (A). O marcador de insuficiência cardíaca cTnI foi significativamente maior nas semanas 4, 8 e 12 no grupo DAC do que no grupo sham nos momentos correspondentes (B). O número de animais, n = 3 cada, foi para os grupos sham e DAC. Testes t não pareados foram utilizados para determinar as diferenças entre os grupos. *P < 0,05 vs. o grupo de simulação. Clique aqui para ver uma versão maior desta figura.

Figura 6: Histologia do miocárdio, valva mitral e parede aórtica. A coloração H & E foi utilizada para examinar o tecido cardíaco ao final do experimento. Cardiomiócitos nos átrios, septo ventricular e ventrículos apresentavam hipertrofia (setas em verde; A), acompanhada de pirose (setas em amarelo; A). As camadas musculares estavam reduzidas na valva mitral (setas em azul; B). Hiperplasia endotelial vascular foi observada na aorta (área dentro das linhas azuis; C). Asteriscos vermelhos: tecidos examinados; L. ventrículo esquerdo; R. ventrículo direito; L. átrio esquerdo; R. átrio, átrio direito. Clique aqui para ver uma versão maior desta figura.

Figura 7: Fibrose e inflamação nos corações DAC. O exame histológico mostrou fibrose miocárdica extensa em miniporcos DAC. Evidenciou-se área fibrótica no ventrículo esquerdo (asteriscos e setas amarelas; A). Observou-se infiltração de células inflamatórias nos ventrículos esquerdos, átrio direito e paredes da aorta (asteriscos em verde; B). Asteriscos vermelhos: tecidos examinados; setas em azul, eosinófilos; L. ventrículo esquerdo; R. átrio, átrio direito. Clique aqui para ver uma versão maior desta figura.
Discussão
Este estudo utilizou técnicas de DAC para desenvolver um modelo de HFpEF para miniporcos tibetanos. Um protocolo passo a passo de preparo de animais e instrumentos é apresentado aqui, incluindo sedação, intubação traqueal, canulação venosa, procedimento cirúrgico e cuidados pós-cirúrgicos. As técnicas de registro das imagens ecocardiográficas do coração modo B e modo M também são apresentadas. Após a DAC, o coração sofreu hipertrofia ventricular esquerda durante as semanas 4 e 6 e dilatação após a semana 8. A FEVE foi preservada durante o período de 12 semanas. Fibrose e inflamação foram observadas em corações DAC.
A combinação de operação torácica aberta e constrição aórtica tem sido utilizada para desenvolver modelos de insuficiência cardíaca em animais de grande e pequeno porte. Por exemplo, a hipertensão induzida por constrição da aorta de roedores foi relatada já na década de 195018. A constrição da aorta ascendente em suínos induziu hipertrofia ventricular esquerda leve em suínos com 2-4 semanas de idade. Em relação ao local cirúrgico para localização da aorta ascendente, poucos estudos selecionaram o terceiro espaço intercostal19,20, enquanto outro estudo selecionou o quarto espaço intercostal para a toracotomia lateral21. Verificou-se que a constrição na aorta descendente era prática em miniporcos tibetanos adultos. O segmento da aorta descendente localizava-se logo abaixo do quarto espaço intercostal e circundado por pouco tecido conjuntivo.
O grau de constrição pode ser crucial para induzir características-chave da ICFEP. Melleby e col. relataram que um anel menor acelerou a hipertrofia, enquanto anéis maiores levaram à FE preservada por 8-20 semanas em camundongos com constrição da aorta ascendente22. Massie e col. estabeleceram um gradiente de pressão de 20 mmHg para cirurgia de tórax aberto em porcos para induzir hipertrofia ventricular21. adotaram a inflação progressiva do manguito para gerar ICFEP em porcos fêmeas Yorkshire-Landrace23. No presente estudo, um aumento de 20% na pressão na aorta descendente por 12 semanas levou à ICFEP. Pesquisadores também combinaram técnicas de constrição aórtica com acetato de deoxicorticosterona ou dieta ocidental para induzir ICFEP em fêmeas suínas Ossabaw10,24. Os graus de constrição são tipicamente estimados pela pressão medida usando um cateter de micromanômetro ou ecocardiografia. Um instrumento foi modificado para medir a pressão aórtica. Um cateter com transdutores de pressão arterial descartáveis conectados a um monitor de paciente foi usado para registrar a pressão na aorta descendente.
Nosso estudo anterior apresentou imagens paraesternais típicas de eixo longo dos corações com ICFEP em miniporcos17; Aqui, imagens representativas de eixo curto paraesternal são adicionadas. Consistente com os resultados anteriores, o modelo de DAC miniporco exibiu dois estágios distintos de remodelação cardíaca, hipertrofia concêntrica e dilatação, durante o período de observação de 12 semanas. Esses fenótipos são consistentes com os sintomas clínicos da ICFEP. Novos achados histológicos no modelo de ICFEP também são revelados neste trabalho. Hipertrofia de cardiomiócitos nos átrios, septo ventricular e ventrículos são encontrados. Além disso, obtém-se infiltração celular inflamatória acentuada no ventrículo esquerdo, átrio direito e parede aórtica. Isso complementa os achados anteriores, que demonstraram suprarregulação das interleucinas -6 e -1β, NFκB e produção de citocinas no miocárdio DAC17. A camada muscular desapareceu na valva mitral do porco ICFEP, sugerindo que anormalidades na valva mitral contribuíram para disfunção cardíaca.
O estabelecimento de um procedimento cirúrgico asséptico é fundamental para a obtenção de modelos suínos bem sucedidos e estáveis. A cirurgia de constrição da aorta em porcos requer mais operadores do que em roedores. Geralmente requer uma equipe cirúrgica experiente de dois cirurgiões, um anestesiologista, duas enfermeiras de centro cirúrgico. Essas funções podem ser assumidas por veterinários, cirurgiões humanos e/ou técnicos bem treinados. Em comparação com uma cirurgia de roedores que leva cerca de 30 minutos para completar um procedimento de constrição da aorta, pode levar mais de 3 h para concluir um procedimento semelhante em porcos. Na prática, instalações insuficientes e pessoal qualificado para cirurgia de grandes animais limitam a aplicação de modelos cirúrgicos de suínos.
Divulgações
Os autores declaram não ter interesses concorrentes.
Agradecimentos
Este trabalho foi apoiado pelo Programa de Ciência e Tecnologia de Guangdong (2008A08003, 2016A020216019, 2019A030317014), pelo Programa de Ciência e Tecnologia de Guangzhou (201804010206), pela Fundação Nacional de Ciências Naturais da China (31672376, 81941002) e pelo Laboratório Chave de Animais de Laboratório da Província de Guangdong (2017B030314171).
Materiais
| Name | Company | Catalog Number | Comments |
| Absorbable surgical suture | Putong Jinhua Medical Co. Ltd, China | 4-0 | |
| Aesthesia ventilator station | Shenzhen Mindray Bio-Medical Electronics Co., Ltd, China | WATO EX-35vet | |
| Aspirator | Shanghai Baojia Medical Apparatus Co., Ltd, China | YX930D | |
| Benzylpenicillin | Sichuan Pharmaceutical. INC, China | H5021738 | |
| Disposal endotracheal tube with cuff | Shenzhen Verybio Co., Ltd, China | 20 cm, ID 0.9 | |
| Disposal transducer | Guangdong Baihe Medical Technology Co., Ltd, China | ||
| Dissection blade | Shanghai Medical Instruments (Group) Co., Ltd, China | ||
| Electrocautery | Shanghai Hutong Medical Instruments (Group) Co., Ltd, China | GD350-B | |
| Enzyme-linked immunosorbent assay ELISA kit | Cusabio Biotech Co., Ltd, China | CSB-E08594r | |
| Eosin | Sigma-Aldrich Corp. | E4009 | |
| Flunixin meglumine | Shanghai Tongren Pharmaceutical Co., Ltd., China | Shouyaozi(2012)-090242103 | |
| Forceps | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Hematoxylin | Sigma-Aldrich Corp. | H3136 | |
| Isoflurane | RWD Life Science Co., Ltd, China | Veteasy for animals | |
| Laryngoscope | Taixing Simeite Medical Apparatus and Instruments Limited Co., Ltd, China | For adults | |
| LED surgical lights | Mingtai Medical Group, China | ZF700 | |
| Microplate reader | Thermo Fisher Scientific, USA | Multiskan FC | |
| Microscope | Leica, Germany | DM2500 | |
| Mobile restraint unit | Customized | N/A | A mobile restraint unit, made by metal frame and wheels, with a canvas cover |
| Oxygen | Local suppliers, Guangzhou, China | ||
| Paraformaldehyde | Sigma-Aldrich Corp. | V900894 | |
| Patient monitor | Shenzhen Mindray Bio-Medical Electronics Company, China | Beneview T5 | |
| Peripheral Intravenous (IV) Catheter | Shenzhen Yima Pet Industry Development Co., Ltd., China | 26G X 16 mm | |
| Propofol | Guangdong Jiabo Phamaceutical Co., Ltd. | H20051842 | |
| Rib retractor | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Ruler | Deli Manufacturing Company, China | ||
| Scalpel handles | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Scissors (g) | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Suture | Medtronic-Coviden Corp. | 3-0, 4-0 | |
| Ultrasonic gel | Tianjin Xiyuansi Production Institute, China | TM-100 | |
| Veterinary monitor | Shenzhen Mindray Bio-Medical Electronics Company, China | ePM12M Vet | |
| Veterinary ultrasound system | Esatoe, Italy | MyLab30 | Equiped with phased array transducer (3-8 Hz) |
| Xylazine hydrochloride injection | Shenda Animal Phamarceutical Co., Ltd., China | Shouyaozi(2016)-07003 | |
| Zoletil injection | Virbac, France | Zoletil 50 | Tiletamine and zolazepam for injection |
Referências
- Dunlay, S. M., Roger, V. L., Redfield, M. M. Epidemiology of heart failure with preserved ejection fraction. Nature Reviews Cardiology. 14 (10), 591-602 (2017).
- Redfield, M. M. Heart failure with preserved ejection fraction. New England Journal of Medicine. 375 (19), 1868-1877 (2016).
- Lam, C. S. P., Voors, A. A., de Boer, R. A., Solomon, S. D., van Veldhuisen, D. J. Heart failure with preserved ejection fraction: From mechanisms to therapies. European Heart Journal. 39 (30), 2780-2792 (2018).
- Solomon, S. D., et al. Angiotensin receptor neprilysin inhibition in heart failure with preserved ejection fraction: Rationale and design of the PARAGON-HF trial. JACC-Heart Failure. 5 (7), 471-482 (2017).
- Cunningham, J. W., et al. Effect of sacubitril/valsartan on biomarkers of extracellular matrix regulation in patients with HFpEF. Journal of the American College of Cardiology. 76 (5), 503-514 (2020).
- Conceição, G., Heinonen, I., Lourenço, A. P., Duncker, D. J., Falcão-Pires, I. Animal models of heart failure with preserved ejection fraction. Netherlands Heart Journal. 24 (4), 275-286 (2016).
- Noll, N. A., Lal, H., Merryman, W. D. Mouse models of heart failure with preserved or reduced ejection fraction. American Journal of Pathology. 190 (8), 1596-1608 (2020).
- Schwarzl, M., et al. A porcine model of hypertensive cardiomyopathy: Implications for heart failure with preserved ejection fraction. American Journal of Physiology-Heart and Circulatory Physiology. 309 (9), 1407-1418 (2015).
- Reiter, U., et al. Early-stage heart failure with preserved ejection fraction in the pig: A cardiovascular magnetic resonance study. Journal of Cardiovascular Magnetic Resonance. 18 (1), 63 (2016).
- Silva, K. A. S., et al. Tissue-specific small heat shock protein 20 activation is not associated with traditional autophagy markers in Ossabaw swine with cardiometabolic heart failure. American Journal of Physiology-Heart and Circulatory Physiology. 319 (5), 1036-1043 (2020).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal. 37 (27), 2129-2200 (2016).
- Tsutsui, H., et al. JCS 2017/JHFS 2017 guideline on diagnosis and treatment of acute and chronic heart failure - Digest version. Circulation Journal. 83 (10), 2084-2184 (2019).
- Yousefi, K., Dunkley, J. C., Shehadeh, L. A. A preclinical model for phenogroup 3 HFpEF. Aging (Albany NY). 11 (13), 4305-4307 (2019).
- Zheng, S., et al. Aged monkeys fed a high-fat/high-sugar diet recapitulate metabolic disorders and cardiac contractile dysfunction. Journal of Cardiovascular Translational Research. 14 (5), 799-815 (2021).
- Shirakabe, A., et al. Drp1-dependent mitochondrial autophagy plays a protective role against pressure overload-induced mitochondrial dysfunction and heart failure. Circulation. 133 (13), 1249-1263 (2016).
- Zhabyeyev, P., et al. Pressure-overload-induced heart failure induces a selective reduction in glucose oxidation at physiological afterload. Cardiovascular Research. 97 (4), 676-685 (2013).
- Tan, W., et al. A porcine model of heart failure with preserved ejection fraction induced by chronic pressure overload characterized by cardiac fibrosis and remodeling. Frontiers in Cardiovascular Medicine. 8, 677727 (2021).
- Beznak, M. Changes in heart weight and blood pressure following aortic constriction in rats. Canadian Journal of Biochemistry and Physiology. 33 (6), 995-1002 (1955).
- Bikou, O., Miyashita, S., Ishikawa, K. Pig model of increased cardiac afterload induced by ascending aortic banding. Methods in Molecular Biology. 1816, 337-342 (2018).
- Hiemstra, J. A., et al. Chronic low-intensity exercise attenuates cardiomyocyte contractile dysfunction and impaired adrenergic responsiveness in aortic-banded mini-swine. Journal of Applied Physiology. 124 (4), 1034-1044 (2018).
- Massie, B. M., et al. Myocardial high-energy phosphate and substrate metabolism in swine with moderate left ventricular hypertrophy. Circulation. 91 (6), 1814-1823 (1995).
- Melleby, A. O., et al. A novel method for high precision aortic constriction that allows for generation of specific cardiac phenotypes in mice. Cardiovascular Research. 114 (12), 1680-1690 (2018).
- Charles, C. J., et al. A porcine model of heart failure with preserved ejection fraction: magnetic resonance imaging and metabolic energetics. ESC Heart Failure. 7 (1), 92-102 (2020).
- Olver, T. D., et al. Western, diet-fed, aortic-banded ossabaw swine: A Preclinical model of cardio-metabolic heart failure. JACC Basic to Translational Science. 4 (3), 404-421 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados