Method Article
Un modèle chirurgical d’insuffisance cardiaque avec fraction d’éjection préservée chez les mini-porcs tibétains
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le présent protocole décrit une procédure étape par étape pour établir un modèle mini-porc d’insuffisance cardiaque avec fraction d’éjection préservée à l’aide d’une constriction aortique descendante. Les méthodes d’évaluation de la morphologie, de l’histologie et de la fonction cardiaques de ce modèle de maladie sont également présentées.
Résumé
Plus de la moitié des cas d’insuffisance cardiaque (IC) sont classés comme insuffisance cardiaque avec fraction d’éjection préservée (HFpEF) dans le monde. Les grands modèles animaux sont limités pour étudier les mécanismes fondamentaux de l’HFpEF et identifier des cibles thérapeutiques potentielles. Ce travail fournit une description détaillée de l’intervention chirurgicale de la constriction aortique descendante (DAC) chez les mini-porcs tibétains afin d’établir un modèle animal de grande taille de HFpEF. Ce modèle utilisait une constriction contrôlée avec précision de l’aorte descendante pour induire une surcharge de pression chronique dans le ventricule gauche. L’échocardiographie a été utilisée pour évaluer les changements morphologiques et fonctionnels dans le cœur. Après 12 semaines de stress DAC, le septum ventriculaire était hypertrophique, mais l’épaisseur de la paroi postérieure était significativement réduite, accompagnée d’une dilatation du ventricule gauche. Cependant, la fraction d’éjection VG des cœurs modèles a été maintenue à >50 % au cours de la période de 12 semaines. De plus, le modèle DAC présentait des lésions cardiaques, notamment une fibrose, une inflammation et une hypertrophie cardiomyocytaire. Les taux de marqueurs de l’insuffisance cardiaque étaient significativement élevés dans le groupe DAC. Cette HFpEF induite par le DAC chez les miniporcs est un outil puissant pour l’étude des mécanismes moléculaires de cette maladie et pour les tests précliniques.
Introduction
L’insuffisance cardiaque avec fraction d’éjection préservée (HFpEF) représente plus de la moitié des cas d’insuffisance cardiaque et est devenue un problème de santé publique mondial1. Les observations cliniques ont indiqué plusieurs caractéristiques critiques de l’HFpEF : (1) un dysfonctionnement diastolique ventriculaire, accompagné d’une rigidité systolique accrue, (2) une fraction d’éjection normale au repos avec une altération des performances physiques, et (3) un remodelage cardiaque2. Les mécanismes proposés comprennent le dérèglement hormonal, l’inflammation microvasculaire systémique, les troubles métaboliques et les anomalies des protéines sarcomériques et de la matrice extracellulaire3. Cependant, des études expérimentales ont montré que l’insuffisance cardiaque avec fraction d’éjection réduite (HFrEF) provoque ces altérations. Des études cliniques ont exploré les effets thérapeutiques des inhibiteurs des récepteurs de l’angiotensine et des médicaments pour le traitement de l’HFrEF dans l’HFpEF 4,5. Cependant, des approches thérapeutiques uniques pour l’HFpEF sont nécessaires. Par rapport à la compréhension des symptômes cliniques, les altérations de la pathologie, de la biochimie et de la biologie moléculaire de l’HFpEF restent mal définies.
Des modèles animaux de HFpEF ont été développés pour explorer les mécanismes, les marqueurs diagnostiques et les approches thérapeutiques. Les animaux de laboratoire, y compris les porcs, les chiens, les rats et les souris, peuvent développer une HFpEF, et divers facteurs de risque, notamment l’hypertension, le diabète sucré et le vieillissement, ont été sélectionnés comme facteurs d’induction 6,7. Par exemple, l’acétate de désoxycorticostérone seul ou associé à un régime riche en graisses/sucres induit une HFpEF chez les porcs 8,9. La surcharge de pression ventriculaire est une autre technique utilisée pour développer l’HFpEF dans des modèles animaux de grande et de petitetaille 10. En outre, des valeurs seuils spécifiques pour définir l’HFpEF ont été adoptées sur tous les continents ces dernières années, comme le montrent les lignes directrices de la Société européenne de cardiologie, de l’American College of Cardiology Foundation/American Heart Association11, de la Japanese Circulation Society/de la Japanese Heart Failure Society12. Ainsi, de nombreux modèles déjà établis peuvent devenir appropriés pour les études HFpEF si les critères cliniques sont adoptés. Par exemple, Youselfi et al. ont affirmé qu’une souche de souris génétiquement modifiée, Col4a3-/-, était un modèle HFpEF efficace. Cette souche a développé des symptômes cardiaques typiques de l’HFpEF, tels qu’un dysfonctionnement diastolique, un dysfonctionnement mitochondrial et un remodelage cardiaque13. Une étude antérieure a utilisé un régime riche en énergie pour induire un remodelage cardiaque avec un intervalle moyen de FE chez des singes âgés de14 ans, caractérisé par un trouble métabolique, une fibrose et une réduction de l’actomyosine MgATPase dans le myocarde. La constriction aortique transverse (TAC) chez la souris est l’un des modèles les plus largement utilisés pour imiter la cardiomyopathie ventriculaire induite par l’hypertension. Le ventricule gauche passe d’une hypertrophie concentrique avec une FE accrue à un remodelage dilaté avec une FE réduitede 15,16. Les phénotypes de transition entre ces deux stades typiques suggèrent que la technique de constriction aortique peut être utilisée pour étudier l’HFpEF.
Les caractéristiques pathologiques, la signalisation cellulaire et les profils d’ARNm d’un modèle porcin HFpEF ont déjà été publiés17. Ici, un protocole étape par étape est présenté pour établir ce modèle et les approches pour évaluer les phénotypes de ce modèle. La procédure est illustrée à la figure 1. Brièvement, le plan chirurgical a été élaboré conjointement par le chercheur principal, les chirurgiens, les techniciens de laboratoire et le personnel de soins aux animaux. Les mini-porcs ont subi des examens de santé, y compris des tests biochimiques et une échocardiographie. Après la chirurgie, des procédures anti-inflammatoires et analgésiques ont été effectuées. L’échocardiographie, l’examen histologique et les biomarqueurs ont été utilisés pour évaluer les phénotypes.
Protocole
Toutes les études sur les animaux ont été approuvées par le Comité institutionnel de protection et d’utilisation des animaux de l’Institut de surveillance des animaux de laboratoire du Guangdong (approbation n° d’homologation). IACUC2017009). Toutes les expériences sur les animaux ont été réalisées conformément au Guide for the Care and Use of Laboratory Animals (8e éd., 2011, The National Academies, États-Unis). Les animaux ont été hébergés dans une installation accréditée par l’AAALAC à l’Institut de surveillance des animaux de laboratoire du Guangdong (licence n°. SYXK (YUE) 2016-0122, Chine). Six mini-porcs tibétains mâles (n = 3 chacun pour le groupe simulé et le groupe DAC, poids de 25 à 30 kg) ont été utilisés pour développer le modèle HFpEF.
1. Préparation des animaux et des instruments
- Acclimater les animaux à l’établissement pendant 14 jours avant la chirurgie.
- Effectuer des examens de santé, y compris des tests biochimiques et une échocardiographie, avant la chirurgie. Exclure les animaux présentant des anomalies cardiaques de structure (dilatation ventriculaire ou hypertrophie) et de fonction (FE <50 %) conformément à la T/CALAS85-2020 Animaux de laboratoire - Lignes directrices pour l’évaluation de la santé des principaux organes, tels que le cœur, le foie, les reins et le cerveau des grands animaux de laboratoire (Association chinoise pour les sciences des animaux de laboratoire, Chine).
- Faire jeûner les animaux pendant plus de 12 h avant l’anesthésie en ne les nourrissant pas le jour de l’opération.
- Préparez la salle d’opération et les appareils (Figure 2). Vérifiez la station de ventilation d’esthésie, les moniteurs vétérinaires et patients, le système d’échographie vétérinaire, l’aspirateur et d’autres dispositifs chirurgicaux. Autoclaver les ciseaux, les pinces, les écarteurs, les manches de scalpel, la tête de l’aspirateur, les aiguilles chirurgicales, etc. (voir le tableau des matériaux).
2. Sédation, intubation trachéale et canulation veineuse
- Pesez les animaux et calculez les médicaments anesthésiques. Endormir les miniporcs avec 1 mg/kg de zolétil injectable (tilétamine et zolazépam pour injection) et 0,5 mg/kg de chlorhydrate de xylazine injectable (voir le tableau des matériaux).
- Contentez et placez les miniporcs en position couchée latérale droite sur la table d’opération. Allumez le système de chauffage pour maintenir la température corporelle des animaux.
- Effectuez l’échocardiographie (étape 5) et prélevez 2 mL d’échantillons de sang.
- Intuber les miniporcs à l’aide d’une sonde endotrachéale reliée à un ventilateur d’anesthésie vétérinaire (figure 3A) (voir le tableau des matériaux).
- Amorcer la ventilation à un volume courant de 8 ml/kg et à 30 respirations/min. Maintenir les animaux avec 1,5 % à 2,5 % d’isoflurane pendant l’intervention chirurgicale.
- Établir une canulation intraveineuse à l’aide d’un cathéter intraveineux périphérique (26 G) (voir le tableau des matériaux) à partir d’une veine de l’oreille (généralement la veine marginale de l’oreille, figure 3B).
- Connectez l’animal à un moniteur vétérinaire.
3. Intervention chirurgicale
- Rasez la région thoracique gauche. Appliquer 0,7 % d’iode et 75 % d’alcool pour préparer la peau de manière aseptique de l’omoplate au diaphragme (Figure 3C).
- Placez des champs stériles sur la zone chirurgicale.
- Administrer du propofol (5 mg/kg) (voir le tableau des matériaux) par injection intraveineuse pour maintenir l’anesthésie générale.
- Marquez l’incision (~15 cm de long) le long du 4ème espace intercostal avant l’incision cutanée avec l’électrocautérisation.
- Ouvrez la poitrine à l’aide d’une combinaison de cautérisation et de dissection contondante du muscle et du tissu conjonctif. Utilisez un aspirateur pour prélever le sang pendant l’opération.
- Utilisez un écarteur de côtes pour écarter les côtes (Figure 3D).
- Localisez le segment de l’aorte thoracique descendante et déterminez le site de constriction (Figure 3E). Utilisez deux sutures chirurgicales 3-0 pour faire deux fois le tour du segment (Figure 3F). Placez trois couches de gaze médicale entre la suture et l’aorte pour éviter d’endommager les tissus par les sutures.
- Mettre en place des unités de mesure de pression pour déterminer le degré de constriction (Figure 3F-H).
REMARQUE : L’unité comprend un cathéter qui perfore la paroi du vaisseau, un tube de connexion, un transducteur de pression et un moniteur patient. - Serrez progressivement la suture chirurgicale entourant le segment descendant de l’aorte pour obtenir le degré de constriction souhaité. Laissez les lectures de pression se stabiliser pendant 20 min et serrez définitivement les nœuds chirurgicaux.
- Utilisez une sonde thoracique de drainage pour évacuer l’air et l’excès de liquide dans la cavité thoracique.
- Fermez la paroi thoracique en couches, rapprochez les côtes et les muscles divisés avec des sutures résorbables.
- Vérifiez s’il y a des saignements et assurez-vous d’une bonne hémostase.
- Appliquez un flacon de benzylpénicilline (800 000 unités) (voir le tableau des matériaux) sur la zone opératoire après la chirurgie.
- Surveillez la présence de clignements d’yeux et de mouvements des membres de l’animal. Débranchez le ventilateur mais laissez la sonde endotrachéale. Surveillez la présence d’une respiration spontanée.
- Remettez l’animal dans sa chambre d’hébergement et laissez-le se réveiller automatiquement.
4. Soins post-opératoires
- Appliquer de la benzylpénicilline quotidiennement pendant 1 semaine (20 000 U/kg).
- Appliquer 1 mg/kg de flunixine méglumine (voir le tableau des matériaux) par jour pendant 1 semaine.
REMARQUE : Les analgésiques opioïdes et AINS doivent être administrés en per- et postopératoire.
5. Échocardiographie transthoracique
- Endormir l’animal avec 1 mg/kg de zolétil.
- Placez l’animal dans une unité de contention mobile avec une housse en toile.
REMARQUE : L’unité de contention mobile (voir le tableau des matériaux) est dotée de quatre ouvertures conçues pour étendre les membres antérieurs et postérieurs de l’animal. - Rasez la poitrine gauche de l’animal.
- Placez les doigts sur le centre gauche de la poitrine pour sentir le pouls apical. Appliquez le gel ultrasonique sur la zone environnante.
- Placez le transducteur multiéléments de l’échographe (3-8 Hz) dans le troisième espace intercostal. Déplacez le transducteur vers l’avant ou vers l’arrière et ajustez l’angle d’encoche.
- Identifiez les oreillettes, les ventricules et l’aorte. Enregistrez les images parasternales en mode B et en mode M à grand axe.
REMARQUE : L’image en mode B représente la section transversale du ventricule gauche au niveau du muscle papillaire, et l’image en mode M montre le mouvement du ventricule gauche au fil du temps. - Tournez la tête du transducteur de 90° dans le sens des aiguilles d’une montre pour obtenir la vue parasternale à court axe. Identifiez le ventricule gauche, le ventricule droit et le muscle papillaire. Enregistrez les images en mode B et en mode M.
- Utilisez le poste de travail fourni par le fabricant de l’échographe pour évaluer la structure et la fonction cardiaques.
Résultats
Échocardiographie
La structure et la fonction cardiaques ont été évaluées aux semaines 0, 2, 4, 6, 8, 10 et 12. Les enregistrements en mode B et en mode M de la vue parasternale à court axe sont illustrés à la figure 4A. La mesure échocardiographique comprenait l’épaisseur du septum ventriculaire (VST), l’épaisseur de la paroi postérieure (PWT) et la dimension interne du ventricule gauche (LVID). La VST à la fin de la diastole a augmenté dans les cœurs DAC, tandis que la PWT à la fin de la diastole a augmenté puis diminué au cours de la période d’observation, ce qui suggère qu’un remodelage hypertrophique était présent dans le ventricule gauche des mini-porcs DAC (Figure 4B,C). Le LVID en fin de diastole a diminué aux semaines 4 et 6, puis a augmenté progressivement après la semaine 8, ce qui suggère que les ventricules ont subi une hypertrophie concentrique avant la dilatation (Figure 4D). La FEVG des cœurs modèles a été maintenue à >50 % au cours de la période de 12 semaines (figure 4E).
Morphologie et marqueur de l’insuffisance cardiaque
Après la semaine 12, les cœurs ont été récoltés comme décrit précédemment17. Par rapport à ceux des cœurs factices, on a observé une hypertrophie des cœurs DAC (Figure 5A). La concentration sérique de troponine I cardiaque (cTnI) a été déterminée à l’aide d’une trousse de dosage immuno-enzymatique aux semaines 0, 4, 8 et 12 selon les instructions du fabricant (voir le tableau des matériaux). La densité optique a été mesurée à 450 nm à l’aide d’un lecteur de microplaques. Le marqueur d’insuffisance cardiaque cTnI était significativement plus élevé aux semaines 4, 8 et 12 dans le groupe DAC que dans le groupe simulé aux moments correspondants (Figure 5B).
Examen histologique
Les tissus des parois libres des ventricules gauche et droit, du septum ventriculaire, de l’oreillette gauche et droite, de la valve mitrale et de l’aorte ont été prélevés et fixés avec 4% de paraformaldéhyde. Les tissus ont été enrobés, découpés en sections et colorés avec une solution d’hématoxyline et d’éosine (H & E) à la suite du rapport précédent17. Les cardiomyocytes hypertrophiques, la fibrose, les cellules inflammatoires, les noyaux pynokes et d’autres structures ont été identifiés au microscope optique. Les cardiomyocytes des oreillettes, de la cloison ventriculaire et des ventricules présentaient une hypertrophie avec pyknose (Figure 6A). Les couches musculaires ont été réduites dans la valve mitrale (Figure 6B) et une hyperplasie endothéliale vasculaire a été observée dans l’aorte (Figure 6C). De plus, le DAC a induit une fibrose étendue dans le myocarde des mini-porcs (Figure 7A), accompagnée d’une infiltration de cellules inflammatoires dans les ventricules gauches, l’oreillette droite et les parois aortiques (Figure 7B).

Figure 1 : Plan d’expérience. Le plan expérimental a été élaboré en collaboration par le chercheur principal, les chirurgiens, les techniciens de laboratoire et le personnel des soins aux animaux. Les mini-porcs ont subi des examens de santé, y compris des tests biochimiques et une échocardiographie. Après l’opération, des procédures anti-inflammatoires et analgésiques ont été effectuées. L’échocardiographie, l’examen histologique et le test de biomarqueurs ont permis d’évaluer les phénotypes de l’insuffisance cardiaque. Le nombre d’animaux, n = 3 chacun, correspondait aux groupes fictifs et DAC. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 2. Dispositifs chirurgicaux. Les appareils nécessaires (A) pour la chirurgie DAC comprenaient l’aspirateur (a), la table d’opération (b), le moniteur vétérinaire (c), les éclairages chirurgicaux à LED (d) et la station de ventilation d’esthésie (e). Un système d’échographie vétérinaire a été utilisé pour évaluer la structure et la fonction des cœurs des animaux avant et après la chirurgie (B). Les outils chirurgicaux comprenaient un laryngoscope (C) et diverses pinces, des manches de scalpel et des ciseaux (D). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Intervention chirurgicale. Après la sédation, l’animal a été intubé à l’aide d’une sonde endotrachéale (A) et la canulation intraveineuse a été établie par une veine de l’oreille (B). Le site chirurgical se trouvait au niveau de la poitrine gauche de l’animal (C). Après avoir exposé l’aorte descendante (D,E), le site de constriction (SB) et les sites invasifs pour la surveillance de la pression (SA, SC) ont été déterminés (F, G), et la pression aortique a été mesurée à l’aide d’un moniteur patient (H). Une caricature montre la vue d’ensemble de la stratégie de constriction (I). Veuillez cliquer ici pour voir une version agrandie de cette figure.
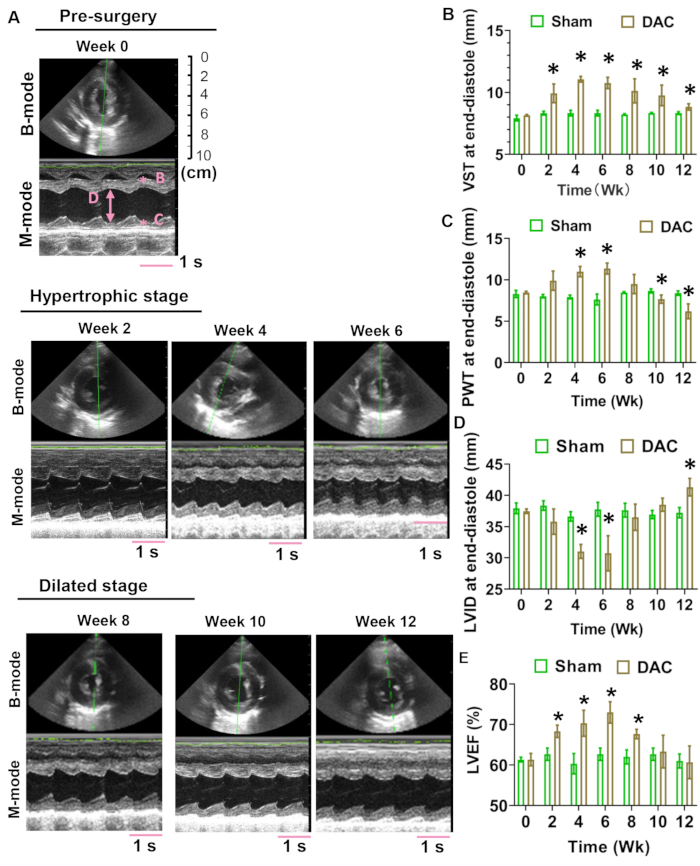
Figure 4 : Évaluation de l’échocardiographie transthoracique. Les images représentatives en mode B et en mode M des cœurs de surcharge de pression de la semaine 0 à la semaine 12 sont affichées en (A). Les images en mode M enregistrées pendant 4 s sont affichées. La barre d’échelle rose indique la longueur record de 1 s.L’épaisseur du septum ventriculaire (VST) à la fin de la diastole a augmenté dans les cœurs DAC (B). En revanche, l’épaisseur de la paroi postérieure (TP) à la fin de la diastole a progressivement augmenté et diminué au cours de la période d’observation (C). La dimension interne du ventricule gauche (VID) à la fin de la diastole a diminué au cours de la semaine 4 et de la semaine 6, puis a augmenté progressivement après la semaine 8 (D). La FEVG des cœurs modèles a été maintenue à >50 % au cours de la période de 12 semaines (E). Le nombre d’animaux, n = 3 chacun, correspondait aux groupes fictifs et DAC. Des tests t non appariés ont été utilisés pour déterminer les différences entre les groupes. *P < 0,05 vs. le groupe simulé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Morphologie du cœur et cTnI sérique. La taille du cœur a semblé augmenter (A). Le marqueur d’insuffisance cardiaque cTnI était significativement plus élevé aux semaines 4, 8 et 12 dans le groupe DAC que dans le groupe simulé aux points de temps correspondants (B). Le nombre d’animaux, n = 3 chacun, correspondait aux groupes fictifs et DAC. Des tests t non appariés ont été utilisés pour déterminer les différences entre les groupes. *P < 0.05 vs. le groupe simulé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Histologie du myocarde, de la valve mitrale et de la paroi aortique. La coloration H & E a été utilisée pour examiner le tissu cardiaque à la fin de l’expérience. Les cardiomyocytes des oreillettes, de la cloison ventriculaire et des ventricules présentaient une hypertrophie (flèches en vert ; A), accompagné de pyrosis (flèches en jaune ; A). Les couches musculaires ont été réduites dans la valve mitrale (flèches en bleu ; B). Une hyperplasie de l’endothélium vasculaire a été observée dans l’aorte (zone à l’intérieur des lignes bleues ; C). Astérisques rouges : tissus examinés ; L. ventricule, ventricule gauche ; Ventricule droit, ventricule droit ; L. oreillette, oreillette gauche ; R. oreillette, oreillette droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Fibrose et inflammation dans les cœurs DAC. L’examen histologique a montré une fibrose myocardique étendue chez les miniporcs DAC. Une zone fibreuse dans le ventricule gauche était visible (astérisques et flèches en jaune ; A). Une infiltration de cellules inflammatoires a été observée dans les ventricules gauches, l’oreillette droite et les parois aortiques (astérisques en vert ; B). Astérisques rouges : tissus examinés ; flèches bleues, éosinophiles ; L. ventricule, ventricule gauche ; R. oreillette, oreillette droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette étude a utilisé les techniques DAC pour développer un modèle HFpEF pour les mini-porcs tibétains. Un protocole étape par étape de préparation de l’animal et de l’instrument est présenté ici, y compris la sédation, l’intubation trachéale, la canulation veineuse, l’intervention chirurgicale et les soins post-opératoires. Les techniques d’enregistrement des images cardiaques échocardiographiques en mode B et en mode M sont également présentées. Après le DAC, le cœur a subi une hypertrophie ventriculaire gauche pendant les semaines 4 et 6 et une dilatation après la semaine 8. Le FEVG a été préservé pendant la période de 12 semaines. Une fibrose et une inflammation ont été observées dans les cœurs DAC.
La combinaison d’une opération thoracique ouverte et d’une constriction aortique a été utilisée pour développer des modèles d’insuffisance cardiaque chez les grands et les petits animaux. Par exemple, l’hypertension induite par la constriction aortique chez les rongeurs a été signalée dès les années 195018. La constriction de l’aorte ascendante chez le porc a induit une légère hypertrophie ventriculaire gauche chez les porcs âgés de 2 à 4 semaines. En ce qui concerne le site opératoire pour la localisation de l’aorte ascendante, quelques études ont retenu le troisième espace intercostal19,20, tandis qu’une autre étude a retenu le quatrième espace intercostal pour la thoracotomie latérale21. Il a été constaté que la constriction au niveau de l’aorte descendante était pratique chez les mini-porcs tibétains adultes. Le segment aortique descendant était situé juste sous le quatrième espace intercostal et entouré de peu de tissu conjonctif.
Le degré de constriction peut être crucial pour induire les principales caractéristiques de l’HFpEF. Melleby et al. ont rapporté qu’une taille d’anneau plus petite accélérait l’hypertrophie, tandis que des tailles d’anneau plus grandes conduisaient à une FE préservée pendant 8 à 20 semaines chez les souris présentant une constriction aortique ascendante22. Massie et al. ont fixé un gradient de pression de 20 mmHg pour la chirurgie thoracique ouverte chez les porcs afin d’induire une hypertrophie ventriculaire21. Charles et al. ont adopté le gonflage progressif de la coiffe pour générer de l’HFpEF chez les porcs femelles Yorkshire-Landrace23. Dans la présente étude, une augmentation de 20% de la pression au niveau de l’aorte descendante pendant 12 semaines a conduit à une HFpEF. Les chercheurs ont également combiné des techniques de constriction aortique avec de l’acétate de désoxycorticostérone ou un régime alimentaire occidental pour induire l’HFpEF chez les porcs femelles Ossabaw10,24. Les degrés de constriction sont généralement estimés par la pression mesurée à l’aide d’un micro-manomètre, d’un cathéter ou d’une échocardiographie. Un outil avait été modifié pour mesurer la pression aortique. Un cathéter muni de transducteurs de pression jetables reliés à un moniteur patient a été utilisé pour enregistrer la pression au niveau de l’aorte descendante.
Notre étude précédente présentait des images parasternales typiques du grand axe des cœurs HFpEF chez les miniporcs17 ; Ici, des images parasternales représentatives du petit axe sont ajoutées. Conformément aux résultats précédents, le modèle DAC miniporc a montré deux stades distincts de remodelage cardiaque, d’hypertrophie concentrique et de dilatation, au cours de la période d’observation de 12 semaines. Ces phénotypes sont compatibles avec les symptômes cliniques de l’HFpEF. De nouveaux résultats histologiques dans le modèle HFpEF sont également révélés dans ce travail. On trouve une hypertrophie cardiomyocytaire dans les oreillettes, le septum ventriculaire et les ventricules. De plus, une infiltration cellulaire inflammatoire sévère dans le ventricule gauche, l’oreillette droite et la paroi aortique est obtenue. Cela complète les résultats précédents, qui ont démontré une régulation positive des interleukines -6 et -1β, NFκB et de la production de cytokines dans le myocarde DAC17. La couche musculaire a disparu dans la valve mitrale du porc HFpEF, ce qui suggère que des anomalies de la valve mitrale ont contribué à un dysfonctionnement cardiaque.
La mise en place d’une procédure chirurgicale aseptique est essentielle pour obtenir des modèles de porcs réussis et stables. La chirurgie de la constriction aortique chez le porc nécessite plus d’opérateurs que celle chez les rongeurs. Il nécessite généralement une équipe chirurgicale expérimentée composée de deux chirurgiens, d’un anesthésiste et de deux infirmières de salle d’opération. Ces rôles peuvent être assumés par des vétérinaires, des chirurgiens humains et/ou des techniciens bien formés. Par rapport à une chirurgie chez les rongeurs qui prend environ 30 minutes pour effectuer une procédure de constriction aortique, cela peut prendre plus de 3 heures pour effectuer une procédure similaire chez les porcs. Dans la pratique, l’insuffisance des installations et du personnel qualifié pour la chirurgie des grands animaux limite l’application des modèles chirurgicaux porcins.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Ces travaux ont été financés par le Programme des sciences et de la technologie du Guangdong (2008A08003, 2016A020216019, 2019A030317014), le Programme des sciences et de la technologie de Guangzhou (201804010206), la Fondation nationale des sciences naturelles de Chine (31672376, 81941002) et le Laboratoire clé des animaux de laboratoire de la province du Guangdong (2017B030314171).
matériels
| Name | Company | Catalog Number | Comments |
| Absorbable surgical suture | Putong Jinhua Medical Co. Ltd, China | 4-0 | |
| Aesthesia ventilator station | Shenzhen Mindray Bio-Medical Electronics Co., Ltd, China | WATO EX-35vet | |
| Aspirator | Shanghai Baojia Medical Apparatus Co., Ltd, China | YX930D | |
| Benzylpenicillin | Sichuan Pharmaceutical. INC, China | H5021738 | |
| Disposal endotracheal tube with cuff | Shenzhen Verybio Co., Ltd, China | 20 cm, ID 0.9 | |
| Disposal transducer | Guangdong Baihe Medical Technology Co., Ltd, China | ||
| Dissection blade | Shanghai Medical Instruments (Group) Co., Ltd, China | ||
| Electrocautery | Shanghai Hutong Medical Instruments (Group) Co., Ltd, China | GD350-B | |
| Enzyme-linked immunosorbent assay ELISA kit | Cusabio Biotech Co., Ltd, China | CSB-E08594r | |
| Eosin | Sigma-Aldrich Corp. | E4009 | |
| Flunixin meglumine | Shanghai Tongren Pharmaceutical Co., Ltd., China | Shouyaozi(2012)-090242103 | |
| Forceps | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Hematoxylin | Sigma-Aldrich Corp. | H3136 | |
| Isoflurane | RWD Life Science Co., Ltd, China | Veteasy for animals | |
| Laryngoscope | Taixing Simeite Medical Apparatus and Instruments Limited Co., Ltd, China | For adults | |
| LED surgical lights | Mingtai Medical Group, China | ZF700 | |
| Microplate reader | Thermo Fisher Scientific, USA | Multiskan FC | |
| Microscope | Leica, Germany | DM2500 | |
| Mobile restraint unit | Customized | N/A | A mobile restraint unit, made by metal frame and wheels, with a canvas cover |
| Oxygen | Local suppliers, Guangzhou, China | ||
| Paraformaldehyde | Sigma-Aldrich Corp. | V900894 | |
| Patient monitor | Shenzhen Mindray Bio-Medical Electronics Company, China | Beneview T5 | |
| Peripheral Intravenous (IV) Catheter | Shenzhen Yima Pet Industry Development Co., Ltd., China | 26G X 16 mm | |
| Propofol | Guangdong Jiabo Phamaceutical Co., Ltd. | H20051842 | |
| Rib retractor | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Ruler | Deli Manufacturing Company, China | ||
| Scalpel handles | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Scissors (g) | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Suture | Medtronic-Coviden Corp. | 3-0, 4-0 | |
| Ultrasonic gel | Tianjin Xiyuansi Production Institute, China | TM-100 | |
| Veterinary monitor | Shenzhen Mindray Bio-Medical Electronics Company, China | ePM12M Vet | |
| Veterinary ultrasound system | Esatoe, Italy | MyLab30 | Equiped with phased array transducer (3-8 Hz) |
| Xylazine hydrochloride injection | Shenda Animal Phamarceutical Co., Ltd., China | Shouyaozi(2016)-07003 | |
| Zoletil injection | Virbac, France | Zoletil 50 | Tiletamine and zolazepam for injection |
Références
- Dunlay, S. M., Roger, V. L., Redfield, M. M. Epidemiology of heart failure with preserved ejection fraction. Nature Reviews Cardiology. 14 (10), 591-602 (2017).
- Redfield, M. M. Heart failure with preserved ejection fraction. New England Journal of Medicine. 375 (19), 1868-1877 (2016).
- Lam, C. S. P., Voors, A. A., de Boer, R. A., Solomon, S. D., van Veldhuisen, D. J. Heart failure with preserved ejection fraction: From mechanisms to therapies. European Heart Journal. 39 (30), 2780-2792 (2018).
- Solomon, S. D., et al. Angiotensin receptor neprilysin inhibition in heart failure with preserved ejection fraction: Rationale and design of the PARAGON-HF trial. JACC-Heart Failure. 5 (7), 471-482 (2017).
- Cunningham, J. W., et al. Effect of sacubitril/valsartan on biomarkers of extracellular matrix regulation in patients with HFpEF. Journal of the American College of Cardiology. 76 (5), 503-514 (2020).
- Conceição, G., Heinonen, I., Lourenço, A. P., Duncker, D. J., Falcão-Pires, I. Animal models of heart failure with preserved ejection fraction. Netherlands Heart Journal. 24 (4), 275-286 (2016).
- Noll, N. A., Lal, H., Merryman, W. D. Mouse models of heart failure with preserved or reduced ejection fraction. American Journal of Pathology. 190 (8), 1596-1608 (2020).
- Schwarzl, M., et al. A porcine model of hypertensive cardiomyopathy: Implications for heart failure with preserved ejection fraction. American Journal of Physiology-Heart and Circulatory Physiology. 309 (9), 1407-1418 (2015).
- Reiter, U., et al. Early-stage heart failure with preserved ejection fraction in the pig: A cardiovascular magnetic resonance study. Journal of Cardiovascular Magnetic Resonance. 18 (1), 63 (2016).
- Silva, K. A. S., et al. Tissue-specific small heat shock protein 20 activation is not associated with traditional autophagy markers in Ossabaw swine with cardiometabolic heart failure. American Journal of Physiology-Heart and Circulatory Physiology. 319 (5), 1036-1043 (2020).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal. 37 (27), 2129-2200 (2016).
- Tsutsui, H., et al. JCS 2017/JHFS 2017 guideline on diagnosis and treatment of acute and chronic heart failure - Digest version. Circulation Journal. 83 (10), 2084-2184 (2019).
- Yousefi, K., Dunkley, J. C., Shehadeh, L. A. A preclinical model for phenogroup 3 HFpEF. Aging (Albany NY). 11 (13), 4305-4307 (2019).
- Zheng, S., et al. Aged monkeys fed a high-fat/high-sugar diet recapitulate metabolic disorders and cardiac contractile dysfunction. Journal of Cardiovascular Translational Research. 14 (5), 799-815 (2021).
- Shirakabe, A., et al. Drp1-dependent mitochondrial autophagy plays a protective role against pressure overload-induced mitochondrial dysfunction and heart failure. Circulation. 133 (13), 1249-1263 (2016).
- Zhabyeyev, P., et al. Pressure-overload-induced heart failure induces a selective reduction in glucose oxidation at physiological afterload. Cardiovascular Research. 97 (4), 676-685 (2013).
- Tan, W., et al. A porcine model of heart failure with preserved ejection fraction induced by chronic pressure overload characterized by cardiac fibrosis and remodeling. Frontiers in Cardiovascular Medicine. 8, 677727 (2021).
- Beznak, M. Changes in heart weight and blood pressure following aortic constriction in rats. Canadian Journal of Biochemistry and Physiology. 33 (6), 995-1002 (1955).
- Bikou, O., Miyashita, S., Ishikawa, K. Pig model of increased cardiac afterload induced by ascending aortic banding. Methods in Molecular Biology. 1816, 337-342 (2018).
- Hiemstra, J. A., et al. Chronic low-intensity exercise attenuates cardiomyocyte contractile dysfunction and impaired adrenergic responsiveness in aortic-banded mini-swine. Journal of Applied Physiology. 124 (4), 1034-1044 (2018).
- Massie, B. M., et al. Myocardial high-energy phosphate and substrate metabolism in swine with moderate left ventricular hypertrophy. Circulation. 91 (6), 1814-1823 (1995).
- Melleby, A. O., et al. A novel method for high precision aortic constriction that allows for generation of specific cardiac phenotypes in mice. Cardiovascular Research. 114 (12), 1680-1690 (2018).
- Charles, C. J., et al. A porcine model of heart failure with preserved ejection fraction: magnetic resonance imaging and metabolic energetics. ESC Heart Failure. 7 (1), 92-102 (2020).
- Olver, T. D., et al. Western, diet-fed, aortic-banded ossabaw swine: A Preclinical model of cardio-metabolic heart failure. JACC Basic to Translational Science. 4 (3), 404-421 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon