Method Article
藏族小型猪射血分数保留的心力衰竭手术模型
* 这些作者具有相同的贡献
摘要
本方案描述了使用降主动脉收缩建立射血分数保留的心力衰竭迷你猪模型的分步程序。还介绍了评估该疾病模型的心脏形态学、组织学和功能的方法。
摘要
全球超过一半的心力衰竭 (HF) 病例被归类为射血分数保留心力衰竭 (HFpEF)。大型动物模型在研究HFpEF的基本机制和确定潜在的治疗靶点方面受到限制。本工作详细介绍了藏族小型猪降主动脉收缩(DAC)的外科手术过程,以建立HFpEF的大型动物模型。该模型使用精确控制的降主动脉收缩来诱导左心室的慢性压力超负荷。超声心动图用于评估心脏的形态学和功能变化。DAC应激12周后,室间隔肥厚,但后壁厚度明显减少,伴有左心室扩张。然而,在 12 周期间,模型心脏的左心室射血分数保持在 >50%。此外,DAC模型显示心脏损伤,包括纤维化、炎症和心肌细胞肥大。DAC组的心力衰竭标志物水平显著升高。这种 DAC 诱导的小型猪 HFpEF 是研究这种疾病的分子机制和临床前测试的有力工具。
引言
射血分数保留的心力衰竭 (HFpEF) 占心力衰竭病例的一半以上,并已成为全球公共卫生问题1。临床观察表明 HFpEF 的几个关键特征:(1) 心室舒张功能障碍,伴有收缩刚度增加,(2) 静息时射血分数正常,运动表现受损,以及 (3) 心脏重塑2.提出的机制包括激素失调、全身性微血管炎症、代谢紊乱以及肌节和细胞外基质蛋白的异常3。然而,实验研究表明,射血分数降低的心力衰竭 (HFrEF) 会导致这些改变。临床研究探讨了血管紧张素受体抑制剂和药物治疗 HFpEF中 HFrEF 的治疗效果 4,5。然而,需要独特的HFpEF治疗方法。与了解临床症状相比,HFpEF在病理学、生物化学和分子生物学方面的改变仍然不明确。
已经开发了 HFpEF 的动物模型来探索其机制、诊断标志物和治疗方法。实验动物,包括猪、狗、大鼠和小鼠,可发生HFpEF,并选择高血压、糖尿病和衰老等多种危险因素作为诱导因素6,7。例如,单独使用醋酸脱氧皮质酮或与高脂肪/高糖饮食联合使用可诱导猪的 HFpEF 8,9。心室压力超负荷是另一种用于在大型和小型动物模型中开发 HFpEF的技术 10。此外,近年来,各大洲都采用了特定的EF临界值来定义HFpEF,如欧洲心脏病学会指南、美国心脏病学会基金会/美国心脏协会11、日本循环学会/日本心力衰竭学会12所示。因此,如果采用临床标准,许多先前建立的模型可能适用于 HFpEF 研究。例如,Youselfi等人声称转基因小鼠品系Col4a3-/-是一种有效的HFpEF模型。该菌株出现典型的 HFpEF 心脏症状,例如舒张功能障碍、线粒体功能障碍和心脏重塑13。之前的一项研究使用高能量饮食在老年猴子14 中诱导具有中等 EF 的心脏重塑,其特征是代谢紊乱、纤维化和心肌中肌动球蛋白 MgATP 酶减少。小鼠横主动脉收缩 (TAC) 是模拟高血压诱导的室性心肌病最广泛使用的模型之一。左心室从向心性肥大(EF升高)进展为扩张性重塑(EF降低15.16)。这两个典型阶段之间的过渡表型表明,主动脉收缩技术可用于研究 HFpEF。
猪 HFpEF 模型的病理特征、细胞信号转导和 mRNA 谱之前已发表17。在这里,提出了建立该模型的分步方案以及评估该模型表型的方法。该过程如 图 1 所示。简而言之,手术计划由主要研究者、外科医生、实验室技术人员和动物护理人员共同制定。这些迷你猪接受了健康检查,包括生化测试和超声心动图检查。手术后,进行了抗炎和镇痛手术。超声心动图、组织学检查和生物标志物用于评估表型。
研究方案
所有动物研究均获得广东省实验动物监测所机构动物护理和使用委员会的批准(批准号。IACUC2017009)。所有动物实验均按照《实验动物护理和使用指南》(第 8 版,2011 年,美国国家科学院)进行。这些动物被安置在广东省实验动物监测研究所(许可证号)AAALAC认可的设施中。SYXK (YUE) 2016-0122, 中国)。使用6只雄性藏族迷你猪(假猪组和DAC组各n=3头,体重25-30公斤)开发HFpEF模型。
1. 动物和器械准备
- 手术前使动物适应设施 14 天。
- 手术前进行健康检查,包括生化检查和超声心动图检查。根据T/CALAS85-2020《实验动物-大型实验动物心脏、肝脏、肾脏和大脑等主要器官健康评估指南》(中国实验动物科学协会),排除心脏结构(心室扩张或肥大)和功能(EF<50%)异常的动物。
- 在麻醉前禁食动物超过12小时,在手术当天不要喂食。
- 准备手术室和设备(图2)。检查麻醉呼吸机站、兽医和患者监护仪、兽医超声系统、吸气器和其他手术设备。高压灭菌剪刀、镊子、牵开器、手术刀柄、吸头、手术针等(见 材料表)。
2.镇静、气管插管、静脉插管
- 称量动物的重量并计算麻醉药物。用1mg / kg佐利地尔注射液(注射用替利他明和唑拉西泮)和0.5mg / kg盐酸甲苯噻嗪注射液镇静小型猪(见 材料表)。
- 约束并将迷你猪放在手术台上的右侧侧卧位置。打开加热系统以保持动物的体温。
- 进行超声心动图检查(第 5 步)并收集 2 mL 血样。
- 用连接到兽医麻醉呼吸机站的气管插管插管微型猪(图3A)(见 材料表)。
- 以 8 mL/kg 潮气量和 30 次/分钟呼吸开始通气。在外科手术过程中,用1.5%-2.5%的异氟烷维持动物。
- 使用来自耳静脉(通常是边缘耳静脉,图3B)的外周静脉导管(26G)(参见材料表)建立静脉插管。
- 将动物连接到兽医监视器。
3. 外科手术
- 剃掉左胸区域。施用0.7%的碘和75%的酒精,无菌地准备从肩胛骨到隔膜的皮肤(图3C)。
- 将无菌窗帘放在手术区域。
- 通过静脉注射给予丙泊酚(5mg / kg)(见 材料表)以维持全身麻醉。
- 在用电烙术切开皮肤之前,沿着第 4 肋间隙标记切口(~15 厘米长)。
- 使用烧灼术和肌肉和结缔组织的钝性解剖相结合打开胸部。手术过程中使用抽吸器排出血液。
- 使用肋骨牵开器展开肋骨(图3D)。
- 定位胸降主动脉段并确定收缩部位(图3E)。使用两个 3-0 手术缝合线绕该节段两次(图 3F)。在缝合线和主动脉之间放置三层医用纱布,以避免缝合线对组织造成损伤。
- 设置压力测量单位以确定收缩程度(图3F-H)。
注意: 该装置包括一根刺穿血管壁的导管、连接管、压力传感器和患者监护仪。 - 逐渐收紧降主动脉段周围的手术缝合线,以达到所需的收缩程度。让压力读数稳定 20 分钟并永久收紧手术结。
- 使用胸腔引流管排出胸腔内的空气和多余的液体。
- 分层闭合胸壁,用可吸收缝合线近似肋骨和分割的肌肉。
- 检查是否有出血,确保止血良好。
- 术后将一瓶苄基青霉素(800,000单位)(见 材料表)涂抹在手术区域。
- 监测动物是否存在眨眼和肢体运动。断开呼吸机,但离开气管插管。监测自主呼吸的存在。
- 将动物放回饲养室,让它自动唤醒。
4. 术后护理
- 每天施用苄基青霉素 1 周 (20,000 U/kg)。
- 每天施用 1 mg/kg 氟尼辛葡甲胺(见 材料表),持续 1 周。
注意:阿片类药物和非甾体抗炎药镇痛药应在术中和术后给药。
5. 经胸超声心动图
- 用 1 mg/kg zoletil 镇静动物。
- 将动物放在带有帆布盖的移动约束装置中。
注意:移动约束装置(见 材料表)有四个孔,旨在伸展动物的前肢和后肢。 - 剃掉动物的左胸。
- 将手指放在胸部的左中央,感受心尖脉搏。将超声波凝胶涂抹在周围区域。
- 将超声系统的相控阵换能器 (3-8 Hz) 放置在第三个肋间隙。将换能器向前或向后移动并调整缺口角度。
- 识别心房、心室和主动脉。记录 B 模式和 M 模式胸骨旁长轴图像。
注意:B 模式图像表示左心室在肌水平的横截面,M 模式图像显示左心室随时间的运动。 - 将换能器头顺时针旋转 90° 以获得胸骨旁短轴视图。识别左心室、右心室和肌。记录 B 模式和 M 模式图像。
- 使用超声系统制造商提供的工作站来评估心脏结构和功能。
结果
超声心动图
在第 0、2、4、6、8、10 和 12 周评估心脏结构和功能。胸骨旁短轴视图的 B 模式和 M 模式记录显示在图 4A 中。超声心动图测量包括室间隔厚度(VST)、后壁厚度(PWT)和左心室内部尺寸(LVID)。在观察期间,DAC心脏中舒张末期的VST增加,而舒张末期的PWT增加然后减少,这表明DAC迷你猪的左心室中存在肥厚重塑(图4B,C)。舒张末期的LVID在第4周和第6周降低,然后在第8周后逐渐增加,表明心室在扩张前经历了向心肥大(图4D)。在12周期间,模型心脏的LVEF保持在>50%(图4E)。
形态学和心力衰竭标志物
第 12 周后,如前所述17 采集心脏。与假心脏相比,观察到DAC心脏扩大(图5A)。按照制造商的说明,在第 0、4、8 和 12 周使用酶联免疫吸附测定试剂盒测定心肌肌钙蛋白 I (cTnI) 的血清浓度(参见材料表)。使用酶标仪在 450 nm 处测量光密度。DAC组在第4、8和12周的心力衰竭标志物cTnI在相应时间点明显高于假手术组(图5B)。
组织学检查
收集来自左心室和右心室游离壁的组织,室间隔,左右心房,二尖瓣和主动脉,并用4%多聚甲醛固定。将组织包埋,切成切片,并用苏木精和伊红(H&E)溶液染色,遵循上次报告17。用光学显微镜鉴定肥厚型心肌细胞、纤维化、炎性细胞、脓结核和其他结构。心房、室间隔和心室中的心肌细胞显示肥大伴脓肿(图6A)。二尖瓣中的肌肉层减少(图6B),在主动脉中观察到血管内皮增生(图6C)。此外,DAC诱导迷你猪心肌广泛纤维化(图7A),伴有左心室、右心房和主动脉壁炎症细胞浸润(图7B)。

图1:实验设计。 实验计划由主要研究者、外科医生、实验室技术人员和动物护理人员共同制定。这些迷你猪接受了健康检查,包括生化测试和超声心动图检查。手术后,进行了抗炎和镇痛手术。超声心动图、组织学检查和生物标志物检测评估心力衰竭表型。动物的数量,n = 3 个,分别用于假和 DAC 组。 请点击这里查看此图的较大版本.

图2.手术器械。 DAC 手术所需的设备 (A) 包括抽吸器 (a)、手术台 (b)、兽医监护仪 (c)、LED 手术灯 (d) 和麻醉呼吸机站 (e)。使用兽医超声系统评估手术前后动物心脏的结构和功能(B)。手术工具包括喉镜(C)和各种镊子、手术刀柄和剪刀(D)。 请点击这里查看此图的较大版本.

图 3:外科手术。 镇静后,用气管插管(A)对动物进行插管,并通过耳静脉(B)建立静脉插管。手术部位在动物的左胸(C)。暴露降主动脉 (D,E) 后,确定收缩部位 (SB) 和压力监测侵入部位 (SA、SC) (F,G),并使用患者监护仪 (H) 测量主动脉压。一幅漫画显示了收缩策略 (I) 的概述。 请点击这里查看此图的较大版本.
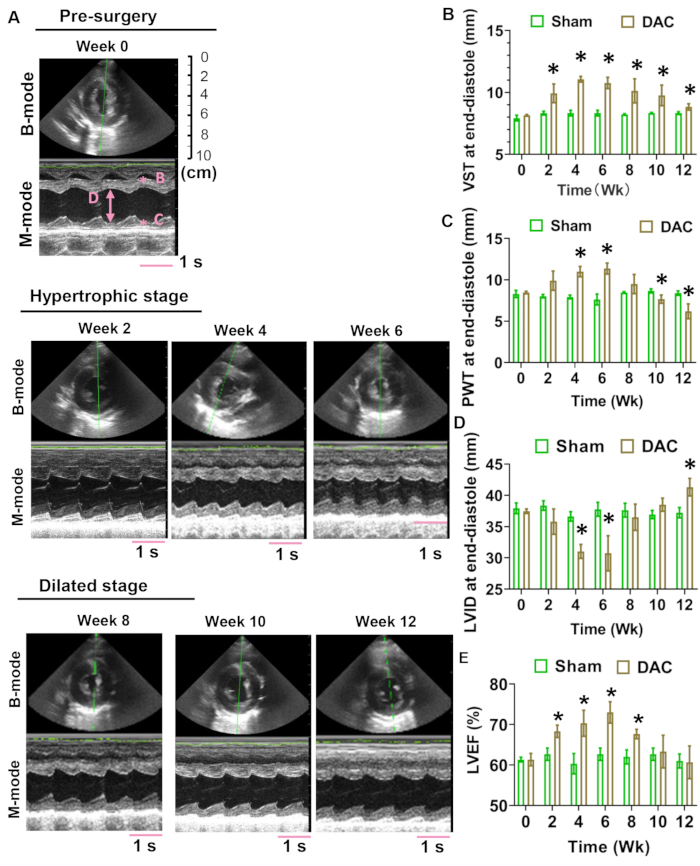
图4:经胸超声心动图评估。 从第 0 周到第 12 周压力超负荷心脏的代表性 B 模式和 M 模式图像显示在 (A) 中。图中显示了记录 4 秒的 M 模式图像。粉红色比例尺表示 1 秒的记录长度.DAC 心脏 (B) 舒张末期的心室间隔厚度 (VST) 增加。相反,舒张末期的后壁厚度(PWT)在观察期间逐渐增减(C)。舒张末期左心室内部尺寸 (LVID) 在第 4 周和第 6 周下降,然后在第 8 周后逐渐升高 (D)。在 12 周期间,模型心脏的 LVEF 保持在 >50% (E)。动物的数量,n = 3 个,分别用于假和 DAC 组。使用未配对的t检验来确定组间的差异。*P < 0.05 对假集团。 请点击这里查看此图的较大版本.

图5:心脏形态和血清cTnI。 心脏的大小似乎增加(A)。DAC 组在第 4、8 和 12 周时的心力衰竭标志物 cTnI 在相应时间点 (B) 显著高于假手术组。动物的数量,n = 3 个,分别用于假和 DAC 组。使用未配对的t检验来确定组间的差异。*P < 0.05 对假集团。 请点击这里查看此图的较大版本.

图 6:心肌、二尖瓣和主动脉壁的组织学。 在实验结束时,H&E染色用于检查心脏组织。心房、室间隔和心室中的心肌细胞显示肥大(绿色箭头; A),伴有热(黄色箭头; 二尖瓣中的肌肉层减少(蓝色箭头; B).在主动脉(蓝线内区域; C).红色星号:检查组织;L.心室,左心室;R.心室,右心室;左心房,左心房;R.心房,右心房。 请点击这里查看此图的较大版本.

图 7:DAC 心脏的纤维化和炎症。 组织学检查显示DAC小型猪广泛性心肌纤维化。显示左心室的纤维化区域(黄色星号和箭头; A).在左心室、右心房和主动脉壁中观察到炎症细胞浸润(绿色星号; B).红色星号:检查组织;蓝色箭头,嗜酸性粒细胞;L.心室,左心室;R.心房,右心房。 请点击这里查看此图的较大版本.
讨论
本研究利用DAC技术建立了藏小型猪的HFpEF模型。本文介绍了动物和器械的分步制备方案,包括镇静、气管插管、静脉插管、外科手术和术后护理。此外,还介绍了超声心动图B型和M型心脏图像的记录技术。DAC 后,心脏在第 4 周和第 6 周出现左心室肥厚,第 8 周后出现扩张。LVEF 在 12 周期间得以保存。在DAC心脏中观察到纤维化和炎症。
开胸手术和主动脉收缩的结合已被用于开发大型和小型动物的心力衰竭模型。例如,早在 1950 年代就报道了啮齿动物主动脉收缩引起的高血压18.猪升主动脉收缩可诱发2-4周龄猪轻度左心室肥大。关于定位升主动脉的手术部位,一些研究选择了第三肋间隙19,20,而另一项研究选择了第四肋间间隙进行侧切开胸术21。结果发现,在成年藏小型猪中,降主动脉收缩是实用的。降主动脉段位于第四肋间正下方,周围有小结缔组织。
收缩程度对于诱导 HFpEF 的关键特征至关重要。Melleby等人报告说,较小的环尺寸加速肥大,而较大的环尺寸导致升主动脉收缩小鼠的EF保留8-20周22。Massie 等人为猪的开胸手术设定了 20 mmHg 的压力梯度,以诱导心室肥大21。Charles等人采用渐进式袖带充气在雌性约克夏-长白猪中产生HFpEF23。在目前的研究中,降主动脉压力增加 20% 持续 12 周导致 HFpEF。研究人员还将主动脉收缩技术与醋酸脱氧皮质酮或西方饮食相结合,以诱导雌性Ossabaw猪的HFpEF 10,24。收缩程度通常由使用微压计导管或超声心动图测量的压力来估计。修改了一种工具来测量主动脉压。使用连接到患者监护仪的带有一次性血压传感器的导管来记录降主动脉的压力。
我们之前的研究展示了迷你猪17 中 HFpEF 心脏的典型胸骨旁长轴图像;在这里,添加了具有代表性的胸骨旁短轴图像。与早期结果一致,在12周的观察期内,minipig DAC模型显示出心脏重塑的两个不同阶段,即向心肥大和扩张。这些表型与HFpEF的临床症状一致。这项工作还揭示了HFpEF模型中的新组织学发现。发现心房、室间隔和心室的心肌细胞肥大。此外,左心室、右心房和主动脉壁有严重的炎性细胞浸润。这补充了先前的研究结果,该研究结果表明 DAC 心肌中白细胞介素 -6 和 -1β、NFκB 和细胞因子产生的上调17。HFpEF猪的二尖瓣中的肌肉层消失,表明二尖瓣的异常导致了心功能障碍。
建立无菌外科手术对于获得成功和稳定的猪模型至关重要。猪的主动脉收缩手术比啮齿动物需要更多的操作者。它通常需要一支由两名外科医生、一名麻醉师、两名手术室护士组成的经验丰富的外科团队。这些角色可以由兽医、人类外科医生和/或训练有素的技术人员担任。与完成主动脉收缩手术大约需要 30 分钟的啮齿动物手术相比,在猪中完成类似的手术可能需要 3 小时以上。在实践中,大型动物手术的设施和技术人员不足限制了猪手术模型的应用。
披露声明
作者声明他们没有相互竞争的利益。
致谢
本研究得到了广东省科技计划(2008A08003、2016A020216019、2019A030317014)、广州市科技计划(201804010206)、国家自然科学基金(31672376、81941002)和广东省实验动物重点实验室(2017B030314171)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Absorbable surgical suture | Putong Jinhua Medical Co. Ltd, China | 4-0 | |
| Aesthesia ventilator station | Shenzhen Mindray Bio-Medical Electronics Co., Ltd, China | WATO EX-35vet | |
| Aspirator | Shanghai Baojia Medical Apparatus Co., Ltd, China | YX930D | |
| Benzylpenicillin | Sichuan Pharmaceutical. INC, China | H5021738 | |
| Disposal endotracheal tube with cuff | Shenzhen Verybio Co., Ltd, China | 20 cm, ID 0.9 | |
| Disposal transducer | Guangdong Baihe Medical Technology Co., Ltd, China | ||
| Dissection blade | Shanghai Medical Instruments (Group) Co., Ltd, China | ||
| Electrocautery | Shanghai Hutong Medical Instruments (Group) Co., Ltd, China | GD350-B | |
| Enzyme-linked immunosorbent assay ELISA kit | Cusabio Biotech Co., Ltd, China | CSB-E08594r | |
| Eosin | Sigma-Aldrich Corp. | E4009 | |
| Flunixin meglumine | Shanghai Tongren Pharmaceutical Co., Ltd., China | Shouyaozi(2012)-090242103 | |
| Forceps | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Hematoxylin | Sigma-Aldrich Corp. | H3136 | |
| Isoflurane | RWD Life Science Co., Ltd, China | Veteasy for animals | |
| Laryngoscope | Taixing Simeite Medical Apparatus and Instruments Limited Co., Ltd, China | For adults | |
| LED surgical lights | Mingtai Medical Group, China | ZF700 | |
| Microplate reader | Thermo Fisher Scientific, USA | Multiskan FC | |
| Microscope | Leica, Germany | DM2500 | |
| Mobile restraint unit | Customized | N/A | A mobile restraint unit, made by metal frame and wheels, with a canvas cover |
| Oxygen | Local suppliers, Guangzhou, China | ||
| Paraformaldehyde | Sigma-Aldrich Corp. | V900894 | |
| Patient monitor | Shenzhen Mindray Bio-Medical Electronics Company, China | Beneview T5 | |
| Peripheral Intravenous (IV) Catheter | Shenzhen Yima Pet Industry Development Co., Ltd., China | 26G X 16 mm | |
| Propofol | Guangdong Jiabo Phamaceutical Co., Ltd. | H20051842 | |
| Rib retractor | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Ruler | Deli Manufacturing Company, China | ||
| Scalpel handles | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Scissors (g) | Shanghai Medical Instruments (Group) Co., Ltd.,China | ||
| Suture | Medtronic-Coviden Corp. | 3-0, 4-0 | |
| Ultrasonic gel | Tianjin Xiyuansi Production Institute, China | TM-100 | |
| Veterinary monitor | Shenzhen Mindray Bio-Medical Electronics Company, China | ePM12M Vet | |
| Veterinary ultrasound system | Esatoe, Italy | MyLab30 | Equiped with phased array transducer (3-8 Hz) |
| Xylazine hydrochloride injection | Shenda Animal Phamarceutical Co., Ltd., China | Shouyaozi(2016)-07003 | |
| Zoletil injection | Virbac, France | Zoletil 50 | Tiletamine and zolazepam for injection |
参考文献
- Dunlay, S. M., Roger, V. L., Redfield, M. M. Epidemiology of heart failure with preserved ejection fraction. Nature Reviews Cardiology. 14 (10), 591-602 (2017).
- Redfield, M. M. Heart failure with preserved ejection fraction. New England Journal of Medicine. 375 (19), 1868-1877 (2016).
- Lam, C. S. P., Voors, A. A., de Boer, R. A., Solomon, S. D., van Veldhuisen, D. J. Heart failure with preserved ejection fraction: From mechanisms to therapies. European Heart Journal. 39 (30), 2780-2792 (2018).
- Solomon, S. D., et al. Angiotensin receptor neprilysin inhibition in heart failure with preserved ejection fraction: Rationale and design of the PARAGON-HF trial. JACC-Heart Failure. 5 (7), 471-482 (2017).
- Cunningham, J. W., et al. Effect of sacubitril/valsartan on biomarkers of extracellular matrix regulation in patients with HFpEF. Journal of the American College of Cardiology. 76 (5), 503-514 (2020).
- Conceição, G., Heinonen, I., Lourenço, A. P., Duncker, D. J., Falcão-Pires, I. Animal models of heart failure with preserved ejection fraction. Netherlands Heart Journal. 24 (4), 275-286 (2016).
- Noll, N. A., Lal, H., Merryman, W. D. Mouse models of heart failure with preserved or reduced ejection fraction. American Journal of Pathology. 190 (8), 1596-1608 (2020).
- Schwarzl, M., et al. A porcine model of hypertensive cardiomyopathy: Implications for heart failure with preserved ejection fraction. American Journal of Physiology-Heart and Circulatory Physiology. 309 (9), 1407-1418 (2015).
- Reiter, U., et al. Early-stage heart failure with preserved ejection fraction in the pig: A cardiovascular magnetic resonance study. Journal of Cardiovascular Magnetic Resonance. 18 (1), 63 (2016).
- Silva, K. A. S., et al. Tissue-specific small heat shock protein 20 activation is not associated with traditional autophagy markers in Ossabaw swine with cardiometabolic heart failure. American Journal of Physiology-Heart and Circulatory Physiology. 319 (5), 1036-1043 (2020).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal. 37 (27), 2129-2200 (2016).
- Tsutsui, H., et al. JCS 2017/JHFS 2017 guideline on diagnosis and treatment of acute and chronic heart failure - Digest version. Circulation Journal. 83 (10), 2084-2184 (2019).
- Yousefi, K., Dunkley, J. C., Shehadeh, L. A. A preclinical model for phenogroup 3 HFpEF. Aging (Albany NY). 11 (13), 4305-4307 (2019).
- Zheng, S., et al. Aged monkeys fed a high-fat/high-sugar diet recapitulate metabolic disorders and cardiac contractile dysfunction. Journal of Cardiovascular Translational Research. 14 (5), 799-815 (2021).
- Shirakabe, A., et al. Drp1-dependent mitochondrial autophagy plays a protective role against pressure overload-induced mitochondrial dysfunction and heart failure. Circulation. 133 (13), 1249-1263 (2016).
- Zhabyeyev, P., et al. Pressure-overload-induced heart failure induces a selective reduction in glucose oxidation at physiological afterload. Cardiovascular Research. 97 (4), 676-685 (2013).
- Tan, W., et al. A porcine model of heart failure with preserved ejection fraction induced by chronic pressure overload characterized by cardiac fibrosis and remodeling. Frontiers in Cardiovascular Medicine. 8, 677727 (2021).
- Beznak, M. Changes in heart weight and blood pressure following aortic constriction in rats. Canadian Journal of Biochemistry and Physiology. 33 (6), 995-1002 (1955).
- Bikou, O., Miyashita, S., Ishikawa, K. Pig model of increased cardiac afterload induced by ascending aortic banding. Methods in Molecular Biology. 1816, 337-342 (2018).
- Hiemstra, J. A., et al. Chronic low-intensity exercise attenuates cardiomyocyte contractile dysfunction and impaired adrenergic responsiveness in aortic-banded mini-swine. Journal of Applied Physiology. 124 (4), 1034-1044 (2018).
- Massie, B. M., et al. Myocardial high-energy phosphate and substrate metabolism in swine with moderate left ventricular hypertrophy. Circulation. 91 (6), 1814-1823 (1995).
- Melleby, A. O., et al. A novel method for high precision aortic constriction that allows for generation of specific cardiac phenotypes in mice. Cardiovascular Research. 114 (12), 1680-1690 (2018).
- Charles, C. J., et al. A porcine model of heart failure with preserved ejection fraction: magnetic resonance imaging and metabolic energetics. ESC Heart Failure. 7 (1), 92-102 (2020).
- Olver, T. D., et al. Western, diet-fed, aortic-banded ossabaw swine: A Preclinical model of cardio-metabolic heart failure. JACC Basic to Translational Science. 4 (3), 404-421 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。