Method Article
Duodenopancreatectomia laparoscópica para câncer de pâncreas utilizando técnica de isolamento in-situ sem toque
Neste Artigo
Resumo
Procedimentos de isolamento No-Touch podem impedir a disseminação de células cancerosas do tumor primário. No entanto, essas técnicas ainda não são amplamente aceitas na duodenopancreatectomia laparoscópica (LPD). Apresentamos a LPD de isolamento No-Touch in situ com ressecção parcial e reconstrução da veia mesentérica superior (VMS) para câncer de pâncreas após terapia neoadjuvante.
Resumo
A duodenopancreatectomia laparoscópica (LPD) é uma operação radical padrão para tumores malignos da cabeça pancreática até agora. Devido às complexas técnicas de ressecção e reconstrução laparoscópica, é difícil realizar LPD em pacientes com câncer de cabeça de pâncreas localmente avançado após terapia neoadjuvante. Nossa equipe inicia a LPD usando a técnica de isolamento No-Touch in situ . A inovação e a otimização desta técnica modificada de isolamento No-Touch enfatizam a exploração da secção distal da veia mesentérica superior (VMS) e do lado esquerdo da artéria mesentérica superior (AMS) antes de avaliar a ressecabilidade por abordagem mesentérica subcolônica, que é uma abordagem ideal de exploração. Em seguida, utilizamos as abordagens mediano-anterior e esquerda-posterior da AMS para cortar o fluxo sanguíneo da cabeça pancreática para tornar o tumor isolado intacto, então mover e dissecar o tumor. É um processo que se encaixa no princípio cirúrgico de ausência de tumor. Este artigo tem como objetivo demonstrar a viabilidade e a segurança da realização da LPD utilizando a técnica de isolamento in situ No-Touch, o que pode elevar a taxa de ressecção R0. É um processo de operação oncológico ideal.
Introdução
A duodenopancreatectomia (DP) é um procedimento cirúrgico padrão para câncer na região pancreaticoduodenal. A manobra de Kocher é amplamente utilizada para a exposição eficiente do duodeno e da cabeça pancreática durante a DP convencional. A mobilização e compressão da área pancreaticoduodenal durante a cirurgia pode causar metástase das células tumorais antes da ligadura dos vasoscircunvizinhos1. Um estudo recente mostrou que as células tumorais tinham a possibilidade potencial de serem espremidas na veia porta (VP) devido ao manuseio e compressão da área tumoral pelos cirurgiões, o que poderia aumentar ainda mais o risco de metástase hepática após acirurgia2.
Com o desenvolvimento da tecnologia biomédica, um cientista pôde detectar a disseminação de células tumorais sólidas, incluindo células cancerosas pancreáticas, para os vasos como células tumorais circulantes (CTC)3,4.
Os procedimentos de isolamento No-Touch, que têm sido utilizados no câncer de cólon, podem impedir a disseminação de células cancerosas, como células tumorais circulantes, a partir do tumorprimário5. Vários estudos relataram o uso de uma técnica de isolamento no-touch para câncer de cabeça pancreática durante a laparotomia duodenopancreatodenopancreatectomia 6,7. O conceito deste procedimento é que o cirurgião não toque o duodeno e a região da cabeça pancreática (incluindo o tumor) antes de ligar e dissecar os vasos (artérias e veias) ao redor da cabeça pancreática.
Técnicas de isolamento No-Touch têm sido relatadas na LPD para neoplasias da região pancreaticoduodenal8. Apresentamos aqui uma LPD modificada de isolamento No-Touch in situ com ressecção parcial e reconstrução de SMV para câncer de pâncreas após terapia neoadjuvante, que disseca primeiro todas as artérias de influxo, transecciona a veia envolvida com margem suficiente, resseca o tumor in situ e remove o espécime em bloco.
O objetivo e as vantagens deste método são garantir que todas as etapas sigam os princípios oncológicos do No-Touch, a fim de diminuir o risco de metástase das células tumorais. A lógica por trás do desenvolvimento e uso desta técnica é que o tumor deve ser mobilizado no estágio final, incluindo a ressecção do tumor in situ e remoção do espécime em bloco após a oclusão das artérias de entrada e saída do tumor. No entanto, como esse procedimento requer técnicas complexas de ressecção e reconstrução quando o cirurgião decide se deseja usá-lo, ele precisa estimar suas próprias situações, como a curva de aprendizado, o tipo de tumor, a condição vascular e outros fatores.
Protocolo
Este estudo foi permitido pelo Comitê de Ética do Segundo Hospital Afiliado da Universidade de Medicina Chinesa de Guangzhou.
1. Seleção dos pacientes
- Aconselhar os pacientes com suspeita de adenocarcinoma ductal pancreático (ADP) na cabeça do pâncreas a fazer uma tomografia computadorizada (TC) com contraste no início. Em seguida, selecionamos os seguintes pacientes: casos limítrofes ressecáveis após terapia neoadjuvante, tumor regride significativamente e tem possibilidade de ressecção radical; enquanto isso, a reconstrução do SMV é potencialmente necessária.
- Excluir os seguintes pacientes: (1) ADP metastático; (2) pacientes com mau estado geral que não toleram cirurgia de grande porte; (3) envolvimento vascular da AMS, artéria hepática comum (AC) ou artéria celíaca (AC).
2. Técnica cirúrgica
- Cenário operatório
- Colocar o paciente anestesiado em decúbito dorsal total, com as pernas abertas.
- Durante a exposição estéril, certifique-se de que a região suprapúbica seja exposta adequadamente para posterior remoção do espécime por incisão de Pfannenstiel. Certifique-se de que o cirurgião operador fique do lado direito, o primeiro assistente esteja do lado esquerdo e o segundo assistente que segura o laparoscópio esteja posicionado entre as pernas do paciente. Use a técnica de 5 portas para realizar o procedimento (Figura 1).
- Após a criação do pneumoperitônio, introduzir o laparoscópio rígido através do trocarte subumbilical de 12 mm e colocar os outros quatro trocárteres ao longo de um semicírculo.
- Fase de exploração
- Explore os órgãos intraperitoneais e as superfícies peritoneais meticulosamente em busca de metástases extrapancreáticas inesperadas.
- Ressecção do omento maior e abertura do saco menor dividindo o ligamento gastrocólico.
- Veia do tronco gastrocólico de Ligate Henle. Explore a lacuna entre o colo pancreático e a VMS na borda inferior do pâncreas.
NOTA: O túnel entre o colo pancreático e a VMS não pode ser criado facilmente se a parede anterior da VMS estiver envolvida.
- Fase de dissecção:
- Abordagem mesentérica subcolônica: Para esta abordagem, siga os passos 2.3.2-2.3.5.
- Após o cólon transverso e seu mesentério estarem elevados cefálico, coloque todo o intestino delgado do lado esquerdo para facilitar a exposição da região pancreaticoduodenal.
- Expor a segunda e terceira partes do duodeno após a secção do mesentério.
- Para reconfirmar a ressecabilidade e mobilizar a parte posterior da cabeça pancreática, expor a veia cava inferior (VCI), veia renal esquerda (VRE), tronco celíaco, aorta e AMS (Figura 2).
- Em seguida, realizar a dissecção ao longo da VMS para limpar todos os tecidos do lado direito. Para expor completamente a VMS, ligadura a raiz da artéria colônica média após confirmar que não há isquemia no cólon transverso.
- Posterior esquerdo da abordagem da AME: Para esta abordagem, siga os passos 2.3.7-2.3.18.
- Coloque todo o intestino delgado do lado esquerdo para facilitar a exposição e a dissecção do duodeno distal proximal ao ligamento de Treitz.
- Divida o jejuno proximal com um grampeador.
- Expor a AMS traçando ao longo da artéria jejunal.
- Colocar um cateter Fr8 pendurado para circundar a face dorsal da AMS e da VMS.
- Tracionar o cateter para o lado superior direito para permitir a dissecção da AMS em seu plano periadventício na margem ântero-esquerda e sua separação do mesopâncreas.
- Ligar a primeira artéria jejunal (AIF) envolvida pelo tumor e sacrificar.
- Identificar a primeira veia jejunal (VJF) e as veias pancreaticoduodenal inferior (VDPI), que são os ramos da face dorsal da VMS.
- Ligate e dissecar o IPDV.
- Dissecar circunferencialmente a AMS para identificar a artéria pancreaticoduodenal inferior (DIP), que ou forma um tronco comum com a AJF ou se origina diretamente da AMS (Figura 3).
- Sacrifique o IPDA.
- Na abordagem posterior esquerda, dissecar a AMS, que é identificada em sua origem acima do VRE, livre do mesopâncreas.
- Nos casos em que o tumor invade o mesocólon, pendurar a VMS e a AMS através de um elástico seguido de coring para fora do mesocólon.
- Abordagem supracólica mediano-anterior da AMS: Para esta abordagem, siga os passos 2.3.20-2.3.34.
- Inicie a abordagem da AME a partir da região do cólon superior.
- Explore a lacuna entre o colo pancreático e a VMS na borda inferior do pâncreas.
- Use um dispositivo grampeador para dividir o estômago 3-5 cm de distância do piloro.
- Remova a vesícula biliar.
- Divida o ducto biliar comum (CBD) como DP convencional. Faça um exame patológico congelado do coto do ducto biliar. Aplique as pinças laparoscópicas do buldogue para ocluir o CBD temporariamente.
- Dissecar o ligamento hepatoduodenal. Realizar uma linfadenectomia ao longo do ACS, da artéria hepática própria (HAP) e do PV.
- Ligate e dissecar a artéria gástrica direita.
- Identificar a artéria gastroduodenal (GDA) no ponto onde o PHA se ramifica do ACS.
- Ligadura dupla ou sutura do GDA para minimizar a chance de erosão e sangramento subsequentes.
- Transeccione o pescoço do pâncreas com uma faca de ultrassom. Faça um exame patológico congelado do coto pancreático.
- Suspender a veia esplênica (VP) com um elástico.
- Configure uma janela em forma de diamante retraindo o mesocólon transverso caudalmente, o PV cranialmente, o SMV para a direita e o SMA para a esquerda.
- Durante a abordagem supracólica mediano-anterior da AMS, disseque os aspectos direito e dorsal da AMS dentro dessa janela em forma de diamante.
- Ressecção da gordura e dos tecidos fibrosos ao redor da AMS e AC do lado caudal para o lado cefálico.
- Ligate e transecto a artéria do processo uncinado (UPA) sob o PV, deixando o espécime aderido ao PV/SMV.
- Combinando com as abordagens mediano-anterior e esquerdo-posterior da AMS, expõe-se facilmente a origem da DIP ou o tronco comum da DIP e da AJ.
OBS: Durante este procedimento, o GDA, a UPA e o IPDA foram completamente ligados. Além disso, todos os influxos da artéria tumoral são completamente ocluídos até este momento para reduzir o sangramento. - Use pinças de buldogue laparoscópicas para prender temporariamente o PV, a veia esplênica e a VMS. Transeccionar a veia envolvida com margem suficiente.
- Em seguida, cortar os linfáticos e dissecar o duodeno do retroperitônio.
- Finalmente, ressecção do tumor in situ e remoção em bloco seguindo os princípios oncológicos do No-Touch 2,6,7.
- Fase de reconstrução
- Meça o comprimento do defeito venoso com uma régua macia. Se o defeito exceder 3 cm, considere o uso de um enxerto de interposição artificial.
- Realizar reconstrução da VMS de caudal para cefálica por sutura contínua com fio de prolene 5-0 (Figura 4).
- Reconstruir o trato digestivo pelo método deChild9.
- De ponta a ponta, realizar sutura em camada única com sutura de hepaticojejunostomia com pontos absorvíveis 4-0.
- Realizar anastomose pancreática por pancreaticojejunostomia término-mucosa término-lateral dentro de um stent interno9.
- Após uma anastomose gastrojejunal látero-lateral, colocar três drenagens perto da anastomose.
- Sacar o espécime e recuperá-lo através da incisão de Pfannenstiel.
Resultados
Um homem de 55 anos com dor abdominal alta e marasmo foi diagnosticado com um tumor de 4,2 cm x 3,1 cm no processo uncinado do pâncreas, e a VMS foi envolvida acima de 180° (Figura 5). A paciente era previamente hígida e apresentava índice de massa corpórea relativamente normal (19,47 kg/m2). Não foram encontradas metástases à distância na TC pré-operatória com contraste. A punção aspirativa por agulha fina guiada por ultrassonografia endoscópica (PAAF-EUS) foi realizada para obter o diagnóstico anatomopatológico de adenocarcinoma. Oito ciclos de esquema de FOLFIRINOX modificado (mFOLFIRINOX) (fluorouracil 2.400 mg/m 2, irinotecano 135 mg/m 2, oxaliplatina 68 mg/m2) foram realizados como quimioterapia neoadjuvante neste paciente. A medicação aliviou eficazmente os sintomas, e o antígeno carboidrato 199 (CA 199) diminuiu de 857,1 U/mL para 109,4 U/mL, enquanto o diâmetro máximo do tumor encolheu de 4,2 cm para 3,5 cm (Figura 6). Além disso, uma TC com contraste mostrou regressão do tumor ao redor da AME.
O tempo total de operação foi de 450 min com 150 mL de perda sanguínea. O paciente evoluiu sem intercorrências no pós-operatório, recebendo alta hospitalar no14º dia de pós-operatório. O nível de amilase no líquido de drenagem no 3º dia de pós-operatório (DPO) 3 foi de 57 U/L. O dreno foi retirado no 7º DPO. O exame histopatológico revelou adenocarcinoma ductal moderadamente pouco diferenciado. As margens de ressecção eram microscopicamente radicais (R0), e nenhum dos 20 linfonodos estava envolvido.

Figura 1: Posição dos trocárteres. Use a técnica de 5 portas. O paciente é colocado em decúbito dorsal com as pernas abertas. Clique aqui para ver uma versão maior desta figura.
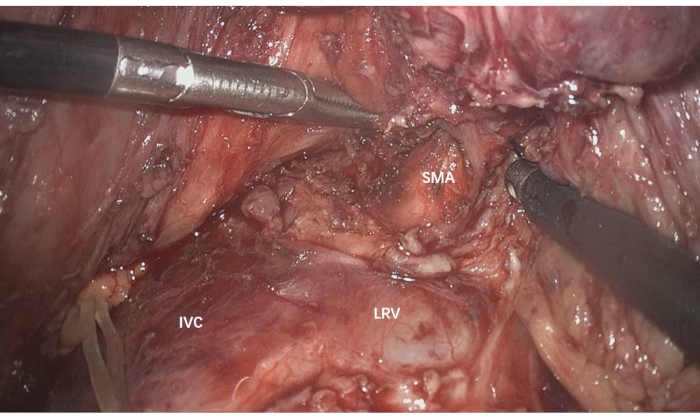
Figura 2: Expor a VCI, VL, tronco celíaco, aorta e AMS para reconfirmar a ressecabilidade e mobilizar a parte posterior da cabeça pancreática. VCI: Veia cava inferior, VRE: veia renal esquerda, AMS: artéria mesentérica superior Clique aqui para ver uma versão maior desta figura.
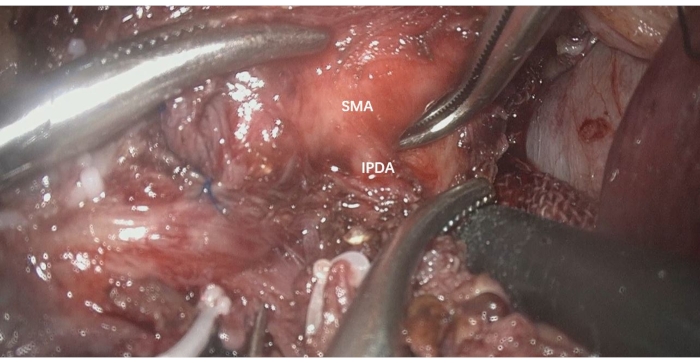
Figura 3: Dissecar circunferencialmente a AMS para identificar a ADPI, que surge diretamente da AMS. API: artéria pancreaticoduodenal inferior, AMS: artéria mesentérica superior Clique aqui para ver uma versão maior desta figura.
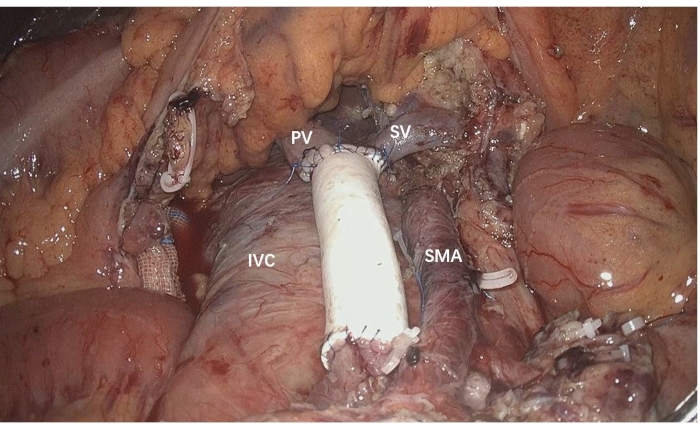
Figura 4: Reconstrução da VMS realizada de caudal para cefálica com enxerto artificial de interposição. VCI: veia cava inferior, VP: veia porta, AMS: artéria mesentérica superior, VMS: veia mesentérica superior Clique aqui para ver uma versão maior desta figura.
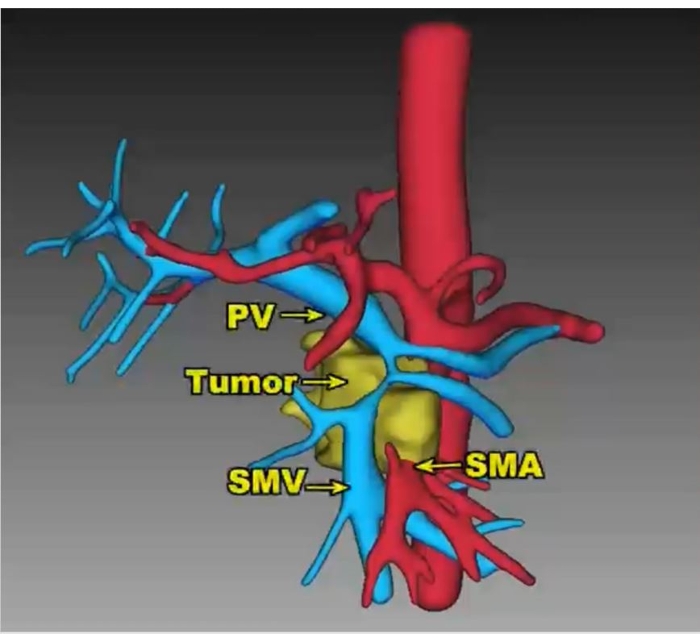
Figura 5: Imagens 3D do vaso reconstruído mostram a massa com mais de 180° de envolvimento da VMS. VP: veia porta, AMS: artéria mesentérica superior, VMS: mesentérica superior Clique aqui para ver uma versão maior desta figura.
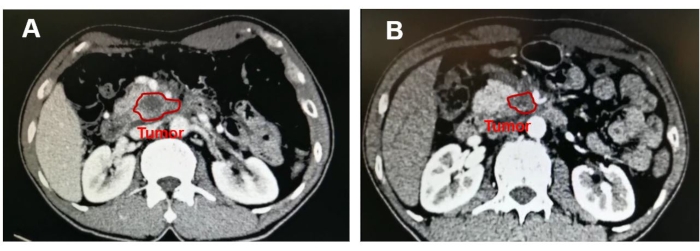
Figura 6: Imagem mostrando a massa no processo uncinado do pâncreas. Após quimioterapia neoadjuvante, o diâmetro máximo do tumor reduziu de (A) 4,2 cm para (B) 3,5 cm. Clique aqui para ver uma versão maior desta figura.
Discussão
O ADP é uma das doenças malignas mais letais. Apesar de as taxas de sobrevida global em 5 anos ainda serem insatisfatórias, a cirurgia continua sendo o único método terapêutico curativo até o momento10. De acordo com o National Comprehensive Cancer Network (NCCN) e o International Study Group of Pancreatic Cancer (ISGPS), pacientes diagnosticados com ADP devem ser definidos como casos limítrofes ressecáveis enquanto a veia mesentérica portal-superior está suspeitamente envolvida, e para melhorar a taxa de ressecção R0, essas coortes são recomendadas para implementar ressecção sincrônica da veia11,12. Nessa condição, os casos limítrofes ressecáveis poderiam obter resultados perioperatórios e de sobrevida semelhantes aos ressecáveis. A duodenopancreatectomia laparoscópica, considerada um procedimento extremamente complicado e intrincado, tem sido relatada como segura e viável com o rápido desenvolvimento de técnicas e instrumentos laparoscópicos nos últimos anos13,14,15.
A ressecção e reconstrução venosa são ainda mais complexas e desafiadoras do que a LPD convencional, de modo que a LPD com reconstrução de prótese vascular artificial para os pacientes após quimioterapia neoadjuvante com ADP é uma das operações radicais mais complicadas. Este estudo fornece uma nova LPD de isolamento in situ No-Touch com ressecção parcial e reconstrução de SMV, que pode potencialmente evoluir para um procedimento padronizado, reprodutível e oncológico eficaz para pacientes com câncer de pâncreas ressecável limítrofe.
Esta técnica modificada de isolamento sem toque enfatiza a exploração da secção distal da VMS e do lado esquerdo da AMS abaixo do cólon transverso para avaliar a ressecabilidade, que é uma abordagem ideal de exploração. Para obedecer ao máximo aos princípios oncológicos No-Touch, a área pancreaticoduodenal, incluindo o tumor, não deve ser mobilizada antes da ligadura e dissecção do vascular ao redor dessa região. Combinando com as abordagens mediano-anterior e esquerda-posterior da AMS, a prioridade é dissecar todos os influxos arteriais tumorais para reduzir o sangramento intraoperatório. O passo seguinte é transeccionar as saídas da veia, incluindo a veia envolvida com margem suficiente. Finalmente, o tumor é ressecado in situ, e o espécime será removido em bloco.
O objetivo e as vantagens deste método são garantir que todas as etapas sigam os princípios oncológicos do No-Touch, a fim de diminuir o risco de metástase das células tumorais. A lógica por trás do desenvolvimento e uso desta técnica é que o tumor deve ser mobilizado no estágio final, incluindo a ressecção do tumor in situ e remoção do espécime em bloco após a oclusão das artérias de entrada e saída do tumor.
Devido às complexas técnicas de ressecção e reconstrução, este procedimento só pode ser realizado por equipes cirúrgicas experientes em centros de alto volume com habilidades cirúrgicas pancreáticas abertas e laparoscópicas. Além disso, o procedimento cirúrgico tem altos requisitos para a cooperação da equipe de operação, habilidades cirúrgicas e cognição anatômica. A quimioterapia neoadjuvante também pode aumentar a dificuldade operatória ao mesmo tempo. Além disso, ensaios clínicos randomizados com maior número de pacientes são difíceis de serem delineados e realizados pelas razões acima. Como resultado, evidências de alto nível para os resultados perioperatórios e de sobrevida dessa técnica são difíceis de estabelecer.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores não têm agradecimentos.
Materiais
| Name | Company | Catalog Number | Comments |
| 3D Laparoscope | STORZ | TC200,TC302 | |
| Absorbable hemostat | ETHICON, LLC | 2 in x 4 in | |
| Artificial Interposition Graft | W.L.Gore & Associates, Inc. | IRTH084040W | |
| Drainage tube | Aiyuan | 424280 | |
| Echelon Flex Powered Plus Articulating Endoscopic Linear Cutter and Endopath Echelon Endoscopic Linear Cutter Reloads with Gripping Surface Technology | Ethicon Endo-Surgery | ECR60G/GST60G | |
| Energy Platform | COVIDIEN ForceTriad Energy Platform | T2131469EX | |
| HARMONIC ACE Ultrasonic Surgical Devices | Ethicon Endo-Surgery | HAR36 | |
| Laparoscopic forceps | Gimmi | ||
| Laparoscopic right angle forceps | KARL STORZ | ||
| Laparoscopic scissors | AESCULAP | ||
| Latex T-shape Catheter | ZHANJIANG STAR ENTERPRISE CO., LTD. | 24Fr | |
| Ligating Clips | Teleflex Medical | 5,44,22,05,44,23,05,44,000 | |
| PDSII | Ethicon, LLC | W9109 | |
| PROLENE | Ethicon, LLC | W8556 | |
| Trocar | Surgaid | NPCS-100-1-12 | |
| Ultrasonic Surgical & Electrosurgical Generator | Ethicon Endo-Surgery | GEN11CN |
Referências
- Hirota, M., et al. Pancreatectomy using the no-touch isolation technique followed by extensive intraoperative peritoneal lavage to prevent cancer cell dissemination: a pilot study. Journal of the Pancreas. 6 (2), 143-151 (2005).
- Gall, T. M., et al. Reduced dissemination of circulating tumor cells with no-touch isolation surgical technique in patients with pancreatic cancer. JAMA Surgery. 149 (5), 482-485 (2014).
- Soeth, E., et al. Detection of tumor cell dissemination in pancreatic ductal carcinoma patients by CK 20 RT-PCR indicates poor survival. Journal of Cancer Research and Clinical Oncology. 131 (10), 669-676 (2005).
- Yap, T. A., Lorente, D., Omlin, A., Olmos, D., de Bono, J. S. Circulating tumor cells: a multifunctional biomarker. Clinical Cancer Research. 20 (10), 2553-2568 (2014).
- Fujita, J., et al. Laparoscopic right hemicolectomy with radical lymph node dissection using the no-touch isolation technique for advanced colon cancer. Surgery Today. 31 (1), 93-96 (2001).
- Hirota, M., et al. Pancreatoduodenectomy using a no-touch isolation technique. The American Journal of Surgery. 199 (5), 65-68 (2010).
- Kuroki, T., Eguchi, S. No-touch isolation techniques for pancreatic cancer. Surgery Today. 47 (1), 8-13 (2017).
- Tan, Z. J., et al. Clinical experience of laparoscopic pancreatoduodenectomy via orthotopic resection. Zhonghua Wai Ke Za Zhi [Chinese Journal of Surgery. 58 (10), 782-786 (2020).
- Osada, S., et al. Reconstruction method after pancreaticoduodenectomy. Idea to prevent serious complications. Journal of the pancreas. 13 (1), 1-6 (2012).
- Mizrahi, J. D., Surana, R., Valle, J. W., Shroff, R. T. Pancreatic cancer. Lancet. 395 (10242), 2008-2020 (2020).
- Tempero, M. A., et al. Pancreatic adenocarcinoma, version 2.2021, NCCN clinical practice guidelines in oncology. Journal of the National Comprehensive Cancer Network JNCCN. 19 (4), 439-457 (2021).
- Bockhorn, M., et al. Borderline resectable pancreatic cancer: a consensus statement by the International Study Group of Pancreatic Surgery (ISGPS). Surgery. 155 (6), 977-988 (2014).
- Tee, M. C., et al. Laparoscopic pancreatoduodenectomy does not completely mitigate increased perioperative risks in elderly patients. HPB (Oxford). The Official Journal of the International Hepato Pancreato Biliary Association. 17 (10), 909-918 (2015).
- Palanivelu, C., et al. Randomized clinical trial of laparoscopic versus open pancreatoduodenectomy for periampullary tumours. The British Journal of Surgery. 104 (11), 1443-1450 (2017).
- Wang, M., et al. Laparoscopic versus open pancreatoduodenectomy for pancreatic or periampullary tumours: A multicentre, open-label, randomised controlled trial. The Lancet. Gastroenterology & Hepatology. 6 (6), 438-447 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados