Method Article
Acoplamento da captura de carbono de uma usina com lagoas abertas semi-automatizadas para cultivo de microalgas
Neste Artigo
Resumo
Um protocolo é descrito para utilizar o dióxido de carbono no gás de usina de gás natural para cultivar microalgas em lagoas abertas de pista. A injeção de gás de flue é controlada com um sensor de pH, e o crescimento das microalgas é monitorado com medições em tempo real da densidade óptica.
Resumo
Nos Estados Unidos, 35% das emissões totais de dióxido de carbono (CO2) vêm da indústria de energia elétrica, das quais 30% representam a geração de eletricidade a gás natural. As microalgas podem biofixar CO2 10 a 15 vezes mais rápido que as plantas e converter biomassa de algas em produtos de interesse, como biocombustíveis. Assim, este estudo apresenta um protocolo que demonstra as sinergias potenciais do cultivo de microalgas com uma usina de gás natural situada no sudoeste dos Estados Unidos em um clima semiárido quente. Tecnologias de última geração são usadas para melhorar a captura e utilização de carbono através da espécie de algas verdes Chlorella sorokiniana, que pode ser processada ainda mais em biocombustível. Descrevemos um protocolo envolvendo uma lagoa de pista aberta semi-automatizada e discutimos os resultados de seu desempenho quando foi testado na usina de Energia Elétrica Tucson, em Tucson, Arizona. O gás de flua foi usado como a principal fonte de carbono para controlar o pH, e Chlorella sorokiniana foi cultivada. Um meio otimizado foi usado para cultivar as algas. A quantidade de CO2 adicionada ao sistema em função do tempo foi monitorada de perto. Além disso, outros fatores físico-químicos que afetam a taxa de crescimento de algas, a produtividade da biomassa e a fixação de carbono foram monitorados, incluindo densidade óptica, oxigênio dissolvido (DO), eletrocondutividade (CE) e temperaturas de ar e lagoa. Os resultados indicam que um rendimento de microalgas de até 0,385 g/L de peso seco sem cinzas é alcançável, com um teor lipídetivo de 24%. Aproveitar as oportunidades sinérgicas entre emissores de CO2 e agricultores de algas pode fornecer os recursos necessários para aumentar a captura de carbono, ao mesmo tempo em que apoia a produção sustentável de biocombustíveis e bioprodutos de algas.
Introdução
O aquecimento global é uma das questões ambientais mais importantes que o mundo enfrenta hoje1. Estudos sugerem que a principal causa é o aumento das emissões de gases de efeito estufa (GEE), principalmente CO2, na atmosfera devido às atividades humanas 2,3,4,5,6,7. Nos EUA, a maior densidade de emissões de CO2 é originária principalmente da combustão de combustíveis fósseis no setor de energia, especificamente usinas de geração de energia elétrica 3,7,8,9. Assim, as tecnologias de captura e utilização de carbono (CCU) surgiram como uma das principais estratégias para reduzir as emissões de GEEem 2,7,10. Estes incluem sistemas biológicos que utilizam a luz solar para converter CO2 e água via fotossíntese, na presença de nutrientes, à biomassa. O uso de microalgas foi proposto devido à taxa de crescimento rápido, alta capacidade de fixação de CO2 e alta capacidade de produção. Além disso, as microalgas têm amplo potencial de bioenergia porque a biomassa pode ser convertida em produtos de interesse, como biocombustíveis que podem substituir combustíveis fósseis 7,9,10,11,12.
As microalgas podem crescer e alcançar a conversão biológica em uma variedade de sistemas de cultivo ou reatores, incluindo lagoas de pista abertas e fotobioreatores fechados 13,14,15,16,17,18,19. Os pesquisadores têm estudado as vantagens e limitações que determinam o sucesso do bioprocesso em ambos os sistemas de cultivo, em condições internas ou externas 5,6,16,20,21,22,23,24,25 . Lagoas abertas são os sistemas de cultivo mais comuns para captura e utilização de carbono em situações onde o gás de chaminé pode ser distribuído diretamente da pilha. Este tipo de sistema de cultivo é relativamente barato, é fácil de escalar, tem baixos custos de energia e tem baixos requisitos de energia para mistura. Além disso, esses sistemas podem ser facilmente co-localizados com a usina para tornar o processo da CCU mais eficiente. No entanto, existem algumas desvantagens que precisam ser consideradas, como a limitação na transferência de gás/massa líquida de CO2. Embora existam limitações, as lagoas abertas de pista foram propostas como o sistema mais adequado para a produção de biocombustíveis microángicos ao ar livre 5,9,11,16,20.
Neste artigo, detalhamos um método para cultivo de microalgas em lagoas abertas de pista que combina a captura de carbono do gás de chaminucultura de uma usina de gás natural. O método consiste em um sistema semi-automatizado que controla a injeção de gás de chaminático com base no pH da cultura; o sistema monitora e registra o status de cultura chlorella sorokiniana em tempo real usando densidade óptica, oxigênio dissolvido (DO), eletrocondutividade (CE) e sensores de temperatura de ar e lagoa. Os dados de biomassa de algas e injeção de gás de flua são coletados por um data logger a cada 10 minutos na instalação de Energia Elétrica de Tucson. A manutenção da cepa de algas, a escala, as medições de controle de qualidade e a caracterização da biomassa (por exemplo, correlação entre densidade óptica, g/L e conteúdo lipíduo) são realizadas em um ambiente laboratorial na Universidade do Arizona. Um protocolo anterior esboçou um método para otimizar as configurações de gás de flua para promover o crescimento de microalgas em fotobioreatores via simulaçãode computador 26. O protocolo aqui apresentado é único na forma de utilizar lagoas abertas de pista e foi projetado para ser implementado no local em uma usina de gás natural, a fim de fazer uso direto do gás de chaminuto produzido. Além disso, medições de densidade óptica em tempo real fazem parte do protocolo. O sistema como descrito é otimizado para um clima semiárido quente (Köppen BSh), que exibe baixa precipitação, variabilidade significativa na precipitação de ano para ano, baixa umidade relativa, altas taxas de evaporação, céu claro e radiação solar intensa27.
Protocolo
1. Sistema de crescimento: configurações de lagoa aberta ao ar livre
- Configure as lagoas abertas de pista perto da fonte de gás de chaminática (contendo 8-10% DE CO2). Certifique-se de que a água e a eletricidade estão disponíveis no local do reator da lagoa e que o reator não está à sombra na maior parte do dia (Figura 1).
- Capture o gás de fluída durante o processo pós-combustão usando uma mangueira de combustível de 0,95 cm, alguns metros antes do gás da chaminé entrar na pilha para ser descarregado na atmosfera (Figura 2).
- Remova a água do gás de chaminé usando uma armadilha de água de 20 L e um condensador (comprimento da bobina ~12 m) entre a pilha e o compressor (Figura 2).
NOTA: O gás de flua normalmente contém aproximadamente 9\u201213,8% de água28. Além disso, o condensador e o gasoduto esfriam o gás de chaminina16. - Conecte os seguintes sensores a um datalogger para monitorar o crescimento de algas: (1) um sensor de densidade óptica em tempo real29, que mede a absorvência em dois comprimentos de onda — 650 e 750 nm — e pode detectar uma concentração celular alga máxima de 1,05 g/L; (2) um sensor DO; (3) termopares de ar e lagoa; (4) um sensor de pH; e (5) um sensor CE.
NOTA: Além disso, os sensores pH e CE estão conectados a um transmissor. A configuração da unidade de data logger é mostrada na Figura 3. - Certifique-se de que todos os componentes do sistema de crescimento de algas estejam calibrados e funcionando corretamente antes da inoculação.
2. sistema de controle de pH
- Gerencie a injeção de gás de flua usando um compressor, um sistema de válvula de controle e o programa de data logger, como mostrado nas Figuras 2 e Figura 3 (material suplementar A).
- Use um tubo para direcionar o gás de chaminução da válvula de controle para o fundo da lagoa da pista através de um difusor de pedra.
- Injete o gás de chaminíudo no sistema de crescimento com base no pH. Quando o valor do pH for maior que 8,05, o sistema injetará gás de flua, enquanto quando o pH é inferior a 8,00, o sistema vai parar a injeção de gás de chaminático em períodos sem crescimento. A vazão é medida em litros padrão por minuto (SLPM).
NOTA: Na válvula de controle, a pressão do gás da chaminé de entrada é limitada a um máximo de 50 psi.
3. Seleção de algas e manutenção da tensão (luz e temperatura)
NOTA: A alga verde Chlorella sorokiniana DOE 1412 foi isolada pela Juergen Polle (Brooklyn College)30,31 e selecionada pela Aliança Nacional para Biocombustíveis Avançados e Bioprodutos (NAABB); sua seleção foi baseada nos estudos anteriores de caracterização de cepas realizados por Huesemann et al.32,33 . Suas pesquisas sobre triagem de algas, produtividade de biomassa e cultivo simulado pelo clima (por exemplo, temperatura e luz) na região Sudoeste ao usar lagoas abertas ao ar livre informaram o método utilizado neste projeto.
- Mantenha culturas à temperatura ambiente (25 °C) usando um ciclo claro/escuro de 12 h/12 h.
- Mantenha a intensidade leve em 200 μM/m2/s para manutenção da cultura cultivada em placas e em pequenas culturas líquidas (50 mL a 500 mL).
- Mantenha a intensidade leve para escalar cultivada em culturas líquidas de 50 mL a 500 mL a 400 μM/m2/s, e culturas líquidas 5 L a 20 L a 600\u2012800 μM/m2/s.
4. Dimensionar e controlar a qualidade
- Prepare o meio de cultura BG11 utilizando água deionizada e os seguintes sais, para macronutrientes, em g/L: 1.5 NaNO3, 0.04 K2HPO4, 0,075 MgSO4*H2O, 0.036 CaCl2*H2O, 0,006 (NH4)5Fe(C6H4O7)2, 0,006 Na2EDTA*2H2O, 0.02 Na2CO3; adicionar 1 mL/L de solução de elemento de rastreamento, que contém os seguintes micronutrientes em g/L: 2,86 H3BO3, 1.81 MnCl2*4H2O, 0,22 ZnSO4*7H2O, 0,39 Na2MoO4*2H2O, 0,079 CuSO4*5H2O, 0,0494 Co(NO3)2*6H2O.
NOTA: Para inoculação de placa e/ou armazenamento a longo prazo, adicione 7,5 g/L de ágar Bacto; para a inoculação cultural, não é necessária adição de ágar. Esterilize o meio de cultura na autoclave por 21 min a 121 °C. - Despeje o meio BG11 com ágar em pratos Petri em um capô de fluxo laminar estéril ou armário de biossegurança. Uma vez que as placas estejam firmes e frias, pipeta 500 μL de uma cultura de estoque de algas congelada suspensa e adicione ampicillina (100 μg/mL); incubar as placas de algas em uma mesa de agitação (120 rpm) por 1 a 2 semanas.
- Use um laço estéril para selecionar uma única colônia de algas a partir de uma placa de cultura e inocula-a em um tubo de 50 mL contendo meio de crescimento estéril em um armário de biossegurança limpo. Cresça a pequena cultura líquida em uma mesa de agitação (120 rpm) por uma semana.
- Transfira 50 mL de cultura de algas (fase de crescimento linear, OD750nm ≥ 1) em um frasco de 1 L com meio líquido de 500 mL. Encaixe cada frasco com uma rolha de borracha e tubos de aço inoxidável para fornecer aeração. Filtre o ar usando filtros de esterilização de ar de 0,2 μm. Deixe a cultura crescer por uma a duas semanas. Monitore a densidade celular usando um espectrofotômetro (OD750nm).
- Coloque a cultura líquida de 500 mL em um carboy de 10 L contendo 8 L de meio de cultura não estéril e injete uma mistura de 5% de CO2 e 95% de ar. Em seguida, cultivar algas nas mesmas condições da etapa 4.4.
- Monitore a placa de estoque e as culturas líquidas (em etapas 4.2\u20124.5) uma vez por semana. Pegue uma alíquota e observe-a sob o microscópio em 10x e 40x de ampliação para garantir o crescimento da cepa desejada. Manteve culturas até serem comprometidas ou usadas para experimentos. Descarte culturas contaminadas.
5. Preparação média concentrada para cultivo de lagoa aberta
- Para preparar os elementos de rastreamento, a solução encha parcialmente um frasco volumoso de 1 L com água destilada (DW). Insira uma barra de meximento magnética e adicione os produtos químicos mostrados na Tabela 1 sequencialmente. Certifique-se de que cada ingrediente se dissolve antes da adição do próximo constituinte. Remova o ímã e encha o frasco até a marca de volume 1 L.
- Encha parcialmente uma garrafa de vidro 1 L com DW e insira a barra de agitação magnética. Coloque o recipiente na parte superior de uma placa de agitador magnético e adicione os produtos químicos para o volume final do reator, adicionando-os sequencialmente, garantindo que cada um se dissolva totalmente. A Tabela 2 lista os produtos químicos para preparar 1 L de médio, então multiplique todos os valores pelo volume final do reator. Encha a garrafa de vidro para 1 L.
6. Inoculação da lagoa aberta ao ar livre
- Limpe completamente o reator usando 30% de alvejante antes de cada inoculação e após a colheita. Recomenda-se deixar o alvejante durante a noite. Enxágüe bem o reator para remover todo o alvejante.
- Calibrar todos os sensores antes da inoculação das algas de acordo com o procedimento de calibração correspondente.
- Diluir a mídia concentrada (na etapa 5) usando a fonte de água preenchendo a lagoa da pista até 80%.
- Inocular o reator usando um carboy 10 L cheio de algas (fase de crescimento linear OD750nm > 2) e trazê-lo para o seu volume final.
- Microalgas aclimate sombreando parcialmente a lagoa do autódromo com paletes de madeira por ~ 3 dias (Figura 4), uma vez que a fase exponencial passou, como uma estratégia de adaptação para evitar a fotoinibição.
NOTA: Este período também dará tempo para que as microalgas se adaptem ao estresse causado pela injeção direta de gás de chaminático.
7. Experimento de crescimento em lote na estação geradora
- Inspecione e regise quaisquer variações do dia-a-dia, incluindo evaporação de água, motor de roda de remo, funcionalidade do sensor e qualquer coisa fora do comum.
- Escorra e inspecione o compressor e a armadilha de água todos os dias para remover qualquer excesso de água para minimizar a corrosão, uma vez que o gás de chaminé é altamente corrosivo34.
- Configure o data logger para digitalizar cada medição do sensor a cada 10 s e armazenar os dados médios a cada 10 minutos. Estes incluem DO, pH, CE, densidade óptica em tempo real, bem como temperatura do ar e reator.
8. Amostragem e monitoramento discretos
- Certifique-se de que o nível de água permanece constante no volume final do reator, caso contrário, a medição da densidade óptica será afetada.
- Após reabastecer a água no reator, pegue uma amostra de 5 mL para medições de massa celular por densidade óptica (540, 680 e 750 nm) usando um espectrômetro ultravioleta visível. Repita o processo diariamente.
- Faça uma amostra de 500 mL três vezes por semana para observações de microscópio e concentração de biomassa com base no peso seco livre de cinzas (AFDW).
- Realize observações de microscópio com lentes objetivas 10x e 40x. Além disso, essas ampliações do microscópio são utilizadas como parte do controle de qualidade de algas descrito na etapa 4.6.
- Use 400 mL da amostra na etapa 8.3 para AFDW
- Coloque cada filtro de microfibra de vidro de tamanho de poro de 0,7 μm em uma bandeja de papel alumínio e pré-trate cada bandeja/filtro de papel alumínio usando um forno por 4h a 540 °C.
- Rotule cada bandeja de papel alumínio usando um lápis #2, grave seu peso (A) e coloque-a no aparelho do filtro de vácuo.
- Mexa a amostra de algas vigorosamente antes de medir um volume a ser filtrado. Filtre a amostra de algas suficiente para dar uma diferença de peso pré/pós-cinzas entre 8 e 16 mgs. Escolha uma diferença de peso para usar ao longo do experimento e mantenha esse valor constante.
- Coloque cada filtro contendo a amostra de algas em sua bandeja de papel alumínio no forno a 105 °C por pelo menos 12 h.
- Retire a bandeja/filtro de papel alumínio do forno de secagem e coloque-a em um desiccador de vidro para evitar a captação de água. Registre cada bandeja de papel alumínio/peso do filtro (B).
- Coloque a bandeja/filtro de papel alumínio no forno de muffle de 540 °C por 4h.
- Desligue o forno de muffle, esfrie bandejas/filtros de papel alumínio, coloque-os no desiccador e grave cada bandeja de papel alumínio/peso do filtro (C).
- Calcule o AFDW usando análise gravimétrica:
% AFDW= C – A x 100 / B
- Segure 2 L de algas antes de colher para análise de extração lipídica assistida por micro-ondas (MAE) usando solventes.
- Centrifugar a amostra de algas a uma força centrífuga relativa (RFC) de 4.400 x g por 15 min. Pegue a pelota de algas e seque-a usando um forno a 80 °C por pelo menos 24 h.
- Triture a amostra de algas e pese o pó de algas (a biomassa recomendada varia de 0,3 g a 0,5 g).
- Adicione o pó de algas (biomassa de algas secas) nos vasos do sistema de reação acelerada de micro-ondas (MARS) Xpress, adicione 10 mL de clorofórmio:metanol (2:1, v/v) solução de solvente sob o capô, feche os vasos e deixe ficar durante a noite.
- Coloque as naves na máquina MARS usando o sensor solvente por 60 min a 70 °C e 800 W de potência.
- Tire os vasos de MARTE e deixe-os esfriar sob o capô.
- Use um funil e uma lã de vidro para separar a parte líquida que contém clorofórmio, metanol e lipídios transferindo cada amostra líquida para um tubo de teste de vidro pré-pesado e mantenha os sólidos (biomassa livre de lipídios) para outras análises.
- Pegue os tubos de ensaio contendo os lipídios para o evaporador de nitrogênio, remova-os uma vez que o líquido tenha sido evaporado e, em seguida, deixe os tubos durante a noite sob o capô para garantir a secura completa.
- Calcular o conteúdo lipídico (wt. %) utilizando análise gravimétrica:
Teor lipídico (wt. %) = Biomassa seca de lipídios x 100/ Massa de algas secas
9. Colheita de algas e rotação de culturas
- Colher 75% do volume total de cultura de algas quando a cultura estiver perto de chegar à fase estacionária. Tome 2\u20125 L de cultura para realizar análises de produtividade de biomassa em laboratório. Processe e converta o resto das algas nos produtos algas desejados.
- Ressunúcule a lagoa aberta usando as algas de 25% restantes como inóculo. Adicione água até 80% do volume total do reator, adicione a mídia concentrada e, em seguida, finalize o enchimento até o volume final do reator, se necessário.
- Cultive a tensão de algas apropriada de acordo com a estação, com base nas condições de temperatura e intensidade da luz.
10. Gerenciamento de dados
- Registo dados no data logger e colete para análise como na etapa 7.3.
- Considere salvar dados brutos e analisados na unidade de compartilhamento regional de Agal Feedstock Testbed (RAFT). Os colaboradores do projeto RAFT contribuem com seus dados para simular e modelar a produtividade de algas e validar o cultivo ao ar livre.
Resultados
Resultados experimentais anteriores do nosso laboratório indicam que o cultivo de microalgas usando uma lagoa de pista aberta semi-automatizada pode ser acoplado a processos de captura de carbono. Para entender melhor a sinergia entre esses dois processos (Figura 2), desenvolvemos um protocolo e o adaptamos para cultivar a espécie de algas verdes Chlorella sorokiniana em condições ao ar livre em um clima semiárido quente. O gás de flua a gás natural foi obtido a partir de uma usina industrial de geração de energia. Este protocolo utiliza várias tecnologias para avaliar a produtividade da biomassa alga: (1) crescimento de algas utilizando um sensor de densidade óptica em tempo real (Figura 5); (2) crescimento de algas em relação às injeções de pulso on-off de gás fluído na cultura em função do pH (Figura 6 e Figura 7); e (3) o crescimento das algas correlações com parâmetros ambientais como temperatura, oxigênio dissolvido e eletrocondutividade (Figura 8 e Figura 9).
Testamos um sensor de densidade óptica em tempo real que monitora o crescimento das algas e a dinâmica fisiológica. Este sensor nos permitiu estabelecer, via correlação de laboratório, a biomassa de peso seco livre de cinzas correspondente (g/L). A Figura 5 mostra uma comparação entre o sensor e as medições laboratoriais. Ambas as leituras mostram tendências semelhantes, aumentando em função do tempo. No entanto, as leituras do sensor in situ podem acompanhar o ciclo de crescimento das algas dia/noite. Esse ciclo mostra que os valores de densidade óptica aumentam durante o dia, mas diminuem à noite durante a respiração, indicando uma mudança na produtividade da biomassa. A integração do sensor de densidade óptica em tempo real torna possível tomar decisões eficazes de gestão sobre o sistema de produção de algas globais.
Implantamos um sistema semi-automatizado de injeção de pulso de gás de flua, que é representado na Figura 6 por um ciclo de injeção de gás de 24 horas medido durante uma temporada de outono particularmente quente em Tucson, AZ. Como mostrado na Figura 6, o gás fluído foi injetado de aproximadamente 8:00 às 18:00 (período diurno), mas não foi injetado entre 18:00 e 8:00 (período noturno). Este ciclo dia/noite reflete a exposição diária da luz solar e a falta de luz durante a noite e, consequentemente, a ativação da fotossíntese ou fotorespiração, respectivamente. A Figura 7 apresenta o gás de chaminução cumulativo injetado (L) durante este lote de algas. Neste caso, foram utilizados 6.564 L de gás de chaminé, correspondente a 538 L CO2, para o crescimento de 0,29 g de biomassa de algas. O gráfico mostra que, à medida que a taxa de crescimento de algas aumentava, era necessário mais gás de chaminócia (CO2) (Figura 6). Os resultados experimentais confirmaram que o sistema de injeção de pulso de gás de flua on-off é eficaz para facilitar a captura e utilização de carbono através do cultivo de microalgas.
Medimos e monitoramos outros parâmetros físico-químicos para estabelecer uma correlação entre eles e o crescimento e a produtividade de algas (Figura 8 e Figura 9). Os parâmetros ambientais medidos foram oxigênio dissolvido, eletrocondutividade (CE), e temperaturas de ar e lagoa. Como esperado, todos os parâmetros, exceto CE, apresentaram tendências semelhantes que estavam altamente correlacionadas com a radiação solar. Os resultados indicam que essas variáveis ambientais tiveram o impacto mais significativo no crescimento de algas e são utilizadas para a modelagem da biomassaúngica 35. A CE não alterou significativamente durante o processo de lote. Assim, não forneceu nenhuma informação relevante sobre o crescimento de algas. Para o cultivo de Chlorella sorokiniana usando água não salina, as medidas ce podem ser omitidas.

Figura 1: Localização do local piloto na Tucson Electric Power para acoplamento da captura de carbono de usinas e reatores semi-automatizados de lagoa aberta para cultivo de microalgas. Os dois locais são representados por: 1) Algas Site U3 (unidade 3) e 2) Algae Site U4 (unidade 4) crédito da foto: José Manuel Cisneros Vazquez. Clique aqui para ver uma versão maior desta figura.
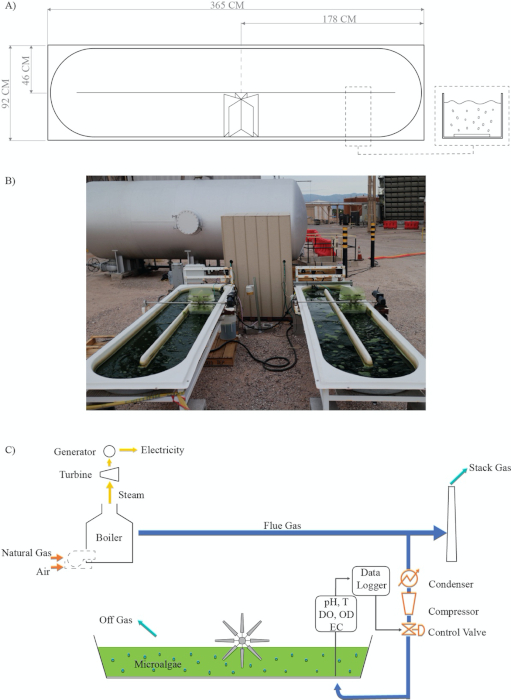
Figura 2: Mapa de fluxo de processo para acoplamento de captura de carbono e lagoas de pista abertas semi-automatizadas para cultivo de microalgas em um clima quente do semiárido. (A) Design open raceway paddlewheel; (B) Instalações experimentais reais; (C) Processo: acoplamento da captura de carbono e microalgas cultivadas modificadas a partir de Van Den Hende28. Lendas: T = Temperatura; DO = Oxigênio dissolvido; OD = Densidade óptica; EC = Condutividade elétrica; Data Logger. Clique aqui para ver uma versão maior desta figura.

Figura 3: Representação esquemática da configuração do sensor. (A) Representação dos sensores gerais de lagoa aberta ao ar livre configurado, em que CV1 e CV2 são as válvulas de controle, DL é o logger de dados, e T1 e T2 são os transmissores. (B) Representação de uma válvula de controle. (C) Representação da conexão dos sensores com o data logger; círculo azul escuro: densidade óptica em tempo real, triângulo laranja: pH e CE, triângulo negro: termopares, triângulo vermelho: oxigênio dissolvido, azul claro: válvula de controle. (D) pH e transmissor CE. Clique aqui para ver uma versão maior desta figura.

Figura 4: Algas sob o processo de aclimatação. Estratégia de aclimatação de microalgas usando paletes de madeira durante a fase exponencial. Clique aqui para ver uma versão maior desta figura.

Figura 5: Representação do monitoramento do crescimento das algas. (A) Gráfico para concentração de biomassa AFDW (g/L) vs. tempo de medições laboratoriais; (B) Gráfico para correlação entre sensor de densidade óptica e medições laboratoriais a 650 nm; e (C) gráfico para sensor de densidade óptica em tempo real vs tempo para um lote experimental. Clique aqui para ver uma versão maior desta figura.
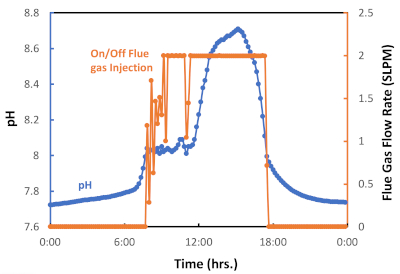
Figura 6: Gráfico para injeção de pulso de gás de flua ligado/desligado como uma mistura de pH. O logger de dados foi configurado para iniciar a injeção de gás de chaminíudo (válvula controlada on) no pH = 8,05 e para acabar com a injeção de gás de chaminático (válvula controlada) em pH = 8,00. Clique aqui para ver uma versão maior desta figura.
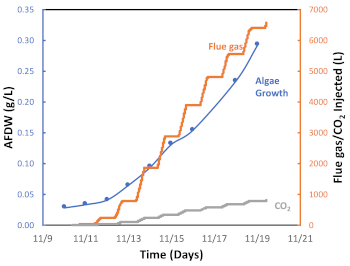
Figura 7: Gráfico para crescimento de algas (g/L), quantidade de gás de flua injetada e quantidade de CO2 injetado em função do tempo. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 8: Representação do monitoramento de temperatura. Lendas: linha amarela sólida = temperatura do reator do lago de pista de corrida; linha cinza sólida = temperatura do ar; e linha azul tracejada = Temperatura da Estação AZMET (Rede Meteorológica do Arizona). Clique aqui para ver uma versão maior desta figura.

Figura 9: Monitoramento dos parâmetros de crescimento das algas. Lendas: linha sólida laranja = radiação solar; linha sólida cinza = eletroconducito (CE); e linha sólida amarela = oxigênio dissolvido (DO). Clique aqui para ver uma versão maior desta figura.
| Componentes | Concentração na solução (g/L) |
| H3BO3 | 0.00286 |
| MnCl2·4H2O | 0.00181 |
| ZnSO4·7H2O | 0.0001373 |
| Na2moo4·2h2o | 0.00039 |
| Cuso4·5H2O | 0.000079 |
| Co(NO3)2·6H2O | 0.00005518 |
| NiCl2·6 H2O | 0.0001 |
Tabela 1: Traço elementos receita de solução.
| Componentes | Nome comum | Concentração na solução (g/L) |
| (NH2) algarismo CO | Ureia | 0.1 |
| Mgso4·7H2O | Sulfato de magnésio | 0.012 |
| NH4H2PO4 | Fosfato de amônio | 0.035 |
| Kcl | Potassa | 0.175 |
| FeCl3 | Citrato lírico (Citraplex) | 0.005423 |
| Solução de metal trace | Volume de Micros 1000x (ml) | 1 |
Tabela 2: Receita de mídia otimizada para 1 L.
Arquivos de codificação suplementar. Clique aqui para baixar este arquivo.
Discussão
Neste estudo, demonstramos que o acoplamento sinérgico da captura de carbono do gás fluído e o cultivo de microalgas é possível em um clima semiárido quente. O protocolo experimental para o sistema semi-automatizado de lagoas de pista de corrida integra tecnologia de ponta para monitorar parâmetros relevantes em tempo real que se correlacionam com o crescimento de algas ao usar gás de chaminé como fonte de carbono. O protocolo proposto visa reduzir a incerteza no cultivo de algas, que é uma das principais desvantagens das lagoas de pista 20,21,36. Em nossa experiência, as etapas mais críticas do protocolo envolvem o sistema de controle de pH e um método eficaz para inocular o sistema (Figura 2). O sistema de controle de pH fornece gás/CO2 flue e representa uma estratégia para otimizar a eficiência na captura e utilização de CO2 (Figura 3)37. Este sistema controlado tem se mostrado mais eficiente do que um sistema de injeção contínua para o processo de cultivo de microalgase porque reduz a gases de efeito estufa, ao mesmo tempo em que fornece gás de chaminático suficiente para atingir a taxa máxima de crescimento de algas20,37. Quando a injeção de gás de chaminó é baseada no pH, um fator-chave para o cultivo de algas é selecionar um valor adequado de pH para as espécies de microalgas antes de vacinar a lagoado autódromo 38,39. Qiu et al.40 descobriram que um valor de pH de 8 é o melhor para a espécie de água doce Chlorella sorokiniania quando se considera o crescimento celular e a produção lipídica40. Além disso, Molina Grima et al.41 recomendam um pH abaixo de 8 para reduzir a perda de nitrogênio e obter melhor absorção de nitrogênio pela microalgae/biomassa41. No entanto, Yuvraj et al.42 sugerem que o pH não é um método apropriado para avaliar o teor de CO2 na água devido ao efeito da fertilização por nitrogênio na acidez do meio42. Nossos resultados mostram que o pH pode ser efetivamente utilizado para gerenciar a injeçãode CO 2 para o sistema aqui apresentado (Figura 6); nosso manejo de injeção de gás de chaminático, que manteve a cultura em pH 8, resultou em altos rendimentos de biomassa e replicabilidade (Figura 7).
Após a inoculação, as algas devem se aclimatar ao sistema para evitar a fotoinibição e ajustar-se à alta temperatura da mídia do autódromo. Neste clima semiárido quente, observamos fotoinibição de algas devido à alta radiação solar 39,43,44 (Figura 9). Esse efeito pode não só retardar, mas também inibir a inoculação de microalgas durante a fase exponencial 32,35,45,46,47. Para reduzir o impacto da aclimatação sobre as microalgas, projetamos uma estratégia bem sucedida e viável que consiste em sombrear parcialmente a lagoa da pista com paletes de madeira. Essa estratégia permite que as microalgas sejam expostas repetidamente, mas por curtos períodos de tempo às condições solares. Outro fator de estresse é a alta temperatura do gás flua e o ar ambiente33,48 (Figura 8). A temperatura do gás de chaminática é bastante alta no estágio pós-combustão 10,48,49. A utilização do gás de chaminuto injetando-o diretamente do gasoduto despachado na lagoa da pista pode contribuir para aumentar ainda mais a temperatura do meio. Assim, um condensador seguido por uma armadilha de água localizada antes do compressor não só reduzirá a transferência de calor, mas também a quantidade de água que atinge o compressor (Figura 2). Descobrimos que ambos os dispositivos eram necessários para reduzir a taxa de falha do compressor. Além disso, a umidade, a temperatura do gás da chamine e a natureza corrosiva do gás de chaminuto devem ser consideradas ao estimar o ciclo de vida e a manutenção do compressor. Além disso, altas temperaturas causam maiores taxas de evaporação.
Este protocolo está sujeito a algumas limitações. De acordo com a Figura 6, a válvula de controle não foi capaz de injetar gás de fluída suficiente quando a fotossíntese estava no seu auge. Esse efeito pode ser atribuído à baixa transferência de massa do gasoso para a fase líquida devido ao projeto do reator 5,16,50,51. Mendoza et al.36,52 e de Godos et al.16 afirmaram que as lagoas de pista têm uma má transferência de massa gás/líquido, o que representa uma das mais severas restrições de projeto 16,36,52. Seu design de canal raso limita a transferência de massa de CO2 devido à pequena área de interface entre o gás e o meio de cultura, o que causa um aumento no co2 off-gassing (Figura 2). Assim, dispositivos e novas configurações foram propostos para aumentar o tempo de contato gás/líquido, incluindo somas, colunas de mistura, silicone permeável e sistemas de difusão de espaçamento 36,52,53. Todos esses sistemas foram usados na tentativa de melhorar a transferência de massa de CO2; no entanto, alguns desses sistemas também melhoram a distribuição de nutrientes, controlam o pH e removem o excesso de O2 5,24,36,52. Finalmente, as paralisações são outras limitações que podem surgir ao capturar e utilizar gás de chaminática real de uma usina. Essas paralisações nem sempre são programadas. Assim, devem ser consideradas fontes alternativas temporárias de CO2, por exemplo, realocação ou conexão da linha principal de CO2 a múltiplas unidades de potência (Figura 1).
A capacidade de produzir microalgas com este protocolo é apoiada por nossos resultados sobre produtividade de algas (Figura 5), respostas algas aos parâmetros selecionados (Figura 6, Figura 8, Figura 9) e cultivo bem sucedido das espécies algas desejadas quando alimentados pela injeção direta de gás flua. Reatores abertos são mais baratos de operar e, portanto, este protocolo baseia-se em seus pontos fortes para acelerar a implantação em escala comercial desta forma de captura e utilização de carbono 16,20,54,55,56. Esta região semiárida quente experimenta alta radiação solar e flutuações significativas de temperatura durante todo o ano (Figura 8 e Figura 9)57; portanto, é um local privilegiado para testar este tipo de protocolo. O sensor de densidade óptica forneceu leituras de OD consistentes para o nosso sistema aberto ao ar livre (Figura 5); esse tipo de coleta de dados seria impraticável usando outros sensores. Além disso, os sensores responderam bem às variações significativas de temperatura do dia para a noite (Figura 8), permitindo-nos tomar decisões oportunas de produtividade alga29. Além disso, o meio otimizado proposto tem a vantagem crítica de ser baseado em fertilizantes comerciais e fontes de nutrientes prontamente disponíveis58 (Tabela 1 e 2); este meio pode ser facilmente produzido internamente ou pode ser originado mediante solicitação de empresas de fertilizantes líquidos agrícolas58. Finalmente, o protocolo semi-automatizado foi testado em uma usina a gás natural adicional. Os resultados desse estudo de confirmação não são apresentados neste artigo. Nesse estudo de confirmação, o protocolo foi bem sucedido apesar das condições climáticas extremas em Tucson e das temperaturas excepcionalmente quentes na estação de geração devido à localização do reator dentro do layout da usina. Portanto, a replicabilidade do protocolo foi examinada para o ambiente de Tucson quando o gás natural é usado como combustível para produzir eletricidade.
Recomenda-se que as etapas a seguir desenvolvam ainda mais esse protocolo e melhorem e melhorem a automação dos processos envolvidos. A primeira recomendação é tornar a injeção de gás de chamine um processo de taxa completamente variável, melhorando assim o gerenciamento de CO2 e pH; o programa atual abre totalmente a válvula de injeção quando o pH sobe acima de 8 e fecha-o quando o pH atinge 8 novamente. Melhorar a forma como o CO2 é injetado também é necessário. O objetivo é reduzir o tamanho das bolhas de CO2 , ou seja, gerar microbolhas para melhorar a difusão de CO2 no meio sem recorrer à injeção de gás fluído em maior pressão. O uso de injetores aprimorados, reduzindo assim os custos operacionais de energia, é considerado necessário em uma aplicação comercial do protocolo. A inclusão de ferramentas preditivas baseadas na previsão do tempo e no status atual das microalgas para o controle do gás e fertilizante de chaminática, principalmente N, para melhorar a eficiência do uso de N, também é recomendada. O uso da modelagem dinâmica de fluidos computacionais é considerado uma ferramenta vital no desenvolvimento do protocolo proposto; a modelagem pode ajudar a otimizar o design, configuração e operação de todo o hardware envolvido no monitoramento e gerenciamento das microalgas. Outra área que poderá ser explorada no futuro é a aplicação de DNA ambiental (eDNA) e técnicas de PCR em tempo real para monitorar a saúde e a composição da cultura das microalgas. Amostras de água poderiam ser analisadas, e os resultados indicariam se as microalgas objetivas são as espécies predominantes no meio ou se ela está competindo ou foi substituída por um organismo diferente.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado através do projeto Regional Algal Feedstock Testbed, Departamento de Energia dos EUA DE-EE0006269. Agradecemos também a Esteban Jimenez, Jessica Peebles, Francisco Acedo, Jose Cisneros, RAFT Team, Mark Mansfield, funcionários da usina de energia UA e funcionários da usina tep por toda a sua ajuda.
Materiais
| Name | Company | Catalog Number | Comments |
| Adjustable speed motor (paddle wheel system) | Leeson | 174307 | Lesson 174307.00, type: SCR Voltage; Amps:10 |
| Aluminum weight boats | Fisher Scientific | 08-732-102 | Fisherbrand Aluminum Weighing Dishes |
| Ammonium Iron (III) (NH?)?[Fe(C?H?O?)?] | Fisher Scientific | 1185 - 57 - 5 | Medium preparation. Ammonium iron(III) citrate |
| Ammonium Phosphate | Sigma-Aldrich | 7722-76-1 | This chemical is used for the optimized medium |
| Ampicillin sodium salt | Sigma Aldrich | A9518-5G | This chemical is used for avoiding algae contamination |
| Autoclave | Amerex Instrument Inc | Hirayama HA300MII | |
| Bacto agar | Fisher Scientific | BP1423500 | Fisher BioReagents Granulated Agar |
| Bleach | Clorox | Germicidal Bleach, concentrated clorox | |
| Boric Acid (H3BO3) | Fisher Scientific | 10043-35-3 | Trace Elelements: Boric acid |
| Calcium chloride dihydrate (CaCl2*2H2O) | Sigma-Aldrich | 10035-04-8 | Medium preparation. Calcium chloride dihydrate |
| Carboys (20 L) | Nalgene - Thermo Fisher Scientific | 2250-0050PK | Polypropylene Carboy w/Handles |
| Centrifuge | Beckman Coulter, Inc | J2-21 | |
| Chloroform | Sigma-Aldrich | 67-66-3 | This chemical is used for lipid extraction |
| Citraplex 20% Iron | Loveland Products | SDS No. 1000595582 -17-LPI | https://www.fbn.com/direct/product/Citraplex-20-Iron#product_info |
| Cobalt (II) nitrate hexahydrate (Co(NO3)2*6H2O) | Sigma-Aldrich | 10026-22-9 | Trace Elements: Cobalt (II) nitrate hexahydrate |
| Compressor | Makita | MAC700 | This equipment is used for the injection CO2 system |
| Control Valve | Sierra Instruments | SmartTrak 100 | This item needs to be customized for your application. In our case, it was used a 5% CO2 and 95% air mixture. |
| Copper (II) Sulfate Pentahydrate (CuSO4*5H2O) | Sigma-Aldrich | 7758-99-8 | Trace Elements: Copper (II) Sulfate Pentahydrate |
| Data Logger: Campbell unit CR3000 | Scientific Campbell | CR3000 | This equipment is used for controlling all the system, motoring and recording data |
| Dissolvde Oxygen Solution | Campbell Scientific | 14055 | Dissolved oxygen electrolyte solution DO6002 - Lot No. 211085 |
| Dissolved Oxygen probe | Sensorex | ? | DO6400/T Dissolved Oxygen Sensor with Digital Communication |
| Electroconductivity calibration solution | Ricca Chemical Company | 2245 - 32 ( R2245000-1A ) | Conductivity Standard, 5000 uS/cm at 25C (2620 ppm TDS as NaCl) |
| Electroconductivity probe sensor | Hanna Instruments | HI3003/D | Flow-thru Conductivity Probe - NTC Sensor, DIN Connector, 3m Cable |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (Na2EDTA*2H2O) | Sigma-Aldrich | 6381-92-6 | Medium Preparation: Ethylenediaminetetraacetic acid disodium salt dihydrate |
| Filters | Fisher Scientific | 09-874-48 | Whatman Binder-Free Glass Microfiber Filters |
| Flasks | Fisher scientific | 09-552-40 | Pyrex Fernbach Flasks |
| Furnace | Hogentogler | Model: F6020C-80 | Thermo Sicentific Thermolyne F6020C - 80 Muffle Furnace |
| Glass dessicator | VWR International LLC | 75871-430 | Type 150, 140 mm of diameter |
| Glass funnel | Fisher Scientific | FB6005865 | Fisherbrand Reusable Glass Long-Stem Funnels |
| Laminar flow hood | Fisher Hamilton Safeair | Fisher Hamilton Stainless Safeair hume hood | |
| Magnesium sulfate heptahydrate (MgSO4*7H2O) | Fisher Scientific | 10034 - 99 - 8 | Medium Preparation: Magnesium sulfate heptahydrate |
| Methanol | Sigma-Aldrich | 67-56-1 | Lipid extraction solvent |
| Micro bubble Diffuser | Pentair Aquatic Eco-Systems | 1PMBD075 | This equipment is used for the injection CO2 system |
| Microalgae: Chlorella Sorokiniana | NAABB | DOE 1412 | |
| Microoscope | Carl Zeiss 4291097 | ||
| Microwave assistant extraction | MARS, CEM Corportation | CEM Mars 5 Xtraction 230/60 Microwave Accelerated Reaction System. Model: 907601 | |
| MnCl2*4H2O | Sigma-Aldrich | 13446-34-9 | Manganese(II) chloride tetrahydrate |
| Mortars | Fisher Scientific | FB961B | Fisherbrand porcelein mortars |
| Nitrogen evaporator | Organomation | N-EVAP 112 Nitrogen Evaporatpr (OA-SYS Heating System) | |
| Oven | VWR International LLC | 89511-410 | Forced Air Oven |
| Paddle Wheel | 8-blade horizontal axis propeller. This usually comes as part of the paddlewheel reactor. | ||
| Paddle wheel motor | Leeson | M1135042.00 | Leeson, Model: CM34025Nz10C; 1/4 HP; Volts 90; FR 34; 62 RPM. |
| Pestles | Fisher Scientific | FB961M | Fisherbrand porcelein pestles |
| pH and EC Transmitter | Hanna Instruments | HI98143 | Hanna Instruments HI98143-04 pH and EC Transmitter with Galvanic isolated 0-4V. |
| pH calibration solutions | Fisher Scientific | 13-643-003 | Thermo Scientific Orion pH Buffer Bottles |
| pH probe sensor | Hanna Instruments | HI1006-2005 | Hanna Instruments HI1006-2005 Teflon pH Electrode with matching pin 5m. |
| Pippete tips | Fisher Scientific | 1111-2821 | 1000 ul TipOne graduated blue tip in racks |
| Pippetter | Fisher Scientific | 13-690-032 | Eppendorf Reserch plus Variable Adjustable Volume Pipettes: Single-channel |
| Plastic cuvettes | Fisher scientific | 14377017 | BrandTech BRAND Plastic Cuvettes |
| Plates | Fisher scientific | 08-757-100D | Corning Falcon Bacteriological Petri Dishes with Lid |
| Potash | This chemical is used for the optimazed medium preparation. It was bought in a fertilizer local company | ||
| Potassium phosphate dibasic (K2HPO4) | Sigma-Aldrich | 7758 -11 - 4 | Medium Preparation: Potassium phosphate dibasic |
| Pyrex reusable Media Storage Bottles | Fisher scientific | 06-414-2A | 1 L and 2 L bottels - PYREX GL45 Screw Caps with Plug Seals |
| Raceway Pond | Similar equipment can be bought at https://microbioengineering.com/products | ||
| Real Time Optical Density Sensor | University of Arizona | This equipment was design and build by a member of the group | |
| RS232 Cable | Sabrent | Sabrent USB 2.0 to Serial (9-Pin) DB-9 RS-232 Converter Cable, Prolific Chipset, Hexnuts, [Windows 10/8.1/8/7/VISTA/XP, Mac OS X 10.6 and Above] 2.5 Feet (CB-DB9P) | |
| Shaker Table | Algae agitation 150 rpm | ||
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | 497-19-8 | Sodium carbonate |
| Sodium molybdate dihydrate (Na2MoO4*2H2O) | Sigma-Aldrich | 10102-40-6 | Medium Preparation: Sodium molybdate dihydrate |
| Sodium nitrate (NaNO3) | Sigma-Aldrich | 7631-99-4 | Medium Preparation: Sodium nitrate |
| Spectophotometer | Fisher Scientific Company | 14-385-400 | Thermo Fisher Scientific - 10S UV-Vis GENESTYS Spectrophotometer cylindrical Longpath cell holder; internal reference dectector, Xenon flash lamp; dual silicon photodiode; 240V, 50 to 60Hz selected automatically. |
| Test tubes | Fisher Scientific | 14-961-27 | Fisherbrand Disposable Borosilicate Glass Tubes with Plain End (10 ml) |
| Thermocouples type K | Omega | KMQXL-125G-6 | |
| Urea | Sigma-Aldrich | 2067-80-3 | Urea |
| Vacuum filtration system | Fisher Scientific | XX1514700 | MilliporeSigma Glass Vacuum Filter Holder, 47 mm. The system includes: Ground glass flask attachment, coarse-frit glass filter support, and flask |
| Vacuum pump | Grainger | Marathon Electric AC Motor Thermally protected G588DX - MOD 5KH36KNA510X. HP 1/4. RPM 1725/1425 | |
| Zinc sulfate heptahydrate (ZnSO4*7H2O) | Sigma-Aldrich | 7446-20-0 | Zinc sulfate heptahydrate |
Referências
- The Intergovernmental Panel on Climate Change. , Available from: https://www.ipcc.ch/ (2018).
- Songolzadeh, M., Soleimani, M., Ravanchi, M., Songolzadeh, R. Carbon Dioxide Separation from Flue Gases: A Technological, Review Emphasizing Reduction in Greenhouse Gas Emissions. The Scientific World Journal. 2014, 1-34 (2014).
- Litynski, J., Klara, S., McIlvried, H., Srivastava, R. The United States Department of Energy's Regional Carbon Sequestration Partnerships program: A collaborative approach to carbon management. Environ International. 32 (1), 128-144 (2006).
- Cuellar-Bermudez, S., Garcia-Perez, J., Rittmann, B., Parra-Saldivar, R. Photosynthetic Bioenergy Utilizing CO2: an Approach on Flue Gases Utilization for Third Generation Biofuels. Journal of Clean Production. 98, 53-65 (2014).
- Cheah, W., Show, P., Chang, J., Ling, T., Juan, J. Biosequestration of Atmospheric CO2 and Flue Gas-Containing CO2 by Microalgae. Bioresource Technology. 184, 190-201 (2014).
- Kao, C., et al. Utilization of Carbon Dioxide in Industrial Flue Gases for the Cultivation of Microalga Chlorella sp. Bioresource Technology. 166, 485-493 (2014).
- White, C., Strazisar, B., Granite, E., Hoffman, S., Pennline, H. Separation and Capture of CO2 from Large Stationary Sources and Sequestration in Geological Formations. Journal of the Air and Waste Management Association. 53 (10), 1172-1182 (2003).
- Benemann, J. CO2 Mitigation with Microalgae Systems. Pergamon Energy Conversion Management Journal. 38, 475-479 (1997).
- U.S.Department of Energy. The Capture , Utilization and Disposal of Carbon Dioxide from Fossil Fuel-Fired Power Plants. Energy. 2, (1993).
- Granite, E., O'Brien, T. Review of Novel Methods for Carbon Dioxide Separation from Flue and Fuel Gases. Fuel Processesing Technology. 86 (14-15), 1423-1434 (2005).
- Benemann, J. Utilization of Carbon Dioxide from Fossil Fuel-Burning Power Plants with Biological Systems. Energy Conversion and Management. 34 (9-11), 999-1004 (1993).
- Joshi, C., Nookaraju, A. New Avenues of Bioenergy Production from Plants: Green Alternatives to Petroleum. Journal of Petroleum & Environmental Biotechnology. 03 (07), 3(2012).
- Chisti, Y. Constraints to commercialization of algal fuels. Journal of Biotechnology. 22, 166-186 (2013).
- Han, S., Jin, W., Tu, R., Wu, W. Biofuel production from microalgae as feedstock: current status and potential. Critical Reviews in Biotechnology. 35 (2), 255-268 (2015).
- Lam, M., Lee, K. Potential of using organic fertilizer to cultivate Chlorella vulgaris for biodiesel production. Applied Energy. 94, 303-308 (2012).
- de Godos, I., et al. Evaluation of carbon dioxide mass transfer in raceway reactors for microalgae culture using flue gases. Bioresource Technology. 153, 307-314 (2014).
- Posten, C., Schaub, G. Microalgae and terrestrial biomass as source for fuels a process view. Journal of Biotechnology. 142 (1), 64-69 (2009).
- Demirbas, M. Biofuels from algae for sustainable development. Applied Energy. 88 (10), 3473-3480 (2011).
- Shelef, G., Sukenik, A., Green, M. Microalgae Harvesting and Processing A Literature Review. , (1984).
- Pawlowski, A., Mendoza, J., Guzmán, J., Berenguel, J., Acién, F., Dormido, S. Effective utilization of flue gases in raceway reactor with event-based pH control for microalgae culture. Bioresource Technology. 170, 1-9 (2014).
- Zhu, B., Sun, F., Yang, M., Lu, L., Yang, G., Pan, K. Large-scale biodiesel production using flue gas from coal-fired power plants with Nannochloropsis microalgal biomass in open raceway ponds. Bioresource Technology. 174, 53-59 (2014).
- Kaštánek, F., et al. In-field experimental verification of cultivation of microalgae Chlorella sp. using the flue gas from a cogeneration unit as a source of carbon dioxide. Waste Management & Research. 28 (11), 961-966 (2010).
- Yadav, G., Karemore, A., Dash, S., Sen, R. Performance evaluation of a green process for microalgal CO2 sequestration in closed photobioreactor using flue gas generated in-situ. Bioresource Technology. 191, 399-406 (2015).
- Zhao, B., Su, Y., Zhang, Y., Cui, G. Carbon dioxide fixation and biomass production from combustion flue gas using energy microalgae. Energy. 89, 347-357 (2015).
- He, L., Chen, A., Yu, Y., Kucera, L., Tang, Y. Optimize Flue Gas Settings to Promote Microalgae Growth in Photobioreactors via Computer Simulations. Journal of Visualized Experiments. (80), e50718(2013).
- He, L., Subramanian, V., Tang, Y. Experimental analysis and model-based optimization of microalgae growth in photo-bioreactors using flue gas. Biomass and Bioenergy. 41, 131-138 (2012).
- Pidwirny, M. Fundamentals of Physical Geography, 2nd ed. , (2006).
- Van Den Hende, S., Vervaeren, H., Boon, N. Flue gas compounds and microalgae: (Bio-) chemical interactions leading to biotechnological opportunities. Biotechnology Advances. 30 (2012), 1405-1424 (2012).
- Jia, F., Kacira, M., Ogden, K. Multi-wavelength based optical density sensor for autonomous monitoring of microalgae. Sensors (Switzerland). 15 (9), 22234-22248 (2015).
- Unkefer, C., et al. Review of the algal biology program within the National Alliance for Advanced Biofuels and Bioproducts. Algal Research. 22, 187-215 (2017).
- Neofotis, P., et al. Characterization and classification of highly productive microalgae strains discovered for biofuel and bioproduct generation. Algal Research. 15, 164-178 (2016).
- Huesemann, M., Van Wagenen, J., Miller, T., Chavis, A., Hobbs, S., Crowe, B. A screening model to predict microalgae biomass growth in photobioreactors and raceway ponds. Biotechnology Bioengineering. 110 (6), 1583-1594 (2013).
- Huesemann, M., et al. Estimating the Maximum Achievable Productivity in Outdoor Ponds: Microalgae Biomass Growth Modeling and Climate Simulated Culturing. Microalgal Production for Biomass and High-Value Products. 28 (2016), 113-137 (2016).
- Ramezan, M., Skone, T., Nsakala, N., Lilijedahl, G. Carbon Dioxide Capture from Existing Coal-Fired Power Plants. , 268(2007).
- Huesemann, M., et al. A validated model to predict microalgae growth in outdoor pond cultures subjected to fluctuating light intensities and water temperatures. Algal Research. 13, 195-206 (2016).
- Mendoza, J., et al. Fluid-dynamic characterization of real-scale raceway reactors for microalgae production. Biomass and Bioenergy. 54, 267-275 (2013).
- Algae Cultivation for Carbon Capture and Utilization Workshop. Algae Cultivation for Carbon Capture and Utilization Workshop. , (2017).
- Park, J., Craggs, R., Shilton, A. Wastewater treatment high rate algal ponds for biofuel production. Bioresource Technology. 102 (1), 35-42 (2011).
- Mata, T., Martins, A., Caetano, N. Microalgae for biodiesel production and other applications: A review. Renewewable and Sustainable Energy Reviews. 14 (1), 217-232 (2010).
- Qiu, R., Gao, S., Lopez, P., Ogden, K. Effects of pH on cell growth, lipid production and CO2 addition of microalgae Chlorella sorokiniana. Algal Research. 28, 192-199 (2017).
- Molina Grima, E., Fernández, F., Garcıa Camacho, F., Chisti, Y. Photobioreactors: light regime, mass transfer, and scaleup. Journal of Biotechnology. 70 (1-3), 231-247 (1999).
- Padmanabhan, Y. P. Technical insight on the requirements for CO2-saturated growth of microalgae in photobioreactors. 3 Biotech. 7 (2), 1-7 (2017).
- Vonshak, A., Torzillo, G. Environmental Stress Physiology. Handbook of Microalgal Culture. 4 (2007), Chapter 4 57-82 (2007).
- Morales, M., Sánchez, L., Revah, S. The impact of environmental factors on carbon dioxide fixation by microalgae. Federation of European Microbiological Society Microbiology Letters. 365 (3), 1-11 (2018).
- Cuaresma, M., Janssen, M., Vílchez, C., Wijffels, R. Horizontal or vertical photobioreactors? How to improve microalgae photosynthetic efficiency. Bioresource Technology. 102 (8), 5129-5137 (2011).
- Richmond, A., Zou, N. Efficient utilisation of high photon irradiance for mass production of photoautotrophic micro-organisms. Journal of Applied Phycology. 11 (1), 123-127 (1999).
- Kurpan, D., Silva, A., Araújo, O., Chaloub, R. Impact of temperature and light intensity on triacylglycerol accumulation in marine microalgae. Biomass and Bioenergy. 72, 280-287 (2015).
- Maedal, K., Owadai, M., Kimura, N., Karubd, I. CO2 fixation from the flue gas on coal-fired thermal power plant by microalgae To screen microalgac which arc suitable for direct CO2 fixation , microalgae were sampled from. Energy Conversion Managment. 36 (6-9), 717-720 (1995).
- Sakai, N., Sakamoto, Y., Kishimoto, N., Chihara, M., Karube, I. Strain from Hot Springs Tolerant to High Temperature and high CO2. Energy Conversion Managment. 36 (6-9), 693-696 (1995).
- Lam, M., Lee, K., Mohamed, A. Current status and challenges on microalgae-based carbon capture. International Journal of Greenhouse Gas Control. 10, 456-469 (2012).
- Raeesossadati, M., Ahmadzadeh, H., McHenry, M., Moheimani, N. CO2 Bioremediation by Microalgae in Photobioreactors: Impacts of Biomass and CO2 Concentrations, Light, and Temperature. Algal Research. 6, 78-85 (2014).
- Mendoza, J., et al. Oxygen transfer and evolution in microalgal culture in open raceways. Bioresource Technology. 137, 188-195 (2013).
- Carvalho, A., Malcata, F., Meireles, A. Microalgal Reactors A Review of Enclosed System Designs and Performances. Biotechnology Progress. 22 (6), 1490-1506 (2006).
- Pires, J., Alvim-Ferraz, M., Martins, F., Simões, M. Carbon dioxide capture from flue gases using microalgae: Engineering aspects and biorefinery concept. Renewable and Sustainable Energy Reviews. 16 (5), 3043-3053 (2012).
- Lam, M., Lee, K. Microalgae biofuels: A critical review of issues, problems and the way forward. Biotechnology Advances. 30 (3), 673-690 (2012).
- Chisti, Y. Biodiesel from microalgae beats bioethanol. Trends in Biotechnology. 26 (3), 126-131 (2008).
- K̈oppen, W., Volken, E., Brönnimann, S. The Thermal Zones of the Earth According to the duration of Hot, Moderate and Cold Periods and to the Impact of Heat on the Organic. Meteorologische Zeitschrift. 20 (3), 351-360 (2011).
- Lammers, P., et al. Review of the Cultivation Program within the National Alliance for Advanced Biofuels and Bioproducts. Algal Research. 22, 166-186 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados