Method Article
Accoppiamento della cattura del carbonio da una centrale elettrica con stagni semi-automatizzati Open Raceway per la coltivazione di microalghe
In questo articolo
Riepilogo
Viene descritto un protocollo per utilizzare l'anidride carbonica nei gas di combustione delle centrali elettriche a gas naturale per coltivare microalghe in stagni di pista aperti. L'iniezione di gas di combustione è controllata con un sensore di pH e la crescita delle microalghe viene monitorata con misurazioni in tempo reale della densità ottica.
Abstract
Negli Stati Uniti, il 35% delle emissioni totali di anidride carbonica (CO2) proviene dall'industria elettrica, di cui il 30% rappresenta la produzione di elettricità a gas naturale. Le microalghe possono biofissare coda 10 a 15 volte più velocemente delle piante e convertire la biomassa algale in prodotti di interesse, come i biocarburanti. Pertanto, questo studio presenta un protocollo che dimostra le potenziali sinergie della coltivazione di microalghe con una centrale elettrica a gas naturale situata nel sud-ovest degli Stati Uniti in un clima caldo semi-arido. Tecnologie all'avanguardia sono utilizzate per migliorare la cattura e l'utilizzo del carbonio attraverso la specie algale verde Chlorella sorokiniana, che può essere ulteriormente trasformata in biocarburante. Descriviamo un protocollo che coinvolge un laghetto semi-automatizzato a circuito aperto e discutiamo i risultati delle sue prestazioni quando è stato testato presso la centrale elettrica di Tucson, a Tucson, in Arizona. Il gas di combustione è stato utilizzato come principale fonte di carbonio per controllare il pH e la clorella sorokiniana è stata coltivata . Un mezzo ottimizzato è stato utilizzato per far crescere le alghe. La quantità di CO2 aggiunta al sistema in funzione del tempo è stata attentamente monitorata. Inoltre, sono stati monitorati altri fattori fisico-chimici che influenzano il tasso di crescita delle alghe, la produttività della biomassa e la fissazione del carbonio, tra cui la densità ottica, l'ossigeno disciolto (DO), l'elettroconduttività (EC) e le temperature dell'aria e dello stagno. I risultati indicano che è possibile ottenere una resa di microalghe fino a 0,385 g/L di peso secco senza ceneri, con un contenuto lipidico del 24%. Sfruttare le opportunità sinergiche tra gli emettitori di CO2 e gli agricoltori di alghe può fornire le risorse necessarie per aumentare la cattura del carbonio, sostenendo al contempo la produzione sostenibile di biocarburanti e bioprodotti algali.
Introduzione
Il riscaldamento globale è una delle questioni ambientali più importanti che il mondo deve affrontare oggi1. Gli studi suggeriscono che la causa principale è l'aumento delle emissioni di gas serra (GHG), principalmente CO2, nell'atmosfera a causa delle attività umane 2,3,4,5,6,7. Negli Stati Uniti, la più grande densità di emissioni di CO2 proviene principalmente dalla combustione di combustibili fossili nel settore energetico, in particolare dagli impianti di generazione di energia elettrica 3,7,8,9. Pertanto, le tecnologie di cattura e utilizzo del carbonio (CCU) sono emerse come una delle principali strategie per ridurre le emissioni di gas serra 2,7,10. Questi includono sistemi biologici che utilizzano la luce solare per convertire CO2 e acqua tramite fotosintesi, in presenza di sostanze nutritive, in biomassa. L'uso di microalghe è stato proposto a causa del rapido tasso di crescita, dell'elevata capacità di fissazione della CO2 e dell'elevata capacità produttiva. Inoltre, le microalghe hanno un ampio potenziale di bioenergia perché la biomassa può essere convertita in prodotti di interesse, come i biocarburanti che possono sostituire i combustibili fossili 7,9,10,11,12.
Le microalghe possono crescere e ottenere la conversione biologica in una varietà di sistemi di coltivazione o reattori, tra cui stagni di pista aperti e fotobioreattori chiusi 13,14,15,16,17,18,19. I ricercatori hanno studiato i vantaggi e i limiti che determinano il successo del bioprocesso in entrambi i sistemi di coltivazione, in condizioni interne o esterne 5,6,16,20,21,22,23,24,25 . Gli stagni aperti sono i sistemi di coltivazione più comuni per la cattura e l'utilizzo del carbonio in situazioni in cui i gas di combustione possono essere distribuiti direttamente dal camino. Questo tipo di sistema di coltivazione è relativamente economico, è facile da scalare, ha bassi costi energetici e ha bassi requisiti energetici per la miscelazione. Inoltre, questi sistemi possono essere facilmente collocati in co-posizione con la centrale elettrica per rendere più efficiente il processo CCU. Tuttavia, ci sono alcuni inconvenienti che devono essere considerati, come la limitazione nel trasferimento di massa di gas / liquido CO2. Sebbene ci siano dei limiti, gli stagni aperti sono stati proposti come il sistema più adatto per la produzione di biocarburanti microalgali all'aperto 5,9,11,16,20.
In questo articolo, descriviamo in dettaglio un metodo per la coltivazione di microalghe in stagni di pista aperti che combina la cattura del carbonio dai gas di scarico di una centrale elettrica a gas naturale. Il metodo consiste in un sistema semi-automatizzato che controlla l'iniezione di fumi in base al pH di coltura; il sistema monitora e registra lo stato della coltura di Chlorella sorokiniana in tempo reale utilizzando la densità ottica, l'ossigeno disciolto (DO), l'elettroconduttività (EC) e i sensori di temperatura dell'aria e dello stagno. I dati sulla biomassa algale e sull'iniezione di gas di combustione vengono raccolti da un data logger ogni 10 minuti presso l'impianto di Tucson Electric Power. La manutenzione del ceppo di alghe, lo scale-up, le misurazioni del controllo di qualità e la caratterizzazione della biomassa (ad esempio, correlazione tra densità ottica, g / L e contenuto lipidico) vengono eseguite in un ambiente di laboratorio presso l'Università dell'Arizona. Un protocollo precedente ha delineato un metodo per ottimizzare le impostazioni dei gas di combustione per promuovere la crescita delle microalghe nei fotobioreattori tramite simulazione al computer26. Il protocollo qui presentato è unico in quanto utilizza stagni di pista aperti ed è progettato per essere implementato in loco in una centrale elettrica a gas naturale al fine di utilizzare direttamente il gas di scarico prodotto. Inoltre, le misurazioni della densità ottica in tempo reale fanno parte del protocollo. Il sistema come descritto è ottimizzato per un clima semiarido caldo (Köppen BSh), che presenta basse precipitazioni, significativa variabilità delle precipitazioni di anno in anno, bassa umidità relativa, alti tassi di evaporazione, cieli limpidi e intensa radiazione solare27.
Protocollo
1. Sistema di crescita: impostazioni del laghetto all'aperto della pista aperta
- Allestire i laghetti aperti vicino alla fonte di gas di scarico (contenenti l'8-10% di CO2). Assicurarsi che l'acqua e l'elettricità siano disponibili nella posizione del reattore dello stagno e che il reattore non sia all'ombra per la maggior parte della giornata (Figura 1).
- Catturare i fumi durante il processo di post-combustione utilizzando un tubo del carburante di 0,95 cm, pochi metri prima che il gas di combustione entri nella pila per essere scaricato nell'atmosfera (Figura 2).
- Rimuovere l'acqua dai gas di scarico utilizzando una trappola per l'acqua da 20 L e un condensatore (lunghezza della bobina ~ 12 m) tra la pila e il compressore (Figura 2).
NOTA: i gas di combustione contengono in genere circa il 9\u201213,8% di acqua28. Inoltre, il condensatore e la tubazione raffreddano i fumi16. - Collegare i seguenti sensori a un datalogger per monitorare la crescita delle alghe: (1) un sensore di densità ottica in tempo reale29, che misura l'assorbanza a due lunghezze d'onda - 650 e 750 nm - e può rilevare una concentrazione massima di cellule algali di 1,05 g / L; (2) un sensore DO; (3) termocoppie ad aria e stagno; (4) un sensore di pH; e (5) un sensore EC.
NOTA: Inoltre, i sensori di pH ed EC sono collegati a un trasmettitore. La configurazione dell'unità data logger è illustrata nella Figura 3. - Assicurarsi che tutti i componenti del sistema di crescita algale siano calibrati e funzionino correttamente prima dell'inoculazione.
2. Sistema di controllo del pH
- Gestire l'iniezione di gas di combustione utilizzando un compressore, un sistema di valvole di controllo e il programma di data logger, come illustrato nelle Figure 2 e Figura 3 (Materiale supplementare A).
- Utilizzare un tubo per dirigere il gas di scarico dalla valvola di controllo al fondo del laghetto della pista attraverso un diffusore in pietra.
- Iniettare i gas di combustione nel sistema di crescita in base al pH. Quando il valore del pH è superiore a 8,05, il sistema inietterà gas di combustione, mentre quando il pH è inferiore a 8,00, il sistema interromperà l'iniezione di gas di combustione nei periodi di assenza di crescita. La portata viene misurata in litri standard al minuto (SLPM).
NOTA: Nella valvola di controllo, la pressione dei fumi in ingresso è limitata a un massimo di 50 psi.
3. Selezione delle alghe e mantenimento della deformazione (luce e temperatura)
NOTA: L'alga verde Chlorella sorokiniana DOE 1412 è stata isolata da Juergen Polle (Brooklyn College)30,31 e selezionata dalla National Alliance for Advanced Biofuels and Bioproducts (NAABB); la sua selezione si è basata sui precedenti studi di caratterizzazione del ceppo eseguiti da Huesemann et al.32,33 . La loro ricerca riguardante lo screening delle alghe, la produttività della biomassa e la coltura simulata dal clima (ad esempio, temperatura e luce) nella regione sud-occidentale quando si utilizzano stagni aperti all'aperto ha informato il metodo utilizzato in questo progetto.
- Mantenere le colture a temperatura ambiente (25 °C) utilizzando un ciclo luce/buio di 12 ore/12 h.
- Mantenere l'intensità luminosa a 200 μM/m2/s per il mantenimento della coltura coltivata su piastre e in piccole colture liquide (da 50 ml a 500 ml).
- Mantenere l'intensità luminosa per lo scale up coltivato in colture liquide da 50 mL a 500 mL a 400 μM / m2 / s e colture liquide da 5 L a 20 L a 600 \ u2012800 μM / m2 / s.
4. Scalabilità verticale e controllo qualità
- Preparare il terreno di coltura BG11 utilizzando acqua deionizzata e i seguenti sali, per i macronutrienti, in g/L: 1,5 NaNO3, 0,04 K2HPO4, 0,075 MgSO4*H2O, 0,036 CaCl2*H2O, 0,006 (NH4)5Fe(C6H4O7)2, 0,006 Na2EDTA*2H2O, 0,02 Na2CO3; aggiungere 1 mL/L di soluzione di oligoelementi, che contiene i seguenti micronutrienti in g/L: 2,86 H3BO3, 1,81 MnCl2*4H2O, 0,22 ZnSO4*7H2O, 0,39 Na2MoO4*2H2O, 0,079 CuSO4*5H2O, 0,0494 Co(NO3)2*6H2O.
NOTA: Per l'inoculazione in piastre e/o la conservazione a lungo termine, aggiungere 7,5 g/L di Bacto agar; per l'inoculazione della coltura, non è necessaria alcuna aggiunta di agar. Sterilizzare il terreno di coltura in autoclave per 21 min a 121 °C. - Versare il mezzo BG11 con agar in piastre di Petri in una cappa a flusso laminare sterile o in un armadio di biosicurezza. Una volta che le piastre sono ferme e fredde, pipettare 500 μL da una coltura di brodo algale congelato ri-sospeso e aggiungere Ampicillina (100 μg / mL); incubare le piastre algali in una tavola shaker (120 rpm) per 1 o 2 settimane.
- Utilizzare un anello sterile per selezionare una singola colonia algale da una piastra di coltura e inocularla in un tubo da 50 ml contenente terreno di crescita sterile in un armadio di biosicurezza pulito. Coltivare la piccola coltura liquida su un tavolo shaker (120 rpm) per una settimana.
- Trasferire 50 mL di coltura di alghe (fase di crescita lineare, OD750nm ≥ 1) in un pallone da 1 L con mezzo liquido da 500 mL. Montare ogni pallone con un tappo di gomma e tubi in acciaio inossidabile per fornire aerazione. Filtrare l'aria utilizzando filtri di sterilizzazione dell'aria da 0,2 μm. Lascia che la cultura cresca per una o due settimane. Monitorare la densità delle celle utilizzando uno spettrofotometro (OD750nm).
- Posizionare la coltura liquida da 500 ml in un carboy da 10 L contenente 8 L di terreno di coltura non sterile e iniettare una miscela di 5% CO2 e 95% aria. Quindi, coltiva le alghe nelle stesse condizioni del passaggio 4.4.
- Monitorare le colture di piastre e liquidi (nella procedura 4.2\u20124.5) una volta alla settimana. Prendi un'aliquota e osservala al microscopio con ingrandimento 10x e 40x per garantire la crescita della deformazione desiderata. Colture conservate fino a quando non sono state compromesse o utilizzate per esperimenti. Scartare le colture contaminate.
5. Preparazione media concentrata per la coltivazione in stagno aperto
- Per preparare la soluzione di oligoelementi riempire parzialmente un matraccio tarato da 1 L con acqua distillata (DW). Inserire una barra di agitazione magnetica e aggiungere le sostanze chimiche mostrate nella Tabella 1 in sequenza. Assicurarsi che ogni ingrediente si dissolva prima dell'aggiunta del costituente successivo. Rimuovere il magnete e riempire il pallone fino al volume di 1 L.
- Riempire parzialmente una bottiglia di vetro da 1 L con DW e inserire la barra magnetica. Posizionare il contenitore sulla parte superiore di una piastra magnetica dell'agitatore e aggiungere le sostanze chimiche per il volume finale del reattore, aggiungendole in sequenza, assicurandosi che ciascuna si dissolva completamente. La tabella 2 elenca le sostanze chimiche per preparare 1 L di mezzo, quindi moltiplicare tutti i valori per il volume finale del reattore. Riempire la bottiglia di vetro a 1 L.
6. Inoculazione del laghetto all'aperto della pista da corsa all'aperto
- Pulire accuratamente il reattore utilizzando il 30% di candeggina prima di ogni inoculazione e dopo la raccolta. Si consiglia di lasciare la candeggina durante la notte. Risciacquare bene il reattore per rimuovere tutta la candeggina.
- Calibrare tutti i sensori prima dell'inoculazione delle alghe in base alla corrispondente procedura di calibrazione.
- Diluire il mezzo concentrato (nel passaggio 5) utilizzando la fonte d'acqua riempiendo il laghetto della pista fino all'80%.
- Inoculare il reattore usando un carboy da 10 L pieno di alghe (fase di crescita lineare OD750nm > 2) e portarlo al suo volume finale.
- Acclimatare le microalghe ombreggiando parzialmente lo stagno della pista con pallet di legno per ~ 3 giorni (Figura 4), una volta passata la fase esponenziale, come strategia di adattamento per evitare la fotoinibizione.
NOTA: Questo periodo fornirà anche il tempo alle microalghe di adattarsi allo stress causato dall'iniezione diretta di gas di combustione.
7. Esperimento di crescita batch presso la stazione di generazione
- Ispeziona e registra eventuali variazioni quotidiane, tra cui l'evaporazione dell'acqua, il motore a pale, la funzionalità del sensore e qualsiasi cosa fuori dall'ordinario.
- Scaricare e ispezionare il compressore e la trappola dell'acqua ogni giorno per rimuovere l'acqua in eccesso per ridurre al minimo la corrosione poiché i gas di scarico sono altamente corrosivi34.
- Configurare il data logger per eseguire la scansione di ogni misura del sensore ogni 10 s e per memorizzare i dati medi ogni 10 minuti. Questi includono DO, pH, EC, densità ottica in tempo reale e temperatura dell'aria e del reattore.
8. Campionamento e monitoraggio discreti
- Assicurarsi che il livello dell'acqua rimanga costante al volume finale del reattore, altrimenti la misurazione della densità ottica ne risentirà.
- Dopo aver reintegrato l'acqua nel reattore, prelevare un campione di 5 ml per le misurazioni della massa cellulare mediante densità ottica (540, 680 e 750 nm) utilizzando uno spettrofotometro ultravioletto-visibile. Ripeti il processo ogni giorno.
- Prendi un campione di 500 ml tre volte alla settimana per le osservazioni al microscopio e la concentrazione di biomassa basata sul peso secco senza ceneri (AFDW).
- Esegui osservazioni al microscopio con lenti obiettivo 10x e 40x. Inoltre, questi ingrandimenti al microscopio sono utilizzati come parte del controllo di qualità delle alghe descritto nel passaggio 4.6.
- Utilizzare 400 ml del campione nel passaggio 8.3 per AFDW
- Impostare ogni filtro in microfibra di vetro di dimensioni dei pori da 0,7 μm in un vassoio di alluminio e pretrattare ogni vassoio/filtro in alluminio utilizzando un forno per 4 ore a 540 °C.
- Etichetta ogni vassoio di alluminio usando una matita #2, registra il suo peso (A) e posizionalo nell'apparato del filtro a vuoto.
- Mescolare vigorosamente il campione di alghe prima di misurare un volume da filtrare. Filtrare abbastanza campione di alghe per dare una differenza di peso pre / post cenere tra 8 e 16 mg. Scegli una differenza di peso da utilizzare nel corso dell'esperimento e mantieni costante questo valore.
- Posizionare ogni filtro contenente il campione di alghe nel suo vassoio di alluminio nel forno a 105 °C per almeno 12 ore.
- Rimuovere il vassoio/filtro di alluminio dal forno di essiccazione e metterlo in un essiccatore di vetro per evitare l'assorbimento di acqua. Registrare ogni peso del vassoio/filtro (B).
- Posizionare il vassoio/filtro in lamina nel forno a muffola a 540 °C per 4 ore.
- Spegnere il forno a muffola, raffreddare i vassoi/filtri di alluminio, posizionarli nell'essiccatore e registrare ogni peso del vassoio/filtro (C).
- Calcola AFDW utilizzando l'analisi gravimetrica:
% AFDW= C – A x 100 / B
- Tenere 2 L di alghe prima della raccolta per l'estrazione lipidica a microonde (MAE) con solventi.
- Centrifugare il campione di alghe ad una forza centrifuga relativa (RFC) di 4.400 x g per 15 min. Prelevare il pellet di alghe e asciugarlo con un forno a 80 °C per almeno 24 ore.
- Macinare il campione di alghe e pesare la polvere algale (la biomassa raccomandata varia da 0,3 g a 0,5 g).
- Aggiungere la polvere di alghe (biomassa algale secca) nei recipienti Xpress del sistema di reazione accelerata a microonde (MARS), aggiungere 10 ml di cloroformio: metanolo (2: 1, v / v) soluzione solvente sotto il cofano, chiudere i vasi e lasciare riposare durante la notte.
- Posizionare i recipienti nella macchina MARS utilizzando il sensore di solvente per 60 minuti a 70 °C e 800 W di potenza.
- Togliere le navi dal MARS e lasciarle raffreddare sotto il cofano.
- Utilizzare un imbuto e lana di vetro per separare la parte liquida che contiene cloroformio, metanolo e lipidi trasferendo ogni campione liquido in una provetta di vetro pre-pesata e mantenere i solidi (biomassa priva di lipidi) per altre analisi.
- Portare le provette contenenti i lipidi all'evaporatore di azoto, rimuoverle una volta che il liquido è stato evaporato e quindi lasciare i tubi durante la notte sotto il cofano per garantire la completa secchezza.
- Calcolare il contenuto lipidico (wt. %) utilizzando l'analisi gravimetrica:
Contenuto lipidico (wt. %) = Biomassa secca dei lipidi x 100/ Massa algale secca
9. Raccolta delle alghe e rotazione delle colture
- Raccogli il 75% del volume totale di coltura delle alghe quando la coltura è vicina a raggiungere la fase stazionaria. Prendi 2\u20125 L di coltura per eseguire analisi di produttività della biomassa in laboratorio. Elaborare e convertire il resto delle alghe nei prodotti algali desiderati.
- Ricresci il laghetto aperto utilizzando il 25% di alghe rimanenti come inoculo. Aggiungere acqua fino all'80% del volume totale del reattore, aggiungere il mezzo concentrato e quindi completare il riempimento fino al volume finale del reattore, se necessario.
- Coltivare il ceppo di alghe appropriato in base alla stagione, in base alle condizioni di temperatura e intensità luminosa.
10. Gestione dei dati
- Registrare i dati nel data logger e raccoglierli per l'analisi come nel passaggio 7.3.
- Prendi in considerazione la possibilità di salvare i dati grezzi e analizzati nell'unità di condivisione Raft (Regional Algal Feedstock Testbed). I collaboratori del progetto RAFT contribuiscono con i loro dati per simulare e modellare la produttività delle alghe e convalidare la coltivazione all'aperto.
Risultati
Precedenti risultati sperimentali del nostro laboratorio indicano che la coltivazione di microalghe utilizzando un laghetto semi-automatizzato a pista aperta può essere accoppiata con processi di cattura del carbonio. Per comprendere meglio la sinergia tra questi due processi (Figura 2), abbiamo sviluppato un protocollo e lo abbiamo adattato per coltivare la specie algale verde Chlorella sorokiniana in condizioni esterne in un clima semiarido caldo. I gas di combustione a gas naturale sono stati ottenuti da una centrale di generazione di energia industriale. Questo protocollo utilizza varie tecnologie per valutare la produttività della biomassa algale: (1) crescita delle alghe utilizzando un sensore di densità ottica in tempo reale (Figura 5); (2) crescita di alghe rispetto alle iniezioni di impulsi on-off dei gas di combustione nella coltura in funzione del pH (figura 6 e figura 7); e (3) correlazioni di crescita delle alghe con parametri ambientali come temperatura, ossigeno disciolto ed elettroconduttività (Figura 8 e Figura 9).
Testiamo un sensore di densità ottica in tempo reale che monitora la crescita delle alghe e le dinamiche fisiologiche. Questo sensore ci ha permesso di stabilire, tramite correlazione di laboratorio, la corrispondente biomassa a peso secco senza ceneri (g/L). La Figura 5 mostra un confronto tra il sensore e le misurazioni di laboratorio. Entrambe le letture mostrano tendenze simili, aumentando in funzione del tempo. Tuttavia, le letture del sensore in situ possono tracciare il ciclo di crescita delle alghe giorno/notte. Detto ciclo mostra che i valori di densità ottica aumentano durante il giorno ma diminuiscono di notte durante la respirazione, indicando un cambiamento nella produttività della biomassa. L'integrazione del sensore di densità ottica in tempo reale consente di prendere decisioni di gestione efficaci sul sistema di produzione algale complessivo.
Implementiamo un sistema di iniezione semi-automatizzato on-off di gas di combustione, che è rappresentato nella Figura 6 da un ciclo di iniezione di gas di combustione di 24 ore misurato durante una stagione autunnale particolarmente calda a Tucson, in Arizona. Come mostrato nella Figura 6, il gas di combustione è stato iniettato dalle 8 alle 18 circa (periodo diurno) ma non è stato iniettato tra le 18:00 e le 8:00 (periodo notturno). Questo ciclo giorno/notte riflette l'esposizione giornaliera alla luce solare e la mancanza di luce durante la notte e, di conseguenza, l'attivazione della fotosintesi o della fotorespirazione, rispettivamente. La figura 7 presenta il gas di combustione cumulativo iniettato (L) durante questo lotto algale. In questo caso, 6.564 L di gas di combustione, corrispondenti a 538 L CO2, sono stati utilizzati per coltivare 0,29 g di biomassa algale. Il grafico mostra che con l'aumentare del tasso di crescita delle alghe, sono stati necessari più gas di combustione (CO2) (Figura 6). I risultati sperimentali hanno confermato che il sistema di iniezione di impulsi di gas di combustione on-off è efficace nel facilitare la cattura e l'utilizzo del carbonio attraverso la coltivazione di microalghe.
Misuriamo e monitoriamo altri parametri fisico-chimici per stabilire una correlazione tra loro e la crescita e la produttività delle alghe (Figura 8 e Figura 9). I parametri ambientali misurati sono stati l'ossigeno disciolto, l'elettroconduttività (EC) e le temperature dell'aria e dello stagno. Come previsto, tutti i parametri, ad eccezione di EC, hanno mostrato tendenze simili che erano altamente correlate con la radiazione solare. I risultati indicano che queste variabili ambientali hanno avuto l'impatto più significativo sulla crescita delle alghe e sono utilizzate per la modellazione della biomassa algale35. La CE non è cambiata in modo significativo durante il processo batch. Pertanto, non ha fornito alcuna informazione pertinente sulla crescita delle alghe. Per la coltivazione di Chlorella sorokiniana utilizzando acqua non salina, le misurazioni CE possono essere omesse.

Figura 1: Posizione del sito pilota a Tucson Electric Power per l'accoppiamento della cattura del carbonio dalla centrale elettrica e reattori semi-automatizzati a stagno aperto per la coltivazione di microalghe. Le due posizioni sono rappresentate da: 1) Sito di alghe U3 (unità 3) e 2) Sito di alghe U4 (unità 4) credito fotografico: Jose Manuel Cisneros Vazquez. Fare clic qui per visualizzare una versione più grande di questa figura.
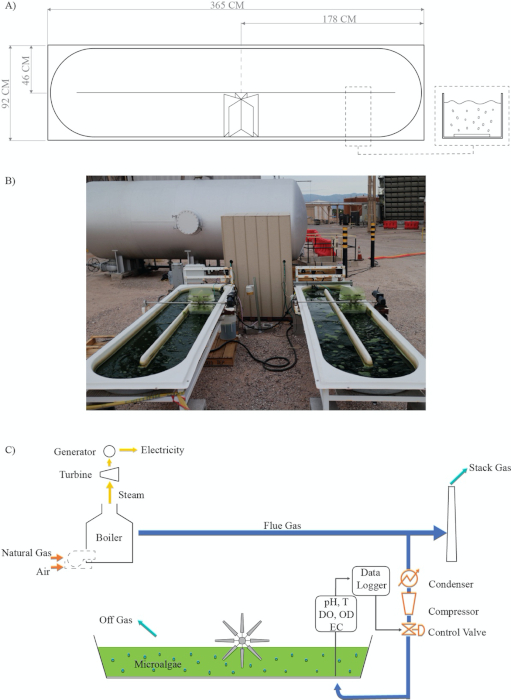
Figura 2: Diagramma di flusso di processo per l'accoppiamento di catture di carbonio e stagni di pista aperti semi-automatizzati per la coltivazione di microalghe in un clima semiarido caldo. (A) Progettazione di ruote a pale open raceway; B) impianto sperimentale reale; (C) Processo: accoppiamento della cattura del carbonio e della coltivazione di microalghe modificate da Van Den Hende28. Leggende: T = Temperatura; DO = Ossigeno disciolto; OD = Densità ottica; EC = Conducibilità elettrica; Data Logger. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Rappresentazione schematica della configurazione del sensore. (A) Rappresentazione dei sensori a stagno aperto complessivi impostati, in cui CV1 e CV2 sono le valvole di controllo, DL è il data logger e T1 e T2 sono i trasmettitori. (B) Rappresentazione di una valvola di controllo. (C) Rappresentazione della connessione dei sensori al data logger; cerchio blu scuro: densità ottica in tempo reale, triangolo arancione: pH ed EC, triangolo nero: termocoppie, triangolo rosso: ossigeno disciolto, azzurro: valvola di controllo. D) trasmettitore di pH e CE. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Alghe sotto il processo di acclimatazione. Strategia di acclimatazione delle microalghe utilizzando pallet di legno durante la fase esponenziale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Rappresentazione del monitoraggio della crescita delle alghe. (A) Grafico per la concentrazione di biomassa AFDW (g/L) rispetto al tempo delle misurazioni di laboratorio; (B) Grafico per la correlazione tra sensore di densità ottica e misure di laboratorio a 650 nm; e (C) grafico per il sensore di densità ottica in tempo reale rispetto al tempo per un lotto sperimentale. Fare clic qui per visualizzare una versione più grande di questa figura.
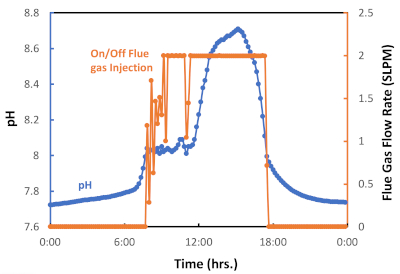
Figura 6: Grafico per l'iniezione di impulsi di gas di combustione on/off come funzione di pH. Il data logger è stato impostato per avviare l'iniezione di gas di combustione (valvola controllata accesa) a pH = 8,05 e per terminare l'iniezione di gas di combustione (valvola controllata spenta) a pH = 8,00. Fare clic qui per visualizzare una versione più grande di questa figura.
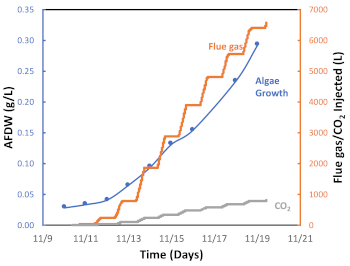
Figura 7: Grafico della crescita algale (g/L), della quantità di gas di combustione iniettati e della quantità di CO2 iniettata in funzione del tempo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Rappresentazione del monitoraggio della temperatura. Leggende: linea gialla solida = temperatura del reattore dello stagno della pista; linea grigia continua = temperatura dell'aria; e linea blu tratteggiata = temperatura della stazione AZMET (The Arizona Meteorological Network). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 9: Monitoraggio dei parametri di crescita delle alghe. Leggende: linea continua arancione = radiazione solare; linea continua grigia = elettroconduttiva (EC); e linea continua gialla = ossigeno disciolto (DO). Fare clic qui per visualizzare una versione più grande di questa figura.
| Componenti | Concentrazione in soluzione (g/L) |
| H3BO3 | 0.00286 |
| MnCl2·4H2O | 0.00181 |
| ZnSO4·7H2O | 0.0001373 |
| Na2MoO4·2H2O | 0.00039 |
| CuSO4·5H2O | 0.000079 |
| Co(NO3)2·6H2O | 0.00005518 |
| NiCl2·6 H2O | 0.0001 |
Tabella 1: Ricetta della soluzione di oligoelementi.
| Componenti | Nome comune | Concentrazione in soluzione (g/L) |
| (NH2) numero arabo CO | Urea | 0.1 |
| MgSO4·7H2O | Solfato di magnesio | 0.012 |
| NH4H2PO4 | Fosfato ammonico | 0.035 |
| Kcl | Potassa | 0.175 |
| FeCl3 · | Citrato ferrico (Citraplex) | 0.005423 |
| Soluzione Trace Metal | Volume di 1000x Micros (ml) | 1 |
Tabella 2: Ricetta multimediale ottimizzata per 1 L.
File di codifica supplementari. Fare clic qui per scaricare questo file.
Discussione
In questo studio, dimostriamo che l'accoppiamento sinergico della cattura del carbonio dei gas di combustione e la coltivazione di microalghe è possibile in un clima caldo semi-arido. Il protocollo sperimentale per il sistema di laghetto semi-automatizzato della pista integra una tecnologia all'avanguardia per monitorare in tempo reale i parametri rilevanti che si correlano alla crescita delle alghe quando si utilizzano i gas di combustione come fonte di carbonio. Il protocollo proposto ha lo scopo di ridurre l'incertezza nella coltivazione delle alghe, che è uno dei principali svantaggi degli stagni di pista 20,21,36. Nella nostra esperienza, i passaggi più critici del protocollo coinvolgono il sistema di controllo del pH e un metodo efficace per inoculare il sistema (Figura 2). Il sistema di controllo del pH eroga gas di combustione/CO2 e rappresenta una strategia per ottimizzare l'efficienza nella cattura e nell'utilizzo della CO2 (Figura 3)37. Questo sistema controllato ha dimostrato di essere più efficiente di un sistema di iniezione continua per il processo di coltivazione delle microalghe perché riduce il degassamento fornendo gas di combustione sufficienti per raggiungere il tasso massimo di crescita delle alghe20,37. Quando l'iniezione di gas di combustione si basa sul pH, un fattore chiave per la coltivazione delle alghe è la selezione di un valore di pH adeguato per le specie di microalghe prima di inoculare lo stagno della pista38,39. Qiu et al.40 hanno scoperto che un valore di pH di 8 è il migliore per la specie d'acqua dolce Chlorella sorokiniania quando si considera la crescita cellulare e la produzione di lipidi40. Inoltre, Molina Grima et al.41 raccomandano un pH inferiore a 8 per ridurre la perdita di azoto e ottenere un migliore assorbimento di azoto da parte delle microalghe / biomassa41. Tuttavia, Yuvraj et al.42 suggeriscono che il pH non è un metodo appropriato per valutare il contenuto di CO2 nell'acqua a causa dell'effetto della fertilizzazione azotata sull'acidità del mezzo42. I nostri risultati mostrano che il pH può essere efficacemente utilizzato per gestire l'iniezione di CO2 per il sistema qui presentato (Figura 6); la nostra gestione dell'iniezione di gas di combustione, che ha mantenuto la coltura a pH 8, ha portato a rese e replicabilità elevate di biomassa (Figura 7).
Dopo l'inoculazione, le alghe devono acclimatarsi al sistema per evitare la fotoinibizione e per adattarsi all'alta temperatura del mezzo della pista. In questo clima caldo semi-arido, abbiamo osservato la fotoinibizione algale a causa dell'elevata radiazione solare 39,43,44 (Figura 9). Questo effetto può non solo ritardare ma anche inibire l'inoculazione delle microalghe durante la fase esponenziale 32,35,45,46,47. Per ridurre l'impatto dell'acclimatazione sulle microalghe, abbiamo progettato una strategia di successo e fattibile che consiste nell'ombreggiare parzialmente il laghetto della pista con pallet di legno. Questa strategia consente alle microalghe di essere esposte ripetutamente ma per brevi periodi di tempo alle condizioni solari. Un altro fattore di stress è l'alta temperatura dei gas di combustione e dell'aria ambiente33,48 (Figura 8). La temperatura dei fumi è piuttosto elevata nella fase di post-combustione 10,48,49. L'utilizzo del gas di combustione iniettandolo direttamente dalla tubazione inviata nel laghetto della pista può contribuire ad aumentare ulteriormente la temperatura del mezzo. Quindi, un condensatore seguito da una trappola d'acqua situata prima del compressore non solo ridurrà il trasferimento di calore, ma anche la quantità di acqua che raggiunge il compressore (Figura 2). Abbiamo scoperto che entrambi i dispositivi erano necessari per ridurre il tasso di guasto del compressore. Inoltre, l'umidità, la temperatura dei gas di combustione e la natura corrosiva dei gas di combustione devono essere considerati quando si stima il ciclo di vita e la manutenzione del compressore. Inoltre, le alte temperature causano tassi di evaporazione più elevati.
Questo protocollo è soggetto ad alcune limitazioni. Secondo la Figura 6, la valvola di controllo non era in grado di iniettare abbastanza gas di combustione quando la fotosintesi era al suo apice. Questo effetto può essere attribuito al basso trasferimento di massa dalla fase gassosa a quella liquida a causa del progetto del reattore 5,16,50,51. Mendoza et al.36,52 e de Godos et al.16 hanno affermato che gli stagni delle piste hanno uno scarso trasferimento di massa gas/liquido, che rappresenta uno dei vincoli di progettazione più severi 16,36,52. Il loro design del canale poco profondo limita il trasferimento di massa di CO2 a causa della breve area di interfaccia tra il gas e il terreno di coltura, che causa un aumento della degassazione di CO2 (Figura 2). Pertanto, sono stati proposti dispositivi e nuove configurazioni per aumentare il tempo di contatto gas/liquido, inclusi pozzetti, colonne di miscelazione, silicone permeabile e sistemi di sparging-diffusione 36,52,53. Tutti questi sistemi sono stati utilizzati nel tentativo di migliorare il trasferimento di massa di CO2; tuttavia, alcuni di questi sistemi migliorano anche la distribuzione dei nutrienti, controllano il pH e rimuovono l'eccesso di O2 5,24,36,52. Infine, le interruzioni sono altre limitazioni che possono sorgere quando si catturano e si utilizzano gas di combustione reali da una centrale elettrica. Queste interruzioni non sono sempre programmate. Pertanto, dovrebbero essere prese in considerazione fonti alternative temporanee di CO2, ad esempio il trasferimento o il collegamento della linea principaleco-2 a più unità di potenza (figura 1).
La capacità di produrre microalghe con questo protocollo è supportata dai nostri risultati sulla produttività delle alghe (Figura 5), sulle risposte algali ai parametri selezionati (Figura 6, Figura 8, Figura 9) e sulla coltivazione di successo delle specie algali desiderate quando alimentate dall'iniezione diretta di gas di combustione. I reattori aperti sono più economici da utilizzare e, quindi, questo protocollo si basa sui loro punti di forza per accelerare la diffusione su scala commerciale di questa forma di cattura e utilizzo del carbonio 16,20,54,55,56. Questa regione semi-arida calda sperimenta un'elevata radiazione solare e significative fluttuazioni di temperatura tutto l'anno (Figura 8 e Figura 9)57; quindi, è una posizione privilegiata per testare questo tipo di protocollo. Il sensore di densità ottica ha fornito letture OD coerenti per il nostro sistema aperto all'aperto (Figura 5); questo tipo di raccolta dati sarebbe poco pratico utilizzando altri sensori. Inoltre, i sensori hanno risposto bene alle significative variazioni di temperatura dal giorno alla notte (Figura 8), consentendoci di prendere decisioni tempestive sulla produttività delle alghe29. Inoltre, il mezzo ottimizzato proposto ha il vantaggio critico di essere basato su fertilizzanti commerciali e fonti di nutrienti prontamente disponibili58 (Tabella 1 e 2); questo mezzo può essere facilmente prodotto internamente o può essere acquistato su richiesta da aziende di fertilizzanti liquidi agricoli58. Infine, il protocollo semi-automatizzato è stato testato in un'ulteriore centrale elettrica a gas naturale. I risultati di tale studio di conferma non sono presentati in questo documento. In quello studio di conferma, il protocollo ha avuto successo nonostante le condizioni meteorologiche estreme a Tucson e le temperature eccezionalmente calde nella stazione di generazione a causa della posizione del reattore all'interno del layout della centrale elettrica. Pertanto, la replicabilità del protocollo è stata esaminata per l'ambiente di Tucson quando il gas naturale viene utilizzato come combustibile per produrre elettricità.
Si raccomandano i seguenti passaggi per sviluppare ulteriormente questo protocollo e per migliorare e potenziare l'automazione dei processi coinvolti. La prima raccomandazione è quella di rendere l'iniezione di fumi un processo a velocità completamente variabile, migliorando così la gestione della CO2 e del pH; il programma corrente apre completamente la valvola di iniezione quando il pH sale sopra 8 e la chiude quando il pH raggiunge nuovamente 8. È inoltre necessario migliorare il modo in cui viene iniettata la CO2 . L'obiettivo è quello di ridurre le dimensioni delle bolle di CO2 , cioè di generare microbolle per migliorare la diffusione di CO2 nel mezzo senza ricorrere all'iniezione di gas di combustione a pressione più elevata. L'utilizzo di iniettori migliorati, riducendo così i costi energetici operativi, è ritenuto necessario in un'applicazione commerciale del protocollo. Si raccomanda inoltre l'inclusione di strumenti predittivi basati sulle previsioni meteorologiche e sullo stato attuale delle microalghe per il controllo dei fumi e dei fertilizzanti, principalmente N, per migliorare l'efficienza di utilizzo di N. L'uso della modellazione fluidodinamica computazionale è considerato uno strumento vitale per sviluppare ulteriormente il protocollo proposto; la modellazione può aiutare a ottimizzare la progettazione, la configurazione e il funzionamento di tutto l'hardware coinvolto nel monitoraggio e nella gestione delle microalghe. Un'altra area che potrebbe essere esplorata in futuro è l'applicazione del DNA ambientale (eDNA) e delle tecniche di PCR in tempo reale per monitorare la salute e la composizione della coltura di microalghe. I campioni d'acqua potrebbero essere analizzati e i risultati indicherebbero se le microalghe oggettive sono la specie predominante nel mezzo o se è in competizione o è stata sostituita da un organismo diverso.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato attraverso il progetto Regional Algal Feedstock Testbed, U.S. Department of Energy DE-EE0006269. Ringraziamo anche Esteban Jimenez, Jessica Peebles, Francisco Acedo, Jose Cisneros, RAFT Team, Mark Mansfield, lo staff della centrale elettrica UA e lo staff della centrale elettrica TEP per tutto il loro aiuto.
Materiali
| Name | Company | Catalog Number | Comments |
| Adjustable speed motor (paddle wheel system) | Leeson | 174307 | Lesson 174307.00, type: SCR Voltage; Amps:10 |
| Aluminum weight boats | Fisher Scientific | 08-732-102 | Fisherbrand Aluminum Weighing Dishes |
| Ammonium Iron (III) (NH?)?[Fe(C?H?O?)?] | Fisher Scientific | 1185 - 57 - 5 | Medium preparation. Ammonium iron(III) citrate |
| Ammonium Phosphate | Sigma-Aldrich | 7722-76-1 | This chemical is used for the optimized medium |
| Ampicillin sodium salt | Sigma Aldrich | A9518-5G | This chemical is used for avoiding algae contamination |
| Autoclave | Amerex Instrument Inc | Hirayama HA300MII | |
| Bacto agar | Fisher Scientific | BP1423500 | Fisher BioReagents Granulated Agar |
| Bleach | Clorox | Germicidal Bleach, concentrated clorox | |
| Boric Acid (H3BO3) | Fisher Scientific | 10043-35-3 | Trace Elelements: Boric acid |
| Calcium chloride dihydrate (CaCl2*2H2O) | Sigma-Aldrich | 10035-04-8 | Medium preparation. Calcium chloride dihydrate |
| Carboys (20 L) | Nalgene - Thermo Fisher Scientific | 2250-0050PK | Polypropylene Carboy w/Handles |
| Centrifuge | Beckman Coulter, Inc | J2-21 | |
| Chloroform | Sigma-Aldrich | 67-66-3 | This chemical is used for lipid extraction |
| Citraplex 20% Iron | Loveland Products | SDS No. 1000595582 -17-LPI | https://www.fbn.com/direct/product/Citraplex-20-Iron#product_info |
| Cobalt (II) nitrate hexahydrate (Co(NO3)2*6H2O) | Sigma-Aldrich | 10026-22-9 | Trace Elements: Cobalt (II) nitrate hexahydrate |
| Compressor | Makita | MAC700 | This equipment is used for the injection CO2 system |
| Control Valve | Sierra Instruments | SmartTrak 100 | This item needs to be customized for your application. In our case, it was used a 5% CO2 and 95% air mixture. |
| Copper (II) Sulfate Pentahydrate (CuSO4*5H2O) | Sigma-Aldrich | 7758-99-8 | Trace Elements: Copper (II) Sulfate Pentahydrate |
| Data Logger: Campbell unit CR3000 | Scientific Campbell | CR3000 | This equipment is used for controlling all the system, motoring and recording data |
| Dissolvde Oxygen Solution | Campbell Scientific | 14055 | Dissolved oxygen electrolyte solution DO6002 - Lot No. 211085 |
| Dissolved Oxygen probe | Sensorex | ? | DO6400/T Dissolved Oxygen Sensor with Digital Communication |
| Electroconductivity calibration solution | Ricca Chemical Company | 2245 - 32 ( R2245000-1A ) | Conductivity Standard, 5000 uS/cm at 25C (2620 ppm TDS as NaCl) |
| Electroconductivity probe sensor | Hanna Instruments | HI3003/D | Flow-thru Conductivity Probe - NTC Sensor, DIN Connector, 3m Cable |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (Na2EDTA*2H2O) | Sigma-Aldrich | 6381-92-6 | Medium Preparation: Ethylenediaminetetraacetic acid disodium salt dihydrate |
| Filters | Fisher Scientific | 09-874-48 | Whatman Binder-Free Glass Microfiber Filters |
| Flasks | Fisher scientific | 09-552-40 | Pyrex Fernbach Flasks |
| Furnace | Hogentogler | Model: F6020C-80 | Thermo Sicentific Thermolyne F6020C - 80 Muffle Furnace |
| Glass dessicator | VWR International LLC | 75871-430 | Type 150, 140 mm of diameter |
| Glass funnel | Fisher Scientific | FB6005865 | Fisherbrand Reusable Glass Long-Stem Funnels |
| Laminar flow hood | Fisher Hamilton Safeair | Fisher Hamilton Stainless Safeair hume hood | |
| Magnesium sulfate heptahydrate (MgSO4*7H2O) | Fisher Scientific | 10034 - 99 - 8 | Medium Preparation: Magnesium sulfate heptahydrate |
| Methanol | Sigma-Aldrich | 67-56-1 | Lipid extraction solvent |
| Micro bubble Diffuser | Pentair Aquatic Eco-Systems | 1PMBD075 | This equipment is used for the injection CO2 system |
| Microalgae: Chlorella Sorokiniana | NAABB | DOE 1412 | |
| Microoscope | Carl Zeiss 4291097 | ||
| Microwave assistant extraction | MARS, CEM Corportation | CEM Mars 5 Xtraction 230/60 Microwave Accelerated Reaction System. Model: 907601 | |
| MnCl2*4H2O | Sigma-Aldrich | 13446-34-9 | Manganese(II) chloride tetrahydrate |
| Mortars | Fisher Scientific | FB961B | Fisherbrand porcelein mortars |
| Nitrogen evaporator | Organomation | N-EVAP 112 Nitrogen Evaporatpr (OA-SYS Heating System) | |
| Oven | VWR International LLC | 89511-410 | Forced Air Oven |
| Paddle Wheel | 8-blade horizontal axis propeller. This usually comes as part of the paddlewheel reactor. | ||
| Paddle wheel motor | Leeson | M1135042.00 | Leeson, Model: CM34025Nz10C; 1/4 HP; Volts 90; FR 34; 62 RPM. |
| Pestles | Fisher Scientific | FB961M | Fisherbrand porcelein pestles |
| pH and EC Transmitter | Hanna Instruments | HI98143 | Hanna Instruments HI98143-04 pH and EC Transmitter with Galvanic isolated 0-4V. |
| pH calibration solutions | Fisher Scientific | 13-643-003 | Thermo Scientific Orion pH Buffer Bottles |
| pH probe sensor | Hanna Instruments | HI1006-2005 | Hanna Instruments HI1006-2005 Teflon pH Electrode with matching pin 5m. |
| Pippete tips | Fisher Scientific | 1111-2821 | 1000 ul TipOne graduated blue tip in racks |
| Pippetter | Fisher Scientific | 13-690-032 | Eppendorf Reserch plus Variable Adjustable Volume Pipettes: Single-channel |
| Plastic cuvettes | Fisher scientific | 14377017 | BrandTech BRAND Plastic Cuvettes |
| Plates | Fisher scientific | 08-757-100D | Corning Falcon Bacteriological Petri Dishes with Lid |
| Potash | This chemical is used for the optimazed medium preparation. It was bought in a fertilizer local company | ||
| Potassium phosphate dibasic (K2HPO4) | Sigma-Aldrich | 7758 -11 - 4 | Medium Preparation: Potassium phosphate dibasic |
| Pyrex reusable Media Storage Bottles | Fisher scientific | 06-414-2A | 1 L and 2 L bottels - PYREX GL45 Screw Caps with Plug Seals |
| Raceway Pond | Similar equipment can be bought at https://microbioengineering.com/products | ||
| Real Time Optical Density Sensor | University of Arizona | This equipment was design and build by a member of the group | |
| RS232 Cable | Sabrent | Sabrent USB 2.0 to Serial (9-Pin) DB-9 RS-232 Converter Cable, Prolific Chipset, Hexnuts, [Windows 10/8.1/8/7/VISTA/XP, Mac OS X 10.6 and Above] 2.5 Feet (CB-DB9P) | |
| Shaker Table | Algae agitation 150 rpm | ||
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | 497-19-8 | Sodium carbonate |
| Sodium molybdate dihydrate (Na2MoO4*2H2O) | Sigma-Aldrich | 10102-40-6 | Medium Preparation: Sodium molybdate dihydrate |
| Sodium nitrate (NaNO3) | Sigma-Aldrich | 7631-99-4 | Medium Preparation: Sodium nitrate |
| Spectophotometer | Fisher Scientific Company | 14-385-400 | Thermo Fisher Scientific - 10S UV-Vis GENESTYS Spectrophotometer cylindrical Longpath cell holder; internal reference dectector, Xenon flash lamp; dual silicon photodiode; 240V, 50 to 60Hz selected automatically. |
| Test tubes | Fisher Scientific | 14-961-27 | Fisherbrand Disposable Borosilicate Glass Tubes with Plain End (10 ml) |
| Thermocouples type K | Omega | KMQXL-125G-6 | |
| Urea | Sigma-Aldrich | 2067-80-3 | Urea |
| Vacuum filtration system | Fisher Scientific | XX1514700 | MilliporeSigma Glass Vacuum Filter Holder, 47 mm. The system includes: Ground glass flask attachment, coarse-frit glass filter support, and flask |
| Vacuum pump | Grainger | Marathon Electric AC Motor Thermally protected G588DX - MOD 5KH36KNA510X. HP 1/4. RPM 1725/1425 | |
| Zinc sulfate heptahydrate (ZnSO4*7H2O) | Sigma-Aldrich | 7446-20-0 | Zinc sulfate heptahydrate |
Riferimenti
- The Intergovernmental Panel on Climate Change. , Available from: https://www.ipcc.ch/ (2018).
- Songolzadeh, M., Soleimani, M., Ravanchi, M., Songolzadeh, R. Carbon Dioxide Separation from Flue Gases: A Technological, Review Emphasizing Reduction in Greenhouse Gas Emissions. The Scientific World Journal. 2014, 1-34 (2014).
- Litynski, J., Klara, S., McIlvried, H., Srivastava, R. The United States Department of Energy's Regional Carbon Sequestration Partnerships program: A collaborative approach to carbon management. Environ International. 32 (1), 128-144 (2006).
- Cuellar-Bermudez, S., Garcia-Perez, J., Rittmann, B., Parra-Saldivar, R. Photosynthetic Bioenergy Utilizing CO2: an Approach on Flue Gases Utilization for Third Generation Biofuels. Journal of Clean Production. 98, 53-65 (2014).
- Cheah, W., Show, P., Chang, J., Ling, T., Juan, J. Biosequestration of Atmospheric CO2 and Flue Gas-Containing CO2 by Microalgae. Bioresource Technology. 184, 190-201 (2014).
- Kao, C., et al. Utilization of Carbon Dioxide in Industrial Flue Gases for the Cultivation of Microalga Chlorella sp. Bioresource Technology. 166, 485-493 (2014).
- White, C., Strazisar, B., Granite, E., Hoffman, S., Pennline, H. Separation and Capture of CO2 from Large Stationary Sources and Sequestration in Geological Formations. Journal of the Air and Waste Management Association. 53 (10), 1172-1182 (2003).
- Benemann, J. CO2 Mitigation with Microalgae Systems. Pergamon Energy Conversion Management Journal. 38, 475-479 (1997).
- U.S.Department of Energy. The Capture , Utilization and Disposal of Carbon Dioxide from Fossil Fuel-Fired Power Plants. Energy. 2, (1993).
- Granite, E., O'Brien, T. Review of Novel Methods for Carbon Dioxide Separation from Flue and Fuel Gases. Fuel Processesing Technology. 86 (14-15), 1423-1434 (2005).
- Benemann, J. Utilization of Carbon Dioxide from Fossil Fuel-Burning Power Plants with Biological Systems. Energy Conversion and Management. 34 (9-11), 999-1004 (1993).
- Joshi, C., Nookaraju, A. New Avenues of Bioenergy Production from Plants: Green Alternatives to Petroleum. Journal of Petroleum & Environmental Biotechnology. 03 (07), 3(2012).
- Chisti, Y. Constraints to commercialization of algal fuels. Journal of Biotechnology. 22, 166-186 (2013).
- Han, S., Jin, W., Tu, R., Wu, W. Biofuel production from microalgae as feedstock: current status and potential. Critical Reviews in Biotechnology. 35 (2), 255-268 (2015).
- Lam, M., Lee, K. Potential of using organic fertilizer to cultivate Chlorella vulgaris for biodiesel production. Applied Energy. 94, 303-308 (2012).
- de Godos, I., et al. Evaluation of carbon dioxide mass transfer in raceway reactors for microalgae culture using flue gases. Bioresource Technology. 153, 307-314 (2014).
- Posten, C., Schaub, G. Microalgae and terrestrial biomass as source for fuels a process view. Journal of Biotechnology. 142 (1), 64-69 (2009).
- Demirbas, M. Biofuels from algae for sustainable development. Applied Energy. 88 (10), 3473-3480 (2011).
- Shelef, G., Sukenik, A., Green, M. Microalgae Harvesting and Processing A Literature Review. , (1984).
- Pawlowski, A., Mendoza, J., Guzmán, J., Berenguel, J., Acién, F., Dormido, S. Effective utilization of flue gases in raceway reactor with event-based pH control for microalgae culture. Bioresource Technology. 170, 1-9 (2014).
- Zhu, B., Sun, F., Yang, M., Lu, L., Yang, G., Pan, K. Large-scale biodiesel production using flue gas from coal-fired power plants with Nannochloropsis microalgal biomass in open raceway ponds. Bioresource Technology. 174, 53-59 (2014).
- Kaštánek, F., et al. In-field experimental verification of cultivation of microalgae Chlorella sp. using the flue gas from a cogeneration unit as a source of carbon dioxide. Waste Management & Research. 28 (11), 961-966 (2010).
- Yadav, G., Karemore, A., Dash, S., Sen, R. Performance evaluation of a green process for microalgal CO2 sequestration in closed photobioreactor using flue gas generated in-situ. Bioresource Technology. 191, 399-406 (2015).
- Zhao, B., Su, Y., Zhang, Y., Cui, G. Carbon dioxide fixation and biomass production from combustion flue gas using energy microalgae. Energy. 89, 347-357 (2015).
- He, L., Chen, A., Yu, Y., Kucera, L., Tang, Y. Optimize Flue Gas Settings to Promote Microalgae Growth in Photobioreactors via Computer Simulations. Journal of Visualized Experiments. (80), e50718(2013).
- He, L., Subramanian, V., Tang, Y. Experimental analysis and model-based optimization of microalgae growth in photo-bioreactors using flue gas. Biomass and Bioenergy. 41, 131-138 (2012).
- Pidwirny, M. Fundamentals of Physical Geography, 2nd ed. , (2006).
- Van Den Hende, S., Vervaeren, H., Boon, N. Flue gas compounds and microalgae: (Bio-) chemical interactions leading to biotechnological opportunities. Biotechnology Advances. 30 (2012), 1405-1424 (2012).
- Jia, F., Kacira, M., Ogden, K. Multi-wavelength based optical density sensor for autonomous monitoring of microalgae. Sensors (Switzerland). 15 (9), 22234-22248 (2015).
- Unkefer, C., et al. Review of the algal biology program within the National Alliance for Advanced Biofuels and Bioproducts. Algal Research. 22, 187-215 (2017).
- Neofotis, P., et al. Characterization and classification of highly productive microalgae strains discovered for biofuel and bioproduct generation. Algal Research. 15, 164-178 (2016).
- Huesemann, M., Van Wagenen, J., Miller, T., Chavis, A., Hobbs, S., Crowe, B. A screening model to predict microalgae biomass growth in photobioreactors and raceway ponds. Biotechnology Bioengineering. 110 (6), 1583-1594 (2013).
- Huesemann, M., et al. Estimating the Maximum Achievable Productivity in Outdoor Ponds: Microalgae Biomass Growth Modeling and Climate Simulated Culturing. Microalgal Production for Biomass and High-Value Products. 28 (2016), 113-137 (2016).
- Ramezan, M., Skone, T., Nsakala, N., Lilijedahl, G. Carbon Dioxide Capture from Existing Coal-Fired Power Plants. , 268(2007).
- Huesemann, M., et al. A validated model to predict microalgae growth in outdoor pond cultures subjected to fluctuating light intensities and water temperatures. Algal Research. 13, 195-206 (2016).
- Mendoza, J., et al. Fluid-dynamic characterization of real-scale raceway reactors for microalgae production. Biomass and Bioenergy. 54, 267-275 (2013).
- Algae Cultivation for Carbon Capture and Utilization Workshop. Algae Cultivation for Carbon Capture and Utilization Workshop. , (2017).
- Park, J., Craggs, R., Shilton, A. Wastewater treatment high rate algal ponds for biofuel production. Bioresource Technology. 102 (1), 35-42 (2011).
- Mata, T., Martins, A., Caetano, N. Microalgae for biodiesel production and other applications: A review. Renewewable and Sustainable Energy Reviews. 14 (1), 217-232 (2010).
- Qiu, R., Gao, S., Lopez, P., Ogden, K. Effects of pH on cell growth, lipid production and CO2 addition of microalgae Chlorella sorokiniana. Algal Research. 28, 192-199 (2017).
- Molina Grima, E., Fernández, F., Garcıa Camacho, F., Chisti, Y. Photobioreactors: light regime, mass transfer, and scaleup. Journal of Biotechnology. 70 (1-3), 231-247 (1999).
- Padmanabhan, Y. P. Technical insight on the requirements for CO2-saturated growth of microalgae in photobioreactors. 3 Biotech. 7 (2), 1-7 (2017).
- Vonshak, A., Torzillo, G. Environmental Stress Physiology. Handbook of Microalgal Culture. 4 (2007), Chapter 4 57-82 (2007).
- Morales, M., Sánchez, L., Revah, S. The impact of environmental factors on carbon dioxide fixation by microalgae. Federation of European Microbiological Society Microbiology Letters. 365 (3), 1-11 (2018).
- Cuaresma, M., Janssen, M., Vílchez, C., Wijffels, R. Horizontal or vertical photobioreactors? How to improve microalgae photosynthetic efficiency. Bioresource Technology. 102 (8), 5129-5137 (2011).
- Richmond, A., Zou, N. Efficient utilisation of high photon irradiance for mass production of photoautotrophic micro-organisms. Journal of Applied Phycology. 11 (1), 123-127 (1999).
- Kurpan, D., Silva, A., Araújo, O., Chaloub, R. Impact of temperature and light intensity on triacylglycerol accumulation in marine microalgae. Biomass and Bioenergy. 72, 280-287 (2015).
- Maedal, K., Owadai, M., Kimura, N., Karubd, I. CO2 fixation from the flue gas on coal-fired thermal power plant by microalgae To screen microalgac which arc suitable for direct CO2 fixation , microalgae were sampled from. Energy Conversion Managment. 36 (6-9), 717-720 (1995).
- Sakai, N., Sakamoto, Y., Kishimoto, N., Chihara, M., Karube, I. Strain from Hot Springs Tolerant to High Temperature and high CO2. Energy Conversion Managment. 36 (6-9), 693-696 (1995).
- Lam, M., Lee, K., Mohamed, A. Current status and challenges on microalgae-based carbon capture. International Journal of Greenhouse Gas Control. 10, 456-469 (2012).
- Raeesossadati, M., Ahmadzadeh, H., McHenry, M., Moheimani, N. CO2 Bioremediation by Microalgae in Photobioreactors: Impacts of Biomass and CO2 Concentrations, Light, and Temperature. Algal Research. 6, 78-85 (2014).
- Mendoza, J., et al. Oxygen transfer and evolution in microalgal culture in open raceways. Bioresource Technology. 137, 188-195 (2013).
- Carvalho, A., Malcata, F., Meireles, A. Microalgal Reactors A Review of Enclosed System Designs and Performances. Biotechnology Progress. 22 (6), 1490-1506 (2006).
- Pires, J., Alvim-Ferraz, M., Martins, F., Simões, M. Carbon dioxide capture from flue gases using microalgae: Engineering aspects and biorefinery concept. Renewable and Sustainable Energy Reviews. 16 (5), 3043-3053 (2012).
- Lam, M., Lee, K. Microalgae biofuels: A critical review of issues, problems and the way forward. Biotechnology Advances. 30 (3), 673-690 (2012).
- Chisti, Y. Biodiesel from microalgae beats bioethanol. Trends in Biotechnology. 26 (3), 126-131 (2008).
- K̈oppen, W., Volken, E., Brönnimann, S. The Thermal Zones of the Earth According to the duration of Hot, Moderate and Cold Periods and to the Impact of Heat on the Organic. Meteorologische Zeitschrift. 20 (3), 351-360 (2011).
- Lammers, P., et al. Review of the Cultivation Program within the National Alliance for Advanced Biofuels and Bioproducts. Algal Research. 22, 166-186 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon