Method Article
Acoplamiento de la captura de carbono de una planta de energía con estanques de canales abiertos semiautomatizados para el cultivo de microalgas
En este artículo
Resumen
Se describe un protocolo para utilizar el dióxido de carbono en el gas de combustión de la planta de energía de gas natural para cultivar microalgas en estanques abiertos de canales. La inyección de gases de combustión se controla con un sensor de pH, y el crecimiento de las microalgas se monitorea con mediciones en tiempo real de la densidad óptica.
Resumen
En los Estados Unidos, el 35% de las emisiones totales de dióxido de carbono (CO2) provienen de la industria de la energía eléctrica, de las cuales el 30% representa la generación de electricidad a gas natural. Las microalgas pueden biofijar el CO2 de 10 a 15 veces más rápido que las plantas y convertir la biomasa de algas en productos de interés, como los biocombustibles. Así, este estudio presenta un protocolo que demuestra las sinergias potenciales del cultivo de microalgas con una central eléctrica de gas natural situada en el suroeste de Estados Unidos en un clima cálido semiárido. Las tecnologías de vanguardia se utilizan para mejorar la captura y utilización de carbono a través de la especie de algas verdes Chlorella sorokiniana, que se puede procesar aún más en biocombustible. Describimos un protocolo que involucra un estanque de pista de rodadura abierto semiautomatizado y discutimos los resultados de su rendimiento cuando se probó en la planta de Tucson Electric Power, en Tucson, Arizona. El gas de combustión se utilizó como la principal fuente de carbono para controlar el pH, y se cultivó Chlorella sorokiniana . Se utilizó un medio optimizado para cultivar las algas. La cantidad de CO2 añadida al sistema en función del tiempo fue monitoreada de cerca. Además, se monitorearon otros factores fisicoquímicos que afectan la tasa de crecimiento de algas, la productividad de la biomasa y la fijación de carbono, incluida la densidad óptica, el oxígeno disuelto (DO), la electroconductividad (EC) y las temperaturas del aire y del estanque. Los resultados indican que se puede alcanzar un rendimiento de microalgas de hasta 0,385 g/L de peso seco libre de cenizas, con un contenido lipídico del 24%. Aprovechar las oportunidades sinérgicas entre los emisores de CO2 y los agricultores de algas puede proporcionar los recursos necesarios para aumentar la captura de carbono al tiempo que apoya la producción sostenible de biocombustibles y bioproductos de algas.
Introducción
El calentamiento global es uno de los problemas ambientales más importantes que enfrenta el mundo hoyen día 1. Los estudios sugieren que la causa principal es el aumento de las emisiones de gases de efecto invernadero (GEI), principalmente CO2, en la atmósfera debido a las actividades humanas 2,3,4,5,6,7. En los Estados Unidos, la mayor densidad de emisiones de CO2 se origina principalmente en la combustión de combustibles fósiles en el sector energético, específicamente en las plantas de generación de energía eléctrica 3,7,8,9. Así, las tecnologías de captura y utilización de carbono (CCU) se han convertido en una de las principales estrategias para reducir las emisionesde GEI 2,7,10. Estos incluyen sistemas biológicos que utilizan la luz solar para convertir el CO2 y el agua a través de la fotosíntesis, en presencia de nutrientes, en biomasa. Se ha propuesto el uso de microalgas debido a la rápida tasa de crecimiento, la alta capacidad de fijación de CO2 y la alta capacidad de producción. Además, las microalgas tienen un amplio potencial de bioenergía porque la biomasa se puede convertir en productos de interés, como los biocombustibles que pueden reemplazar a los combustibles fósiles 7,9,10,11,12.
Las microalgas pueden crecer y lograr la conversión biológica en una variedad de sistemas de cultivo o reactores, incluidos estanques abiertos de canales y fotobiorreactores cerrados 13,14,15,16,17,18,19. Los investigadores han estudiado las ventajas y limitaciones que determinan el éxito del bioproceso en ambos sistemas de cultivo, ya sea en condiciones interiores o exteriores 5,6,16,20,21,22,23,24,25 . Los estanques de canales abiertos son los sistemas de cultivo más comunes para la captura y utilización de carbono en situaciones en las que los gases de combustión se pueden distribuir directamente desde la chimenea. Este tipo de sistema de cultivo es relativamente barato, es fácil de escalar, tiene bajos costos de energía y tiene bajos requisitos de energía para la mezcla. Además, estos sistemas se pueden ubicar fácilmente con la planta de energía para hacer que el proceso de CCU sea más eficiente. Sin embargo, hay algunos inconvenientes que deben tenerse en cuenta, como la limitación en la transferencia de masa de gas / líquido CO2. Aunque existen limitaciones, los estanques de pista de rodadura abiertos se han propuesto como el sistema más adecuado para la producción de biocombustibles de microalgas al aire libre 5,9,11,16,20.
En este artículo, detallamos un método para el cultivo de microalgas en estanques abiertos que combina la captura de carbono del gas de combustión de una planta de energía de gas natural. El método consiste en un sistema semiautomatizado que controla la inyección de gases de combustión en función del pH del cultivo; el sistema monitorea y registra el estado del cultivo de Chlorella sorokiniana en tiempo real utilizando sensores de densidad óptica, oxígeno disuelto (DO), electroconductividad (EC) y temperatura del aire y del estanque. Los datos de biomasa de algas e inyección de gases de combustión son recopilados por un registrador de datos cada 10 minutos en las instalaciones de Tucson Electric Power. El mantenimiento de la cepa de algas, la ampliación, las mediciones de control de calidad y la caracterización de la biomasa (por ejemplo, la correlación entre la densidad óptica, g / L y el contenido de lípidos) se realizan en un entorno de laboratorio en la Universidad de Arizona. Un protocolo anterior describía un método para optimizar la configuración de los gases de combustión para promover el crecimiento de microalgas en fotobiorreactores a través de la simulación por computadora26. El protocolo presentado aquí es único en el sentido de que utiliza estanques de pista de rodadura abiertos y está diseñado para implementarse in situ en una planta de energía de gas natural con el fin de hacer un uso directo del gas de combustión producido. Además, las mediciones de densidad óptica en tiempo real son parte del protocolo. El sistema descrito está optimizado para un clima semiárido cálido (Köppen BSh), que exhibe baja precipitación, variabilidad significativa en la precipitación de un año a otro, baja humedad relativa, altas tasas de evaporación, cielos despejados e intensa radiación solar27.
Protocolo
1. Sistema de crecimiento: configuración de estanque de pista de rodadura abierta al aire libre
- Instale los estanques abiertos de la pista de rodadura cerca de la fuente de gases de combustión (que contienen 8-10% de CO2). Asegúrese de que el agua y la electricidad estén disponibles en la ubicación del reactor del estanque y que el reactor no esté a la sombra la mayor parte del día (Figura 1).
- Capture los gases de combustión durante el proceso de postcombustión utilizando una manguera de combustible de 0,95 cm, unos metros antes de que el gas de combustión entre en la chimenea para ser descargado a la atmósfera (Figura 2).
- Retire el agua de los gases de combustión utilizando una trampa de agua de 20 L y un condensador (longitud de la bobina ~ 12 m) entre la pila y el compresor (Figura 2).
NOTA: Los gases de combustión generalmente contienen aproximadamente 9\u201213.8% de agua28. Además, el condensador y la tubería enfrían el gas de combustión16. - Conecte los siguientes sensores a un registrador de datos para monitorear el crecimiento de algas: (1) un sensor de densidad óptica en tiempo real29, que mide la absorbancia a dos longitudes de onda, 650 y 750 nm, y puede detectar una concentración máxima de células de algas de 1.05 g / L; (2) un sensor de OD; (3) termopares de aire y estanque; (4) un sensor de pH; y (5) un sensor EC.
NOTA: Además, los sensores de pH y EC están conectados a un transmisor. La configuración de la unidad registradora de datos se muestra en la Figura 3. - Asegúrese de que todos los componentes del sistema de crecimiento de algas estén calibrados y funcionen correctamente antes de la inoculación.
2. Sistema de control de pH
- Gestione la inyección de gases de combustión mediante un compresor, un sistema de válvulas de control y el programa de registro de datos, como se muestra en la Figura 2 y la Figura 3 (Material complementario A).
- Use un tubo para dirigir el gas de combustión desde la válvula de control hasta el fondo del estanque de la pista de rodadura a través de un difusor de piedra.
- Inyecte el gas de combustión en el sistema de crecimiento en función del pH. Cuando el valor de pH es superior a 8,05, el sistema inyectará gases de combustión, mientras que cuando el pH sea inferior a 8,00, el sistema detendrá la inyección de gases de combustión en períodos de no crecimiento. El caudal se mide en litros estándar por minuto (SLPM).
NOTA: En la válvula de control, la presión de los gases de combustión de entrada se limita a un máximo de 50 psi.
3. Selección de algas y mantenimiento de la tensión (luz y temperatura)
NOTA: El alga verde Chlorella sorokiniana DOE 1412 fue aislada por Juergen Polle (Brooklyn College)30,31 y seleccionada por la Alianza Nacional para Biocombustibles y Bioproductos Avanzados (NAABB); su selección se basó en los estudios previos de caracterización de cepas realizados por Huesemann et al.32,33. Su investigación con respecto a la detección de algas, la productividad de la biomasa y el cultivo simulado por el clima (por ejemplo, temperatura y luz) en la región suroeste cuando se utilizan estanques de pistas de rodadura abiertas al aire libre informaron el método utilizado en este proyecto.
- Mantenga los cultivos a temperatura ambiente (25 °C) utilizando un ciclo de luz/oscuridad de 12 h/12 h.
- Mantenga la intensidad de la luz a 200 μM/m2/s para el mantenimiento del cultivo cultivado en placas y en pequeños cultivos líquidos (50 mL a 500 mL).
- Mantenga la intensidad de la luz para escalar en cultivos líquidos de 50 ml a 500 ml a 400 μM / m2 / s, y cultivos líquidos de 5 L a 20 L a 600 \ u2012800 μM / m2 / s.
4. Escalado y control de calidad
- Preparar el medio de cultivo BG11 utilizando agua desionizada y las siguientes sales, para macronutrientes, en g/L: 1.5 NaNO3, 0.04 K2HPO4, 0.075 MgSO4*H2O, 0.036 CaCl2*H2O, 0.006 (NH4)5Fe(C6H4O7)2, 0.006 Na2EDTA*2H2O, 0,02 Na2CO3; añadir 1 ml/L de solución de oligoelementos, que contiene los siguientes micronutrientes en g/L: 2,86 H3BO3, 1,81 MnCl2*4H2O, 0,22 ZnSO4*7H2O, 0,39 Na2MoO4*2H2O, 0,079 CuSO4*5H2O, 0,0494 Co(NO3)2*6H2O.
NOTA: Para la inoculación de placas y/o almacenamiento a largo plazo, añadir 7,5 g/L de agar Bacto; para la inoculación del cultivo, no se necesita la adición de agar. Esterilizar el medio de cultivo en autoclave durante 21 min a 121 °C. - Vierta el medio BG11 con agar en placas de Petri en una campana de flujo laminar estéril o en un gabinete de bioseguridad. Una vez que las placas estén firmes y frías, pipetee 500 μL de un cultivo de algas congeladas resuspendido y agregue Ampicilina (100 μg / ml); incubar las placas de algas en una mesa agitadora (120 rpm) durante 1 a 2 semanas.
- Use un bucle estéril para seleccionar una sola colonia de algas de una placa de cultivo e inocularla en un tubo de 50 ml que contenga medio de crecimiento estéril en un gabinete de bioseguridad limpio. Cultive el pequeño cultivo líquido en una mesa agitadora (120 rpm) durante una semana.
- Transfiera 50 ml de cultivo de algas (fase de crecimiento lineal, OD750nm ≥ 1) a un matraz de 1 L con medio líquido de 500 ml. Ajuste cada matraz con un tapón de goma y tubos de acero inoxidable para proporcionar aireación. Filtre el aire utilizando filtros de esterilización de aire de 0,2 μm. Deja que la cultura crezca durante una o dos semanas. Monitoree la densidad celular usando un espectrofotómetro (OD750nm).
- Coloque el cultivo líquido de 500 ml en un carboy de 10 L que contenga 8 L de medio de cultivo no estéril e inyecte una mezcla de 5% de CO2 y 95% de aire. Luego, cultive algas en las mismas condiciones que en el paso 4.4.
- Monitoree los cultivos de placas y líquidos (en los pasos 4.2\u20124.5) una vez a la semana. Tome una alícuota y obsérvela bajo el microscopio a un aumento de 10x y 40x para asegurar el crecimiento de la cepa deseada. Cultivos mantenidos hasta que han sido comprometidos o utilizados para experimentos. Deseche los cultivos contaminados.
5. Preparación de medio concentrado para el cultivo en estanque abierto
- Para preparar la solución de oligoelementos, llene parcialmente un matraz aforado de 1 L con agua destilada (DW). Inserte una barra de agitación magnética y agregue los productos químicos que se muestran en la Tabla 1 secuencialmente. Asegúrese de que cada ingrediente se disuelva antes de la adición del siguiente constituyente. Retire el imán y llene el matraz hasta la marca de volumen de 1 L.
- Llene parcialmente una botella de vidrio de 1 L con DW e inserte la barra de agitación magnética. Coloque el recipiente en la parte superior de una placa agitadora magnética y agregue los productos químicos para el volumen final del reactor, agregándolos secuencialmente, asegurando que cada uno se disuelva por completo. La Tabla 2 enumera los productos químicos para preparar 1 L de medio, así que multiplique todos los valores por el volumen final del reactor. Llene la botella de vidrio a 1 L.
6. Inoculación de estanque de pista de carreras abierta al aire libre
- Limpie a fondo el reactor con lejía al 30% antes de cada inoculación y después de la cosecha. Se recomienda dejar la lejía durante la noche. Enjuague bien el reactor para eliminar toda la lejía.
- Calibrar todos los sensores antes de la inoculación de algas de acuerdo con su correspondiente procedimiento de calibración.
- Diluya el medio concentrado (en el paso 5) utilizando la fuente de agua llenando el estanque de la pista de rodadura hasta en un 80%.
- Inocular el reactor utilizando un carboy de 10 L lleno de algas (fase de crecimiento lineal OD750nm > 2) y llevarlo a su volumen final.
- Aclimatar las microalgas sombreando parcialmente el estanque de la pista de rodadura con palets de madera durante ~ 3 días (Figura 4), una vez pasada la fase exponencial, como estrategia de adaptación para evitar la fotoinhibición.
NOTA: Este período también proporcionará tiempo para que las microalgas se adapten al estrés causado por la inyección directa de gases de combustión.
7. Experimento de crecimiento por lotes en la estación generadora
- Inspeccione y registre cualquier variación diaria, incluida la evaporación del agua, el motor de la rueda de paletas, la funcionalidad del sensor y cualquier cosa fuera de lo común.
- Drene e inspeccione el compresor y la trampa de agua todos los días para eliminar el exceso de agua para minimizar la corrosión, ya que los gases de combustión son altamente corrosivos34.
- Configure el registrador de datos para escanear cada medición del sensor cada 10 s y almacenar los datos promedio cada 10 minutos. Estos incluyen DO, pH, EC, densidad óptica en tiempo real, así como la temperatura del aire y del reactor.
8. Muestreo y monitoreo discretos
- Asegúrese de que el nivel de agua permanezca constante en el volumen final del reactor, de lo contrario, la medición de la densidad óptica se verá afectada.
- Después de reponer el agua en el reactor, tome una muestra de 5 ml para mediciones de masa celular por densidad óptica (540, 680 y 750 nm) utilizando un espectrofotómetro ultravioleta-visible. Repita el proceso diariamente.
- Tome una muestra de 500 ml tres veces por semana para observaciones al microscopio y concentración de biomasa basada en el peso seco libre de cenizas (AFDW).
- Realizar observaciones de microscopio con lentes de objetivos 10x y 40x. Además, estos aumentos de microscopio se utilizan como parte del control de calidad de algas descrito en el paso 4.6.
- Utilice 400 ml de la muestra en el paso 8.3 para AFDW
- Coloque cada filtro de microfibra de vidrio de tamaño de poro de 0,7 μm en una bandeja de papel de aluminio y trate previamente cada bandeja / filtro de papel de aluminio con un horno durante 4 h a 540 ° C.
- Etiquete cada bandeja de papel de aluminio con un lápiz # 2, registre su peso (A) y colóquelo en el aparato de filtro de vacío.
- Revuelva la muestra de algas vigorosamente antes de medir un volumen a filtrar. Filtre suficiente muestra de algas para dar una diferencia de peso pre / post ceniza de entre 8 y 16 mg. Elija una diferencia de peso para usar durante el transcurso del experimento y mantenga este valor constante.
- Coloque cada filtro que contenga la muestra de algas en su bandeja de papel de aluminio en el horno a 105 °C durante al menos 12 h.
- Retire la bandeja/filtro de aluminio del horno de secado y colóquelo en un desecador de vidrio para evitar la absorción de agua. Registre cada bandeja de lámina/peso del filtro (B).
- Coloque la bandeja/filtro de lámina en el horno de mufla de 540 °C durante 4 h.
- Apague el horno de amortiguación, enfríe las bandejas / filtros de lámina, colóquelos en el desecador y registre cada bandeja de lámina / peso del filtro (C).
- Calcule AFDW utilizando análisis gravimétrico:
% AFDW= C – A x 100 / B
- Mantenga 2 L de algas antes de la recolección para el análisis de extracción de lípidos por extracción asistida por microondas (MAE) utilizando solventes.
- Centrifugar la muestra de algas a una fuerza centrífuga relativa (RFC) de 4.400 x g durante 15 min. Tome el pellet de algas y séquelo con un horno a 80 ° C durante al menos 24 h.
- Moler la muestra de algas y pesar el polvo de algas (la biomasa recomendada varía de 0,3 g a 0,5 g).
- Agregue el polvo de algas (biomasa de algas secas) en los recipientes Xpress del sistema de reacción acelerada por microondas (MARS), agregue 10 ml de cloroformo: solución de disolvente de metanol (2: 1, v / v) debajo del capó, cierre los recipientes y deje reposar durante la noche.
- Coloque los recipientes en la máquina MARS utilizando el sensor de disolvente durante 60 min a 70 °C y 800 W de potencia.
- Saque los buques del MARS y déjelos enfriar bajo el capó.
- Use un embudo y lana de vidrio para separar la parte líquida que contiene cloroformo, metanol y lípidos transfiriendo cada muestra líquida a un tubo de ensayo de vidrio prepesado y mantenga los sólidos (biomasa libre de lípidos) para otros análisis.
- Lleve los tubos de ensayo que contienen los lípidos al evaporador de nitrógeno, retírelos una vez que el líquido se haya evaporado y luego deje los tubos durante la noche debajo del capó para garantizar una sequedad completa.
- Calcular el contenido de lípidos (wt. %) mediante análisis gravimétrico:
Contenido de lípidos (wt. %) = Biomasa seca de lípidos x 100/ Masa de algas secas
9. Cosecha de algas y rotación de cultivos
- Cosechar el 75% del volumen total de cultivo de algas cuando el cultivo está cerca de alcanzar la fase estacionaria. Tome 2\u20125 L de cultivo para realizar análisis de productividad de biomasa en el laboratorio. Procesa y convierte el resto de las algas en los productos de algas deseados.
- Vuelva a cultivar el estanque abierto de la pista de rodadura utilizando el 25% de algas restantes como inóculo. Agregue agua hasta el 80% del volumen total del reactor, agregue los medios concentrados y luego termine de llenar hasta el volumen final del reactor si es necesario.
- Cultive la cepa de algas adecuada de acuerdo con la temporada, según las condiciones de temperatura e intensidad de la luz.
10. Gestión de datos
- Registre datos en el registrador de datos y recopile para su análisis como en el paso 7.3.
- Considere la posibilidad de guardar datos en bruto y analizados en la unidad de participación de la plataforma regional de pruebas de materias primas de algas (RAFT). Los colaboradores del proyecto RAFT aportan sus datos para simular y modelar la productividad de las algas y validar el cultivo al aire libre.
Resultados
Los resultados experimentales previos de nuestro laboratorio indican que el cultivo de microalgas utilizando un estanque de raceway abierto semiautomatizado se puede combinar con procesos de captura de carbono. Para comprender mejor la sinergia entre estos dos procesos (Figura 2), desarrollamos un protocolo y lo adaptamos para cultivar la especie de algas verdes Chlorella sorokiniana en condiciones exteriores en un clima semiárido cálido. El gas de combustión de gas natural se obtuvo de una estación de generación de energía industrial. Este protocolo utiliza diversas tecnologías para evaluar la productividad de la biomasa de algas: (1) crecimiento de algas utilizando un sensor de densidad óptica en tiempo real (Figura 5); (2) crecimiento de algas con respecto a las inyecciones de pulsos de encendido y apagado de gases de combustión en el cultivo en función del pH (Figura 6 y Figura 7); y (3) correlaciones de crecimiento de algas con parámetros ambientales como la temperatura, el oxígeno disuelto y la electroconductividad (Figura 8 y Figura 9).
Probamos un sensor de densidad óptica en tiempo real que monitorea el crecimiento de algas y la dinámica fisiológica. Este sensor nos permitió establecer, a través de la correlación de laboratorio, la biomasa de peso seco libre de cenizas correspondiente (g/L). La Figura 5 muestra una comparación entre el sensor y las mediciones de laboratorio. Ambas lecturas muestran tendencias similares, aumentando en función del tiempo. Sin embargo, las lecturas del sensor in situ pueden rastrear el ciclo de crecimiento de algas día/noche. Dicho ciclo muestra que los valores de densidad óptica aumentan durante el día pero disminuyen por la noche durante la respiración, lo que indica un cambio en la productividad de la biomasa. La integración del sensor de densidad óptica en tiempo real permite tomar decisiones de gestión efectivas sobre el sistema general de producción de algas.
Implementamos un sistema semiautomatizado de inyección de pulsos de gases de combustión on-off, que está representado en la Figura 6 por un ciclo de inyección de gases de combustión de 24 horas medido durante una temporada de otoño particularmente cálida en Tucson, AZ. Como se muestra en la Figura 6, los gases de combustión se inyectaron aproximadamente de 8 am a 6 pm (período diurno) pero no se inyectaron entre las 6 pm y las 8 am (período nocturno). Este ciclo día/noche refleja la exposición diaria a la luz solar y la falta de luz durante la noche, y en consecuencia, la activación de la fotosíntesis o la fotorrespiración, respectivamente. La Figura 7 presenta el gas de combustión acumulado inyectado (L) durante este lote de algas. En este caso, se utilizaron 6.564 L de gases de combustión, correspondientes a 538 L CO2, para cultivar 0,29 g de biomasa de algas. El gráfico muestra que a medida que aumentaba la tasa de crecimiento de algas, se requerían más gases de combustión (CO2) (Figura 6). Los resultados experimentales han confirmado que el sistema de inyección de pulsos de gases de combustión encendido y apagado es eficaz para facilitar la captura y utilización de carbono a través del cultivo de microalgas.
Medimos y monitoreamos otros parámetros fisicoquímicos para establecer una correlación entre ellos y el crecimiento y la productividad de las algas (Figura 8 y Figura 9). Los parámetros ambientales medidos fueron oxígeno disuelto, electroconductividad (CE) y temperaturas del aire y del estanque. Como era de esperar, todos los parámetros, excepto la CE, mostraron tendencias similares que estaban altamente correlacionadas con la radiación solar. Los resultados indican que estas variables ambientales tuvieron el impacto más significativo en el crecimiento de algas y se utilizan para el modelado de biomasa de algas35. Las CE no cambiaron significativamente durante el proceso por lotes. Por lo tanto, no proporcionó ninguna información pertinente sobre el crecimiento de las algas. Para el cultivo de Chlorella sorokiniana utilizando agua no salina, se pueden omitir las mediciones de EC.

Figura 1: Ubicación del sitio piloto en Tucson Electric Power para acoplar la captura de carbono de la planta de energía y los reactores semiautomatizados de estanque abierto para el cultivo de microalgas. Las dos ubicaciones están representadas por: 1) Sitio de Algas U3 (unidad 3) y 2) Sitio de Algas U4 (unidad 4) Crédito de la foto: José Manuel Cisneros Vázquez. Haga clic aquí para ver una versión más grande de esta figura.
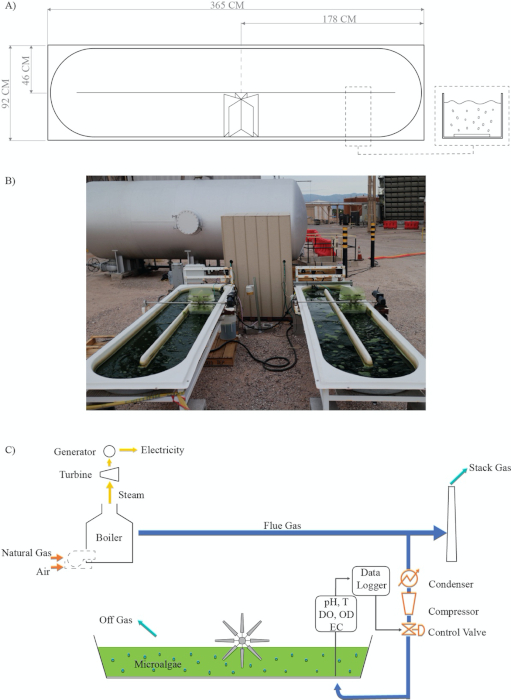
Figura 2: Diagrama de flujo de proceso para acoplar la captura de carbono y estanques de pista de rodadura abiertos semiautomatizados para el cultivo de microalgas en un clima semiárido caliente. (A) Diseño de rueda de paletas open Raceway; B) Instalación experimental real; (C) Proceso: acoplamiento de captura de carbono y cultivo de microalgas modificado a partir de Van Den Hende28. Leyendas: T = Temperatura; DO = Oxígeno disuelto; OD = Densidad óptica; EC = Conductividad eléctrica; Registrador de datos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Representación esquemática de la configuración del sensor. (A) Representación de la configuración general de los sensores de estanque abierto al aire libre, en los que CV1 y CV2 son las válvulas de control, DL es el registrador de datos y T1 y T2 son los transmisores. (B) Representación de una válvula de control. (C) Representación de la conexión de los sensores al registrador de datos; círculo azul oscuro: densidad óptica en tiempo real, triángulo naranja: pH y EC, triángulo negro: termopares, triángulo rojo: oxígeno disuelto, azul claro: válvula de control. (D) pH y transmisor CE. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Algas bajo el proceso de aclimatación. Estrategia de aclimatación de microalgas utilizando palets de madera durante la fase exponencial. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Representación del monitoreo del crecimiento de algas. (A) Gráfico para la concentración de biomasa AFDW (g/L) vs. tiempo de mediciones de laboratorio; (B) Gráfico para la correlación entre el sensor de densidad óptica y las mediciones de laboratorio a 650 nm; y (C) gráfico para el sensor de densidad óptica en tiempo real frente al tiempo para un lote experimental. Haga clic aquí para ver una versión más grande de esta figura.
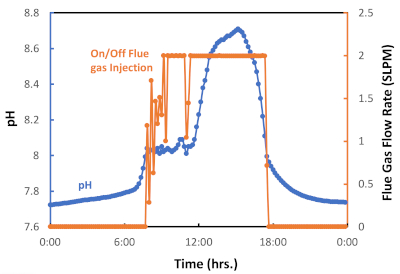
Figura 6: Gráfico para la inyección de pulso de gases de combustión de encendido / apagado como una función de pH. El registrador de datos se configuró para iniciar la inyección de gases de combustión (válvula controlada encendida) a pH = 8.05 y para finalizar la inyección de gases de combustión (válvula controlada apagada) a pH = 8.00. Haga clic aquí para ver una versión más grande de esta figura.
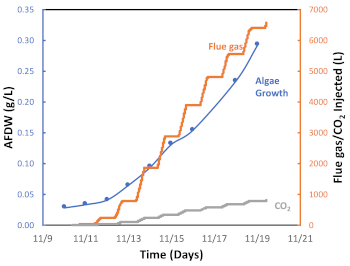
Figura 7: Gráfico para el crecimiento de algas (g/L), la cantidad de gases de combustión inyectados y la cantidad de CO2 inyectado en función del tiempo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Representación del monitoreo de temperatura. Leyendas: línea amarilla sólida = temperatura del reactor del estanque de la pista; línea gris sólida = temperatura del aire; y línea azul discontinua = temperatura de la estación AZMET (The Arizona Meteorological Network). Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Monitoreo de parámetros de crecimiento de algas. Leyendas: línea sólida naranja = radiación solar; línea sólida gris = electroconductividad (CE); y línea sólida amarilla = oxígeno disuelto (DO). Haga clic aquí para ver una versión más grande de esta figura.
| Componentes | Concentración en solución (g/L) |
| H3BO3 | 0.00286 |
| MnCl2·4H2O | 0.00181 |
| ZnSO4·7H2O | 0.0001373 |
| Na2MoO4·2H2O | 0.00039 |
| Cuso4·5H2O | 0.000079 |
| Co(NO3)2·6H2O | 0.00005518 |
| NiCl2·6 H2O | 0.0001 |
Tabla 1: Receta de solución de oligoelementos.
| Componentes | Nombre común | Concentración en solución (g/L) |
| (NH2) número arábigo CO | Urea | 0.1 |
| mgSO4·7H2O | Sulfato de magnesio | 0.012 |
| NH4H2PO4 | Fosfato de amonio | 0.035 |
| Kcl | Potasa | 0.175 |
| FeCl3 | Citrato férrico (Citraplex) | 0.005423 |
| Solución de metal traza | Volumen de 1000x Micros (ml) | 1 |
Tabla 2: Receta de medios optimizada para 1 L.
Archivos de codificación suplementarios. Haga clic aquí para descargar este archivo.
Discusión
En este estudio, demostramos que el acoplamiento sinérgico de la captura de carbono de los gases de combustión y el cultivo de microalgas es posible en un clima semiárido caliente. El protocolo experimental para el sistema de estanques semiautomatizados de la pista de rodadura integra tecnología de vanguardia para monitorear parámetros relevantes en tiempo real que se correlacionan con el crecimiento de algas cuando se utiliza gas de combustión como fuente de carbono. El protocolo propuesto está destinado a reducir la incertidumbre en el cultivo de algas, que es uno de los principales inconvenientes de los estanques de regatas 20,21,36. En nuestra experiencia, los pasos más críticos del protocolo involucran el sistema de control de pH y un método efectivo para inocular el sistema (Figura 2). El sistema de control de pH suministra gases de combustión/CO2 y representa una estrategia para optimizar la eficiencia en la captura y utilización de CO2 (Figura 3)37. Se ha demostrado que este sistema controlado es más eficiente que un sistema de inyección continua para el proceso de cultivo de microalgas porque reduce la desgasificación al tiempo que proporciona suficientes gases de combustión para alcanzar la tasa máxima de crecimiento de algas20,37. Cuando la inyección de gases de combustión se basa en el pH, un factor clave para el cultivo de algas es seleccionar un valor de pH adecuado para las especies de microalgas antes de inocular el estanque de la pista de rodadura38,39. Qiu et al.40 encontraron que un valor de pH de 8 es el mejor para la especie de agua dulce Chlorella sorokiniania cuando se considera el crecimiento celular y la producción de lípidos40. Además, Molina Grima et al.41 recomiendan un pH inferior a 8 para reducir la pérdida de nitrógeno y lograr una mejor absorción de nitrógeno por parte de las microalgas/biomasa41. Sin embargo, Yuvraj et al.42 sugieren que el pH no es un método apropiado para evaluar el contenido de CO2 en el agua debido al efecto de la fertilización nitrogenada sobre la acidez del medio42. Nuestros resultados muestran que el pH se puede utilizar eficazmente para gestionar la inyección de CO2 para el sistema presentado aquí (Figura 6); nuestra gestión de la inyección de gases de combustión, que mantuvo el cultivo a pH 8, dio como resultado altos rendimientos de biomasa y replicabilidad (Figura 7).
Después de la inoculación, las algas deben aclimatarse al sistema para evitar la fotoinhibición y ajustarse a la alta temperatura del medio de rodadura. En este clima cálido semiárido, hemos observado fotoinhibición de algas debido a la alta radiación solar 39,43,44 (Figura 9). Este efecto no solo puede retrasar sino también inhibir la inoculación de microalgas durante la fase exponencial 32,35,45,46,47. Para reducir el impacto de la aclimatación en las microalgas, diseñamos una estrategia exitosa y factible que consiste en sombrear parcialmente el estanque de la pista de rodadura con palets de madera. Esta estrategia permite que las microalgas se expongan repetidamente pero durante cortos períodos de tiempo a las condiciones solares. Otro factor de estrés es la alta temperatura de los gases de combustión y del aire ambiente33,48 (Figura 8). La temperatura de los gases de combustión es bastante alta en la etapa de postcombustión 10,48,49. La utilización del gas de combustión inyectándolo directamente desde la tubería enviada al estanque de la pista de rodadura puede contribuir a aumentar aún más la temperatura del medio. Por lo tanto, un condensador seguido de una trampa de agua ubicada antes del compresor no solo reducirá la transferencia de calor, sino también la cantidad de agua que llega al compresor (Figura 2). Encontramos que ambos dispositivos eran necesarios para reducir la tasa de fallas del compresor. Además, la humedad, la temperatura de los gases de combustión y la naturaleza corrosiva de los gases de combustión deben tenerse en cuenta al estimar el ciclo de vida y el mantenimiento del compresor. Además, las altas temperaturas causan mayores tasas de evaporación.
Este protocolo está sujeto a algunas limitaciones. Según la Figura 6, la válvula de control no fue capaz de inyectar suficiente gas de combustión cuando la fotosíntesis estaba en su punto máximo. Este efecto se puede atribuir a la baja transferencia de masa de la fase gaseosa a la fase líquida debido al diseño del reactor 5,16,50,51. Mendoza et al.36,52 y de Godos et al.16 afirmaron que los estanques de raceway tienen una mala transferencia de masa gas/líquido, lo que representa una de las limitaciones de diseño más severas 16,36,52. Su diseño de canal poco profundo limita la transferencia de masa de CO2 debido al área de interfaz corta entre el gas y el medio de cultivo, lo que provoca un aumento en la desgasificación de CO2 (Figura 2). Así, se han propuesto dispositivos y configuraciones novedosas para aumentar el tiempo de contacto gas/líquido, incluyendo sumideros, columnas de mezcla, silicona permeable y sistemas de sparging-difusión 36,52,53. Todos estos sistemas se han utilizado en un intento de mejorar la transferencia de masa de CO2; sin embargo, algunos de estos sistemas también mejoran la distribución de nutrientes, controlan el pH y eliminan el exceso de O2 5,24,36,52. Finalmente, las interrupciones son otras limitaciones que pueden surgir al capturar y utilizar gases de combustión reales de una planta de energía. Estas interrupciones no siempre están programadas. Por lo tanto, se deben considerar fuentes alternativas temporales de CO2, por ejemplo, la reubicación o la conexión de la línea principal de CO2 a múltiples unidades de potencia (Figura 1).
La capacidad de producir microalgas con este protocolo está respaldada por nuestros resultados sobre la productividad de las algas (Figura 5), las respuestas de las algas a los parámetros seleccionados (Figura 6, Figura 8, Figura 9) y el cultivo exitoso de las especies de algas deseadas cuando se nutren de la inyección directa de gases de combustión. Los reactores abiertos son más baratos de operar y, por lo tanto, este protocolo se basa en sus fortalezas para acelerar el despliegue a escala comercial de esta forma de captura y utilización de carbono 16,20,54,55,56. Esta región semiárida caliente experimenta una alta radiación solar y fluctuaciones significativas de temperatura durante todo el año (Figura 8 y Figura 9)57; por lo tanto, es un lugar privilegiado para probar este tipo de protocolo. El sensor de densidad óptica proporcionó lecturas OD consistentes para nuestro sistema abierto al aire libre (Figura 5); este tipo de recopilación de datos sería poco práctica utilizando otros sensores. Además, los sensores respondieron bien a las variaciones significativas de temperatura del día a la noche (Figura 8), lo que nos permitió tomar decisiones oportunas sobre la productividad de las algas29. Además, el medio optimizado propuesto tiene la ventaja crítica de estar basado en fertilizantes comerciales y fuentes de nutrientes fácilmente disponibles58 (Tablas 1 y 2); este medio se puede producir fácilmente internamente o se puede obtener a pedido de las empresas de fertilizantes líquidos agrícolas58. Finalmente, el protocolo semiautomatizado se probó en una planta de energía de gas natural adicional. Los resultados de ese estudio de confirmación no se presentan en este documento. En ese estudio de confirmación, el protocolo fue exitoso a pesar de las condiciones climáticas extremas en Tucson y las temperaturas excepcionalmente altas en la estación de generación debido a la ubicación del reactor dentro del diseño de la planta de energía. Por lo tanto, se ha examinado la replicabilidad del protocolo para el medio ambiente de Tucson cuando el gas natural se utiliza como combustible para producir electricidad.
Se recomiendan los siguientes pasos para desarrollar aún más este protocolo y para mejorar y mejorar la automatización de los procesos involucrados. La primera recomendación es hacer de la inyección de gases de combustión un proceso de tasa completamente variable, mejorando así la gestión del CO2 y el pH; el programa actual abre completamente la válvula de inyección cuando el pH se eleva por encima de 8 y la cierra cuando el pH alcanza 8 nuevamente. También es necesario mejorar la forma en que se inyecta el CO2 . El objetivo es reducir el tamaño de las burbujas de CO2 , es decir, generar microburbujas para mejorar la difusión de CO2 en el medio sin recurrir a inyectar gases de combustión a mayor presión. El uso de inyectores mejorados, reduciendo así los costos de energía operativa, se considera necesario en una aplicación comercial del protocolo. También se recomienda la inclusión de herramientas predictivas basadas en el pronóstico del tiempo y el estado actual de las microalgas para controlar los gases de combustión y los fertilizantes, principalmente N, para mejorar la eficiencia del uso de N. El uso del modelado dinámico de fluidos computacional se considera una herramienta vital para desarrollar aún más el protocolo propuesto; el modelado puede ayudar a optimizar el diseño, la configuración y el funcionamiento de todo el hardware involucrado en el monitoreo y la gestión de las microalgas. Otra área que podría explorarse en el futuro es la aplicación de ADN ambiental (eDNA) y técnicas de PCR en tiempo real para monitorear la salud y composición del cultivo de microalgas. Se podrían analizar muestras de agua, y los resultados indicarían si las microalgas objetivo son la especie predominante en el medio o si está compitiendo o ha sido reemplazada por un organismo diferente.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado a través del proyecto Regional Algal Feedstock Testbed, Departamento de Energía de los Estados Unidos DE-EE0006269. También agradecemos a Esteban Jiménez, Jessica Peebles, Francisco Acedo, José Cisneros, RAFT Team, Mark Mansfield, el personal de la planta de energía de UA y el personal de la planta de energía TEP por toda su ayuda.
Materiales
| Name | Company | Catalog Number | Comments |
| Adjustable speed motor (paddle wheel system) | Leeson | 174307 | Lesson 174307.00, type: SCR Voltage; Amps:10 |
| Aluminum weight boats | Fisher Scientific | 08-732-102 | Fisherbrand Aluminum Weighing Dishes |
| Ammonium Iron (III) (NH?)?[Fe(C?H?O?)?] | Fisher Scientific | 1185 - 57 - 5 | Medium preparation. Ammonium iron(III) citrate |
| Ammonium Phosphate | Sigma-Aldrich | 7722-76-1 | This chemical is used for the optimized medium |
| Ampicillin sodium salt | Sigma Aldrich | A9518-5G | This chemical is used for avoiding algae contamination |
| Autoclave | Amerex Instrument Inc | Hirayama HA300MII | |
| Bacto agar | Fisher Scientific | BP1423500 | Fisher BioReagents Granulated Agar |
| Bleach | Clorox | Germicidal Bleach, concentrated clorox | |
| Boric Acid (H3BO3) | Fisher Scientific | 10043-35-3 | Trace Elelements: Boric acid |
| Calcium chloride dihydrate (CaCl2*2H2O) | Sigma-Aldrich | 10035-04-8 | Medium preparation. Calcium chloride dihydrate |
| Carboys (20 L) | Nalgene - Thermo Fisher Scientific | 2250-0050PK | Polypropylene Carboy w/Handles |
| Centrifuge | Beckman Coulter, Inc | J2-21 | |
| Chloroform | Sigma-Aldrich | 67-66-3 | This chemical is used for lipid extraction |
| Citraplex 20% Iron | Loveland Products | SDS No. 1000595582 -17-LPI | https://www.fbn.com/direct/product/Citraplex-20-Iron#product_info |
| Cobalt (II) nitrate hexahydrate (Co(NO3)2*6H2O) | Sigma-Aldrich | 10026-22-9 | Trace Elements: Cobalt (II) nitrate hexahydrate |
| Compressor | Makita | MAC700 | This equipment is used for the injection CO2 system |
| Control Valve | Sierra Instruments | SmartTrak 100 | This item needs to be customized for your application. In our case, it was used a 5% CO2 and 95% air mixture. |
| Copper (II) Sulfate Pentahydrate (CuSO4*5H2O) | Sigma-Aldrich | 7758-99-8 | Trace Elements: Copper (II) Sulfate Pentahydrate |
| Data Logger: Campbell unit CR3000 | Scientific Campbell | CR3000 | This equipment is used for controlling all the system, motoring and recording data |
| Dissolvde Oxygen Solution | Campbell Scientific | 14055 | Dissolved oxygen electrolyte solution DO6002 - Lot No. 211085 |
| Dissolved Oxygen probe | Sensorex | ? | DO6400/T Dissolved Oxygen Sensor with Digital Communication |
| Electroconductivity calibration solution | Ricca Chemical Company | 2245 - 32 ( R2245000-1A ) | Conductivity Standard, 5000 uS/cm at 25C (2620 ppm TDS as NaCl) |
| Electroconductivity probe sensor | Hanna Instruments | HI3003/D | Flow-thru Conductivity Probe - NTC Sensor, DIN Connector, 3m Cable |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (Na2EDTA*2H2O) | Sigma-Aldrich | 6381-92-6 | Medium Preparation: Ethylenediaminetetraacetic acid disodium salt dihydrate |
| Filters | Fisher Scientific | 09-874-48 | Whatman Binder-Free Glass Microfiber Filters |
| Flasks | Fisher scientific | 09-552-40 | Pyrex Fernbach Flasks |
| Furnace | Hogentogler | Model: F6020C-80 | Thermo Sicentific Thermolyne F6020C - 80 Muffle Furnace |
| Glass dessicator | VWR International LLC | 75871-430 | Type 150, 140 mm of diameter |
| Glass funnel | Fisher Scientific | FB6005865 | Fisherbrand Reusable Glass Long-Stem Funnels |
| Laminar flow hood | Fisher Hamilton Safeair | Fisher Hamilton Stainless Safeair hume hood | |
| Magnesium sulfate heptahydrate (MgSO4*7H2O) | Fisher Scientific | 10034 - 99 - 8 | Medium Preparation: Magnesium sulfate heptahydrate |
| Methanol | Sigma-Aldrich | 67-56-1 | Lipid extraction solvent |
| Micro bubble Diffuser | Pentair Aquatic Eco-Systems | 1PMBD075 | This equipment is used for the injection CO2 system |
| Microalgae: Chlorella Sorokiniana | NAABB | DOE 1412 | |
| Microoscope | Carl Zeiss 4291097 | ||
| Microwave assistant extraction | MARS, CEM Corportation | CEM Mars 5 Xtraction 230/60 Microwave Accelerated Reaction System. Model: 907601 | |
| MnCl2*4H2O | Sigma-Aldrich | 13446-34-9 | Manganese(II) chloride tetrahydrate |
| Mortars | Fisher Scientific | FB961B | Fisherbrand porcelein mortars |
| Nitrogen evaporator | Organomation | N-EVAP 112 Nitrogen Evaporatpr (OA-SYS Heating System) | |
| Oven | VWR International LLC | 89511-410 | Forced Air Oven |
| Paddle Wheel | 8-blade horizontal axis propeller. This usually comes as part of the paddlewheel reactor. | ||
| Paddle wheel motor | Leeson | M1135042.00 | Leeson, Model: CM34025Nz10C; 1/4 HP; Volts 90; FR 34; 62 RPM. |
| Pestles | Fisher Scientific | FB961M | Fisherbrand porcelein pestles |
| pH and EC Transmitter | Hanna Instruments | HI98143 | Hanna Instruments HI98143-04 pH and EC Transmitter with Galvanic isolated 0-4V. |
| pH calibration solutions | Fisher Scientific | 13-643-003 | Thermo Scientific Orion pH Buffer Bottles |
| pH probe sensor | Hanna Instruments | HI1006-2005 | Hanna Instruments HI1006-2005 Teflon pH Electrode with matching pin 5m. |
| Pippete tips | Fisher Scientific | 1111-2821 | 1000 ul TipOne graduated blue tip in racks |
| Pippetter | Fisher Scientific | 13-690-032 | Eppendorf Reserch plus Variable Adjustable Volume Pipettes: Single-channel |
| Plastic cuvettes | Fisher scientific | 14377017 | BrandTech BRAND Plastic Cuvettes |
| Plates | Fisher scientific | 08-757-100D | Corning Falcon Bacteriological Petri Dishes with Lid |
| Potash | This chemical is used for the optimazed medium preparation. It was bought in a fertilizer local company | ||
| Potassium phosphate dibasic (K2HPO4) | Sigma-Aldrich | 7758 -11 - 4 | Medium Preparation: Potassium phosphate dibasic |
| Pyrex reusable Media Storage Bottles | Fisher scientific | 06-414-2A | 1 L and 2 L bottels - PYREX GL45 Screw Caps with Plug Seals |
| Raceway Pond | Similar equipment can be bought at https://microbioengineering.com/products | ||
| Real Time Optical Density Sensor | University of Arizona | This equipment was design and build by a member of the group | |
| RS232 Cable | Sabrent | Sabrent USB 2.0 to Serial (9-Pin) DB-9 RS-232 Converter Cable, Prolific Chipset, Hexnuts, [Windows 10/8.1/8/7/VISTA/XP, Mac OS X 10.6 and Above] 2.5 Feet (CB-DB9P) | |
| Shaker Table | Algae agitation 150 rpm | ||
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | 497-19-8 | Sodium carbonate |
| Sodium molybdate dihydrate (Na2MoO4*2H2O) | Sigma-Aldrich | 10102-40-6 | Medium Preparation: Sodium molybdate dihydrate |
| Sodium nitrate (NaNO3) | Sigma-Aldrich | 7631-99-4 | Medium Preparation: Sodium nitrate |
| Spectophotometer | Fisher Scientific Company | 14-385-400 | Thermo Fisher Scientific - 10S UV-Vis GENESTYS Spectrophotometer cylindrical Longpath cell holder; internal reference dectector, Xenon flash lamp; dual silicon photodiode; 240V, 50 to 60Hz selected automatically. |
| Test tubes | Fisher Scientific | 14-961-27 | Fisherbrand Disposable Borosilicate Glass Tubes with Plain End (10 ml) |
| Thermocouples type K | Omega | KMQXL-125G-6 | |
| Urea | Sigma-Aldrich | 2067-80-3 | Urea |
| Vacuum filtration system | Fisher Scientific | XX1514700 | MilliporeSigma Glass Vacuum Filter Holder, 47 mm. The system includes: Ground glass flask attachment, coarse-frit glass filter support, and flask |
| Vacuum pump | Grainger | Marathon Electric AC Motor Thermally protected G588DX - MOD 5KH36KNA510X. HP 1/4. RPM 1725/1425 | |
| Zinc sulfate heptahydrate (ZnSO4*7H2O) | Sigma-Aldrich | 7446-20-0 | Zinc sulfate heptahydrate |
Referencias
- The Intergovernmental Panel on Climate Change. , Available from: https://www.ipcc.ch/ (2018).
- Songolzadeh, M., Soleimani, M., Ravanchi, M., Songolzadeh, R. Carbon Dioxide Separation from Flue Gases: A Technological, Review Emphasizing Reduction in Greenhouse Gas Emissions. The Scientific World Journal. 2014, 1-34 (2014).
- Litynski, J., Klara, S., McIlvried, H., Srivastava, R. The United States Department of Energy's Regional Carbon Sequestration Partnerships program: A collaborative approach to carbon management. Environ International. 32 (1), 128-144 (2006).
- Cuellar-Bermudez, S., Garcia-Perez, J., Rittmann, B., Parra-Saldivar, R. Photosynthetic Bioenergy Utilizing CO2: an Approach on Flue Gases Utilization for Third Generation Biofuels. Journal of Clean Production. 98, 53-65 (2014).
- Cheah, W., Show, P., Chang, J., Ling, T., Juan, J. Biosequestration of Atmospheric CO2 and Flue Gas-Containing CO2 by Microalgae. Bioresource Technology. 184, 190-201 (2014).
- Kao, C., et al. Utilization of Carbon Dioxide in Industrial Flue Gases for the Cultivation of Microalga Chlorella sp. Bioresource Technology. 166, 485-493 (2014).
- White, C., Strazisar, B., Granite, E., Hoffman, S., Pennline, H. Separation and Capture of CO2 from Large Stationary Sources and Sequestration in Geological Formations. Journal of the Air and Waste Management Association. 53 (10), 1172-1182 (2003).
- Benemann, J. CO2 Mitigation with Microalgae Systems. Pergamon Energy Conversion Management Journal. 38, 475-479 (1997).
- U.S.Department of Energy. The Capture , Utilization and Disposal of Carbon Dioxide from Fossil Fuel-Fired Power Plants. Energy. 2, (1993).
- Granite, E., O'Brien, T. Review of Novel Methods for Carbon Dioxide Separation from Flue and Fuel Gases. Fuel Processesing Technology. 86 (14-15), 1423-1434 (2005).
- Benemann, J. Utilization of Carbon Dioxide from Fossil Fuel-Burning Power Plants with Biological Systems. Energy Conversion and Management. 34 (9-11), 999-1004 (1993).
- Joshi, C., Nookaraju, A. New Avenues of Bioenergy Production from Plants: Green Alternatives to Petroleum. Journal of Petroleum & Environmental Biotechnology. 03 (07), 3(2012).
- Chisti, Y. Constraints to commercialization of algal fuels. Journal of Biotechnology. 22, 166-186 (2013).
- Han, S., Jin, W., Tu, R., Wu, W. Biofuel production from microalgae as feedstock: current status and potential. Critical Reviews in Biotechnology. 35 (2), 255-268 (2015).
- Lam, M., Lee, K. Potential of using organic fertilizer to cultivate Chlorella vulgaris for biodiesel production. Applied Energy. 94, 303-308 (2012).
- de Godos, I., et al. Evaluation of carbon dioxide mass transfer in raceway reactors for microalgae culture using flue gases. Bioresource Technology. 153, 307-314 (2014).
- Posten, C., Schaub, G. Microalgae and terrestrial biomass as source for fuels a process view. Journal of Biotechnology. 142 (1), 64-69 (2009).
- Demirbas, M. Biofuels from algae for sustainable development. Applied Energy. 88 (10), 3473-3480 (2011).
- Shelef, G., Sukenik, A., Green, M. Microalgae Harvesting and Processing A Literature Review. , (1984).
- Pawlowski, A., Mendoza, J., Guzmán, J., Berenguel, J., Acién, F., Dormido, S. Effective utilization of flue gases in raceway reactor with event-based pH control for microalgae culture. Bioresource Technology. 170, 1-9 (2014).
- Zhu, B., Sun, F., Yang, M., Lu, L., Yang, G., Pan, K. Large-scale biodiesel production using flue gas from coal-fired power plants with Nannochloropsis microalgal biomass in open raceway ponds. Bioresource Technology. 174, 53-59 (2014).
- Kaštánek, F., et al. In-field experimental verification of cultivation of microalgae Chlorella sp. using the flue gas from a cogeneration unit as a source of carbon dioxide. Waste Management & Research. 28 (11), 961-966 (2010).
- Yadav, G., Karemore, A., Dash, S., Sen, R. Performance evaluation of a green process for microalgal CO2 sequestration in closed photobioreactor using flue gas generated in-situ. Bioresource Technology. 191, 399-406 (2015).
- Zhao, B., Su, Y., Zhang, Y., Cui, G. Carbon dioxide fixation and biomass production from combustion flue gas using energy microalgae. Energy. 89, 347-357 (2015).
- He, L., Chen, A., Yu, Y., Kucera, L., Tang, Y. Optimize Flue Gas Settings to Promote Microalgae Growth in Photobioreactors via Computer Simulations. Journal of Visualized Experiments. (80), e50718(2013).
- He, L., Subramanian, V., Tang, Y. Experimental analysis and model-based optimization of microalgae growth in photo-bioreactors using flue gas. Biomass and Bioenergy. 41, 131-138 (2012).
- Pidwirny, M. Fundamentals of Physical Geography, 2nd ed. , (2006).
- Van Den Hende, S., Vervaeren, H., Boon, N. Flue gas compounds and microalgae: (Bio-) chemical interactions leading to biotechnological opportunities. Biotechnology Advances. 30 (2012), 1405-1424 (2012).
- Jia, F., Kacira, M., Ogden, K. Multi-wavelength based optical density sensor for autonomous monitoring of microalgae. Sensors (Switzerland). 15 (9), 22234-22248 (2015).
- Unkefer, C., et al. Review of the algal biology program within the National Alliance for Advanced Biofuels and Bioproducts. Algal Research. 22, 187-215 (2017).
- Neofotis, P., et al. Characterization and classification of highly productive microalgae strains discovered for biofuel and bioproduct generation. Algal Research. 15, 164-178 (2016).
- Huesemann, M., Van Wagenen, J., Miller, T., Chavis, A., Hobbs, S., Crowe, B. A screening model to predict microalgae biomass growth in photobioreactors and raceway ponds. Biotechnology Bioengineering. 110 (6), 1583-1594 (2013).
- Huesemann, M., et al. Estimating the Maximum Achievable Productivity in Outdoor Ponds: Microalgae Biomass Growth Modeling and Climate Simulated Culturing. Microalgal Production for Biomass and High-Value Products. 28 (2016), 113-137 (2016).
- Ramezan, M., Skone, T., Nsakala, N., Lilijedahl, G. Carbon Dioxide Capture from Existing Coal-Fired Power Plants. , 268(2007).
- Huesemann, M., et al. A validated model to predict microalgae growth in outdoor pond cultures subjected to fluctuating light intensities and water temperatures. Algal Research. 13, 195-206 (2016).
- Mendoza, J., et al. Fluid-dynamic characterization of real-scale raceway reactors for microalgae production. Biomass and Bioenergy. 54, 267-275 (2013).
- Algae Cultivation for Carbon Capture and Utilization Workshop. Algae Cultivation for Carbon Capture and Utilization Workshop. , (2017).
- Park, J., Craggs, R., Shilton, A. Wastewater treatment high rate algal ponds for biofuel production. Bioresource Technology. 102 (1), 35-42 (2011).
- Mata, T., Martins, A., Caetano, N. Microalgae for biodiesel production and other applications: A review. Renewewable and Sustainable Energy Reviews. 14 (1), 217-232 (2010).
- Qiu, R., Gao, S., Lopez, P., Ogden, K. Effects of pH on cell growth, lipid production and CO2 addition of microalgae Chlorella sorokiniana. Algal Research. 28, 192-199 (2017).
- Molina Grima, E., Fernández, F., Garcıa Camacho, F., Chisti, Y. Photobioreactors: light regime, mass transfer, and scaleup. Journal of Biotechnology. 70 (1-3), 231-247 (1999).
- Padmanabhan, Y. P. Technical insight on the requirements for CO2-saturated growth of microalgae in photobioreactors. 3 Biotech. 7 (2), 1-7 (2017).
- Vonshak, A., Torzillo, G. Environmental Stress Physiology. Handbook of Microalgal Culture. 4 (2007), Chapter 4 57-82 (2007).
- Morales, M., Sánchez, L., Revah, S. The impact of environmental factors on carbon dioxide fixation by microalgae. Federation of European Microbiological Society Microbiology Letters. 365 (3), 1-11 (2018).
- Cuaresma, M., Janssen, M., Vílchez, C., Wijffels, R. Horizontal or vertical photobioreactors? How to improve microalgae photosynthetic efficiency. Bioresource Technology. 102 (8), 5129-5137 (2011).
- Richmond, A., Zou, N. Efficient utilisation of high photon irradiance for mass production of photoautotrophic micro-organisms. Journal of Applied Phycology. 11 (1), 123-127 (1999).
- Kurpan, D., Silva, A., Araújo, O., Chaloub, R. Impact of temperature and light intensity on triacylglycerol accumulation in marine microalgae. Biomass and Bioenergy. 72, 280-287 (2015).
- Maedal, K., Owadai, M., Kimura, N., Karubd, I. CO2 fixation from the flue gas on coal-fired thermal power plant by microalgae To screen microalgac which arc suitable for direct CO2 fixation , microalgae were sampled from. Energy Conversion Managment. 36 (6-9), 717-720 (1995).
- Sakai, N., Sakamoto, Y., Kishimoto, N., Chihara, M., Karube, I. Strain from Hot Springs Tolerant to High Temperature and high CO2. Energy Conversion Managment. 36 (6-9), 693-696 (1995).
- Lam, M., Lee, K., Mohamed, A. Current status and challenges on microalgae-based carbon capture. International Journal of Greenhouse Gas Control. 10, 456-469 (2012).
- Raeesossadati, M., Ahmadzadeh, H., McHenry, M., Moheimani, N. CO2 Bioremediation by Microalgae in Photobioreactors: Impacts of Biomass and CO2 Concentrations, Light, and Temperature. Algal Research. 6, 78-85 (2014).
- Mendoza, J., et al. Oxygen transfer and evolution in microalgal culture in open raceways. Bioresource Technology. 137, 188-195 (2013).
- Carvalho, A., Malcata, F., Meireles, A. Microalgal Reactors A Review of Enclosed System Designs and Performances. Biotechnology Progress. 22 (6), 1490-1506 (2006).
- Pires, J., Alvim-Ferraz, M., Martins, F., Simões, M. Carbon dioxide capture from flue gases using microalgae: Engineering aspects and biorefinery concept. Renewable and Sustainable Energy Reviews. 16 (5), 3043-3053 (2012).
- Lam, M., Lee, K. Microalgae biofuels: A critical review of issues, problems and the way forward. Biotechnology Advances. 30 (3), 673-690 (2012).
- Chisti, Y. Biodiesel from microalgae beats bioethanol. Trends in Biotechnology. 26 (3), 126-131 (2008).
- K̈oppen, W., Volken, E., Brönnimann, S. The Thermal Zones of the Earth According to the duration of Hot, Moderate and Cold Periods and to the Impact of Heat on the Organic. Meteorologische Zeitschrift. 20 (3), 351-360 (2011).
- Lammers, P., et al. Review of the Cultivation Program within the National Alliance for Advanced Biofuels and Bioproducts. Algal Research. 22, 166-186 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados