Method Article
Indução da Modificação das Células Leptomenínias via Injeção Intracisternal
Neste Artigo
Resumo
Descrevemos uma injeção intracisternal que emprega uma agulha dobrada na ponta que pode ser estabilizada no crânio, eliminando assim o risco de dano ao parênquima subjacente. A abordagem pode ser usada para mapeamento do destino genético e manipulações de células leptomeningeais e para rastrear o movimento do fluido cefalorraquidiano.
Resumo
O protocolo aqui descrito descreve como injetar soluções com segurança e manualmente através da cisterna magna, eliminando o risco de danos ao parnchyma subjacente. Protocolos publicados anteriormente recomendam o uso de agulhas retas que devem ser reduzidas a um máximo de 1-2 mm da superfície dural. A queda repentina da resistência uma vez perfurada a membrana dural dificulta a manutenção da agulha em posição constante. Nosso método, em vez disso, emprega uma agulha dobrada na ponta que pode ser estabilizada contra o osso occipital do crânio, impedindo assim que a seringa penetre no tecido após perfuração da membrana dural. O procedimento é simples, reproduzível e não causa desconforto duradouro nos animais operados. Descrevemos a estratégia de injeção intracisternal no contexto do mapeamento do destino genético das células leptomenínias vasculares. A mesma técnica pode, além disso, ser utilizada para abordar uma ampla gama de questões de pesquisa, como sondar o papel das leptomeninges no neurodesenvolvimento e a disseminação da meningite bacteriana, através da ablação genética de genes putativamente implicados nesses fenômenos. Além disso, o procedimento pode ser combinado com um sistema de infusão automatizado para uma entrega constante e usado para rastrear o movimento do fluido cefalorraquidiano através da injeção de moléculas rotuladas fluorescentes.
Introdução
As células leptomeningeais são uma população de células semelhantes ao fibroblasto organizadas em uma camada fina sobrepondo o cérebro e expressando genes implicados na crosslinking de colágeno (por exemplo, Dcn e Lum),e no estabelecimento de uma barreira cérebro-meningeal (por exemplo, Cldn11)1,2. As células leptomenínias estão implicadas em uma ampla gama de funções fisiológicas, desde o controle rigoroso sobre a drenagem do fluido cefalorraquidiano3 até a orientação de progenitores neurais no cérebro em desenvolvimento4,5. Um estudo recente também propôs que as leptomeninges no recém-nascido podem abrigar células radiais semelhantes à glia que migram para o parênquima cerebral e se desenvolvem em neurônios corticais funcionais6.
As células leptomenínias estão localizadas próximas aos astrócitos superficiais e compartilham com elas, assim como outras astroglias parênquias, expressão de connexin-30 (Cx30)7. O procedimento cirúrgico descrito abaixo permite a rotulagem generalizada e específica dessas células meningeais através de uma entrega única de endoxifen na cisterna magna de camundongos transgênicos expressando condicionalmente tdTomato em células Cx30+ (ou seja, usando um sistema CreER-loxP para mapeamento do destino). O endoxifen é um metabólito ativo do Tamoxifen e induz a recombinação de células expressas por CreER da mesma forma que o Tamoxifen. É, no entanto, a solução recomendada para aplicação tópica porque se dissolve em 5-10% DMSO, em vez de altas concentrações de etanol. Além disso, o endoxifen não atravessa a barreira cérebro-meningeal, permitindo assim uma recombinação específica de células leptomeningeais, sem rotular a população cx30+ astroglial subjacente (ver Resultados Representativos).
A técnica aqui apresentada visa injetar manual e seguramente o composto no fluido cefalorraquidiano, via acesso direto à cisterna magna. Ao contrário de outros procedimentos mais invasivos que requerem craniotomia, esta abordagem permite infundir compostos sem causar danos ao crânio ou ao parequima cerebral. Assim, não está associada à indução de reações inflamatórias desencadeadas pela ativação de células glia parenquiais. Semelhante a outras estratégias de injeção descritas antesde 8,9,10, a abordagem presente baseia-se na exposição cirúrgica da membrana dural atlanto-occipital que cobre a cisterna magna, após dissecção contundente dos músculos do pescoço sobreposto. No entanto, ao contrário de outros procedimentos, recomendamos o uso de uma agulha dobrada na ponta, que pode ser estabilizada contra o osso occipital durante a administração. Isso evitará que a agulha penetre muito fundo e prejudique o cerebelo subjacente e a medula.
Este procedimento cirúrgico é compatível com investigações de rastreamento de linhagem que visam mapear mudanças nas identidades celulares e rotas migratórias através de camadas parêmicas. Também pode ser adaptado a estudos de ablação genética que pretendem sondar o papel das células leptomeningeais na saúde e na doença, como sua contribuição para o desenvolvimento cortical5 ou a disseminação da meningite bacteriana3,11. Finalmente, pode ser utilizado para rastrear o movimento do fluido cefalorraquidiano quando combinado com a entrega de rastreadores fluorescentes em animais do tipo selvagem.
Protocolo
Os procedimentos cirúrgicos apresentados foram aprovados pela Estocolmo Norra Djurförsöksetiska Nämnd e realizados de acordo com as especificações fornecidas pelo instituto de pesquisa (Instituto Karolinska, Suécia).
NOTA: A injeção intracisternal pode ser adaptada de forma flexível para múltiplos fins de pesquisa. Apresentamos abaixo um procedimento desenvolvido para rotular eficientemente as células leptomeningeais para mapeamento do destino com base na injeção de endoxifen em uma linha de rato transgênica que transporta R26R-tdTomato12 e CreER, este último sob o promotor Cx3013. A rotulagem dessa população de células pode ser obtida através da injeção de construtos virais utilizando o mesmo procedimento descrito abaixo. Finalmente, esta abordagem pode ser empregada para rastrear o fluxo de fluido cefalorraquidiano, por infusão de rastreadores fluorescentes.
1. Preparação do Sistema de Injeção
NOTA: Recomendamos a realização do procedimento em uma sala cirúrgica adequada e em condições assépticas. As ferramentas cirúrgicas podem ser esterilizadas usando calor (autoclave, esterilizador de fibra de vidro) ou higienizadas usando um desinfetante químico de alto nível se forem sensíveis ao calor. Enxágüe os instrumentos antes de usar ao empregar desinfecção química ou permita-os esfriar quando higienizados com calor.
- Com fórceps, dobre a agulha da seringa de injeção a 30° a 3 mm da ponta.
NOTA: Use seringas Hamilton com uma agulha chanfrada de 30 G. - Prepare 1 mg/mL de solução endoxifen, diluída em 10% DMSO e encha a seringa com a agulha dobrada.
NOTA: Administrar 5 μL do composto para garantir a exposição generalizada de células meningeais no camundongo C57Bl/6j adulto (ca. 25-30 g), embora experimentos piloto que testem diferentes concentrações e volumes de injeção possam ser necessários no tratamento de animais de diferentes idades e cepas. - Ajuste o suporte da cabeça do mouse de modo que o pedaço da boca esteja a aproximadamente 30° da superfície da mesa cirúrgica.
NOTA: Um quadro estereotático com fixação de três pontos (ou seja, orelhas e boca) também pode ser usado para este procedimento. Neste caso, porém, o animal só será fixado com o pedaço da boca, enquanto as barras de ouvido podem ser estendidas sob os membros dianteiros do animal e ser usadas para apoiar o corpo do animal durante o procedimento.
2. Indução da Anestesia
- Para anestésicos injetáveis, utilize concentrações e modos de administração recomendados pela unidade veterinária da instituição local.
- Para anestésicos inalacionais, como isoflurano, prepare a unidade de administração de acordo com as especificações do fabricante.
- Com isoflurano, definir a concentração do composto em 4% para indução de anestesia.
- Entregar ar a uma taxa de 400 mL/min.
- Deixe a unidade de anestesia encher a câmara com o anestésico por alguns minutos e coloque o mouse na câmara depois.
NOTA: Para os presentes experimentos, usamos camundongos transgênicos adultos (>2 meses e aproximadamente 30 g) masculinos e femininos que transportam Cx30-CreER e R26R-tdTomato, e criados em um fundo C57Bl/6j. - Monitore o animal durante a indução da anestesia. O padrão de respiração deve diminuir quando o mouse estiver sob anestesia total.
- Retire o animal da câmara e verifique se há supressão do reflexo da pata apertando delicadamente as patas traseiras.
NOTA: O reflexo ainda pode estar presente, mas atrasou alguns segundos. Se esse for o caso, coloque o animal de volta na câmara até que a supressão completa do reflexo da pata tenha sido alcançada. - Administrar analgésico (por exemplo, Carprofeno, 5 mg/kg através de injeção subcutânea) para auxiliar o tratamento da dor pós-operatória.
3. Posicionamento do Animal para o Procedimento
- Fixar a cabeça do animal no porta-cabeças. Para melhorar a acessibilidade à cisterna magna, posicione o corpo do animal a aproximadamente 30° da superfície da mesa e da cabeça intitulada para baixo, para estabelecer um ângulo de 120° com o resto do corpo e estender a parte de trás do pescoço para facilitar o acesso à cisterna magna(Figura 1A).
- Adicione toalhas de papel por baixo do animal para apoiar seu corpo durante todo o procedimento.
- Segure a entrega de anestesia através do bocal e reduza a concentração de isoflurano para 2,5% e a entrega de ar para 200 ml/min.
- Aplique pomada oftálmica.
4. Exposição da Cisterna Magna
- Raspe a parte de trás do pescoço do animal e higienize a área com 70% de etanol e Betadine.
- Utilizando uma tesoura cirúrgica, realize uma incisão midline (cerca de 7 mm de comprimento) começando no nível do osso occipital e estendendo-o posteriormente.
- Separe suavemente os músculos conjuntivos superficiais e os músculos do pescoço puxando lateralmente da linha média com pinças de ponta finas. Isso exporá a membrana dural sobrepondo a cisterna magna, em forma de triângulo invertido.
- Use lanças de absorção estéreis ou cotonetes de algodão para controlar qualquer sangramento resultante.
- Posicione um pequeno separador cirúrgico para manter os músculos do pescoço puxados para fora e possibilitar a visualização da cisterna magna durante todo o procedimento.
5. Injeção Intracisternal
- Para ter acesso à cisterna magna, identifique a extremidade caudal do osso occipital e insira a agulha que antes estava dobrada imediatamente por baixo.
NOTA: Haverá uma queda repentina na resistência à medida que a membrana dural for perfurada. No entanto, a ponta da agulha só penetrará ligeiramente sob a superfície meningeal, graças à sua forma enganchando. - Uma vez perfurada a dura dura, permita que a ponta dobrada da agulha penetre sob a superfície dural puxando suavemente a seringa para cima e paralelamente ao corpo do animal, a fim de "enganchar" a agulha no crânio (ver Figura 1B). Isso garantirá uma melhor estabilidade e evitará que a agulha penetre mais fundo, evitando assim o risco de danificar o cerebelo subjacente ou a medula.
- Injete o composto lentamente para evitar interferência suspito do fluxo natural do fluido cefalorraquidiano.
NOTA: Dependendo do propósito do experimento, a taxa de infusão pode variar. Se for necessária uma taxa de infusão lenta e constante (por exemplo, ao usar o procedimento para rastrear o movimento do fluido cefalorraquidiano), pode ser aconselhável usar um sistema de microinfusão automatizado em combinação com a seringa. - Após a injeção, deixe a agulha descansar no local por 1 min e remova-a cuidadosamente. Use fórceps de ponta fina para ajudar a retração da agulha de sua posição enganchando.
NOTA: O uso de uma agulha fina (por exemplo, 30 G) não leva a danos substanciais da membrana meningeal, e consequente saída do fluido cefalorraquidiano. Se forem necessários tamanhos maiores de agulha, recomendamos parar o vazamento de fluido, aplicando pressão no local da injeção usando uma ponta de algodão estéril.
6. Concluir o Procedimento e os Cuidados Pós-Operatórios
- Remova o separador e deixe que os músculos voltem à sua posição original sobrepondo a membrana dural.
- Feche a incisão cutânea usando algumas gotas de adesivo cianoacrilato.
NOTA: Alternativamente, utilize suturas absorvíveis (por exemplo, 5-0 suturas de vicril) e feche a incisão cutânea com pontos interrompidos. - Aplique anestésico local (por exemplo, 100 μL de 5% de lidocaína) no local da incisão.
- Retire o animal do suporte e coloque em uma gaiola limpa posicionada sobre uma almofada de aquecimento. Monitore o animal até que ele recupere a consciência.
NOTA: Não se espera que o procedimento cause dor ou angústia duradoura no animal. No entanto, o camundongo deve ser monitorado de perto durante os primeiros dias pós-operatórios e medidas de alívio da dor podem ser realizadas sempre que necessário, e de acordo com as recomendações fornecidas pela unidade veterinária de sua instituição.
Resultados
A injeção intracisternal de endoxidos em camundongos transgênicos que expressam CreER sob o promotor Cx3013 e um repórter fluorescente induível permite uma recombinação específica de células leptomenínias sem rotular a superfície de expressão cx30 e os astrócitos parêmicos no córtex(Figura 1). Para ter acesso à cisterna magna, o animal anestesiado é posicionado com seu corpo e sua cabeça em um ângulo de aproximadamente 120°, permitindo assim que a parte de trás do pescoço seja esticada(Figura 1A). A porção atlanto-occipital da membrana dural é então exposta através de dissecção contundente dos músculos do pescoço, ganhando assim acesso à cisterna magna subjacente. Uma injeção manual segura é realizada com uma agulha dobrada a aproximadamente 30° a 3 mm da ponta. Isso permite que a seringa seja mantida contra o osso occipital do crânio, melhorando assim a estabilidade durante a administração (Figura 1B). Aproveitando o movimento fisiológico do fluido cefalorraquidiano, a solução endoxifen é distribuída por todo o espaço subaracnóideo para recombinar eficientemente as células leptomenínias sobrepondo lâmpadas olfativas, córtex e cerebelo(Figura 1C). Como demonstrado na Figura 1,a solução não atravessa a barreira cérebro-meninge e não entra em contato com células astrogliais do parênquima, ao contrário da administração sistêmica através de gavage oral (2 mg/mL por dia, em cinco dias consecutivos; Figura 1C-E).
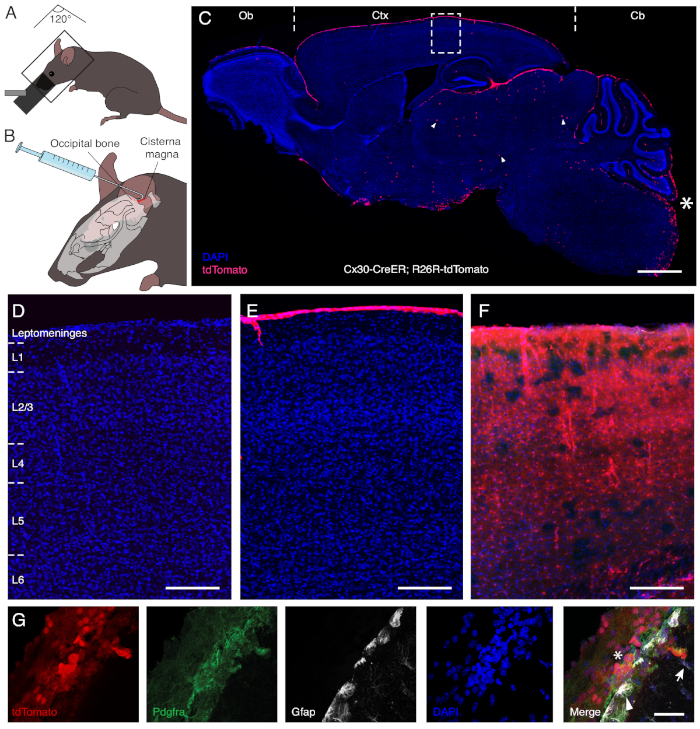
Figura 1: Rotulagem específica de células leptomeningeais através de injeção intracisternal de endoxifen. Os painéis A e B ilustram o procedimento desenvolvido para administração intracisternal. Para ter acesso à cisterna magna, a parte de trás do pescoço deve ser esticada. O animal anestesiado está, portanto, posicionado em um ângulo aproximado de 120° entre o corpo e a cabeça, que está inclinado para baixo(A). A agulha enganchada permite fixar a seringa ao crânio e proceder com segurança com uma administração manual da solução (B). O painel C exibe uma seção sagital do cérebro após administração intracisternal de endoxifen em um modelo de rato transgênico que carrega CreER sob o promotor Cx30 e expressão induzida de repórter fluorescente tdTomato. O asterisco (*) marca o local da injeção e demonstra a ausência de danos operacionais após o procedimento. O endoxifen induz seletivamente a recombinação genética e a expressão genética do repórter em células na camada meningeal sobrepondo a lâmpada olfativa (Ob), córtex (Ctx) e cerebelo (Cb). Apenas alguns astrócitos no cérebro médio (ponta de flecha) são recombinados após a entrega intracisternal de endoxifen. Os painéis D-F são ampliações da área encaixotada em C em animais tratados com solução veicular (D),submetidos à injeção intracisternal de endoxifen(E),ou tratados sistematicamente através de gavage oral(F). Considerando que a administração intracisternal rotula especificamente as células das leptomeningas, a entrega sistêmica também leva à recombinação de astrócitos expressos em Cx30 em todas as camadas corticais (L1 a L6). O Painel G ilustra a recombinação de células leptomeningeais (asterisco), identificadas através da reatividade de Pdgfra, após injeção intracisternal. Em contraste, a superfície (ponta de flecha) e os astrócitos parenquimal (seta) que expressam Gfap permanecem sem rótulo. Barras de escala = 1.000 μm(C),150 μm(D-F)e 40 μm(G). Clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo aqui descrito apresenta um procedimento simples e reprodutível para rotular células leptomeningeais para mapeamento do destino. Utilizamos injeção intracisternal de endoxifen, um metabólito ativo de Tamoxifen, para induzir a expressão do repórter fluorescente tdTomato em Cx30-CreER; Ratos R26R-tdTomato12,13.
Em comparação com outros protocolos usados para obter acesso ao fluido cefalorraquidiano através da cisterna magna9,nossa abordagem garante uma administração manual segura graças ao uso de uma agulha dobrada que pode ser estabilizada ao osso occipital do crânio. Uma vez que a membrana dural da cisterna magna é perfurada, há uma queda súbita de resistência. Neste ponto, outros protocolos recomendam baixar a agulha para um máximo de 1-2 mm da superfície dural e mantê-la manualmente em posição estável durante todo o procedimento9. Ao contrário de uma agulha reta, a agulha presa ao crânio é presa ao crânio e não pode penetrar mais fundo no tecido, eliminando assim o risco de danificar o cerebelo subjacente ou medula. Nosso sistema viciado permite uma administração mais segura da solução, especialmente quando se usa uma taxa lenta de infusão.
O procedimento aqui descrito não deve causar desconforto duradouro ao animal operado. Deve-se ter cuidado, no entanto, ao administrar grandes volumes de solução. Uma taxa de entrega rápida pode levar a alterações na pressão intracraniana e ao desenvolvimento de sintomas neurológicos no camundongo. Sugerimos injetar volumes de até 5-10 μL para evitar esse risco ou montar a seringa em um micromanipulador que tenha controle sobre a taxa de entrega. Isso é particularmente importante ao adaptar este procedimento ao estudo do movimento do fluido cefalorraquidiano. Recomenda-se evitar a injeção manual e usar uma taxa lenta de infusão (por exemplo, 1 μL/min) para evitar perturbações excessivas do fluxo fisiológico. Além disso, o presente protocolo foi projetado para realizar uma única injeção intracisternal, que rotula eficientemente as células leptomeningeais. Recomendamos considerar as especificações éticas, bem como a capacidade do animal de suportar múltiplos procedimentos cirúrgicos, caso o estudo exija administração repetida de compostos.
Além da administração endoxifen, a técnica aqui descrita pode ser combinada com a entrega de vírus portadores de genes de repórter sob um promotor específico de células leptomeningeais. Além disso, o presente sistema de entrega pode ser utilizado para o rastreamento agudo do fluxo do fluido cefalorraquidiano10. Para isso, rastreadores fluorescentes como Cell Tracker (ca. 700 Da) ou Dextran Fluorescin (ca. 3000 Da) podem ser entregues através da cisterna magna, e a seringa pode ser montada em um micromanipulador para permitir o controle sobre a taxa de infusão do composto. Isso pode ser importante para evitar perturbações excessivas do movimento natural do fluido cefalorraquidiano em experimentos de rastreamento.
As células leptomenínias expressam claudin-11 e outras proteínas associadas a junções apertadas, que contribuem para o estabelecimento de uma barreira de fluido helêfalo-cefalorraquidiano no espaço subaracnóideide e para o controle homeostático da circulação de fluidos e nutrientes3. A abordagem aqui descrita pode ser combinada com a bladade condicional de genes implicados no controle juncional da barreira para sondar seu papel putativo na manutenção da composição estritamente regulada do fluido cefalorraquidiano. Além disso, as células das leptomeningas desempenham um papel no desenvolvimento, onde fornecem sinais extrínsecos que contribuem para a geração de neurônios corticais5 e a formação de conexões calosais4. Nosso método também pode ser adaptado para obter mais informações sobre o papel das leptomeninges no desenvolvimento cortical correto e na descoberta de caminhos axonais. Finalmente, bactérias como neisseria meningitidis têm se mostrado ligadas às células leptomeningeis humanas14, e modelos animais para a doença foram desenvolvidos para estudar a invasão bacteriana e os danos neurológicos resultantes15,16, embora os ligantes superficiais responsáveis pela infecção ainda não tenham sido totalmente determinados. A recombinação seletiva de células leptomeningeais alcançadas com nossa técnica poderia ajudar na identificação dos locais de adesão usados pelas bactérias para infectar o espaço subaracnóideo. Note-se que o protocolo aqui apresentado pode exigir modificações para dar conta dos requisitos éticos e de segurança adicionais necessários para a realização de procedimentos que impliquem infecções bacterianas.
Em conclusão, a injeção intracisternal aqui descrita representa uma abordagem cirúrgica simples e bem tolerada que oferece a oportunidade de investigar uma ampla gama de funções de fluidoletomeníngue e cefalorraquidiano, quando combinada com abordagens de edição de genes ou infusão de moléculas rotuladas.
Divulgações
Os autores não declaram interesses concorrentes.
Agradecimentos
Este estudo foi apoiado por subsídios do Conselho Sueco de Pesquisa, da Sociedade Sueca de Câncer, da Fundação Sueca de Pesquisa Estratégica, de Knut och Alice Wallenbergs Stiftelse e do Programa de Pesquisa Estratégica em Células-Tronco e Medicina Regenerativa do Instituto Karolinska (StratRegen).
Materiais
| Name | Company | Catalog Number | Comments |
| Anesthesia unit | Univentor 410 | 8323102 | Complete of vaporizer, chamber, and tubing that connects to chamber and mouse head holder |
| Anesthesia (Isoflurane) | Baxter Medical AB | 000890 | |
| Betadine | Sigma-Aldrich | PVP1 | |
| Carprofen | Orion Pharma AB | 014920 | Commercial name Rymadil |
| Cyanoacrylate glue | Carl Roth | 0258.1 | Use silk 5-0 sutures, in alternative |
| Medbond Tissue Glue | Stoelting | 50479 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Endoxifen | Sigma-Aldrich | E8284 | |
| Ethanol 70% | Histolab | 01370 | |
| Hamilton syringe (30 G beveled needle) | Hamilton | 80300 | |
| Lidocaine | Aspen Nordic | 520455 | |
| Mouse head holder | Narishige International | SGM-4 | With mouth piece for inhalational anhestetics. Alternatively, use a stereotactic frame |
| Scissors | Fine Science Tools | 15009-08 | |
| Shaver | Aesculap | GT420 | |
| Sterile absorption spears | Fine Science Tools | 18105-01 | Sterile cotton swabs are also a good option |
| Surgical separator | World Precision Instrument | 501897 | |
| Tweezers | Dumont | 11251-35 | |
| Viscotears | Bausch&Lomb Nordic AB | 541760 |
Referências
- Vanlandewijck, M., et al. A molecular atlas of cell types and zonation in the brain vasculature. Nature. 554 (7693), 475-480 (2018).
- Whish, S., et al. The inner CSF-brain barrier: developmentally controlled access to the brain via intercellular junctions. Frontiers in Neuroscience. 9, 16(2015).
- Weller, R. O., Sharp, M. M., Christodoulides, M., Carare, R. O., Mollgard, K. The meninges as barriers and facilitators for the movement of fluid, cells and pathogens related to the rodent and human CNS. Acta Neuropathologica. 135 (3), 363-385 (2018).
- Choe, Y., Siegenthaler, J. A., Pleasure, S. J. A cascade of morphogenic signaling initiated by the meninges controls corpus callosum formation. Neuron. 73 (4), 698-712 (2012).
- Siegenthaler, J. A., et al. Retinoic acid from the meninges regulates cortical neuron generation. Cell. 139 (3), 597-609 (2009).
- Bifari, F., et al. Neurogenic Radial Glia-like Cells in Meninges Migrate and Differentiate into Functionally Integrated Neurons in the Neonatal Cortex. Cell Stem Cell. 20 (3), 360-373 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins? FEBS Letters. 588 (8), 1259-1270 (2014).
- Ramos, M., et al. Cisterna Magna Injection in Rats to Study Glymphatic Function. Methods in Molecular Biology. 1938, 97-104 (2019).
- Xavier, A. L. R., et al. Cannula Implantation into the Cisterna Magna of Rodents. Journal of Visualized Experiments. (135), (2018).
- Iliff, J. J., et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Coureuil, M., Lecuyer, H., Bourdoulous, S., Nassif, X. A journey into the brain: insight into how bacterial pathogens cross blood-brain barriers. Nature Reviews Microbiology. 15 (3), 149-159 (2017).
- Madisen, L., et al. Transgenic mice for intersectional targeting of neural sensors and effectors with high specificity and performance. Neuron. 85 (5), 942-958 (2015).
- Slezak, M., et al. Transgenic mice for conditional gene manipulation in astroglial cells. Glia. 55 (15), 1565-1576 (2007).
- Hardy, S. J., Christodoulides, M., Weller, R. O., Heckels, J. E. Interactions of Neisseria meningitidis with cells of the human meninges. Molecular Microbiology. 36 (4), 817-829 (2000).
- Colicchio, R., et al. The meningococcal ABC-Type L-glutamate transporter GltT is necessary for the development of experimental meningitis in mice. Infection and Immunity. 77 (9), 3578-3587 (2009).
- Ricci, S., et al. Inhibition of matrix metalloproteinases attenuates brain damage in experimental meningococcal meningitis. BMC Infectious Diseases. 14, 726(2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados