Method Article
내분비주주입을 통한 렙토메닝 세포 변형 유도
요약
우리는 두개골에 안정될 수 있는 끝에 바늘을 구부린, 따라서 근본적인 자렌치에 손상의 리스크를 제거하는 intracisternal 주입을 기술합니다. 이 접근법은 렙토메닝 세포의 유전적 운명 매핑 및 조작및 뇌척수액 이동 추적에 사용될 수 있습니다.
초록
여기에 설명된 프로토콜은 기본 자렌치마에 손상을 줄 위험을 제거하면서 시스터나 마그나를 통해 솔루션을 안전하고 수동으로 주입하는 방법을 설명합니다. 이전에 게시된 프로토콜은 경면에서 최대 1-2mm로 낮혀야 하는 직선 바늘을 사용하는 것이 좋습니다. 경막이 뚫리면 저항이 급격히 떨어지면 바늘을 일정한 위치에 유지하기가 어려워집니다. 우리의 방법은 대신, 두개골의 후두 뼈에 대해 안정화 될 수있는 끝에 바늘구부러진 바늘을 사용하여 주사기가 경막 의 천공 후 조직으로 침투하는 것을 방지합니다. 이 절차는 간단하고 재현 가능하며 수술 된 동물에게 오래 지속되는 불편 함을 일으키지 않습니다. 우리는 혈관 렙토메닝 세포의 유전 운명 매핑의 맥락에서 내분비증 주입 전략을 기술합니다. 동일한 기술은, 또한, 신경 발달에 있는 leptomeninges의 역할을 탐구하고 세균성 뇌막염의 퍼짐과 같은 광범위한 연구 질문을, 이러한 현상에 연루된 유전자의 유전 절제를 통해 이용될 수 있습니다. 또한, 절차는 일정한 납품을 위한 자동화된 주입 시스템과 결합되고 형광표지된 분자의 주입을 통해 뇌척수액 운동을 추적하는 데 이용될 수 있습니다.
서문
렙토메닝 세포는 뇌를 오버레이하고 콜라겐 가교(예를 들어, Dcn 및 Lum)에연루된 유전자를 표현하는 얇은 층으로 구성된 섬유아세포와 같은 세포 집단이며, 뇌-수막 장벽(예를 들어, Cldn11)1,,2. 렙토메닝 세포는 뇌척수액배수에 대한 엄격한 통제로부터 뇌의 발달 뇌에서 신경 전구체의 지도에 이르기까지 광범위한 생리 기능에 연루되어4,,5. 최근 연구는 또한 신생아에 있는 leptomeninges 두뇌 자영으로 이동하고 기능적인 피질 신경으로 발전하는 방사형 glia 같이 세포를 항구할 수 있다는 것을 제안했습니다6.
렙토메닝 세포는 표면 성상 세포에 근접하여 위치하며, 그들과 공유하며, 다른 실치형 천체, 코넥신-30(Cx30)의 발현도7. 아래에 설명된 외과 적 절차는 Cx30+ 세포에서 tdTomato를 조건부로 발현하는 형질전환 마우스의 시스터나 마그나로 엔도시펜의 일회성 전달을 통해 이러한 수막 세포의 광범위하고 구체적인 라벨링을 허용합니다 (즉, 운명 매핑을 위한 CreER-loxP 시스템을 사용하여). 엔도시펜은 타목시펜의 활성 대사 산물이며 타목시펜과 같은 방식으로 CreER 발현 세포의 재조합을 유도합니다. 그러나 고농도의 에탄올 대신 5-10% DMSO에 용해되기 때문에 국소 적용에 권장되는 솔루션입니다. 추가적으로, endoxifen는 두뇌 수막 장벽을 교차하지 않으며, 그것으로 근본적인 Cx30+ 천체 집단의 표지 없이 렙토메닝 세포의 특정 재조합을 가능하게 합니다 (대표 결과참조).
여기에 제시 된 기술은 수동으로 안전하게 시스터나 마그나에 직접 액세스를 통해 뇌척수액에 화합물을 주입하는 것을 목표로합니다. 다른 달리, 개두술을 필요로 하는 더 침략적인 절차, 이 접근은 두개골 또는 두뇌 sarenchyma에 손상을 일으키는 원인이 되지 않고 화합물을 주입하는 것을 허용합니다. 따라서, 그것은 실화 신경교 세포의 활성화에 의해 유발 된 염증 반응의 유도와 연관되지 않습니다. 8,9,910이전에 설명된 다른 주사전략과유사하게, 본 접근법은 목 근육을 둔하게 해부한 후, 시스터나 마그나를 덮는 아틀란토 후두막의 외과적 노출에 의존한다. 그러나 다른 절차와 달리 투여 중 후두 뼈에 대해 안정화 될 수있는 팁에 바늘을 구부려 사용하는 것이 좋습니다. 이것은 바늘이 너무 깊게 관통하고 근본적인 소뇌 및 수질손상을 손상하는 리스크를 방지할 것입니다.
이 외과 적 절차는 실치층을 통해 세포 정체성 및 마이그레이션 경로의 변화를 매핑하는 것을 목표로 하는 계보 추적 조사와 호환됩니다. 또한 피질 발달에 대한 그들의 기여또는 세균성 뇌막염의 확산과 같은 건강과 질병에서 렙토메닝 세포의 역할을 탐구하려는 유전적 절제 연구에 적응될 수 있다33,11.5 마지막으로, 야생형 동물의 형광 추적자의 전달과 결합될 때 뇌척수액 의 움직임을 추적하는 데 활용될 수 있다.
프로토콜
이로써 제시 된 외과 절차는 스톡홀름 노라 Djurförsöksetiska Nämnd에 의해 승인및 연구 기관 (카롤린스카 연구소, 스웨덴)에서 제공하는 사양에 따라 수행되었다.
참고: 인종 차별 적 주입은 여러 연구 목적을 위해 유연하게 적응 할 수 있습니다. 우리는 R26R-tdTomato12 및 CreER를 운반하는 형질전환 마우스 라인에서 엔도시펜의 주입에 기초하여 운명 매핑을 위한 렙토메닝 세포를 효율적으로 표지하기 위해 개발된 절차 아래에 제시하고, Cx30프로모터(13)에의하여 후자. 세포의 이 인구의 표시는 아래에 설명된 동일한 절차를 사용하여 바이러스 성 구조의 주입을 통해 달성될 수 있습니다. 마지막으로,이 접근법은 형광 추적기의 주입에 의해 뇌척수액 흐름을 추적하는 데 사용될 수 있습니다.
1. 주입 시스템의 준비
참고: 우리는 적절한 수술실에서, 그리고 무균 조건에서 절차를 수행하는 것이 좋습니다. 수술 도구는 열 (오토 클레이브, 유리 비드 살균기)을 사용하여 살균하거나 열에 민감한 경우 높은 수준의 화학 소독제를 사용하여 살균 할 수 있습니다. 화학 소독을 할 때 사용하기 전에 기기를 헹구거나 열로 소독할 때 식히십시오.
- 집게를 사용하여 주사기의 바늘을 팁에서 3mm에서 30°로 구부립니다.
참고: 30G 의 베벨 바늘로 해밀턴 주사기를 사용하십시오. - 10% DMSO로 희석한 엔도시펜 용액 1 mg/mL을 준비하고 구부러진 바늘로 주사기를 채웁니다.
참고 : 성인 C57Bl / 6j 마우스 (ca. 25-30g)에서 수막 세포의 광범위한 노출을 보장하기 위해 화합물의 5 μL을 투여하지만 다른 연령과 균주의 동물을 치료할 때 다른 농도와 주사 량을 테스트하는 파일럿 실험이 필요할 수 있습니다. - 마우스 헤드 홀더를 조정하여 마우스 조각이 수술 테이블 표면에서 약 30°에 있도록 합니다.
참고: 3점 고정이 있는 입체 프레임(즉, 귀와 입)도 이 절차에 사용할 수 있습니다. 그러나 이 경우 동물은 입으로만 고정되는 반면, 이어 바는 동물의 앞다리 아래에 확장될 수 있으며 시술 중에 동물의 신체를 지탱하는 데 사용할 수 있습니다.
2. 마취의 유도
- 주 사용 마 테 에 대 한, 농도 사용 하 고 지역 기관에서 수의 단위에 의해 권장 하는 관리의 모드.
- 이소플루란과 같은 흡입 마취제의 경우 제조업체의 사양에 따라 관리 장치를 준비하십시오.
- 이소플루란과 함께 마취 유도를 위해 화합물의 농도를 4 %로 설정하십시오.
- 400 mL /min의 속도로 공기를 전달합니다.
- 마취 장치가 몇 분 동안 마취실로 챔버를 채우고 나중에 챔버에 마우스를 놓습니다.
참고: 본 실험을 위해, 우리는 Cx30-CreER 및 R26R-tdTomato를 운반하는 성인 (>2 개월 및 약 30 g) 수컷 및 여성 형질전환 마우스를 사용하고 C57Bl/6j 배경에서 사육하였다. - 마취의 유도 하는 동안 동물을 모니터링. 마우스가 완전한 마취하에 있을 때 호흡 패턴은 느려져야 합니다.
- 챔버에서 동물을 제거하고 뒷발을 섬세하게 꼬집어 발 반사의 억제를 확인합니다.
참고: 반사는 여전히 존재하지만 몇 초 지연 될 수 있습니다. 이 경우, 발 반사의 완전한 억제가 달성 될 때까지 챔버에 다시 동물을 배치합니다. - 진통 (예를 들어, 카프로펜, 피하 주사를 통해 5 mg / kg)을 투여하여 수술 후 통증 관리를 돕습니다.
3. 절차에 대한 동물의 위치
- 동물의 머리를 머리 홀더에 고정합니다. 시스터나 마그나에 대한 접근성을 향상시키기 위해, 동물의 몸을 테이블 표면에서 약 30°로 위치시키고 머리 아래쪽을 향하여 몸의 나머지 부분과 120°의 각도를 설정하고 목 뒤쪽을 확장하여 시스테르나 마그나에 쉽게 접근할 수 있도록합니다(그림 1A).
- 시술 내내 몸의 지탱을 위해 동물 밑에 종이 타월을 추가하십시오.
- 구강 조각을 통해 마취 전달을 확보하고 이소플루란 농도를 2.5%로 낮추고 공기 전달을 200 ml/min로 줄입니다.
- 안과 연고를 바르고 있습니다.
4. 시스테르나 마그나의 노출
- 동물의 목 뒤쪽을 면도하고 70 % 에탄올과 베타 딘으로 부위를 살균하십시오.
- 외과 용 가위를 사용하여 후두 뼈 의 수준에서 시작하여 후방으로 연장하는 중간 선 절개 (길이 7mm)를 수행하십시오.
- 미세한 팁 핀셋으로 중간선에서 옆으로 당기는 피상적 결합 조직과 목 근육을 부드럽게 분리합니다. 이것은 거꾸로 된 삼각형모양의 시스터나 마그나를 오버레이하는 경막막을 드러날 것입니다.
- 멸균 흡수 창이나 면봉을 사용하여 출혈을 조절하십시오.
- 목 근육을 옆으로 당기고 시스터나 마그나의 시각화를 가능하게하기 위해 작은 수술 분리기를 배치하십시오.
5. 인종 차별 주사
- 시스터나 마그나에 접근하려면 후두 뼈의 꼬리 끝을 식별하고 이전에 바로 밑에 구부러진 바늘을 삽입하십시오.
참고: 경막이 뚫리면 저항이 갑자기 떨어질 것입니다. 그러나, 바늘의 끝은 수막 표면 의 밑에 약간 관통할 것입니다, 그것의 후크 모양 덕분에. - 경막이 천공되면, 바늘의 구부러진 끝이 주사기를 위쪽으로 부드럽게 당겨 서 경도 표면 아래에 침투하게하고 동물의 몸에 평행하게 하여 바늘을 두개골에 "후크"합니다 (그림 1B참조). 이것은 더 나은 안정성을 보장하고 따라서 근본적인 소뇌 또는 수질손상의 리스크를 피하기 위하여 더 깊은 침투에서 바늘을 방지할 것입니다.
- 뇌척수액의 자연적인 흐름과의 간섭을 피하기 위해 화합물을 천천히 주입하십시오.
참고: 실험의 목적에 따라 주입 속도가 다를 수 있습니다. 느리고 꾸준한 주입 속도가 필요한 경우 (예 : 뇌척수액 움직임을 추적하는 절차를 사용할 때), 주사기와 함께 자동 미세 주입 시스템을 사용하는 것이 좋습니다. - 주입 후 바늘을 1 분 동안 사이트에 놓고 조심스럽게 제거하십시오. 후크 된 위치에서 바늘의 후퇴를 돕기 위해 미세 팁 집게를 사용합니다.
참고: 얇은 바늘 (예를 들어, 30 G)의 사용은 수막막의 실질적인 손상으로 이어지지 않으며 뇌척수액의 결과적으로 유출을 유발하지 않습니다. 더 큰 바늘 크기가 필요한 경우 멸균 면 팁을 사용하여 사출 부위에 압력을 가하여 유체 누출을 중지하는 것이 좋습니다.
6. 수술 후 진료의 결말
- 분리기를 제거하고 근육이 경막을 덮어 원래 위치로 돌아갈 수 있도록 하십시오.
- 시아노아크릴레이트 접착제 몇 방울을 사용하여 피부 절개를 닫습니다.
참고: 또는 흡수성 봉합사(예: 5-0 vicryl 봉합사)를 사용하고 중단된 바늘로 피부 절개를 닫습니다. - 절개 부위에 국소 마취제 (예를 들어, 5 % 리도카인 의 100 μL)를 적용하십시오.
- 동물을 홀더에서 꺼내 난방 패드에 놓인 깨끗한 케이지에 놓습니다. 동물이 의식을 되찾을 때까지 동물을 모니터링합니다.
참고: 절차는 동물에 있는 오래 지속되는 고통 또는 고민을 일으키는 원인이 될 것으로 예상되지 않습니다. 그럼에도 불구 하 고, 마우스는 첫 번째 수술 후 일 동안 밀접 하 게 모니터링 해야 하 고 통증 완화 조치 필요할 때마다 착수 될 수 있습니다., 그리고 기관에서 수의 단위에서 제공 하는 권고에 따라.
결과
Cx30프로모터(13)와 유도성 형광 리포터 하에서 CreER를 발현하는 형질전환 마우스에서 엔독시펜의 내분은 피질내의 인접한 Cx30 발현 표면 및 parenchymal 성상세포에 라벨을 붙이지 않고 렙토메닝 세포의 특이적인 재조합을 허용한다(도1). 시스터나 마그나에 접근하기 위해 마취 된 동물은 몸과 머리를 약 120 °의 각도로 배치하여 목 뒤쪽을 뻗을 수 있습니다(그림 1A). 경막의 아틀란토 후두 부분은 목 근육의 무딘 해부를 통해 다음 노출, 따라서 기본 cisterna 마그나에 대한 액세스를 얻고. 안전한 수동 분사는 팁에서 3mm에서 약 30 °로 구부러진 바늘로 수행됩니다. 이것은 두개골의 후두 뼈에 대하여 주사기를 붙일 수 있게 하고, 따라서 투여 도중 안정성을 향상시키다(그림 1B). 뇌척수액의 생리학적 움직임을 활용하면, 엔도시펜 용액은 지주막 공간 전체에 분포되어 후각 전구, 피질 및 소뇌를 오버레이하는 렙토메링 세포를 효율적으로 재결합시된다(그림1C). 그림 1에서입증된 바와 같이, 용액은 뇌-수막 장벽을 교차하지 않으며, 경구 관력을 통한 전신 투여와는 달리, 실치종의 천체세포와 접촉하지 않는다(하루 2 mg/mL, 5일 연속; 그림 1C-E).
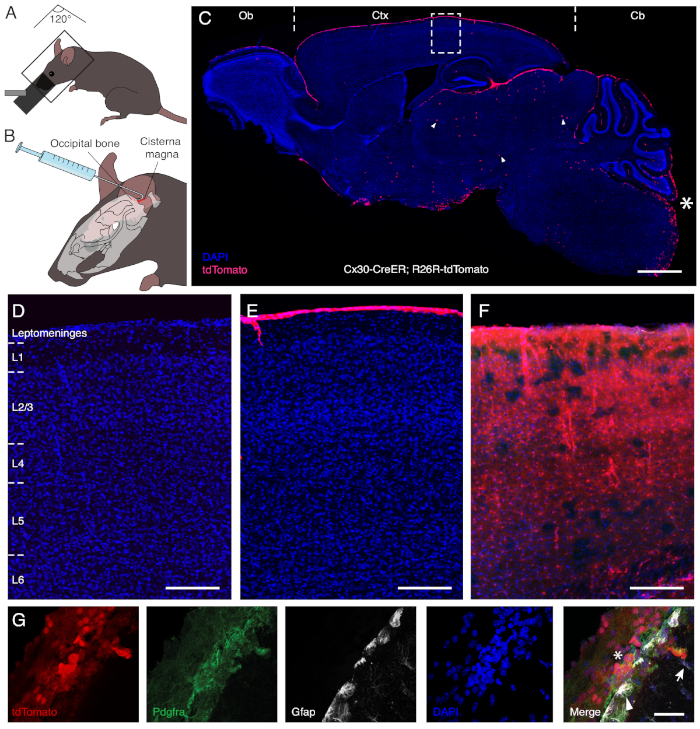
그림 1: 엔독시펜의 내분비성 주입을 통한 렙토메닝 세포의 특정 라벨링. 패널 A와 B는 내성주의 행정을 위해 개발된 절차를 설명한다. 시스터나 마그나에 접근하려면 목 뒤쪽을 펴야합니다. 따라서 마취 된 동물은 몸과 머리 사이의 대략 120 ° 각도에 위치하여 아래쪽으로 기울어져 있습니다(A). 후크 된 바늘은 두개골에 주사기를 고정하고 용액(B)의수동 투여를 안전하게 진행할 수 있습니다. 패널 C는 Cx30 프로모터 하에서 CreER를 운반하는 형질전환 마우스 모델에서 엔도시펜의 내성 투여 후 뇌의 시상 섹션을 표시하고 tdTomato 형광 리포터의 유도성 발현을 나타낸다. 별표(*)는 주사 부위를 표시하고 시술 후 수술 적 손상이 없는 것을 보여줍니다. 엔도시펜은 후각 전구(Ob), 피질(Ctx) 및 소뇌(Cb)를 오버레이하는 수막층에서 세포에서 유전적 재조합 및 리포터 유전자 발현을 선택적으로 유도한다. 중뇌 (화살촉)의 몇 점성술만이 엔독시펜의 내성 분신 전달 후에 재결합됩니다. 패널 D-F는 비히클용액(D)으로처리된 동물에서 C에서 박스형 영역의 배율이며, 엔독시펜(E)의 내성분사 주사를 행하거나, 경구 관저(F)를 통해 체계적으로 처리하였다.EF intracisternal 관리는 렙토메닝의 세포를 구체적으로 표지하는 반면, 전신 전달은 또한 피질 층을 통하여 Cx30 발현 성상 세포의 재조합으로 이어집니다 (L1 to L6). 패널 G는 프록토메닝 겔세포(별표)의 재조합을 나타내며, Pdgfra 반응성을 통해 확인된, 내성분투내 주사 후. 대조적으로 Gfap을 표현하는 표면(화살촉) 및 실사(화살표) 성상세포는 레이블이 지정되지 않은 상태로 유지됩니다. 배율 막대 = 1,000 μm(C),150 μm(D-F),및 40 μm(G). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명된 프로토콜은 운명 매핑을 위해 렙토메닝 세포에 레이블을 지정하는 간단하고 재현 가능한 절차를 제시합니다. 우리는 Tx30-CreER에서 tdTomato 형광 리포터의 발현을 유도하기 위해 타목시펜의 활성 대사 산물인 엔독시펜의 내성 분사술을 사용합니다. R26R-tdTomato 마우스12,,13.
시스터나 마그나9를통해 뇌척수액에 접근하는 데 사용되는 다른 프로토콜과 비교하여, 우리의 접근 법은 두개골의 후두 뼈에 안정될 수 있는 구부러진 바늘의 사용 덕분에 안전한 수동 투여를 보장합니다. 일단 시스터나 마그나의 경막이 천포되면, 저항에 있는 급격한 투하가 있습니다. 이 시점에서 다른 프로토콜은 바늘을 경면에서 최대 1-2mm로 낮추고 절차9전반에 걸쳐 수동으로 일정한 위치에 유지하는 것이 좋습니다. 직선 바늘반대로, 후크 바늘은 두개골에 고정되고 조직에 더 깊이 침투할 수 없으므로 근본적인 소뇌 또는 수질을 손상시킬 위험이 없습니다. 우리의 후크 시스템은 특히 주입속도가 느린 경우 보다 안전한 용액 투여를 가능하게 합니다.
여기에 설명된 절차는 수술된 동물에게 오래 지속되는 불편함을 야기할 것으로 예상되지 않습니다. 그러나 대량의 용액을 관리할 때는 주의를 기울여야 합니다. 빠른 전달 속도 두 개 내 압력에 변경 및 마우스에 신경 증상의 개발으로 이어질 수 있습니다. 우리는 이 리스크를 피하기 위하여 5-10 μL까지 부피를 주입하거나 납품 비율을 통제하는 마이크로 조작기에 주사기를 조립하는 것을 건의합니다. 이것은 뇌척수액 운동의 연구 결과에 이 절차를 적응할 때 특히 중요합니다. 수동 주입을 피하고 생리적 흐름의 과도한 침투를 방지하기 위해 느린 주입 속도 (예 : 1 μL / min)를 사용하는 것이 좋습니다. 더욱이, 본 프로토콜은 렙토메닝 세포를 효율적으로 표지하는 단일 내분비증 주사를 수행하도록 설계된다. 우리는 윤리적 인 명세뿐만 아니라 여러 수술 절차를 견딜 수있는 동물의 능력을 고려하는 것이 좋습니다, 연구는 화합물의 반복 투여를 필요로하는 경우.
엔도시펜 투여 이외에, 여기서 설명된 기술은 렙토메닝 세포 특이적 프로모터 하에서 리포터 유전자를 운반하는 바이러스의 전달과 결합될 수 있다. 더욱이, 본 전달 시스템은 뇌척수액흐름(10)의급성 추적에 활용될 수 있다. 이를 위해, 세포 추적기(ca. 700 Da) 또는 Dextran Fluorescin(ca. 3000 Da)과 같은 형광 추적자는 시스터나 마그나를 통해 전달될 수 있으며, 주사기는 화합물의 주입 속도를 제어할 수 있도록 마이크로조작기에 장착될 수 있다. 이것은 추적 실험에 있는 자연적인 뇌척수액 운동의 과도한 소요를 피하기 위하여 중요할지도 모릅니다.
렙토메닝 세포는 클라우디콘-11 및 단단한 접합과 관련된 다른 단백질을 발현하며, 이는 지주막 공간에서 혈액-뇌척수액 장벽의 확립과 유체 및 영양분 순환의 동압 조절에 기여한다3. 여기에서 설명된 접근은 엄격하게 통제된 뇌척수액 조성을 유지하는 그들의 putative 역할을 탐구하기 위하여 장벽의 접합 통제에서 연루된 유전자의 조건부 절제와 결합될 수 있습니다. 추가적으로, 렙토메닝에서 세포는 개발에 있는 역할을 합니다, 여기서 그들은 피질 뉴런의생성및 굳은 살연결의형성에 기여하는 외적 신호를 제공하는 4. 우리의 방법은 또한 정확한 피질 발달 및 축색 경로 찾기에 있는 leptomeninges의 역할에 대한 추가 통찰력을 얻기 위하여 적응될 수 있습니다. 마지막으로, Neisseria 수막염과 같은 박테리아는 인간 렙토메닝세포(14)에부착하는 것으로 나타났으며, 질병에 대한 동물 모델은 세균 침입 및 그에 따른 신경손상(15,15,16)을연구하기 위해 개발되었으며, 감염에 대한 책임이 있는 표면 리간드는 아직 완전히 결정되지 않고 있다. 우리의 기술로 달성된 렙토메링 세포의 선택적 재조합은 지주막 공간을 감염시키기 위하여 박테리아에 의해 이용된 접착 사이트의 확인을 원조할 수 있었습니다. 참고로, 이에 제시된 프로토콜은 세균 감염을 수반하는 절차를 수행하는 데 필요한 추가적인 윤리적 및 안전 적 요구 사항을 고려하여 수정이 필요할 수 있습니다.
결론적으로, 본명 설명에 기재된 내분은 유전자 편집 접근법 또는 표지된 분자의 주입과 결합될 때 광범위한 렙토메닝 및 뇌척수액 기능을 조사할 수 있는 기회를 제공하는 간단하고 잘 용납된 외과적 접근법을 나타낸다.
공개
저자는 경쟁적인 이익을 선언하지 않습니다.
감사의 말
이 연구는 스웨덴 연구 위원회, 스웨덴 암 학회, 전략적 연구를위한 스웨덴 재단, 너트 오크 앨리스 발렌 베르첼스와 카롤린스카 연구소에서 줄기 세포와 재생 의학의 전략적 연구 프로그램에서 보조금에 의해 지원되었다 (StratRegen).
자료
| Name | Company | Catalog Number | Comments |
| Anesthesia unit | Univentor 410 | 8323102 | Complete of vaporizer, chamber, and tubing that connects to chamber and mouse head holder |
| Anesthesia (Isoflurane) | Baxter Medical AB | 000890 | |
| Betadine | Sigma-Aldrich | PVP1 | |
| Carprofen | Orion Pharma AB | 014920 | Commercial name Rymadil |
| Cyanoacrylate glue | Carl Roth | 0258.1 | Use silk 5-0 sutures, in alternative |
| Medbond Tissue Glue | Stoelting | 50479 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Endoxifen | Sigma-Aldrich | E8284 | |
| Ethanol 70% | Histolab | 01370 | |
| Hamilton syringe (30 G beveled needle) | Hamilton | 80300 | |
| Lidocaine | Aspen Nordic | 520455 | |
| Mouse head holder | Narishige International | SGM-4 | With mouth piece for inhalational anhestetics. Alternatively, use a stereotactic frame |
| Scissors | Fine Science Tools | 15009-08 | |
| Shaver | Aesculap | GT420 | |
| Sterile absorption spears | Fine Science Tools | 18105-01 | Sterile cotton swabs are also a good option |
| Surgical separator | World Precision Instrument | 501897 | |
| Tweezers | Dumont | 11251-35 | |
| Viscotears | Bausch&Lomb Nordic AB | 541760 |
참고문헌
- Vanlandewijck, M., et al. A molecular atlas of cell types and zonation in the brain vasculature. Nature. 554 (7693), 475-480 (2018).
- Whish, S., et al. The inner CSF-brain barrier: developmentally controlled access to the brain via intercellular junctions. Frontiers in Neuroscience. 9, 16(2015).
- Weller, R. O., Sharp, M. M., Christodoulides, M., Carare, R. O., Mollgard, K. The meninges as barriers and facilitators for the movement of fluid, cells and pathogens related to the rodent and human CNS. Acta Neuropathologica. 135 (3), 363-385 (2018).
- Choe, Y., Siegenthaler, J. A., Pleasure, S. J. A cascade of morphogenic signaling initiated by the meninges controls corpus callosum formation. Neuron. 73 (4), 698-712 (2012).
- Siegenthaler, J. A., et al. Retinoic acid from the meninges regulates cortical neuron generation. Cell. 139 (3), 597-609 (2009).
- Bifari, F., et al. Neurogenic Radial Glia-like Cells in Meninges Migrate and Differentiate into Functionally Integrated Neurons in the Neonatal Cortex. Cell Stem Cell. 20 (3), 360-373 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins? FEBS Letters. 588 (8), 1259-1270 (2014).
- Ramos, M., et al. Cisterna Magna Injection in Rats to Study Glymphatic Function. Methods in Molecular Biology. 1938, 97-104 (2019).
- Xavier, A. L. R., et al. Cannula Implantation into the Cisterna Magna of Rodents. Journal of Visualized Experiments. (135), (2018).
- Iliff, J. J., et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Coureuil, M., Lecuyer, H., Bourdoulous, S., Nassif, X. A journey into the brain: insight into how bacterial pathogens cross blood-brain barriers. Nature Reviews Microbiology. 15 (3), 149-159 (2017).
- Madisen, L., et al. Transgenic mice for intersectional targeting of neural sensors and effectors with high specificity and performance. Neuron. 85 (5), 942-958 (2015).
- Slezak, M., et al. Transgenic mice for conditional gene manipulation in astroglial cells. Glia. 55 (15), 1565-1576 (2007).
- Hardy, S. J., Christodoulides, M., Weller, R. O., Heckels, J. E. Interactions of Neisseria meningitidis with cells of the human meninges. Molecular Microbiology. 36 (4), 817-829 (2000).
- Colicchio, R., et al. The meningococcal ABC-Type L-glutamate transporter GltT is necessary for the development of experimental meningitis in mice. Infection and Immunity. 77 (9), 3578-3587 (2009).
- Ricci, S., et al. Inhibition of matrix metalloproteinases attenuates brain damage in experimental meningococcal meningitis. BMC Infectious Diseases. 14, 726(2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유