Method Article
通过宫内注射诱导利普托门宁皮细胞修饰
摘要
我们描述了一种宫内注射,在头尖弯曲的针头可以稳定在头骨上,从而消除了对底层腹腔损伤的风险。该方法可用于脑膜蛋白酶细胞的基因命运图谱和操作,以及跟踪脑脊液运动。
摘要
此处概述的协议描述了如何通过蓄水池安全、手动注入溶液,同时消除对底层帕伦奇马的损害风险。以前发布的协议建议使用直针,应降低至从杜面表面到最大 1-2 毫米。一旦硬膜被刺穿,阻力突然下降,使得很难将针头保持在稳定的位置。相反,我们的方法使用一根针弯曲在尖端,可以稳定在头骨的骨骼上,从而防止注射器在透过杜拉膜后渗透到组织中。该过程简单明了,可重复,不会在操作的动物中引起持久的不适。我们描述了血管脑蛋白酶细胞遗传命运图的背景下的宫内注射策略。此外,同样的技术也可以用来解决广泛的研究问题,例如通过基因消融这些现象,探讨利普托明病在神经发育和细菌性脑膜炎传播中的作用。此外,该程序可与自动输注系统相结合,实现持续输送,并通过注射荧光标记分子跟踪脑脊液运动。
引言
脑皮细胞是一种类似成纤维细胞的细胞群,它们组织成一层薄薄的细胞,覆盖大脑,表达与胶原蛋白交联有关的基因(例如,Dcn和Lum),以及建立脑脑电明屏障(例如,Cldn11)1、2。1,2脑膜细胞涉及广泛的生理功能,从严格控制脑脊液排水3到指导发育中的大脑中神经祖细胞44、5。5最近的一项研究还提出,新生儿中的耳皮层可能含有径向胶质状细胞,这些细胞会迁移到脑皮质瘤中,并发育成功能性皮质神经元6。
细胞体位于靠近表面星体细胞附近,并与它们共享,以及其他帕伦奇马尔星体,表达connexin-30(Cx30)7。7下面概述的外科手术允许通过一次性将内毒素输送到转基因小鼠的水箱中,在Cx30+ 细胞中表达tdTomato(即使用CreER-loxP系统进行命运映射)对这些脑膜炎细胞进行+广泛和具体的标签。Endoxifen 是塔莫西芬的活性代谢物,与塔莫西芬一样诱导克里尔表达细胞的重组。然而,它是推荐用于局部应用的解决方案,因为它溶解在5-10%的DMSO中,而不是高浓度的乙醇。此外,内氧西芬不会跨越脑脑阻隔,从而能够对脑皮质细胞进行特定的重组,而无需标记基础Cx30+天体胶质种群(参见代表性结果)。
此处介绍的技术旨在通过直接进入水仙子,手动安全地将化合物注入脑脊液中。与其他需要颅骨切除术的更具侵入性的程序不同,这种方法允许在不造成颅骨或脑筋皮损伤的情况下注入化合物。因此,它与由激活皮质胶质细胞触发的炎症反应的诱导无关。与,88、9、109之前描述的其他注射策略类似,本办法依赖于覆盖水箱的肌酸-四面体膜的外科暴露,在钝刻颈部肌肉解剖后。10然而,与其他程序不同,我们建议在尖端弯曲针头,在给剂期间,针对骨骼可以稳定。这将防止针头穿透太深和损害潜在的小脑和髓线的风险。
此外科手术与谱系追踪调查兼容,旨在绘制细胞身份的变化和通过层形层的迁移路线。它也可以适应基因消融研究,旨在探讨利皮质细胞在健康和疾病中的作用,如它们对皮质发育5或细菌性脑膜炎的传播的贡献,3,11。最后,当与野生动物中荧光示踪剂的传递相结合时,可用于跟踪脑脊液运动。
研究方案
特此提出的外科手术得到了斯德哥尔摩诺拉·久尔夫·德尔塞茨卡·纳姆德的批准,并符合该研究所(瑞典卡罗林斯卡研究所)提供的规格。
注:宫内注射可以灵活适应多种研究目的。我们下面介绍了一个程序,用于根据携带R26R-tdTomato12和CreER的转基因小鼠生产线注射内毒素,有效地标记蛋白酶细胞的命运映射,后者在Cx30促进12剂13下。通过使用下面概述的相同程序注入病毒结构,可以获得这种细胞群的标签。最后,这种方法可用于跟踪脑脊液流动,通过注入荧光示踪剂。
1. 注射系统的制备
注:我们建议在合适的手术室和无菌条件下进行手术。手术工具可以使用热(高压灭菌器、玻璃珠消毒器)进行消毒,或者使用高级化学消毒剂进行消毒,如果它们对热敏感。使用化学消毒时,在使用前冲洗仪器,或在用热消毒时让仪器冷却。
- 使用钳子,将注射注射器的针头弯曲到 30°,距离尖端 3 mm。
注:使用带有 30 G 的线针的汉密尔顿注射器。 - 制备1mg/mL的内氧辛溶液,稀释10%DMSO,用弯曲的针头回填注射器。
注:施用5μL的化合物,以确保在成年C57Bl/6j小鼠(约25-30克)中广泛接触脑膜炎细胞,尽管在治疗不同年龄和菌株的动物时可能需要测试不同浓度和注射量的试验性实验。 - 调整鼠标头座,使嘴片距离手术台面约 30°。
注:具有三点固定(即耳朵和嘴)的立体定向框架也可用于此过程。然而,在这种情况下,动物将只固定在嘴片,而耳杆可以延伸到动物的前肢,并用于支持动物的身体在手术过程中。
2. 麻醉的诱导
- 对于注射麻醉剂,使用当地机构兽医单位推荐的浓度和管理模式。
- 对于吸入麻醉剂(如异物),请根据制造商的规格准备管理单元。
- 使用安福拉内,将化合物的浓度设定为4%,用于麻醉诱导。
- 以 400 mL/min 的速度输送空气。
- 让麻醉装置在腔室中充满麻醉剂几分钟,然后将鼠标放在室中。
注:在本实验中,我们使用成年(>2个月大,约30克)雄性和雌性转基因小鼠携带Cx30-CreER和R26R-tdTomato,并在C57Bl/6j背景下繁殖。 - 在麻醉过程中监测动物。当鼠标完全麻醉时,呼吸模式应减慢。
- 将动物从腔室中取出,通过巧妙地捏住后爪,检查爪子反射是否抑制。
注:反射可能仍然存在,但延迟了几秒钟。如果是这种情况,将动物放回室内,直到完全抑制爪反射。 - 施用镇痛药(例如,卡普罗芬,5毫克/千克通过皮下注射),以帮助术后疼痛管理。
3. 动物在程序上的定位
- 将动物的头固定在头架上。为提高对蓄水池的可及性,将动物的身体从桌子表面和头部置于约30°处,与身体其余部分建立120°角,并伸长颈部后部,以方便进入蓄水池(图1A)。
- 在动物下面添加纸巾,在整个过程中支持其身体。
- 通过口片确保麻醉,将西罗兰浓度降低至2.5%,空气输送降至200毫升/分钟。
- 涂抹眼科药膏。
4. 《麦格纳》的曝光
- 用70%的乙醇和贝塔丁对动物的脖子后部进行消毒。
- 使用手术剪刀,执行中线切口(约7毫米长),从骨骼的水平开始,并后延伸。
- 轻轻地分开表面的连接组织和颈部肌肉从中线侧拉与细尖钳。这将暴露覆盖蓄水池的膜膜,形状为倒三角形。
- 使用无菌吸收矛或棉签来控制任何由此产生的出血。
- 放置一个小手术分离器,以保持颈部肌肉拉到一边,并在整个过程中实现蓄水池的可视化。
5. 宫内注射
- 要进入卡斯特纳麦格纳,确定骨骼的切口末端,并插入先前立即弯曲的针头。
注:当杜听觉膜被刺穿时,电阻会突然下降。然而,由于针尖的钩形,它只会在脑膜炎表面的下方稍微穿透。 - 一旦杜拉被穿孔,让针的弯曲尖端穿透下的杜听觉表面,轻轻地拉注射器向上和平行的动物的身体,以便"钩"到头骨(见图Figure 11B)。这将确保更好的稳定性,并防止针穿透更深,从而避免损害潜在的小脑或髓。
- 缓慢注射化合物,避免干扰脑脊液的自然流动。
注:根据实验的目的,输液率可能会有所不同。如果需要缓慢且稳定的输注率(例如,在使用该程序跟踪脑脊液运动时),建议将自动微输液系统与注射器结合使用。 - 注射后,让针头在部位休息1分钟,并小心地取出。使用细尖钳帮助将针头从钩位置撤回。
注:使用细针(例如 30 G)不会导致脑膜的严重损伤,并导致脑脊液流出。如果需要较大的针头尺寸,我们建议使用无菌棉尖在注射部位施加压力,从而阻止液体泄漏。
6. 结束程序和术后护理
- 拆下分离器,让肌肉回到其原始位置,覆盖杜听觉膜。
- 使用几滴氰丙烯酸酯粘合剂关闭皮肤切口。
注:或者,使用可吸收缝合线(例如,5-0 维基质缝合),并关闭皮肤切口与中断的缝合。 - 在切口部位施用局部麻醉剂(例如,100 μL 5% 利多卡因)。
- 将动物从支架上取下,放在位于加热垫上的干净笼子中。监测动物,直到它恢复知觉。
注:该程序预计不会在动物中引起持久的疼痛或痛苦。然而,在术后的第一天,应密切监测小鼠,必要时可根据您所在机构兽医单位的建议采取疼痛缓解措施。
结果
在在Cx30促进剂13下表达CreER的转基因小鼠体内注射内毒素,以及一个可诱导的荧光报告器允许对瘦蛋白细胞进行特定重组,而无需在皮层中标记邻近的Cx30表达表面和帕伦奇质的天体细胞(图1)。为了获得进入蓄水池,麻醉动物的身体和头部以大约120°的角度定位,从而允许其颈部背部被拉伸(图1A)。然后,通过颈部肌肉的钝剖面暴露,从而获得进入底层的胸腔。在距离尖端3毫米处弯曲至约30°的针头进行安全手动注射。这允许注射器对颅骨的骨骼进行持有,从而提高在管理过程中的稳定性(图1B)。利用脑脊液的生理运动,内毒素溶液分布在亚拉奇诺伊德空间,以有效地重组覆盖嗅球、皮层和小脑的脑膜细胞(图1C)。如图1所示,该溶液不会跨越脑脑障碍,也不会与帕伦奇马的天体胶质细胞接触,而不是通过口服gavage进行全身管理(连续五天每天2毫克/米L);图 1C-E。
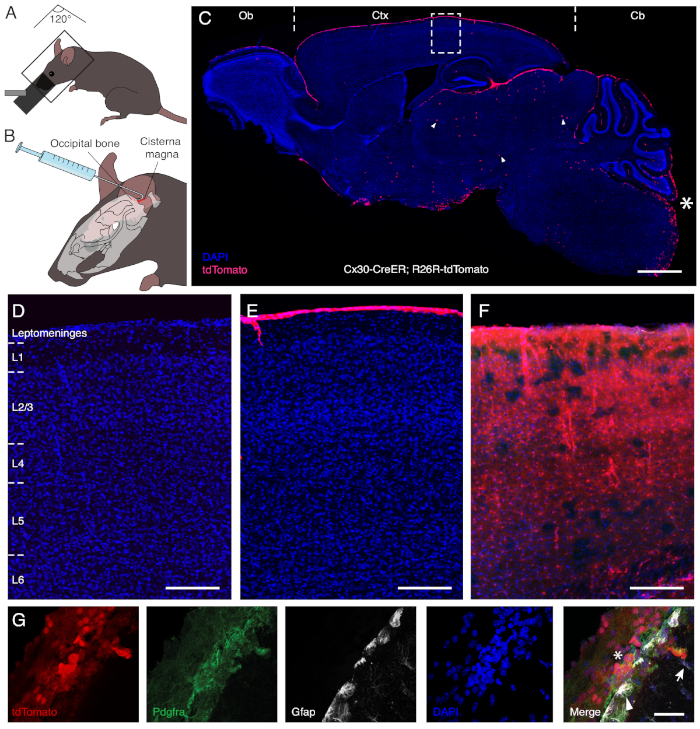
图1:通过内毒素注射对利普平球细胞进行特定标记。小组A和B说明了为宫内管理制定的程序。为了进入蓄水池,颈部的背部应伸展。因此,麻醉动物位于身体和头部之间的近似角度为120°,向下倾斜(A)。钩针允许将注射器固定到头骨上,并安全地进行溶液的手动管理(B)。面板C在 Cx30 启动器下携带 CreER 的转基因小鼠模型中显示内毒素后脑的凹陷部分,以及 tdTomato 荧光报告器的诱导表达。星号 (*) 标记注射部位,并表明手术后没有手术损伤。Endoxifen选择性地诱导基因重组,并在覆盖嗅球(Ob)、皮层(Ctx)和小脑(Cb)的脑膜层细胞中进行基因重组和报告基因表达。在内核氧核酸的宫内传递后,只有几个中脑(箭头)的天体细胞被重新组合。面板D-F是用车辆溶液(D)处理的动物中C的盒装区域的放大倍数,接受内毒素(E)的宫内注射,或通过口服gavage(F)系统处理。F虽然宫内管理专门标记了利普托明格的细胞,但系统传递也会导致在整个皮质层(L1 到 L6)中重组 Cx30 表达的星形细胞。面板G说明了通过Pdgfra反应确定在宫内注射后确定的利皮内皮细胞(星号)的重组。相比之下,表面(箭头)和填充(箭头)星形细胞表示Gfap仍然未标记。刻度柱 = 1,000 μm (C), 150 μm (D-F) 和 40 μm (G).请点击此处查看此图形的较大版本。
讨论
此处概述的协议提供了一个简单且可重复的过程,用于标记脂肪映射的利普托明尼细胞。我们使用甲氧西芬(塔莫西芬的活性代谢物)的内腔注射,诱导Cx30-CreER中tdTomato荧光报告器的表达;R26R-tdTomato小鼠1212,1313。
与其他用于通过气囊9获得脑脊液的规程相比,我们的方法确保了安全手动管理,这要归功于使用弯曲的针头,可以稳定到头骨的骨骼。一旦水箱的膜膜穿孔,电阻就会突然下降。此时,其他协议建议将针从杜面表面降至最大 1-2 mm,并在整个过程9中手动保持其稳定位置。与直针相反,钩针固定在头骨上,不能深入组织,从而消除了破坏底层小脑或髓线的风险。我们的钩系统允许更安全的解决方案管理,尤其是在使用缓慢的输液率时。
此处概述的程序不会给受操作的动物造成长期不适。但是,在管理大量解决方案时,必须小心谨慎。快速分娩率可能导致颅内压力改变和小鼠神经症状的发展。我们建议注射体积高达5-10μL,以避免这种风险或组装注射器到控制输送速率的微机械手。当调整这个程序以适应脑脊液运动的研究时,这一点尤其重要。建议避免人工注射,并使用缓慢的输注速度(例如1 μL/min),以防止过度渗透生理流量。此外,本协议旨在执行单次宫内注射,有效标记耳皮细胞。我们建议考虑道德规范,以及动物承受多种外科手术的能力,如果研究需要重复管理化合物。
除了内毒素管理外,此处概述的技术还可以与携带报告基因的病毒在细胞特异性促进剂下传递。此外,目前的输送系统可用于脑脊液流的急性跟踪10。为此,荧光示踪剂,如细胞跟踪器(约700 Da)或Dextran氟氟辛(约3000 Da)可以通过蓄水池麦格纳交付,注射器可以安装在微机械上,从而控制化合物的输液率。这在避免自然脑脊液运动在追踪实验中的过度干扰可能很重要。
脑膜细胞表达胆素-11和其他与紧密结点相关的蛋白质,有助于在亚阿拉克诺德空间建立血脑脊液屏障,以及流体和营养循环的稳静控制3。这里概述的方法可能与与与屏障结交控制有关的基因的有条件消融相结合,以探索其在维持严格调节的脑脊液成分中的假定作用。此外,来自灵通门的细胞在发育中起着一定的作用,它们提供外在信号,有助于产生皮质神经元5和形成电体连接4。我们的方法也可以适应,以进一步深入了解利普托明因在正确的皮质发育和合行路径查找中的作用。最后,奈塞里亚脑膜炎等细菌已证明附着在人类肾上皮细胞14,并且动物模型已经开发为研究细菌入侵和造成的神经损伤15,16,,16虽然表面配体负责感染尚未完全确定。用我们的技术实现的蛋白酶细胞的选择性重组可以帮助识别细菌用来感染亚阿拉奇诺德空间的粘附部位。值得注意的是,特此提出的议定书可能需要修改,以考虑到执行导致细菌感染的程序所需的其他道德和安全要求。
最后,本文所述的宫内注射是一种简单且耐受良好的手术方法,当与基因编辑方法结合或注入标记分子时,有机会研究各种脑膜和脑脊液功能。
披露声明
作者声明没有相互竞争的利益。
致谢
这项研究得到了瑞典研究理事会、瑞典癌症协会、瑞典战略研究基金会、克努特·奥赫·爱丽丝·瓦伦贝格斯·斯蒂夫瑟斯和卡罗林斯卡研究所干细胞和再生医学战略研究方案的资助。
材料
| Name | Company | Catalog Number | Comments |
| Anesthesia unit | Univentor 410 | 8323102 | Complete of vaporizer, chamber, and tubing that connects to chamber and mouse head holder |
| Anesthesia (Isoflurane) | Baxter Medical AB | 000890 | |
| Betadine | Sigma-Aldrich | PVP1 | |
| Carprofen | Orion Pharma AB | 014920 | Commercial name Rymadil |
| Cyanoacrylate glue | Carl Roth | 0258.1 | Use silk 5-0 sutures, in alternative |
| Medbond Tissue Glue | Stoelting | 50479 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Endoxifen | Sigma-Aldrich | E8284 | |
| Ethanol 70% | Histolab | 01370 | |
| Hamilton syringe (30 G beveled needle) | Hamilton | 80300 | |
| Lidocaine | Aspen Nordic | 520455 | |
| Mouse head holder | Narishige International | SGM-4 | With mouth piece for inhalational anhestetics. Alternatively, use a stereotactic frame |
| Scissors | Fine Science Tools | 15009-08 | |
| Shaver | Aesculap | GT420 | |
| Sterile absorption spears | Fine Science Tools | 18105-01 | Sterile cotton swabs are also a good option |
| Surgical separator | World Precision Instrument | 501897 | |
| Tweezers | Dumont | 11251-35 | |
| Viscotears | Bausch&Lomb Nordic AB | 541760 |
参考文献
- Vanlandewijck, M., et al. A molecular atlas of cell types and zonation in the brain vasculature. Nature. 554 (7693), 475-480 (2018).
- Whish, S., et al. The inner CSF-brain barrier: developmentally controlled access to the brain via intercellular junctions. Frontiers in Neuroscience. 9, 16(2015).
- Weller, R. O., Sharp, M. M., Christodoulides, M., Carare, R. O., Mollgard, K. The meninges as barriers and facilitators for the movement of fluid, cells and pathogens related to the rodent and human CNS. Acta Neuropathologica. 135 (3), 363-385 (2018).
- Choe, Y., Siegenthaler, J. A., Pleasure, S. J. A cascade of morphogenic signaling initiated by the meninges controls corpus callosum formation. Neuron. 73 (4), 698-712 (2012).
- Siegenthaler, J. A., et al. Retinoic acid from the meninges regulates cortical neuron generation. Cell. 139 (3), 597-609 (2009).
- Bifari, F., et al. Neurogenic Radial Glia-like Cells in Meninges Migrate and Differentiate into Functionally Integrated Neurons in the Neonatal Cortex. Cell Stem Cell. 20 (3), 360-373 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins? FEBS Letters. 588 (8), 1259-1270 (2014).
- Ramos, M., et al. Cisterna Magna Injection in Rats to Study Glymphatic Function. Methods in Molecular Biology. 1938, 97-104 (2019).
- Xavier, A. L. R., et al. Cannula Implantation into the Cisterna Magna of Rodents. Journal of Visualized Experiments. (135), (2018).
- Iliff, J. J., et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Coureuil, M., Lecuyer, H., Bourdoulous, S., Nassif, X. A journey into the brain: insight into how bacterial pathogens cross blood-brain barriers. Nature Reviews Microbiology. 15 (3), 149-159 (2017).
- Madisen, L., et al. Transgenic mice for intersectional targeting of neural sensors and effectors with high specificity and performance. Neuron. 85 (5), 942-958 (2015).
- Slezak, M., et al. Transgenic mice for conditional gene manipulation in astroglial cells. Glia. 55 (15), 1565-1576 (2007).
- Hardy, S. J., Christodoulides, M., Weller, R. O., Heckels, J. E. Interactions of Neisseria meningitidis with cells of the human meninges. Molecular Microbiology. 36 (4), 817-829 (2000).
- Colicchio, R., et al. The meningococcal ABC-Type L-glutamate transporter GltT is necessary for the development of experimental meningitis in mice. Infection and Immunity. 77 (9), 3578-3587 (2009).
- Ricci, S., et al. Inhibition of matrix metalloproteinases attenuates brain damage in experimental meningococcal meningitis. BMC Infectious Diseases. 14, 726(2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。