Method Article
אינדוקציה של שינוי תאי לטומנאנואל באמצעות הזרקה בתוך החלק האחר
In This Article
Summary
אנו מתארים הזרקה תאיים כי מעסיקה מחט כפוף בקצה כי ניתן לייצב את הגולגולת, ובכך לחסל את הסיכון של נזק על הבסיס הבסיסי. הגישה יכולה לשמש למיפוי הגורל הגנטי ומניפולציות של תאים לטומאנעיים ולמעקב אחר תנועת נוזל מוחי שדרתי.
Abstract
הפרוטוקול המתואר כאן מתאר כיצד להזריק בביטחה ובאופן ידני פתרונות דרך הcisterna מגנה תוך סילוק הסיכון לנזק על הבסיס הבסיסי. פרוטוקולים שפורסמו בעבר ממליצים באמצעות מחטים ישר כי יש להוריד למקסימום של 1-2 מ"מ מהמשטח ריר. ירידה פתאומית התנגדות פעם קרום ריר כבר נוקב מקשה לשמור על המחט במצב קבוע. השיטה שלנו, במקום זאת, מעסיקה מחט כפופה לקצה שניתן לייצב כנגד עצם העורף של הגולגולת, ובכך למנוע ממזרק לחדור לתוך הרקמה לאחר ניקוב הקרום הריר. הנוהל הוא פשוט, מנוכל, ואינו גורם לאי נוחות ארוכת טווח בבעלי החיים המופעלים. אנו מתארים את אסטרטגיית ההזרקה תאיים בהקשר של מיפוי הגורל הגנטי של תאי כלי דם ללפטואנגים. אותה טכניקה יכולה, יתר על כן, להיות מנוצל כדי להתמודד עם מגוון רחב של שאלות מחקר, כגון בדיקה את התפקיד של לטומאנטינוגים ב-נוירופיתוח והתפשטות של דלקת קרום המוח בקטריאלי, באמצעות צריבה גנטית של גנים מעורבים בתופעות אלה. בנוסף, ההליך יכול להיות משולב עם מערכת אינפוזיה יצרנית עבור מסירה קבועה משמש למעקב אחר התנועה נוזל מוחי באמצעות הזרקה של מולקולות המסומנת באופן פלואורוסקופים.
Introduction
תאים לטומאננטאל הם האוכלוסייה הדומה ביותר של תאים מאורגנים בשכבה דקה על ידי הנחת המוח וביטוי גנים מעורבים קולגן הקישור (g., dcn ו לאם), ובהקמת מחסום מאנקרום המוח (g, Cldn11)1,2. תאים לטומניניאל מעורבים במגוון רחב של תפקודים פיזיולוגיים, החל משליטה קפדנית על ניקוז נוזל השדרה השדרתי3 להדרכה של ושלתי עצביים במוח המתפתח4,5. מחקר שנערך לאחרונה הציע גם כי לפטטואנגים ב היילוד עשוי הנמל הרדיאלי של התאים הרדיאליים להגר למוח בתוך מתוך מעגל ולהתפתח נוירונים בקליפת כליה6.
תאים לטומאנציטים ממוקמים בסמיכות לפני השטח אסטרוציטים ולשתף איתם, כמו גם בנוסף astrochymal אסטרוגליה, ביטוי של קונשין-30 (Cx30)7. הליך כירורגי המתואר להלן מאפשר התוויות נרחב וספציפי של התאים האלה מנאינטיים באמצעות מסירה חד פעמי של אנקסיפן לתוך cisterna מגנה של עכברים טרנסגניים מותנית ביטוי tdTomato ב Cx30+ תאים (כלומר, באמצעות creer-loxp מערכת עבור מיפוי הגורל). אנדוקסיפן הוא מטבוליט פעיל של טמוקסיפן ומעורר שילוב של תאים של מבטא CreER באותו אופן כמו טממוקסיפן. זה, עם זאת, את הפתרון המומלץ עבור יישום אקטואלי כי הוא מתמוסס ב 5-10% DMSO, במקום ריכוזים גבוהים של אתנול. בנוסף, אנדוקסיפן אינו חוצה את מחסום המוח, ובכך מאפשר שילוב מיוחד של תאי לפטומאל, ללא תיוג של אוכלוסיית Cx30+ astroglial המשמשת כבסיס (ראה תוצאות מייצגות).
הטכניקה המוצגת כאן מכוונת באופן ידני ובטוח להזריק את המתחם בנוזל השדרתי, דרך גישה ישירה לcisterna מגנה. שלא כמו אחרים, הליכים פולשניים יותר הדורשים פתיחת גולגולת, גישה זו מאפשרת להשרות תרכובות מבלי לגרום נזק לגולגולת או המוח מכימומה. כך, הוא אינו משויך אינדוקציה של תגובות דלקתיות המופעל על ידי הפעלת תאים של המוקף מעקב. בדומה לאסטרטגיות הזרקה אחרות שתוארו לפני8,9,10, הגישה הנוכחית מסתמך על חשיפה כירורגית של קרום ריר העורף של atlanto-העורפית המכסה את cisterna מגנה, לאחר ניתוח קהה של שרירי הצוואר כיסה נחת. עם זאת, בניגוד להליכים אחרים, אנו ממליצים על שימוש במחט כפופה לקצה, אשר ניתן לייצב נגד עצם העורף במהלך הממשל. זה ימנע את הסיכון של המחט חודר עמוק מדי ופוגע המוח החלק האחורי ואת לשד.
הליך כירורגי זה תואם לחקירות מעקב אחר שושלת היוחסין המטרתן לבצע מיפוי שינויים בזהויות תאים ובנתיבי הגירה באמצעות שכבות של מסלולים. זה יכול גם להיות מותאם למחקרים הגנטי אבלציה שבכוונתך לחקור את התפקיד של תאים לטומאנאינאל בריאות ומחלות, כגון תרומתם להתפתחות קורטיקלית5 או התפשטות של דלקת קרום העין של חיידקים3,11. לבסוף, זה יכול להיות מנוצל כדי לעקוב אחר תנועת נוזל השדרה השדרתי כאשר בשילוב עם משלוח של מעוקב פלורסנט בחיות מסוג wildtype.
Protocol
הליכים כירורגיים שהוצגו בזאת אושרו על ידי Stockholms Norra Dnförssetiska Nämnd ובוצע בהסכמה עם מפרטים שסופקו על ידי מכון המחקר (Karolinska מכון, שוודיה).
הערה: הזרקת התאיים ניתן להתאים בגמישות למטרות מחקר מרובים. אנו מציגים להלן הליך שפותח ביעילות תווית לטומטואנגים לפני מיפוי הגורל מבוסס על הזרקה של אנדוקסיפן בקו העכבר הטרנסגניים נושאת R26R-tdTomato12 ו creer, האחרון תחת Cx30 יזם13. ניתן להשיג התוויות של אוכלוסיה זו של תאים באמצעות הזרקה של מבנים ויראליים באמצעות אותו ההליך המתואר להלן. לבסוף, גישה זו יכולה להיות מועסק עבור מעקב אחר זרימת נוזל מוחי שדרתי, על ידי אינפוזיה של מעוקב פלורסנט.
1. הכנת מערכת ההזרקה
הערה: אנו ממליצים לבצע את ההליך בחדר ניתוח מתאים, ובתנאים אספטי. כלים כירורגיים יכולים להיות מעוקר באמצעות חום (החיטוי, מעקר זכוכית מחוטא) או מחוטא באמצעות חיטוי כימי ברמה גבוהה אם הם רגישים לחום. לשטוף את המכשירים לפני השימוש בעת העסקת חיטוי כימי או לאפשר להם להתקרר כאשר מחוטא עם חום.
- באמצעות מלקחיים, לכופף את המחט של מזרק הזריקה כדי 30 ° ב 3 מ"מ מהקצה.
הערה: השתמש מזרקים המילטון עם מחט משופע 30 G. - הכינו 1 מ"ג/mL של פתרון אנדוקסיפן, מדולל 10% dmso ו-ילוי רקע את המזרק עם המחט הכפופה.
הערה: מנהל 5 μL של המתחם כדי להבטיח חשיפה נרחבת של תאים ממנגים בעכבר C57Bl/6j למבוגרים (ca. 25-30 g), למרות ניסויים פיילוט כי בדיקת ריכוזים שונים אמצעי אחסון הזרקה עשוי להיות נחוץ בעת טיפול בבעלי חיים של גילאים שונים וזנים. - כוונן את מחזיק ראש העכבר כך שפיסת הפה תהיה בערך 30 ° מהמשטח של השולחן הכירורגי.
הערה: ניתן להשתמש במסגרת סטריאוטקטיקה עם קיבוע של שלוש נקודות (כלומר, אוזניים ושפה) עבור הליך זה. אולם, במקרה זה, החיה תהיה קבועה רק עם פיסת הפה, בעוד שפסי האוזן יכולים להיות מורחבים תחת העצמות של בעל החיים ולשמש לתמיכה בגוף החיה במהלך ההליך.
2. אינדוקציה של הרדמה
- לזריקות הרדמה, להשתמש בריכוזים ובמצבי הניהול המומלצים על ידי היחידה הוטרינרית במוסד המקומי.
- למכשיר הרדמה, כגון isof, הכינו את יחידת הניהול בהתאם למפרט היצרן.
- . ב -4% לצורך הרדמה
- אספקת אוויר בקצב של 400 mL/min.
- אפשר ליחידת ההרדמה למלא את החדר עם ההרדמה לכמה דקות ולמקם את העכבר בתא לאחר מכן.
הערה: עבור הניסויים הנוכחיים, השתמשנו במבוגר (> 2 חודשים ובערך 30 g) עכברים מעבר זכר ונקבה הנושאים Cx30-CreER ו R26R-tdTomato, והתרבו על רקע C57Bl/6j. - לעקוב אחר החיה במהלך אינדוקציה של הרדמה. דפוס הנשימה אמור להאט כאשר העכבר נמצא תחת הרדמה מלאה.
- הסר את בעל החיים מהתא ובדוק אם הדיכוי של הרפלקס בכף היד מצבטת בעדינות את הכפות האחוריות.
הערה: ייתכן כי הרפלקס עדיין קיים אך מתעכב כמה שניות. אם זה המקרה, מניחים את בעל החיים בחדר עד שהדחקה המוחלטת של הרפלקס של הכפה הושגה. - ניהול כאבים (למשל, Carprofen, 5 מ"ג/ק"ג באמצעות הזרקה תת עורית) כדי לסייע ניהול לאחר הניתוח כאב.
3. מיקום בעל החיים לפרוצדורה
- התקן את ראשו של בעל החיים על מחזיק הראש. כדי לשפר את הנגישות cisterna מגנה, למקם את הגוף של החיה על כ 30 ° מהמשטח של השולחן ואת הראש שכותרתו כלפי מטה, כדי ליצור זווית של 120 ° עם שאר הגוף ולהאריך את גב הצוואר כדי להקל על הגישה לcisterna מגנה (איור 1א).
- הוסיפו מגבות נייר מתחת לבעל החיים כדי לתמוך בגופה לאורך כל התהליך.
- מאובטח משלוח הרדמה דרך פיסת הפה ולהפחית את הריכוז isof, כדי 2.5% ומשלוח האוויר 200 ml/min.
- החלת משחה אופטלמולוגית.
4. חשיפת הCisterna מגנה
- לגלח את העורף של החיה ולחטא את האזור עם 70% אתנול ובטאדין.
- באמצעות מספריים כירורגי, לבצע חתך באמצע הדרך (ca. 7 מ"מ באורך) החל ברמה של עצם העורף והרחבת אותו באופן פוקטילי.
- להפריד בעדינות רקמת חיבור שטחית ושרירי הצוואר משיכת הצידה מן הקו האמצע עם מלקחיים טיפים עדינים. זה יחשוף את קרום ריר מעל הנחת הcisterna מגנה, בצורת משולש הפוך.
- השתמש בחניתות ספיגה סטרילית או בתחבושות כותנה כדי לשלוט על כל דימום התוצאה.
- מיקום מפריד כירורגי קטן כדי לשמור על שרירי הצוואר משכה הצידה ולאפשר ויזואליזציה של cisterna מגנה במהלך ההליך.
5. הזרקה בתוך ההחדרה
- כדי לקבל גישה cisterna מגנה, לזהות את קצה caudal של עצם העורף ולהכניס את המחט כי היה כפוף בעבר מיד מתחת.
הערה: תהיה ירידה פתאומית ההתנגדות כמו קרום ריר מנוקב. עם זאת, קצה המחט יחדור מעט מתחת לפני השטח של המננגיאל, תודות לצורתו המכורה. - לאחר מחורר השכבה, הניחו לקצה העקום של המחט לחדור מתחת לפני השטח הריר על-ידי משיכת המזרק בעדינות כלפי מעלה ובמקביל לגוף החיה, כדי "לחבר" את המחט לגולגולת (ראה איור 1ב). זה יבטיח יציבות טובה יותר ותמנע את המחט מלחדור עמוק יותר, ובכך למנוע את הסיכון של פגיעה המוח החסר הבסיסית או לשד.
- הכנס לאט את התרכובת כדי למנוע הפרעות בזרימה הטבעית של נוזל השידרה.
הערה: בהתאם למטרת הניסוי, קצב העירוי עשוי להשתנות. אם שיעור העירוי האיטי והיציב נדרש (למשל, בעת שימוש בהליך למעקב אחר תנועת נוזל השדרה השדרתי), ייתכן שמומלץ להשתמש במערכת מיקרואינפוזיה יצרנית בשילוב עם המזרק. - לאחר ההזרקה, תן את המחט לנוח באתר 1 דקות ובזהירות להסיר אותו. השתמש מלקחיים עצה עדין כדי לסייע לנסיגה של המחט מן העמדה מכורה שלה.
הערה: השימוש במחט דקה (למשל, 30 G) אינו מוביל לנזק משמעותי של קרום המנאינאל, והזרימה הזורמת של נוזל השדרתי. אם יש צורך במידות מחטים גדולות יותר, אנו ממליצים לעצור את דליפת הנוזלים על-ידי הפעלת לחץ באתר ההזרקה באמצעות קצה כותנה סטרילי.
6. הסכם הליך וטיפול שלאחר הניתוח
- להסיר את המפריד ולאפשר לשרירים לחזור למיקום המקורי שלהם הנחת קרום ריר.
- סגרו את חתך העור באמצעות מספר טיפות של דבק ציאנואקרילי.
הערה: לחילופין, יש להשתמש בתפרים נספגים (למשל, 5-0 תפרים ולאחר תפר) ולסגור את חתך העור בתפרים מקוטע. - החל הרדמה מקומית (למשל, 100 μL של 5% לידוקאין) באתר החתך.
- הסר את בעל החיים מן המחזיק ומקום בכלוב נקי ממוקם על כרית חימום. לעקוב אחר בעל החיים עד שהוא חוזר להכרתו.
הערה: הנוהל אינו צפוי לגרום לכאב או למצוקה ארוכי-טווח בבעלי החיים. עם זאת, על העכבר להיות מנוטר באופן מדוק עבור הימים הראשונים של הניתוח ואמצעי הסיוע לכאב ניתן לעשות בכל פעם שהוא נראה הכרחי, ובהתאם להמלצות שסיפק היחידה הוטרינרית במוסד שלך.
תוצאות
הזרקה התאיים של אנדוקסיפן בעכברים טרנסגניים המבטא CreER תחת Cx30 יזם13 ו עיתונאי פלורסנט inducible מאפשר שילוב מסוים של תאים לטומאנואנציטים ללא תיוג השכנה Cx30-המבטא השכנות ו-משטח astrochymal בקליפת המוח (איור 1). על מנת לקבל גישה לcisterna מגנה, בעל החיים מורדם ממוקם עם הגוף והראש שלה בזווית של כ 120 °, ובכך, המאפשר את גב הצוואר שלה להיות נמתח (איור 1א). החלק atlanto-העורף של קרום ריר הוא נחשף לאחר מכן באמצעות ניתוח קהה של שרירי הצוואר, ובכך צובר גישה הבסיס cisterna מגנה. הזרקה בטוחה ידנית מבוצעת עם מחט כפוף כ 30 ° ב 3 מ ' מהקצה. הדבר מאפשר להחזיק את המזרק כנגד עצם העורף של הגולגולת, ובכך לשפר את היציבות במהלך הניהול (איור 1ב). ניצול התנועה הפיסיולוגית של הנוזל השדרתי, הפתרון האנדוקסיפן מופץ ברחבי החלל התת-מגנטי כדי לשלב ביעילות את התאים הלפיטומטים הנחת הריח, הקליפה והמוח העליון (איור 1ג). כפי שמתואר באיור 1, הפתרון אינו חוצה את המוח-מכשול מחסום ואינו בא במגע עם תאים astroglial של הכימומה, בניגוד לניהול מערכתי דרך אוראלי gavage (2 מ"ג/mL ליום, בחמישה ימים רצופים; איור 1ג-ה).
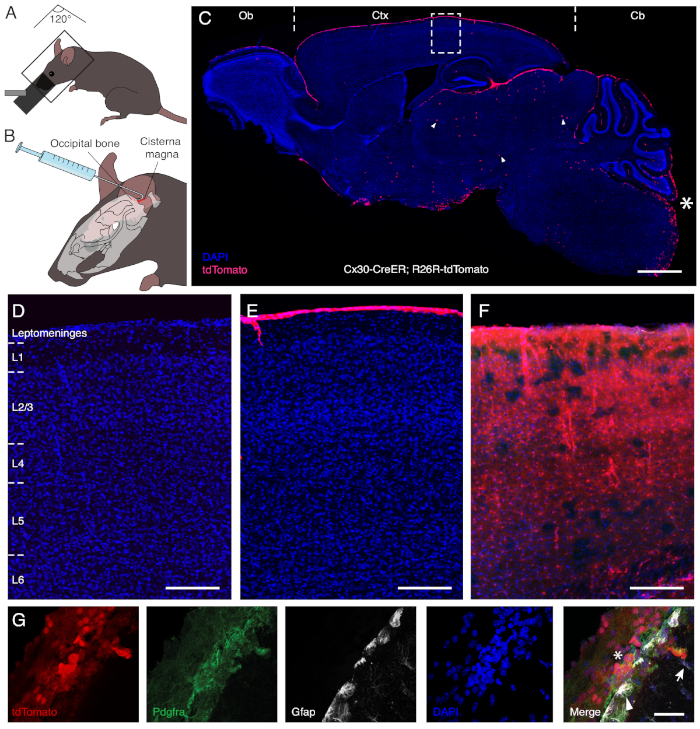
איור 1: התוויות הספציפיות של התאים הלפטומאל באמצעות הזרקה תאיים של אנדוקסיפן. פאנל A ו- B להמחיש את ההליך שפותח עבור מינהל תאיים. על מנת לקבל גישה cisterna מגנה, החלק האחורי של הצוואר צריך להיות מתוח. החיה המקחית, אפוא, ממוקמת בזווית משוערת של 120 ° בין הגוף לראש, אשר מוטה כלפי מטה (א). המחט המכורה מאפשרת לאבטח את המזרק לגולגולת ולהמשיך בבטחה בניהול ידני של הפתרון (ב). פאנל C מציג קטע משונן של המוח לאחר הממשל התאיים של אנדוקסיפן במודל עכבר טרנסגניים נושאת creer תחת היזם Cx30 וביטוי inducible של כתב פלורסנט tdTomato. הכוכבית (*) מסמנת את אתר ההזרקה וממחישה את העדר נזק פעיל בעקבות ההליך. אנדוקסיפן באופן סלקטיבי מעורר שילוב גנטי וביטוי הגן של העיתונאי בתאים בשכבה המנבלית מניחה את הנורה (Ob), קליפת המוח (סי-טי-אקס), והמוח העליון (Cb). רק מספר אסטרוציטים במוח האמצע (ראש חץ) להיות משולב לאחר המסירה התאיים של אנדוקסיפן. פאנלים D-F הם המאגתים של השטח הארוז ב C בבעלי חיים שטופלו בפתרון הרכב (D), נתון הזרקה תאיים של אנדוקסיפן (E), או מטופל מערכתית דרך אוראלי gavage (F). בעוד המינהל התאיים תוויות במיוחד בתאים של לפטטואנגים, משלוח מערכתי מוביל גם לשילוב של Cx30-הביטוי אסטרוציטים ברחבי שכבות קליפת הראש (L1 כדי L6). פאנל G ממחיש שילוב של תאי לטומאנגים (כוכבית), מזוהה באמצעות פעילות מחודשת Pdgfra, לאחר הזרקת תאיים. לעומת זאת, משטח (ראש חץ) ומכ (מקשי החיצים) האסטרולוגים מבטאים Gfap נשארים ללא תווית. קנה מידה ברים = 1,000 יקרומטר (C), 150 יקרומטר (D-F), ו 40 יקרומטר (G). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הפרוטוקול המתואר כאן מציג הליך פשוט וברור לתייג תאים לטומאנציאל מיפוי הגורל. אנו משתמשים הזרקה תאיים של אנדוקסיפן, מטבוליט פעיל של טממוקסיפן, כדי לגרום לביטוי של כתבת פלורסנט tdTomato ב Cx30-CreER; . R26R. עכברים12,13-
לעומת פרוטוקולים אחרים המשמשים לקבלת גישה לנוזל שדרתי באמצעות cisterna מגנה9, הגישה שלנו מבטיחה מנהל ידני בטוח הודות לשימוש של מחט מכופף כי ניתן לייצב את עצם העורף של הגולגולת. לאחר הקרום הריר של הcisterna מגנה הוא מחורר, יש ירידה פתאומית בהתנגדות. בשלב זה, פרוטוקולים אחרים ממליצים הנמכת המחט למקסימום של 1-2 מ"מ מפני השטח ריר ולשמור באופן ידני את זה בעמדה קבועה לאורך ההליך9. בניגוד מחט ישר, המחט מכור מאובטח לגולגולת לא יכול לחדור עמוק יותר ברקמות, ובכך לחסל את הסיכון של פגיעה המוח הראשי או לשד. המערכת הכורה שלנו מאפשרת ניהול בטוח יותר של הפתרון, במיוחד כאשר משתמשים בקצב איטי של אינפוזיה.
הנוהל המתואר כאן אינו צפוי לגרום לאי נוחות ארוכת טווח לבעל החיים המופעל. הטיפול חייב להילקח, עם זאת, בעת מתן כמויות גדולות של פתרון. שיעור משלוח מהיר עלול לגרום לשינויים בלחץ תוך גולגולתי ופיתוח של תסמינים נוירולוגיים בעכבר. אנו מציעים להזריק כרכים עד 5-10 μL כדי למנוע סיכון זה או להרכיב את המזרק על מיקרומניפולציה הנמצאת בשליטת שיעור המסירה. דבר זה חשוב במיוחד בעת התאמת הליך זה לחקר תנועת הנוזלים השדרתי. מומלץ להימנע מהזרקה ידנית ולהשתמש בקצב העירוי האיטי (לדוגמה, 1 μL/min) כדי למנוע הפריה יתר של הזרימה הפיזיולוגית. יתר על כן, הפרוטוקול הנוכחי נועד לבצע הזרקה תאיים אחת, אשר ביעילות מתייג תאים לטומאנגים. אנו ממליצים לשקול מפרט מוסרי, כמו גם את יכולתו של בעל החיים לעמוד בהליכים כירורגיים מרובים, אם המחקר דורש הנהלה חוזרת של תרכובות.
בנוסף לניהול אנדוקסיפן, הטכניקה המתוארים כאן יכולה להיות משולבת עם משלוח של וירוסים הנושאים גנים כתבת תחת מקדם ספציפי לתא ללפטואנאינאל. יתר על כן, מערכת המסירה הנוכחית יכול להיות מנוצל עבור מעקב אקוטי של זרימת נוזל השדרה10. למטרה זו, מכשירי פלורסנט כגון מעקב אחר תאים (ca. 700 Da) או Dextran Fluorescin (ca. 3000 Da) ניתן להעביר דרך cisterna מגנה, ואת המזרק ניתן לרכוב על מיקרומניפולציה כדי לאפשר שליטה על שיעור העירוי של המתחם. זה עשוי להיות חשוב על מנת למנוע הפרעה מוגזמת של התנועה הטבעית נוזלי השדרה בניסויים העקיבה.
תאים לטומאנאינלטיים אקספרס קלודין-11 וחלבונים אחרים הקשורים בצמתים הדוקים, אשר תורמים להקמת מחסום נוזלי השדרתי מפני דם בחלל הארכאנמיאיד ולשליטה הומאטית בזרימת נוזלים וחומרים מזינים3. הגישה המתוארים כאן עשוי להיות משולב עם אבלציה מותנה של גנים מעורבים בשליטה junctional של המכשול כדי לחקור את התפקיד הפיוטי שלהם בשמירה על הרכב נוזל מוסדר בקפדנות בתוך שדרתי. בנוסף, תאים מתוך ללפטואים לשחק תפקיד בפיתוח, שם הם מספקים אותות חיצוניים התורמים את הדור של נוירונים בקליפת העור5 ואת היווצרות של התקשרויות callosal4. השיטה שלנו יכול גם להיות מותאם כדי לקבל תובנה נוספת לתוך התפקיד של לפטומאנגים בהתפתחות הקורטיקלית הנכון ולמצוא האקאליות. בסופו של דבר, חיידקים כגון מנינגקוקוס neisseria הוכחו לצרף לתאי האדם ללפטואנגיאל14, ומודלים של בעלי חיים עבור המחלה פותחו כדי לחקור את הפלישה חיידקים וכתוצאה מכך נזק נוירולוגי15,16, למרות פני השטח האחראים לזיהום עדיין להיות נחוש במלואו. שילוב מחדש סלקטיבי של תאים לטומאנ, שהושגו עם הטכניקה שלנו יכול לסייע בזיהוי של אתרי הדבקה המשמשים חיידקים כדי להדביק את מרחב תת הארכאנאיד. לתשומת לב, הפרוטוקול המוצג בזאת עשוי לדרוש שינויים בחשבון עבור דרישות אתיות ובטיחות נוספות הדרושות לביצוע הליכים המחייבים זיהומים חיידקיים.
לסיכום, ההזרקה התאיים במסמך זה מייצגת גישה כירורגית פשוטה ונסבלת המציעה את ההזדמנות לחקור מגוון רחב של פונקציות נוזלים לטומאנלוגיות ושדרתי, בשילוב עם גישות לעריכת גנים או אינפוזיה של מולקולות המסומנת בדגל.
Disclosures
המחברים לא מצהירים על אינטרסים מתחרים.
Acknowledgements
מחקר זה היה נתמך על ידי מענקים מן המועצה למחקר שוודי, האגודה לסרטן שוודי, הקרן השבדית למחקר אסטרטגי, קנוט ו אליס וולנברגים Stiftelse ואת תוכנית המחקר האסטרטגי בתאי גזע ורפואה רגנרטיבית Karolinska (StratRegen).
Materials
| Name | Company | Catalog Number | Comments |
| Anesthesia unit | Univentor 410 | 8323102 | Complete of vaporizer, chamber, and tubing that connects to chamber and mouse head holder |
| Anesthesia (Isoflurane) | Baxter Medical AB | 000890 | |
| Betadine | Sigma-Aldrich | PVP1 | |
| Carprofen | Orion Pharma AB | 014920 | Commercial name Rymadil |
| Cyanoacrylate glue | Carl Roth | 0258.1 | Use silk 5-0 sutures, in alternative |
| Medbond Tissue Glue | Stoelting | 50479 | |
| DMSO | Sigma-Aldrich | D2650 | |
| Endoxifen | Sigma-Aldrich | E8284 | |
| Ethanol 70% | Histolab | 01370 | |
| Hamilton syringe (30 G beveled needle) | Hamilton | 80300 | |
| Lidocaine | Aspen Nordic | 520455 | |
| Mouse head holder | Narishige International | SGM-4 | With mouth piece for inhalational anhestetics. Alternatively, use a stereotactic frame |
| Scissors | Fine Science Tools | 15009-08 | |
| Shaver | Aesculap | GT420 | |
| Sterile absorption spears | Fine Science Tools | 18105-01 | Sterile cotton swabs are also a good option |
| Surgical separator | World Precision Instrument | 501897 | |
| Tweezers | Dumont | 11251-35 | |
| Viscotears | Bausch&Lomb Nordic AB | 541760 |
References
- Vanlandewijck, M., et al. A molecular atlas of cell types and zonation in the brain vasculature. Nature. 554 (7693), 475-480 (2018).
- Whish, S., et al. The inner CSF-brain barrier: developmentally controlled access to the brain via intercellular junctions. Frontiers in Neuroscience. 9, 16(2015).
- Weller, R. O., Sharp, M. M., Christodoulides, M., Carare, R. O., Mollgard, K. The meninges as barriers and facilitators for the movement of fluid, cells and pathogens related to the rodent and human CNS. Acta Neuropathologica. 135 (3), 363-385 (2018).
- Choe, Y., Siegenthaler, J. A., Pleasure, S. J. A cascade of morphogenic signaling initiated by the meninges controls corpus callosum formation. Neuron. 73 (4), 698-712 (2012).
- Siegenthaler, J. A., et al. Retinoic acid from the meninges regulates cortical neuron generation. Cell. 139 (3), 597-609 (2009).
- Bifari, F., et al. Neurogenic Radial Glia-like Cells in Meninges Migrate and Differentiate into Functionally Integrated Neurons in the Neonatal Cortex. Cell Stem Cell. 20 (3), 360-373 (2017).
- De Bock, M., et al. A new angle on blood-CNS interfaces: a role for connexins? FEBS Letters. 588 (8), 1259-1270 (2014).
- Ramos, M., et al. Cisterna Magna Injection in Rats to Study Glymphatic Function. Methods in Molecular Biology. 1938, 97-104 (2019).
- Xavier, A. L. R., et al. Cannula Implantation into the Cisterna Magna of Rodents. Journal of Visualized Experiments. (135), (2018).
- Iliff, J. J., et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid beta. Science Translational Medicine. 4 (147), (2012).
- Coureuil, M., Lecuyer, H., Bourdoulous, S., Nassif, X. A journey into the brain: insight into how bacterial pathogens cross blood-brain barriers. Nature Reviews Microbiology. 15 (3), 149-159 (2017).
- Madisen, L., et al. Transgenic mice for intersectional targeting of neural sensors and effectors with high specificity and performance. Neuron. 85 (5), 942-958 (2015).
- Slezak, M., et al. Transgenic mice for conditional gene manipulation in astroglial cells. Glia. 55 (15), 1565-1576 (2007).
- Hardy, S. J., Christodoulides, M., Weller, R. O., Heckels, J. E. Interactions of Neisseria meningitidis with cells of the human meninges. Molecular Microbiology. 36 (4), 817-829 (2000).
- Colicchio, R., et al. The meningococcal ABC-Type L-glutamate transporter GltT is necessary for the development of experimental meningitis in mice. Infection and Immunity. 77 (9), 3578-3587 (2009).
- Ricci, S., et al. Inhibition of matrix metalloproteinases attenuates brain damage in experimental meningococcal meningitis. BMC Infectious Diseases. 14, 726(2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved